Похожие презентации:
Часть 2. Органическая химия
1.
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА
химия
Лекция 4
2013/14 уч. год
Часть 2. Органическая химия.
Лекцию читает профессор Белавин Иван Юрьевич
2.
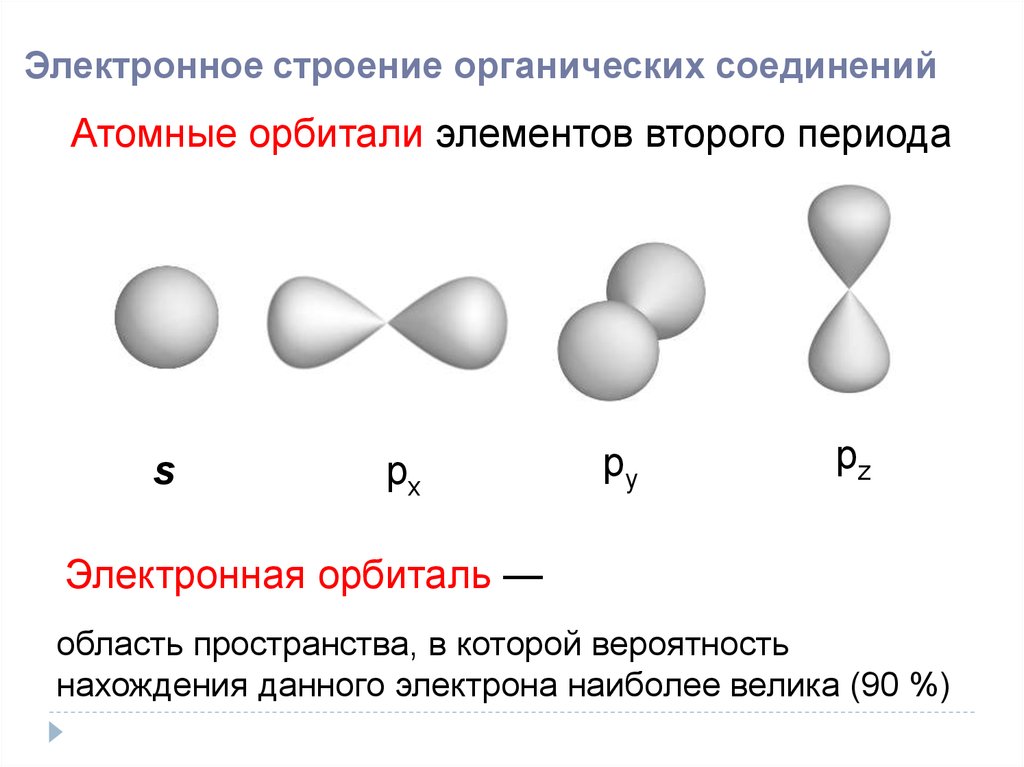
Электронное строение органических соединенийАтомные орбитали элементов второго периода
s
px
py
pz
Электронная орбиталь —
область пространства, в которой вероятность
нахождения данного электрона наиболее велика (90 %)
3.
Гибридизация —смешивание нескольких атомных орбиталей различной формы
и близкой энергии с образованием такого же числа новых
гибридных орбиталей, расположение которых в пространстве
соответствует геометрии молекулы. Для элементов 2-го
периода гибридные орбитали имеют одинаковую форму и
энергию
sp-гибридизация
p
+ =
sp
180°
линейный фрагмент
4.
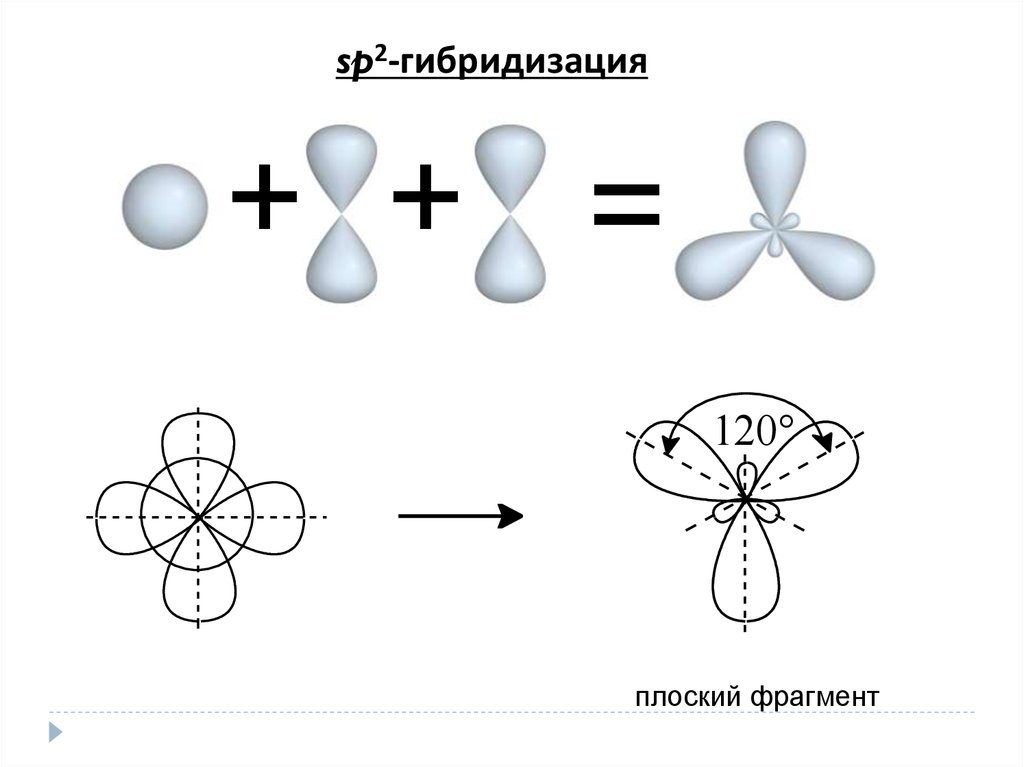
sp2-гибридизация+ + =
120°
плоский фрагмент
5.
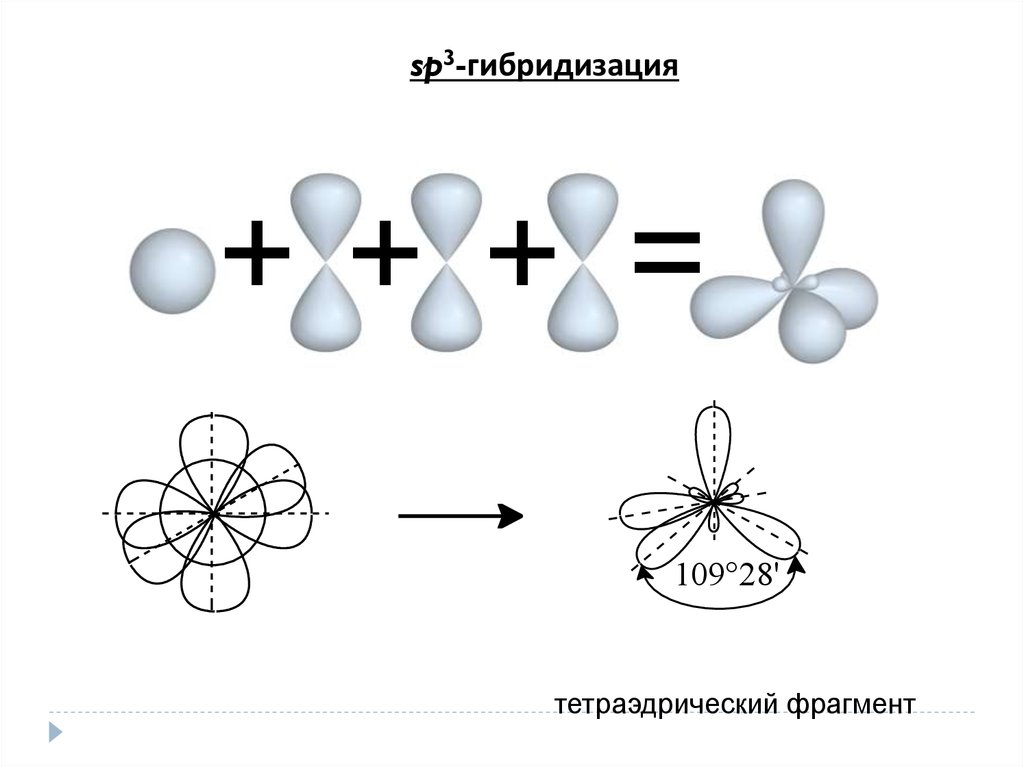
sp3-гибридизация++ + =
109°28'
тетраэдрический фрагмент
6.
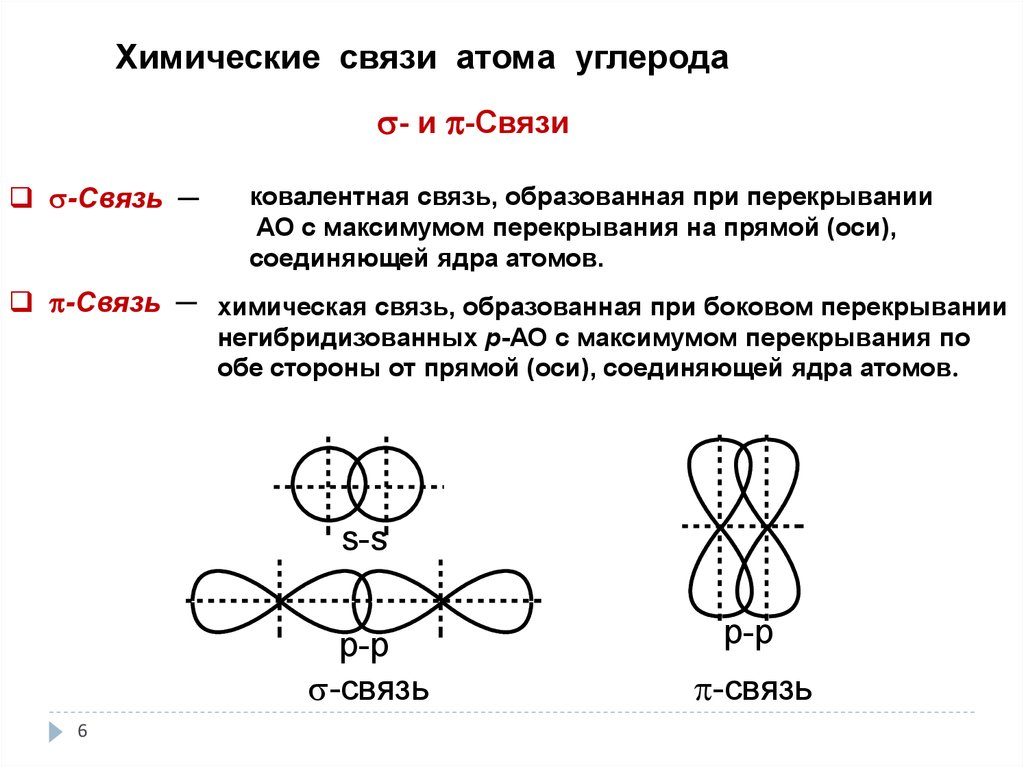
Химические связи атома углерода- и -Связи
-Связь ─
ковалентная связь, образованная при перекрывании
АО с максимумом перекрывания на прямой (оси),
соединяющей ядра атомов.
-Связь ─ химическая связь, образованная при боковом перекрывании
негибридизованных р-АО с максимумом перекрывания по
обе стороны от прямой (оси), соединяющей ядра атомов.
s-s
p-p
-связь
6
p-p
-связь
7.
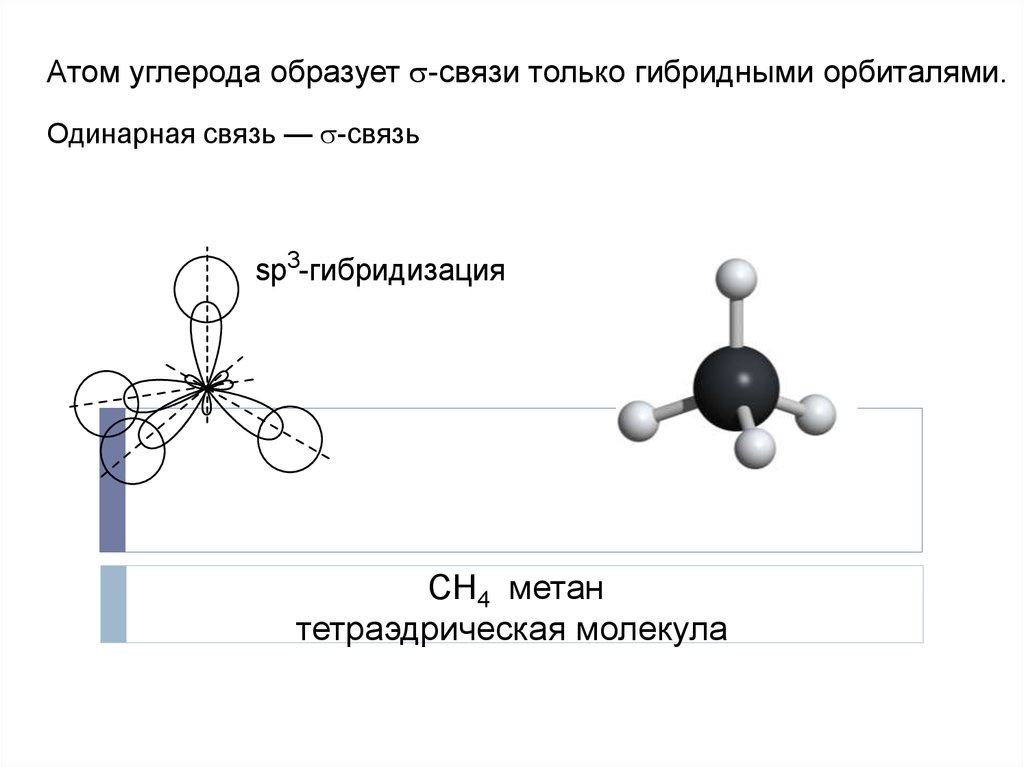
Атом углерода образует -связи только гибридными орбиталями.Одинарная связь — -связь
sp3-гибридизация
СН4 метан
тетраэдрическая молекула
8.
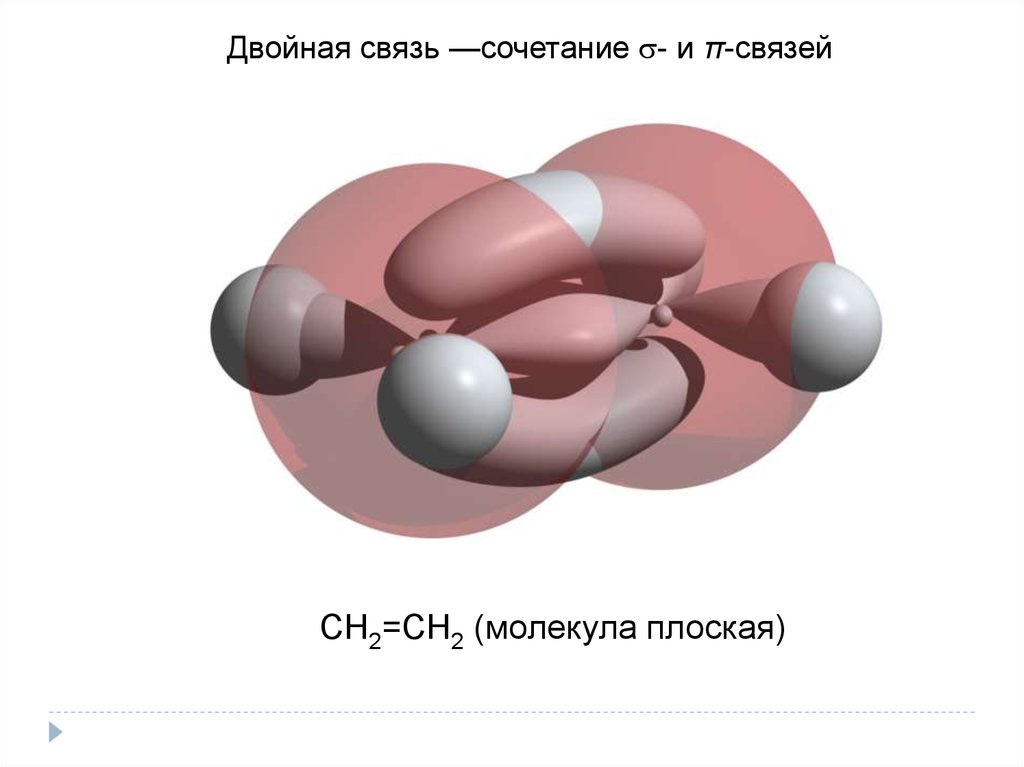
Двойная связь —сочетание - и π-связейСН2=СН2 (молекула плоская)
9.
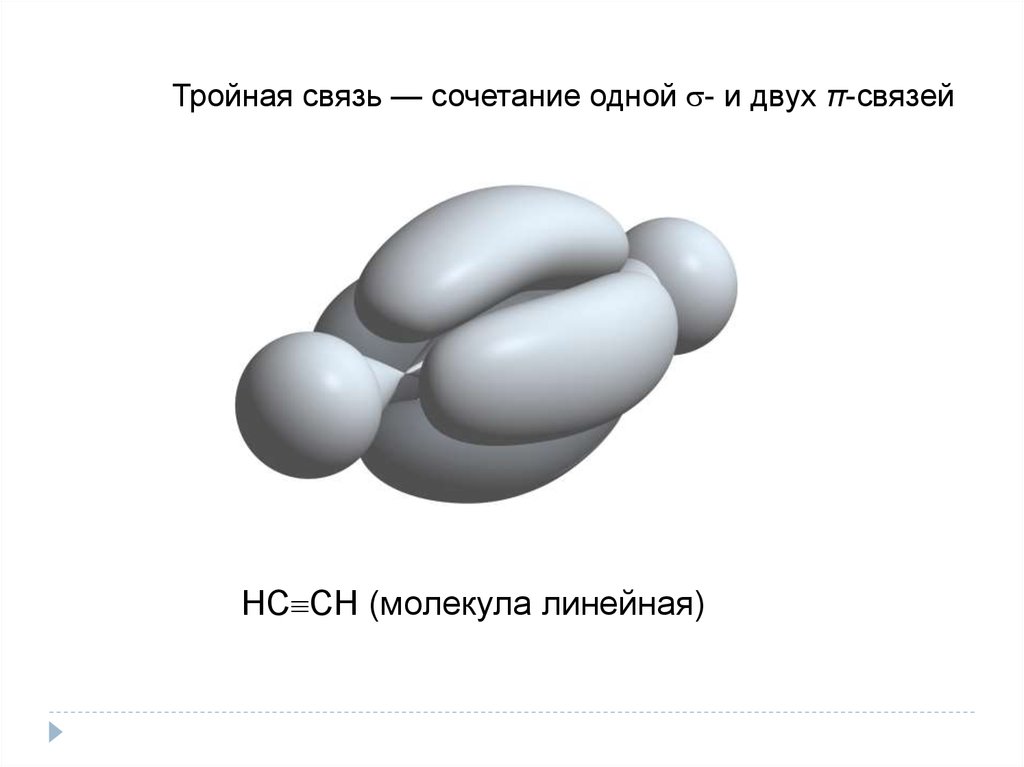
Тройная связь — сочетание одной - и двух π-связейНС СН (молекула линейная)
10.
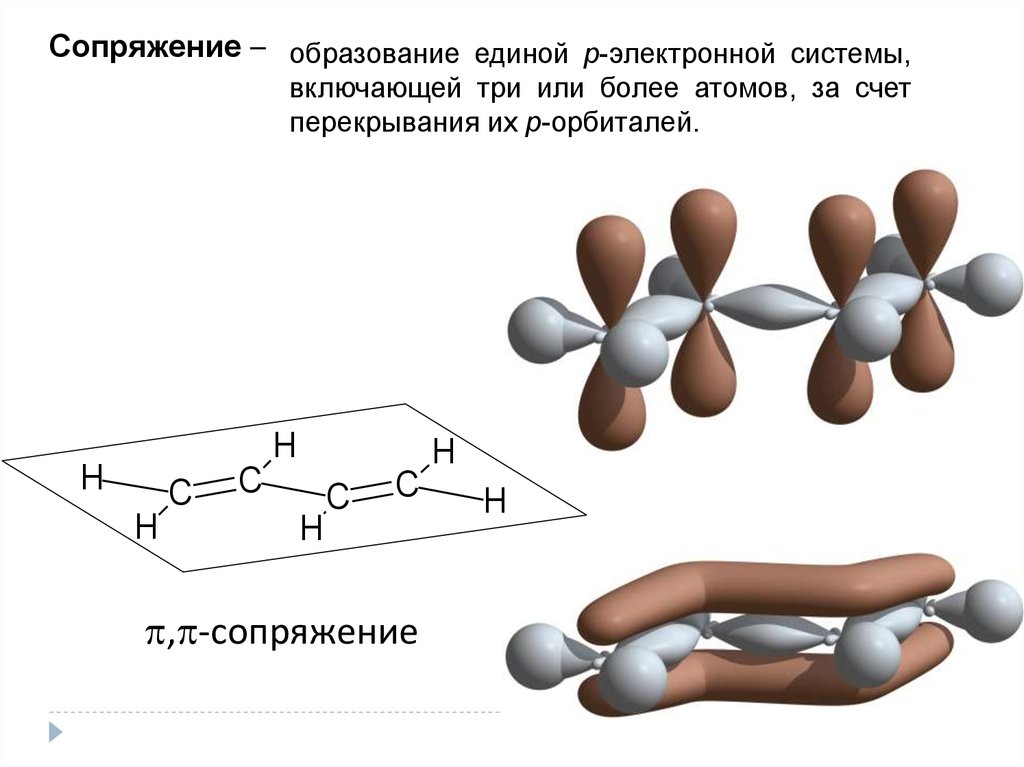
Сопряжение – образование единой р-электронной системы,включающей три или более атомов, за счет
перекрывания их p-орбиталей.
H
H
C
H
H
C
H
C
C
, -сопряжение
H
11.
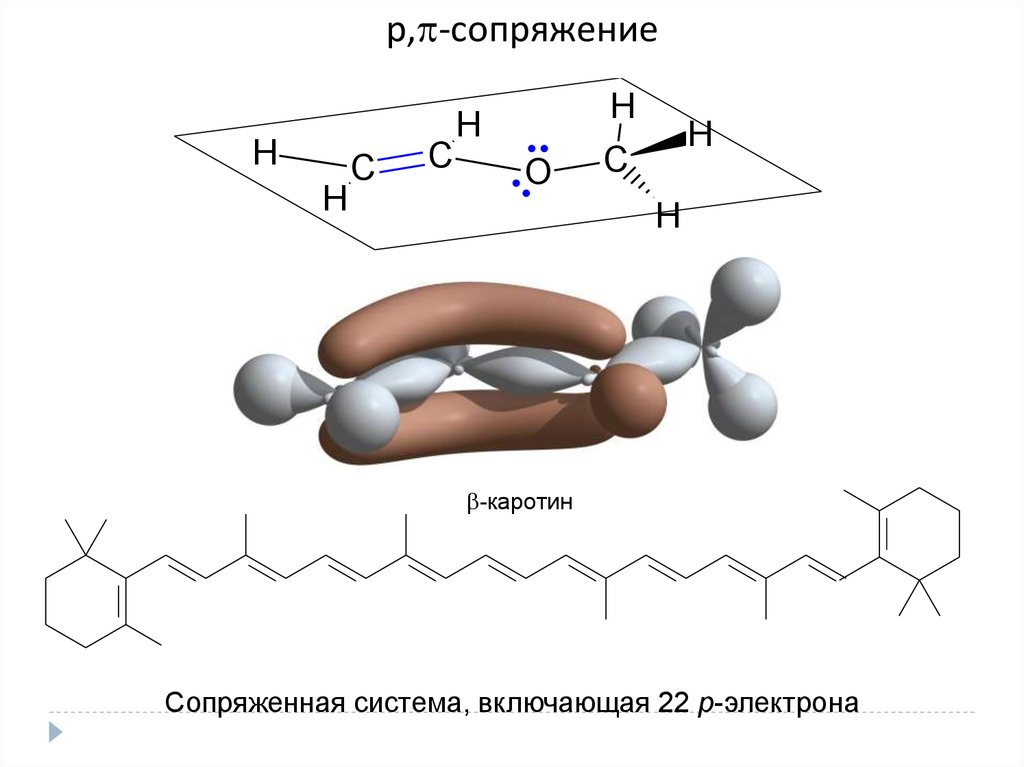
p, -cопряжениеH
H
C
C
H
O
H
C
H
H
-каротин
Сопряженная система, включающая 22 р-электрона
12.
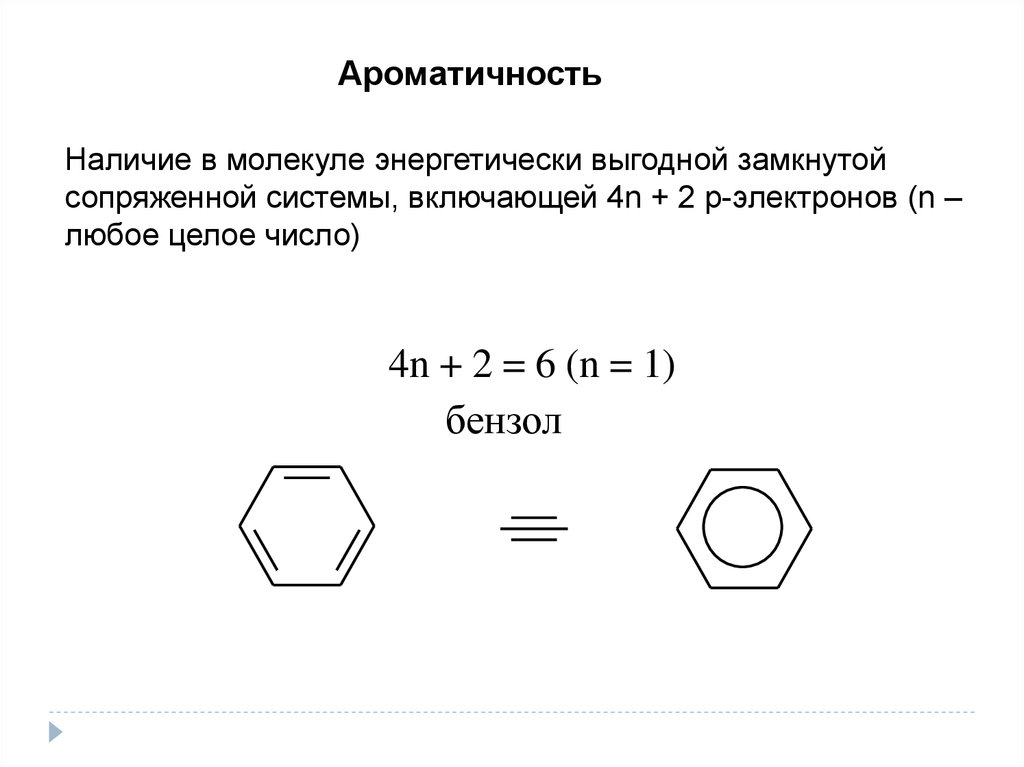
АроматичностьНаличие в молекуле энергетически выгодной замкнутой
сопряженной системы, включающей 4n + 2 р-электронов (n –
любое целое число)
4n + 2 = 6 (n = 1)
бензол
13.
14.
ПирролN
H
N
H
15.
H3CCH3
CH
HOOCCH2CH2
N
N
Fe
N
N
CH3
HOOCCH2CH2
CH
H3C
CH2
гем
n = 6 4 × 6 + 2 = 26 p-электронов
CH2
16.
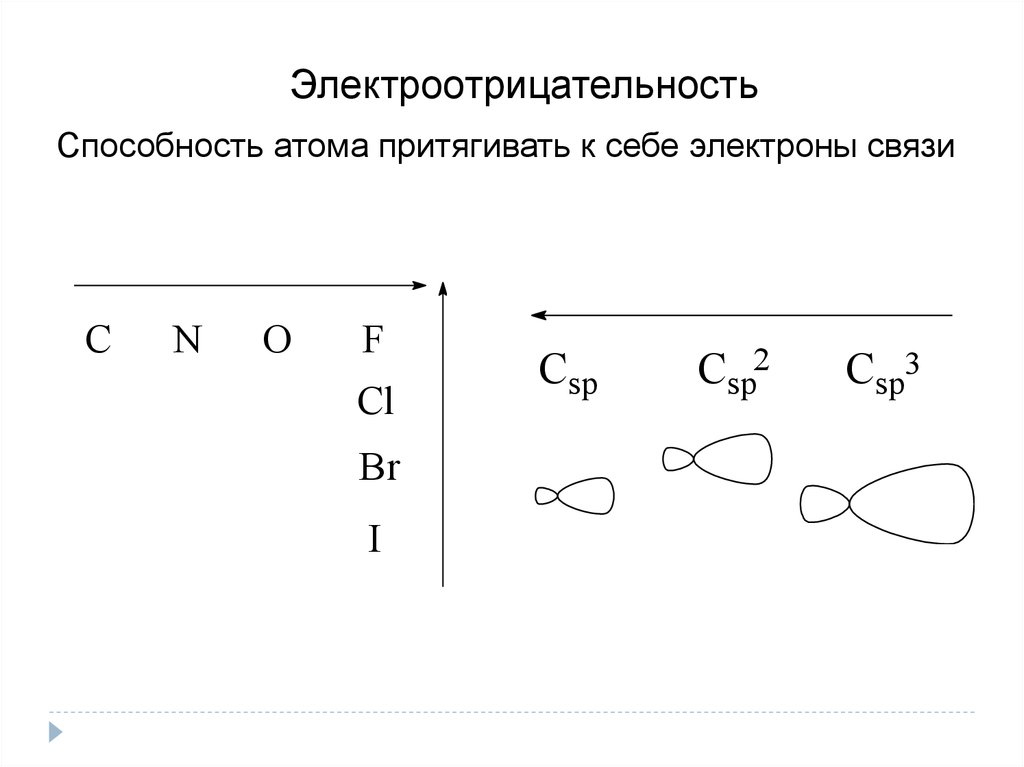
ЭлектроотрицательностьСпособность атома притягивать к себе электроны связи
С
N
O
F
Cl
Br
I
Csp
Csp2
Csp3
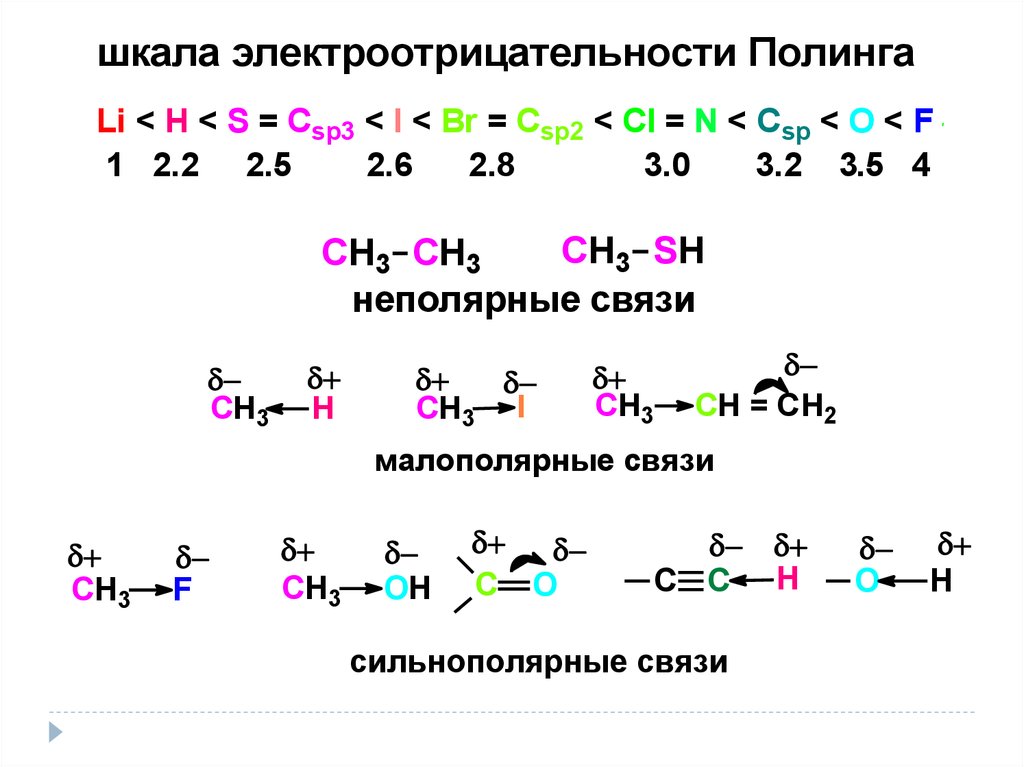
17.
шкала электроотрицательности ПолингаLi < H < S = Csp3 < I < Br = Csp2 < Cl = N < Csp < O < F
1 2.2 2.5
2.6
2.8
3.0
3.2 3.5 4
СН3 SH
СН3 СН3
неполярные связи
СН3
Н
СН3 I
СН3
CH = CH2
малополярные связи
СН3
F
СН3
OH
C O
C C H
сильнополярные связи
О
Н
18.
электронные эффекты заместителей(по сравнению с атомом водорода)
1. Индуктивный эффект (I) - передача электронного влияния
заместителя по цепи -связей
+I эффект:
Н
Н
С
СН2
СН2
+ICH
3
O
R
+I O-
Н
-I эффект:
F
F
F
C
CH2 CH2
-I CF
3
+
NH3
R
-I NH +
3
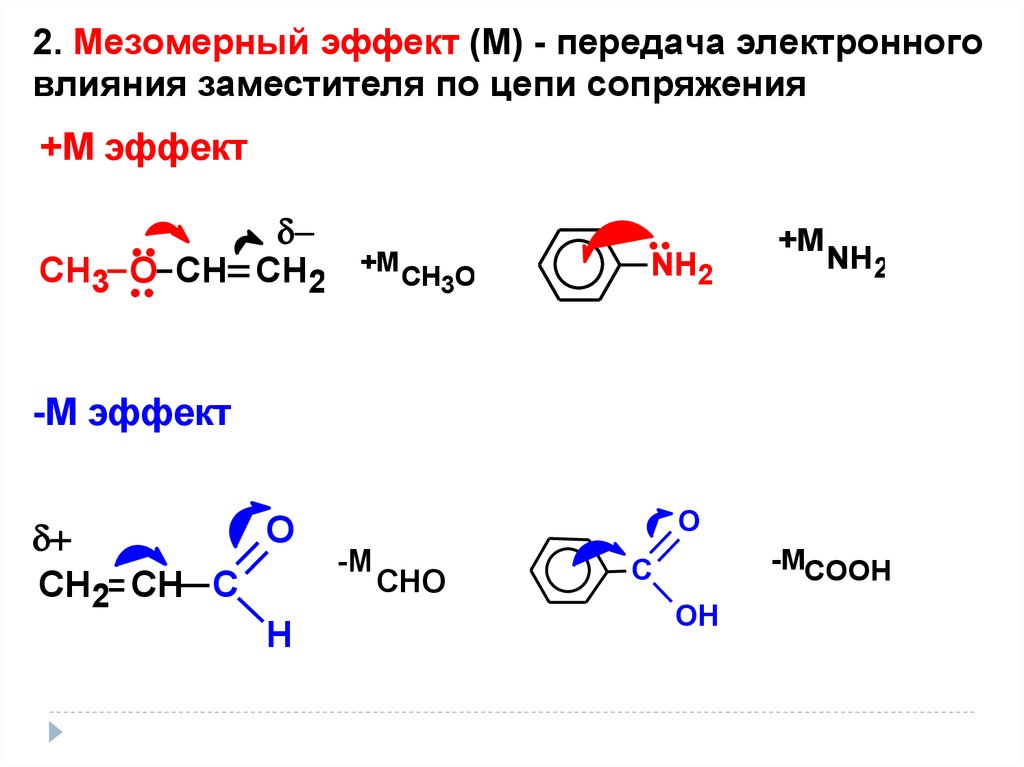
19.
2. Мезомерный эффект (М) - передача электронноговлияния заместителя по цепи сопряжения
+M эффект
СН3 О СН СН2
+M
CH3O
NH2
+M
NH2
-M эффект
О
СН2 СН С
Н
О
-М
СНО
-МСООН
С
ОН
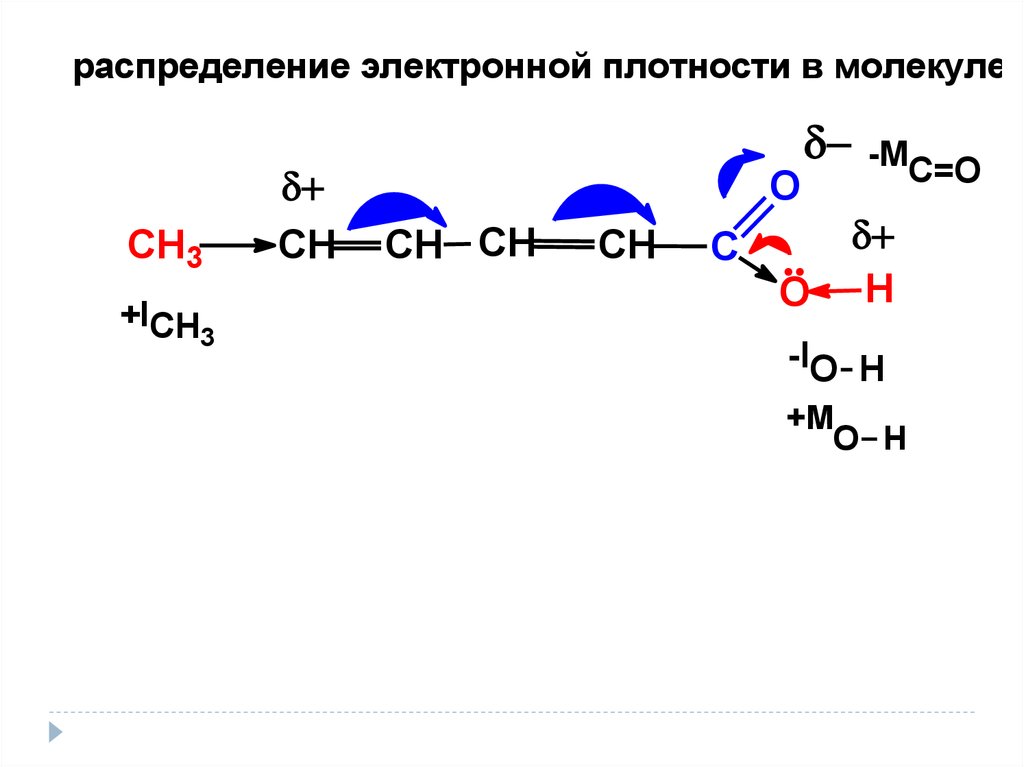
20.
распределение электронной плотности в молекулеСН3
+ICH
3
СН
О
СН СН
СН
С
О
-MC=O
Н
-IO H
+M
O H
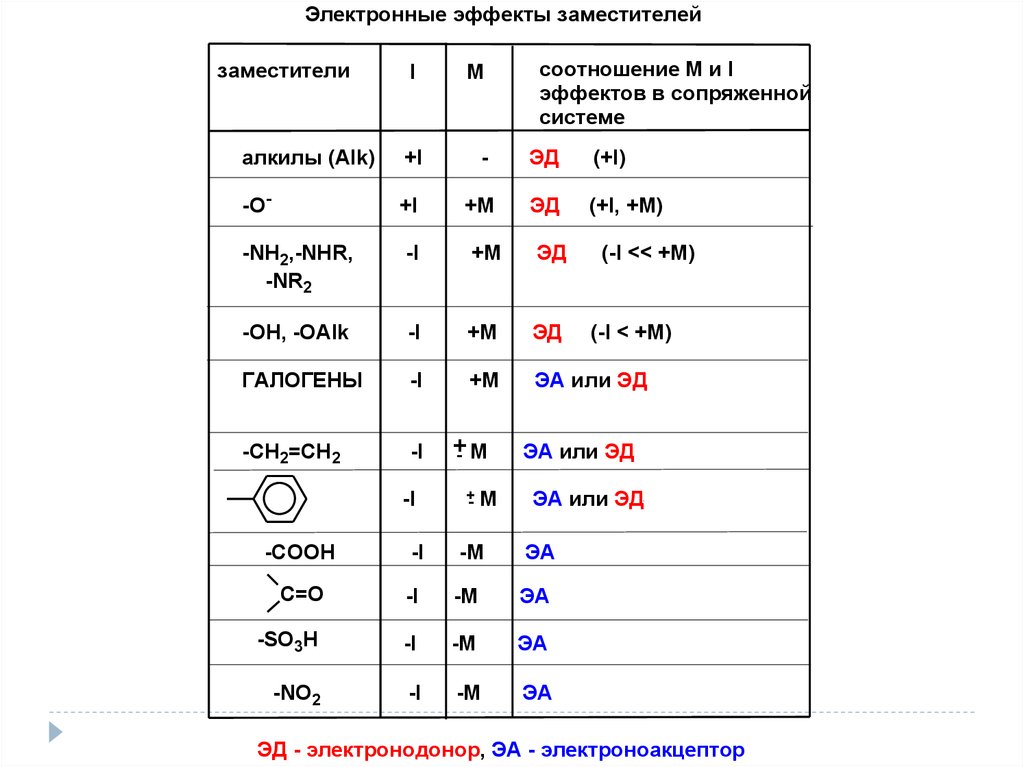
21.
Электронные эффекты заместителейзаместители
I
M
соотношение М и I
эффектов в сопряженной
системе
алкилы (Alk)
+I
-
ЭД
(+I)
-O-
+I
+M
ЭД
(+I, +M)
-NH2,-NHR,
-NR2
-I
+M
ЭД
-ОН, -OAlk
-I
+M
ЭД
ГАЛОГЕНЫ
-I
+M
ЭА или ЭД
-CH2=CH2
-I
-I
+- M
+- M
(-I << +M)
(-I < +M)
ЭА или ЭД
ЭА или ЭД
-COOH
-I
-M
ЭА
С=О
-I
-M
ЭА
-SO3H
-I
-M
ЭА
-NO2
-I
-M
ЭА
ЭД - электронодонор, ЭА - электроноакцептор
22.
± М-эффект+
СН2
_
СН2
+М
-М
С6Н5
С6Н5
СН2
СН2
+
СН СН2
+МСН СН
2
_
СН СН2 -М СН2 СН
23.
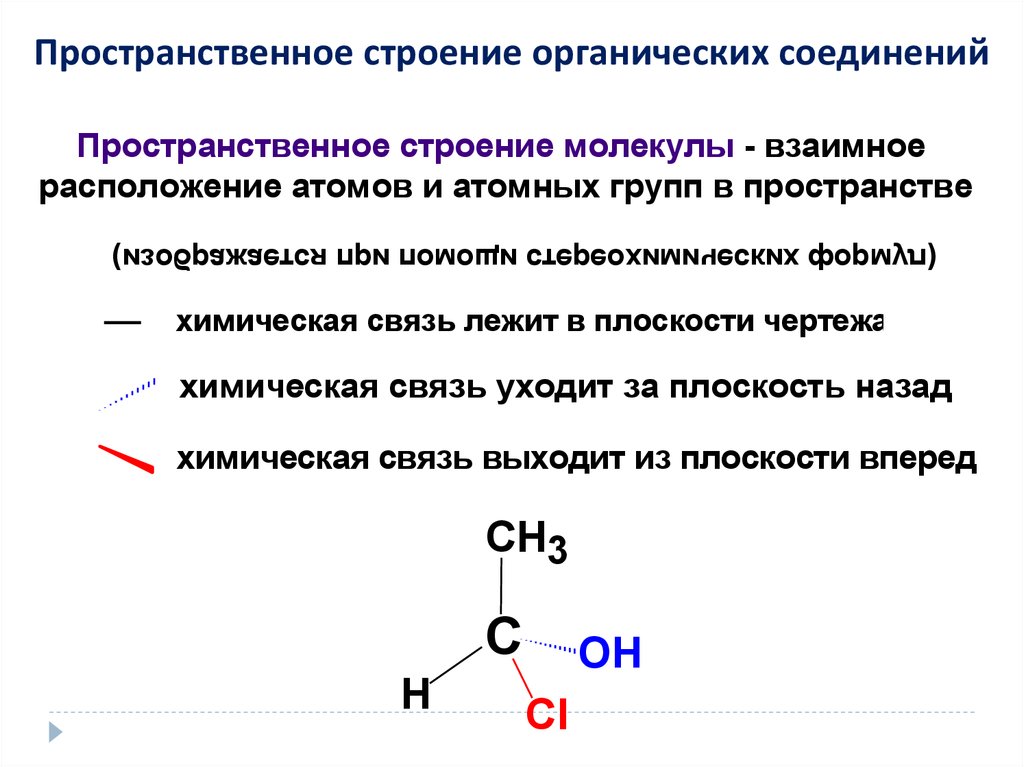
Пространственное строение органических соединенийПространственное строение молекулы - взаимное
расположение атомов и атомных групп в пространстве
(изображается при помощи стереохимических формул)
химическая связь лежит в плоскости чертежа
химическая связь уходит за плоскость назад
химическая связь выходит из плоскости вперед
СН3
С
Н
ОН
Сl
24.
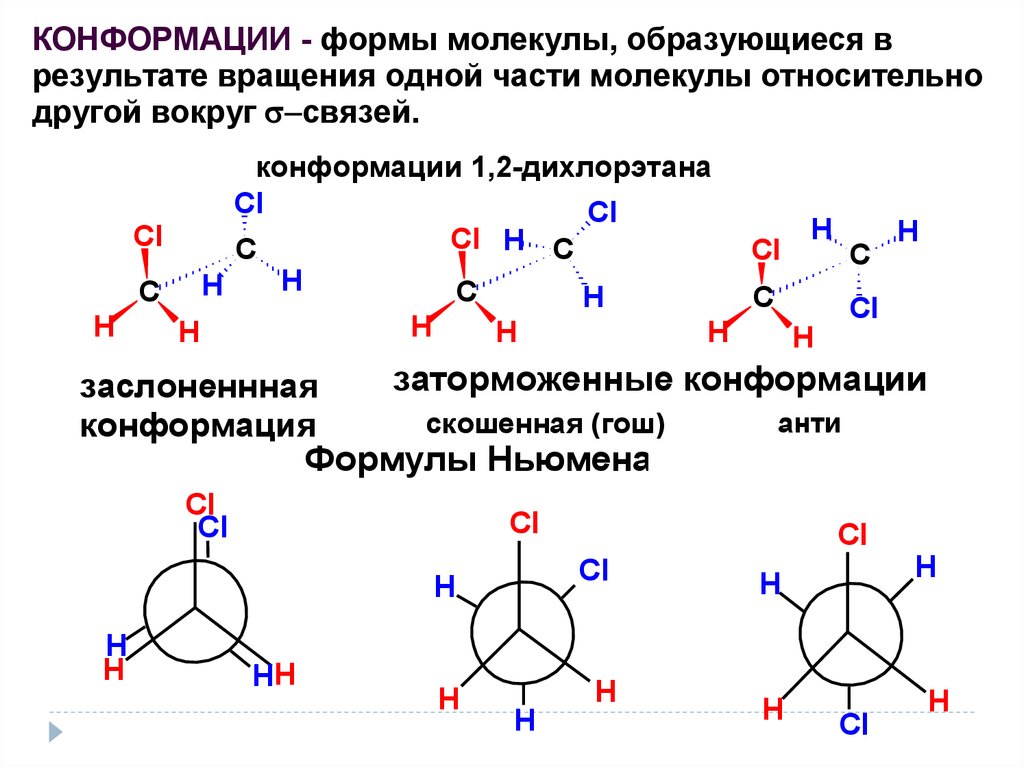
КОНФОРМАЦИИ - формы молекулы, образующиеся врезультате вращения одной части молекулы относительно
другой вокруг связей.
конформации 1,2-дихлорэтана
Cl
Cl
H
H
Cl
Cl H С
С
Cl
С
H
С H
С
H
С
Cl
H
H
H
H
H
H
заторможенные конформации
заслоненнная
анти
скошенная (гош)
конформация
Формулы Ньюмена
Cl
Cl
Cl
Cl
H
H
H
HH
H
Cl
H
H
H
H
Cl
H
H
25.
конфигурация - расположение атомов иатомных групп в пространстве без учета
возможных конформаций
пространственные изомеры (стереоизомеры)
энантиомеры
диастереомеры
(зеркальные изомеры
или оптические антиподы)
(незеркальные изомеры)
26.
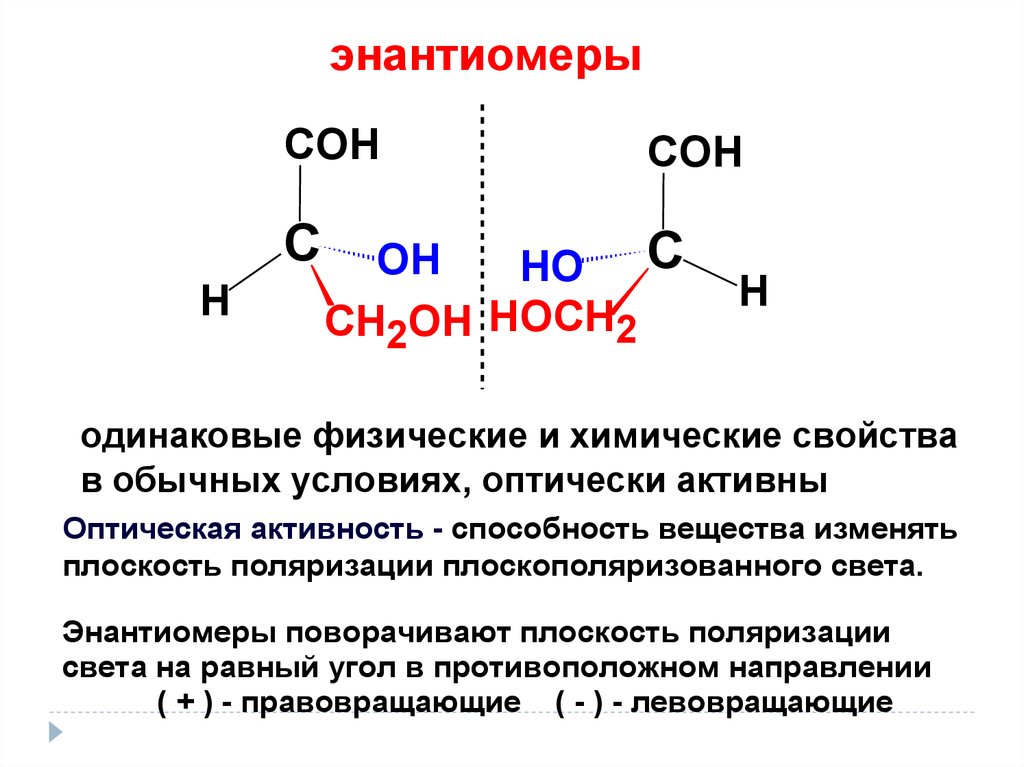
энантиомерыСОН
С
Н
СОН
ОН
НО С
СН2ОН НОСН2
Н
одинаковые физические и химические свойства
в обычных условиях, оптически активны
Оптическая активность - способность вещества изменять
плоскость поляризации плоскополяризованного света.
Энантиомеры поворачивают плоскость поляризации
света на равный угол в противоположном направлении
( + ) - правовращающие ( - ) - левовращающие
27.
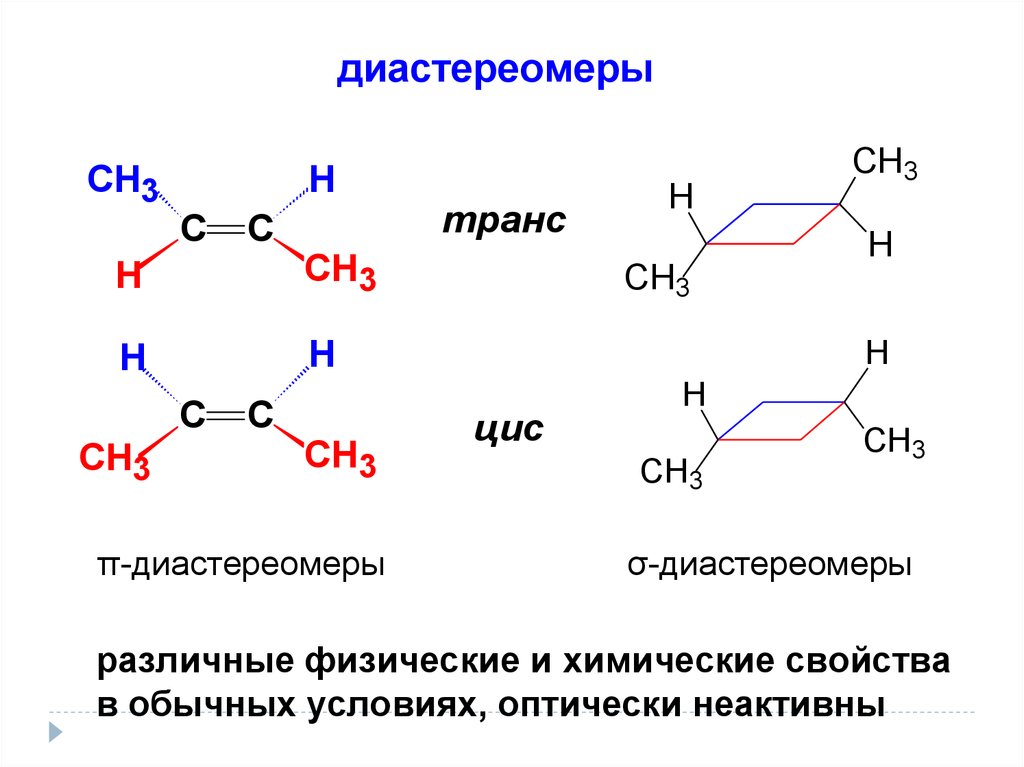
диастереомерыСН3
Н
С
С
Н
СН3
Н
Н
С
СН3
С
СН3
π-диастереомеры
транс
H
CH3
CH3
H
H
цис
H
CH3
CH3
σ-диастереомеры
различные физические и химические свойства
в обычных условиях, оптически неактивны
28.
хиральность – свойство объекта не бытьхиральность
– свойство
объектаотображению
не быть
идентичным
своему
зеркальному
идентичным своему зеркальному отображению
асимметрический атом углерода
атом углерода,
асимметрический
атом различными
углерода
связанный
с четырьмя
заместителями
атом
углерода,
связанный с четырьмя различными
заместителями
зеркало
H
H
С
Z С
Z
зеркало
X
Y
X
Y
H
H
С
X
С
XY
Y
Z
Z
29.
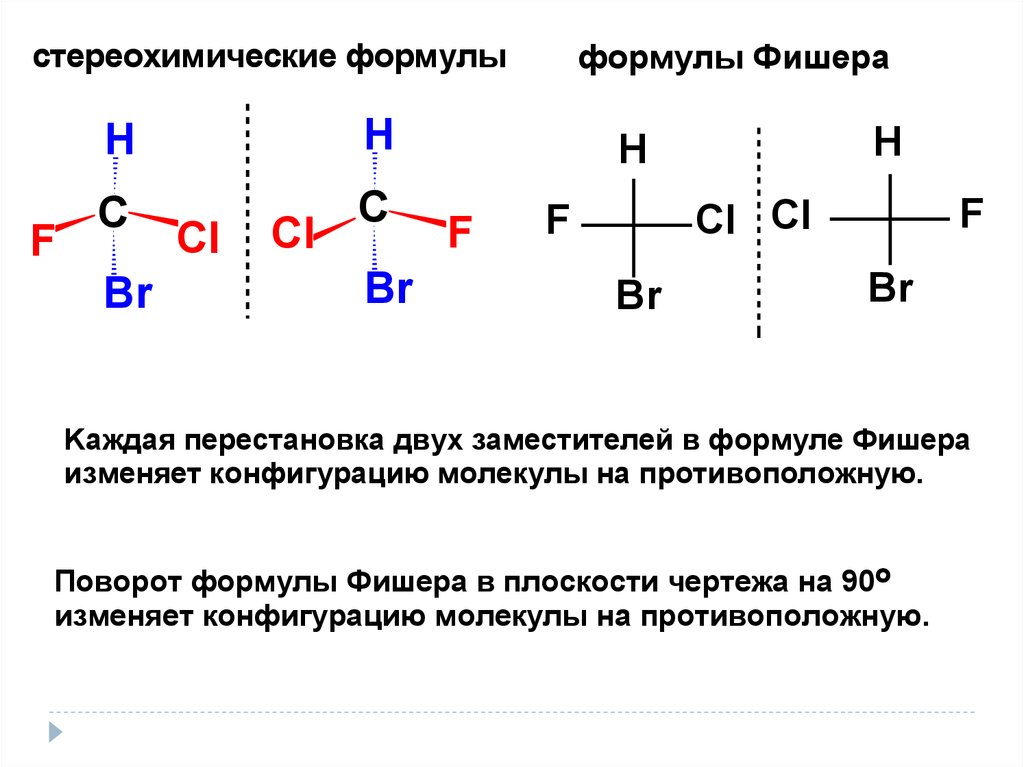
формулы Фишерастереохимические формулы
F
Н
Н
С
С
Br
Сl
Сl
Br
Н
Н
F
F
Сl Сl
F
Br
Br
Kаждая перестановка двух заместителей в формуле Фишера
изменяет конфигурацию молекулы на противоположную.
Поворот формулы Фишера в плоскости чертежа на 90о
изменяет конфигурацию молекулы на противоположную.
30.
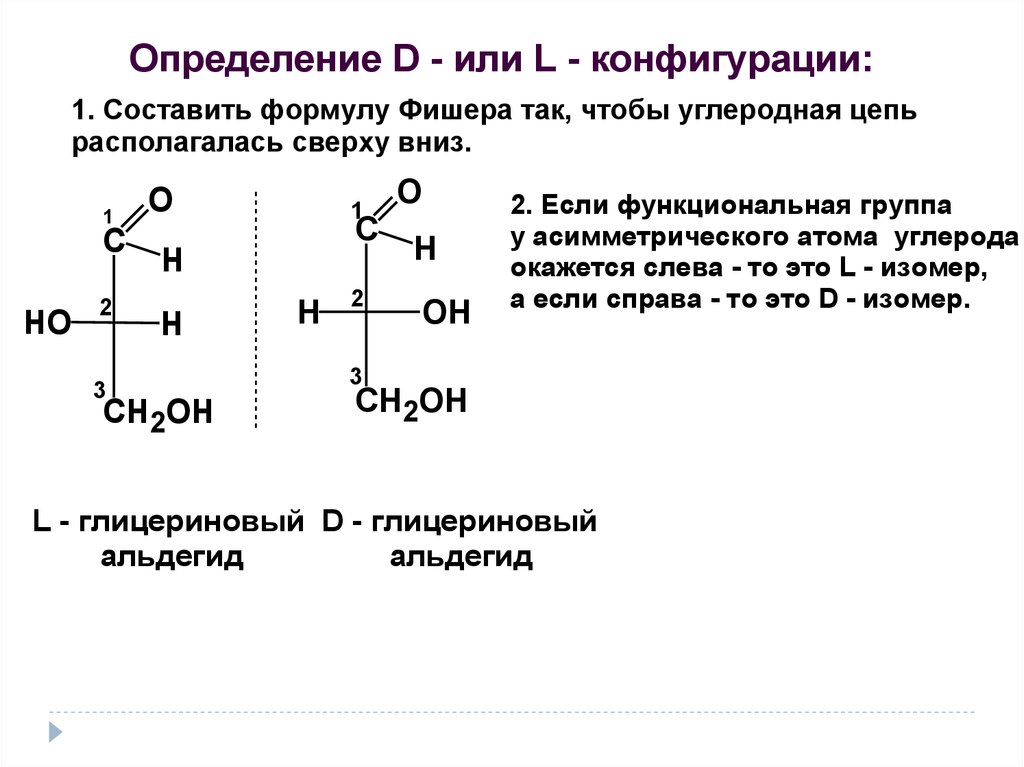
Определение D - или L - конфигурации:1. Составить формулу Фишера так, чтобы углеродная цепь
располагалась сверху вниз.
1
С
НО
2
3
О
1
С
Н
Н
СН2ОН
Н
2
О
Н
ОН
2. Если функциональная группа
у асимметрического атома углерода
окажется слева - то это L - изомер,
а если справа - то это D - изомер.
3
СН2ОН
L - глицериновый D - глицериновый
альдегид
альдегид
31.
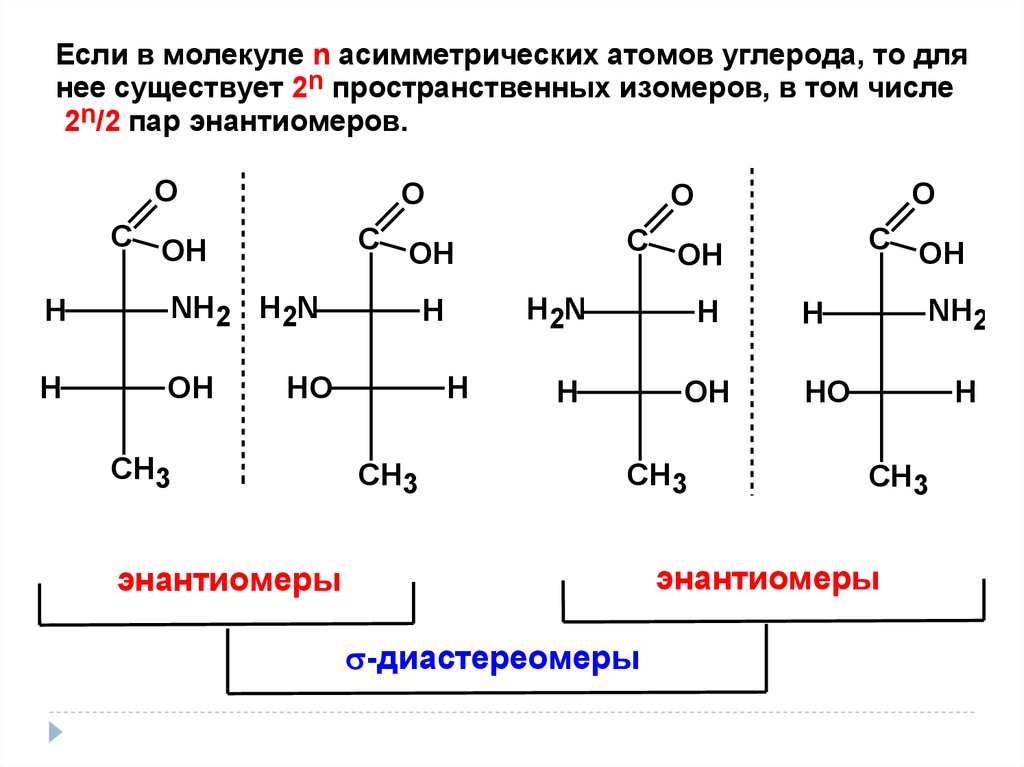
Если в молекуле n асимметрических атомов углерода, то длянее существует 2n пространственных изомеров, в том числе
2n/2 пар энантиомеров.
O
O
O
O
С ОН
С ОН
С ОН
С ОН
H
NH2 Н2N
H
OH
НO
СН3
Н2N
H
H
СН3
H
H
OH
СН3
NH2
H
НO
H
СН3
энантиомеры
энантиомеры
-диастереомеры
32.
Кислотность и основность органических соединенийСопряженные кислоты и основания
Кислота - молекула или ион, способные отдать протон (Н+)
СН3СООН
СН3СОО-
+
CH3NH3+
CH3NH2
+
кислоты
Н+
H+
сопряженные
основания
Основание - молекула или ион, способные присоединить протон
СН3 ОН + Н+
CH2COOR + H+
основания
+ H
СН3 O
H
CH3COOR
сопряженные
кислоты
33.
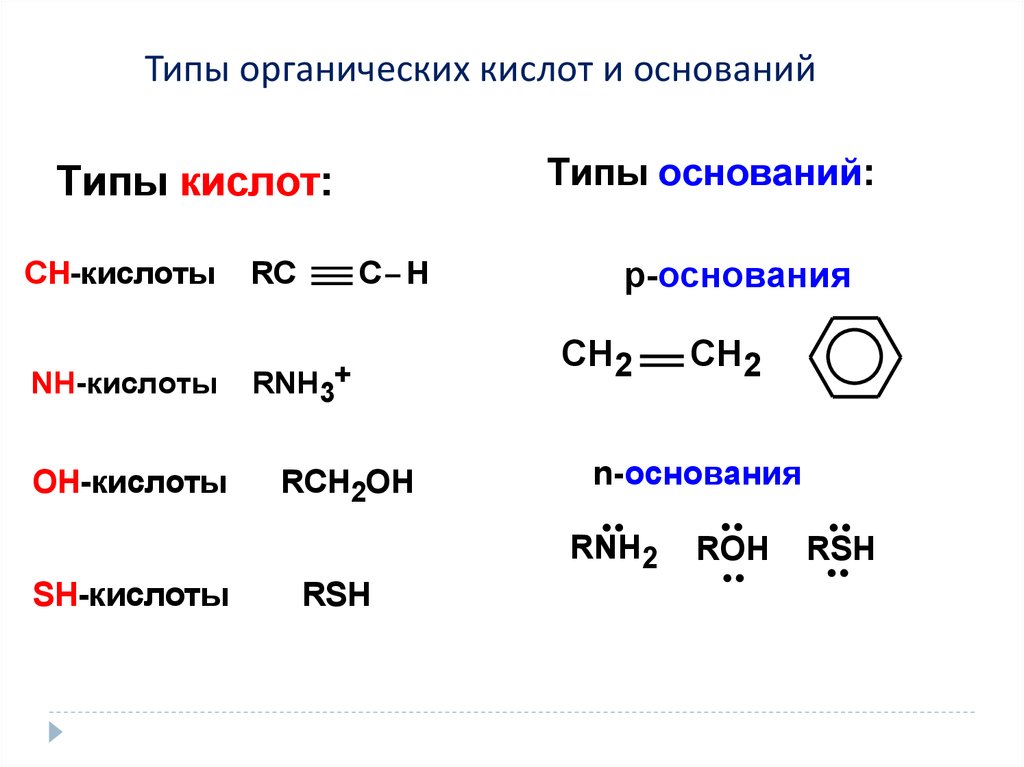
Типы органических кислот и основанийТипы оснований:
Типы кислот:
СН-кислоты
RC
NH-кислоты
RNH3+
OH-кислоты
C H
RCH2OH
p-основания
СН2
n-основания
RNH2
SH-кислоты
RSH
СН2
ROH
RSH
34.
кислотность - способность отдавать протонусиление кислотных свойств
C H
N H
O H
F H
S H
Cl H
35.
OC2H5
O-H
O-H
pKa = 16
CH3-C
pKa = 10
O-H
pKa = 4.7
увеличение кислотности
увеличение устойчивости аниона
С2Н5-О-
Cl3C
COOH
О
>
+ H
R O
H
-
СН3-С
H COOH > CH3
>>
R O H
О
О
COOH
36.
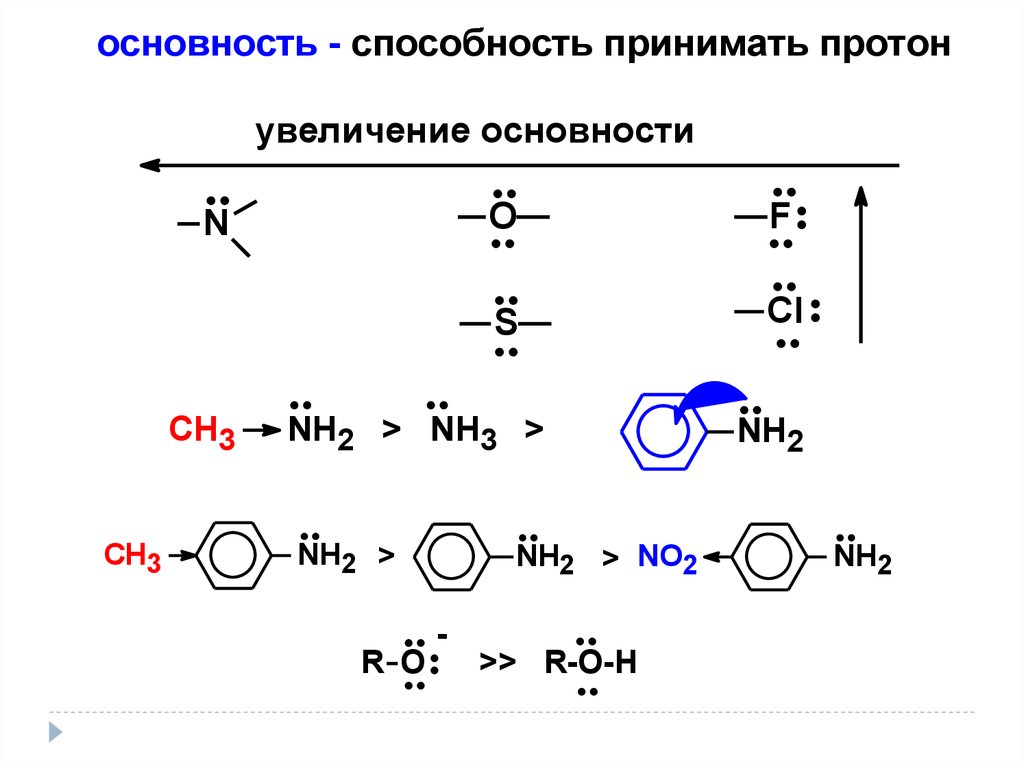
основность - способность принимать протонувеличение основности
N
CH3
CH3
O
F
S
Cl
NH2 > NH3 >
NH2 >
R O
NH2 > NO2
-
>> R-O-H
NH2
NH2
37.
Реакционная способность органических соединений.Некоторые термины и определения
Реакционная способность – способность вещества вступать в ту
или иную химическую реакцию и реагировать с большей или меньшей
легкостью.
Реакционный центр – атом или группа атомов в
молекуле,непосредственно участвующие в химической реакции.
Субстрат – вещество, подвергающееся изменениям в
результате химической реакции.
Реагент –
37
его партнер..
38.
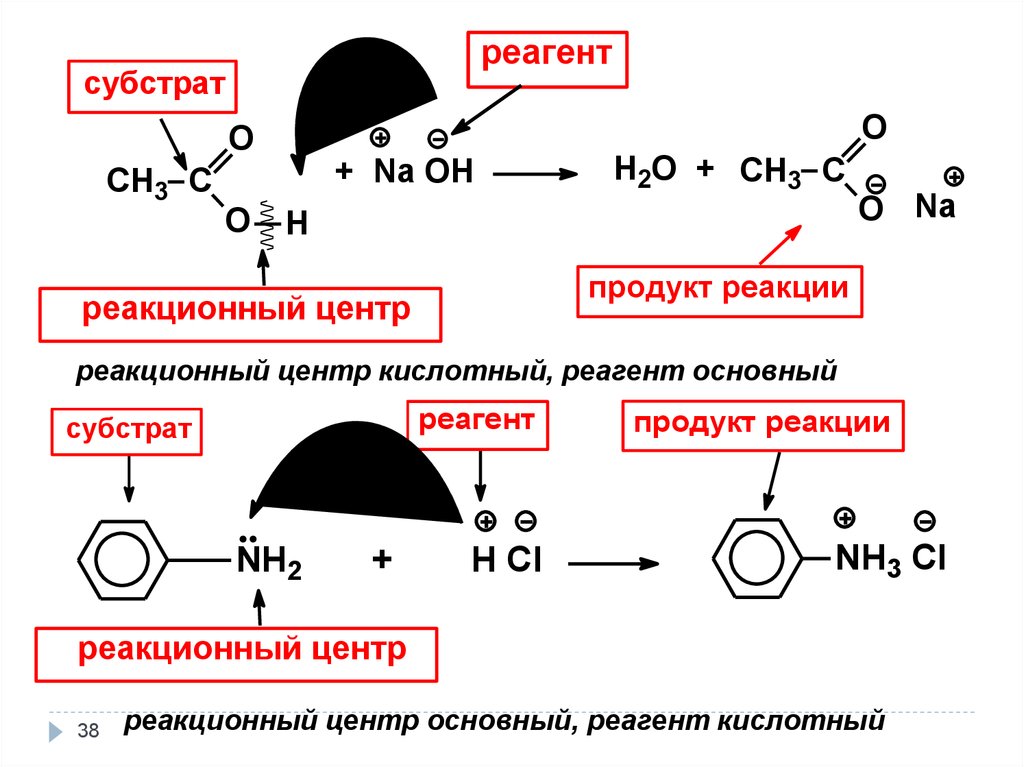
реагентсубстрат
О
О
СН3 С
О
+ Na OH
H2O + СН3 С
Н
О Na
продукт реакции
реакционный центр
реакционный центр кислотный, реагент основный
реагент
субстрат
NH2
+
H Cl
продукт реакции
NH3 Cl
реакционный центр
38
реакционный центр основный, реагент кислотный
39.
Типы реагентовКислотные реагенты (кислоты) –
доноры протона по отношению к реакционному партнеру — частично
или нацело ионизированные в водных растворах нейтральные
молекулы (HCl, CH3COOH) или положительно заряженные частицы
(NH4+,H3O+).
Основные реагенты (основания) –
акцепторы протона по отношению к реакционному партнеру; отрывают
протон от кислотного центра — отрицательно заряженные частицы (B– —
HO–, CH3O–)или нейтральные молекулы (B —NH3, H2O )
39
40.
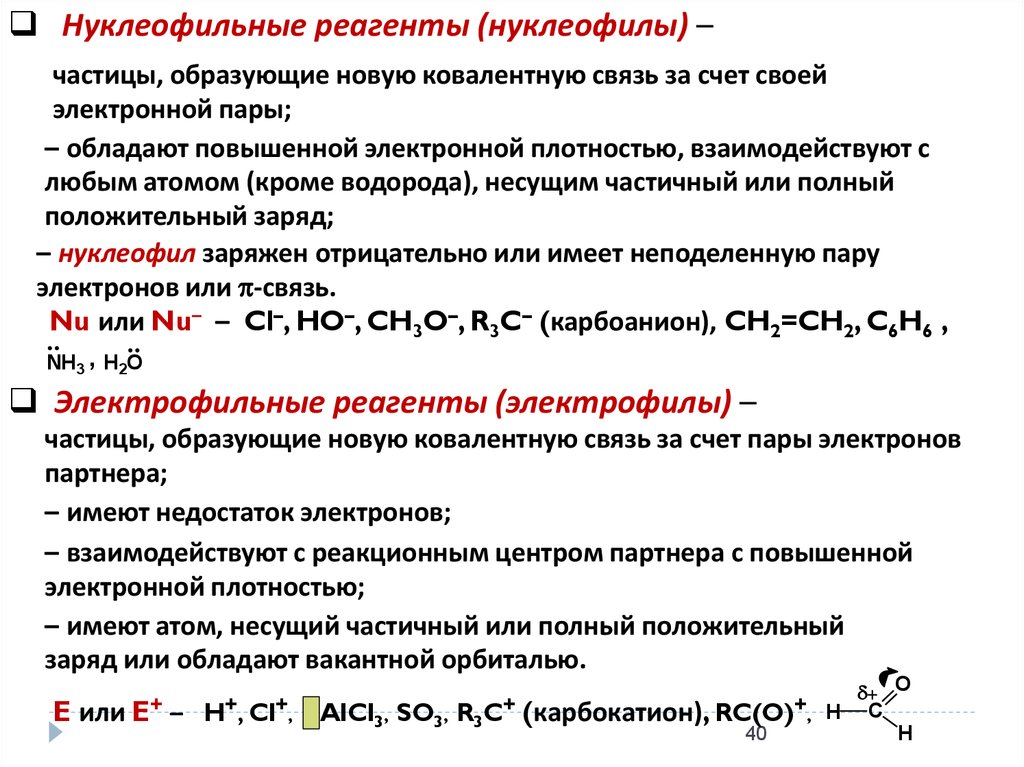
Нуклеофильные реагенты (нуклеофилы) –частицы, образующие новую ковалентную связь за счет своей
электронной пары;
– обладают повышенной электронной плотностью, взаимодействуют с
любым атомом (кроме водорода), несущим частичный или полный
положительный заряд;
– нуклеофил заряжен отрицательно или имеет неподеленную пару
электронов или -связь.
Nu или Nu– – Cl–, HO–, CH3O–, R3C– (карбоанион), CH2=CH2, C6H6 ,
NH3 , H2O
Электрофильные реагенты (электрофилы) –
частицы, образующие новую ковалентную связь за счет пары электронов
партнера;
– имеют недостаток электронов;
– взаимодействуют с реакционным центром партнера с повышенной
электронной плотностью;
– имеют атом, несущий частичный или полный положительный
заряд или обладают вакантной орбиталью.
E
или E+
–
H+, Cl+,
C+
AlCl3, SO3, R3
(карбокатион), RC(O)+, H
40
O
C
H
41.
Радикальные реагенты (радикалы) –свободные атомы или частицы с неспаренным электроном.
R• — Cl•, Br•, HOO•, R•, •O—O• (бирадикал)
Окислители –
нейтральные молекулы или ионы, принимающие электроны или атомы
водорода от органического субстрата. [O] (или Ox) — O2, Fe3+,
органические окислители
Восстановители –
нейтральные молекулы или ионы, отдающие электроны или атомы
водорода органическому субстрату.
[H] (или Red) — H2, Fe2+, H–, органические восстановители
41
42.
Способы разрыва ковалентной связи1. Гомолитический (свободнорадикальный)
X Y
X
+
Y
образующиеся активные промежуточные частицы – свободные радикалы
2. Гетеролитический (ионный)
Х Y
+
X
–
+ Y
образующиеся активные органические промежуточные частицы
– карбокатионы (положительный заряд на атоме С) или
– карбоанионы (отрицательный заряд на атоме углерода).
42
43.
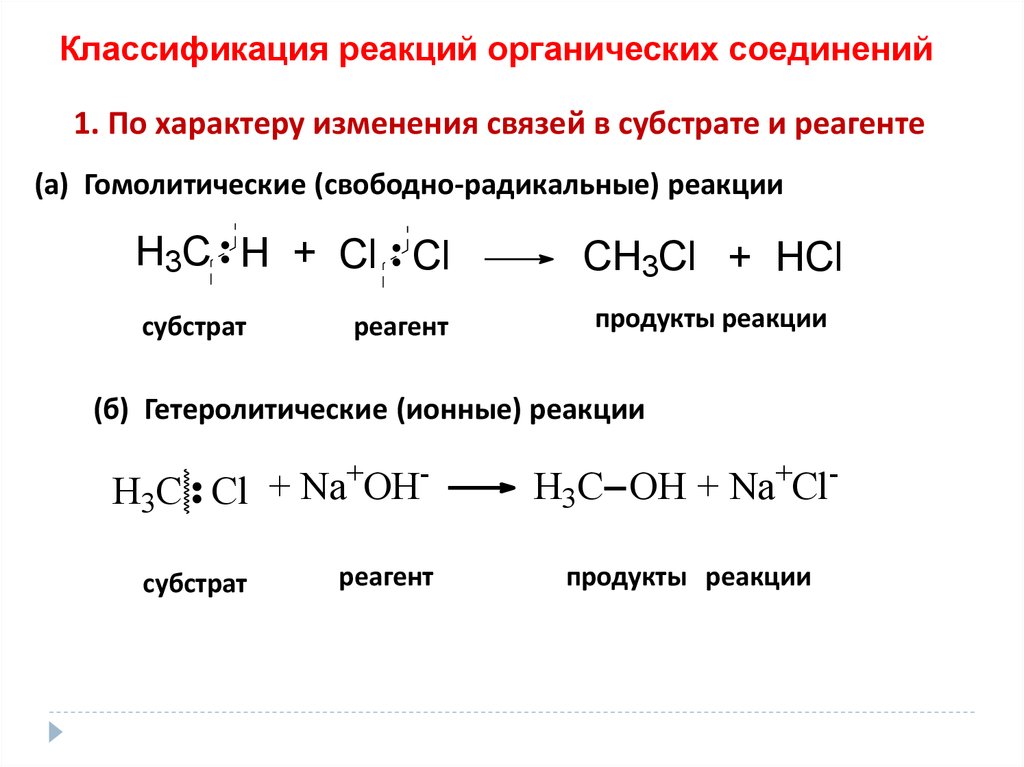
Классификация реакций органических соединений1. По характеру изменения связей в субстрате и реагенте
(а) Гомолитические (свободно-радикальные) реакции
H3C H + Cl Cl
субстрат
реагент
CH3Cl + HCl
продукты реакции
(б) Гетеролитические (ионные) реакции
+
+
Na
OH
H3C Cl
субстрат
реагент
H3C OH + Na+Clпродукты реакции
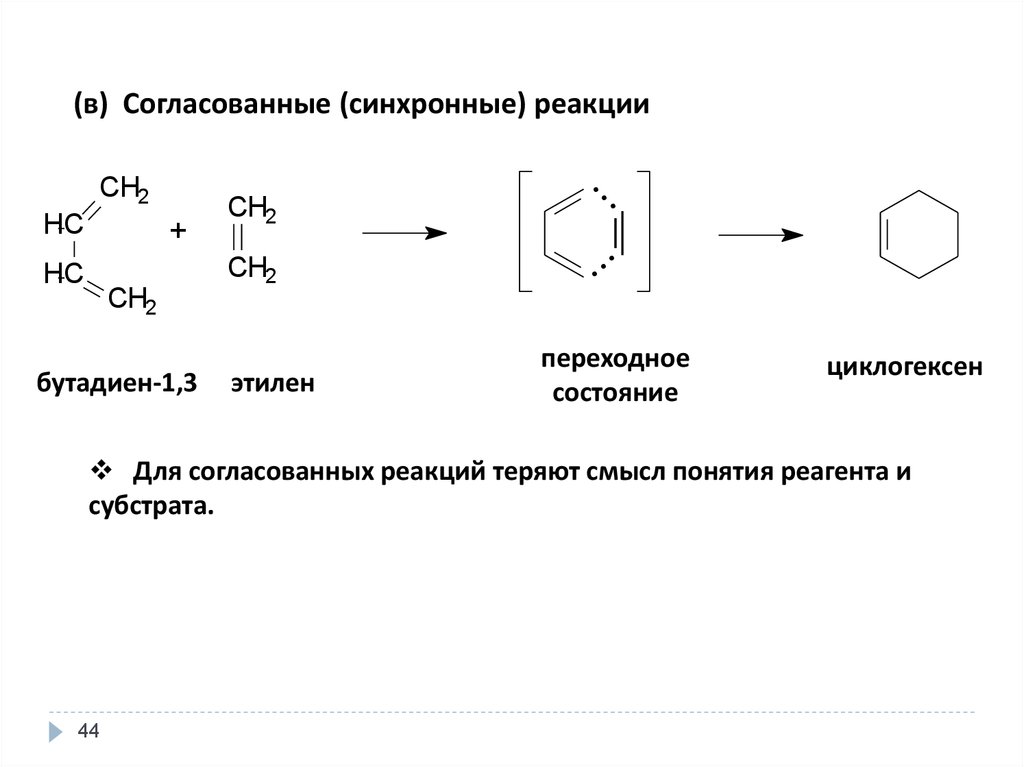
44.
(в) Согласованные (синхронные) реакцииCH2
+
HC
CH2
CH2
HC
•
•
CH2
бутадиен-1,3
этилен
переходное
состояние
циклогексен
Для согласованных реакций теряют смысл понятия реагента и
субстрата.
44
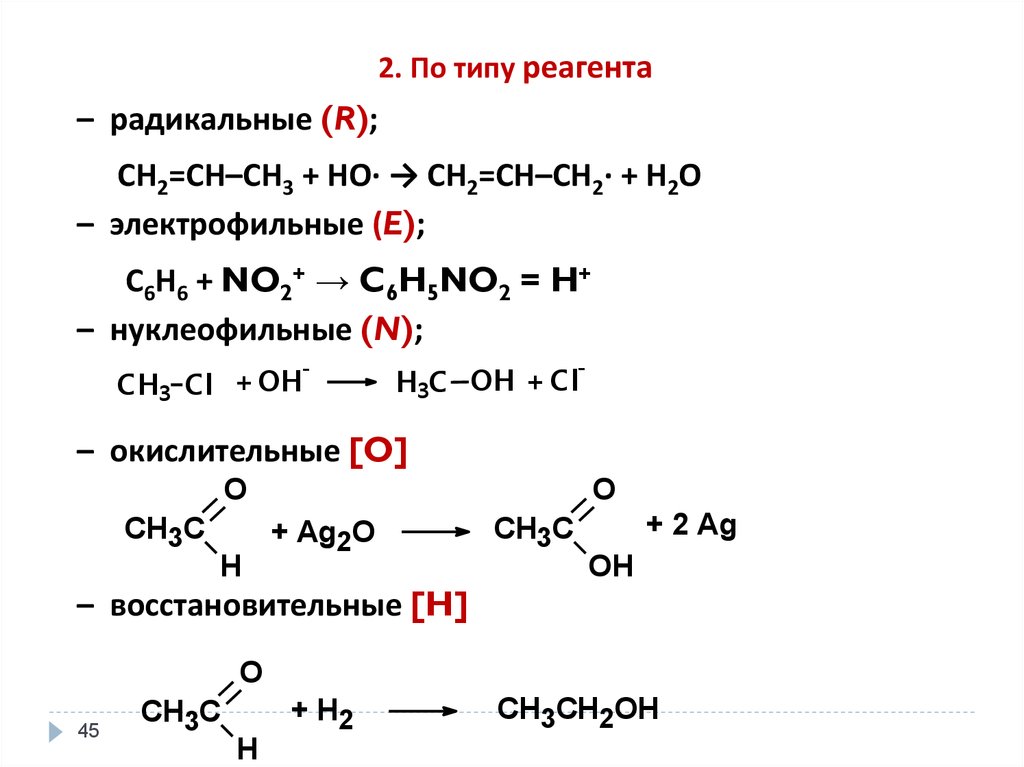
45.
2. По типу реагента– радикальные (R);
СН2=СН–СН3 + НО· → СН2=СН–СН2· + Н2О
– электрофильные (E);
С6Н6 + NO2+ → C6H5NO2 = H+
– нуклеофильные (N);
-
CH3 Cl + OH
-
H3C OH + Cl
– окислительные [O]
O
CH3C
H
O
+ Ag2O
+ 2 Ag
CH3C
OH
– восстановительные [H]
O
45
+ H2
CH3C
H
CH3CH2OH
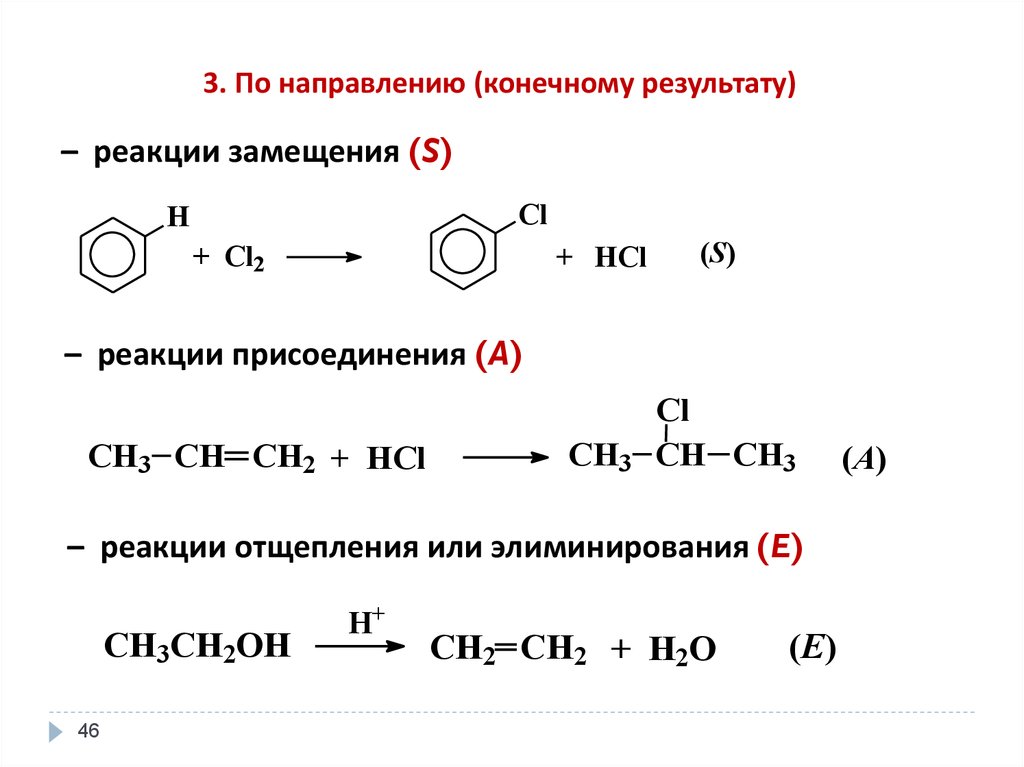
46.
3. По направлению (конечному результату)– реакции замещения (S)
Cl
H
+ Сl2
+ HCl
(S)
CH3
Cl
CH CH3
– реакции присоединения (A)
CH3 CH CH2 + HCl
– реакции отщепления или элиминирования (E)
CH3CH2OH
46
H+
CH2 CH2 + H2O
(E)
(A)
47.
– реакции перегруппировки (изомеризации)+
CH3CH2CH2OH
H
пропанол-1
OH
CH3 CH CH3
пропанол-2
– реакции циклизации
CH2CH2CH2COOH
OH
4-гидроксибутановая
кислота (ГОМК)
47
O
O
+ H2O
-бутиролактон
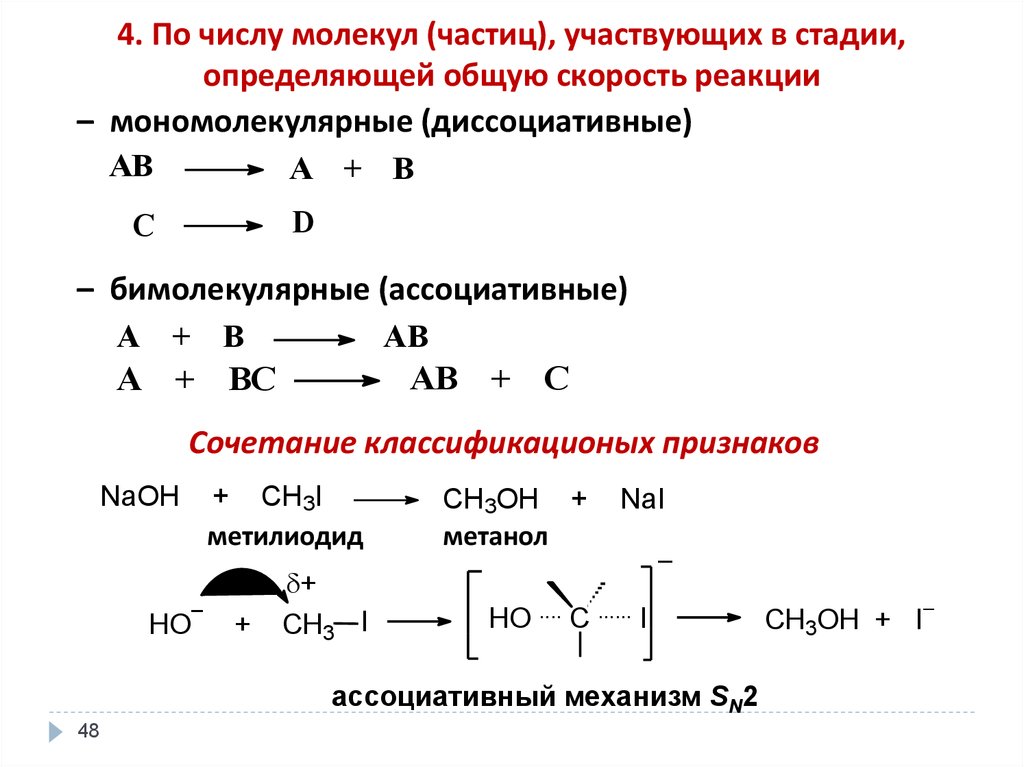
48.
4. По числу молекул (частиц), участвующих в стадии,определяющей общую скорость реакции
– мономолекулярные (диссоциативные)
AB
A + B
D
C
– бимолекулярные (ассоциативные)
A + B
AB
AB + C
A + BC
Сочетание классификационых признаков
NaOH
+ CH3I
метилиодид
–
HO
+
+
CH3 I
CH3OH +
метанол
NaI
–
HO .... C ...... I
ассоциативный механизм SN2
48
–
CH3OH + I
49.
Понятие о механизме реакцииМеханизм реакции –
– детальное описание процесса, в результате которого исходные
вещества превращаются в конечные продукты.
– детальное описание всех стадий реакции
Включает:
(1) элементарные стадии реакции;
(2) способ разрыва и образования связей на каждой стадии.
Согласуется с:
(3) стереохимией процесса – пространственным строением исходных
продуктов, переходных состояний, промежуточно образующихся частиц
и продуктов реакции;
(4) кинетическими закономерностями процесса;
(5) термодинамикой процесса.
49
50.
Механизм реакции(переходное
состояние или
промежуточное
соединение)
Исходные
соединения
Продукты
реакции
Активные промежуточные частицы:
CH2 CH2
CH3CHCH3
Радикал
R
50
CH3CHCH3
CH3CHCH3
Карбоанион
Карбокатион
R
R+
X
X
π-комплекс
51.
Факторы, определяющие реакционную способностьорганического соединения
(статические и динамические)
Статические факторы
(молекула в нереагирующем состоянии)
электронный
распределение электронной
плотности в молекуле
(электроотрицательность
атомов, входящих в
молекулу, электронные
эффекты заместителей,
наличие сопряженных и
ароматических фрагментов).
51
пространственный
пространственная
доступность реакционного
центра молекулы.
52.
Динамические факторыВключают оценку энергии промежуточных частиц
или переходного состояния.
Чем больше возможностей для делокализации
(рассредоточения) электронной плотности в
промежуточной частице (свободном радикале, катионе,
анионе, -комплексе), или в переходном состоянии, тем
более они устойчивы (стабильны), тем ниже их энергия и
тем легче идет реакция.
52
53.
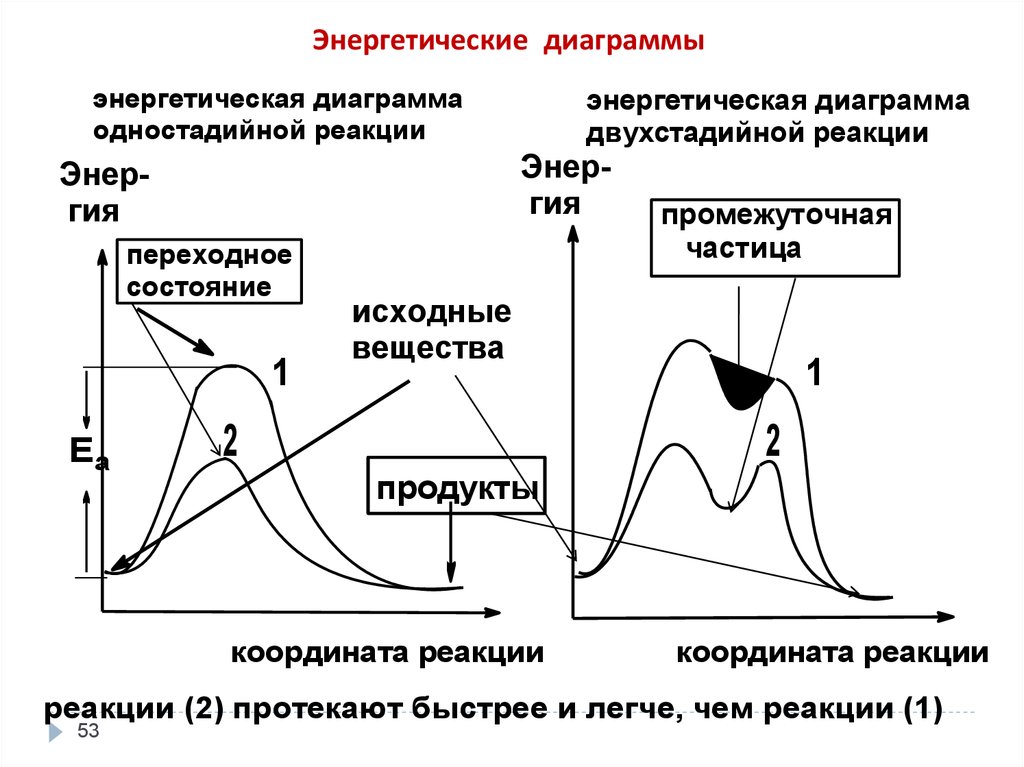
Энергетические диаграммыэнергетическая диаграмма
одностадийной реакции
Энергия
Энергия
переходное
состояние
1
Еа
энергетическая диаграмма
двухстадийной реакции
промежуточная
частица
исходные
вещества
2
1
2
продукты
координата реакции
координата реакции
реакции (2) протекают быстрее и легче, чем реакции (1)
53
54.
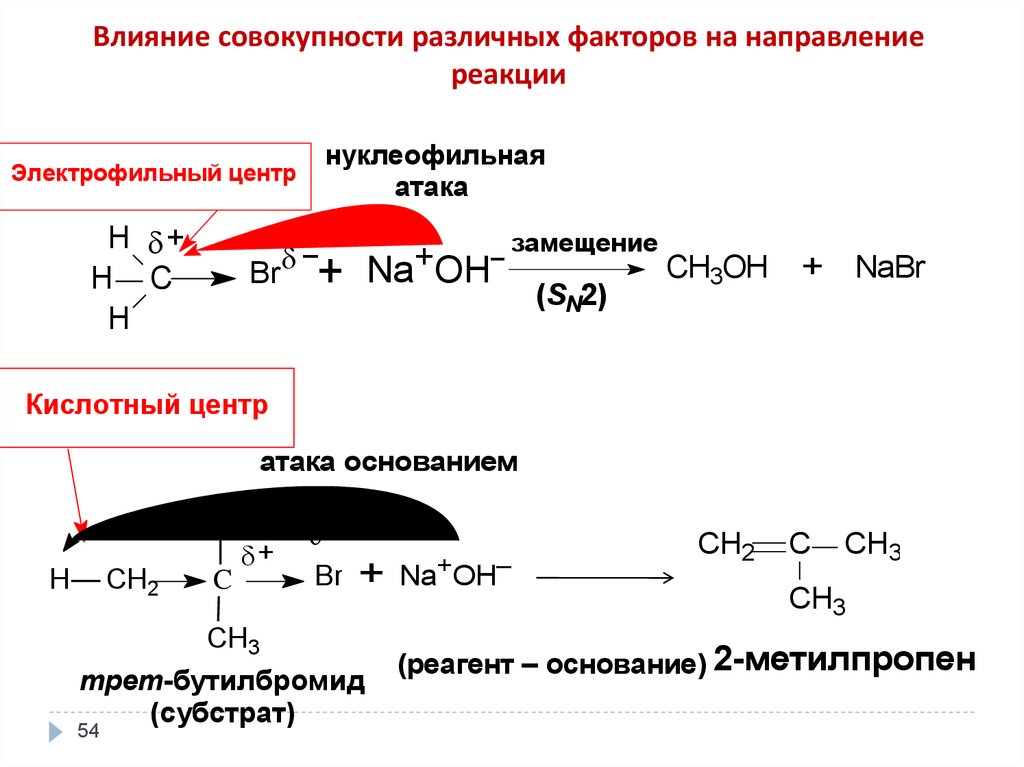
Влияние совокупности различных факторов на направлениереакции
нуклеофильная
атака
Электрофильный центр
H +
H C
H
замещение
+
–
CH3OH + NaBr
Na OH
–
Br
+
(SN2)
Кислотный центр
атака основанием
H
CH2
CH3
+
C
–
Br
+
CH3
трет-бутилбромид
(субстрат)
54
Na+OH–
CH2
C
CH3
CH3
(реагент – основание) 2-метилпропен




















 Химия
Химия








