Похожие презентации:
Фенол. Состав молекулы фенола
1. Фенол
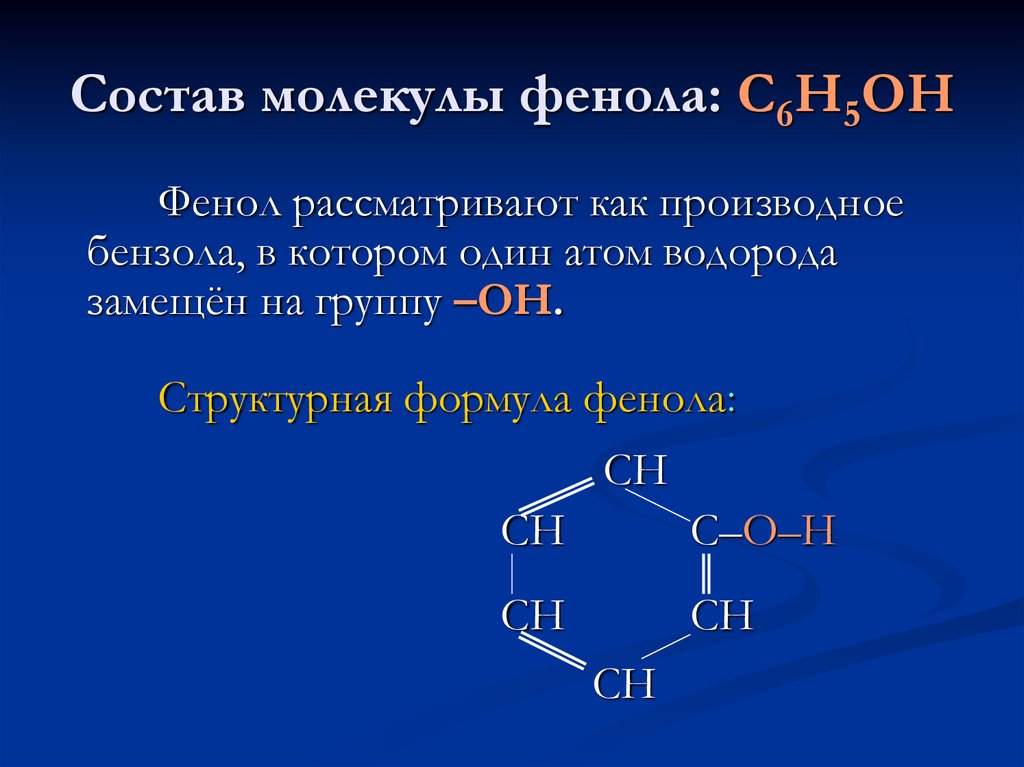
Пильникова Н.Н.2. Состав молекулы фенола: С6Н5ОН
Фенол рассматривают как производноебензола, в котором один атом водорода
замещён на группу –ОН.
Структурная формула фенола:
СН
СН
С–О–Н
СН
СН
СН
3. Физические свойства фенола
Фенол – твёрдое вещество (с характернымзапахом).
Высокие температуры кипения и плавления
фенола объясняются наличием
межмолекулярных водородных связей,
которые прочнее, чем между молекулами
предельных одноатомных спиртов.
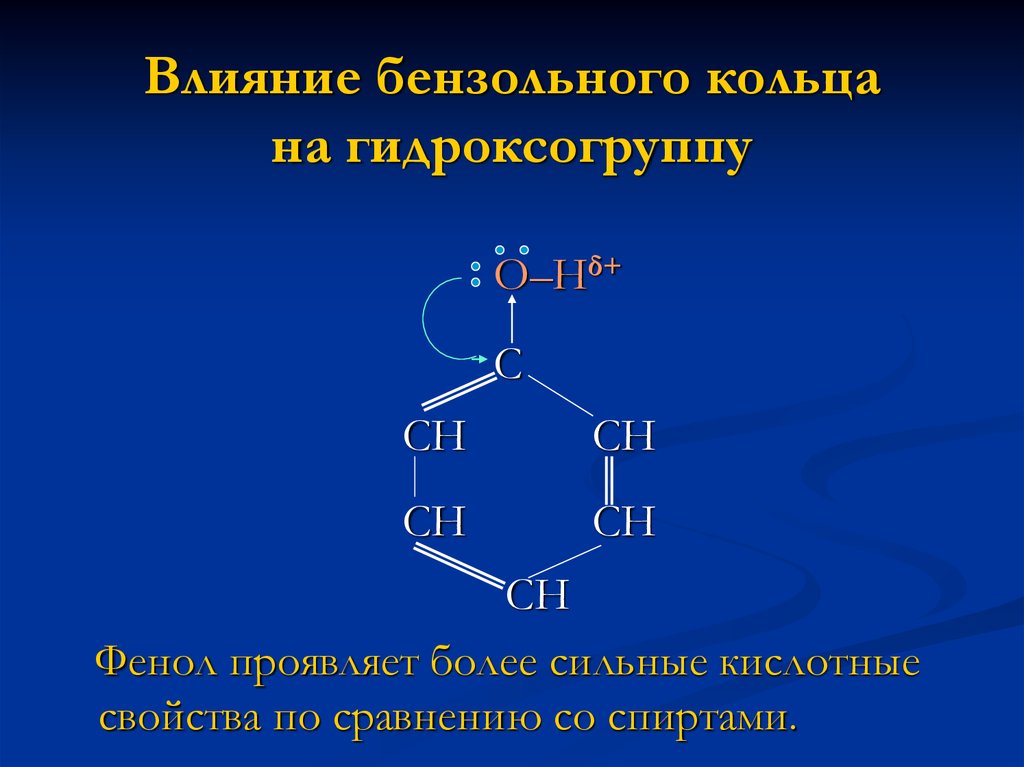
4. Влияние бензольного кольца на гидроксогруппу
О–Нδ+С
СН
СН
СН
СН
СН
Фенол проявляет более сильные кислотные
свойства по сравнению со спиртами.
5. Кислотные свойства фенола
1. Взаимодействие с активными металлами:2С6Н5–ОН + 2Na → 2С6Н5–ОNa + H2
фенолят натрия
2. Взаимодействие с основаниями:
С6Н5–ОН + NaОН → С6Н5–ОNa + H2О
фенолят натрия
3. Взаимодействие с солями:
с FeCl3 → комплексное соединение
(сине-фиолетовый раствор)
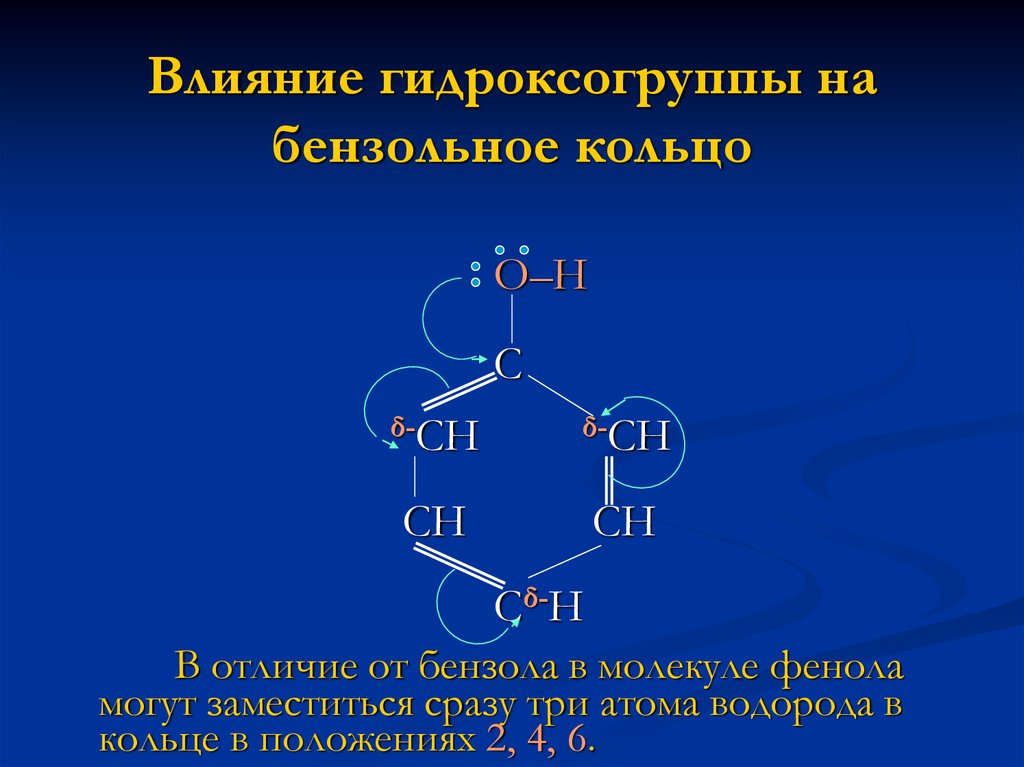
6. Влияние гидроксогруппы на бензольное кольцо
О–НС
δ-СН
δ-СН
СН
СН
Сδ-Н
В отличие от бензола в молекуле фенола
могут заместиться сразу три атома водорода в
кольце в положениях 2, 4, 6.
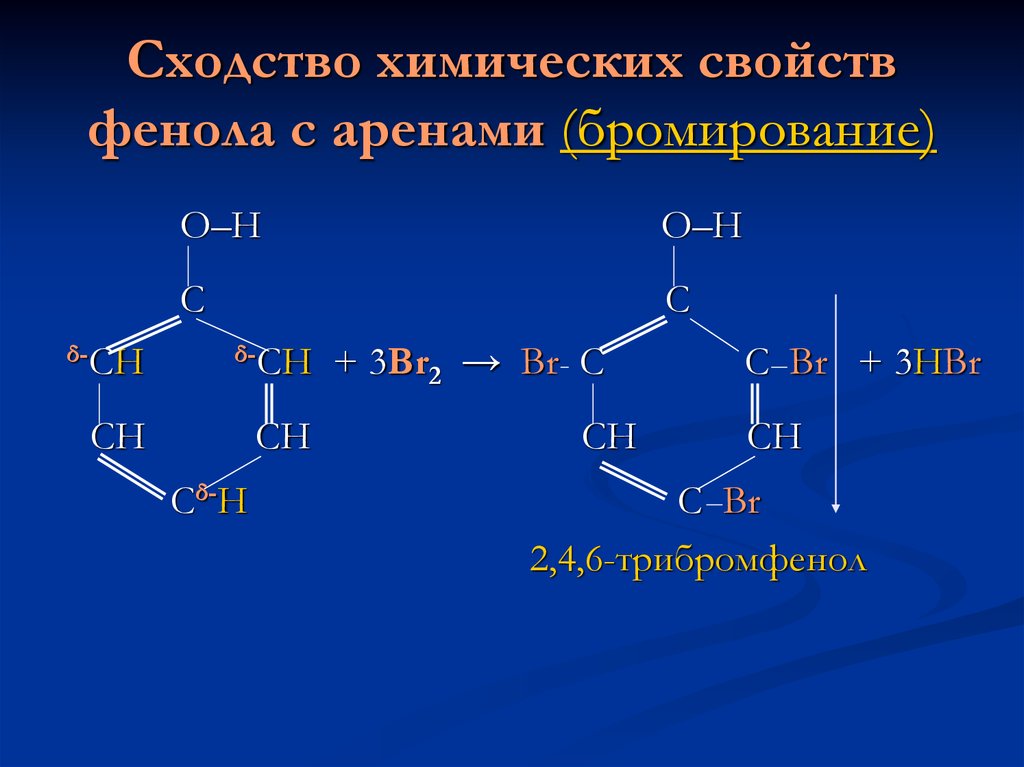
7. Сходство химических свойств фенола с аренами (бромирование)
О–НО–Н
С
С
δ-СН
δ-СН
СН
СН
Сδ-Н
+ 3Br2 → Br С
СН
С Br + 3HBr
СН
С Br
2,4,6-трибромфенол
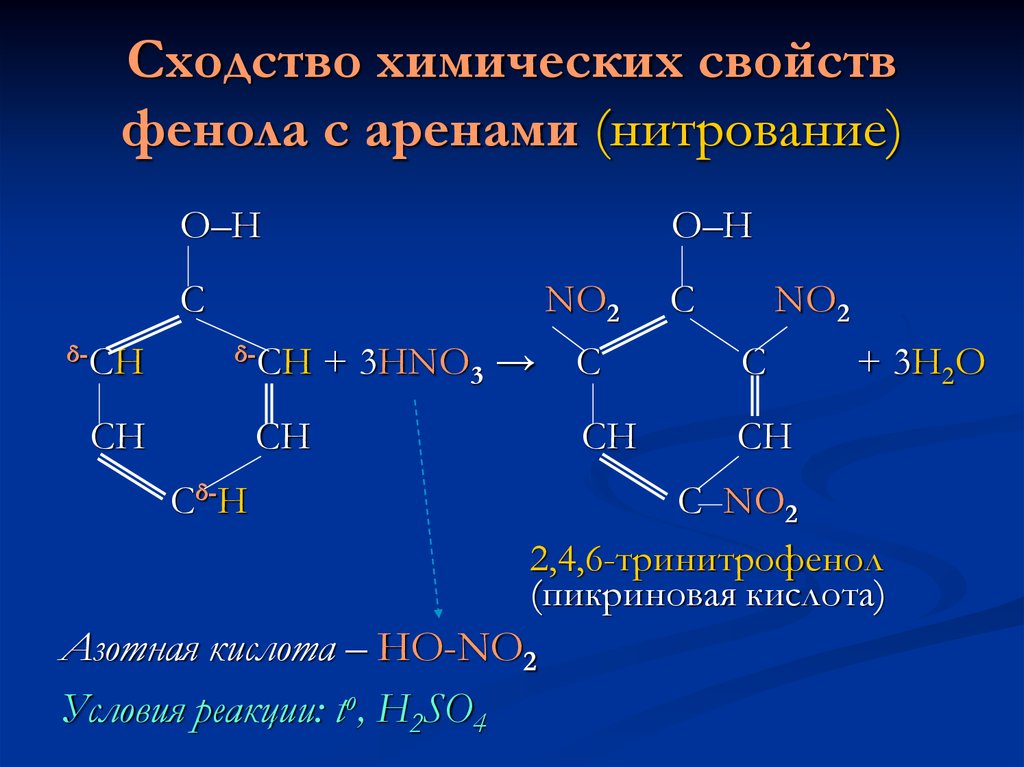
8. Сходство химических свойств фенола с аренами (нитрование)
О–НО–Н
С
NO2
δ-СН
δ-СН
СН
СН
Сδ-Н
+ 3HNO3 →
С
NO2
С
С
СН
СН
+ 3H2O
С NO2
2,4,6-тринитрофенол
(пикриновая кислота)
Азотная кислота – HO-NO2
Условия реакции: tо, H2SO4
9. Применение фенола
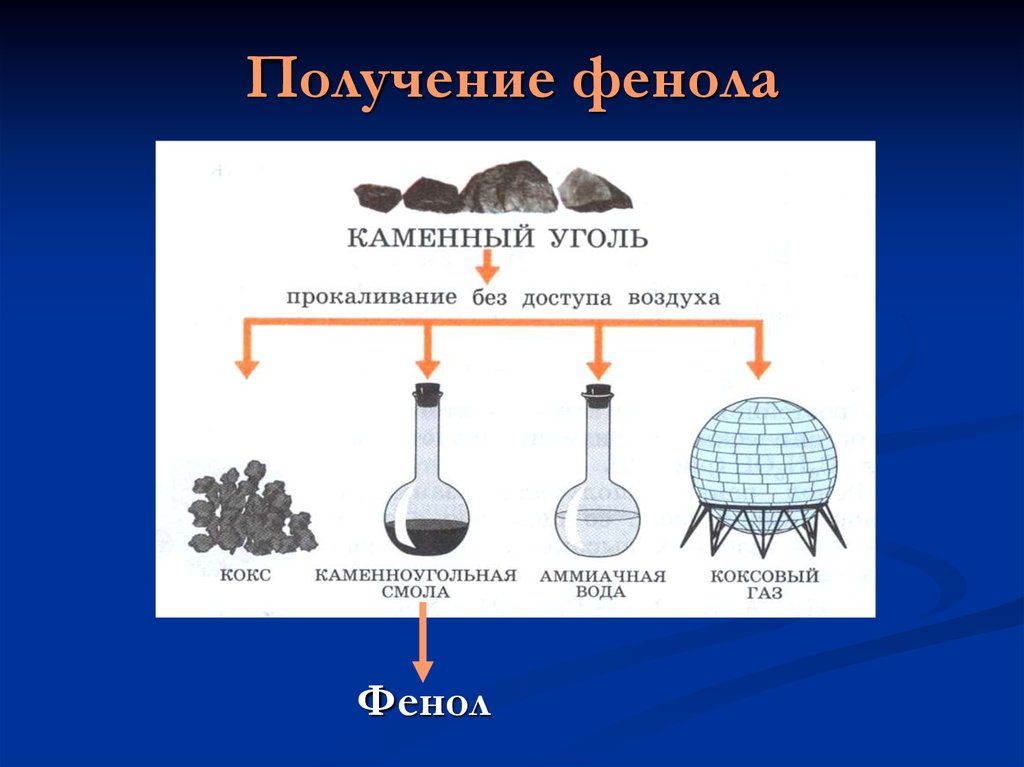
10. Получение фенола
Фенол11. Выводы
Фенол сочетает в себе свойства спиртов иароматических углеводородов.
В ряду: одноатомные спирты → многоатомные спирты
→ фенол усиливаются кислотные свойства.
Качественными реакциями на фенол являются:
а) взаимодействие с раствором FeCl3 с образованием сине-фиолетового окрашивания;
б) взаимодействие фенола с бромной водой с
образованием белого осадка.
Природным источником получения фенола
является каменный уголь.





 Химия
Химия








