Похожие презентации:
Химическая связь
1. Химическая связь
2.
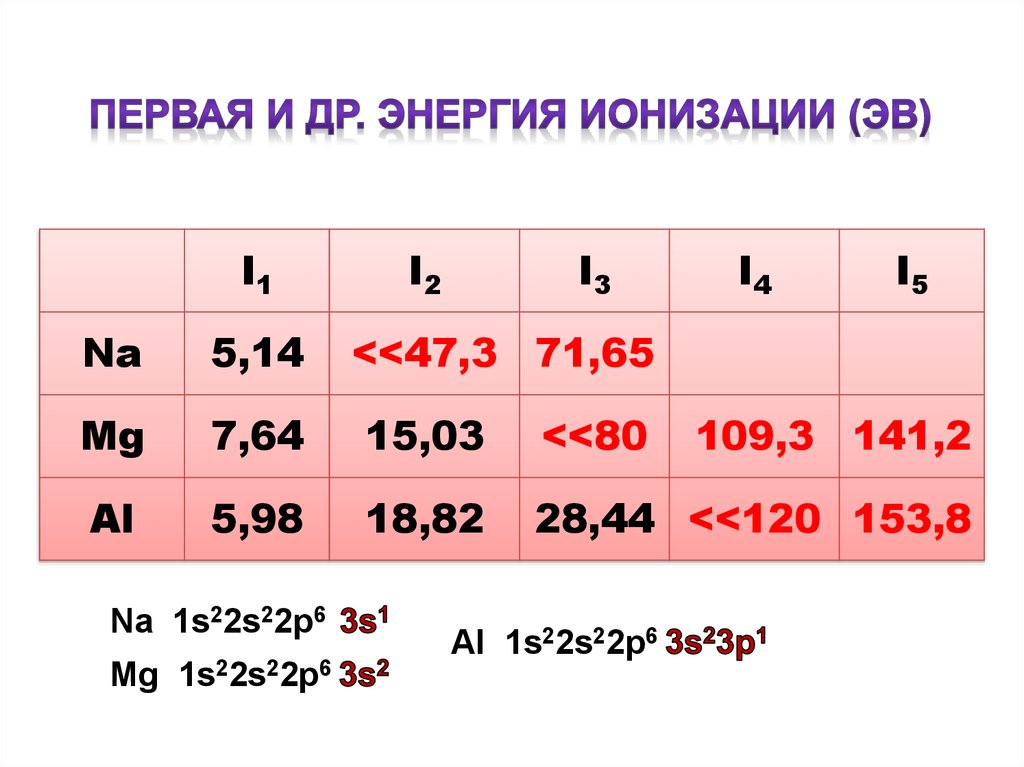
І1І2
І3
І4
І5
Nа
5,14
Мg
7,64
15,03
<<80
Аl
5,98
18,82
28,44 <<120 153,8
Na 1s22s22p6
Mg 1s22s22p6
<<47,3 71,65
Al 1s22s22p6
109,3 141,2
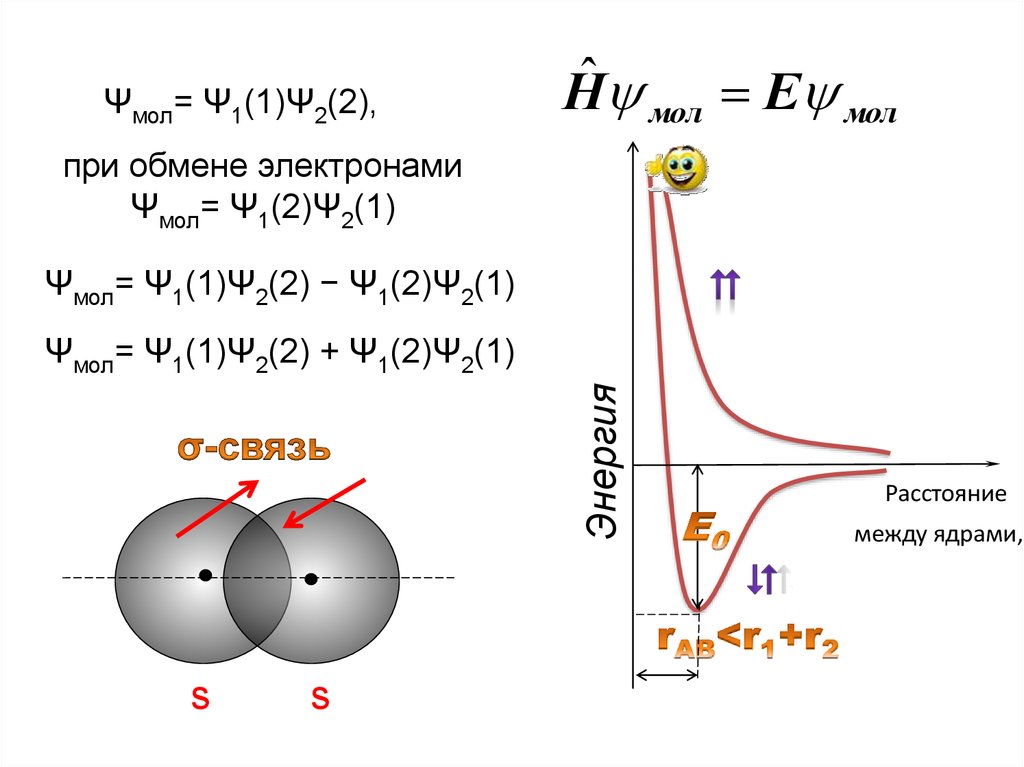
3.
Нˆ мол Е молe–1 r12 e–2
r(В2)
А
rАВ
В
Молекула Н2: А и В – ядра; е1 и е2 – электроны.
4.
Ψмол= Ψ1(1)Ψ2(2),Нˆ мол Е мол
при обмене электронами
Ψмол= Ψ1(2)Ψ2(1)
Ψмол= Ψ1(1)Ψ2(2) − Ψ1(2)Ψ2(1)
Энергия
Ψмол= Ψ1(1)Ψ2(2) + Ψ1(2)Ψ2(1)
s
s
Расстояние
между ядрами,
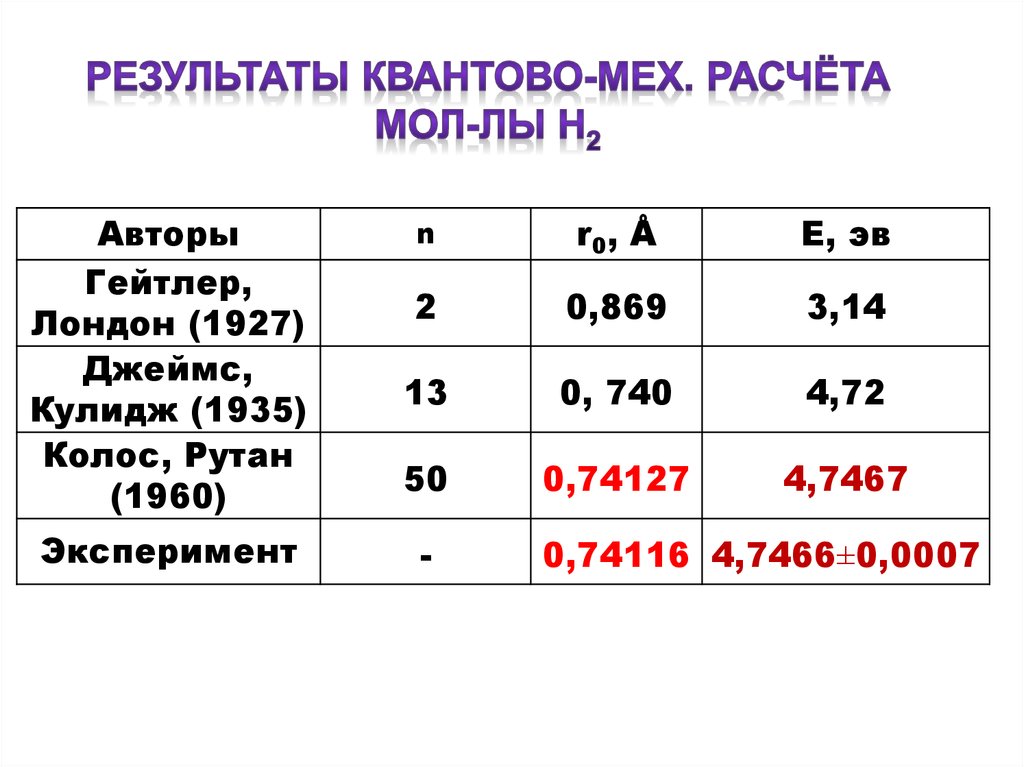
5.
АвторыГейтлер,
Лондон (1927)
Джеймс,
Кулидж (1935)
Колос, Рутан
(1960)
Эксперимент
n
r0 , Å
Е, эв
2
0,869
3,14
13
0, 740
4,72
50
0,74127
4,7467
-
0,74116 4,7466±0,0007
6.
а) насыщаемостьб) направленность
в) поляризуемость
сигма σ
пи π
дельта δ
7.
Механизмы образования ковалентной связиОбменный
Н 1s
Н 1s
Донорно-акцепторный
А
В
Свободная АО
(акцептор)
Неподелённая
электронная пара
(донор НЭП)
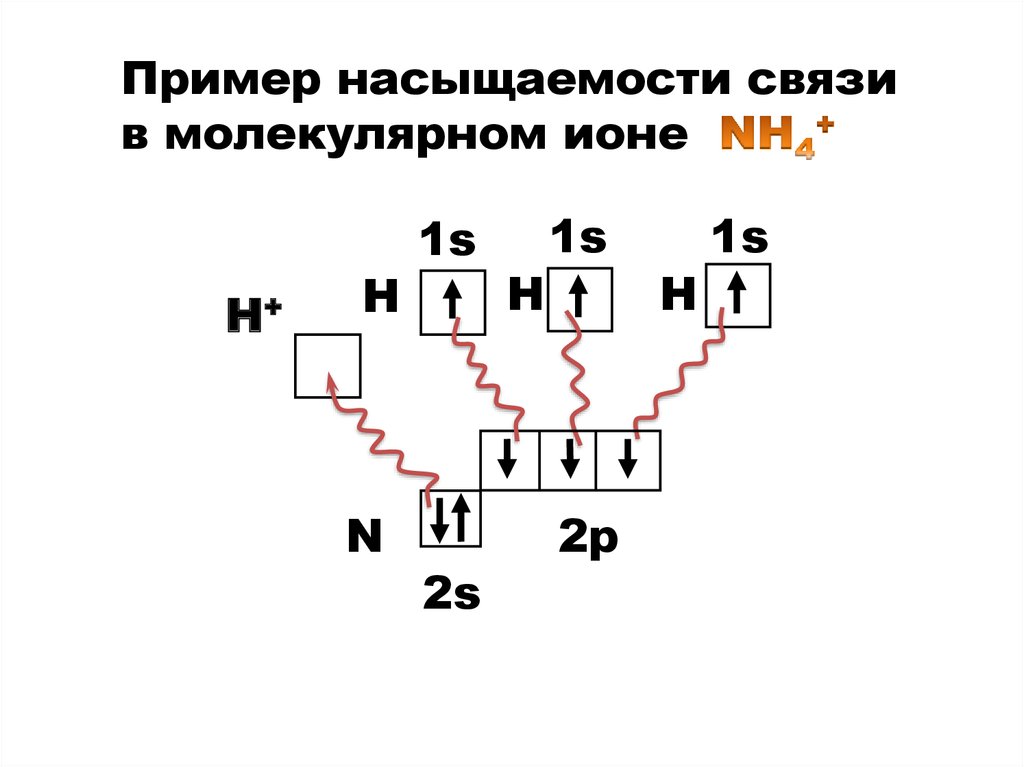
8.
Пример насыщаемости связив молекулярном ионе
Н+
Н
N
1s
2s
Н
1s
2р
Н
1s
9.
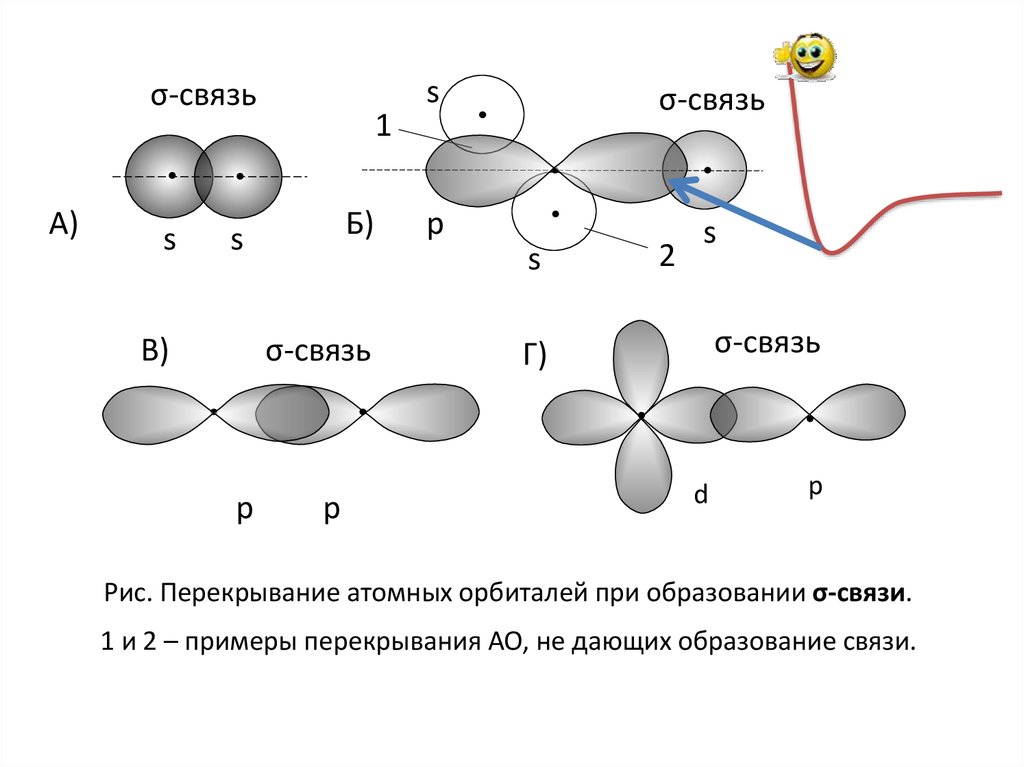
σ-связьА)
s
1
Б)
s
р
σ-связь
p
s
s
σ-связь
В)
s
р
2
σ-связь
Г)
d
p
Рис. Перекрывание атомных орбиталей при образовании σ-связи.
1 и 2 – примеры перекрывания АО, не дающих образование связи.
10.
Б)А)
p
d
p
В)
d
p
d
Рис. Перекрывание АО при образовании π-связей.
d
d
Рис. Перекрывание d-орбиталей при образовании δ-связи.
11.
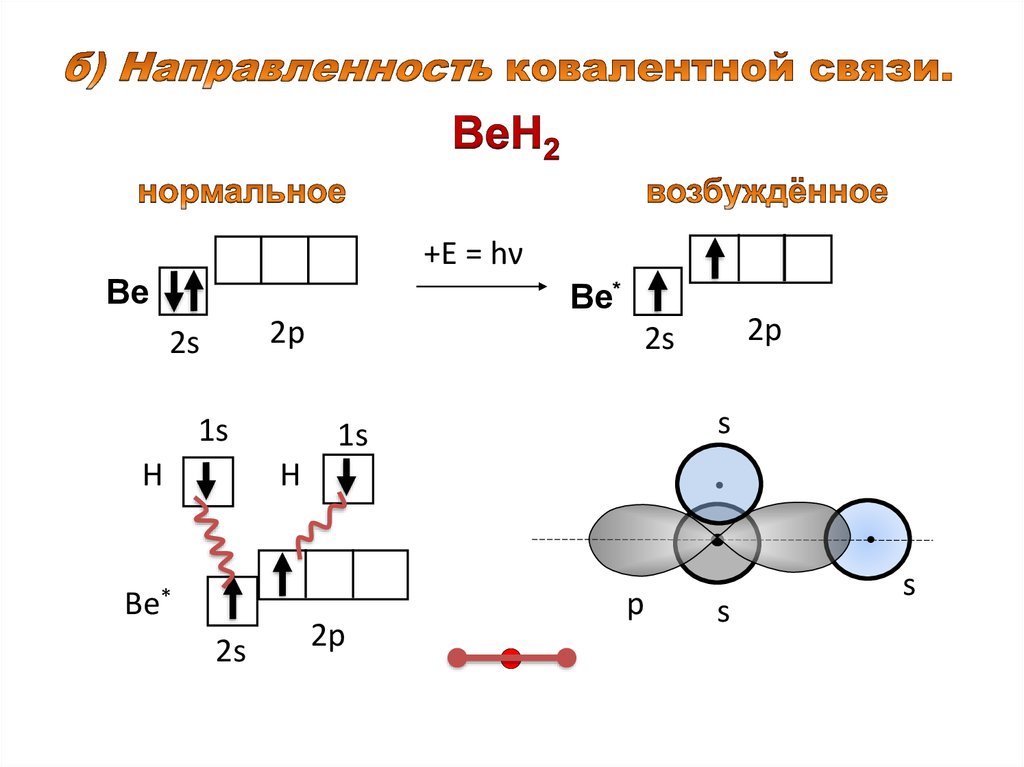
+Ε = hνВе
Ве*
2р
2s
1s
Н
2р
2s
s
1s
Н
Ве*
2s
2р
p
s
s
12.
zz
х
x
Образование sp-гибридных орбиталей.
z
x
Н
Ве
Н
Образование молекулы ВеН2.
13.
.1. АО должны быть обязательно разного типа (s, p, и/или d),
причём
.
(гибридных орбиталей).
3. Обозначение ГО: sp; sp2; sp3; sp2d; sp3d2 «эс-пэ-три-дэ-два».
4. ГО, имея одинаковую форму и энергию, располагаются в
пространстве строго симметрично в стремлении к
минимуму энергии с сохранением элементов симметрии
исходного набора. Графическое изображение ГО:
5. В гибридизации принимают участие как электроны,
образующие
, так и
. ГО могут образовывать
только сигма -связи.
в гибридизации не участвуют.
14.
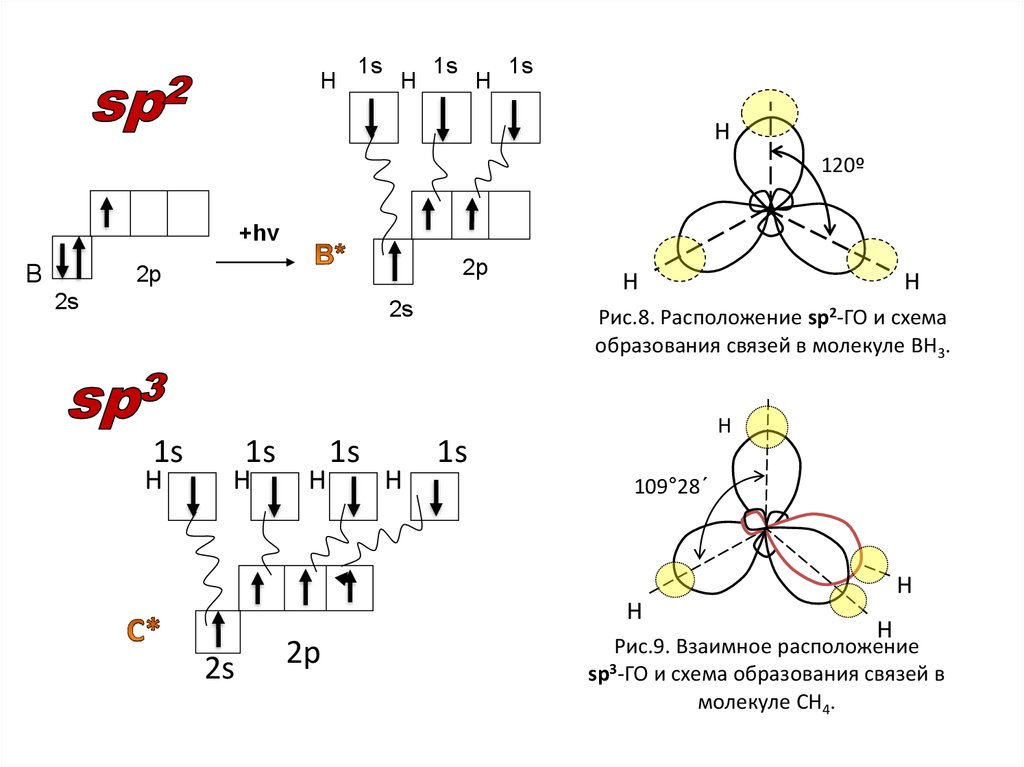
Н1s
Н
1s
Н
1s
Н
120º
+hν
В
2р
2р
2s
2s
1s
Н
1s
Н
Н
1s
Н
Н
Н
Рис.8. Расположение sp2-ГО и схема
образования связей в молекуле ВН3.
Н
1s
109°28´
Н
Н
2s
2р
Н
Рис.9. Взаимное расположение
sp3-ГО и схема образования связей в
молекуле СН4.
15.
Таблица 1.Тип гибридизации и пространственная
конфигурация молекул
Тип
гибридиза
ции ц. а.
sp
sp2
sp3
sp2d
(dsp2)
sp3d
sp3d2
(d2sp3)
все по
90°
Направлен
ие ГО от
ядра атома
Валентный
угол
между ГО
180°
все 120º
все 109°
все 90º
три угла по
120°
шесть углов
по 90°
Пример
ВеН2,
СаСl2
ВН3, ВСl3
СН4, NH4+
[РdСl4]2-
РСl5
SF6
линейная
плоская
треугольн
ая
тетраэдр
квадрат
тригональная
бипирамида
октаэдр
Конфигура
ция
молекулы
16.
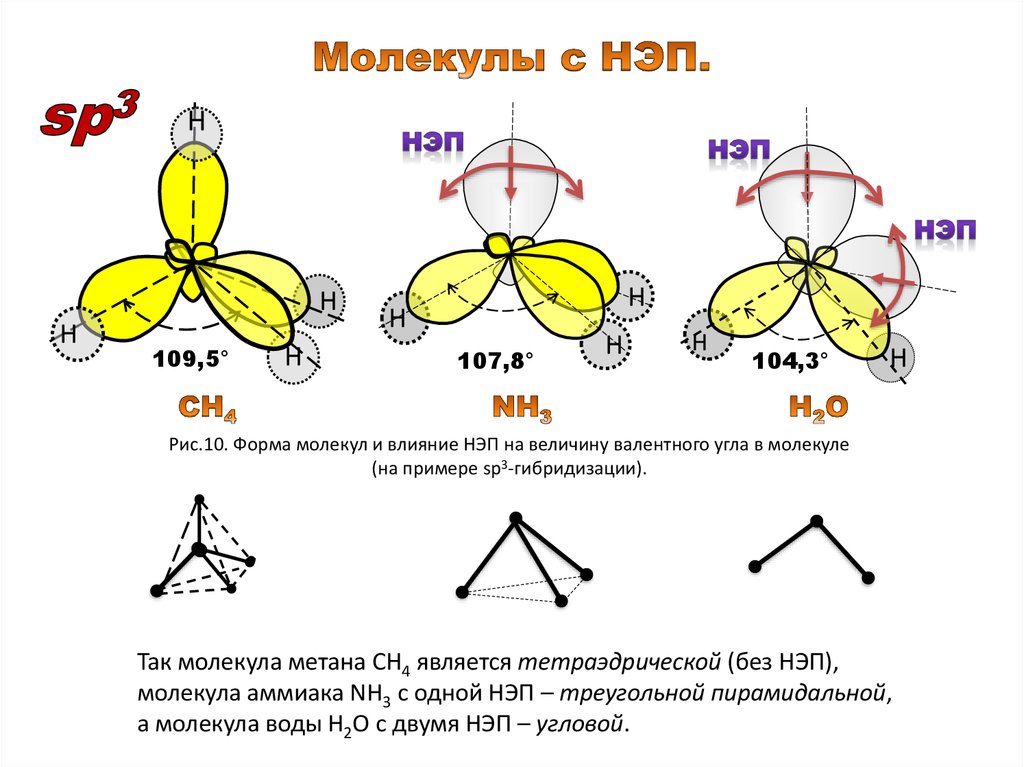
НН
Н
109,5°
Н
Н
Н
107,8°
Н
Н
104,3°
Н
Рис.10. Форма молекул и влияние НЭП на величину валентного угла в молекуле
(на примере sp3-гибридизации).
Так молекула метана СН4 является тетраэдрической (без НЭП),
молекула аммиака NH3 с одной НЭП – треугольной пирамидальной,
а молекула воды Н2О с двумя НЭП – угловой.
17.
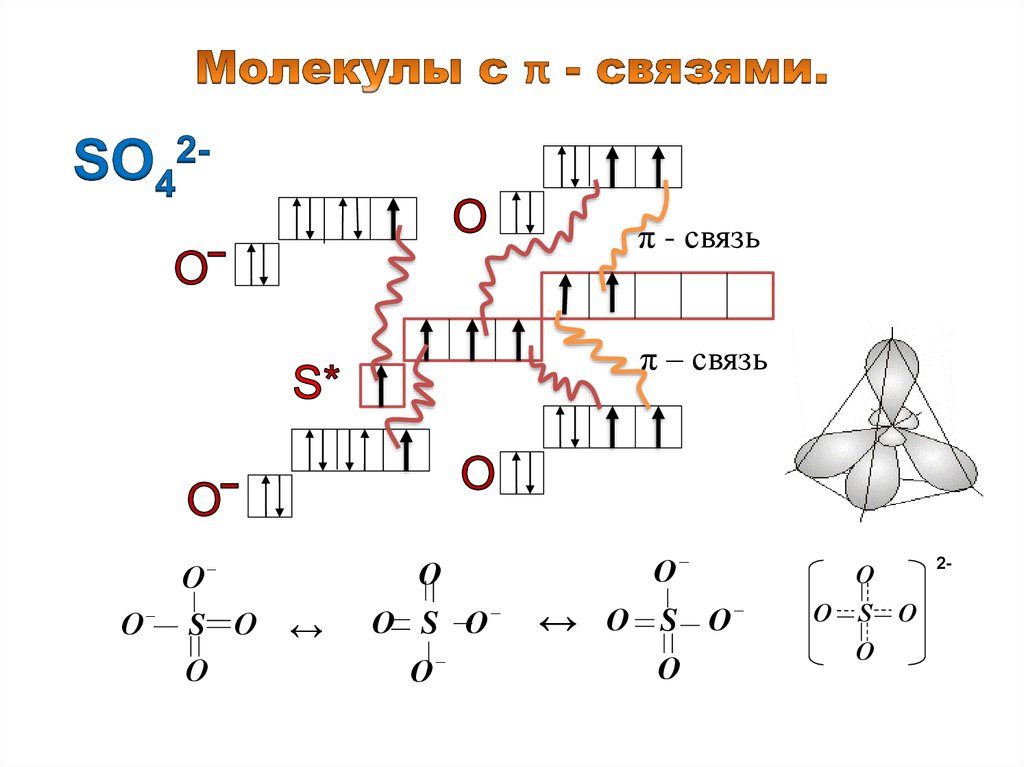
π - связьπ – связь
О
О
S О
О
↔
О
О S О
О
↔
О
О S О
О
О
О S О
О
2-
18.
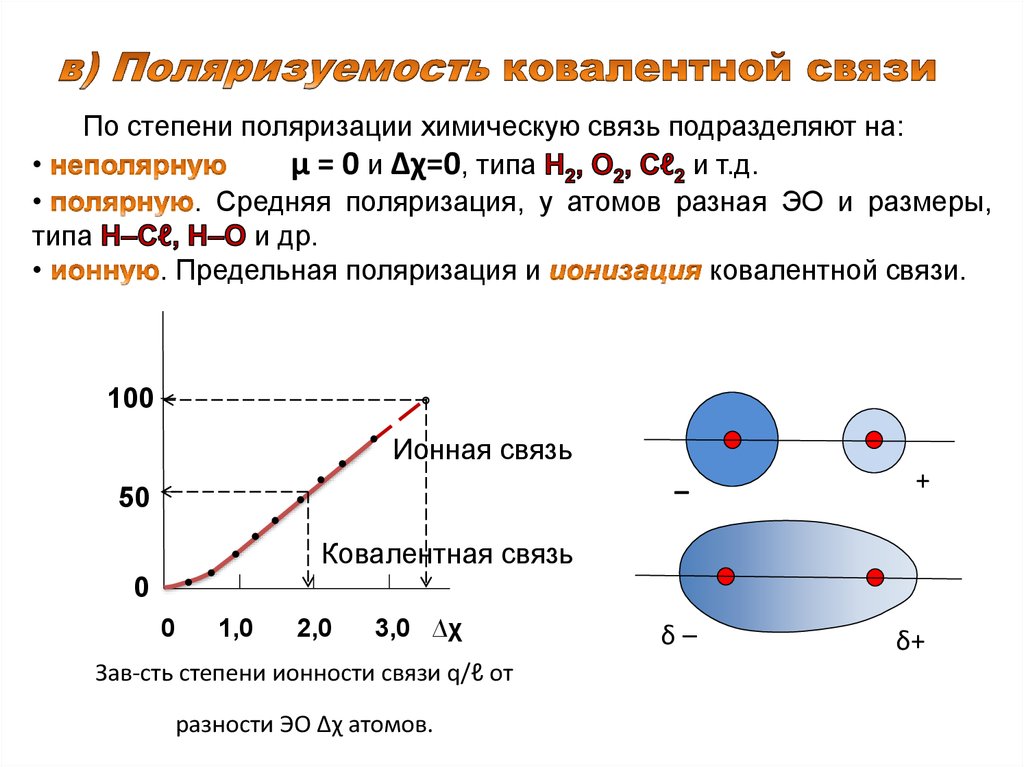
По степени поляризации химическую связь подразделяют на:μ = 0 и ∆χ=0, типа
и т.д.
. Средняя поляризация, у атомов разная ЭО и размеры,
типа
и др.
. Предельная поляризация и
ковалентной связи.
100
Ионная связь
–
+
50
δ–
δ+
Ковалентная связь
0
0
1,0
2,0
3,0 ∆χ
Зав-сть степени ионности связи q/ℓ от
разности ЭО ∆χ атомов.
19.
Свойства –неспецифичность
ненасыщаемость
ненаправленность.
Ионные соединения не образуют
молекул.
координационное число – к.ч.
rкатиона
rаниона
0,41 ÷ 0,73
0,73 ÷ 1,37
координация
октаэдр
куб
к.ч.
6
8
20.
к.ч. = 6к.ч. = 8
21.
1927-29 гг. Ф. Гунд, Р. Малликен, Р. Ленард-Джонс и др.Основные положения метода МО:
1. При образовании молекулы электроны переходят с АО на
молекулярные орбитали МО, двигаясь в поле всех ядер.
2. Молекулярные орбитали являются многоцентровыми.
3. МО также как и АО характеризуются тремя квантовыми числами:
главным n, побочным ℓ, магнитным mℓ; определяющими их
энергию, число и ориентацию в пространстве.
Обозначают МО буквами греческого алфавита,
латинскими буквами, принятыми для обозначения АО:
сходными
с
АО
s
p
d
f
МО
σ
π
δ
φ
4. Заполнение МО электронами подчиняется тем же принципам, что и
АО:
а) принцип минимума энергии;
б) принцип Паули;
в) правило Гунда.
22.
Имеются различные варианты ММО. Наиболее широкоеиспользование получил метод
«молекулярная орбиталь –
есть линейная комбинация атомных орбиталей».
Принцип линейной комбинации подразумевает конструирование
МО путём сложения и вычитания волновых функций электронов
исходных АО.
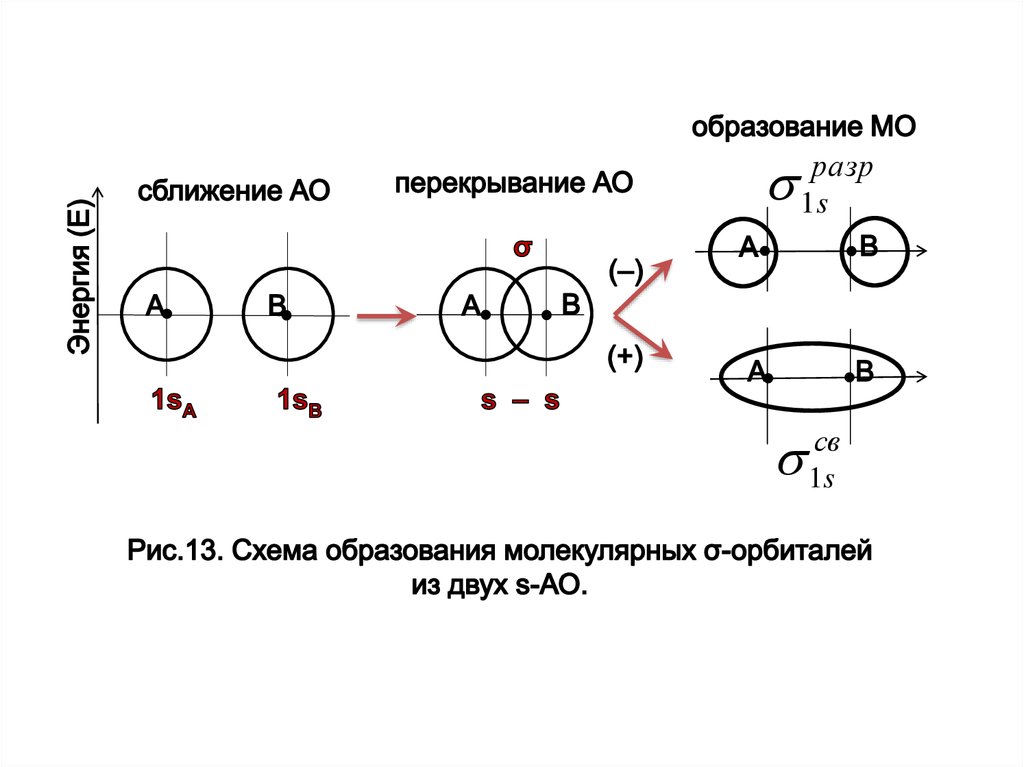
Линейная комбинация двух s-орбиталей (молекула Н2) даёт
столько же молекулярных орбиталей МО в виде:
ψ+ = с1ψ1 + с2ψ2
и
ψ– = с1ψ1 – с2ψ2,
ψ+ - связывающая МО – (волновая функция - при сложении исходных АО ).
ψ– - разрыхляющая МО – (волновая функция- при вычитании исходных АО).
23.
24.
разр1s
св
1s
25.
АОУвеличение энергии
Н
МО
Н2
АО
1разр
s
Н
N связ N разр
nсвязи
2
+ΔΕ
1s
–ΔΕ
nH 2
1s
св
1s
Рис.14. Энергетическая диаграмма АО атомов и МО
двухатомных молекул элементов первого периода.
2 0
1
2
26.
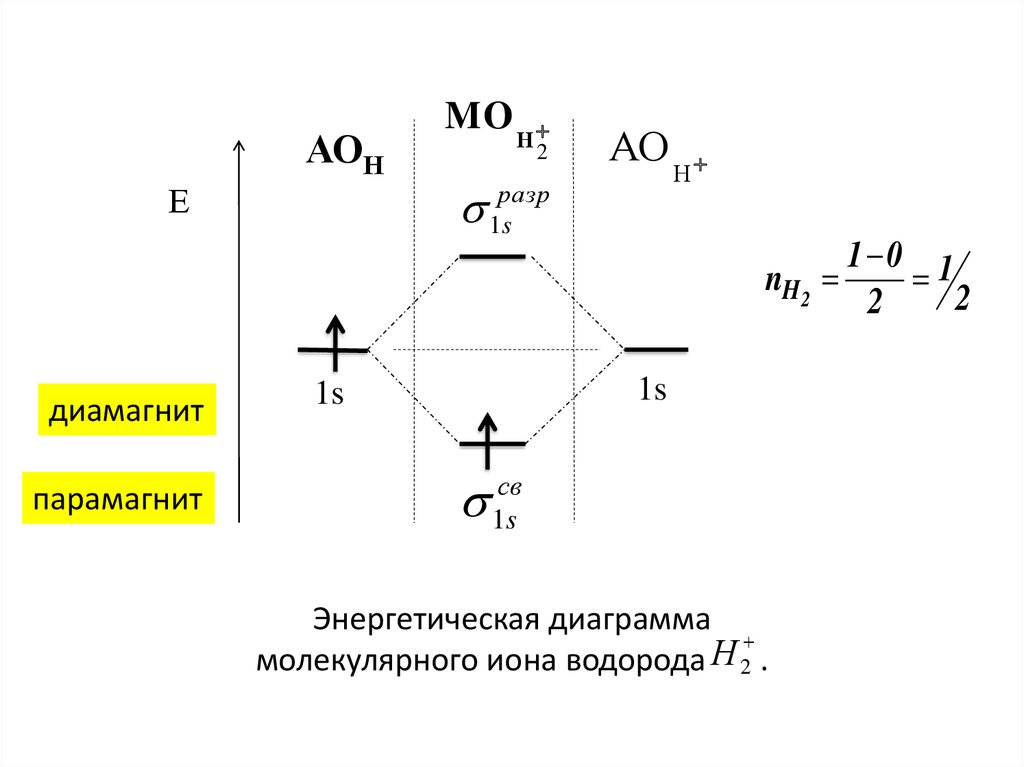
АОНЕ
диамагнит
парамагнит
MO
Н
2
АО
разр
1s
Н
1 0 1
nH 2
2
2
1s
1s
св
1s
Энергетическая диаграмма
Н
молекулярного иона водорода 2 .
27.
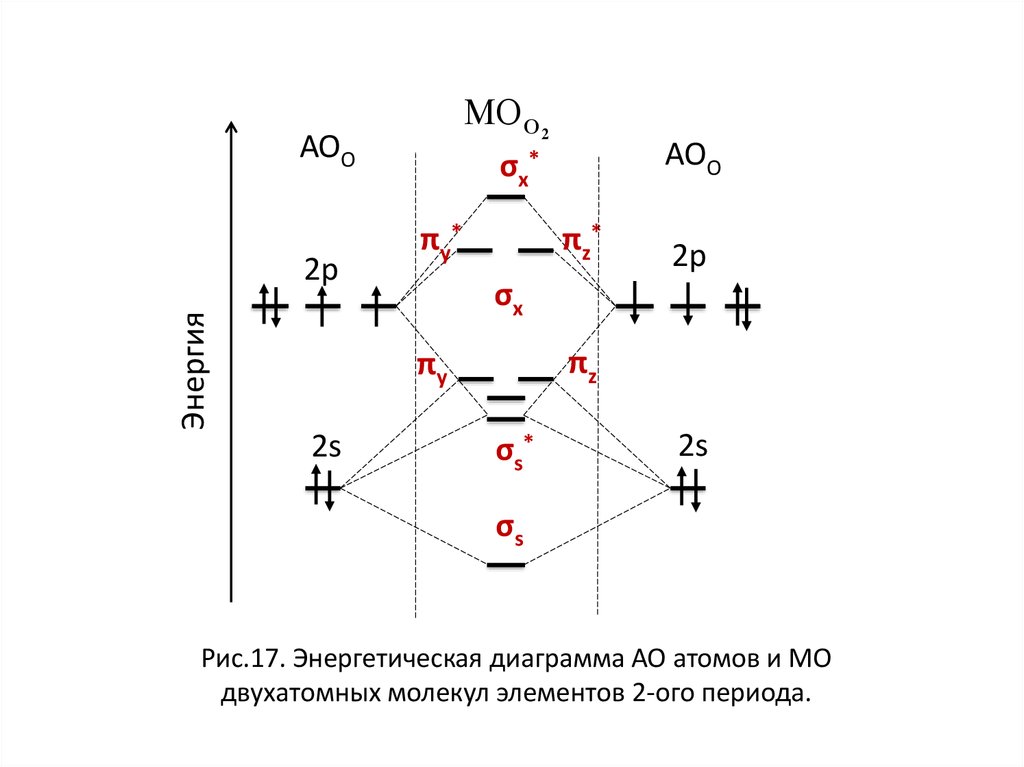
σ1s < σ1s* < σ2s < σ2s* <МО О 2
АОО
< πy* = πz* < σx*
АОО
σx *
πy*
парамагнит
nO2
πz*
2р
8 4
2
2
2р
2р
Энергия
2s
πy
2s
πz
σx
σs*
О
2s
σs
НЭП
О
2р
2s
Рис.17. Энергетическая диаграмма АО атомов и МО
двухатомных молекул элементов 2-ого периода.
диамагнит
28.
МО О 2АОО
Энергия
2р
πy*
πz*
2р
σx
πz
πy
2s
АОО
σx*
σs*
2s
σs
Рис.17. Энергетическая диаграмма АО атомов и МО
двухатомных молекул элементов 2-ого периода.
29.
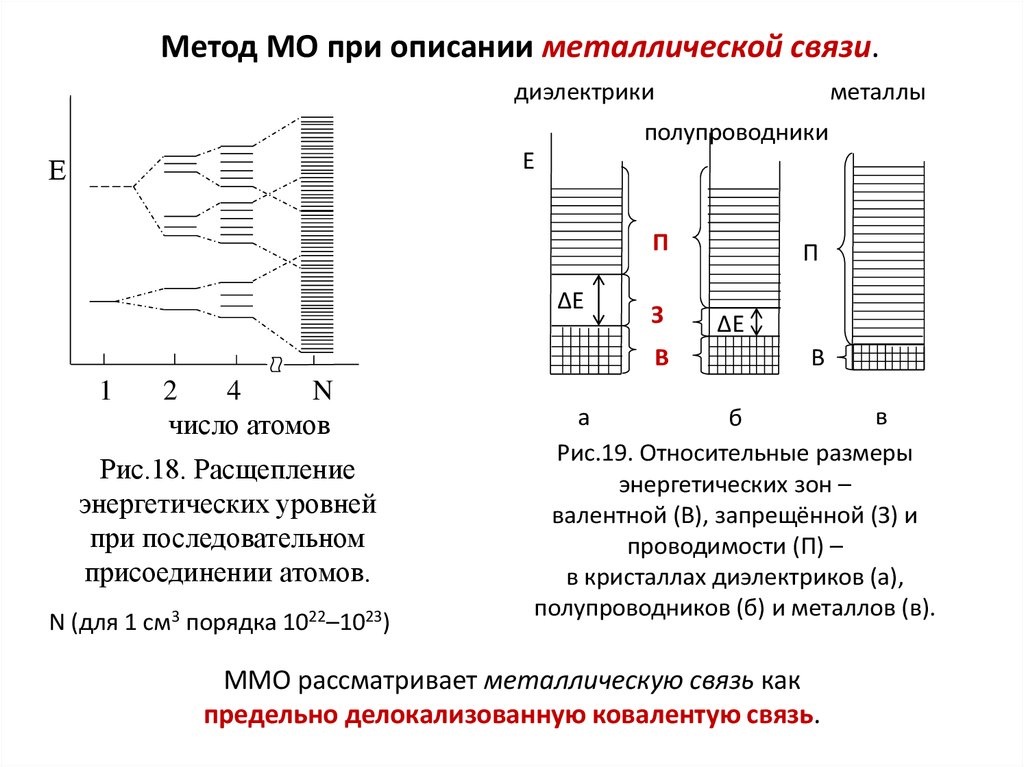
Метод МО при описании металлической связи.диэлектрики
металлы
полупроводники
Е
Е
П
ΔΕ
З
В
1
2
4
N
число атомов
Рис.18. Расщепление
энергетических уровней
при последовательном
присоединении атомов.
N (для 1 см3 порядка 1022–1023)
П
ΔΕ
В
в
а
б
Рис.19. Относительные размеры
энергетических зон –
валентной (В), запрещённой (З) и
проводимости (П) –
в кристаллах диэлектриков (а),
полупроводников (б) и металлов (в).
ММО рассматривает металлическую связь как
предельно делокализованную ковалентую связь.
30.
Длина связи600-1000
I.
II.
(одинарная)
150-600
а) полярная
100-400
б) неполярная
ІІІ. Комплексообразование
150-400
а) сильное
< 40
б) слабое
5-25 до 40
ІV.
V.
0-15
а) ориентационное
0-2
б) индукционное
0-20 до 60
в) дисперсионное
Прочность связи, кДж/моль
Характеристика различных типов связи
31.
Межмолекулярное взаимодействие.Ван-дер-Ваальс, 1873г.
+
(а) ориентационное
─
а)
+ ─
(б) индукционное
±
б)
+ ─
+ ─
μ=0
+ ─
μинд≠0
(в) дисперсионное
в)
±
±
+─ +─
32.
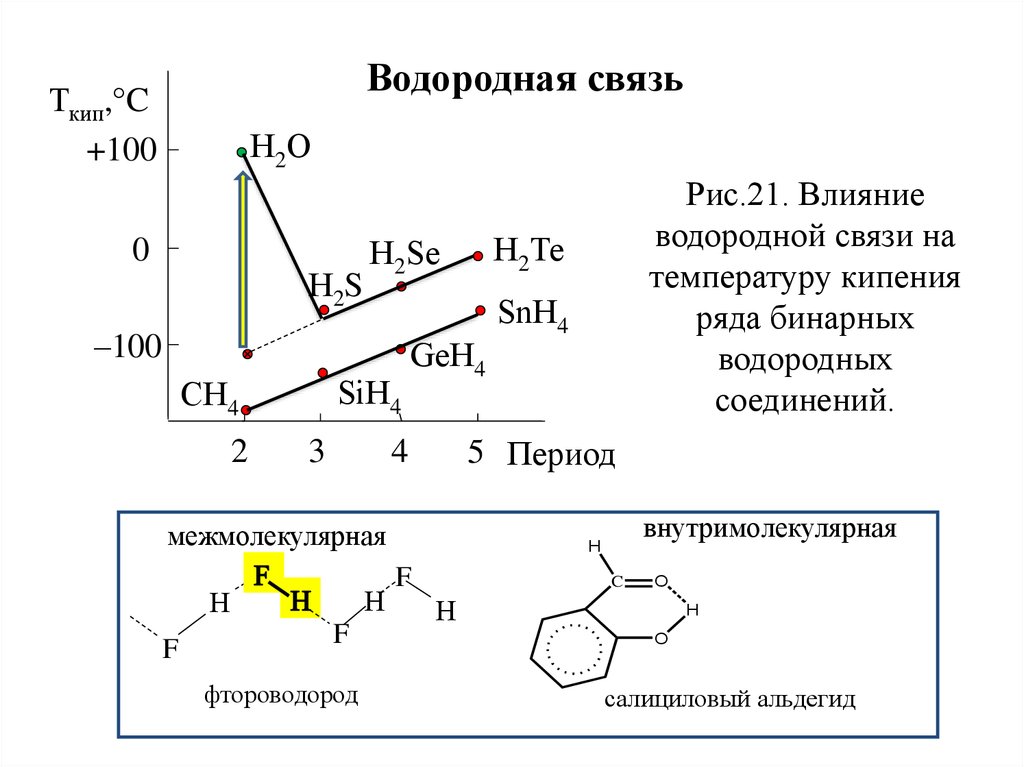
Водородная связьТкип,°C
+100
Н2О
0
Н2S
SiН4
СН4
2
3
GеН4
межмолекулярная
Н
F
F
фтороводород
SnН4
5 Период
4
Н
Н2Те
Н2Sе
–100
Рис.21. Влияние
водородной связи на
температуру кипения
ряда бинарных
водородных
соединений.
внутримолекулярная
H
F
C
O
Н
H
O
салициловый альдегид
33.
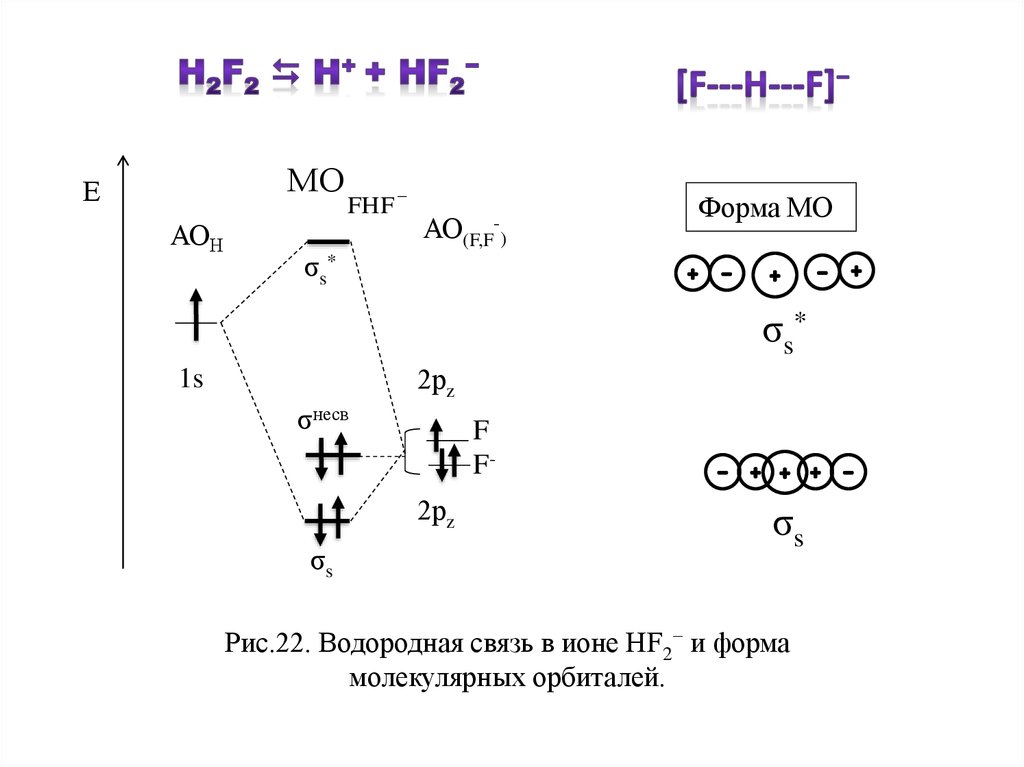
МОЕ
АОН
FHF
_
АО(F,F-)
Форма МО
σs*
σ s*
2рz
1s
σнесв
F
F2рz
σs
σs
Рис.22. Водородная связь в ионе НF2− и форма
молекулярных орбиталей.
34.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯВсе хим. в-ва подразделяют на простые и сложные.
Сложные в-ва: первого порядка NH3, H2O, KCN, Fe(CN)2
В-ва, у к-рых элементы проявляют “дополнительные”
валентности, – комплексные.
4KCN + Fe(CN)2 = 4KCN*Fe(CN)2 = K4[Fe(CN)6]
“Дополнительные” химические связи в К.С. имеют
ковалентный характер и образуются по донорноакцепторному механизму.
Первые комплексные соединения были синтезированы в
середине 19 века. Первая теория строения К.С. –
координационная теория (А. Вернер, 1893 г).


















 Химия
Химия








