Похожие презентации:
Гидролиз солей
1. Гидролиз солей
Если в растворе соль и вода,Всегда ли там нейтральная
среда?
2. Гидролиз солей
- процесс взаимодействияионов некоторых солей с
водой.
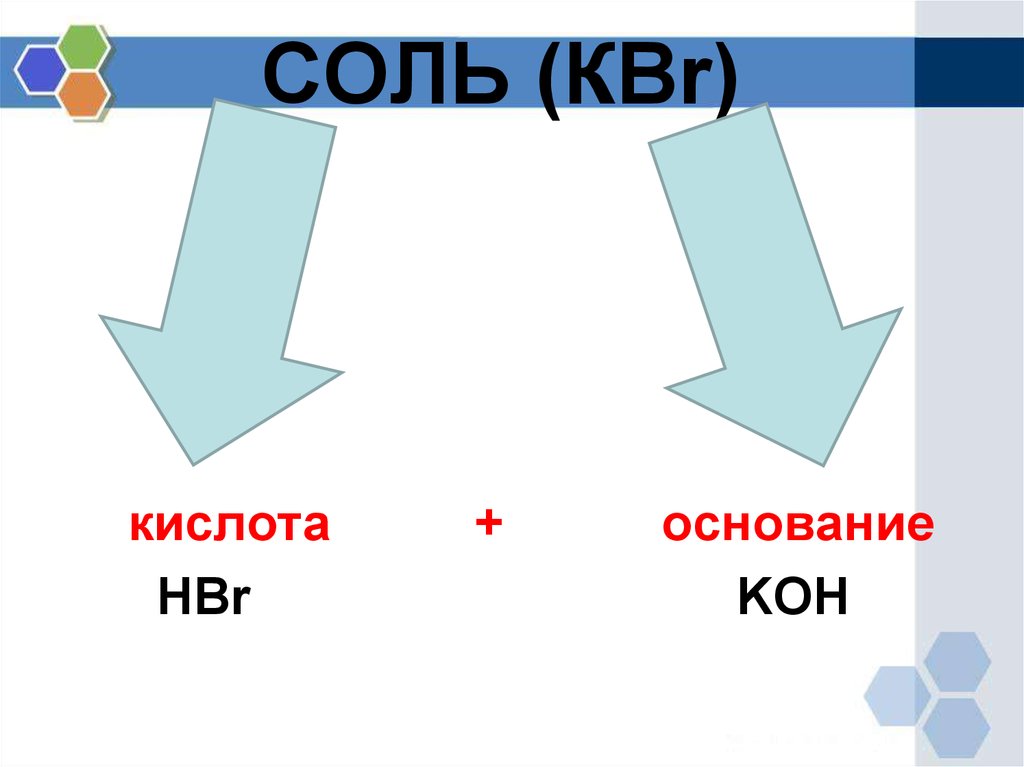
3. СОЛЬ (КBr)
кислотаHBr
+
основание
KOH
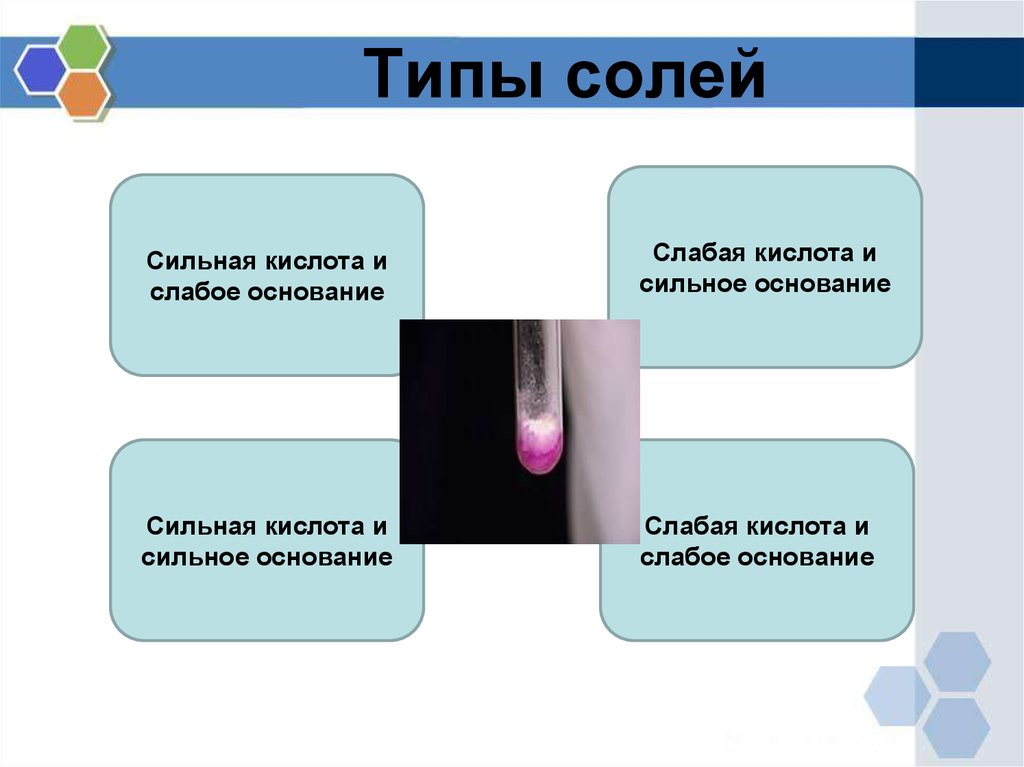
4. Типы солей
Сильная кислота ислабое основание
Слабая кислота и
сильное основание
Сильная кислота и
сильное основание
Слабая кислота и
слабое основание
5. Алгоритм составления ионного и молекулярного уравнения гидролиза соли
1. Составляем уравнение электролитической диссоциации соли.2. Определяем силу основания и кислоты, образующих соль.
3. Выбираем ион слабого электролита.
4. Составляем уравнение гидролиза выбранного иона
5. Определяем характер среды (рН < 7 или рН > 7)
6. По ионному уравнению составляем молекулярное.
6. З А П О М Н И Т Е
ЗАПОМНИТЕГИДРОЛИЗ – ОБРАТИМЫЙ ПРОЦЕСС
7. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону)
AlCl3 Al3++3ClAl3++ 3CL- + -HO-H+AlOH2++H+ + 3CLAlCl3 + H2O
AlOHCl2 + HCl
(раствор имеет кислую среду, реакция
протекает обратимо,
гидролиз по второй ступени протекает в
ничтожной степени)
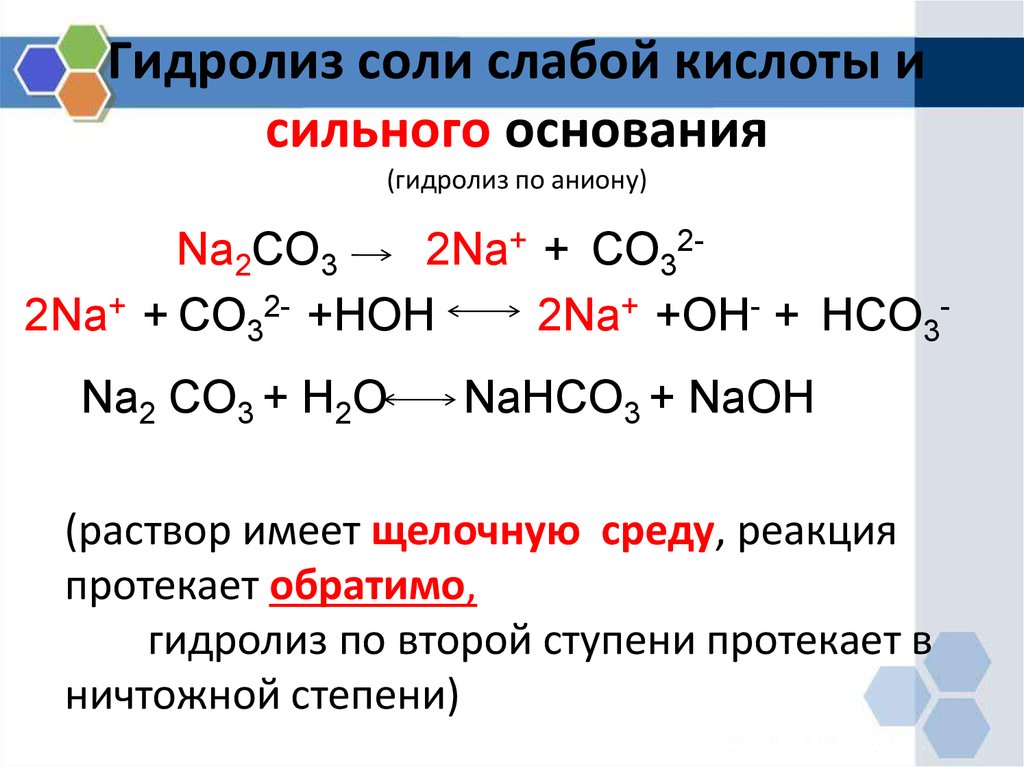
8. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону)
Na2CO32Na+ + CO322Na+ + CO32- +HOH
2Na+ +OH- + HCO3Na2 CO3 + H2O
NaHCO3 + NaOH
(раствор имеет щелочную среду, реакция
протекает обратимо,
гидролиз по второй ступени протекает в
ничтожной степени)
9. запомните
Гидролиз протекает по «слабому»;Среда определяется «сильным»
10. Гидролиз соли сильной кислоты и сильного основания (гидролиз по аниону и катиону)
NaCLNa+ + CLNa+ + CL- +HOH
Na+ +OH- + CL- + H(раствор имеет нейтральную среду, реакция
протекает обратимо, гидролиз не протекает)
11. Сделайте выводы:
Какие соли могут подвергатьсягидролизу?
Почему они подвергаются гидролизу?
Как определить реакцию среды соли?
12. Запомните
Соли, образованные сильнойкислотой и сильным основанием
гидролизу не подвергаются
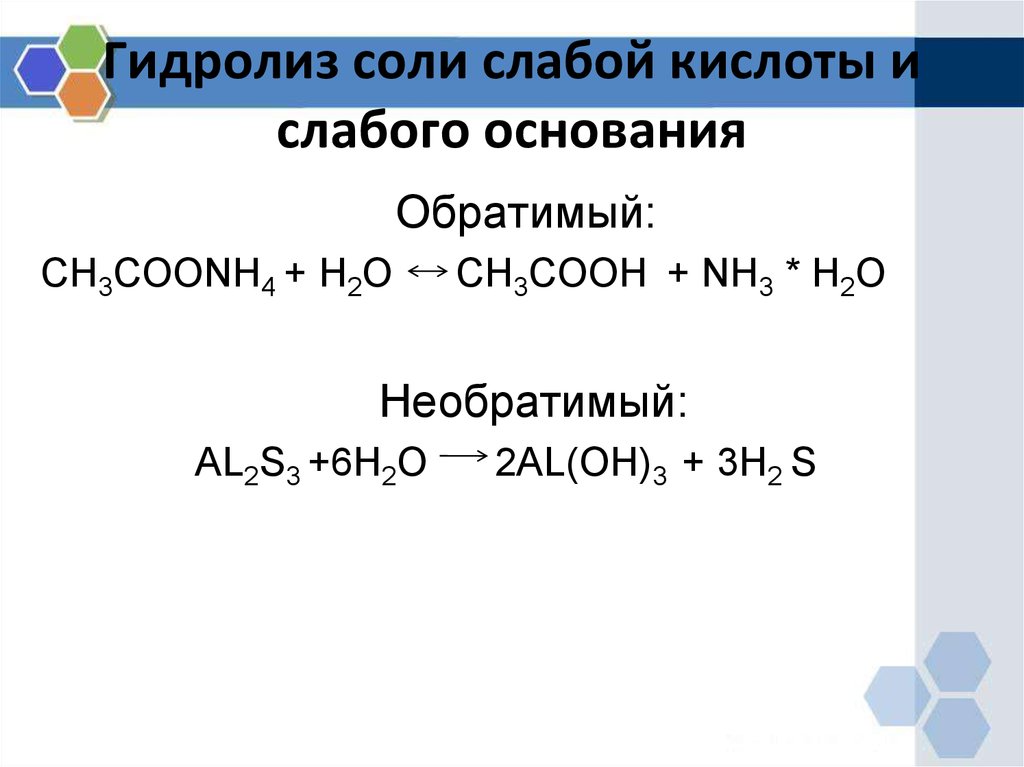
13. Гидролиз соли слабой кислоты и слабого основания
Обратимый:CH3COONH4 + H2O
CH3COOH + NH3 * H2O
Необратимый:
AL2S3 +6H2O
2AL(OH)3 + 3H2 S









 Химия
Химия