Похожие презентации:
ТИР применительно к кислотно-основным взаимодействиям
1. ТИР применительно к кислотно-основным взаимодействиям
Автопротолиз. Шкала рН растворов электролитовПонятие нейтральной, кислой и щелочной среды в растворах
электролитов
2. Растворы могут быть водными и неводными.
• (H2O + K2SO4): водный раствор K2SO4 или раствор K2SO4 в воде.• (C2H5OH + ФФ): спиртовый раствор фенолфталеина или раствор
ФФ в этаноле.
• (CHCl3 + Dit): хлороформный раствор дитизона или раствор
дитизона в хлороформе.
• (H2SO4 конц. + ДФА): сернокислый раствор дифениламина или
раствор ДФА в серной кислоте.
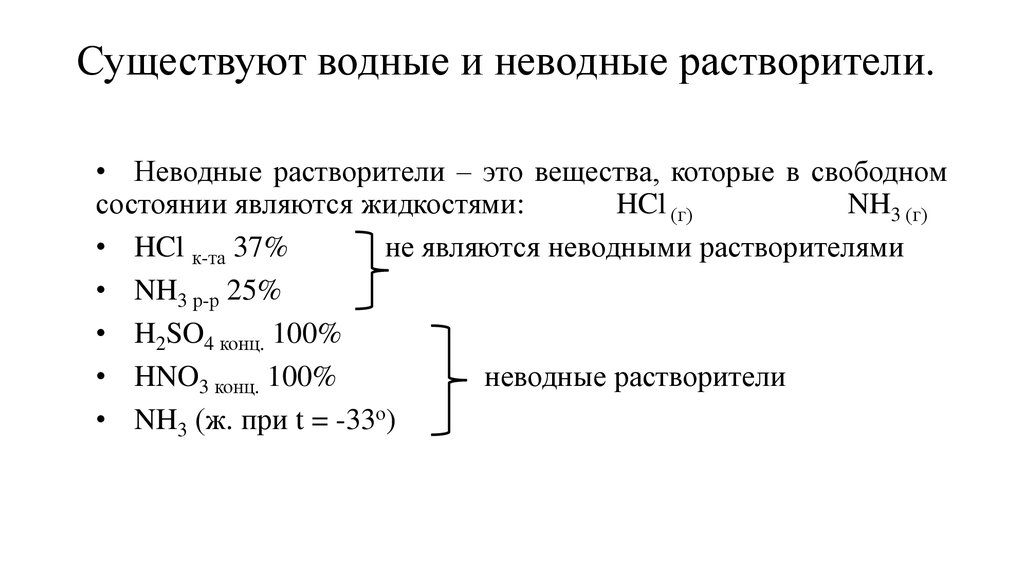
3. Существуют водные и неводные растворители.
• Неводные растворители – это вещества, которые в свободномсостоянии являются жидкостями:
HCl (г)
NH3 (г)
• HCl к-та 37%
не являются неводными растворителями
• NH3 р-р 25%
• H2SO4 конц. 100%
• HNO3 конц. 100%
неводные растворители
• NH3 (ж. при t = -33о)
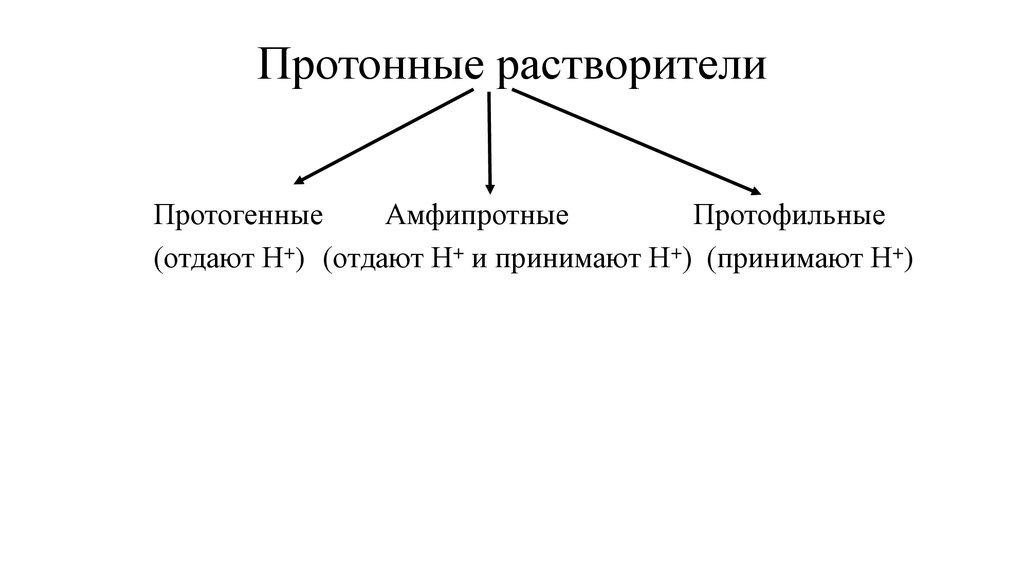
4. Все растворители делятся на протонные и апротонные.
• Протонные растворители взаимодействуют с протономН+, отдают или принимают его.
• Апротонные растворители не взаимодействуют с Н+
(CCl4, CHCl3, C6H6).
5. Протонные растворители
ПротогенныеАмфипротные
Протофильные
(отдают Н+) (отдают Н+ и принимают Н+) (принимают Н+)
6. Автопротолиз
Автопротолиз – это саморазложение (самораспадили самодиссоциация) растворителя, в результате
которого Н+ переходит от одной молекулы
растворителя к другой, с образованием 2-х
ионизированных частиц общим названием лиат-ион
(–) и лионий-ион (+).
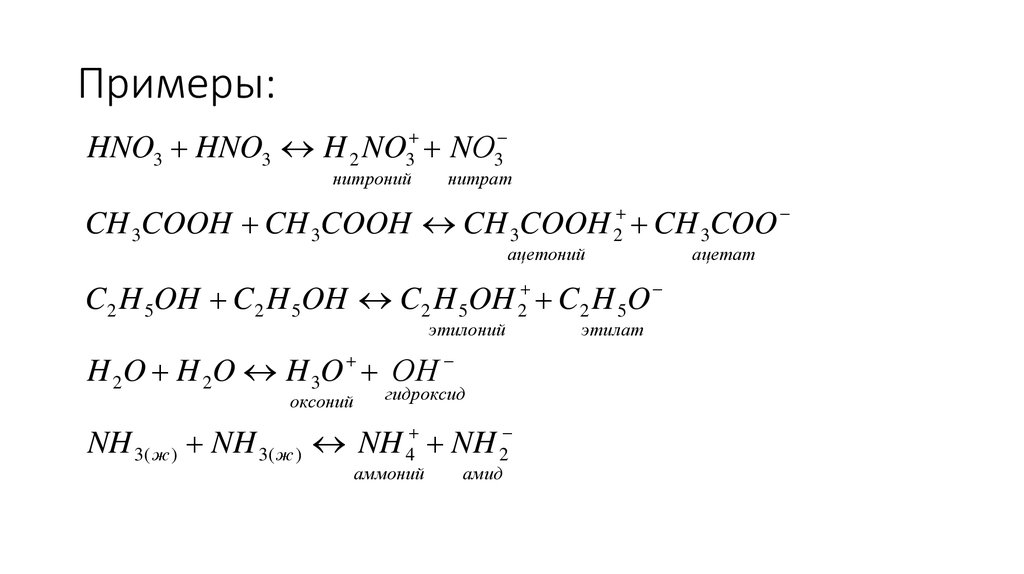
7. Примеры:
23
нитроний
3
нитрат
HNO3 HNO3 H NO NО
CH 3COOH CH 3COOH CH 3COOH 2 CH 3COO
ацетоний
C2 H 5OH C2 H 5OH C2 H 5OH 2 C2 H 5O
этилоний
H 2O H 2O H 3O ОН
оксоний
гидроксид
4
аммоний
2
амид
NH 3( ж ) NH 3( ж ) NH NH
этилат
ацетат
8.
Общее равновесие:K
[S ] [H 2 S ]
2
[HS] const
HS
растворитель
HS H 2S S
2
K [HS] [S ] [H 2 S ]
const const
const
Кавт. = [S–] ∙ [H2S+], но т.к. [H2S+] = [H+],
поэтому Kавт. = [S–] ∙ [H+]
После логарифмирования с обратным знаком получаем:
lg K авт.
lg [S ]
lg [H ]
р
р
р
рКавт. = рS + рН
9. Правило. В любых растворах любых электролитов при данной температуре произведение концентраций лиат- и лионий-ионов, а также
Правило.В любых растворах любых электролитов при данной
температуре произведение концентраций лиат- и лионийионов, а также сумма их показателей – есть величины
постоянные и равные соответственно Кавт. и рКавт., численное
значение которых зависит от природы растворителя.
Растворитель
1. HNO3 конц.
2. H2SO4 конц.
3. HCOOH конц.
4. CH3COOH конц.
5. H2O
6. C2H5OH (100%)
7. NH3 (ж) t = -33оС
Кавт
10–2,6
10–3,8
10–6
10–13,4
10–14
10–19
10–22
рКавт
2,6
3,8
6
13,4
14 КW=10–14=[OH–]∙[H+]
19
22
10. рН = рКавт – рS; рS = рКавт – рН
Чем больше константа автопротолиза, или чем меньше рКавт, тем вбольшей степени растворитель обладает протогенными
свойствами, т.е. проявляет в большей степени кислотную функцию.
Численные значения [H+], [S–], рН, pS рассчитывают:
рН = рКавт – рS;
рS = рКавт – рН
Они могут принимать значения:
[H+], [S–]: ≠ 0; = 1; < 1; > 1.
рН, рS: 0; < 0; > 0.
К авт.
[H ]
;
[S ]
К авт.
[S ]
[H ]
11. Понятие нейтральности среды
рКавт1 / 2 рКавт
Среда нейтральная: [H ] [S ] К
10
авт 10
Среда кислая:
[H ] [S ] К авт 10 рКавт 10 1 / 2 рКавт
Среда щелочная:
1 / 2 рК авт
[H ] [S ] 10
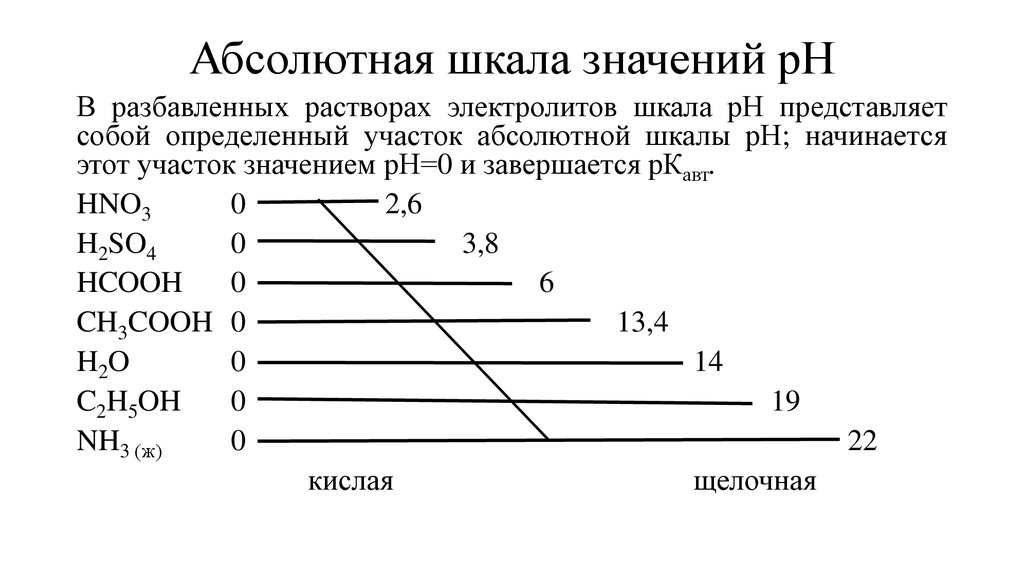
12. Абсолютная шкала значений рН
Абсолютная шкала значений рНВ разбавленных растворах электролитов шкала рН представляет
собой определенный участок абсолютной шкалы рН; начинается
этот участок значением рН=0 и завершается рКавт.
HNO3
0
2,6
H2SO4
0
3,8
HCOOH
0
6
CH3COOH 0
13,4
H2O
0
14
C2H5OH
0
19
NH3 (ж)
0
22
кислая
щелочная
13. Понятие нейтральной, кислой и щелочной среды зависит от природы растворителя. Одно и то же значение рН в разных растворителях
может означать нейтральную, или кислую, илищелочную среду.
Примеры: рН (А) в H2SO4 конц. = 3
щелочная среда
рН (А) в HCOOH конц. = 3 нейтральная среда
рН (А) в NH3 (ж) = 3
кислая среда
При изменении природы растворителя меняются и такие характеристики
электролитов как Кдисс., К SO , Кнест.
К а ( CH 3COOH ), H 2O 1,8 10 5
К SO CaSO4 , H 2O 10 5
К а ( CH 3COOH ),C2 H 5OH 10 10
К SO CaSO4 ,C2 H 5OH 10 10
14. Шкала рН водных растворов электролитов
01 2
сильно
кислая
3
4
5
слабо
кислая
6
7
8
9
10 11 12 13 14
нейтральная слабо
сильно
щелочная щелочная
15. Расчет рН в чистых водных растворах кислот
1. Однопротонные HCl, HNO3, HI, HBrHCl → H+ + Cl– Кк не существует, Кт = 1
а) Сисх: 10–7 – 10–3 моль/л; I = 0; f(H+) = 1; C(H+) = a(H+)
рН = -lg C(H+) = -lg Cкислоты
Пример:
СHCl = 10–5
рН = 10–5 = 5
16. Расчет рН в чистых водных растворах кислот
б) Сисх < 10–7 моль/лI = 0, f(H+) = 1; C(H+) = a(H+)
CHCl = 10–9
рН ≈ 7
в) Сисх > 10–3 моль/л;
I > 0, f(H+) < 1, C(H+) > a(H+)
рН = -lg a(H+) = -lg f(H+) ∙ Cисх.
Сисх = 10–2 моль/л
рН = -lg 10–2 ∙ f(H+) ≈ 2,05
Отн. погрешность 2,5%, если округлить до 2.
Сисх = 10–1
рН = 1,1.
Отн. погрешность 10%, если округлить до 1.
17. Расчет рН в чистых водных растворах кислот
2. Двухпротонные и многопротонные: H2SO4; H4[Fe(CN)6]Расчет рН производят так же, как и в 1, т.к. сильные двух- и
многопротонные кислоты являются сильными только по 1-й
ступени; поэтому наибольший вклад в общую концентрацию Н+
вносит концентрация Н+, соответствующая 1-й ступени
диссоциации.
18. Расчет рН в чистых водных растворах кислот
3. Кислоты слабые.1. Однопротонные HF, HCN, HNO2 и др.
HF ↔ H+ + F–
Кк; Кт < 1.
[H+] < Cисх.
[H+] = α ∙ Cисх., но α = f (Cисх.), т.е. для каждого конкретного случая
необходимо знать значение α, соответствующее исходной
концентрации.
19. Расчет рН в чистых водных растворах кислот
Ка;
С исх
К
[H ]
[H ] 2 K (C [H ])
[HF]ост.
2
Если К 1, C K
рН lg[ H ] lg
обр.
2
[H ]обр
.
С исх.
[H ]
обр.
[H ] 2 K[H ] KC 0
K
K 2
[H ] ( ) K C
2
обр.
[F ]
универсальная формула расчета
[H ] K C
K C
упрощенная формула
20. Расчет рН в чистых водных растворах кислот
Двух- и многопротонные кислоты H2S, H2CO3, H3PO4 и др.Формулы расчета [H+] и рН аналогичны однопротонным кислотам,
но учитывается только К1.
Например:
[H ]
H2S K1 C
21. Расчет рН в чистых водных растворах оснований
Основания: [OH–] рассчитывают по тем же формулам, что и длякислот, только заменяя [H+] на [OH–]. После расчета [OH–]
вычисляют рОН, а затем рН по формуле:
рН = 14 – рОН
22. Расчет рН в водных растворах, содержащих смеси кислот или оснований
Расчет рН проводят по суммарной концентрации Н+ или ОН–-ионов,которые образуются при диссоциации всех кислот или оснований –
сильных и слабых, содержащихся
в
растворе.
n
n
рН lg [ H ]
или
рН lg a ( H )
Для кислот:
i 1
Для оснований:
n
i 1
рОН lg [OH ]
i 1
n
или
рОН lg a[OH ]
i 1
Наибольший вклад в суммарную концентрацию или активность Н+
или ОН–-ионов вносят сильные или более сильные среди слабых
кислоты или основания.
23.
Расчетные формулы [H+] для смесей кислот:1. Смесь сильных кислот: [H+] = С1+С2+…+Сn
2. Смесь сильной и слабой кислоты: [H+] = Ссильной к-ты
3. Смесь слабых кислот разной силы:[H+] = √Ка.С для более сильной
кислоты (константы различаются более чем на порядок)
4. Смесь слабых кислот примерно равной силы (порядок констант
одинаковый):
[H+] = √К1а.С1+ К2а.С2
(индексы 1 и 2 относятся к первой и второй кислоте соответственно)
Формулы для смесей оснований аналогичны с заменой [H+] на [ОH-] и Ка на Кb
24.
25. Понятие активной и общей кислотности и щелочности
Активная кислотность или щелочность – это концентрация Н+ илиОН– в данном растворе, которые рассчитывают по предварительно
установленному значению рН. Экспериментальное определение рН
проводят путем измерения его колориметрически или
потенциометрически.
Общая кислотность или щелочность – это концентрация кислоты
или смеси кислот, основания или смеси оснований в данном
растворе. Эта концентрация может быть рассчитана по
универсальной или упрощенным формулам расчета для
концентраций Н+ или ОН–. Эти расчеты дают грубую оценку. Более
точную оценку можно получить в результате титрования с
визуальной или инструментальной индикацией.
26. рН в растворах кислот или оснований в присутствии одноименных и посторонних ионов
Посторонние и одноименные ионы входят в состав солей, которыене вступают в химическую реакцию с кислотой или основанием.
Эти соли не подвергаются или подвергаются гидролизу.
1. Сильная кислота (сильное основание) + соль (не гидролизуется,
содержит одноименные или посторонние ионы).
Примеры:
HCl + NaCl
NaOH + NaCl
HCl + KNO3
NaOH + KNO3
рН рассчитывают, учитывая присутствие в растворе только сильной
кислоты или основания.
27. рН в растворах кислот или оснований в присутствии одноименных и посторонних ионов
2. Сильная кислота (сильное основание) + соль (гидролизуется,содержит одноименные или посторонние ионы).
Примеры:
HCl + FeCl3
NaOH + CH3COONa
HCl + FeSO4
NaOH + HCOOK
Гидролиз солей в присутствии сильных кислот или сильных
оснований протекает незначительно или подавляется, поэтому рН
рассчитывают, учитывая присутствие в растворе только сильной
кислоты или сильного основания, если их концентрация больше
чем 10–7 моль/л.
28. рН в растворах кислот или оснований в присутствии одноименных и посторонних ионов
3. Слабая кислота (слабое основание) + соль (не гидролизуется,содержит посторонние ионы).
Примеры:
CH3COOH + KCl
NH4OH + KNO3
рН рассчитывают, учитывая присутствие в растворе только слабой
кислоты или слабого основания.
29. рН в растворах кислот или оснований в присутствии одноименных и посторонних ионов
4. Слабая кислота (слабое основание) + соль (гидролизуется,содержит одноименные ионы).
Примеры:
CH3COOH + CH3COONa
NH4OH + NH4Cl
рН рассчитывают, учитывая наличие в растворе:
и слабой кислоты, и соли
и слабого основания, и соли.
30. рН в растворах кислот или оснований в присутствии одноименных и посторонних ионов
Слабая кислота и слабое основание диссоциируют на ионынезначительно, т.е. в растворе имеется подвижное равновесие
между молекулами кислоты или основания и их ионами. Соли как
сильные электролиты диссоциируют полностью и увеличивают
концентрацию одноименных ионов, а потому смещают равновесие
в сторону молекул слабой кислоты или слабого основания. При
этом
уменьшается
концентрация
Н+-ионов
кислоты
и
увеличивается значение рН в её растворе.
При этом уменьшается концентрация ОН–-ионов основания и
уменьшается значение рН в его растворе.
31. рН в растворах кислот или оснований в присутствии одноименных и посторонних ионов
Примеры:CH3COOH ↔ CH3COO– + H+ уменьшается
CH3COONa → CH3COO– + Na+
NH4OH ↔ NH4+ + OH– уменьшается
NH4Cl → NH4+ + Cl–
Изменение значения рН в растворе слабой кислоты или слабого
основания в присутствии одноименных ионов называется
буферным эффектом.
рН в растворе слабой кислоты при этом увеличивается, а в растворе
слабого основания – уменьшается.
32. Задача. Имеется два раствора кислот с известными значениями рН и одинаковыми молярными концентрациями: HCl (pH = 1) и
неизвестнаякислота НА (рН = 3).
Определить рН раствора, полученного при сливании равных объемов
этих двух растворов.
Решение: Поскольку HCl – сильная кислота, Co(HCl) = [H+] = 0,1 моль/л.
По условию задачи концентрации HCl и HA одинаковы, поэтому Co(HA)
= 0,1 моль/л.
Для 0,1 М раствора НА известен рН = 3, т.е. [H+] = 10-3 моль/л. При
таком значении [H+] можно не учитывать диссоциацию воды и принять
[A-]=[H+]. Вычислив степень диссоциации α = [H+]/Cо(HA) = 10-2, можно
сделать вывод, что НА – слабая кислота, а для слабых кислот можно
использовать приближение [HA] = Co(HA). Далее можно вычислить
значение: Kа(HA)=[H+][A-]/[HA]=10-3.10-3/10-1=10-5
33.
При смешивании равных объемов растворов двух кислот HCl и НАс одинаковыми концентрациями (Co = 0,1 моль/л) происходит
увеличение в 2 раза объема конечного раствора и, следовательно,
уменьшение в 2 раза начальных концентраций, которые станут
Co(HCl) = Co(HA) = 0,05 моль/л. Поскольку смешиваются сильная
(HCl) и слабая (НА) кислоты, то диссоциация НА подавляется
сильной кислотой, и рН раствора определяется только сильной
кислотой, т.е. [H+] = Co(HCl) = 0,05 моль/л и рН = 1,3.
• Ответ: рН = 1,3.
34.
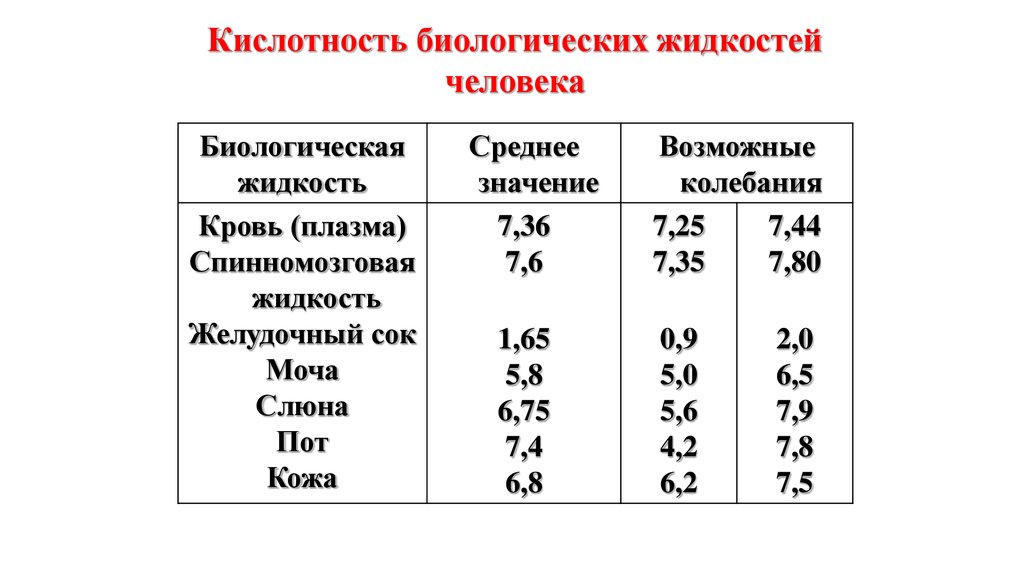
Кислотность биологических жидкостейчеловека
Биологическая
жидкость
Кровь (плазма)
Спинномозговая
жидкость
Желудочный сок
Моча
Слюна
Пот
Кожа
Среднее
значение
7,36
7,6
1,65
5,8
6,75
7,4
6,8
Возможные
колебания
7,25
7,44
7,35
7,80
0,9
5,0
5,6
4,2
6,2
2,0
6,5
7,9
7,8
7,5
35.
Для биологическихжидкостей характерен
кислотно-основной гомеостаз
(постоянство значений рН),
обусловленный действием
биологических буферных
систем.
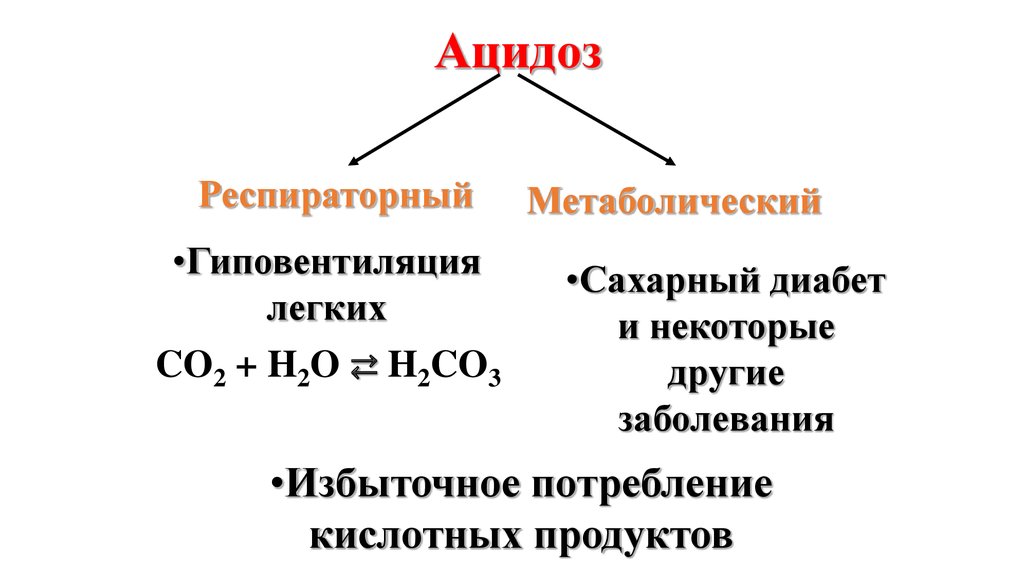
36.
Наиболее опасными видаминарушения кислотно-основного
равновесия в крови являются:
• ацидоз – увеличение
кислотности крови,
• алкалоз –увеличение
щелочности крови.
37.
АцидозРеспираторный
•Гиповентиляция
легких
CO2 + H2O ⇄ H2CO3
Метаболический
•Сахарный диабет
и некоторые
другие
заболевания
•Избыточное потребление
кислотных продуктов
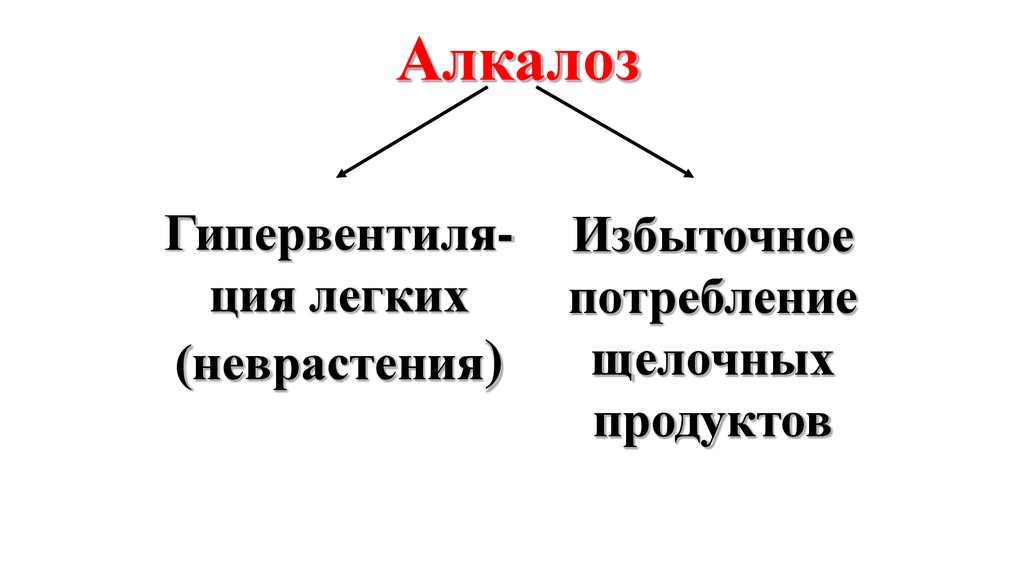
38.
АлкалозГипервентиляция легких
(неврастения)
Избыточное
потребление
щелочных
продуктов
39.
Опасность изменениярН связана
1) со снижением
активности ферментов и
гормонов, активных в
узком диапазоне рН;
40.
2) с изменениемосмотического давления
биологических
жидкостей;
3) с изменением скорости
биохимических реакций,
катализируемых
+
катионами Н .
41.
При изменении рНкрови на 0,3 единицы
может наступить
тяжелое коматозное
состояние, а 0,4
единицы смертельный исход.
42.
Коррекция ацидоза внутривенное введение 4%-ногораствора NaHCO3:
HCO3- + H+ ⇄ H2CO3
Антацидными (гипоцидными)
называются лекарственные
препараты, снижающие
кислотность биологических
жидкостей
43.
Коррекция алкалозавнутривенное введениерастворов аскорбиновой
кислоты (5% или 15%).
44.
Повышение кислотности в ротовойполости связано с приемом пищи
(особенно сладкой). При этом
происходит разрушение зубной эмали
(толщина которой всего 2 мм):
Сa5(PO4)3F(т) ⇄ 5 Са2+ + 3 РО43- + FВ норме равновесие смещено влево. При
избыточной кислотности концентрация Fуменьшается:
Н+ + F- ⇄ НF.
Равновесие смещается вправо.
45.
46. Основные положения теории кислот и оснований Бренстеда-Лоури
1. Кислоты (диспротиды) – вещества, способные отдавать Н+ ипревращаться в сопряженные основания.
2. Основания (эмпротиды) – вещества, способные принимать Н+ и
превращаться в сопряженные кислоты.
3. Кислоты и основания могут быть электронейтральными,
положительными и отрицательными.
4. Кислота и сопряженное основание или основание и сопряженная
кислота представляют собой кислотно-основную сопряженную
пару.
47. Основные положения теории кислот и оснований Бренстеда-Лоури
Примеры:• HCl ↔ H+ + Cl–
• H2CO3 ↔ H+ + HCO3–
• HCO3– ↔ H+ + CO32–
• H2O ↔ H+ + OH–
• H3O+ ↔ H+ + H2O
• [Zn(H2O)2]2+ ↔ H+ + [ZnOH∙H2O]+
• (ZnOH∙H2O)+ ↔ H+ + Zn(OH)2
• C5H5NH+ ↔ H+ + C5H5N
• пиридиний-ион
пиридин
В сопряженных парах заряд кислоты всегда на единицу больше заряда
основания или заряд основания всегда на единицу меньше заряда кислота.
• H2CO3 / CO32– несопряженная пара
48.
49.
5. Способность веществ быть кислотой или основанием являетсяне абсолютной, а функциональной, т.е. зависит от той среды, в
которой они находятся.
Пример:
HNO 3 NaOH NaNO3 H 2 O
к та
HNO 3 HClO 4 ClO
H
NO
4
2
3
осн е
H 2 NO3ClO 4
перхлорат нитрония
50.
6. Для протекания кислотно-основного взаимодействиянеобходимо иметь минимум две кислотно-основные
сопряженные пары.
к та 1 Н осн е 1
осн е 2 Н к та 2
к та 1 / осн е 1
к та 2 / осн е 2
к та 1 осн е 2 осн е 1 к та 2
При взаимодействии кислоты и основания образуются
новая кислота и новое основание.
51.
7. Диссоциация кислот и оснований протекает при непосредственномхимическом участии растворителя. Диссоциация кислот:
к та "0":
HCl H 2 O Cl H 3O
к та 1 осн е 2
осн е 1 к та 2
к та " ": HS H 2 O S 2 H 3O
к та " ": [ Zn HOH]2 H 2 O ZnOH H 3O
При диссоциации кислот растворитель (вода Н2О) выполняет функцию
основания. Диссоциация оснований:
осн е "0":
NaOH HOH OH [ Na H 2 O]
осн е 1
к та 2
осн е 2
к та 1
осн е " ": [ ZnOH ] HOH OH [ Zn H 2 O]2
осн е 1
осн е " ":
к та 2
осн е 2
к та 1
Cl HOH OH HCl
осн е 1 к та 2
осн е 2 к та 1
При диссоциации оснований растворитель (вода (Н2О) выполняет
функцию кислоты.
52.
8. Каждая кислота характеризуется константой кислотности Ка, а каждоеоснование характеризуется константой основности Кв.
Кислоты: Численные значения констант кислотности Ка нулевых “0” и
отрицательных “-“ кислот содержатся в справочнике.
Ка “0” кислоты – это единственная или первая ступенчатая константа
электронейтральной кислоты (кислоты Аррениуса).
Например:
К
5 10 4 (из справочника )
а , HNO2
Ка “-“ кислоты – это соответствующая ступенчатая константа
электронейтральной кислоты.
K
13
K
10
2, H 2S
a , HS
K
a , H 2 PO
4
K 2, H 3 PO4 10 7
K
a , HPO24
K 3, H 3 PO4 10 13
Константы кислотности положительных “+” кислот рассчитывают.
53.
Основания:Численные значения констант основности Кв нулевых “0” и
положительных “+” оснований содержатся в справочнике.
Кв “0” основания – это единственная или первая ступенчатая константа
электронейтрального основания (основания Аррениуса).
Кв “+” основания – это соответствующая ступенчатая константа
электронейтрального основания.
Например:
К в, NH 3 H 2 O 1,8 10 5 (из справочника )
К
в, ZnOH
K 2, Zn (OH) 2
Константы основности отрицательных “-“ оснований рассчитывают.
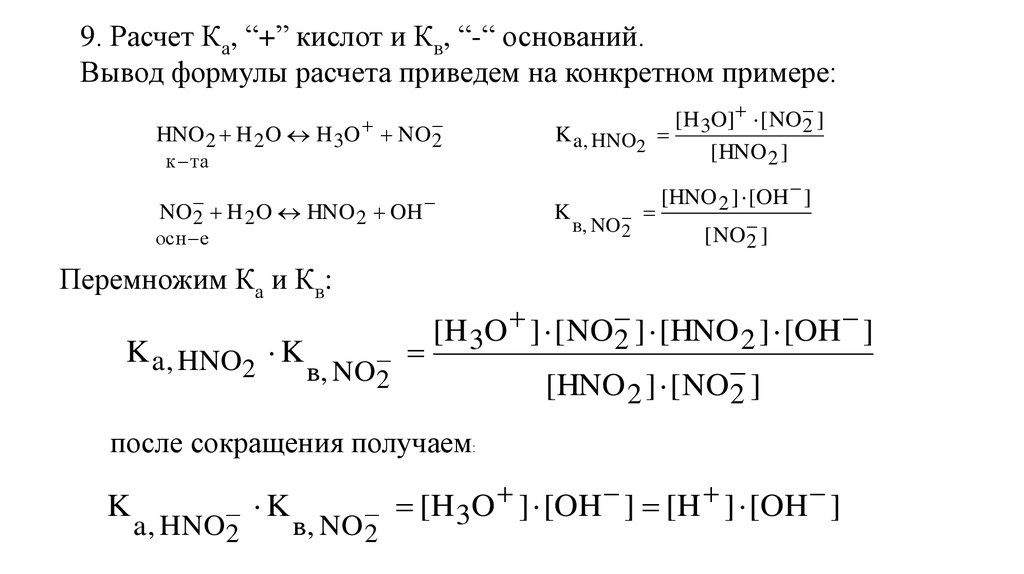
54.
9. Расчет Ка, “+” кислот и Кв, “-“ оснований.Вывод формулы расчета приведем на конкретном примере:
HNO 2 H 2 O H 3O NO
2
к та
NO
2 H 2 O HNO 2 OH
осн е
[H 3O] [ NO
2]
K a , HNO2
[HNO 2 ]
K
в, NO
2
[HNO 2 ] [OH ]
[ NO
2]
Перемножим Ка и Кв:
[H 3O ] [ NO 2 ] [HNO 2 ] [OH ]
K a , HNO2 K
в, NO 2
[HNO 2 ] [ NO
2]
после сокращения получаем:
K
K
[H 3O ] [OH ] [H ] [OH ]
a , HNO2
в, NO 2
55.
Для общего случая (т.е. в любых растворителях):К а, к ты К в, сопр. осн я [лионий ион] [лиат ион] К авт.
или
К а, к ты К в, сопр. осн я К авт.
Прологарифмируем с обратным знаком. Получаем
рК а, к ты рК в, сопр. осн я рК авт.
Если растворитель вода Н2О:
К а , к ты К в, сопр. осн я [H ] [OH ] K W
рК а, к ты рК в, сопр. осн я рК W
56.
Правило:В любых растворах любых кислот и оснований при данной
температуре произведение
К а, к ты К в, сопр. осн я
, а так же сумма их показателей – есть величины постоянные и
равные соответственно константе автопротолиза Кавт и показателю
константы автопротолиза (рКавт), численные значения которых
зависят от природы растворителя, в котором содержится кислотноосновная пара.
57.
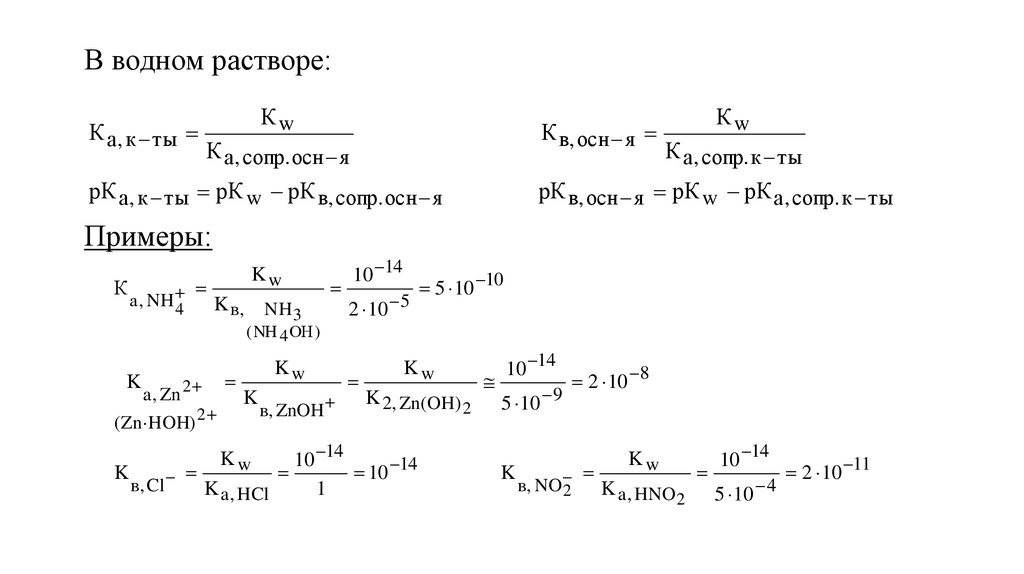
В водном растворе:К а , к ты
Кw
К в, осн я
К а , сопр. осн я
рК а , к ты рК w рК в, сопр. осн я
Кw
К а , сопр. к ты
рК в, осн я рК w рК а , сопр. к ты
Примеры:
К
а , NH
4
Kw
K в,
NH 3
10 14
2 10 5
5 10 10
( NH 4 ОН )
K
a , Zn 2
( Zn HOH) 2
Kw
K
в, ZnOH
Kw
K 2, Zn(OH) 2
10 14
K
10 14
в, Cl
K a , HCl
1
Kw
10 14
5 10 9
K
2 10 8
в, NO
2
Kw
K a , HNO2
10 14
5 10 4
2 10 11
58.
Амфолиты характеризуются и Ка и Кв.Пример:
1) HCO 3 амфолит
K
11
10
5
K
2, H 2 CO 3
a , HCO3
K
8
10
2
в, HCO3
K a , H 2 CO 3 K1, H 2 CO 3 5 10 7
Kw
Kw
10 14
2) [ ZnOH ] амфолит
K
7
10
9
,
4
K
2, Zn (OH) 2
в, ZnOH
K
10
10
7
,
7
a , ZnOH
K в, Zn (OH) 2 K1, Zn (OH) 2 1,3 10 5
Kw
Kw
10 14
59.
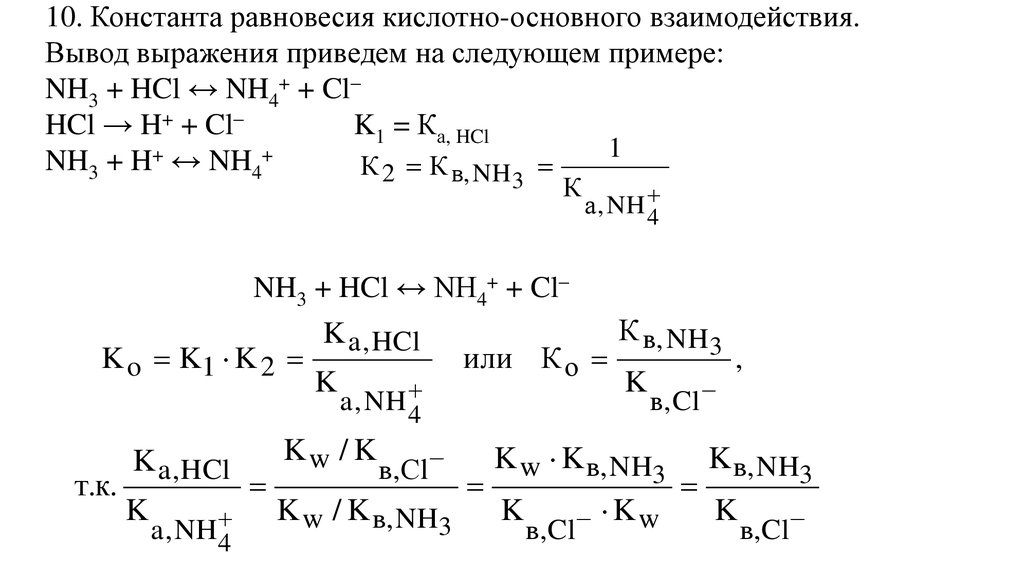
10. Константа равновесия кислотно-основного взаимодействия.Вывод выражения приведем на следующем примере:
NH3 + HCl ↔ NH4+ + Cl–
HCl → H+ + Cl–
K1 = Ка, HCl
1
NH3 + H+ ↔ NH4+
К 2 К в, NH
3
К
а , NH
4
NH3 + HCl ↔ NH4+ + Cl–
K o K1 K 2
т.к.
K a , HCl
K
a , NH
4
K a , HCl
K
a , NH
4
Kw / K
в,Сl
K w / K в, NH3
или К о
К в, NH 3
K
в, Cl
K w K в, NH3
K
в,Cl
Kw
,
K в, NH3
K
в,Cl
60.
К равновесия – есть отношение Ка вступившей в реакцию кислоты кКа образовавшейся кислоты или отношение Кв вступившего в реакцию
основания к Кв образовавшегося основания.
Кислоты и основания имеют общее название – протолиты.
К
К а (в) вступ. в р цию протолита
К а (в) образов. протолита
61.
Чтобы протекала кислотно-основная реакция необходимо, чтобыконстанта равновесия была бы больше единицы (К > 1), значит в
реакцию вступают более сильная кислота и более сильное
основание, а образуются более слабые кислота и основание.
Поэтому определить возможность протекания кислотно-основной
реакции можно по Ка кислотно-основных сопряженных пар, где Ка
кислотно-основной пары есть Ка кислоты в этой паре.
Пара с большим значением Ка содержит более сильную кислоту, а с
меньшим значением Ка – более сильное основание. Другие составные
части кислотно-основных пар являются продуктами взаимодействия.
62.
NaHCO 3 NaOH Na 2 CO3 H 2 Oк та 2
осн е 1
осн е 2
к та 1
или HCO 3 OH CO32 H 2 O
Эта реакция протекает при участии следующих пар :
HCO 3 / CO32
K a 5 10 11 (K 2, H 2 CO 3 )
H 2 O / OH
K a 1,8 10 16
Так как 5∙10–11>1,8∙10–16, поэтому HCO3– более сильная кислота, а OH– более сильное основание, которые реагируют друг с другом с
образованием CO32– и H2O, значит HCO3– и OH–-ионы несовместимы,
т.е. совместно присутствовать в растворе не могут – вступают в
химическую реакцию.
63.
А вот NaHCO3 и C6H5COONa (бензоат натрия), а также NH4Cl иC6H5COONa; NaHCO3 + NH4Cl могут совместно присутствовать в
растворе, т.к. в химическую реакцию не вступают. Докажем:
1) NaHCO 3 C 6 H 5 COONa Na 2 CO 3 C 6 H 5 COOH
или HCO 3 C 6 H 5 COO CO 32 C 6 H 5 COOH
к та 1
осн е 2
осн е 1
к та 2
HCO 3 / CO 32
K a 5 10 11
C 6 H 5 COOH / C 6 H 5 COO
K a 6 10 5
6∙10–5 > 5∙10–11, поэтому реагируют C6H5COOH и CO32–, а
HCO3– и C6H5COO– - продукты реакции. Значит реакция идет
справа налево.
64.
2) NH 4Cl C6 H 5COONa C6 H 5COOH NH 3 NaClили
4
NH C6 H 5COO C6 H 5COOH NH 3
NH 4 / NH 3
C6 H 5COOH / C6 H 5COO
K a 5 10 10
K a 6 10
5
6∙10–5 > 5∙10–10, поэтому реагируют C6H5COOH и NH3,
значит реакция идет справа налево.
65.
3) NaHCO3 + NH4Cl ↔ H2CO3 + NH3 + NaClили HCO3– + NH4+
↔ H2CO3 + NH3
Протон Н+ уходит от NH4+, а не от HCO3–, потому что NH4+ более
сильная кислота, чем HCO3–, т.к.
К
10 , a K
11
5
10
5
10
а , NH
a
,
HCO
3
4
В результате сравнения значений Ка кислотно-основных сопряженных
пар H2CO3 / HCO3–
Ка = 5∙10–7
NH4+ / NH3
Ka = 5∙10–10
приходим к выводу, что реакция может протекать между H2CO3 и NH3, но
не между NH4+ и HCO3–. Значит NH4Cl и NaHCO3 совместимы. Эти
вещества NaHCO3, C6H5COONa, NH4Cl входят в состав микстуры от кашля,
они химически друг с другом не взаимодействуют (это мы доказали
расчетами), а потому каждое из них не изменяет лечебного действия.























































 Химия
Химия








