Похожие презентации:
Растворы. Общая характеристика растворов
1.
Лекция № 5Растворы
1. Общая характеристика растворов.
2. Способы выражения концентрации растворов.
3. Коллигативные свойства растворов.
4. Основные положения теории электролитической диссоциации.
5. Количественные характеристики процесса диссоциации.
6. Степень электролитической диссоциации. Классификация
растворов по величине α.
7. Закон разбавления Оствальда.
8. Ионное произведение воды. Водородный и гидроксильный
показатель.
9. Гидролиз, сущность процесса.
10. Произведение растворимости.
1
2.
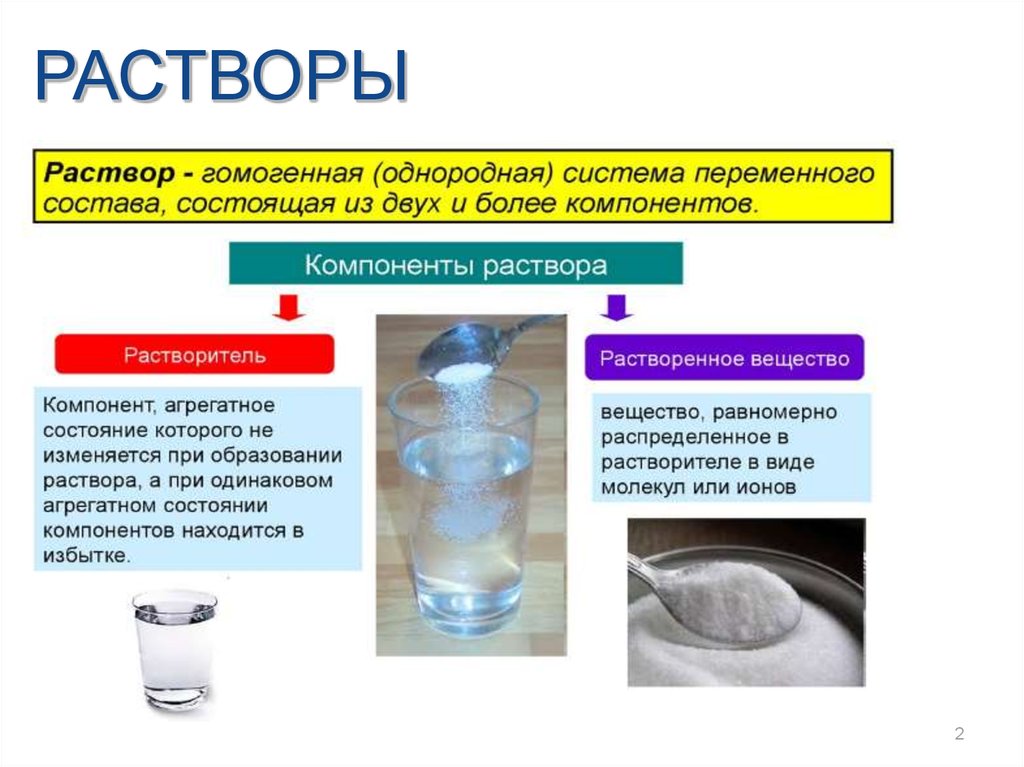
РАСТВОРЫ2
3.
КЛАССИФИКАЦИЯ1. По агрегатному состоянию
– жидкие, твердые и
газообразные
2. По размеру частиц – истинные, коллоидные
3. По количеству компонентов – бинарные, тройные...
4. По способности проводить электрический
ток – электролиты и неэлектролиты
АВ + nS ⇄ АВnS ⇄ А+ xS + В– (n – x)S,
где S – молекулы растворителя
АВ +nS ⇄ АВnS
3
4.
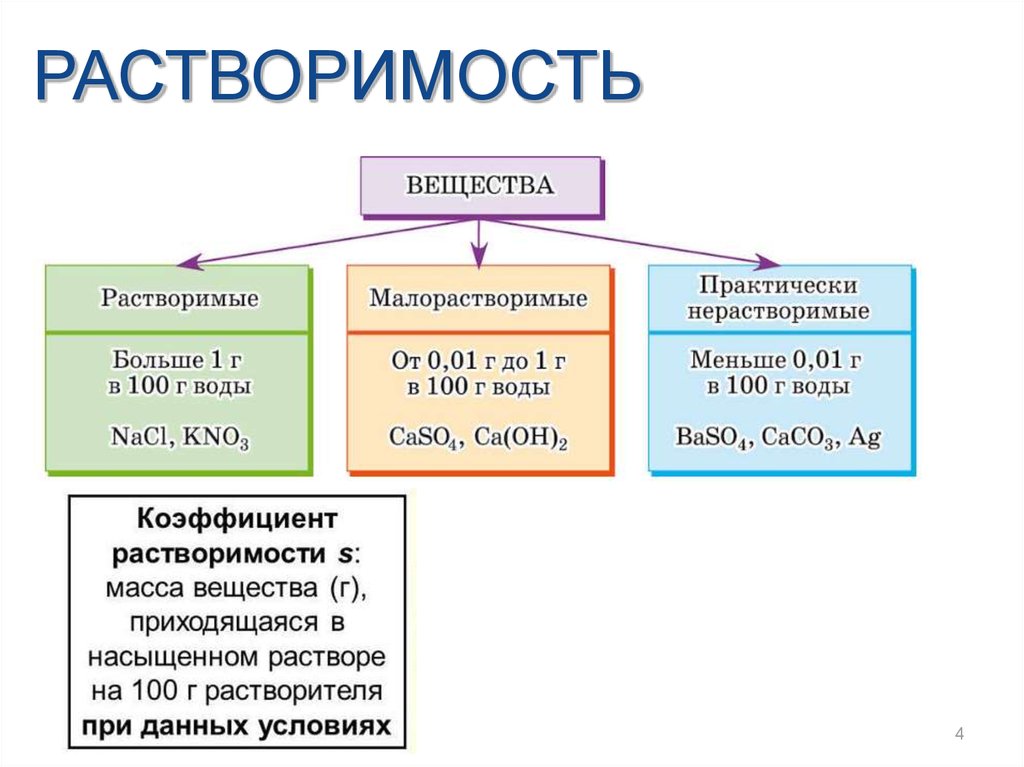
РАСТВОРИМОСТЬ4
5.
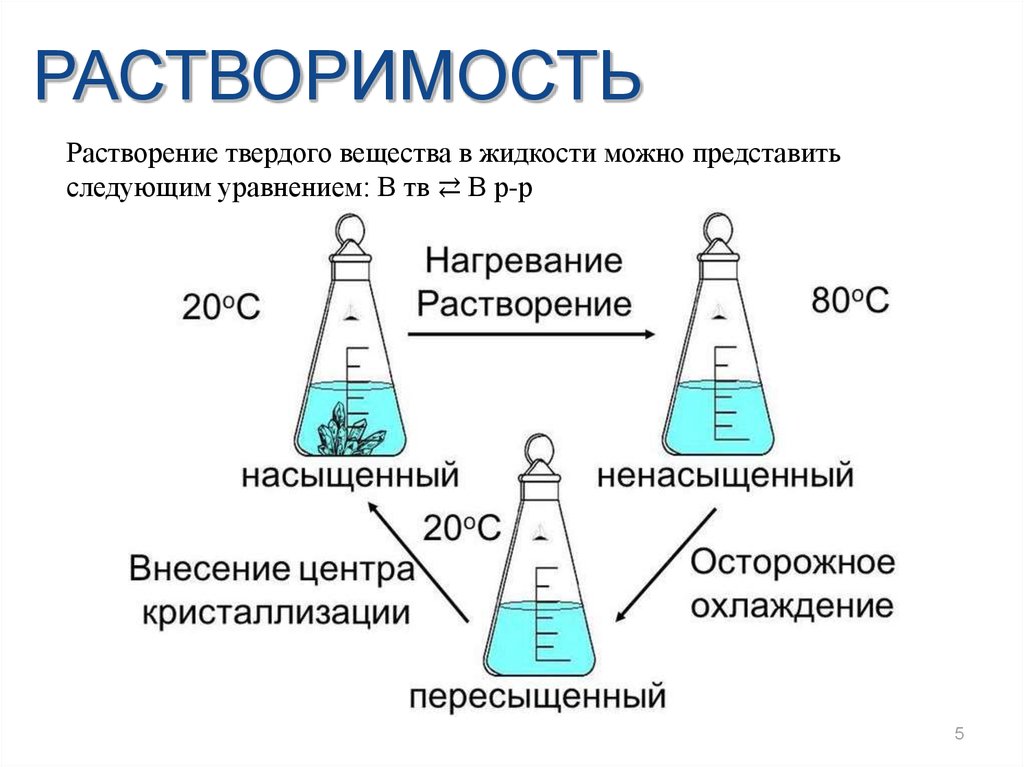
РАСТВОРИМОСТЬРастворение твердого вещества в жидкости можно представить
следующим уравнением: В тв ⇄ В р-р
5
6.
МЕХАНИЗМ РАСТВОРЕНИЯ• Если | ΔHреш | > | ΔHsolv |, то процесс растворения является
эндотермическим, и при повышении температуры
растворимость будет увеличиваться.
• Если | ΔHреш | < | ΔHsolv |, то процесс растворения является
экзотермическим, и при повышении температуры
растворимость будет уменьшаться.
6
7.
КОНЦЕНТРАЦИЯ РАСТВОРОВCC ,CAB
m n - порядок реакции
7
8.
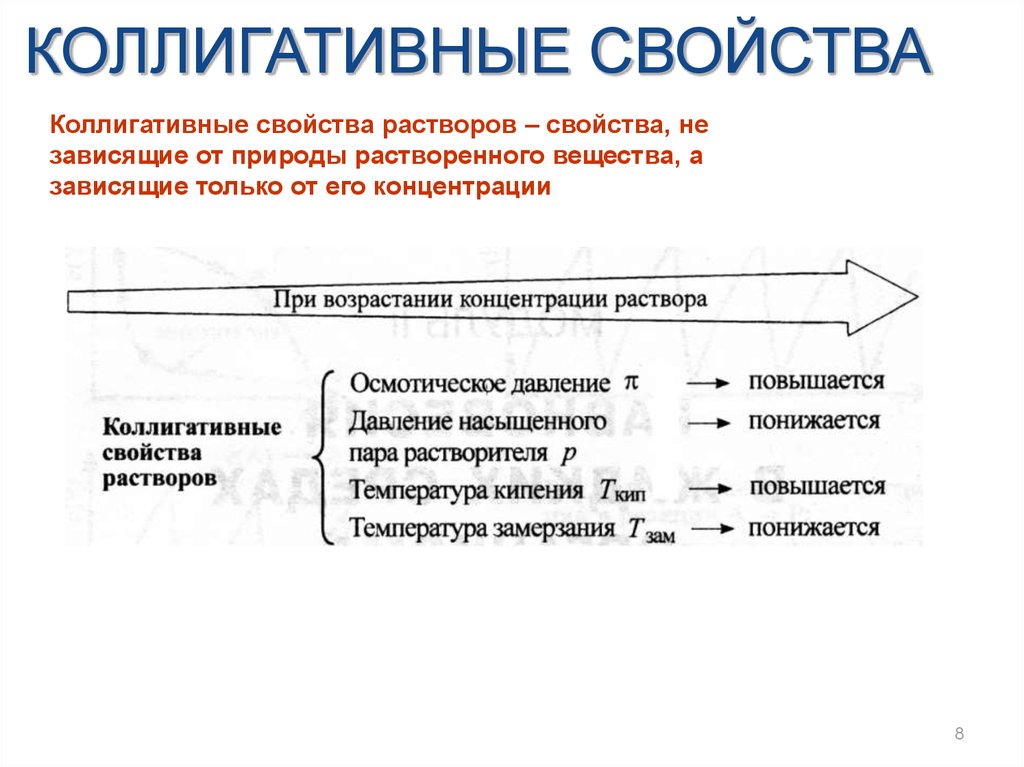
КОЛЛИГАТИВНЫЕ СВОЙСТВАКоллигативные свойства растворов – свойства, не
зависящие от природы растворенного вещества, а
зависящие только от его концентрации
8
9.
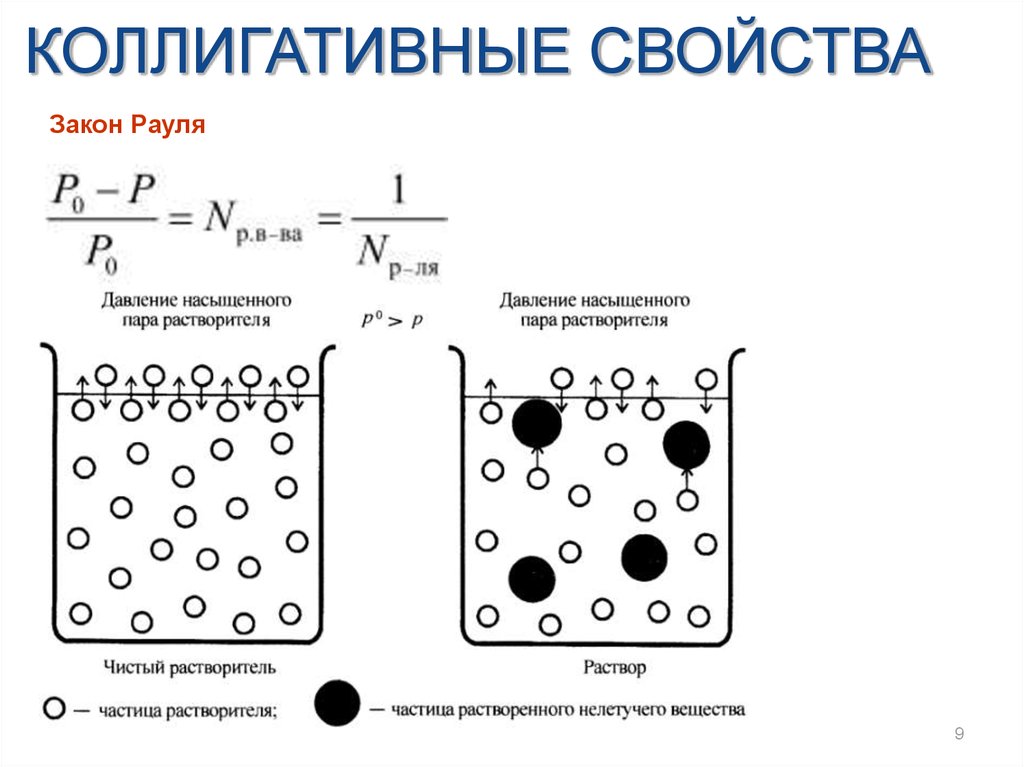
КОЛЛИГАТИВНЫЕ СВОЙСТВАЗакон Рауля
9
10.
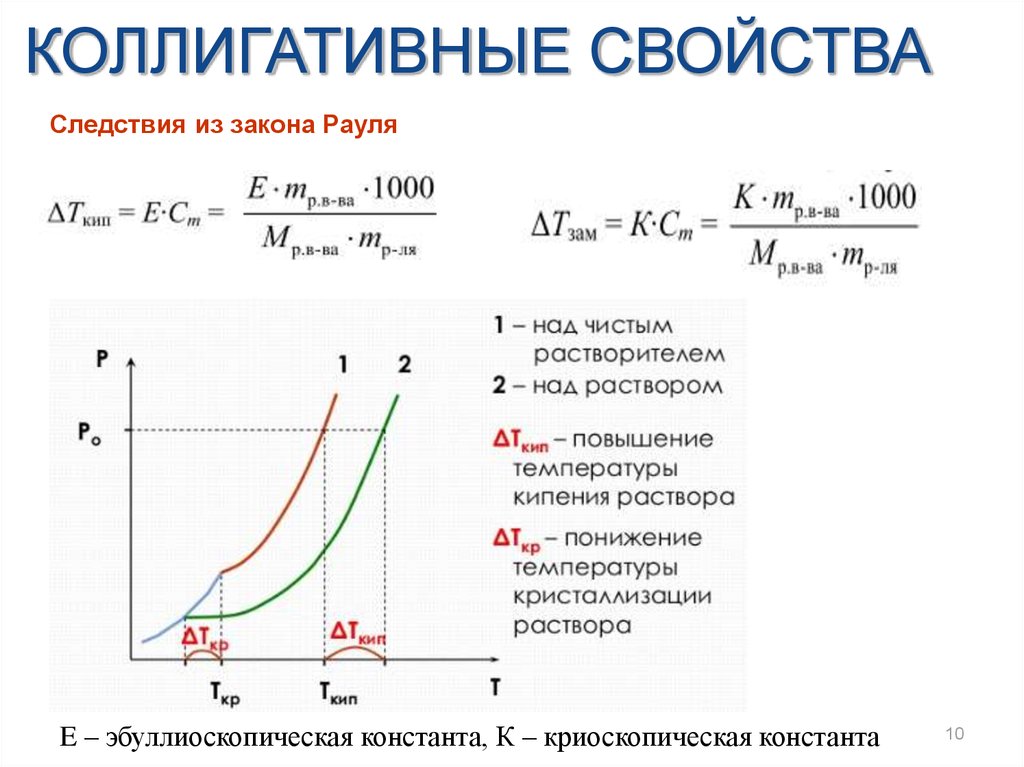
КОЛЛИГАТИВНЫЕ СВОЙСТВАСледствия из закона Рауля
E – эбуллиоскопическая константа, К – криоскопическая константа
10
11.
КОЛЛИГАТИВНЫЕ СВОЙСТВА11
12.
КОЛЛИГАТИВНЫЕ СВОЙСТВАУравнения применимы только к растворам неэлектролитов. Для
растворов электролитов в уравнение вводят поправочный коэффициент
Вант-Гоффа (i) – изотонический коэффициент
12
13.
КОЛЛИГАТИВНЫЕ СВОЙСТВАВ гипотонических растворах протекает разрушение клеток - лизис, а в
случае эритроцитов гемолиз. В гипертонических растворах происходит
сморщивание клеток (плазмолиз).
13
14.
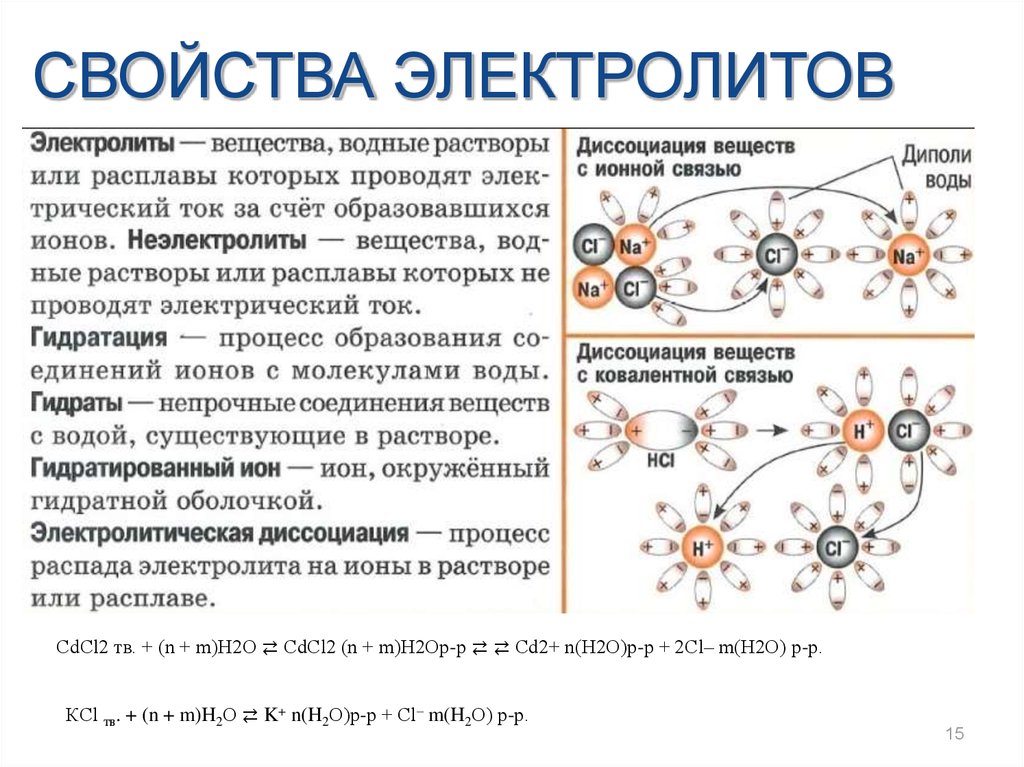
СВОЙСТВА ЭЛЕКТРОЛИТОВ• Распад электролита на ионы под влиянием полярных молекул
растворителя (например, воды) называется электролитической
диссоциацией.
• АВ + (n+m)Н2О ⇄ АВ(Н2О)n+m ⇄ А+(Н2О)n + В–(Н2О)m
• Степень электролитической диссоциации (α) показывает отношение
числа молекул, диссоциирующих (распавшихся) на ионы, к общему
числу молекул растворенного вещества.
• α=Nдис./Nобщ или α=С/С0
• Степень диссоциации зависит от природы растворенного вещества,
природы растворителя, от температуры, от концентрации раствора
14
15.
СВОЙСТВА ЭЛЕКТРОЛИТОВCdCl2 тв. + (n + m)H2O ⇄ CdCl2 (n + m)H2Oр-р ⇄ ⇄ Cd2+ n(H2O)р-р + 2Cl– m(H2O) р-р.
КCl тв. + (n + m)H2О ⇄ K+ n(H2O)р-р + Cl– m(H2O) р-р.
15
16.
СВОЙСТВА ЭЛЕКТРОЛИТОВСлабые электролиты
0<α<0,03
Нерастворимые в воде
основания NH4OH H2O
Кислоты: CH3COOH,
H2CO3, Н2S, HCN,
H2SiO3, H3BO3
Средние электролиты
0,03<α<0,3
Кислоты: H2SO3, HF,
HNO2, H3PO4
Сильные электролиты
α>0,3
Основания: LiOH, KOH,
NaOH, Sr(OH)2, Ba(OH)2;
большинство
растворимых солей
Кислоты: HNO3, HCl,
HBr, HI, H2SO4 , HClO4
Т.к. диссоциация- процесс обратимый, то для него справедлив закон
действующих масс. Для бинарного электролита
16
17.
СВОЙСТВА ЭЛЕКТРОЛИТОВПусть раствор содержал С моль/л электролита, степень диссоциации которого a,
тогда в равновесии концентрация недиссоциированных молекул равна
С – С · a = С (1- a ), а концентрации катионов - С· a , анионов - С· a.
Подставляем эти значения в выражение для Кдис.
Кдис = С2· a2 / C (1-a) = С · a2/ (1-a)
Кдис = С ·a2/(1-a)
17
18.
СВОЙСТВА ЭЛЕКТРОЛИТОВ18
19.
СВОЙСТВА ЭЛЕКТРОЛИТОВСогласно теории Дебая-Гюккеля для описания реальных свойств
растворов сильных электролитов вводится понятие эффективной
(кажущейся) концентрации или активности (а) и коэффициента
активности (fa), которые связаны соотношении а = fa · С
fa- коэффициент активности (кажущаяся степень диссоциации)
включает в себя силы электростатического взаимодействия между
ионами,
величина,
характеризующая
отклонение
свойств
концентрированных растворов сильных электролитов от свойств
разбавленных растворов слабых электролитов.
f - зависит от ионной силы раствора I
mA + nB = pC + gД
р
Ка
ас а Д
q
а A aB
m
n
1
1 n
2
2
2
I С1 Z1 C2 Z 2 ...Ci Zi Ci Z 2i
2
2 i 1
19
20.
СВОЙСТВА ЭЛЕКТРОЛИТОВZ=1 (NaNO3 = Na+ + NO3-)
I= ½ (C1·12 + C2·12) = C
Z=2 (CuSO4 = Cu2+ + SO42-)
I= ½ (C·22 + C·22) = ½·8C= 4C
I=C
I=4C
Z =1, Z =2 (CuCl2 = Cu+2 + 2Cl-)
I= ½ (C·22 + 2C·12) = ½ · 6C= 3C
I=3C
Z=3, Z=1 (K3PO4 = 3K+ + PO43-)
I= ½ (3C·12 + C·32) = ½·12C = 6C
I=6C
Связь коэффициента активности с ионной силой раствора выражается
формулами:
20
21.
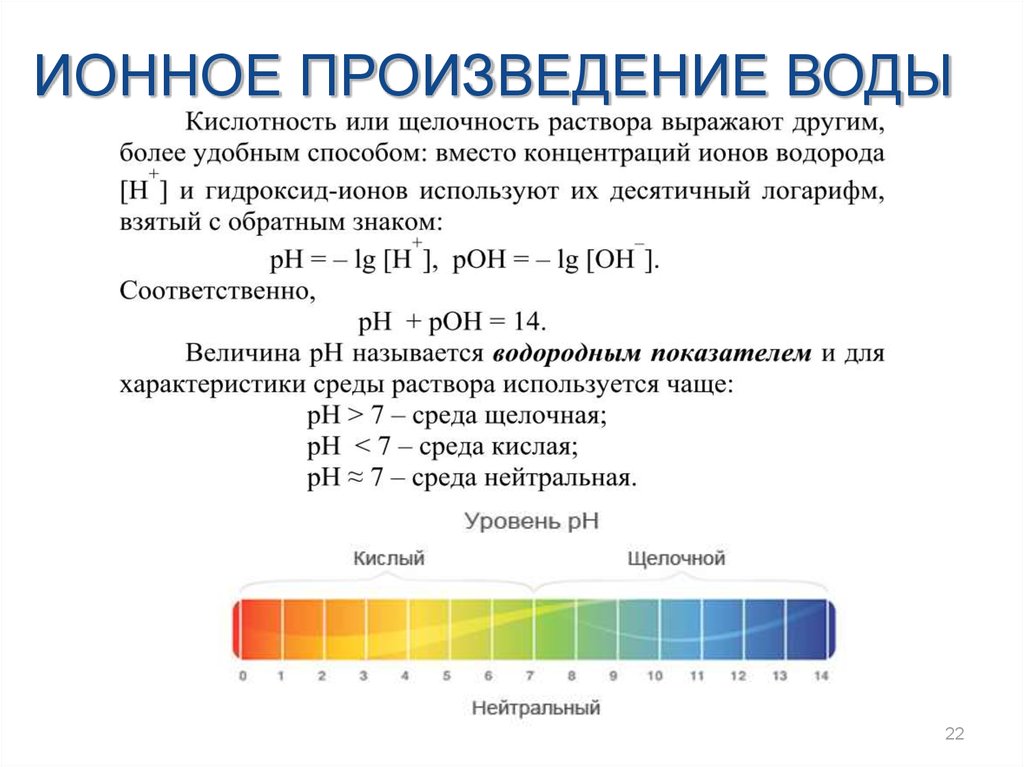
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫН ОН
10 14 10 7 моль / л
21
22.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ22
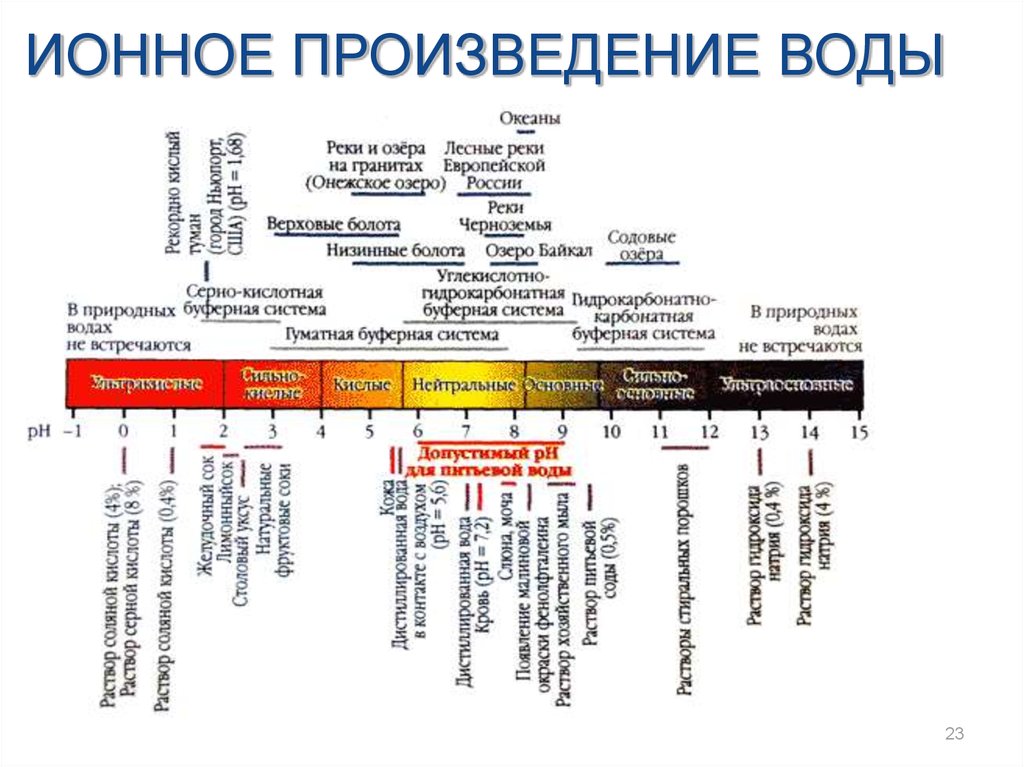
23.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ23
24.
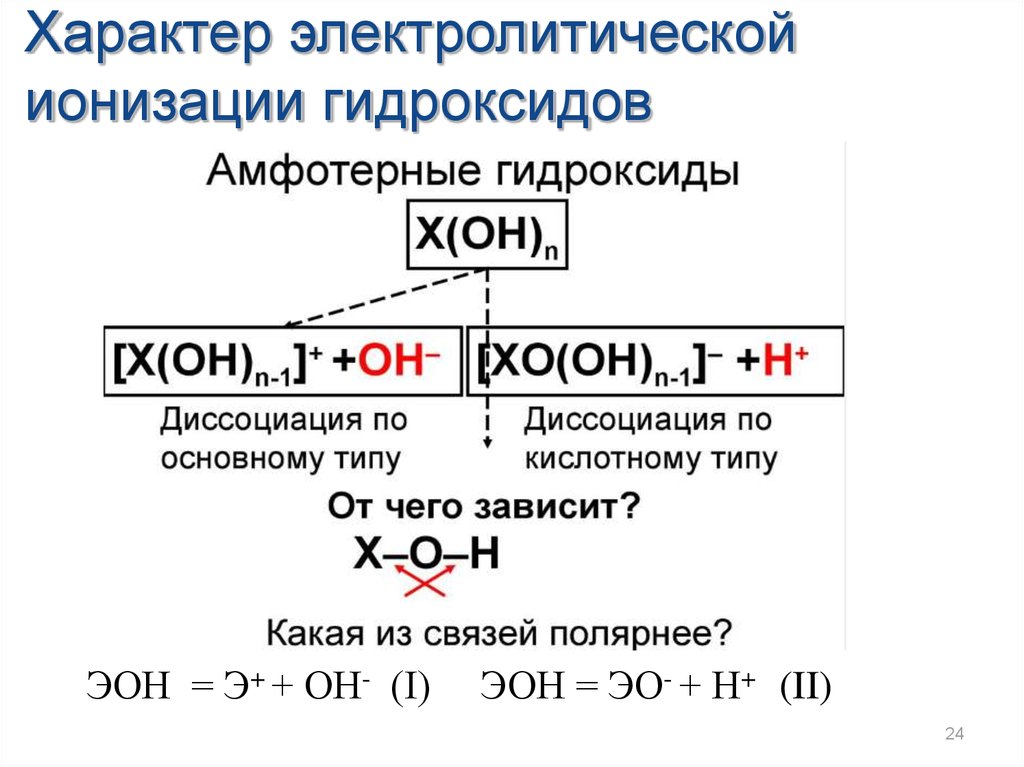
Характер электролитическойионизации гидроксидов
ЭОН = Э+ + ОН- (I)
ЭОН = ЭО- + Н+ (II)
24
25.
Диссоциация многоосновных кислот25
26.
Диссоциация многокислотныхоснований
26
27.
Реакции в растворах. ГидролизНейтрализация доходит до конца только тогда, когда единственным
малодиссоциированным веществом в системе является вода, например:
НС1 + КОН = КС1 + Н2О
Взаимная нейтрализация кислот и оснований, отличающихся друг от
друга по силе, до конца не протекает.
Например:
СН3СООН + КОН = СН3СООК + Н2О
СН3СООН + К+ + ОН- = СН3СОО- + К+ + Н2О
СН3СООН + ОН- = СН3СОО- + Н2О
Эта реакция нейтрализации обратима. Обратная реакция
нейтрализации, т.е. реакция взаимодействия кислоты и основания
называется реакцией гидролиза.
Гидролизом соли называется - взаимодействие ионов соли с водой,
приводящее к образованию слабого электролита и к изменению рН
среды. Гидролиз – является частным случаем сольволиза –
обменного разложения растворенного вещества и растворителя.
27
28.
Реакции в растворах. Гидролиз28
29.
Реакции в растворах. Гидролиз29
30.
Реакции в растворах. Гидролиз30
31.
Реакции в растворах. Гидролиз31
32.
Реакции в растворах. ГидролизВ случае соли NH4CH3COO, константы диссоциации КNH4OH = КСН3СООН
практически одинаковы и равны 1,8 10-5.
СН3СОО- + NH-4 + НОН=СН3СОН + NH4ОН рН = 7
Т.к. концентрации ацетат - ионов и ионов аммония в растворе одинаковы,
то кислота и основание равны по силе, то реакция среды будет
нейтральной.
При взаимодействии солей А13+,Сr3+, Fe3+ с растворами сульфидов и
карбонатов в осадок выпадают не сульфиды и карбонаты этих катионов, а
их гидроксиды.
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза
двух солей и реакция идет до конца. Это примеры совместного гидролиза
– когда продукты гидролиза одной соли взаимодействуют с продуктами
гидролиза другой соли, образуя при этом слабо диссоциирующие
соединения и гидролиз обеих солей идет до конца.
32
33.
Гидролиз. Количественныехарактеристики
33
34.
Гетерогенные равновесия в растворе34
35.
Гетерогенные равновесия в раствореУсловие образования осадка: ПИ > ПР
ПИ – произведение концентраций (ионов)
35
36.
Гетерогенные равновесия в растворе36
37.
Гетерогенные равновесия в раствореМалорастворимые соли слабых кислот потому и растворяются в сильных
кислотах, что при этом ионы Н+ связывают анионы солей в
малодиссоциированные молекулы слабых кислот.
CaC2O4→ Ca+2 + C2O4-2
осадок
2HCl ↔ 2Cl- + 2H+
H2C2O4
или для солей непрочной угольной кислоты:
BaCO3 → Ba+2 + CO3-2
осадок
HCl ↔ 2Cl- + 2H+
Н2СO3=H2O + CO2↑
Исключение составляют малорастворимые соли слабых кислот с ничтожной
величиной произведения растворимости, например сульфид ртути (ΙΙ) с
ПР=4·10-53 . Сместить равновесие между осадком HgS и раствором, действуя
сильной кислотой невозможно, так как сероводородная кислота образует
гораздо больше ионов S2-, чем их получается за счет растворимости HgS
HgS↔Hg+2 + S237
равновесие смещено влево
38.
Гетерогенные равновесия в раствореИногда осадки солей растворяются с образованием прочных комплексных
ионов. Так, хлорид серебра легко растворяется в NH4OH, потому что
ионы Ag+, посылаемые осадком в раствор связываются молекулами
аммиака в комплексные ионы:
AgCl + 2NH3 → [Ag(NH3)2]+ + ClПонижение концентрации ионов Ag+ приводит к нарушению равновесия
между раствором и твердой фазой, т.е. приводит к растворению осадка.
Примерами процессов в уравнении реакции которых слева и справа
входят труднорастворимые вещества, могут служить:
AgCl(k)↓ + NaI(p) ↔ AgI↓(k) + NaCl(p) ΔG˚= - 54кДж
BaCO3↓(k) + Na2SO4(p) ↔ BaSO4↓(k) + Na2CO3(p) ΔG˚≈ 0
Равновесие смещается в сторону образования менее растворимого
соединения. В реакции (1) равновесие смещено вправо, т.к.
ПРAgI=1,1·10-16 < ПРAgCl =1,8·10-10. В реакции (2) равновесие лишь
несколько сдвинуто в сторону BaSO4 (ПР BaCO3 = 4,9·10-9 > ПР BaSO4
=1,08·10-10).
38
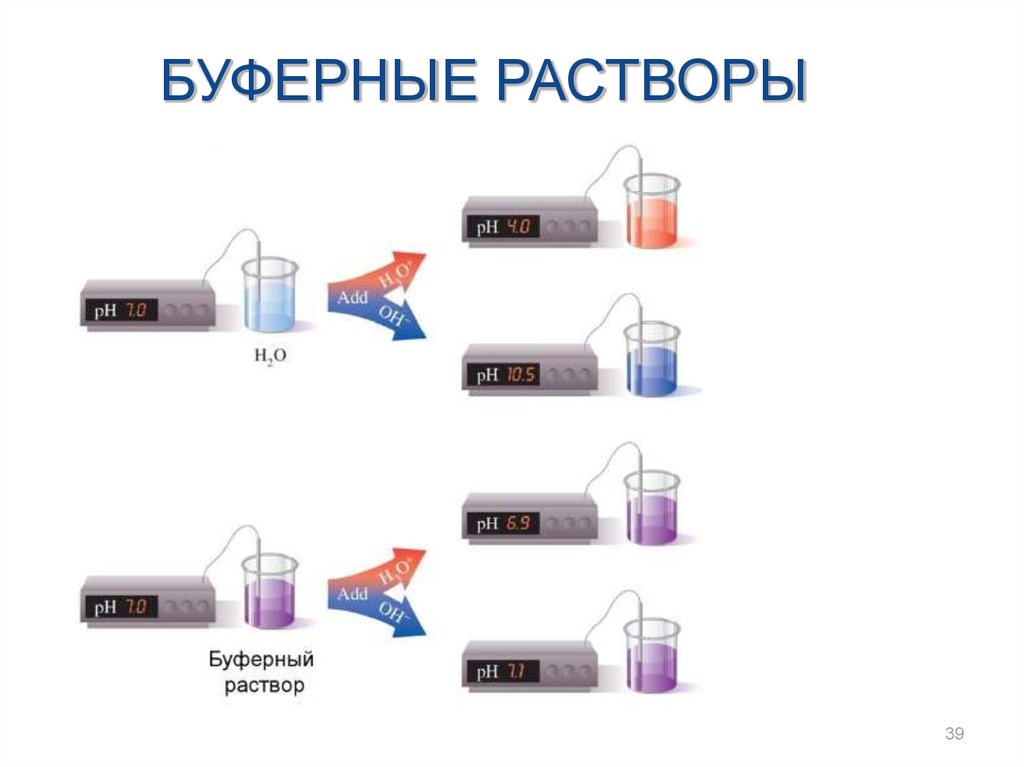
39.
БУФЕРНЫЕ РАСТВОРЫ39
40.
БУФЕРНЫЕ РАСТВОРЫ40
41.
БУФЕРНЫЕ РАСТВОРЫ41
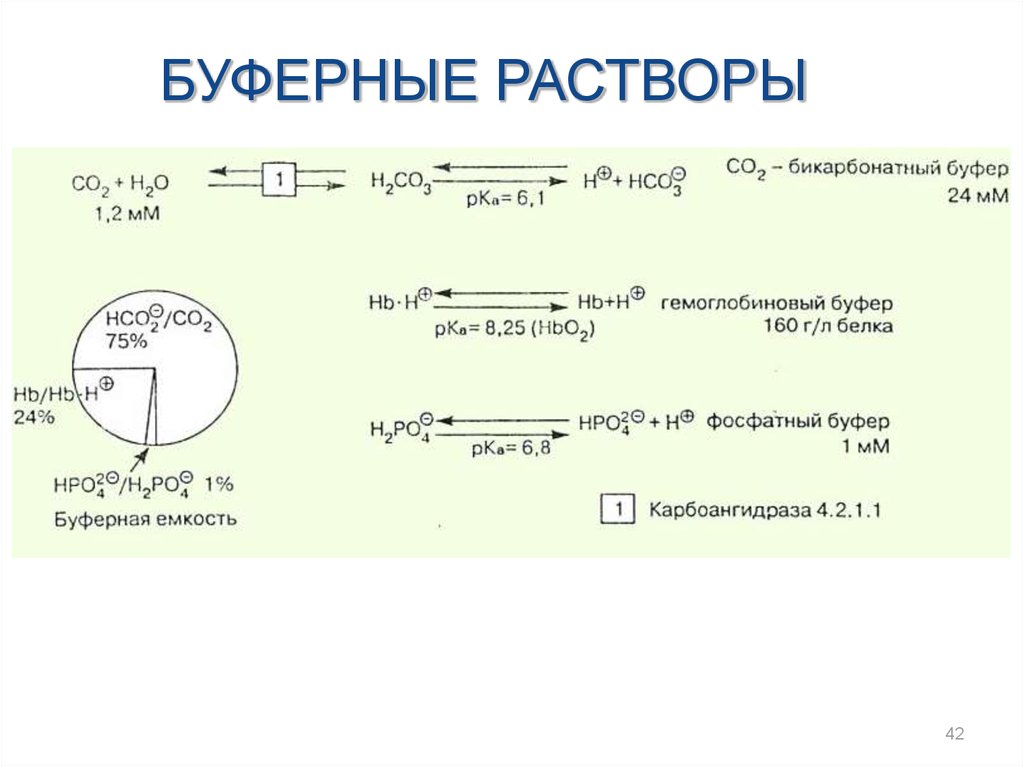
42.
БУФЕРНЫЕ РАСТВОРЫ42
43.
БУФЕРНЫЕ РАСТВОРЫ43
44.
БУФЕРНЫЕ РАСТВОРЫ44
45.
БУФЕРНЫЕ РАСТВОРЫ45
46.
БУФЕРНЫЕ РАСТВОРЫ46
47.
БУФЕРНЫЕ РАСТВОРЫ47
48.
БУФЕРНЫЕ РАСТВОРЫ48




































 Химия
Химия








