Похожие презентации:
Аліциклічні вуглеводні
1. АЛІЦИКЛІЧНІ вуглеводні
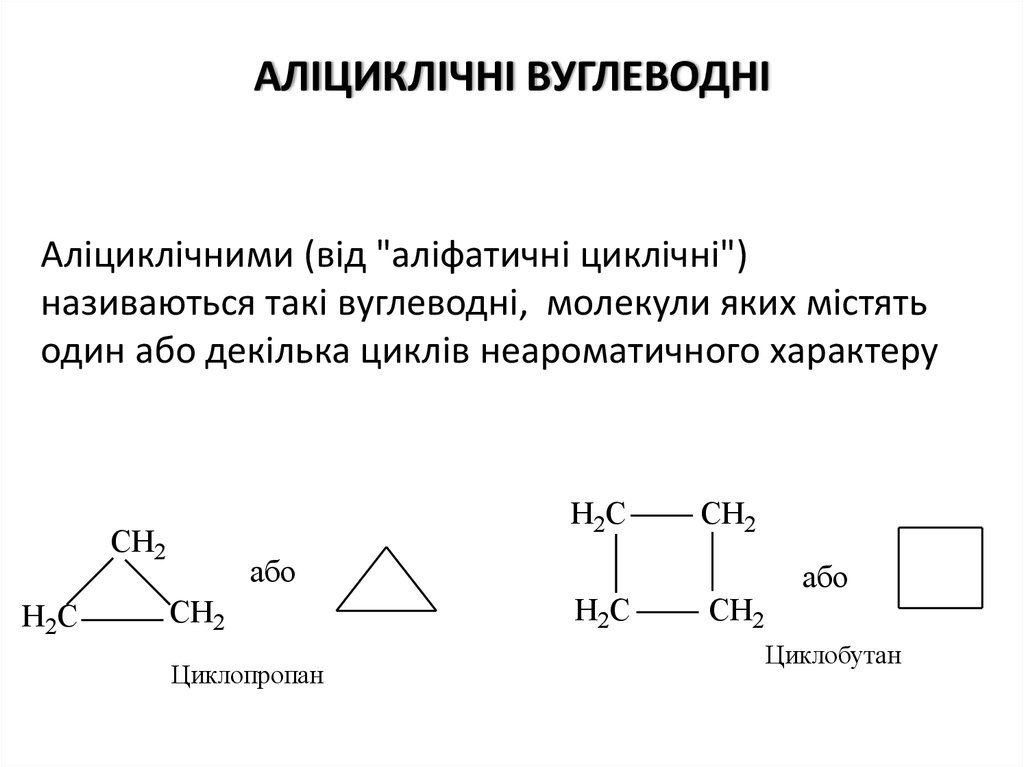
АЛІЦИКЛІЧНІ ВУГЛЕВОДНІАліциклічними (від "аліфатичні циклічні")
називаються такі вуглеводні, молекули яких містять
один або декілька циклів неароматичного характеру
Н2С
СН2
Н2С
СН2
або
СН2
Циклопропан
Н2С
СН2
або
Циклобутан
2. Аліциклічні вуглеводні ще називаються циклопарафінами, циклоалканами або, якщо вони містять в циклі 5-6 атомів вуглецю –
нафтенами.• За аналогією до вуглеводнів з відкритим
ланцюгом, серед аліциклічних також можна
виділити циклоалкани (нема кратних зв'язків),
циклоалкени (один подвійний зв'язок),
циклоалкіни (один потрійний зв'язок) тощо.
• Назви аліциклічних вуглеводнів утворюють
додаванням до назви відповідного ациклічного
вуглеводня префікса цикло-.
• За іншою класифікацією аліциклічні вуглеводні
поділяються на моно-, бі-, три- та поліциклічні залежно від числа циклів в їх молекулах.
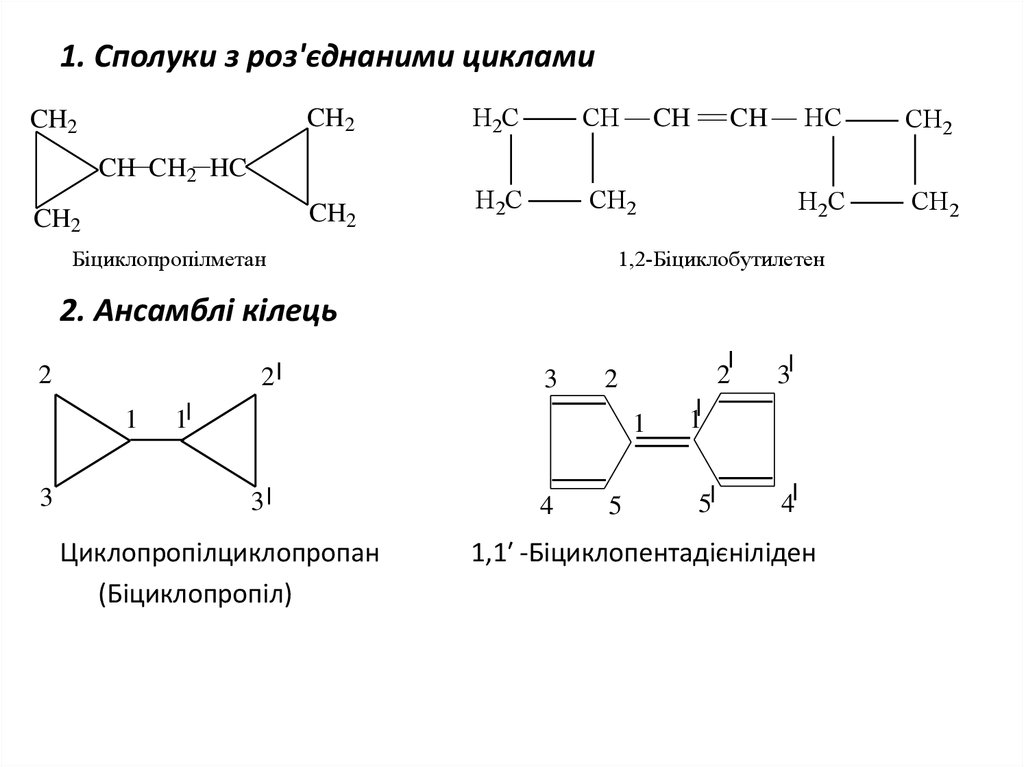
3. 1. Сполуки з роз'єднаними циклами
CH2CH2
Н2С
СН
CH2
Н2С
СН2
CH CH2 HC
CH2
Біциклопропілметан
CH
CH
НС
СН2
Н2С
СН2
1,2-Біциклобутилетен
2. Ансамблі кілець
2
2
1
3
3
2
2
1
1
3
Циклопропілциклопропан
(Біциклопропіл)
4
5
3
1
5
4
1,1′ -Біциклопентадієніліден
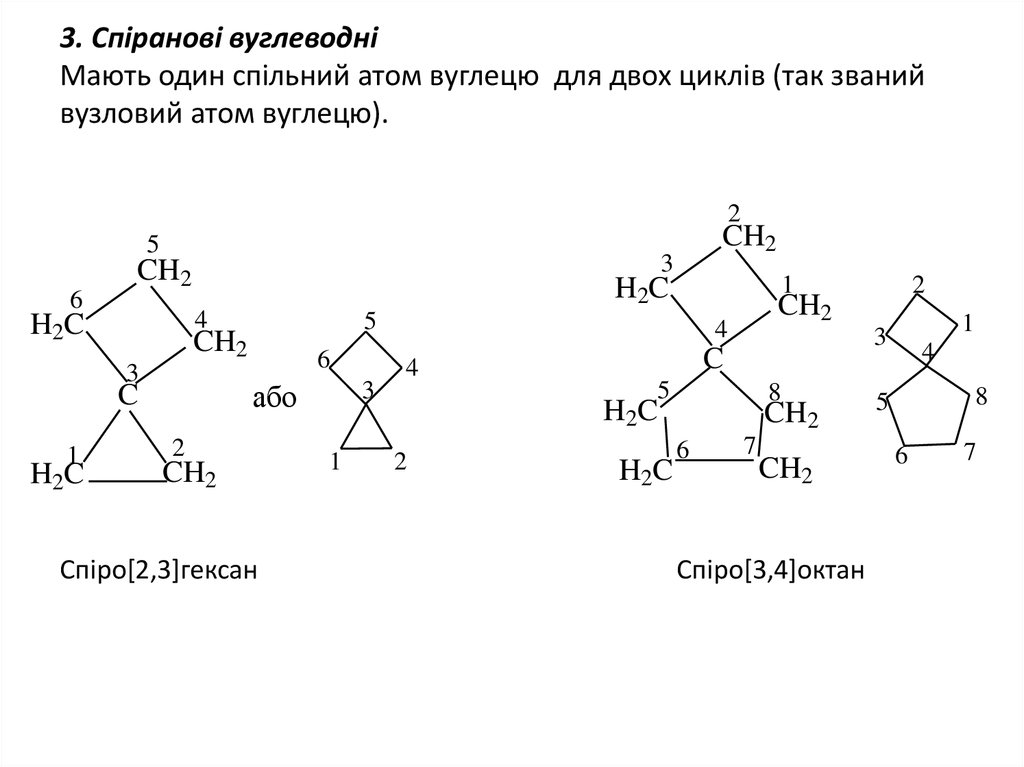
4. 3. Спіранові вуглеводні Мають один спільний атом вуглецю для двох циклів (так званий вузловий атом вуглецю).
25
3
CH2
6
6
або
C
H2C
5
CH2
3
1
1
H2C
4
H2C
CH2
2
CH2
Cпіро[2,3]гексан
3
1
CH2
4
5
8
H2C
2
H2C
CH2
6
1
3
C
4
2
7
CH2
Спіро[3,4]октан
4
8
5
6
7
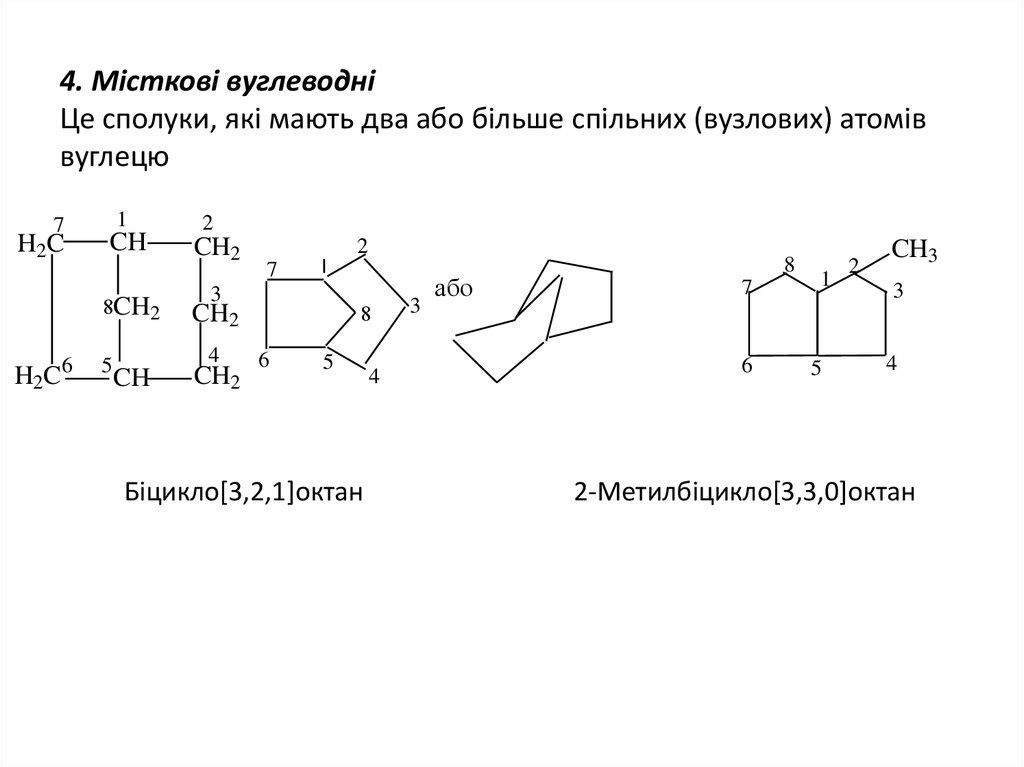
5. 4. Місткові вуглеводні Це сполуки, які мають два або більше спільних (вузлових) атомів вуглецю
7H2C
1
CH
8CH2
H2C
6
5
2
CH2
7
3
8
CH2
4
CH
2
CH2
6
5
Біцикло[3,2,1]октан
4
3
або
8
7
6
1
5
2
CH3
3
4
2-Метилбіцикло[3,3,0]октан
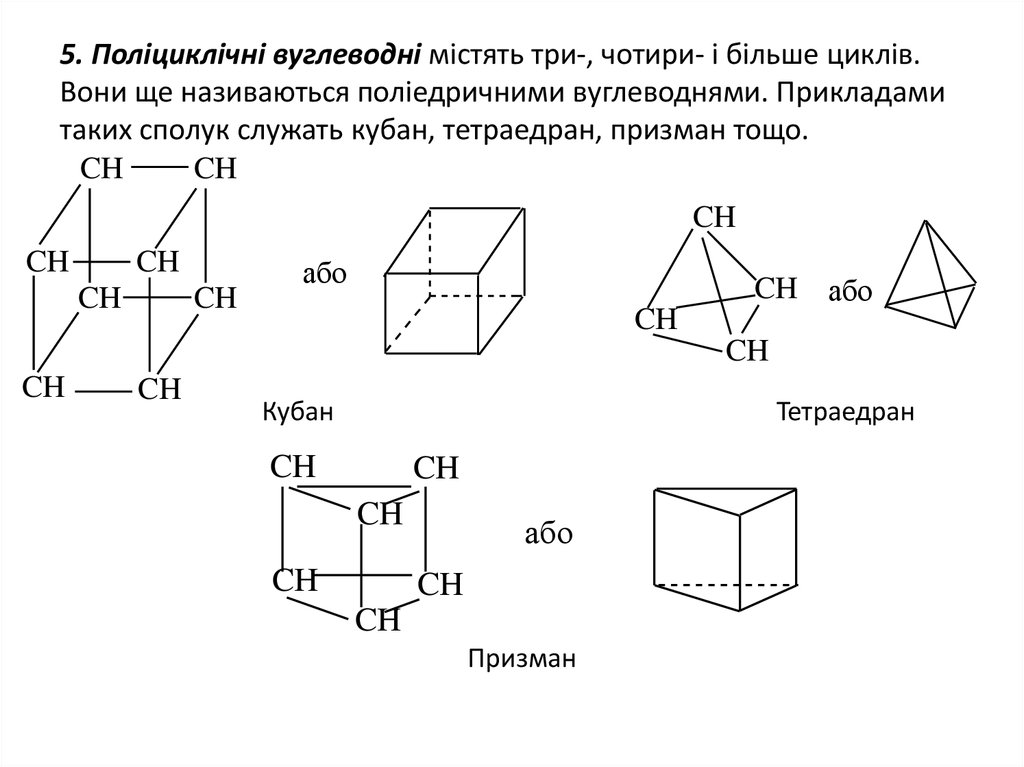
6. 5. Поліциклічні вуглеводні містять три-, чотири- і більше циклів. Вони ще називаються поліедричними вуглеводнями. Прикладами
таких сполук служать кубан, тетраедран, призман тощо.CH
CH
CH
CH
CH
CH
CH
або
CH або
CH
CH
CH
CH
Кубан
Тетраедран
CH
CH
CH
CH
або
CH
CH
Призман
7. ізомерія аліциклічних вуглеводнів
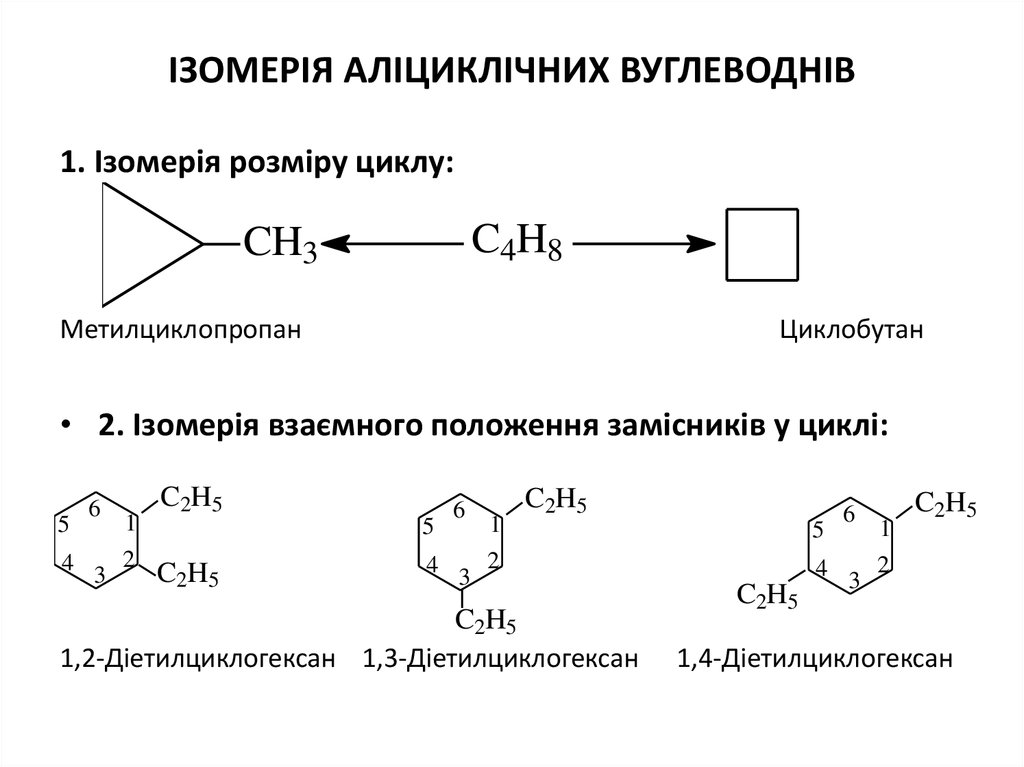
ІЗОМЕРІЯ АЛІЦИКЛІЧНИХ ВУГЛЕВОДНІВ1. Ізомерія розміру циклу:
C4H8
CH3
Метилциклопропан
Циклобутан
• 2. Ізомерія взаємного положення замісників у циклі:
5
4
6
3
1
2
C2H5
5
C2H5
4
6
3
1
C2H5
5
2
C2H5
1,2-Діетилциклогексан 1,3-Діетилциклогексан
4
C2H5
6
3
1
C2H5
2
1,4-Діетилциклогексан
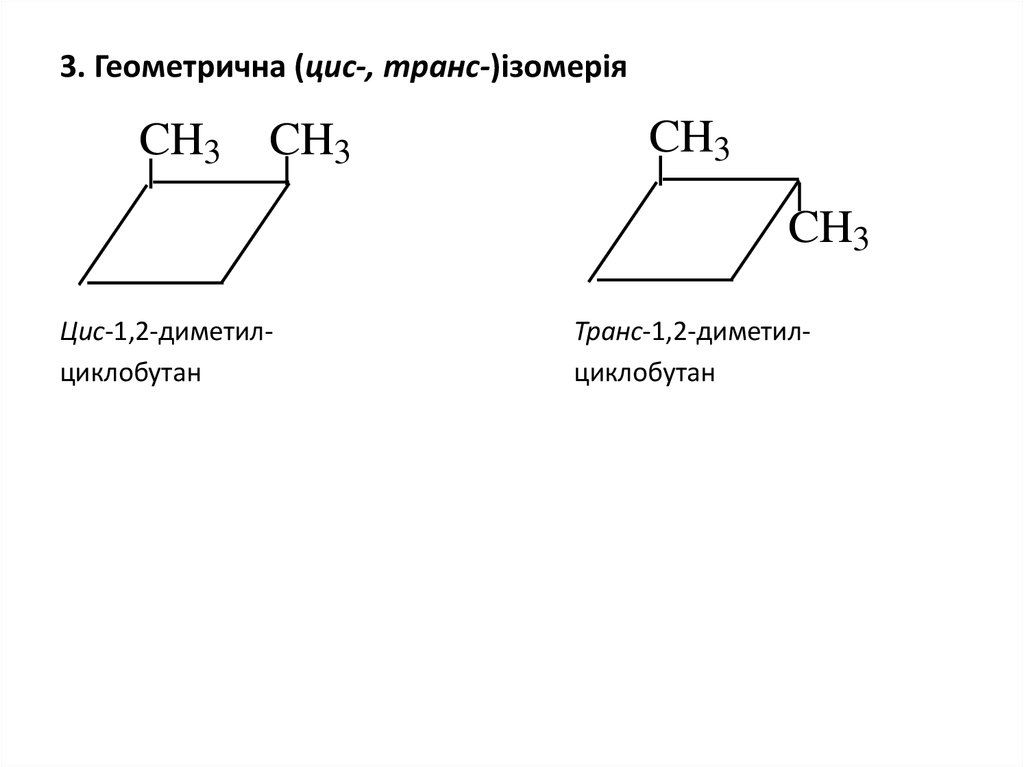
8. 3. Геометрична (цис-, транс-)ізомерія
CH3CH3
CH3
CH3
Цис-1,2-диметилциклобутан
Транс-1,2-диметилциклобутан
9. Способи одержання
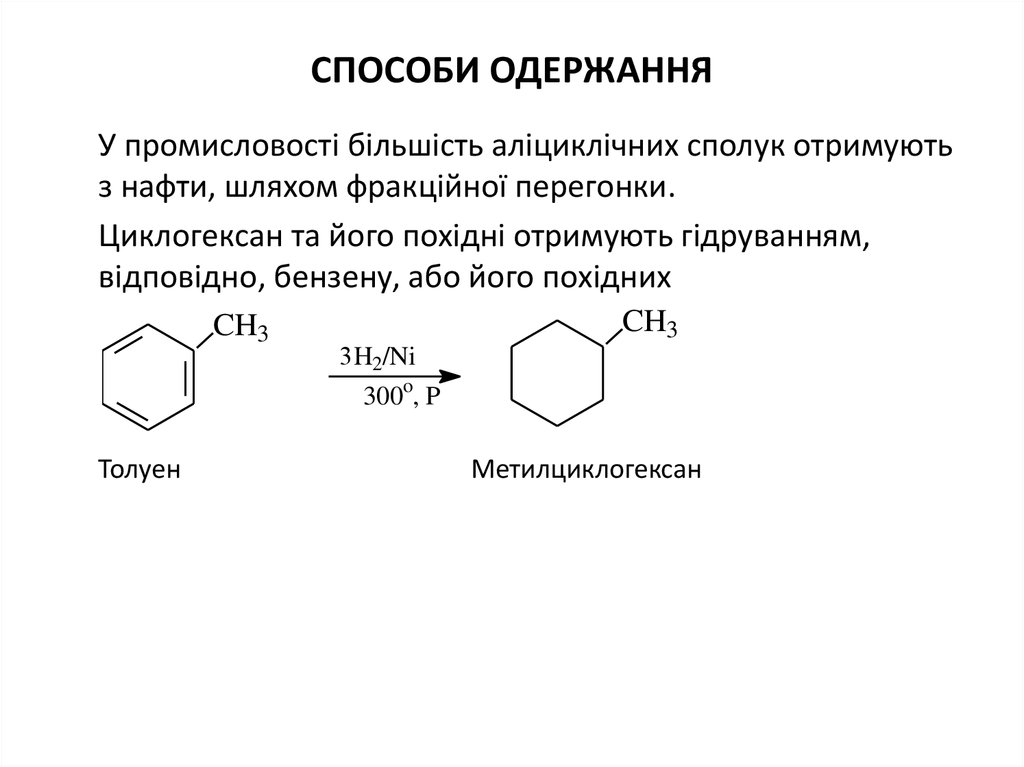
СПОСОБИ ОДЕРЖАННЯУ промисловості більшість аліциклічних сполук отримують
з нафти, шляхом фракційної перегонки.
Циклогексан та його похідні отримують гідруванням,
відповідно, бензену, або його похідних
CH3
3H2/Ni
CH3
300o, P
Толуен
Метилциклогексан
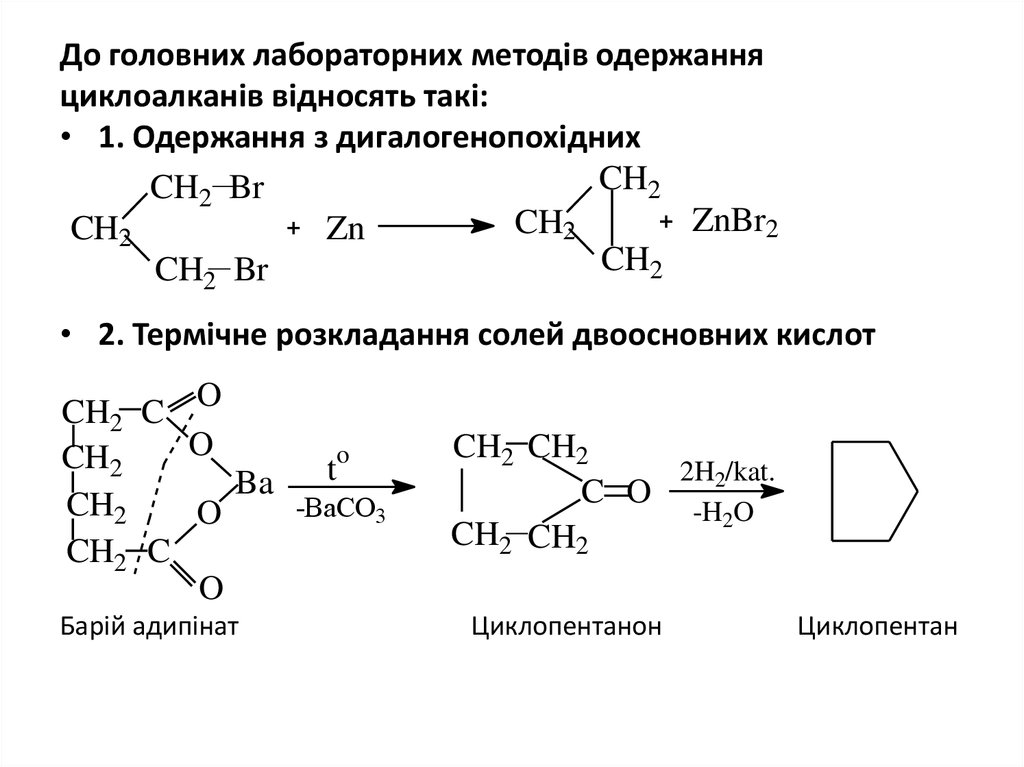
10. До головних лабораторних методів одержання циклоалканів відносять такі:
• 1. Одержання з дигалогенопохіднихCH2
CH2 Br
ZnBr2
CH2
CH2
Zn
CH2
CH2 Br
• 2. Термічне розкладання солей двоосновних кислот
O
CH2 C
O
o
CH2
t
Ba
CH2
-BaCO3
O
CH2 C
O
Барій адипінат
CH2 CH2
2H2/kat.
C O
-H2O
CH2 CH2
Циклопентанон
Циклопентан
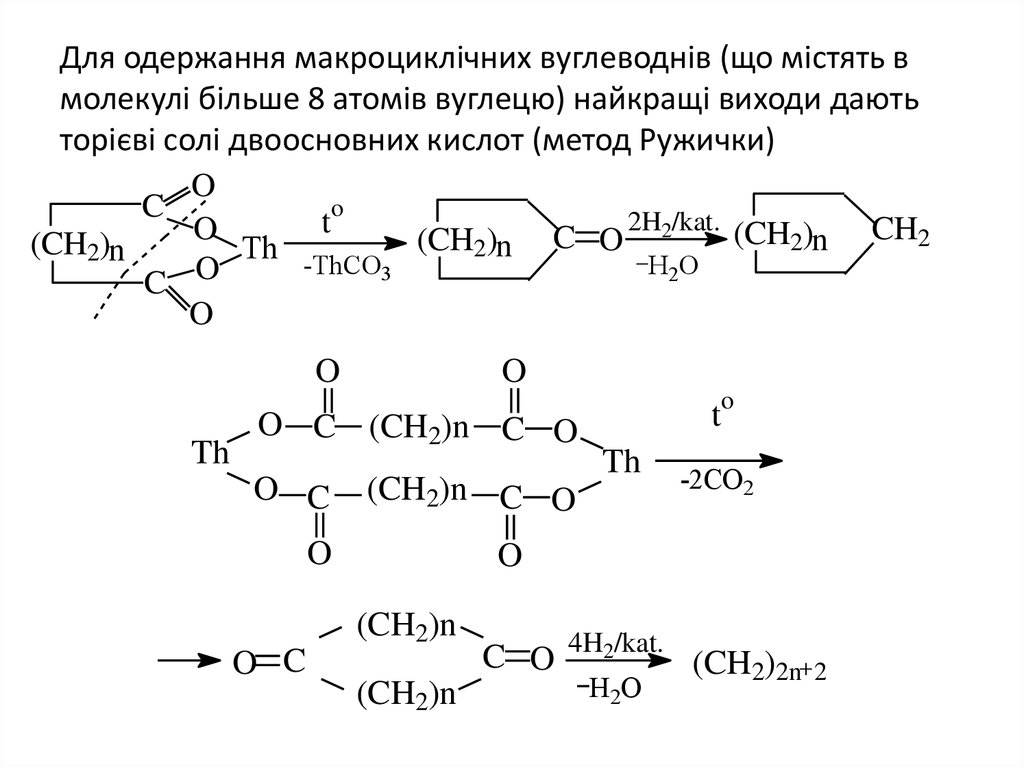
11. Для одержання макроциклічних вуглеводнів (що містять в молекулі більше 8 атомів вуглецю) найкращі виходи дають торієві солі
двоосновних кислот (метод Ружички)O
o
C
2H2/kat. (CH )
t
O
CH2
C
O
2n
(CH2)n
Тh -ThCO (CH2)n
Н2О
3
C O
O
O
Th
O
O C (CH2)n C O
O C
(CH2)n C O
O
Th
-2CO2
O
(CH2)n
O C
o
t
(CH2)n
C O 4H2/kat. (CH2)2n
Н2О
2
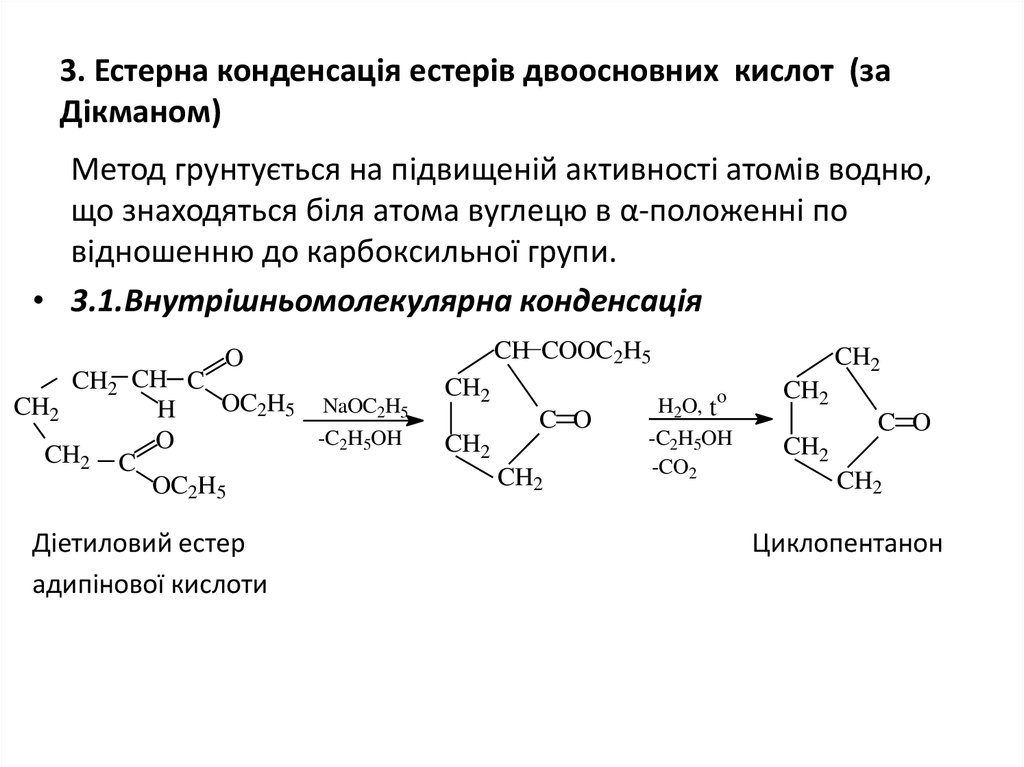
12. 3. Естерна конденсація естерів двоосновних кислот (за Дікманом)
Метод грунтується на підвищеній активності атомів водню,що знаходяться біля атома вуглецю в α-положенні по
відношенню до карбоксильної групи.
• 3.1.Внутрішньомолекулярна конденсація
CH COOC2H5
O
CH2 CH C
OC2H5 NaOC2H5
CH2
H
-C2H5OH
O
CH2 C
OC2H5
Діетиловий естер
адипінової кислоти
CH2
C O
CH2
CH2
CH2
H2O, to
CH2
-C2H5OH
-CO2
CH2
C O
CH2
Циклопентанон
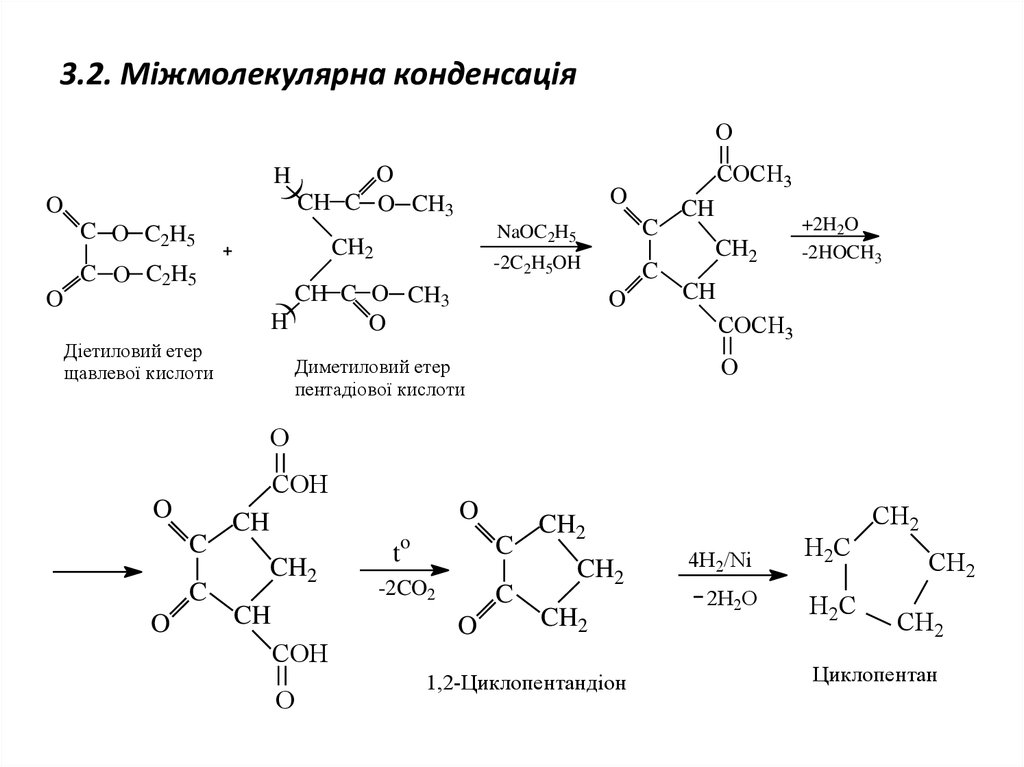
13. 3.2. Міжмолекулярна конденсація
ОO
CH C O CH3
H
O
)
O
C О C2H5
CH2
C О C2H5
NaOC2H5
C
-2C2H5OH
C
CH C O CH3
H)
O
O
Діетиловий етер
щавлевої кислоти
СОСН3
O
CH
CH2
+2H2O
-2HOCH3
CH
СОСН3
О
Диметиловий етер
пентадіової кислоти
О
СОН
O
C
C
O
O
CH
o
CH2
CH
СОН
О
C
t
-2CO2
C
O
CH2
CH2
CH2
1,2-Циклопентандіон
4H2/Ni
2H2O
H2C
H2C
CH2
CH2
CH2
Циклопентан
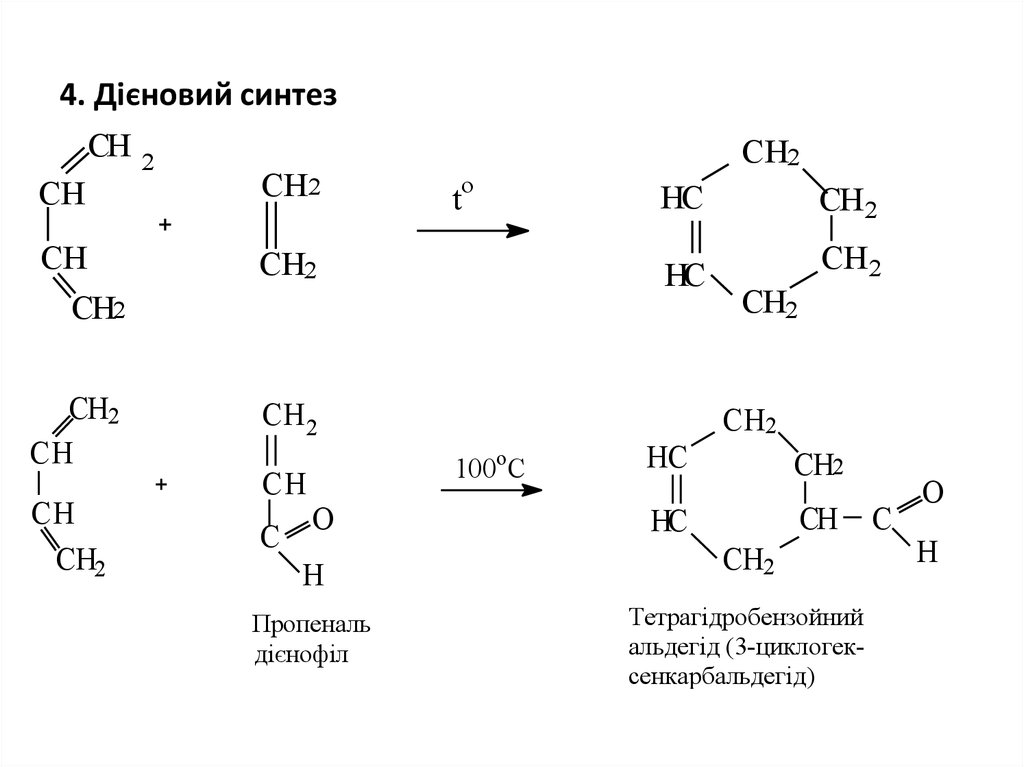
14. 4. Дієновий синтез
СНСН
СН
2
СН 2
o
t
СН2
СН2
СН2
СН
СН
СН2
СН 2
С
О
Н
Пропеналь
дієнофіл
НС
СН2
НС
СН 2
СН2
СН2
100oC
СН
СН2
НС
СН2
СН
НС
СН2
Тетрагідробензойний
альдегід (3-циклогексенкарбальдегід)
С
О
Н
15. фІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІЦиклоалкани (С3-С4) - це гази, (С5-С10) - безбарвні рідини,
котрі не розчиняються у воді.
Хімічні властивості циклопарафінів в значній мірі залежать
від розмірів їх циклів. Так циклопропан, який має
найменший цикл, здатний до реакцій приєднання з
розривом циклу і за своїми хімічними властивостями
нагадує алкени. Для циклобутану також характерні реакції
приєднання з розривом циклу, але їх протікання вимагає
жорсткіших умов. Найбільшу стійкість мають п'яти- та
шестичленні цикли. Останні не розщеплюються при дії на
холоді брому, озону, перманганату калію тощо і в цьому
плані вони більше нагадують алкани.
В чому ж причина такої різної поведінки циклоалканів?
16.
• Відносну стійкість циклоалканів Байєр пояснювавнапругою, що виникає в циклі при його утворенні (теорія
напружень Байера). При цьому він постулював, що всі
цикли плоскі. В циклоалканах атоми вуглецю знаходяться
в sp3-гібридному стані. Валентний кут, що характерний для
цього стану становить 109o28’. При утворенні циклу
відбувається деформація цього кута. При чому, чим більша
деформація, тим більшим буде напруження в циклі і тим
меншою буде його стабільність.
17. Розрахуємо величини відхилення валентних кутів від 109o28' для різних циклоалканів. Позначимо кут відхилення через α.
• Для циклопропану, молекула якого є правильнимтрикутником з валентним кутом 60о відхилення
валентного кута (α) від 109o28' складає
CH2
C
o
60
o
109 28
o
109 28 60
2
CH2
o
o
24 44
18. Для циклобутану
109o282
o
90
o
9 44
• Для циклопентану α = 0o4', для циклогексану (α = -5o16') і
по мірі збільшення величини циклу її значення буде
поступово зростати, а це означає, що стійкіст циклів буде
зменшуватися. Однак, ці розрахунки не підтвердилися
експериментально. Було встановлено, що шести- і більше
членні цикли не менш стійкі, ніж п'ятичленні.
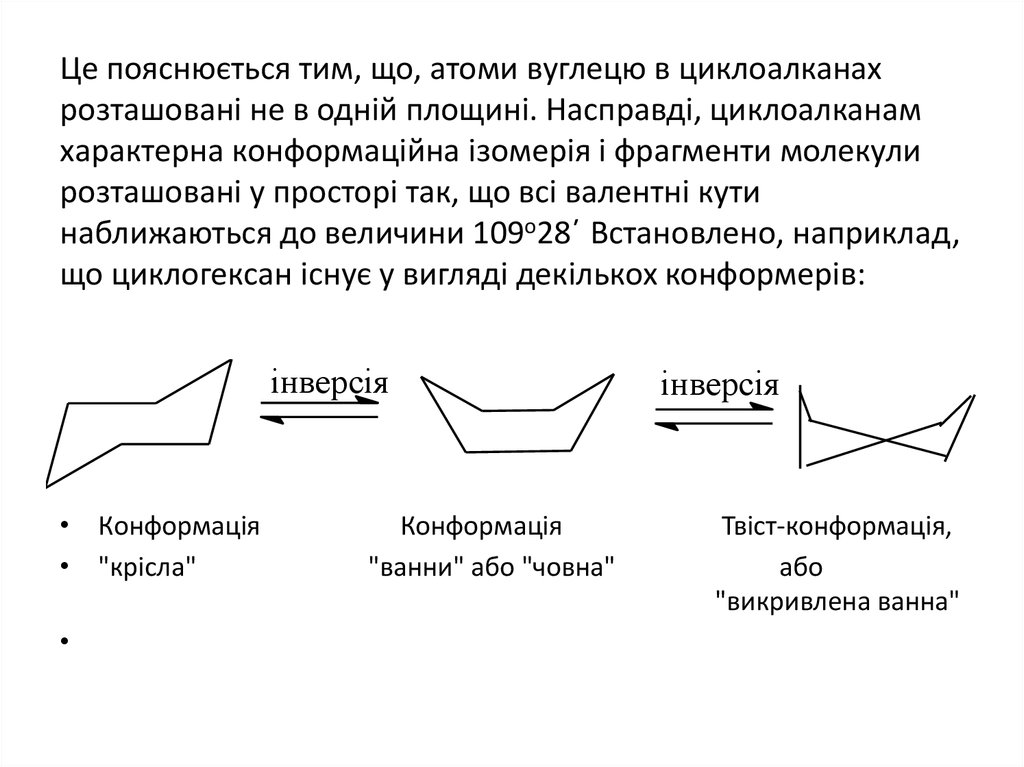
19. Це пояснюється тим, що, атоми вуглецю в циклоалканах розташовані не в одній площині. Насправді, циклоалканам характерна
конформаційна ізомерія і фрагменти молекулирозташовані у просторі так, що всі валентні кути
наближаються до величини 109о28΄ Встановлено, наприклад,
що циклогексан існує у вигляді декількох конформерів:
інверсія
• Конформація
• "крісла"
Конформація
"ванни" або "човна"
інверсія
Твіст-конформація,
або
"викривлена ванна"
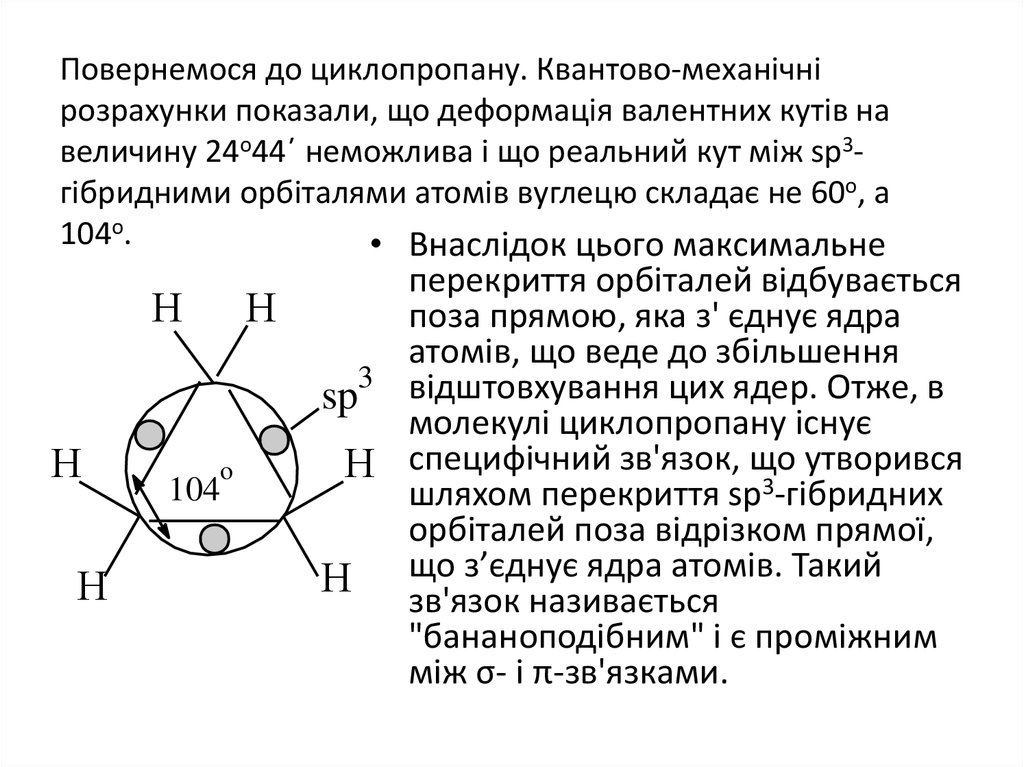
20. Повернемося до циклопропану. Квантово-механічні розрахунки показали, що деформація валентних кутів на величину 24о44΄ неможлива
і що реальний кут між sp3гібридними орбіталями атомів вуглецю складає не 60о, а104о.
• Внаслідок цього максимальне
Н
Н
Н
104
Н
o
перекриття орбіталей відбувається
поза прямою, яка з' єднує ядра
атомів, що веде до збільшення
3
sp відштовхування цих ядер. Отже, в
молекулі циклопропану існує
утворився
Н специфічний зв'язок, що
шляхом перекриття sp3-гібридних
орбіталей поза відрізком прямої,
з’єднує ядра атомів. Такий
Н що
зв'язок називається
"бананоподібним" і є проміжним
між σ- і π-зв'язками.
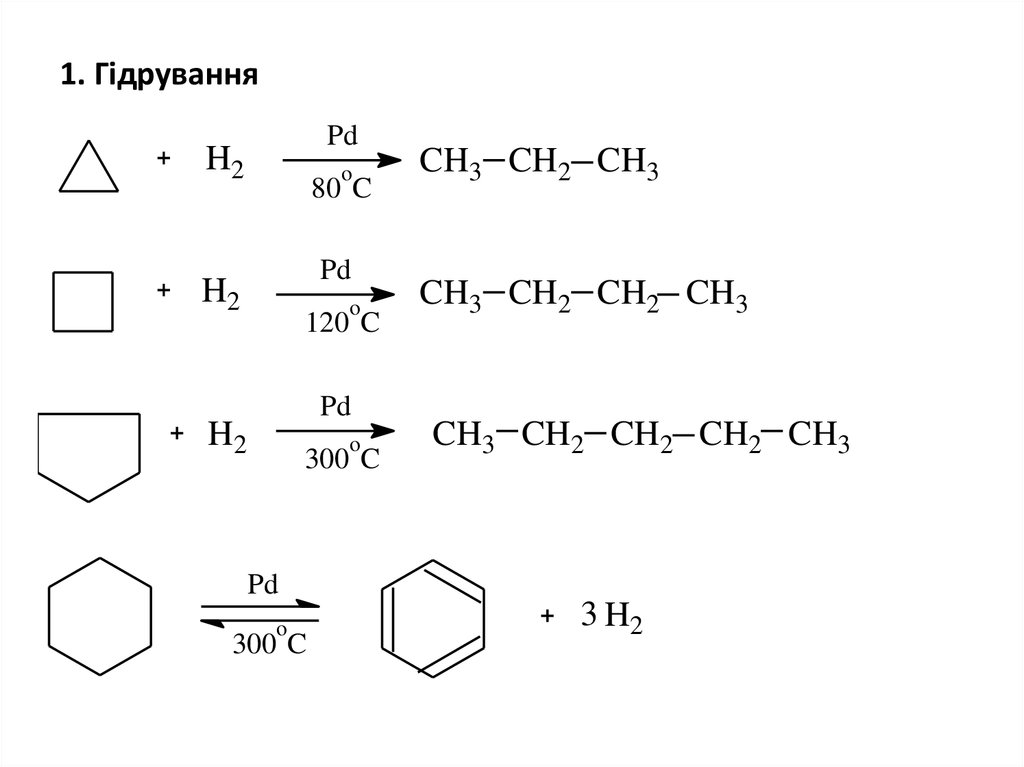
21. 1. Гідрування
PdH2
o
80 C
Pd
H2
o
120 C
Pd
H2
o
300 C
CH3 CH2 CH3
CH3 CH2 CH2 CH3
CH3 CH2 CH2 CH2 CH3
Pd
o
300 C
3 H2
22.
• Як видно зі схеми, циклопропан гідрується доволілегко, гідрування циклобутану вимагає
жорсткіших умов, циклопентан розщеплюється
воднем тільки при значно вищій температурі, а
циклогексан за цих умов не приєднує, а
відщеплює водень, перетворюючись на бензен.
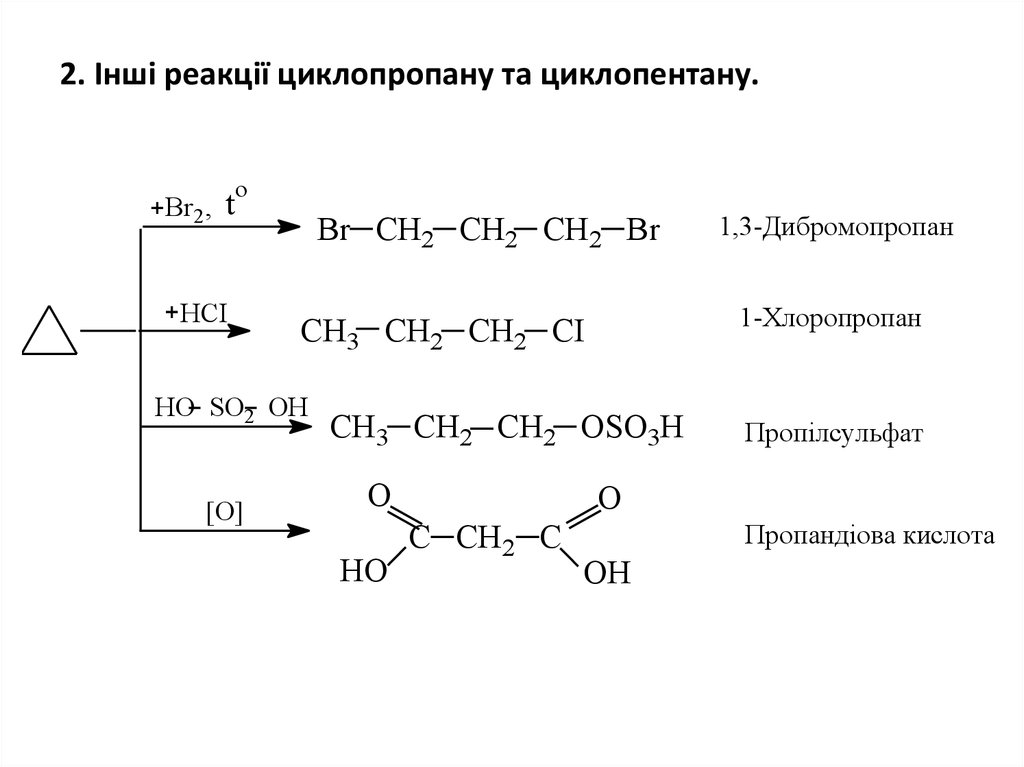
23. 2. Інші реакції циклопропану та циклопентану.
oBr2 , t
HCI
Br CH2 CH2 CH2 Br
[О]
1-Хлоропропан
CH3 CH2 CH2 CI
HO SO2 OH
CH3 CH2 CH2 OSO3H
О
НО
1,3-Дибромопропан
Пропілсульфат
О
C CH2 C
Пропандіова кислота
ОН
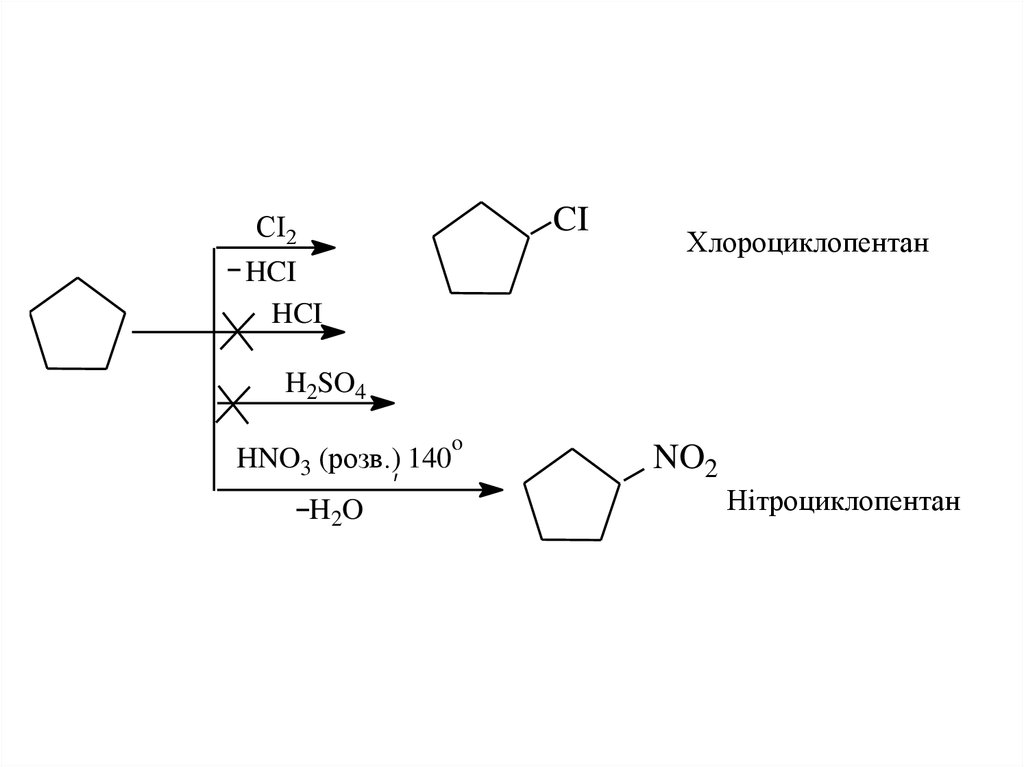
24.
CIСІ2
Хлороциклопентан
HCI
HCI
H2SO4
o
HNO3 (розв.), 140
H2O
NO2
Нітроциклопентан
25.
• Порівняння цих двох схем показує, щоциклопропан легко вступає в реакції
приєднання з розривом напруженого
трьохчленного кільця, однак для
циклопентану, що має ненапружений цикл,
більшою мірою характерні реакції
заміщення.
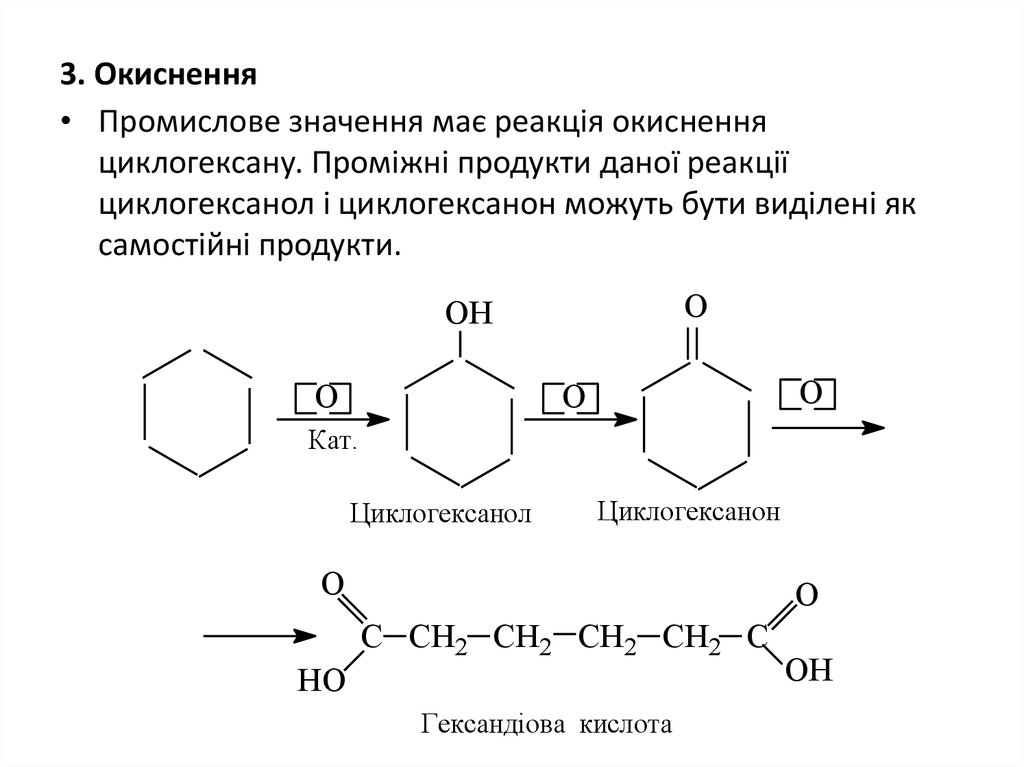
26. 3. Окиснення
• Промислове значення має реакція окисненняциклогексану. Проміжні продукти даної реакції
циклогексанол і циклогексанон можуть бути виділені як
самостійні продукти.
О
ОН
О
О
О
Кат.
Циклогексанол
Циклогексанон
О
О
С СН2 СН2 СН2 СН2 С
НО
Гександіова кислота
ОН
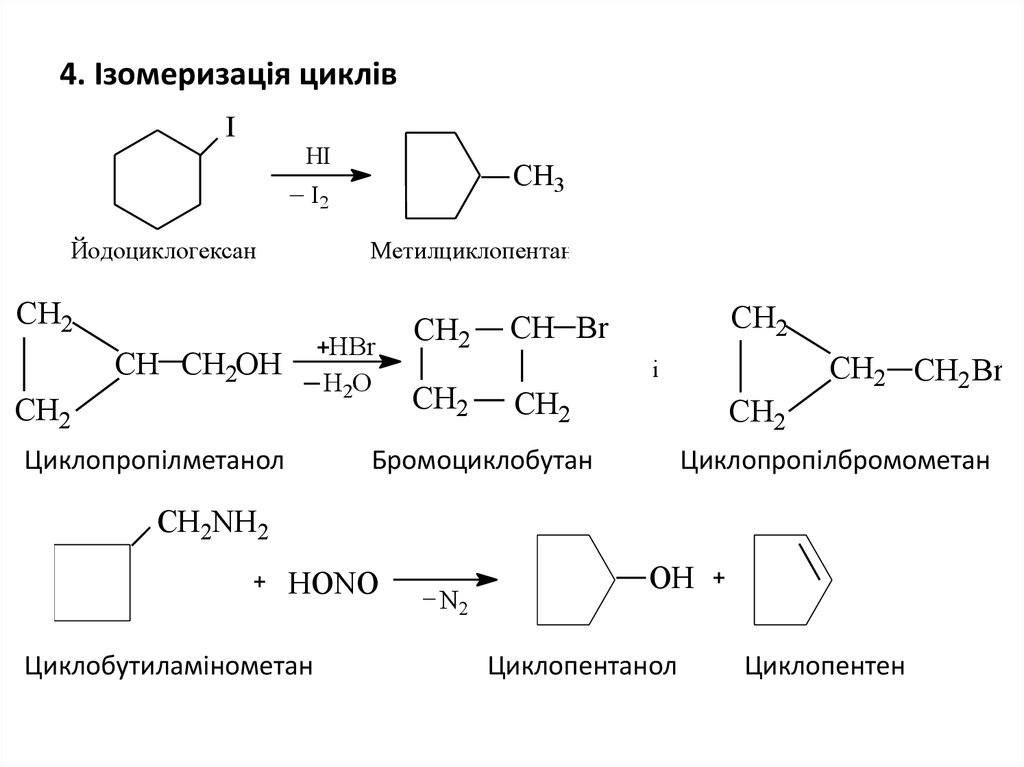
27. 4. Ізомеризація циклів
IНI
CH3
I2
Йодоциклогексан
Метилциклопентан
CH2
HBr
Н2О
CH CH2OH
CH2
Циклопропілметанол
CH2
CH2
CH2
CH Br
і
CH2
CH2
Бромоциклобутан
CH2 CH2 Br
Циклопропілбромометан
CH2NH2
HONO
Циклобутиламінометан
N2
ОН
Циклопентанол
Циклопентен
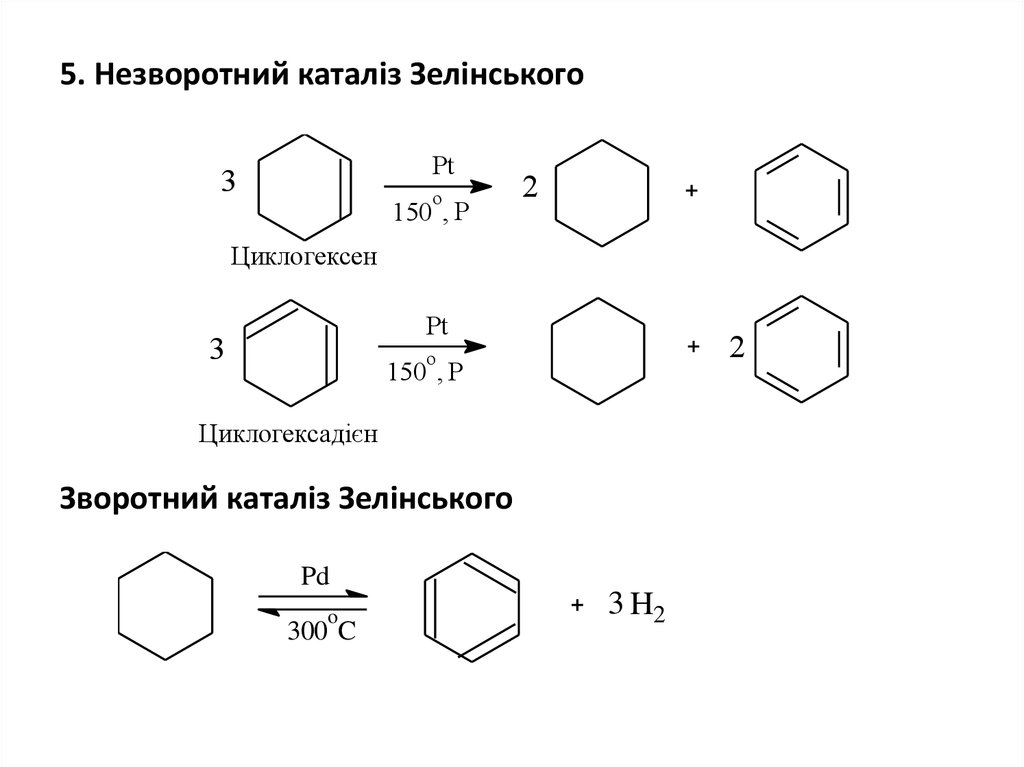
28. 5. Незворотний каталіз Зелінського
Pt3
o
150 , P
2
Циклогексен
Pt
3
2
o
150 , P
Циклогексадієн
Зворотний каталіз Зелінського
Pd
o
300 C
3 H2
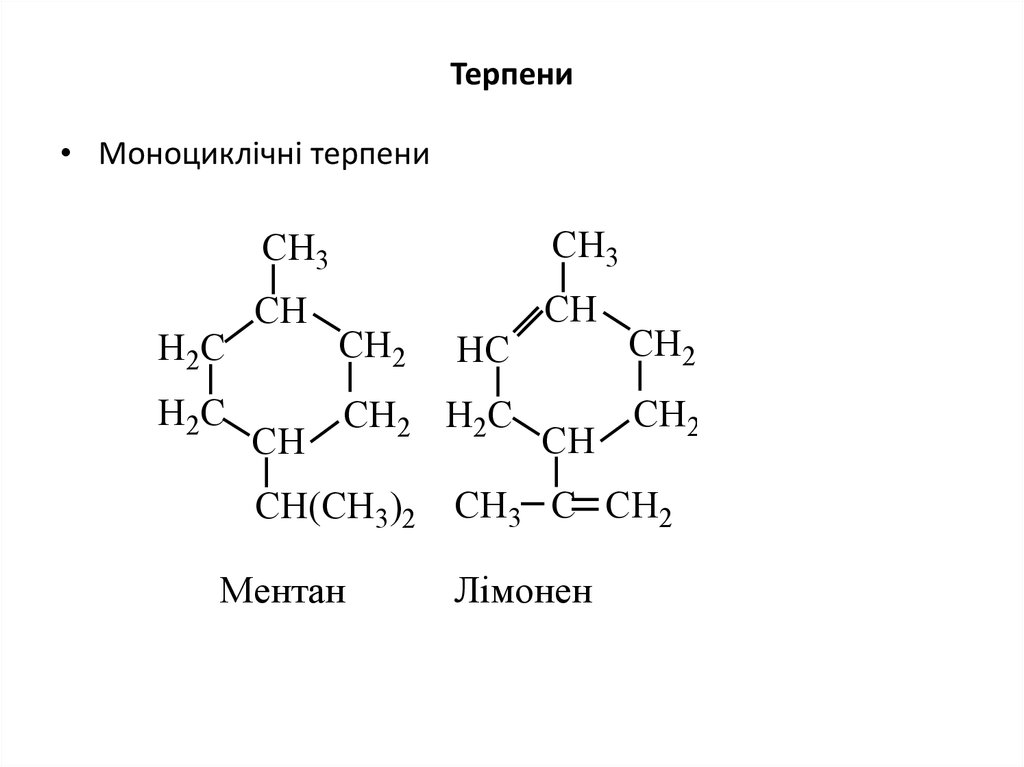
29. Терпени
• Моноциклічні терпениH2C
H2C
CH3
CH3
CH
CH
CH
CH2
HC
CH2 H2C
CH
CH2
CH2
CH(CH3)2 CH3 C CH2
Ментан
Лімонен
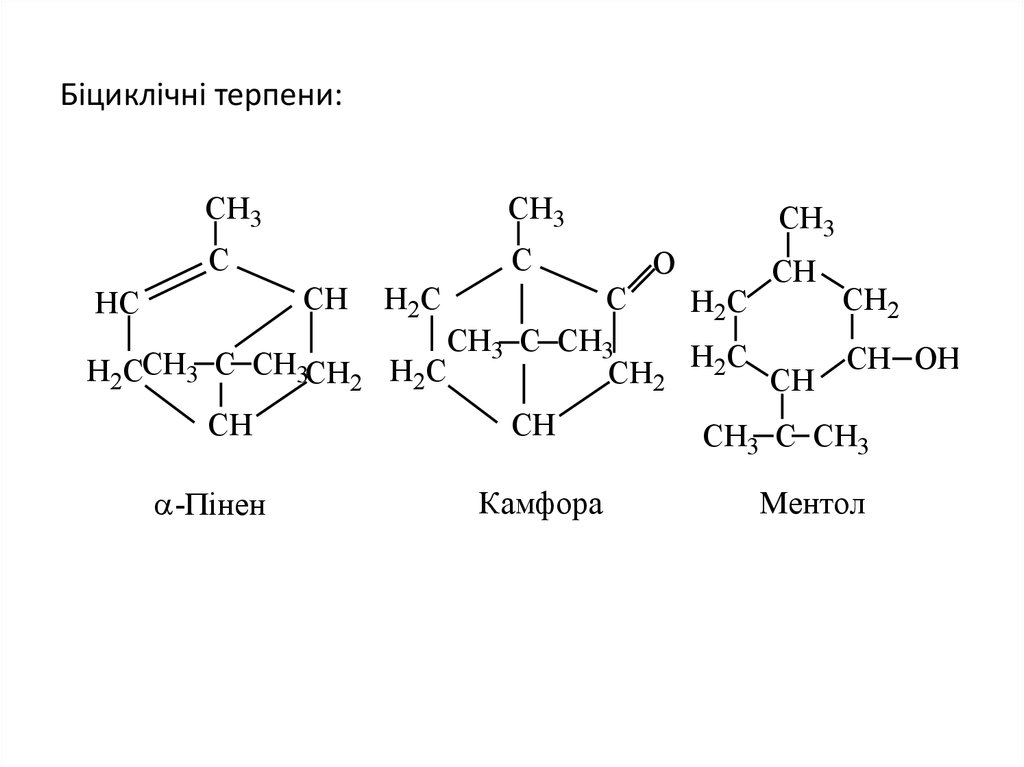
30. Біциклічні терпени:
CH3CH3
C
C
CH
HC
H2CCH3 C CH3CH2
CH
-Пінен
H2C
CH3
O
C
CH
H2C
CH2
CH3 C CH3
H2C
CH OH
H2C
CH2
CH
CH
CH C CH
3
Камфора
3
Ментол







 Химия
Химия








