Похожие презентации:
Алкени (етиленові вуглеводні, олефіни)
1. АЛКЕНИ (ЕТИЛЕНОВІ ВУГЛЕВОДНІ, ОЛЕФІНИ)
Алкенами називають вуглеводні, в молекулах яких міжвуглецевими атомами є один подвійний С═С-зв’язок.
Алкени утворюють гомологічний ряд загальної формули
СпН2n. Ряд починається з етену СН2═СН2, який, часто
називають етиленом.
НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ
За номенклатурою IUPAC назви алкенів утворюють від
назв відповідних алканів (з тим же числом атомів
вуглецю), шляхом заміни суфікса –ан на - ен.
СН3-СН3 ;
етан
СН2=СН2
етен
2.
Головний ланцюг вибирають так, щоб вінобов’язково включав подвійний зв’язок і
нумерацію головного ланцюга починають з того
кінця, до якого ближче подвійний зв’язок.
Місце знаходження подвійного зв’язку в
головному ланцюзі позначають локантом,
відповідно до того вуглецевого атома, де він
знаходиться. Цей локант прийнято ставити перед
назвою головного ланцюга (допускається і після
суфікса -ен)
3. Назви залишків алкенів (алкенільних груп) утворюються приєднанням до назви алкена закінчення –ил (іл).
етеніл (вініл),СН2=СН
3
2
СН3 СН СН 1-пропеніл,
1
СН2 СН СН2 2-пропеніл (аліл)
СН2=С
1-Метилетиніл (ізопропеніл),
СН3
4
3
2
1
CH3 CH=CH CH2
2-бутеніл (кротил),
4.
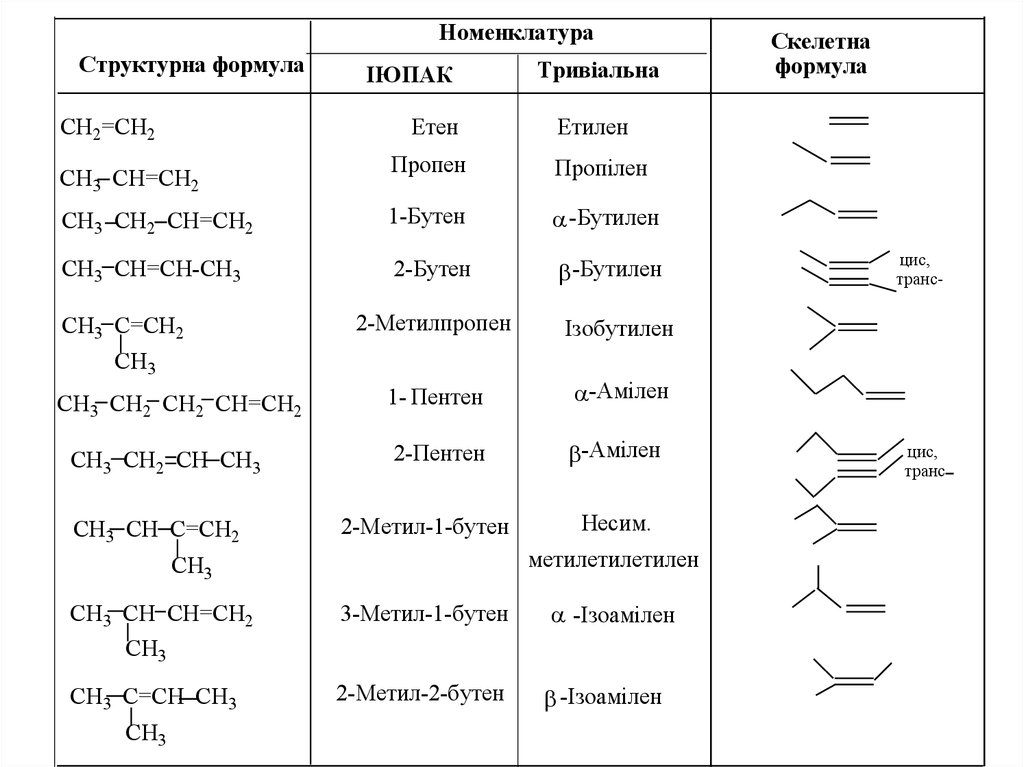
НоменклатураСтруктурна формула
СH2=CH2
ІЮПАК
Етен
Тривіальна
Етилен
Пропен
Пропілен
CH3 CH2 CH=CH2
1-Бутен
-Бутилен
CH3 CH=CH-CH3
2-Бутен
-Бутилен
СH3 CH=CH2
CH3 C=CH2
2-Метилпропен
Ізобутилен
1- Пентен
-Амілен
2-Пентен
-Амілен
CH3
CH3 CH2 CH2 CH=CH2
CH3 CH2 CH CH3
CH3 CH C=CH2
2-Метил-1-бутен
CH3 CH CH=CH2
Несим.
метилетилетилен
CH3
3-Метил-1-бутен
-Ізоамілен
CH3
CH3 C=CH CH3
CH3
2-Метил-2-бутен
Скелетна
формула
-Ізоамілен
цис,
транс-
цис,
транс
5. ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ
•ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ• 1. Дегідрування алканів
Дегідрування алканів відбувається при температурі до 600оС.
CH2=CH CH2 CH3 + H2
H3C CH2 CH2 CH3
Cr2O3
1-Бутен
o
300-450 C
СH3 СH=СH СH3 + H2
2-Бутен
CH3 CH CH3
CH3
Cr2O3
o
t C
CH2=C CH3
+ H2
CH3
2. Виділення з продуктів крекінгу нафти та природного газу
Газоподібні алкени - етилен, пропілен, бутилен виділяють з продуктів
термічного крекінгу нафтопродуктів. Вміст нижчих алкенів (особливо
етилену) в газах крекінгу тим вищий, чим вища температура крекінгу
та довший час нагрівання. Алкени також утворюються при піролізі
нафти та коксуванні кам’яного вугілля.
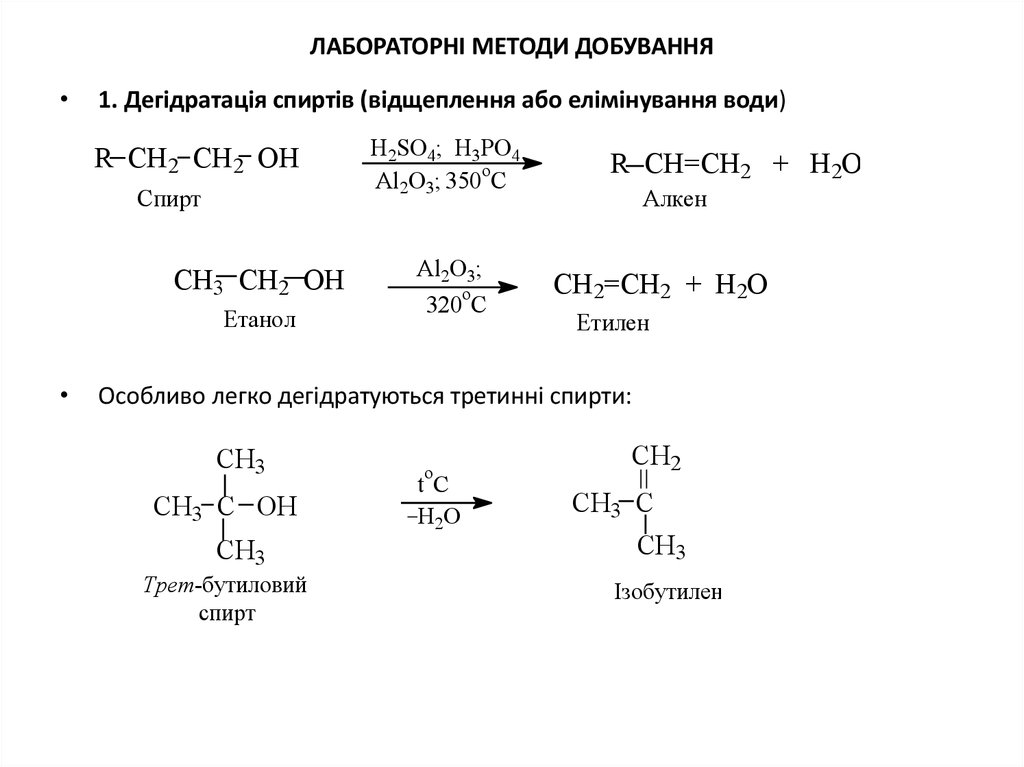
6. ЛАБОРАТОРНІ МЕТОДИ ДОБУВАННЯ
1. Дегідратація спиртів (відщеплення або елімінування води)
R CH2 CH2 OH
Спирт
СH3 СH2 OH
Етанол
H2SO4; H3PO4
o
Al2O3; 350 C
Al2O3;
o
320 C
R CH=CH2 + H2O
Алкен
CH2=CH2 + H2O
Етилен
Особливо легко дегідратуються третинні спирти:
CH3
СH3 C OH
CH3
Трет-бутиловий
спирт
o
tC
H2O
CH2
СH3 C
CH3
Ізобутилен
7.
2. Відщеплення галогеноводнів або галогенів від алкілгалогенідів
дегідрогалогенування і дегалогенування)
При дії на алкілгалогеніди спиртового розчину лугу утворюються алкени за
рахунок дегідрогалогенування:
CH3
CH3
3 2 1
KOH (спирт)
H3С С СH2
СH3 С=СH2
-HCI
2-Метилпропен
H CI
2-Метил-1хлорoпропан
Можливе також термічне відщеплення галогеноводню (при нагріванні):
o
R CH2 CH2 CI
(Ізобутилен)
tC
R CH=CH2 + HCI
Під дією Zn, солей Cr (II), або LiAlH4, можна одержати алкени з дигалогенопохідних:
R CH CH 2
CI CI
Zn
o
t
R CH=CH2 + ZnCI2
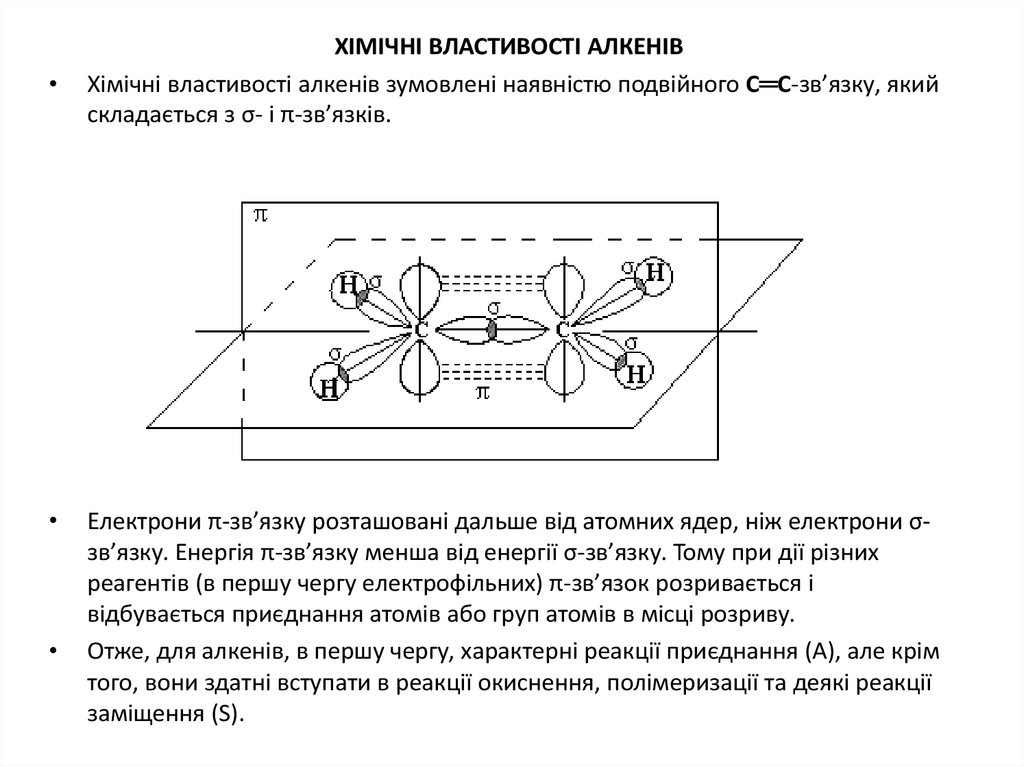
8. ХІМІЧНІ ВЛАСТИВОСТІ АЛКЕНІВ
ХІМІЧНІ ВЛАСТИВОСТІ АЛКЕНІВ
Хімічні властивості алкенів зумовлені наявністю подвійного С═С-зв’язку, який
складається з σ- і π-зв’язків.
Електрони π-зв’язку розташовані дальше від атомних ядер, ніж електрони σзв’язку. Енергія π-зв’язку менша від енергії σ-зв’язку. Тому при дії різних
реагентів (в першу чергу електрофільних) π-зв’язок розривається і
відбувається приєднання атомів або груп атомів в місці розриву.
Отже, для алкенів, в першу чергу, характерні реакції приєднання (А), але крім
того, вони здатні вступати в реакції окиснення, полімеризації та деякі реакції
заміщення (S).
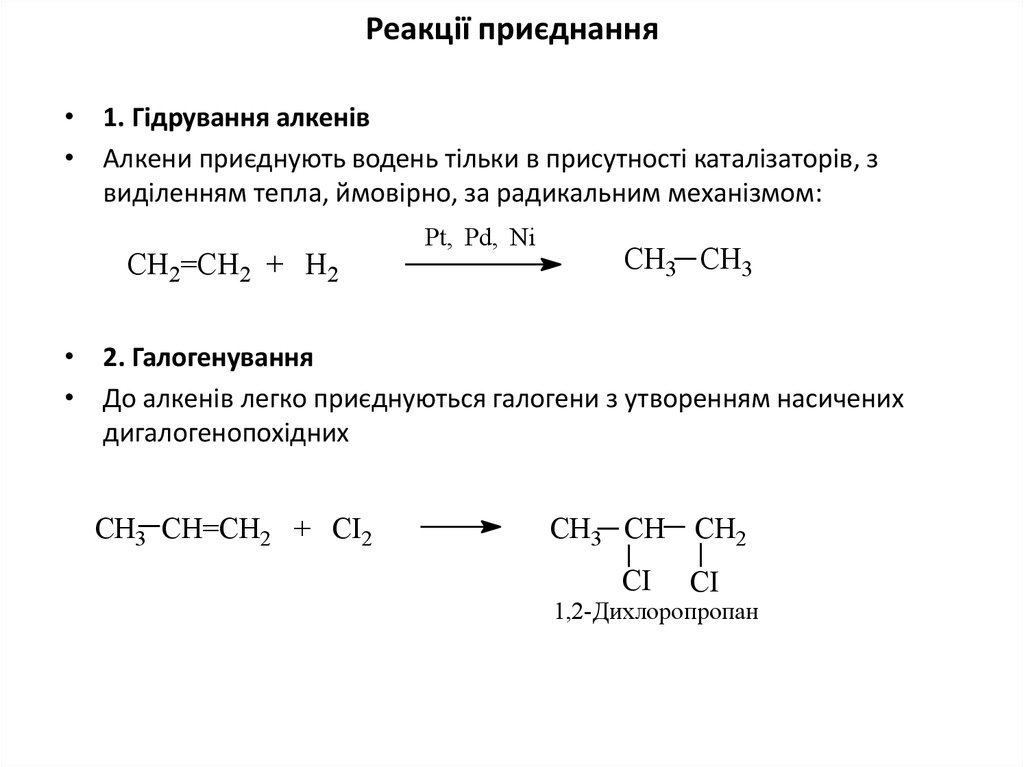
9. Реакції приєднання
• 1. Гідрування алкенів• Алкени приєднують водень тільки в присутності каталізаторів, з
виділенням тепла, ймовірно, за радикальним механізмом:
СН2=СН2 + Н2
Pt, Pd, Ni
CH3 CH3
• 2. Галогенування
• До алкенів легко приєднуються галогени з утворенням насичених
дигалогенопохідних
СН3 СН=СН2 + СІ2
СН3 СН СН2
CI
CI
1,2-Дихлорoпропан
10.
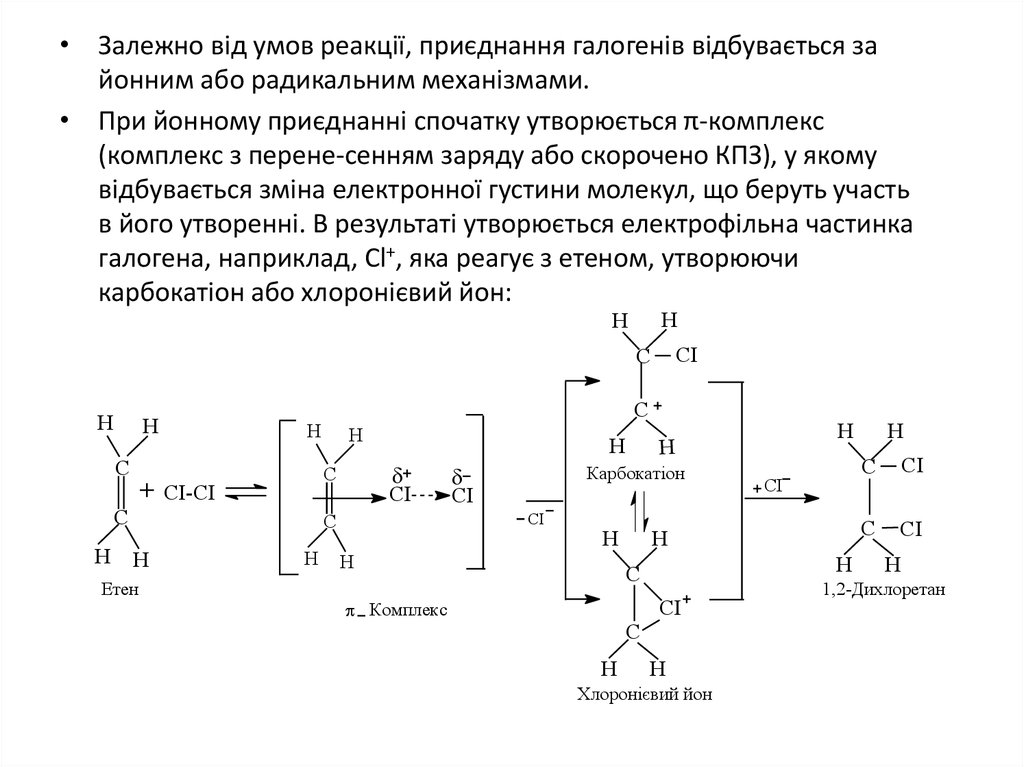
• Залежно від умов реакції, приєднання галогенів відбувається зайонним або радикальним механізмами.
• При йонному приєднанні спочатку утворюється π-комплекс
(комплекс з перене-сенням заряду або скорочено КПЗ), у якому
відбувається зміна електронної густини молекул, що беруть участь
в його утворенні. В результаті утворюється електрофільна частинка
галогена, наприклад, Сl+, яка реагує з етеном, утворюючи
карбокатіон або хлоронієвий йон:
H
H
CI
C
H
H
C
H
C
H
CI
C
CI-CI
H
C
H
Етен
H
Карбокатіон
CI
C
H
CI
H
H
C
Комплекс
C
H
CI
H
H
CI
H
Хлоронієвий йон
H
H
H
C
CI
C
CI
H
1,2-Дихлоретан
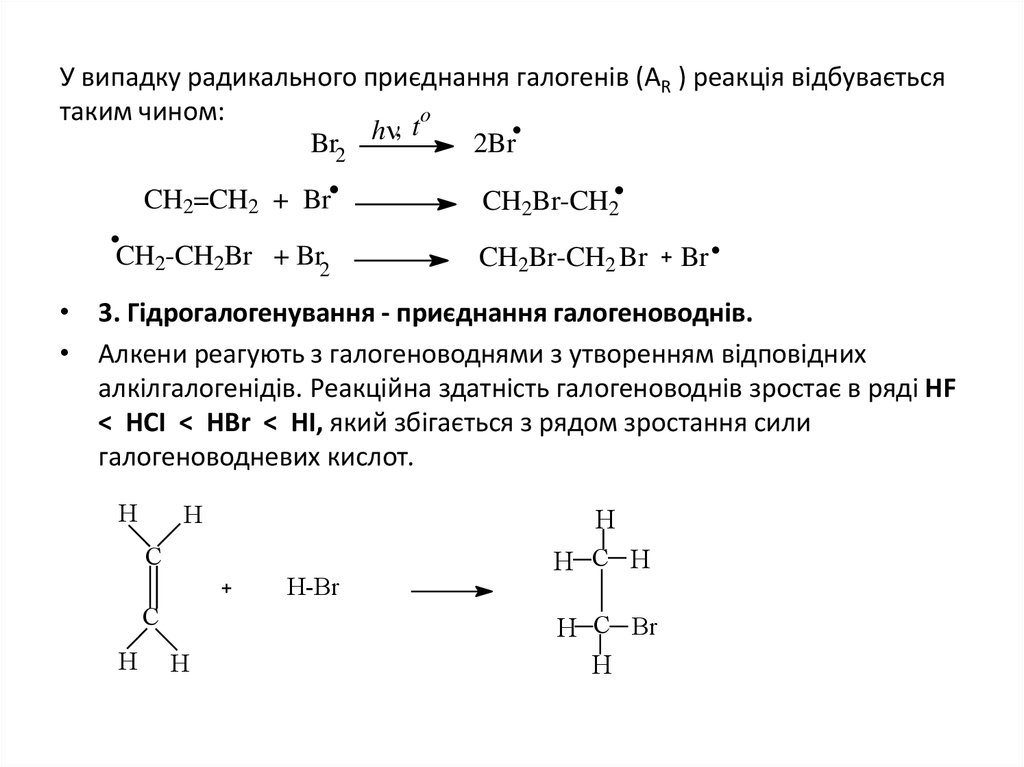
11. У випадку радикального приєднання галогенів (АR ) реакція відбувається таким чином:
У випадку радикального приєднання галогенів (АR ) реакція відбуваєтьсятаким чином:
o
,t
h
Br2
2Br
CH2=CH2 + Br
CH2-CH2Br + Br2
CH2Br-CH2
CH2Br-CH2 Br
Br
• 3. Гідрогалогенування - приєднання галогеноводнів.
• Алкени реагують з галогеноводнями з утворенням відповідних
алкілгалогенідів. Реакційна здатність галогеноводнів зростає в ряді HF
< HCI < HBr < HI, який збігається з рядом зростання сили
галогеноводневих кислот.
H
H
H
C
H-Br
C
H
H
H C H
H C Br
H
12. Правило В.В.Марковнікова – у випадку приєднання галогеноводнів до несимет-ричних алкенів, водень приєднується до найбільш
Правило В.В.Марковнікова – у випадку приєднання галогеноводнів до несиметричних алкенів, водень приєднується до найбільш «гідрованого» ненасиченогоатома вуглецю, тобто, до того, у якого більше атомів водню:
CH3-CH=CH2 + H-Br
CH3-CH-CH2
Пропен
Br H
2-Бромoпропан
Правило Марковнікова реалізується при йонному механізмі реакції (АE).
Пояснення цього правила можна дати, розглядаючи стабільність проміжних
карбокатіонів. Інтермедіат (1) вторинний карбкатіон буде стабільніший ніж (2)
за рахунок кращої делокалізації його позитивного заряду:
H
H
H C CH C H
H
CH3-CH=CH2 + H
r
CH3-CH-CH3
2-Бромопропан
r
H
1
Н Н
H C C CH2
Н Н
2
r
CH3-CH2-CH2
r
1-Бромопропан
13.
• Пероксидний ефект М.Караша (1933). При радикальному механізміприєднання галогеноводнів завжди відбувається проти правила
Марковнікова. Цей механізм реалізується в присутності пероксиду
водню.
• На першій стадії утворюється атомарний бром, який являє собою
вільний радикал:
H2O2 2 HBr
2Br
2H2O
CH3-CH-CH2Br
CH3-CH=CH2 + Br
1
CH3-CH2Br-CH2
2
CH3 CH CH2Br + H Br
CH3 CH2 CH2Br + Br
14. 4. Гідратація алкенів відбувається у присутності кислот за правилом Марковнікова
Каталізатором процесу служить конц. сульфатна кислота
OH
СН3
H2SO4
CH3 C CH3
С=СН2 + Н-ОH
CH3
Ізобутилен
CH3
Трет-бутиловий спирт
(2-Метилпропанол-2)
Розроблені економічно вигідніші методи гідратації на твердих каталізаторах
без H2SO4:
СН2=СН2 + Н2О
10МПа, Н3РО4/SiO2
o
300 C
CH3CH2OH
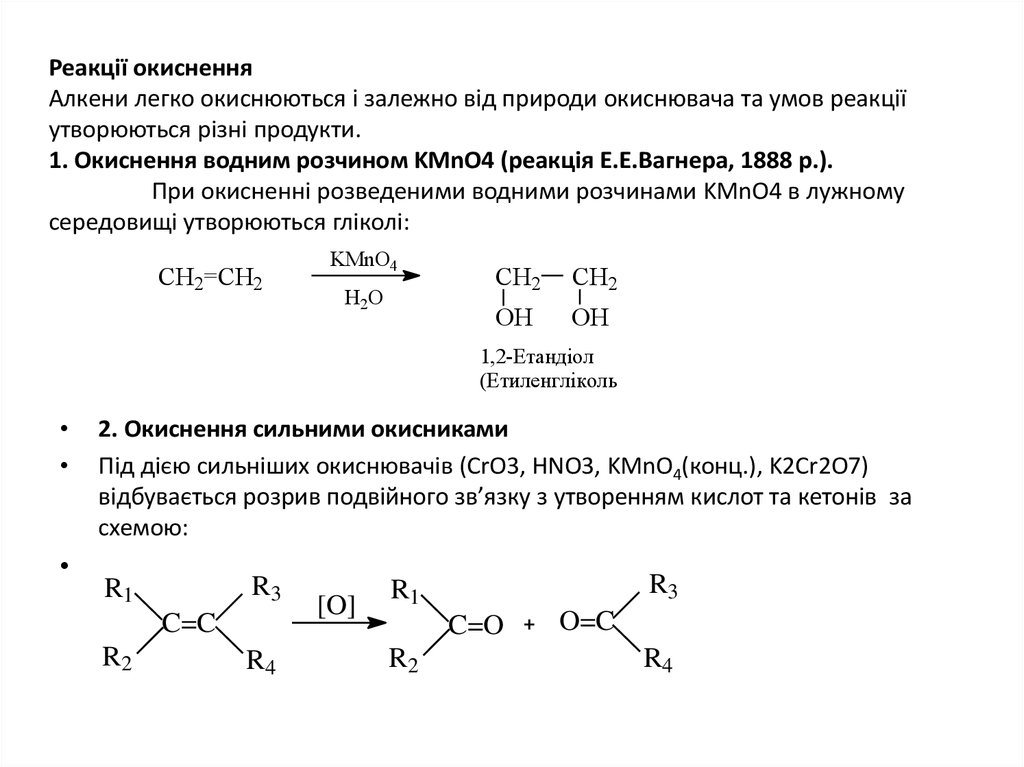
15. Реакції окиснення Алкени легко окиснюються і залежно від природи окиснювача та умов реакції утворюються різні продукти. 1.
Реакції окисненняАлкени легко окиснюються і залежно від природи окиснювача та умов реакції
утворюються різні продукти.
1. Окиснення водним розчином KMnO4 (реакція Е.Е.Вагнера, 1888 р.).
При окисненні розведеними водними розчинами KMnO4 в лужному
середовищі утворюються гліколі:
CH2=CH2
KMnO4
H2O
CH2
CH2
OH
OH
1,2-Етандіол
(Етиленгліколь)
2. Окиснення сильними окисниками
Під дією сильніших окиснювачів (CrO3, HNO3, KMnO4(конц.), K2Cr2O7)
відбувається розрив подвійного зв’язку з утворенням кислот та кетонів за
схемою:
R3
R1
C=C
R2
R4
[O]
R3
R1
C=O
R2
O=C
R4
16. 3. Окиснення молекулярним киснем Окиснення алкенів киснем протікає різними шляхами, залежно від умов реакції. 3.1. Без
каталізатора - окиснення напрямлене на розрив β-С-Н-зв’язку зутворенням гідропероксидів, які далі розпадаються на спирти та альдегіди.
СН2=С СН2
Н
О2
СН2=СН СН2 ОО Н
Н
Гідропероксид алілу
Розклад
СН2 СН
Акролеїн
С
О
Н
Н2О
3.2. У присутності каталізаторів одержують органічні оксиди (епоксиди)
2 CH2=CH2 + О2
Ag
2 CH2 CH2
О
Оксид етилену
17. 3. Окиснення озоном (озонування за Гаррієсом) Реакцію озонування використовують для встановлення будови алкенів і вона завжди
протікає селективно за місцем подвійного зв'язку з утвореннямпероксиду водню, та карбонільних сполук (альдегідів або кетонів).
СН3-СН2-СН-СН-СН3 Перегрупування
CH3-СН2-СН=СН-СН3 О3
Мольозонід
(нестійкий)
CH3-СН2-СН-О-СН-СН3
O
O
Озонід
НОН
О3
О
О
CH
-СН
-С
+
С-СН3
Н2О2 +
3
2
Н
Н
Водню
пероксид
Пропіоновий
альдегід
Оцтовий
альдегід
4. Окиснення в присутності солей паладію
Окиснення алкенів в присутності солей Pd (II) і води також приводить до
утворення карбонільних сполук типу альдегідів або кетонів, але за іншою
схемою:
CH2=CH2 + Н2О + РdCI2
СН3-С
О
+ 2HCI + Pd
Н
18. Реакції заміщення
Реакції заміщення• Цей тип реакцій не є характерним для алкенів. Їх слід розглядати як
виняток, вони протікають за участю β-С-Н-зв’язків.
До них відноситься так звана реакція аномального хлорування
пропену:
o
СН2=СН СН3
CI2
500 C
СН2=СН CH2 CI
3-Хлоропропен
(алілхлорид)
HCl
19. Реакції полімеризації
Молекули алкенів здатні приєднуватися одна до одної за рахунок
розщеплення
π-зв'язків з утворенням димерів, тримерів тощо (реакція олігомеризації), або
полімерів (реакція полімеризації).
Полімери характеризуються великою молекулярною масою і
відносяться до високомолекулярних сполук (ВМС). Їх молекулярна маса рівна
кільком десяткам і, навіть, сотеням тисяч а.о.м. На загал до ВМС відносяться
сполуки, молекулярна маса яких перевищує 20000 а.о.м. У випадку утворення
сполук молекулярної маси 500-20000, реакція називається олігомеризацією
Реакцією полімеризації з етилену синтезують поліетилен за схемою:
• n СН2 = СН2 → (─СН2─СН2─)n
Етилен
(мономер)
Поліетилен
(полімер)
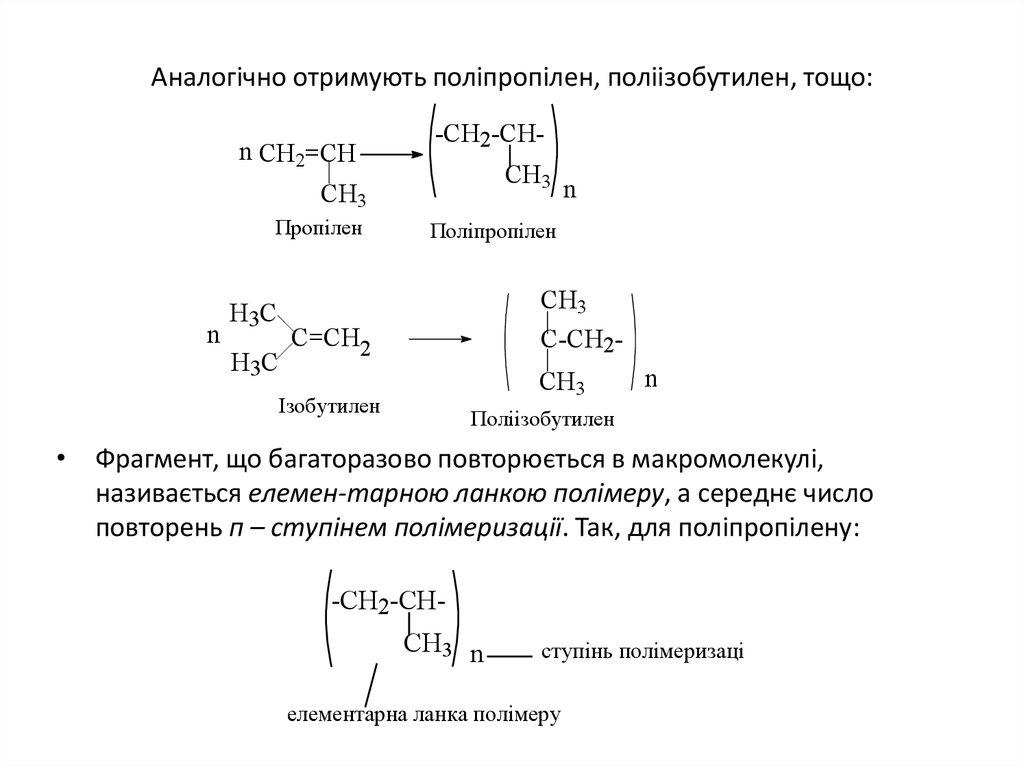
20. Аналогічно отримують поліпропілен, поліізобутилен, тощо:
n CH2=CH-CH2-CHCH3
CH3
Пропілен
n
n
Поліпропілен
CH3
Н 3С
Н 3С
C=CH2
C-CH2CH3
Ізобутилен
n
Поліізобутилен
• Фрагмент, що багаторазово повторюється в макромолекулі,
називається елемен-тарною ланкою полімеру, а середнє число
повторень п – ступінем полімеризації. Так, для поліпропілену:
-CH2-CHCH3 n
ступінь полімеризації
елементарна ланка полімеру












 Химия
Химия








