Похожие презентации:
Непредельные углеводороды. (Лекция 6)
1. Непредельные углеводороды
2. Алкены
– это ненасыщенные углеводородыобщей формулы СnH2n, имеющие в своем
составе одну двойную связь.
Изомерия
структурная (углеродного скелета,
положения кратной связи, межклассовая);
пространственная (геометрическая).
3. Способы получения алкенов
Дегидрирование предельных углеводородовДегалогенирование дигалогеналканов
4. Способы получения алкенов
Дегалогенирование галогеналкановДегидратация спиртов
5. Химические свойства алкенов
Реакции электрофильногоприсоединения (AdE);
Реакции окисления;
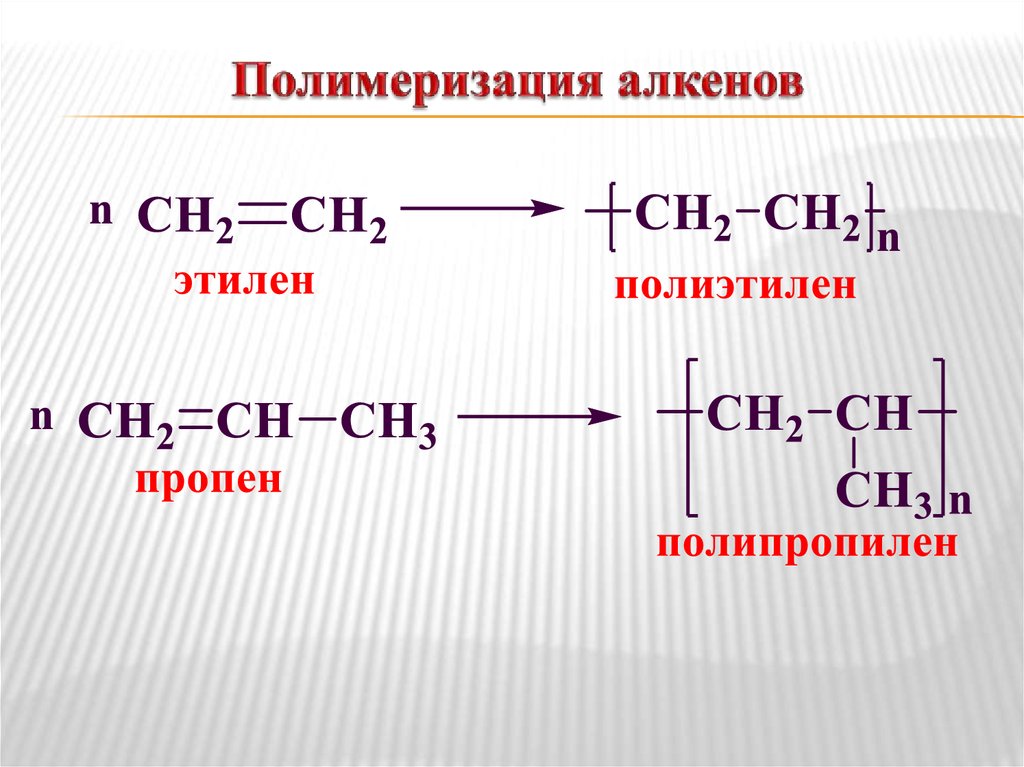
Реакции полимеризации.
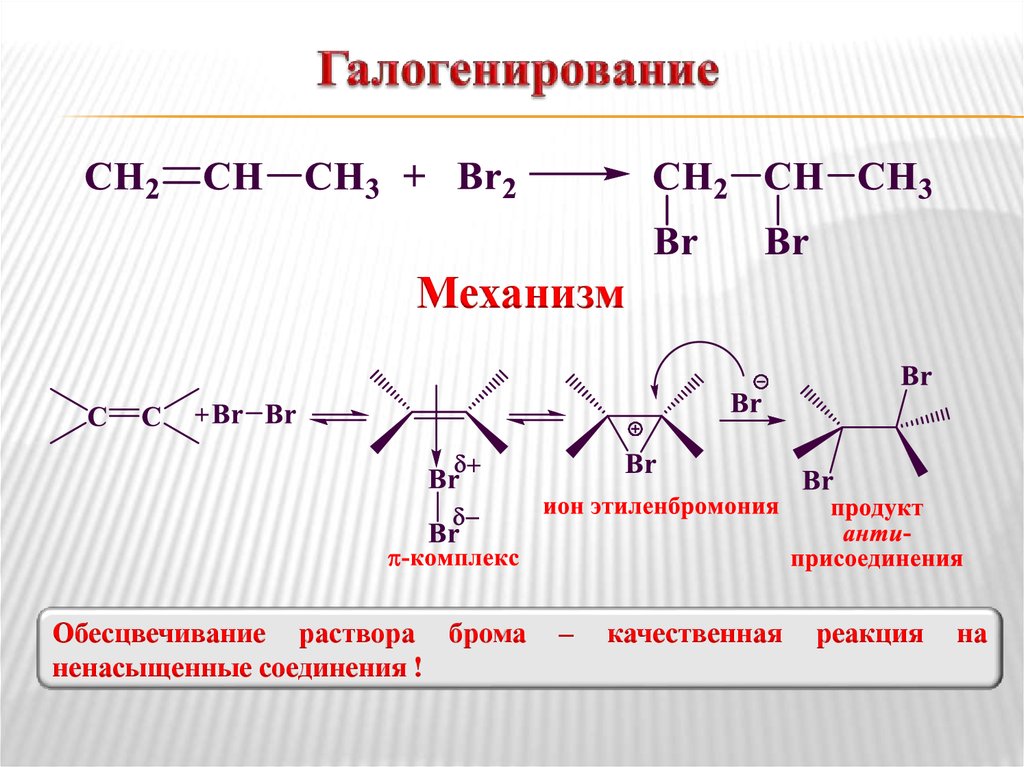
6. Галогенирование
МеханизмОбесцвечивание раствора брома
ненасыщенные соединения !
–
качественная
реакция
на
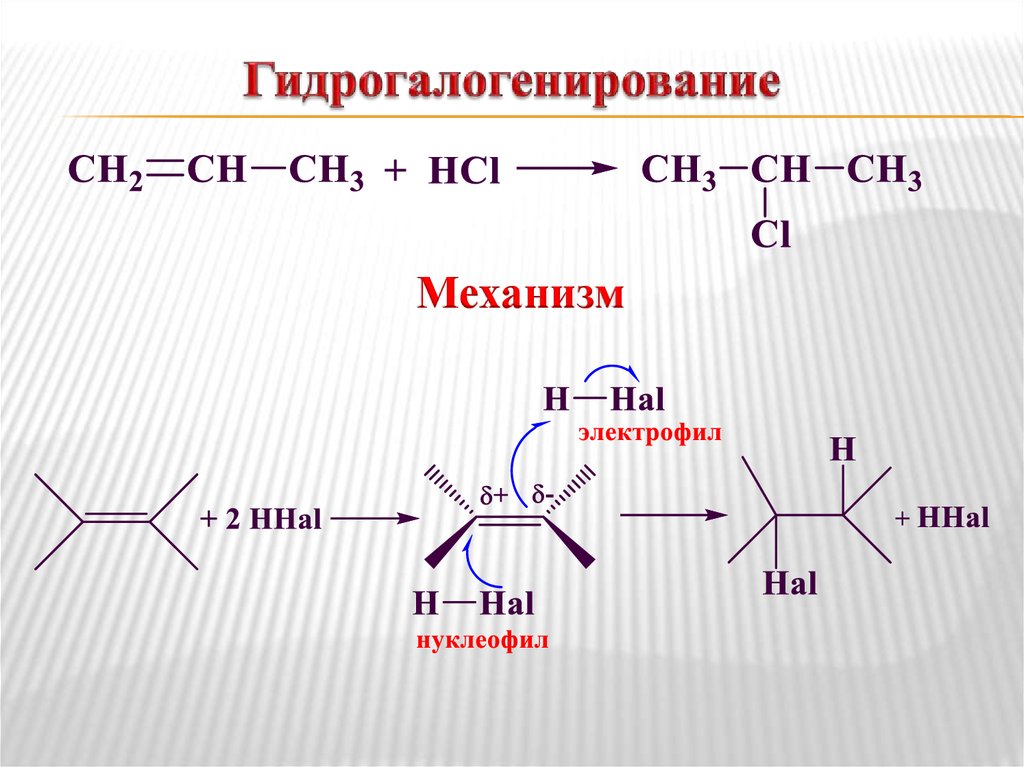
7. Гидрогалогенирование
Механизм8. Региоселективность гидрогалогенирования
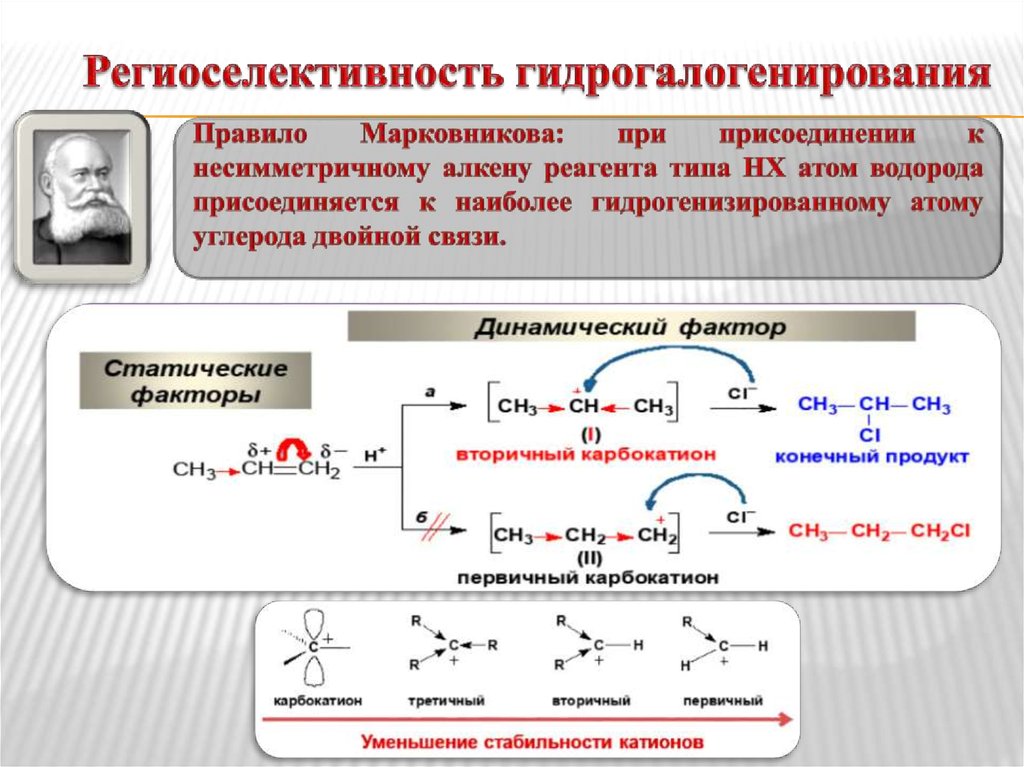
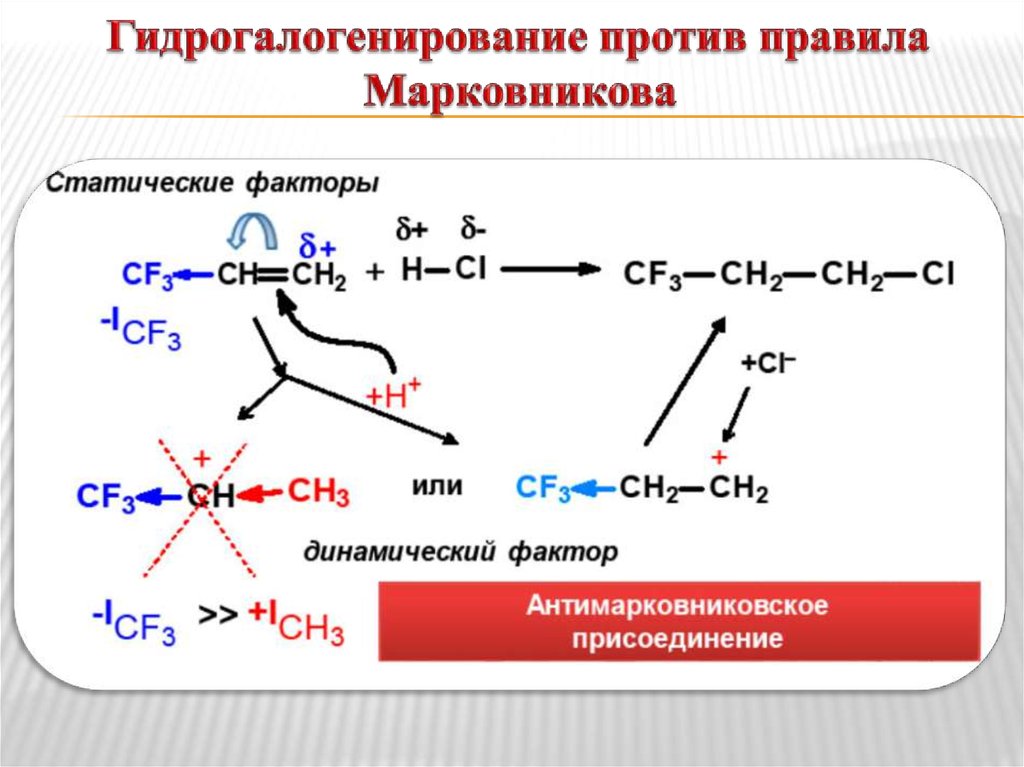
9. Гидрогалогенирование против правила Марковникова
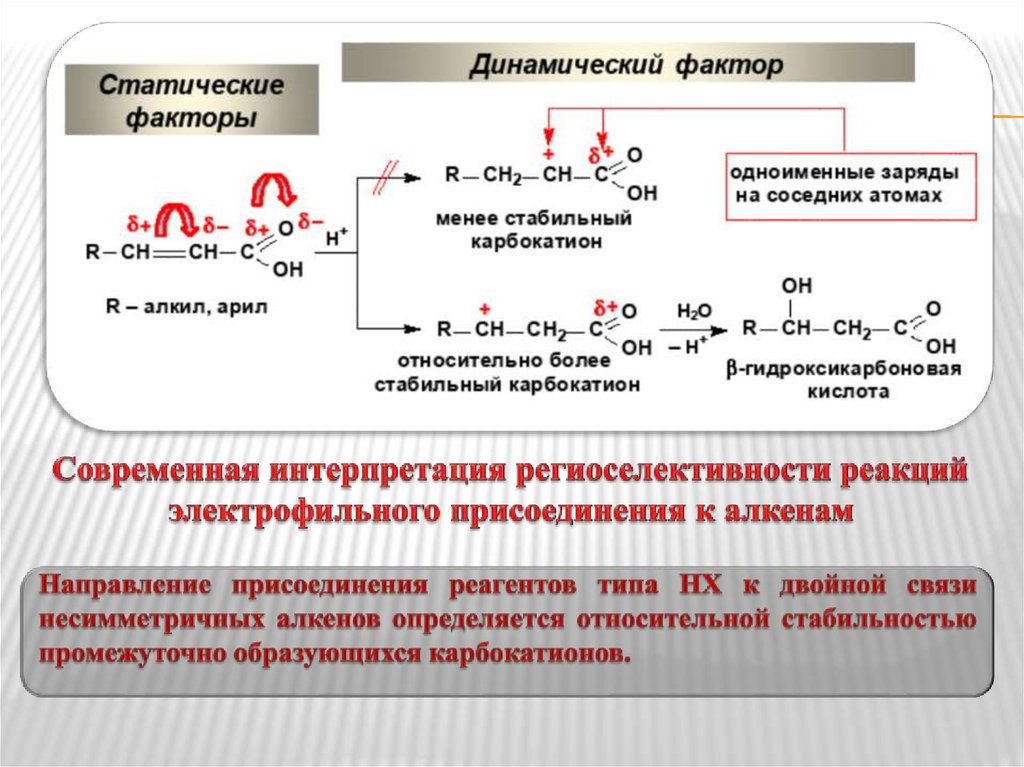
10. Современная интерпретация региоселективности реакций электрофильного присоединения к алкенам
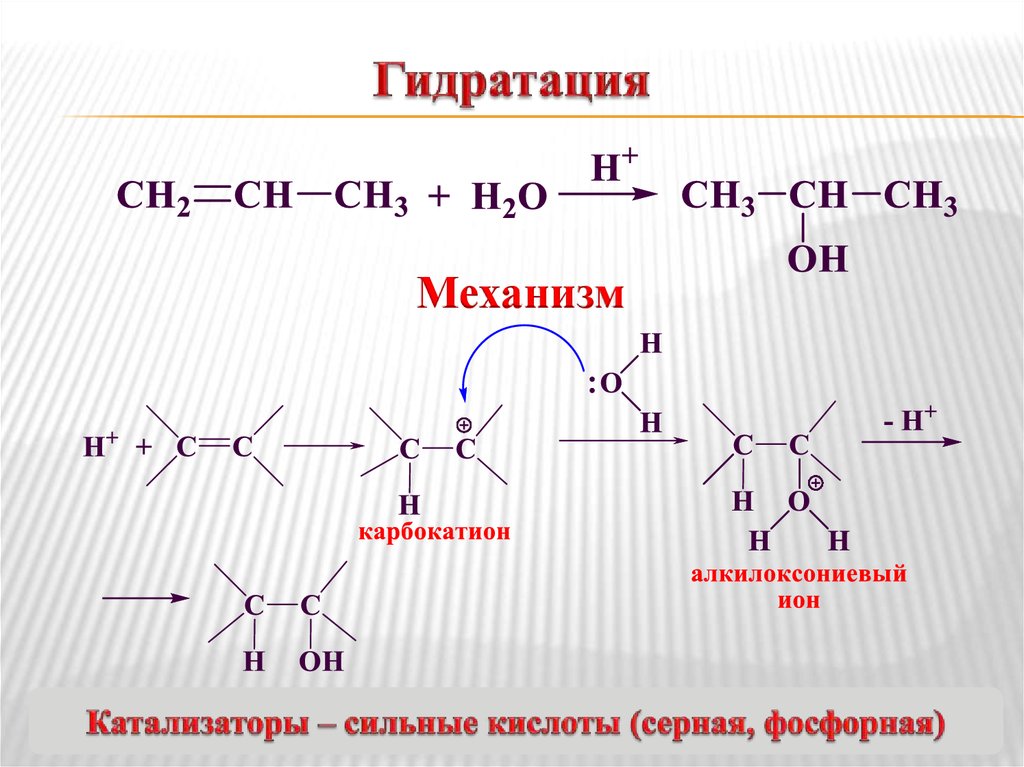
11. Гидратация
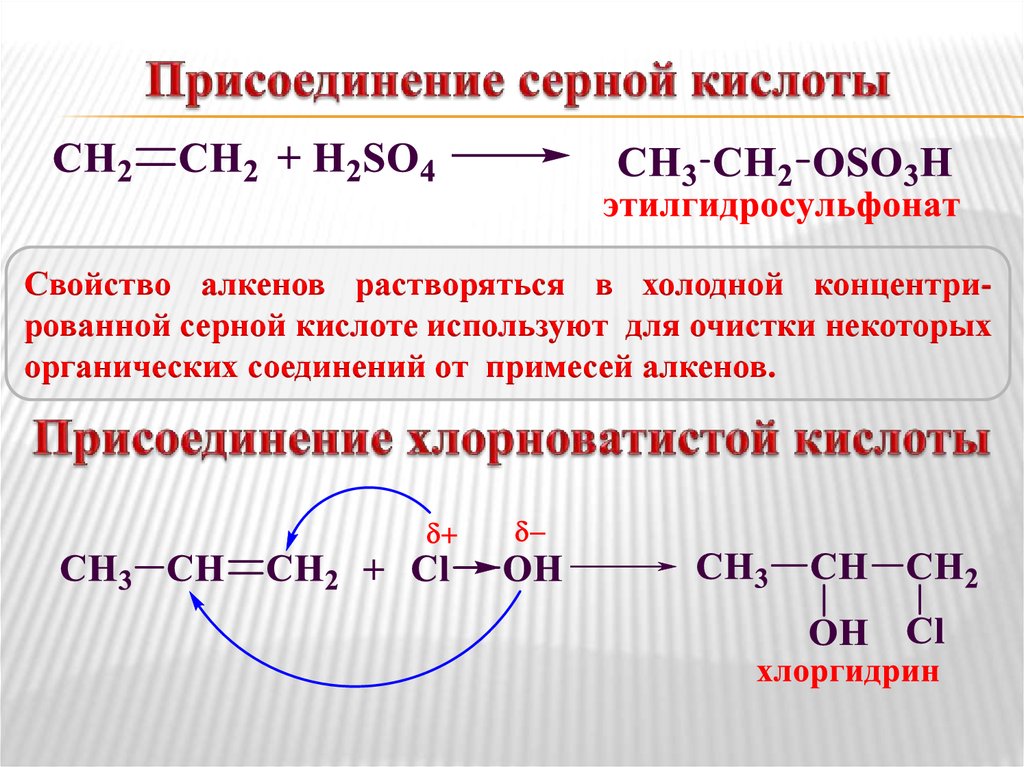
Механизм12. Присоединение серной кислоты
Свойство алкенов растворяться в холодной концентрированной серной кислоте используют для очистки некоторыхорганических соединений от примесей алкенов.
13. Сравнительная оценка реакционной способности алкенов в AdE-реакциях
Чем больше электронная плотность между атомамиуглерода, образующими двойную связь, тем легче
протекает электрофильное присоединение.
Донорные заместители увеличивают электронную
плотность двойной связи и ускоряют реакцию;
Акцепторные заместители уменьшают электронную
плотность двойной связи и замедляют реакцию.
Увеличение реакционной способности в AdE-реакциях
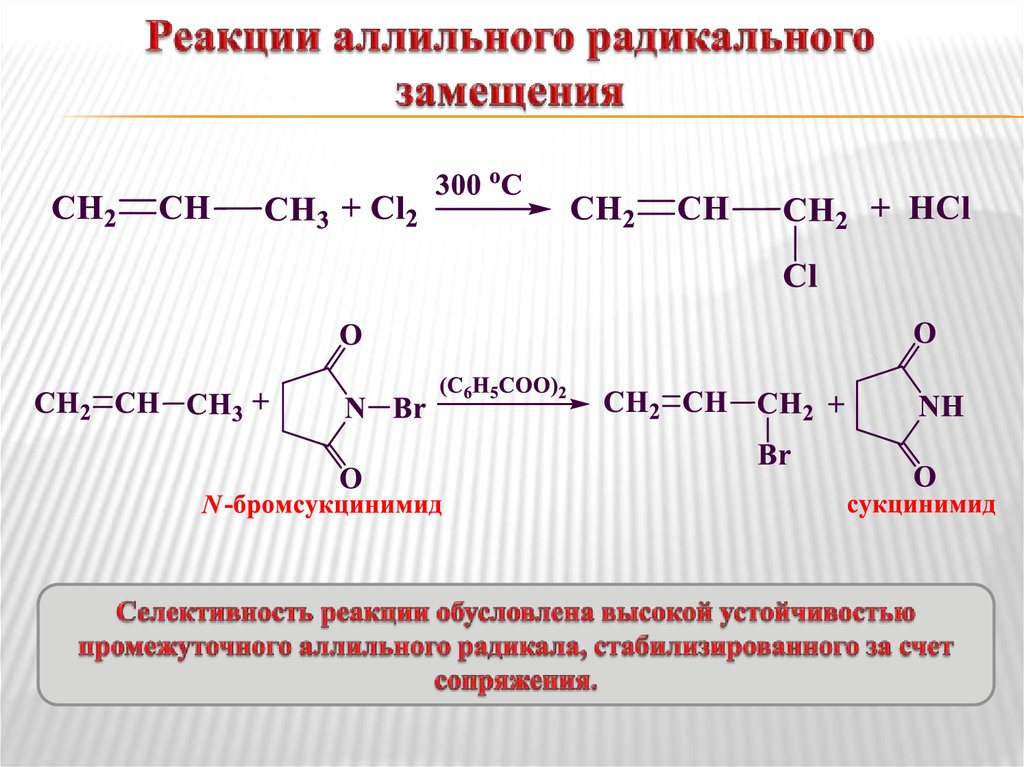
14. Реакции аллильного радикального замещения
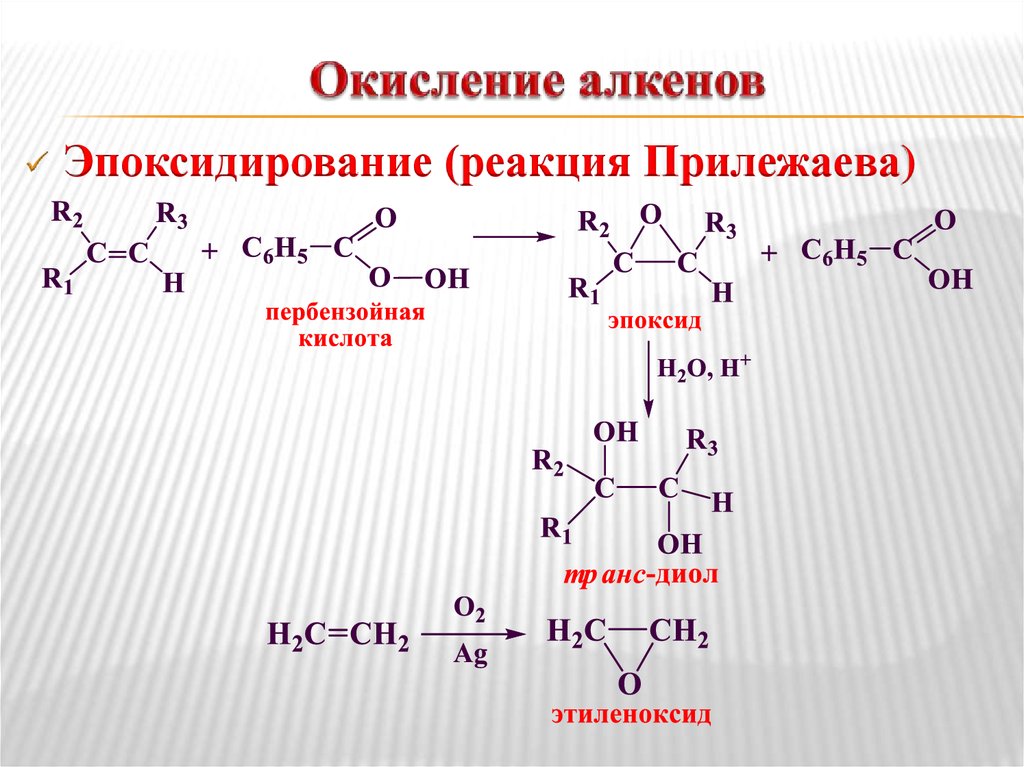
15. Окисление алкенов
Эпоксидирование (реакция Прилежаева)16. Окисление алкенов
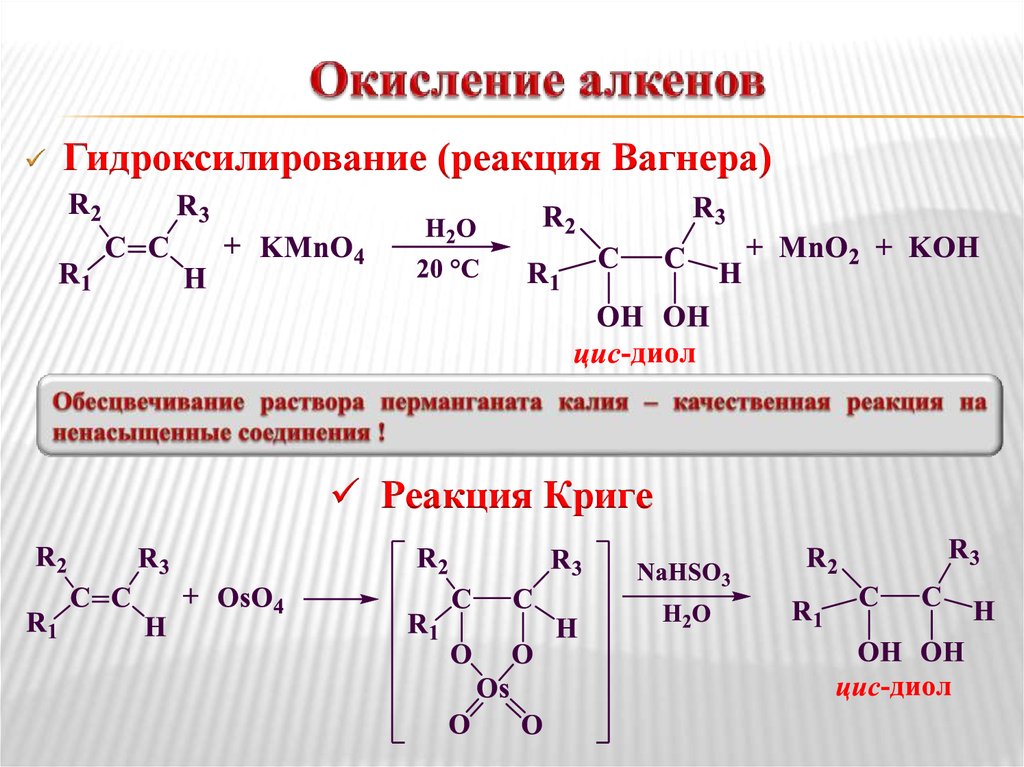
Гидроксилирование (реакция Вагнера)Реакция Криге
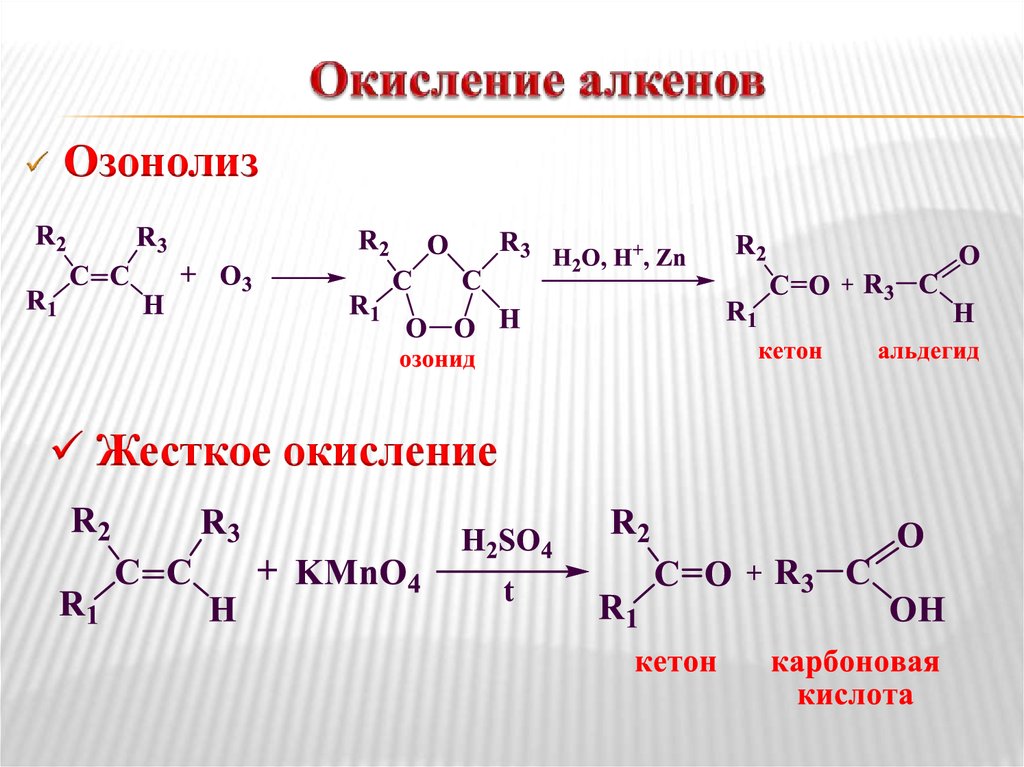
17. Окисление алкенов
ОзонолизЖесткое окисление
18. Полимеризация алкенов
19. Алкадиены
– это ненасыщенные углеводороды общей формулы СnH2n-2, имеющие всвоем составе две двойные связи.
Типы диенов
кумулированные ( С=С=С );
сопряженные ( С=С–С=С );
изолированные ( С=С–(СН2)n–С=С, n 1 ).
20. Способы получения алкадиенов
Реакции элиминирования(дегидрогалогенирование, дегидратация)
Реакция Лебедева (получение бутадиена-1,3)
21. Химические свойства алкадиенов
Сопряженные алкадиены более реакционноспособны вреакциях электрофильного присоединения. Эти реакции
имеют некоторые особенности.
22. Реакции электрофильного присоединения
Соотношение продуктов 1,2- и 1,4-присоединения определяетсятемпературой реакции. При низких температурах (ниже 0оС)
преобладает продукт 1,2-присоединения, при более высоких
температурах – продукт 1,4-присоединения.
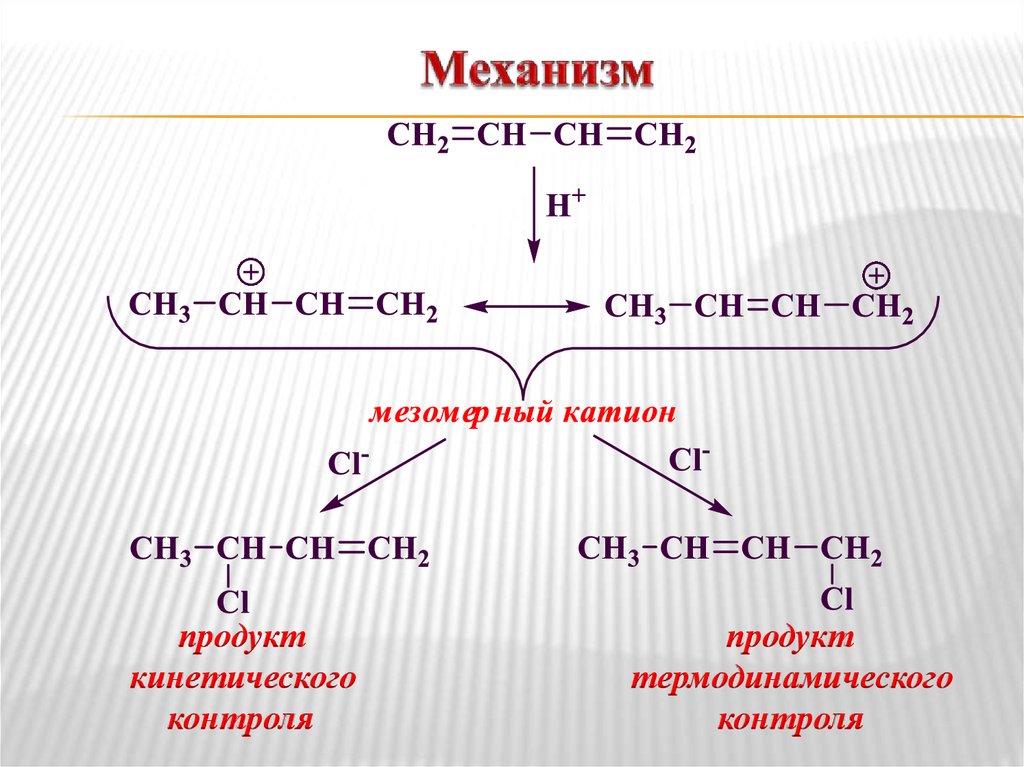
23. Механизм
продукткинетического
контроля
продукт
термодинамического
контроля
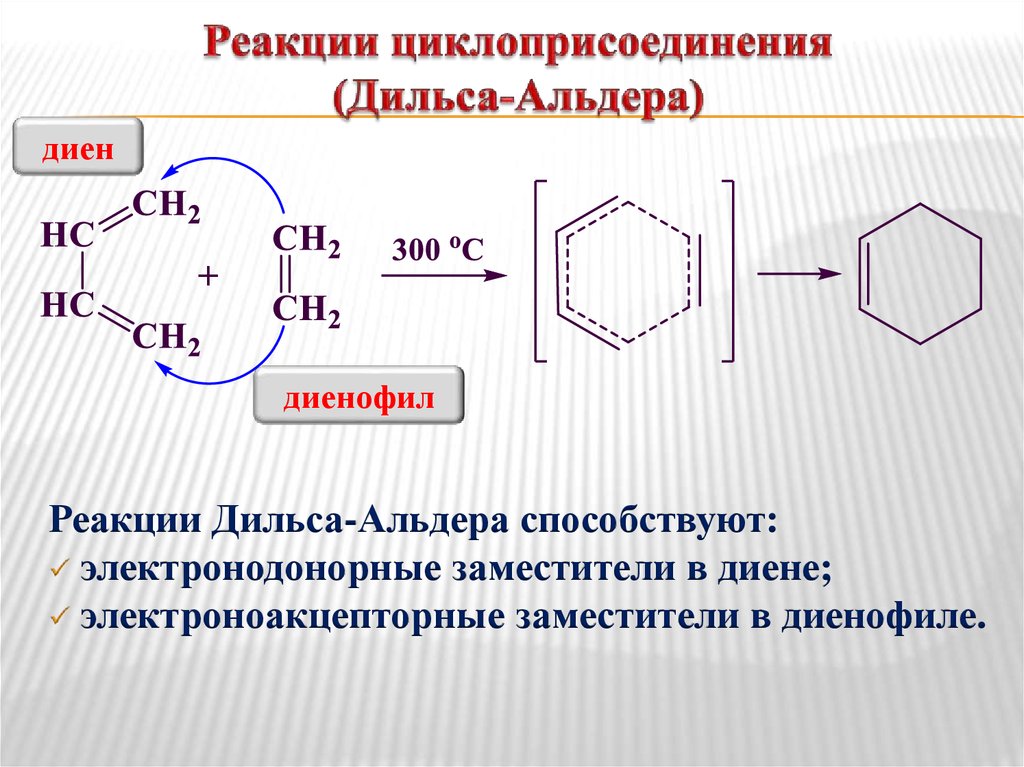
24. Реакции циклоприсоединения (Дильса-Альдера)
диендиенофил
Реакции Дильса-Альдера способствуют:
электронодонорные заместители в диене;
электроноакцепторные заместители в диенофиле.
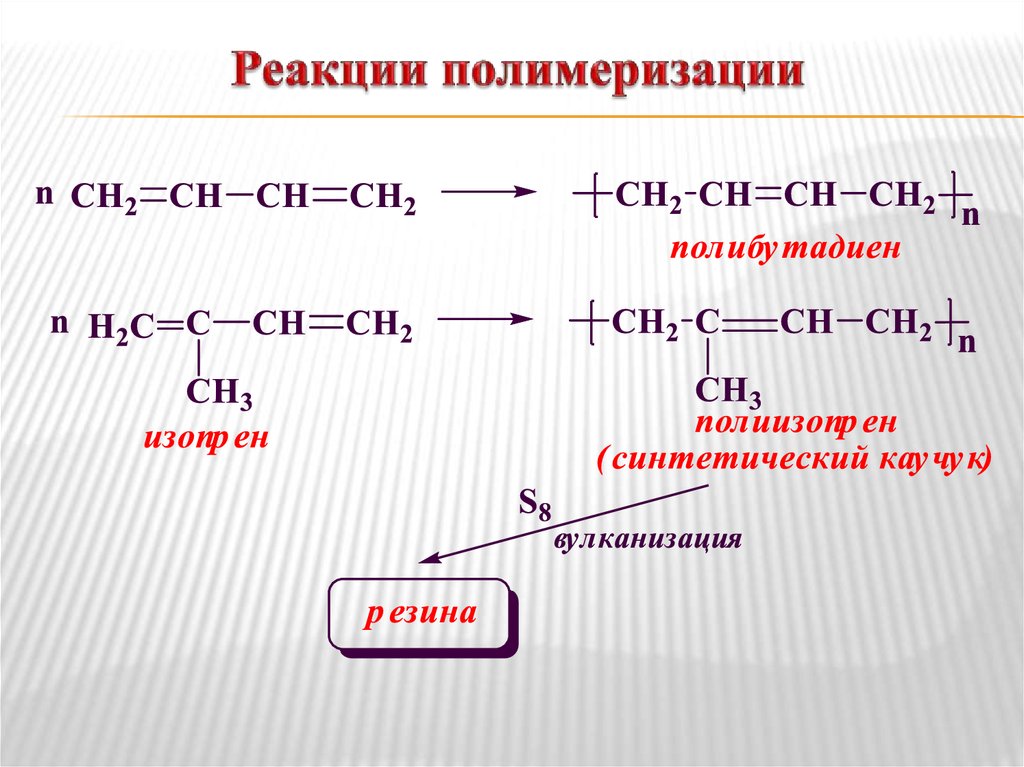
25. Реакции полимеризации
26. Алкины
– это ненасыщенные углеводородыобщей формулы СnH2n-2, имеющие в своем
составе одну тройную связь.
Изомерия
углеродного скелета;
положения тройной связи.
Алкины, имеющие концевую тройную связь,
называются терминальными.
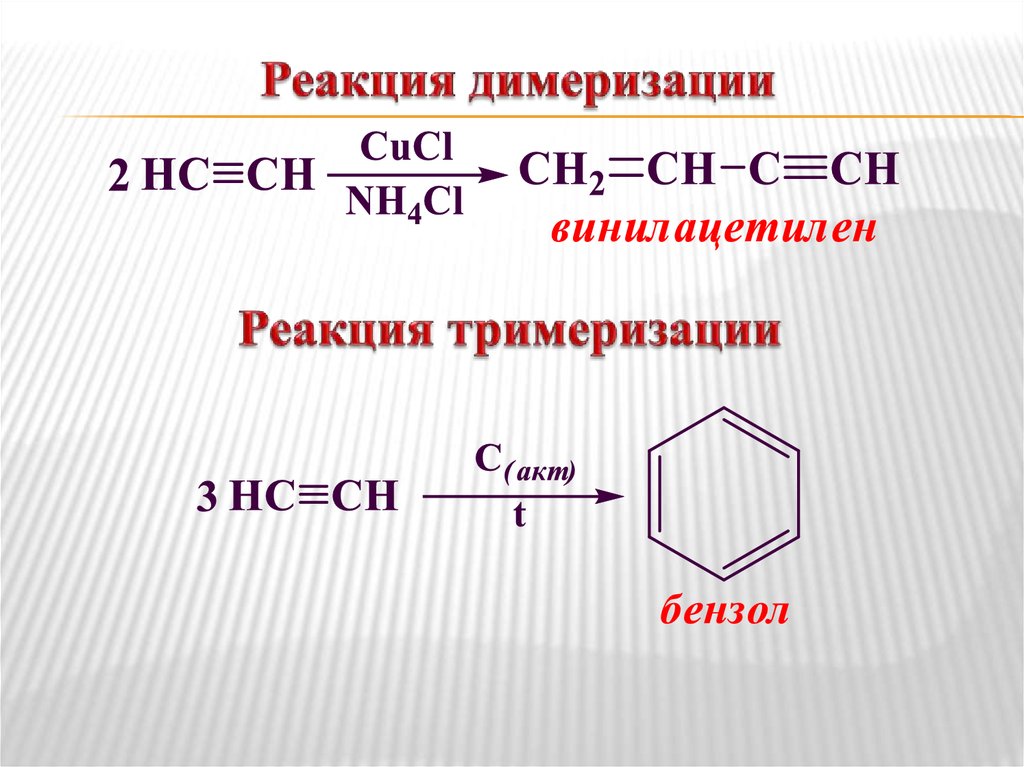
27. Способы получения алкинов
Гидролиз карбида кальция (получение ацетилена)Пиролиз метана (получение ацетилена)
Дегидрогалогенирование дигалогеналканов
28. Способы получения алкинов
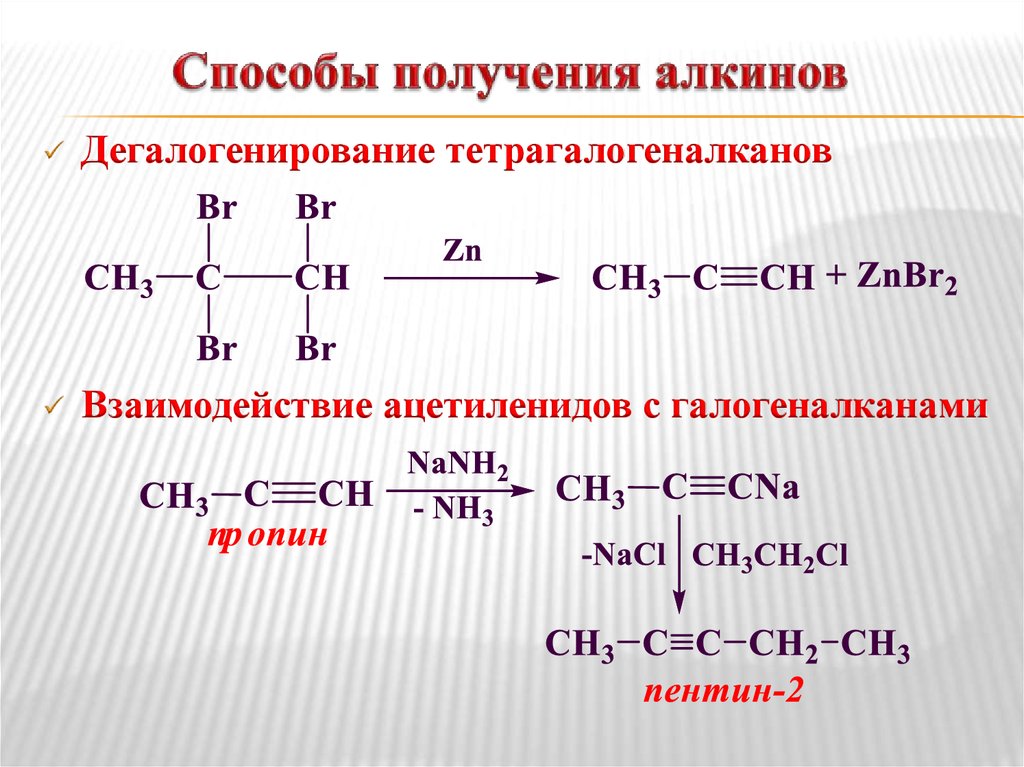
Дегалогенирование тетрагалогеналкановВзаимодействие ацетиленидов с галогеналканами
29. Химические свойства алкинов
Реакции электрофильного присоединения (AdE);Реакции замещения (для терминальных алкинов);
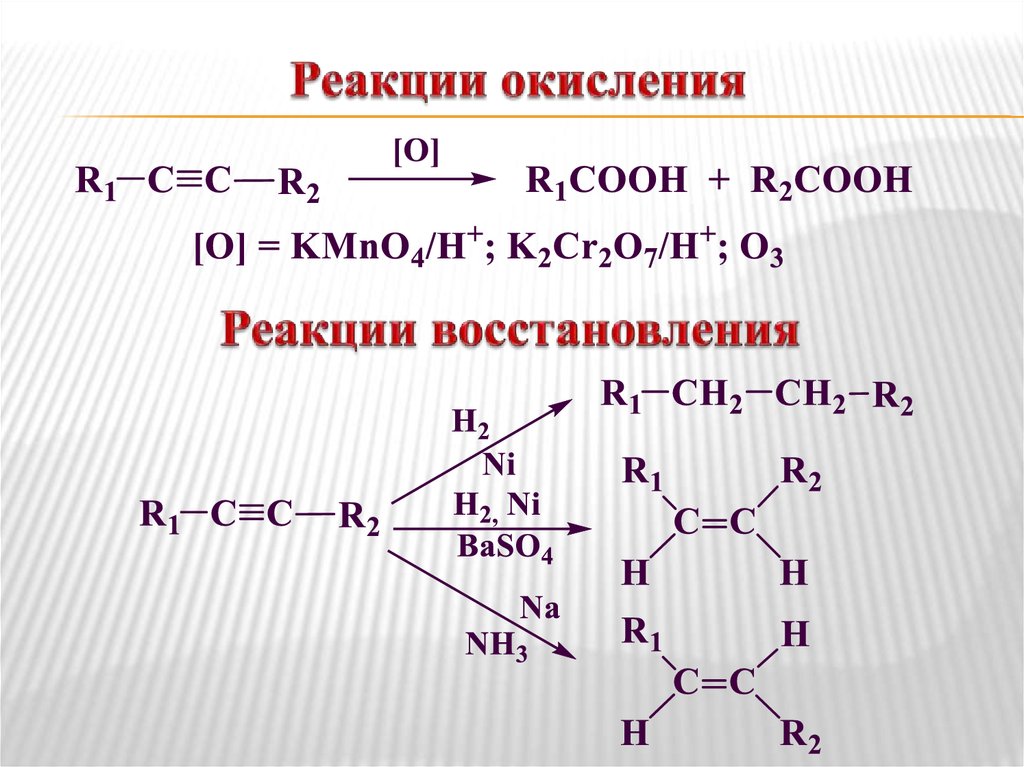
Реакции окисления и восстановления.
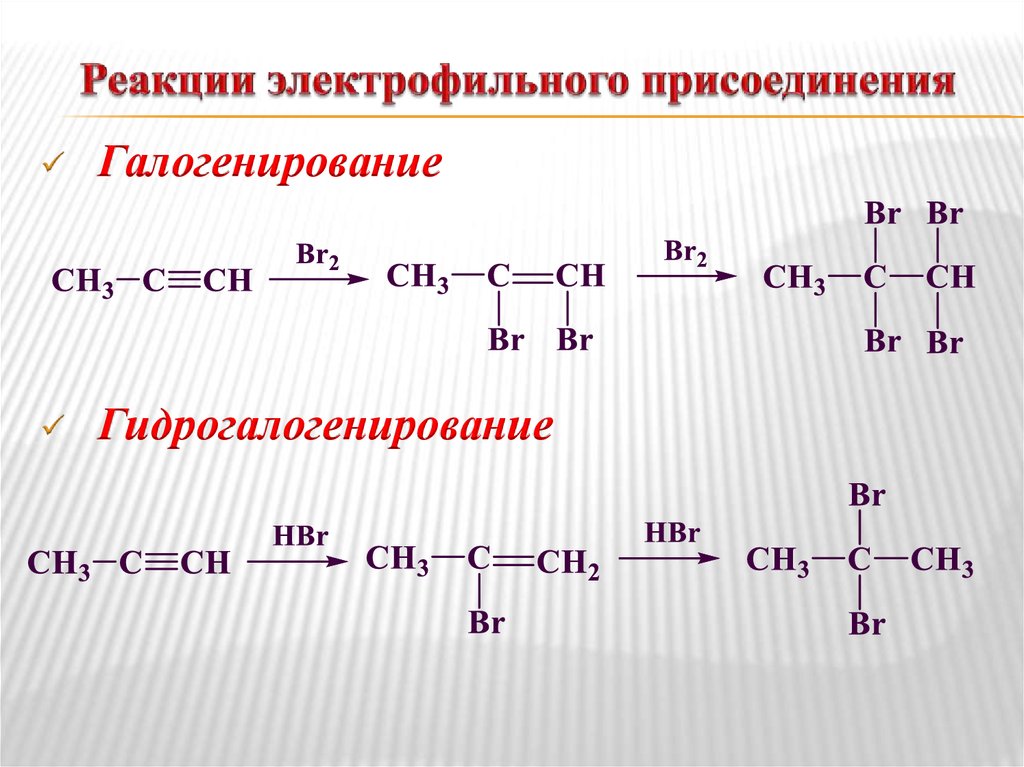
30. Реакции электрофильного присоединения
ГалогенированиеГидрогалогенирование
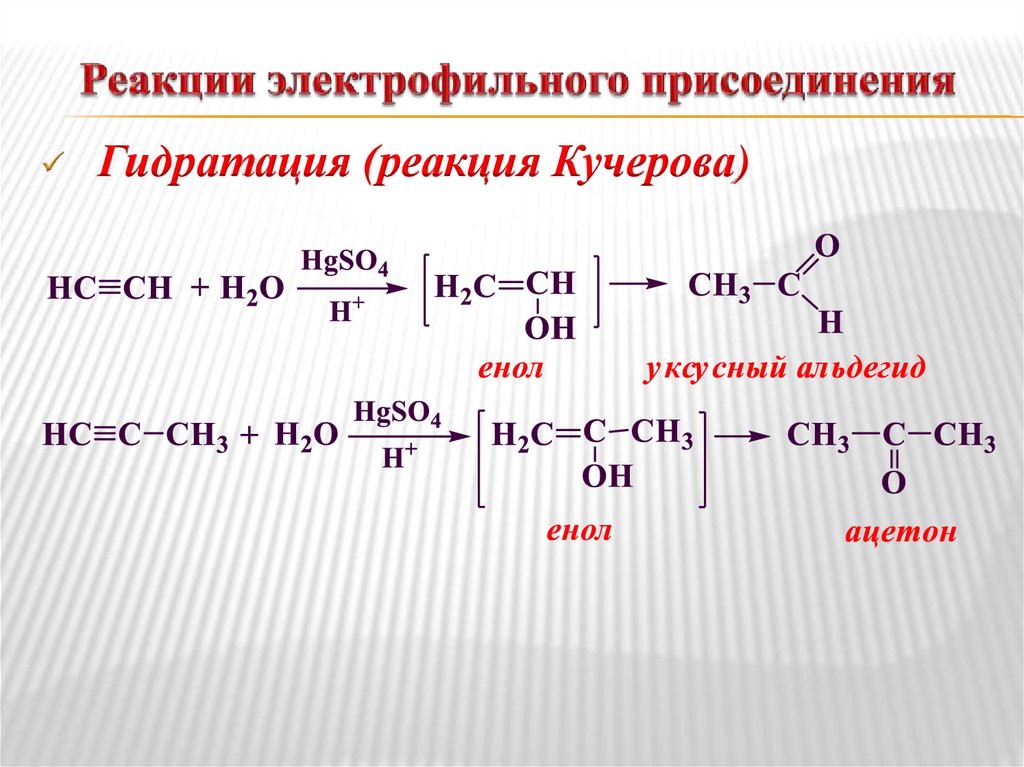
31. Реакции электрофильного присоединения
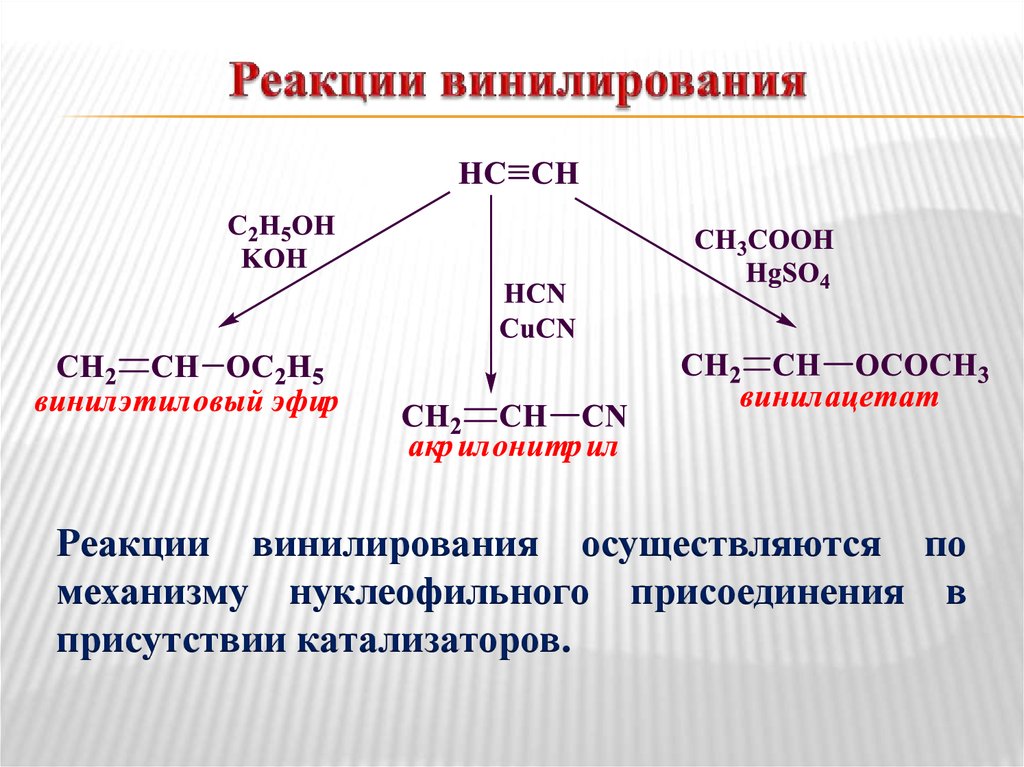
Гидратация (реакция Кучерова)32. Реакции винилирования
осуществляются помеханизму нуклеофильного присоединения в
присутствии катализаторов.
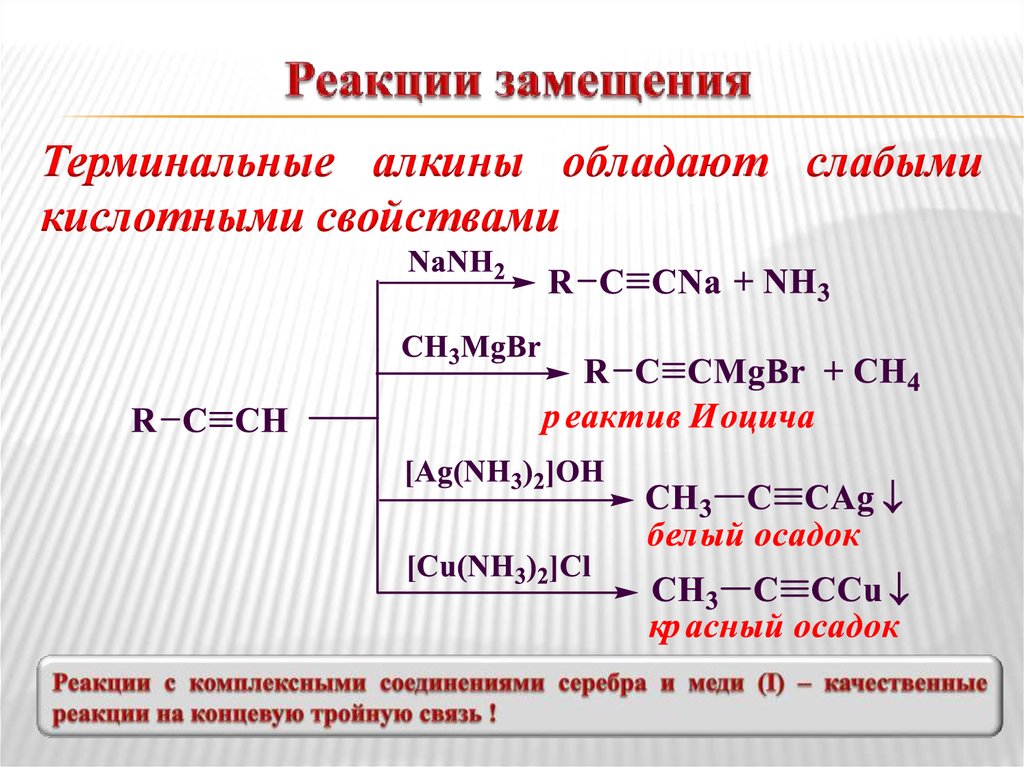
33. Реакции замещения
Терминальные алкины обладают слабымикислотными свойствами












 Химия
Химия








