Похожие презентации:
Производные пиразола. (Лекция 5)
1.
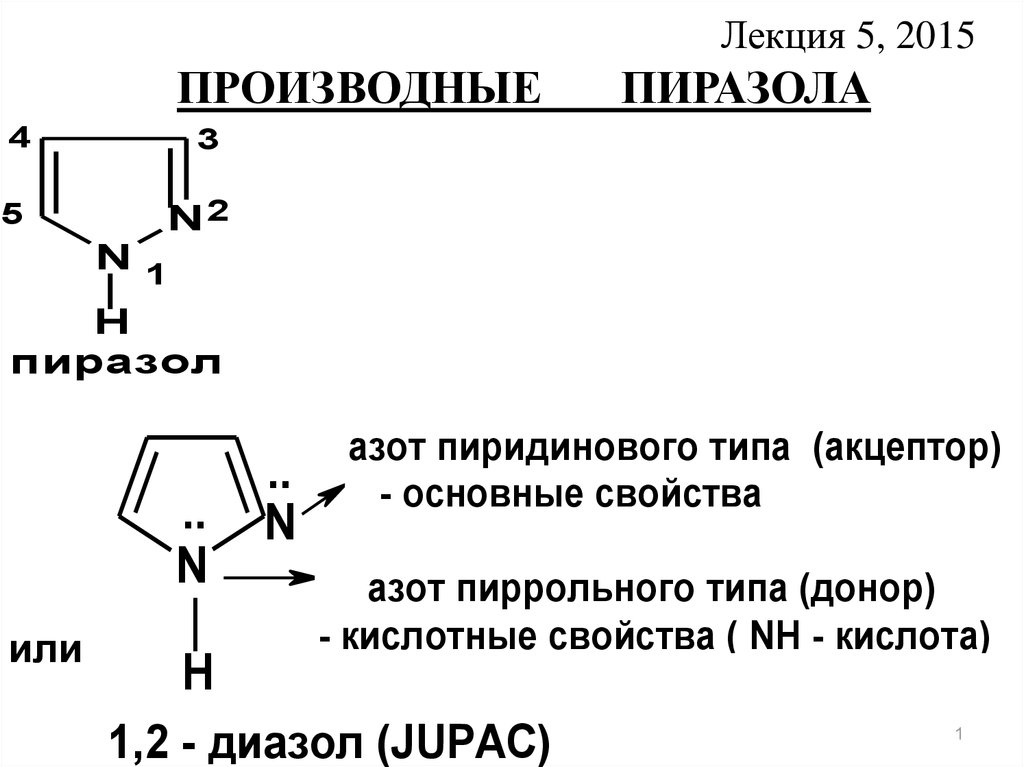
Лекция 5, 2015ПРОИЗВОДНЫЕ
4
5
ПИРАЗОЛА
3
N2
N1
H
пиразол
..
N
или
..
N
азот пиридинового типа (акцептор)
- основные свойства
азот пиррольного типа (донор)
- кислотные свойства ( NH - кислота)
H
1,2 - диазол (JUPAC)
1
2.
Впервые открыт в 1883 г. Германия, Людвигом КнорромФеназон (МНН)
Антипирин
CH3
O
N
N
CH3
1-фенил-2,3диметилпиразолон-5
2
3.
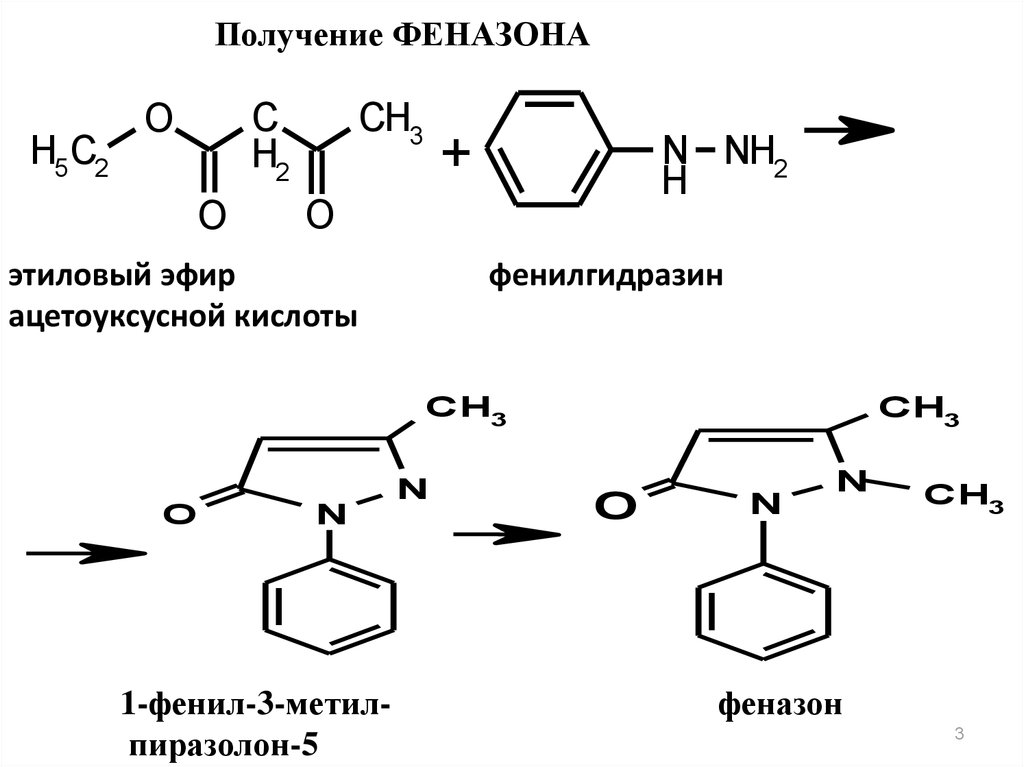
Получение ФЕНАЗОНАH5 C2
C
H2
O
O
CH3
+
N NH2
H
O
этиловый эфир
ацетоуксусной кислоты
фенилгидразин
CH3
O
N
1-фенил-3-метилпиразолон-5
N
CH3
O
N
N
CH3
феназон
3
4.
Физич. св-ва: Белый кристал. порош, слабогорькоговкуса, очень легко р-им в воде, спирте, р-рим в
хлороф. и эфире.
Химические св-ва:
Производные
пиразола
имеют
слабо
выраженный основный центр — гетероатом азота во 2м положении.
Атом азота в 1-м положении практически не
проявляет основных свойств из-за влияния атома
кислорода карбонильной группы и фенильного
радикала.
Таким образом, антипирин является слабым
однокислотным основанием. Водный раствор его
4
нейтрален (pH 6,0—7,5).
5.
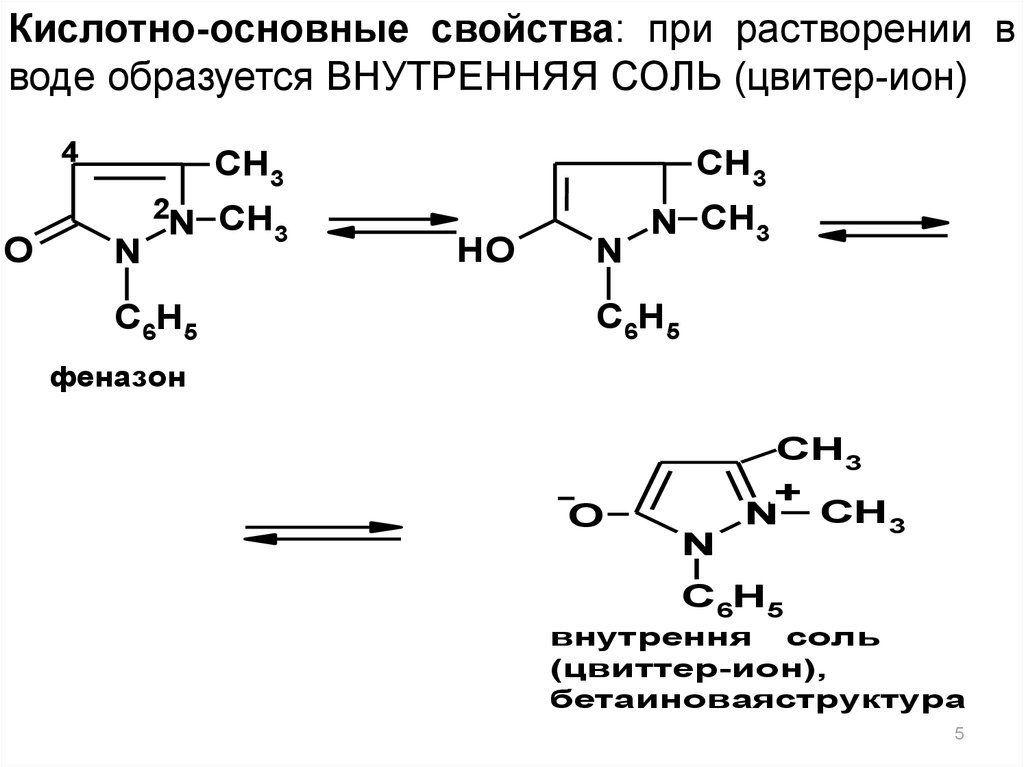
Кислотно-основные свойства: при растворении вводе образуется ВНУТРЕННЯЯ СОЛЬ (цвитер-ион)
4
CH3
CH3
N CH3
N CH3
2
O
N
C6H5
HO
N
C6H5
феназон
O
N
CH3
+
N CH3
C6H5
внутрення
я соль
(цвиттер-ион),
бетаиноваяструктура
5
6.
Подлинность:1) t плавл.=110-113 0С;
2) ИК-, УФ – спектры ( - max)
3) Химические методы
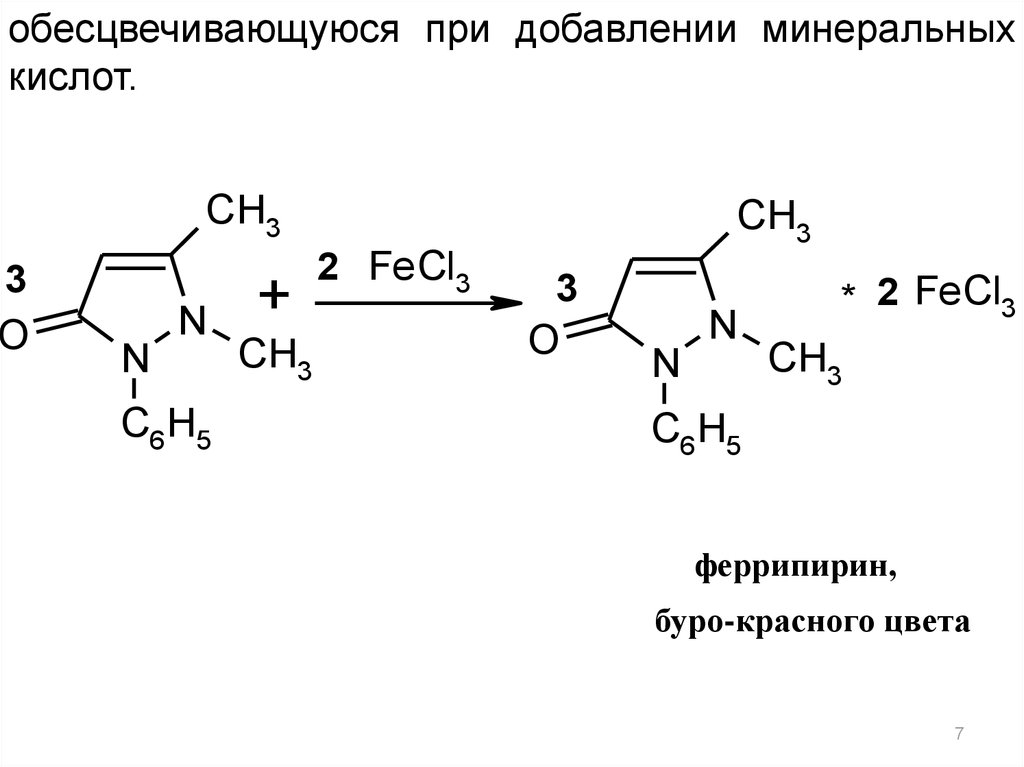
1.1. Реакции комплексообразования:
За счет способности давать в водном растворе
цвиттер-ион антипирин образует с железа(III)
хлоридом комплексную соль красного цвета,
6
7.
обесцвечивающуюся при добавлении минеральныхкислот.
3
O
CH3
N
N
C6 H5
+
CH3
CH3
2 FeCl3
3
O
N
N
* 2 FeCl3
CH3
C6 H5
феррипирин,
буро-красного цвета
7
8.
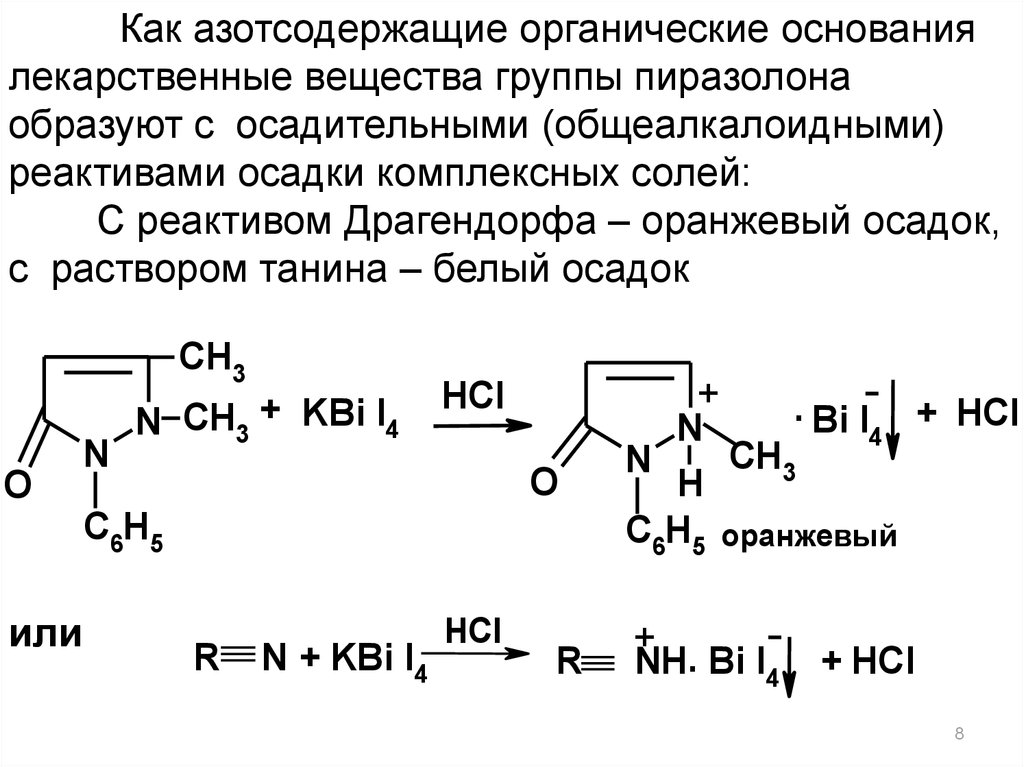
Как азотсодержащие органические основаниялекарственные вещества группы пиразолона
образуют с осадительными (общеалкалоидными)
реактивами осадки комплексных солей:
С реактивом Драгендорфа – оранжевый осадок,
с раствором танина – белый осадок
CH3
O
N
N CH3 + KBi I4
HCl
O
C6H5
или
R
N + KBi I4
HCl
R
+
. Bi I + HCl
N
4
CH3
N
H
C6H5 оранжевый
+
NH. Bi I4
+ HCl
8
9.
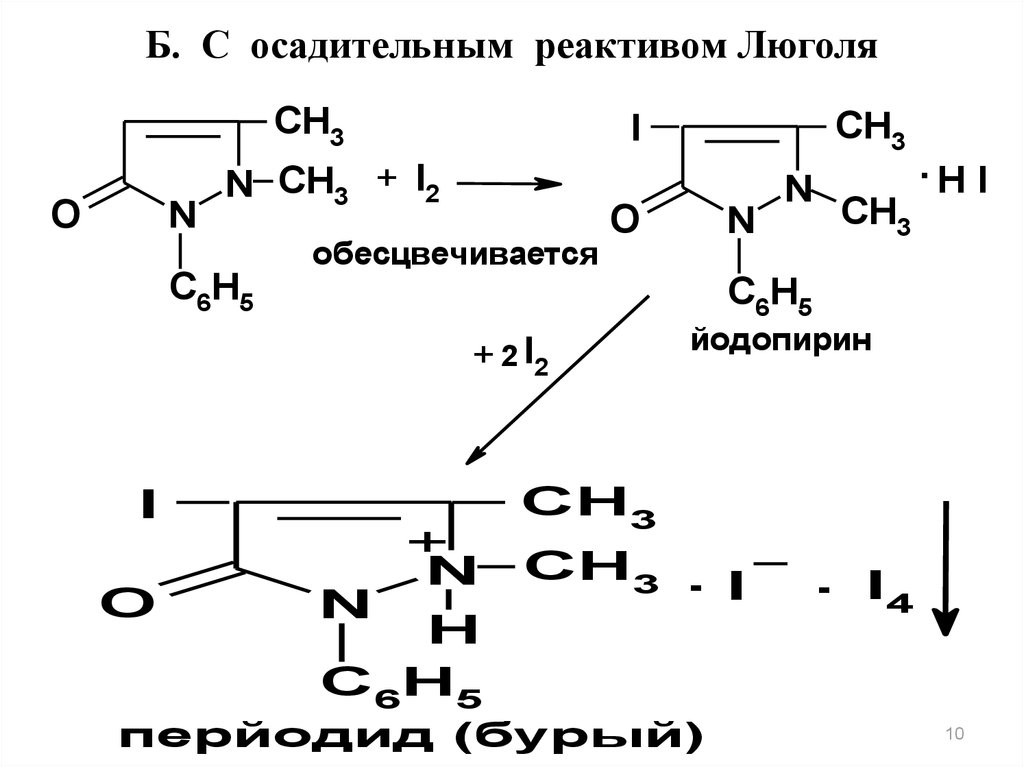
Антипирин с раствором йода (реактивом Люголя- раствор йода в калия йодиде)
(Особенность прохождения реакции)
сначала образует бесцветный йодопирин
(при
добавлении
первых
капель
реактива
наблюдается обесцвечивание йода),
затем (при избытке реактива) выпадает бурый
осадок комплексной соли — перйодида.
9
10.
Б. С осадительным реактивом ЛюголяCH3
O
N
CH3
I
N CH3 + I2
обесцвечивается
O
N
C6H5
O
CH3
C6H5
+ 2 I2
I
N
.H I
йодопирин
CH3
+
N CH3 . I
N
H
C6H5
перйодид (бурый)
. I4
10
11.
2. реакции электрофильного замещенияРеакции протекают по 4-му положению пиразола.
Электрофилами являются нитрозо- и нитропроизводные,
галогены
Антипирин не окисляется растворами йода и натрия
нитрита в кислой среде, а образует продукты замещения:
А. с р-ром натрия нитрита (NaNO2)
специфическая реакция
CH3
O
N
N CH3
C6H5
+ NaNO2 + HCl
O=N
CH3
O
N CH3
N
C6H5
нитрозоантипирин
(изумрудно-зел.)11
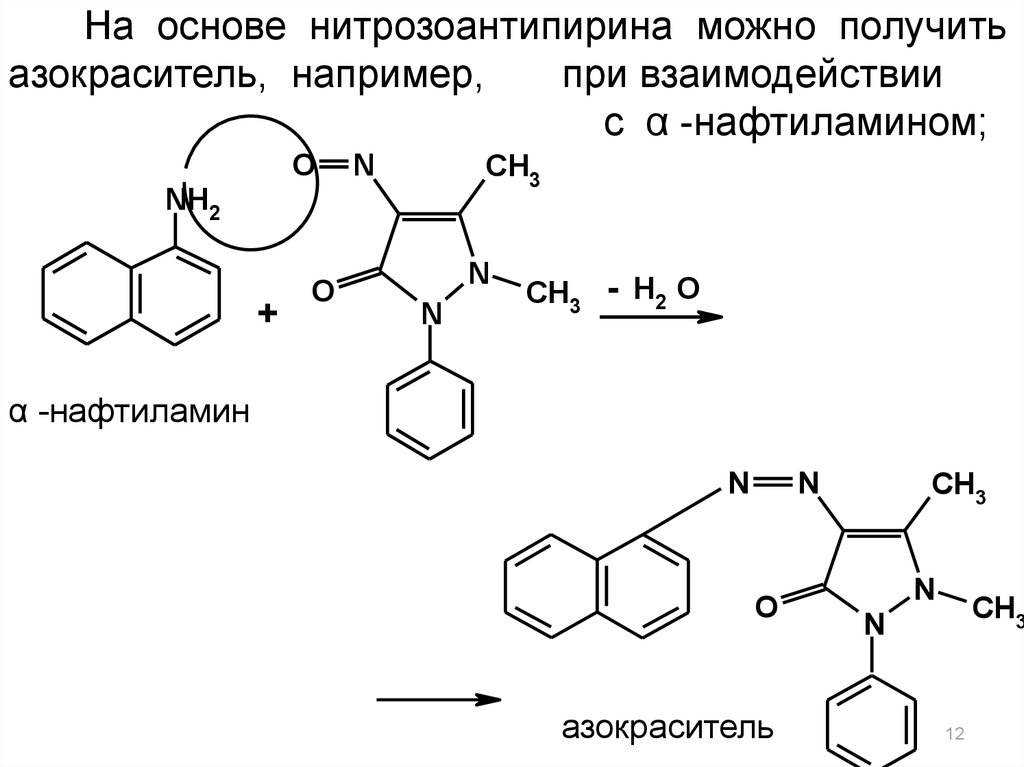
12.
На основе нитрозоантипирина можно получитьазокраситель, например,
при взаимодействии
с α -нафтиламином;
Азокраситель
(красного цвета)
O
N
CH3
NH2
+
O
N
N
CH3
- H2 O
α -нафтиламин
N
N
O
азокраситель
CH3
N
CH3
N
12
13.
Индофеноловый краситель образуется присочетании нитрозоантипирина с α-нафтолом (в
кето-форме):
O
O
N
CH3
N
N
CH3
OH
O
+
α-нафтол
H
H
CH3
O
N
N
O
N
CH3
13
14.
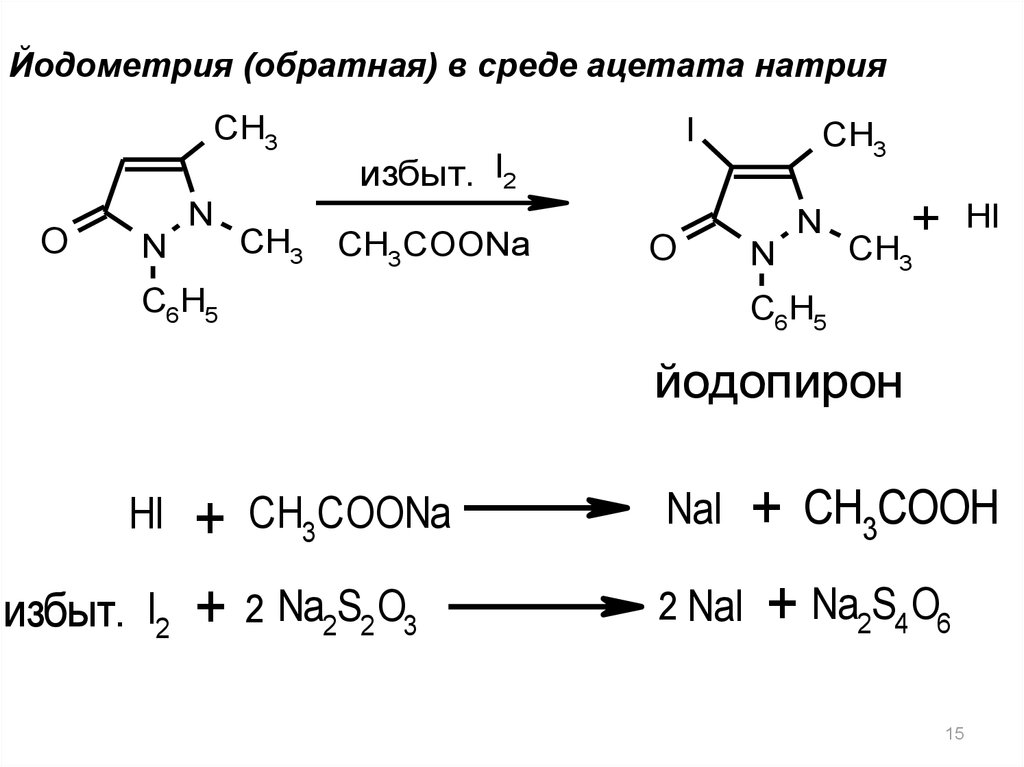
Количественный анализ феназона1.Йодометрия (обратная) в среде ацетата
натрия, для связывания выделяющейся кислоты
йодоводородной, для предотвращения обратной
реакци.
Так как йодопирин может адсорбировать
йод, для его извлечения добавляют хлороформ.
Избыток йода титруют натрия тиосульфатом до обесцвечивания хлороформного слоя.
Параллельно проводят контрольный опыт.
14
15.
Йодометрия (обратная) в среде ацетата натрияCH3
O
N
N
CH3
I
CH3
избыт. I2
CH3 COONa
O
C6 H5
N
N
+
HI
CH3
C6 H5
йодопирон
HI
избыт. I2
+ CH3COONa
+ 2 Na2S2 O3
NaI
2 NaI
+
CH3COOH
+ Na2S4 O6
15
16.
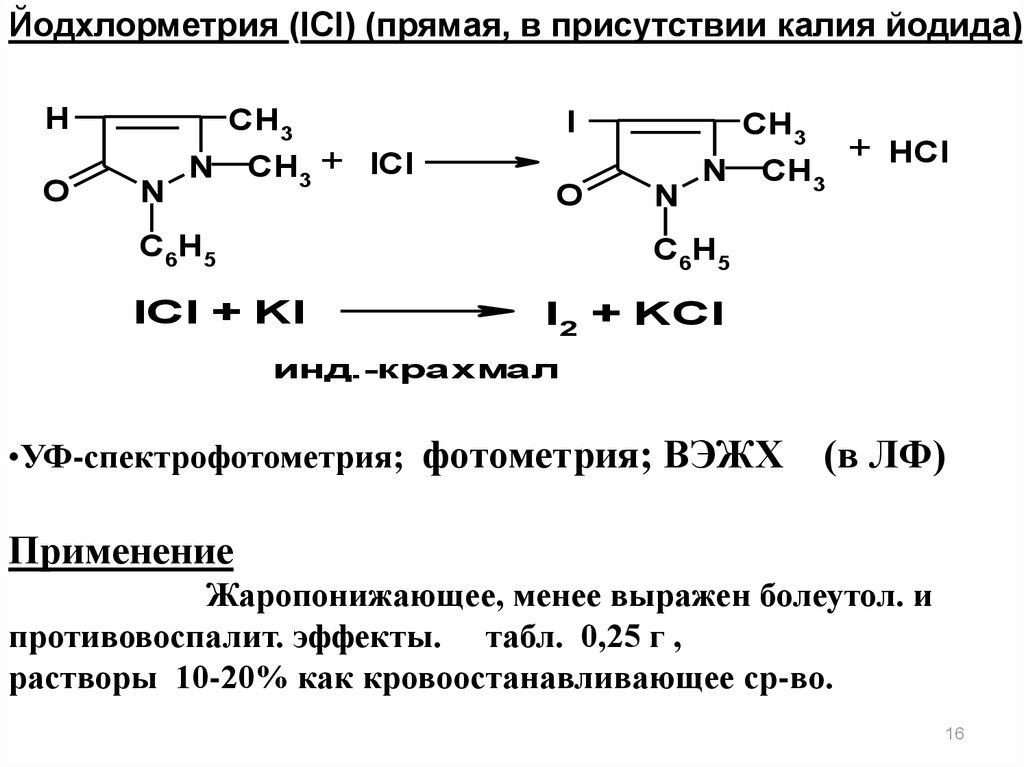
Йодхлорметрия (IСl) (прямая, в присутствии калия йодида)H
O
CH3
N
N
CH3 + ICl
I
O
C6H5
CH3
N
N
CH3
+ HCl
C6H5
ICl + KI
I2 + KCl
инд.-крахмал
•УФ-спектрофотометрия; фотометрия; ВЭЖХ
(в ЛФ)
Применение
Жаропонижающее, менее выражен болеутол. и
противовоспалит. эффекты. табл. 0,25 г ,
растворы 10-20% как кровоостанавливающее ср-во.
16
17.
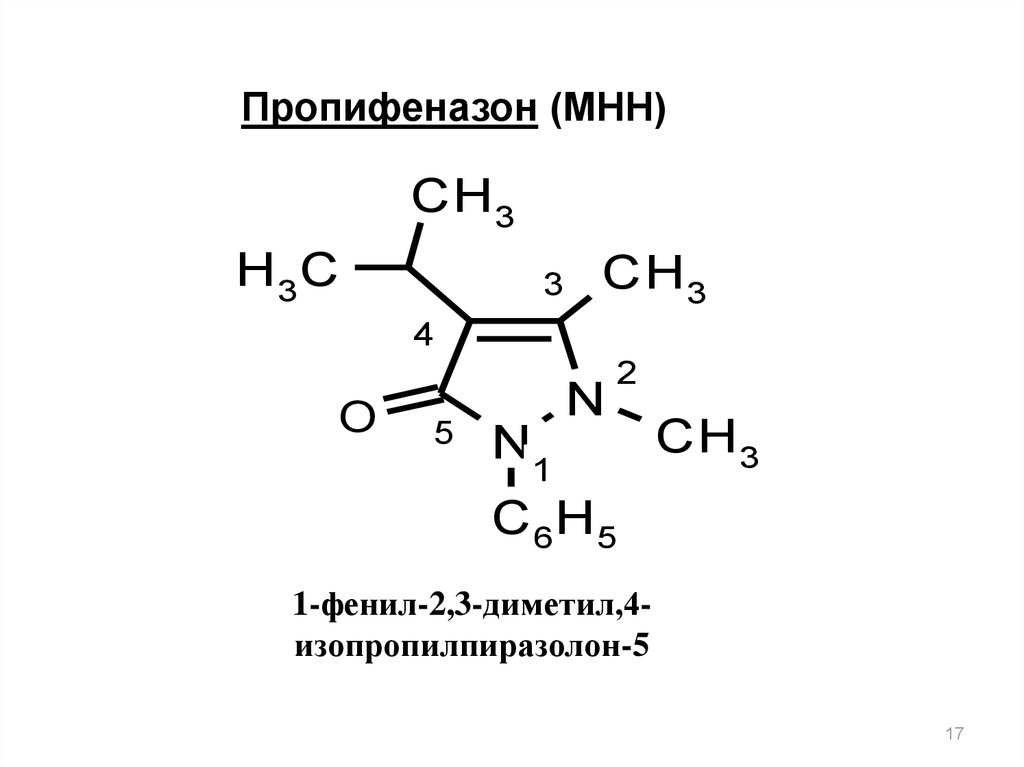
Пропифеназон (МНН)CH 3
H 3C
3
CH 3
4
O
5
N
2
N1
CH 3
C 6H5
1-фенил-2,3-диметил,4изопропилпиразолон-5
17
18.
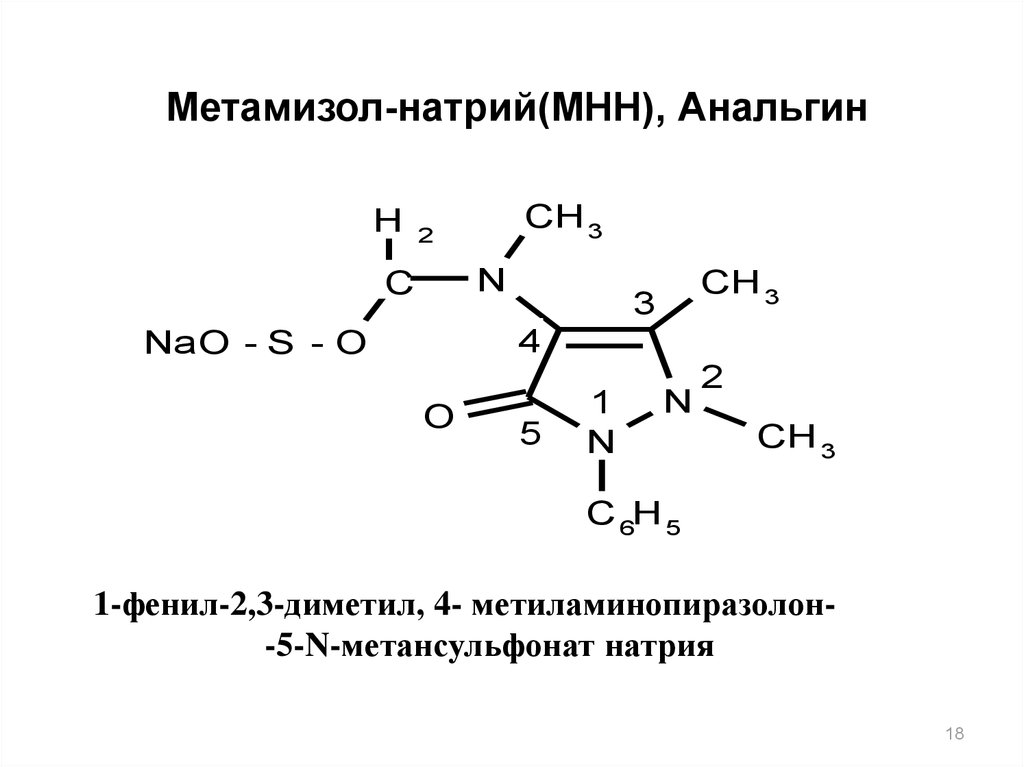
Метамизол-натрий(МНН), АнальгинH
CH 3
2
N
C
CH 3
3
4
NaO - S - O
O
5
1
N
N
2
CH 3
C 6H 5
1-фенил-2,3-диметил, 4- метиламинопиразолон-5-N-метансульфонат натрия
18
19.
Физико-химические характеристикиАнальгин растворим в воде т.к.является натриевой
солью замещенной серной кислоты
Подлинность анальгина и пропифеназона: 1. tпл
2. ТСХ
3. ИК, УФ-спектры (европ. Фарм.)
4. ВЭЖХ (сравнивают время удерж. со станд. образцом)
Химические с-ва
1. Р-и окисления: с хлоридом железа
анальгин даёт - синее окрашивание,
пропифеназон – красно-коричневое, переход. в желтое при
добав. HCl развед.
В качестве окислителей можно использовать:
хлорная известь, FeCl 3, NaNO2, I 2 , AgNO3
2. основные свойства доказывают реакциями:
А. С осадительными реактивами – окрашенные осадки
19
20.
Как азотсодержащие органические основаниялекарственные
вещества
группы
пиразолона
образуют осадки комплексных солей с общеалкалоидными реактивами (с реактивом Драгендорфа –
оранжевый).
С реактивом Люголя анальгин окисляется при
действии
первых
капель,
с
образованием
окрашенных продуктов, а при добавлении избытка
реактива образуется осадок перйодида (или
полийодида) анальгина.
20
21.
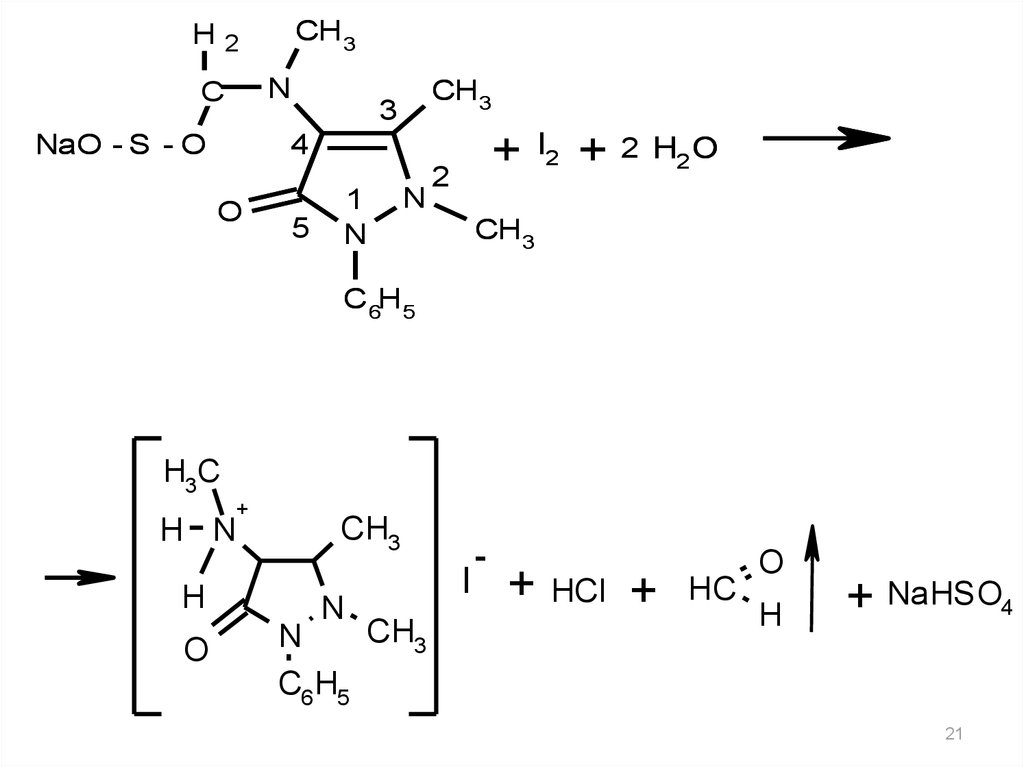
CH 3H2
N
C
CH 3
3
+
4
NaO - S - O
O
5
1
N
N
2
I2
+ 2 H2 O
CH 3
C 6H 5
H3C
+
H N
H
O
CH3
N
CH3
N
C6 H5
I
-
+
HCl
+
HC
O
H
+ NaHSO4
21
22.
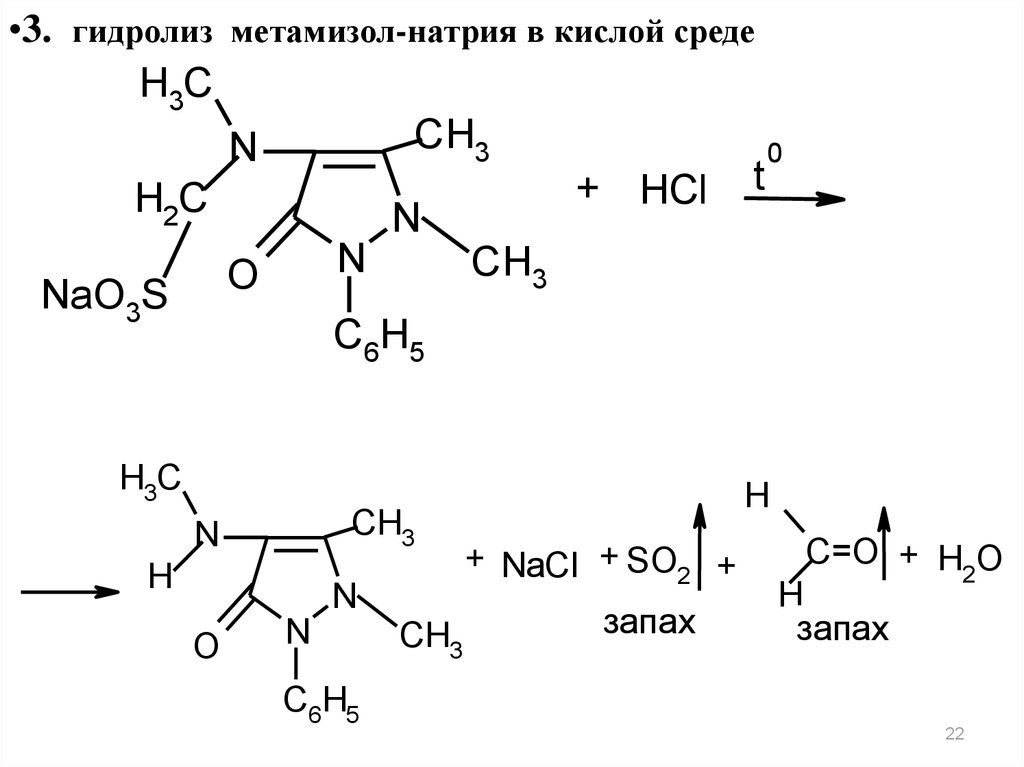
•3. гидролиз метамизол-натрия в кислой средеH3C
CH3
N
0
t
+
H
Cl
H2C
N
N
CH3
O
NaO3S
C6H5
H3C
CH3
N
H
N
O
N
C6H5
CH3
H
+ NaCl + SO2 +
запах
C=O + H O
2
H
запах
22
23.
Формальдегид с кислотой салициловойобразует ауриновый краситель
3
COOH
+
OH
H
H
HO
O
C=O
HOOC
ауриновый
краситель
(малиновое
окраш.)
COOH
C
COOH
OH
23
24.
При окислении метамизола-натрия растворомкалия йодата в присутствии хлористоводородной
кислоты
раствор
приобретает
малиновое
окрашивание, затем выделяется бурый осадок йода.
Происходит
это за счет взаимодействия калия
йодата с образующимся при гидролизе метамизоланатрия диоксидом серы:
5SO2 + 2KIO3 4SO3 + I2 + K2SO4
Серу в метамизоле-натрия обнаруживают путем
прокаливания в смеси карбонатов натрия и калия в
течение 10 мин. Плав охлаждают, растворяют в
азотной кислоте и фильтруют. Образовавшиеся
сульфат-ионы обнаруживают с помощью раствора
24
бария хлорида.
25.
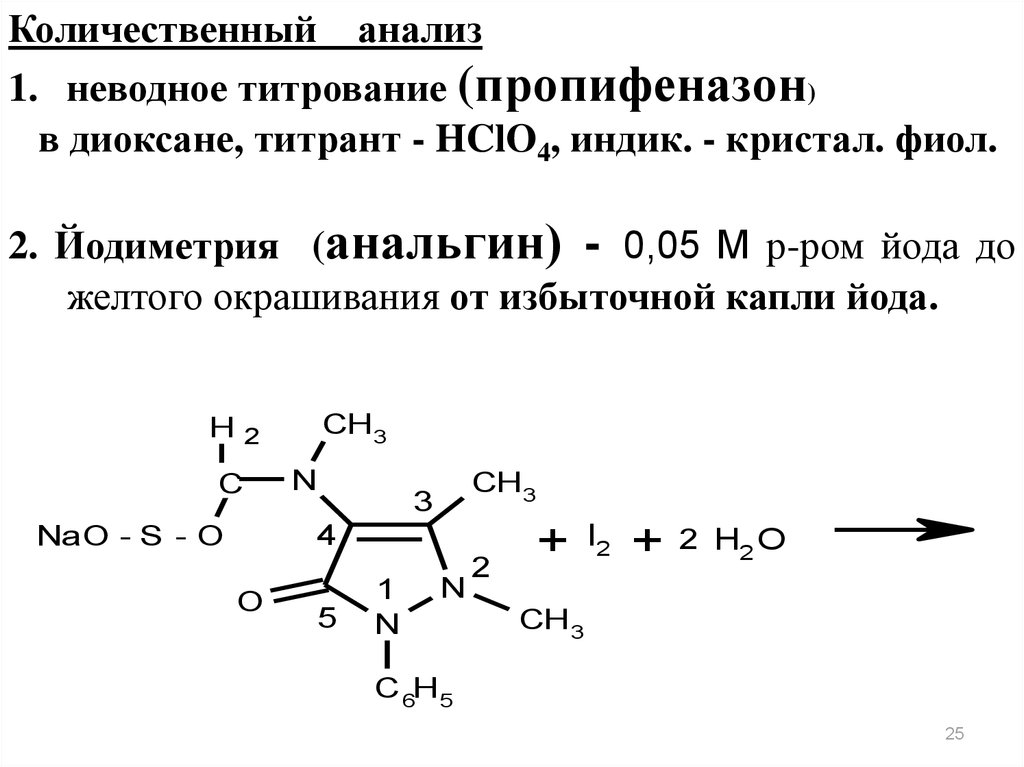
Количественный анализ1. неводное титрование (пропифеназон)
в диоксане, титрант - HClO4, индик. - кристал. фиол.
2. Йодиметрия (анальгин) - 0,05 M р-ром йода до
желтого окрашивания от избыточной капли йода.
CH 3
H2
C
N
CH 3
3
4
NaO - S - O
O
5
1
N
N
2
+
I2
+
2 H2 O
CH 3
C 6H 5
25
26.
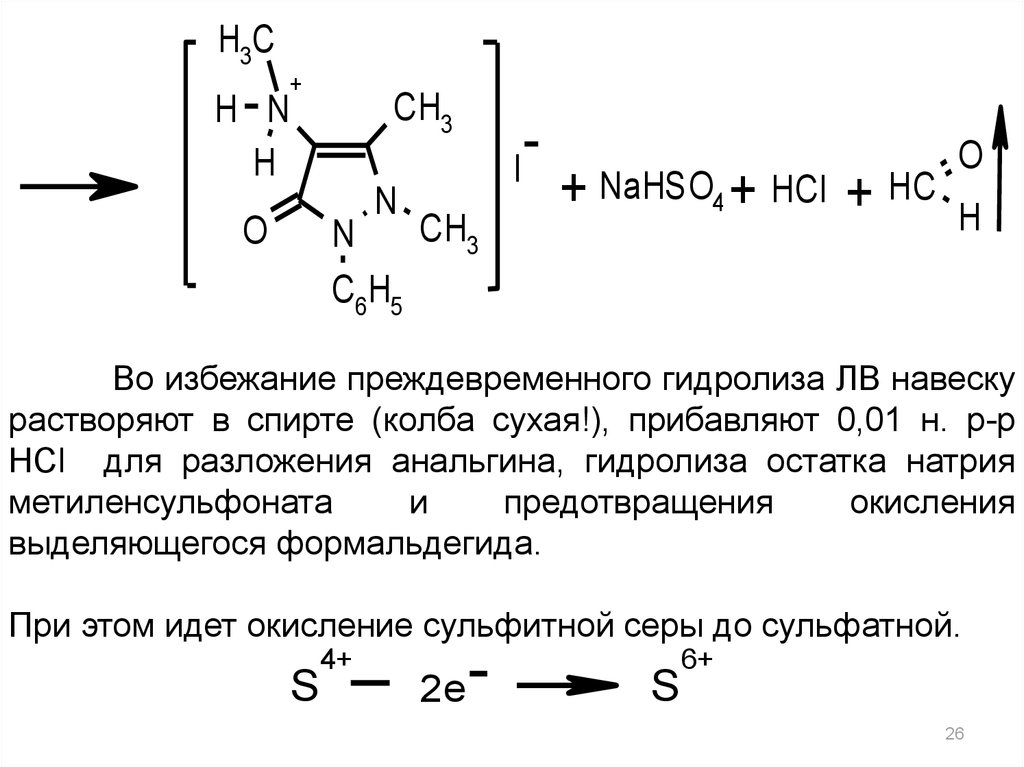
H3CH N
H
+
CH3
I
N
CH3
N
C6H5
O
+ NaHSO4 + HCl + HC
O
H
Во избежание преждевременного гидролиза ЛВ навеску
растворяют в спирте (колба сухая!), прибавляют 0,01 н. р-р
HCl для разложения анальгина, гидролиза остатка натрия
метиленсульфоната
и
предотвращения
окисления
выделяющегося формальдегида.
При этом идет окисление сульфитной серы до сульфатной.
S
4+
2e
S
6+
26
27.
3. УФ-спектрофотометрия для лекарственных форм4. ВЭЖХ - лекарственные формы пропифеназона
Хранение. Т.к. легко окисляются - в хорошо укупорен.
склянках, в прохладном, защищен. от света месте.
Применяют – болеутоляющ., противовоспалит.,
жаропониж.
пропифеназон табл. (саридон, содержит пропифеназон,
парацетамол, и кофеин)
анальгин
табл. 0,5 г;
50% р-р для инъекций
входит в состав различных болеутоляющих средств:
баралгин, пентальгин, андипал, темпалгин и др.
27
28.
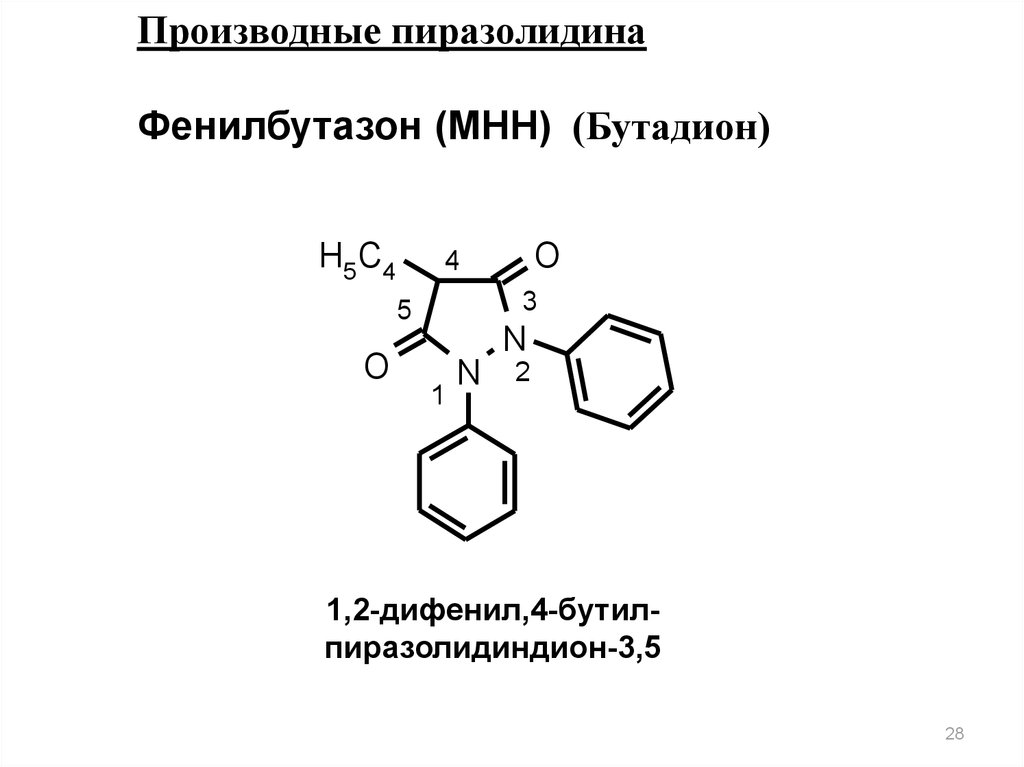
Производные пиразолидинаФенилбутазон (МНН) (Бутадион)
H5 C4
3
5
O
O
4
N
1
N
2
1,2-дифенил,4-бутилпиразолидиндион-3,5
28
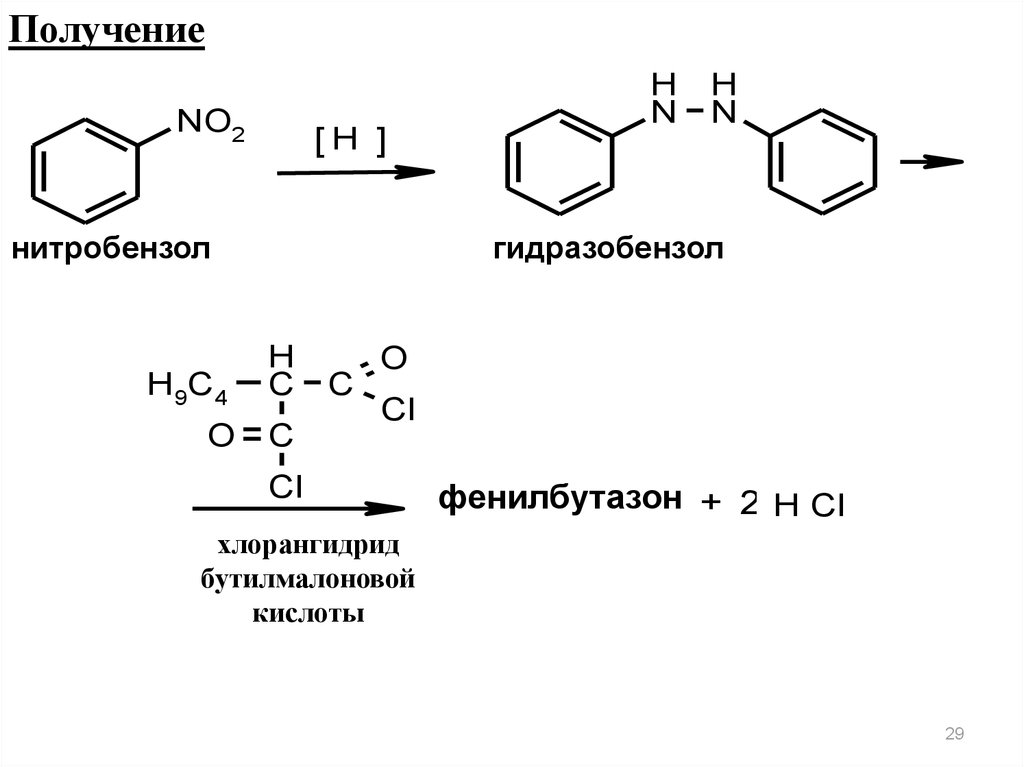
29.
ПолучениеNO2
[H ]
нитробензол
H9C4
H
N
H
N
гидразобензол
H
C
O C
C
O
Cl
Cl
фенилбутазон + 2 H Cl
хлорангидрид
бутилмалоновой
кислоты
29
30.
Физические св-ва: бел . или со слегка желтоватымоттен. пор., не р-рим в воде, р-рим в щелочах,
хлороформе.
Физ. –хим. характеристики: tпл; ИК-, УФ-спектры
Химические свойства
свойства ЛС
А. Кислотно-основные
В среде концентрированных минеральных
кислот он ведет себя как азотистое основание.
30
31.
Вацетоновых
растворах
фенилбутазон
обладает кислотными свойствами вследствие
наличия подвижного атома водорода в положении 4
и способнности к кето-енольной таутомерии.
H
O
C 4H 9
O
N
N C 6H 5
H 9C 4
OH
O
C 6H 5
дикетоформа
кето-енольная форма
Это позволяет получать соли фенилбутазона с
гидроксидом натрия и с солями тяжелых металлов.
31
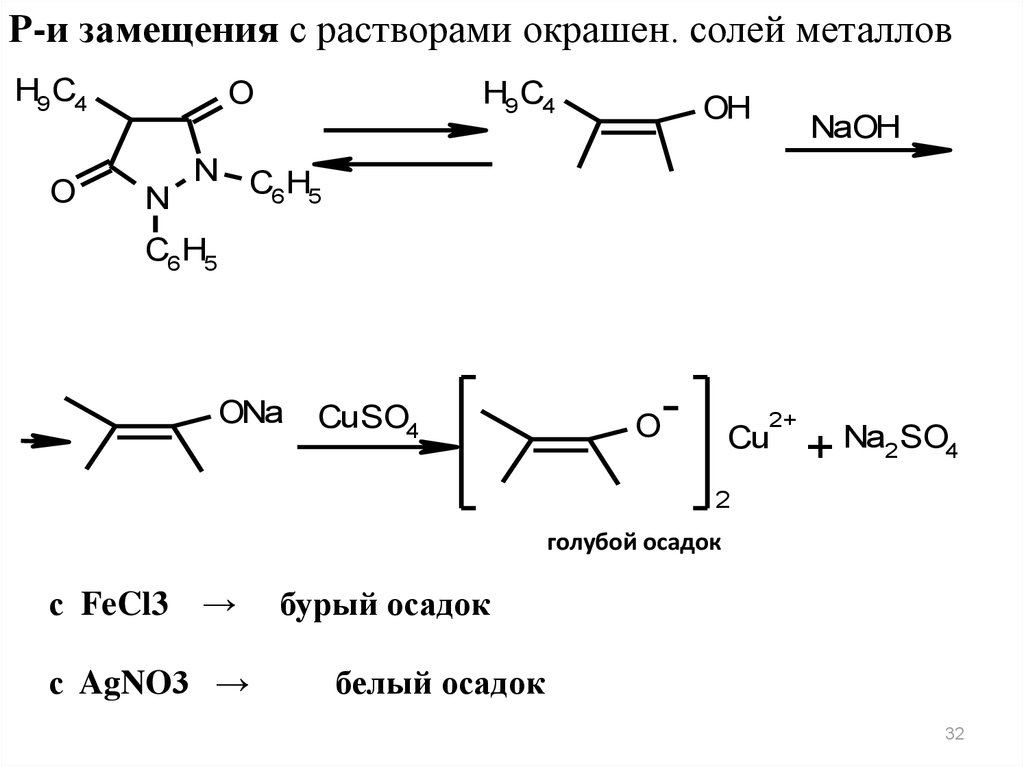
32.
Р-и замещения с растворами окрашен. солей металловH9 C4
O
H9 C4
O
N
OH
NaOH
N CH
6 5
C6 H5
ONa
CuSO4
2+
O
Cu
+ Na2 SO4
2
голубой осадок
с FeCl3 →
с AgNO3 →
бурый осадок
белый осадок
32
33.
•Реакции окисления:Фенилбутазон может быть
окислен только в жестких условиях (действием
концентрированной серной кислотой в присутствии
нитрита
натрия).
оранжевое
стойкое
При
окрашивание,
вишневое
нагревании
появляется
переходящее
окрашивание
и
в
более
выделяются
пузырьки газа.
33
34.
Реакцииокисления
фенилбутазона
обусловлены наличием в его молекуле остатка
гидразобензола, который окисляется до окрашенных
производных азобензола:
O
H5 C4
O
N
N
H2SO4
N N
H H
NaNO2
t
N N
азобензол
34
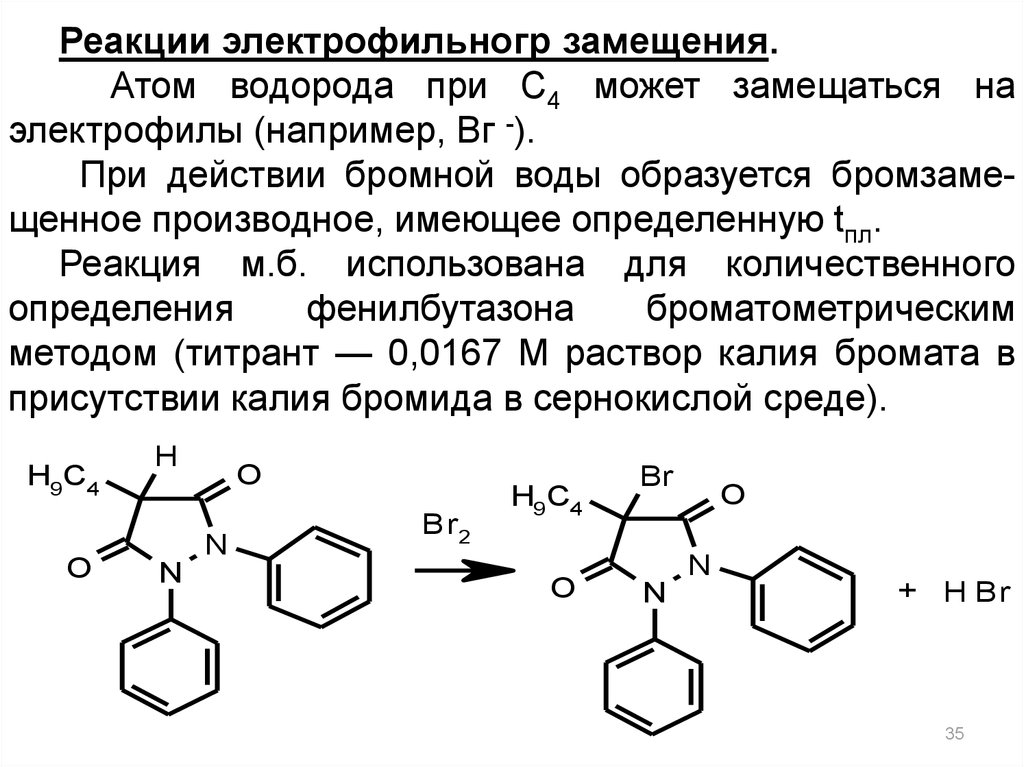
35.
Реакции электрофильногр замещения.Атом водорода при С4 может замещаться на
электрофилы (например, Вг -).
При действии бромной воды образуется бромзамещенное производное, имеющее определенную tпл.
Реакция м.б. использована для количественного
определения
фенилбутазона
броматометрическим
методом (титрант — 0,0167 М раствор калия бромата в
присутствии калия бромида в сернокислой среде).
H9C4
O
H
O
N
N
Br2
H9C4
O
Br
O
N
N
+ H Br
35
36.
Количественный анализ•Нейтрализация в среде ацетона, который растворяет
ЛВ и препятствует гидролизу образующейся
натриевой соли, (индикатор Ф/Ф)
H
O
H9C4
O
N
N C6H5 + NaOH
C6H5
ф/ф
ONa
H9C4
O
N
N C6H5 + H2O
C6H5
•УФ-спектрофотометрия
•ВЭЖХ
•Описано цериметрическое определение фенилбутазона в
водно-спиртовой среде и присутствии кислоты(Н2SO4).
36
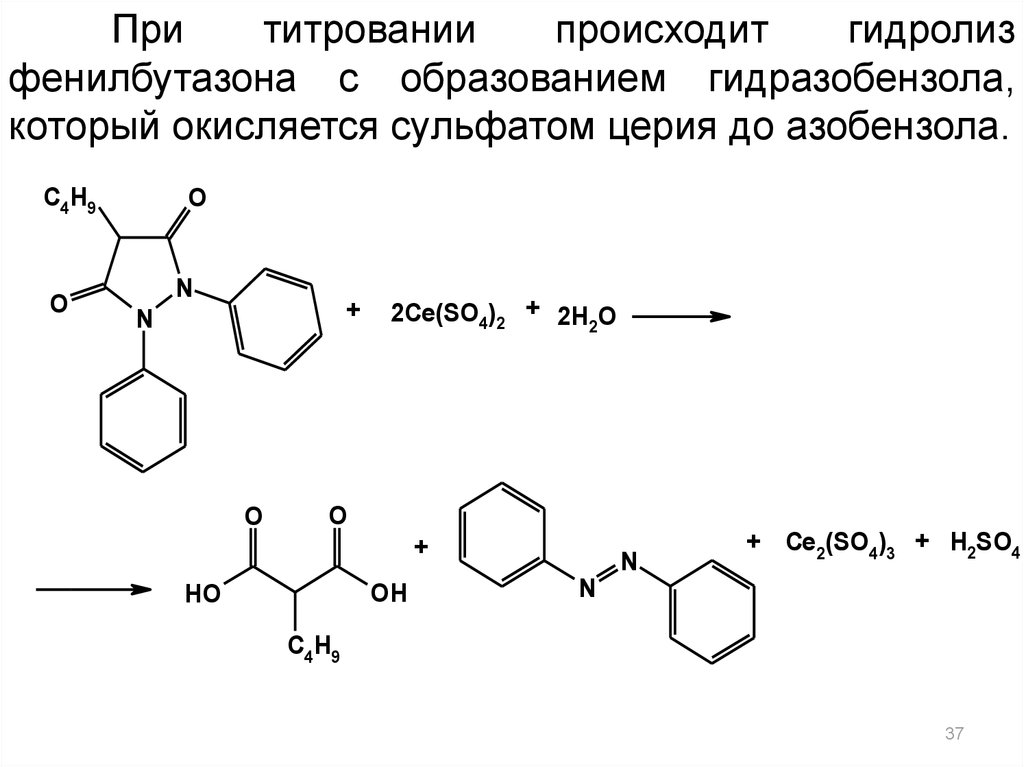
37.
Прититровании
происходит
гидролиз
фенилбутазона с образованием гидразобензола,
который окисляется сульфатом церия до азобензола.
C4H9
O
O
N
+
N
O
2Ce(SO4)2 + 2H2O
O
+
OH
HO
N
N
+ Ce2(SO4)3 + H2SO4
C4H9
37
38.
Избыток титранта устанавливаютйодометрическим методом.
2Ce(SO4 ) 2 + 2KI → I 2 + Ce2 (SO4 ) 3 + K 2 SO4
I 2 + 2Na 2S 2O 3 → 2NaI + Na 2S 4O 6
•Примен. болеутоляющ., противовоспалит.
• При неинфекционных артритах, заболеваниях
позвоночника (например, Реопирин – таб., р-р д/ин.
Аминофеназон и фенилбутазон).
38
39.
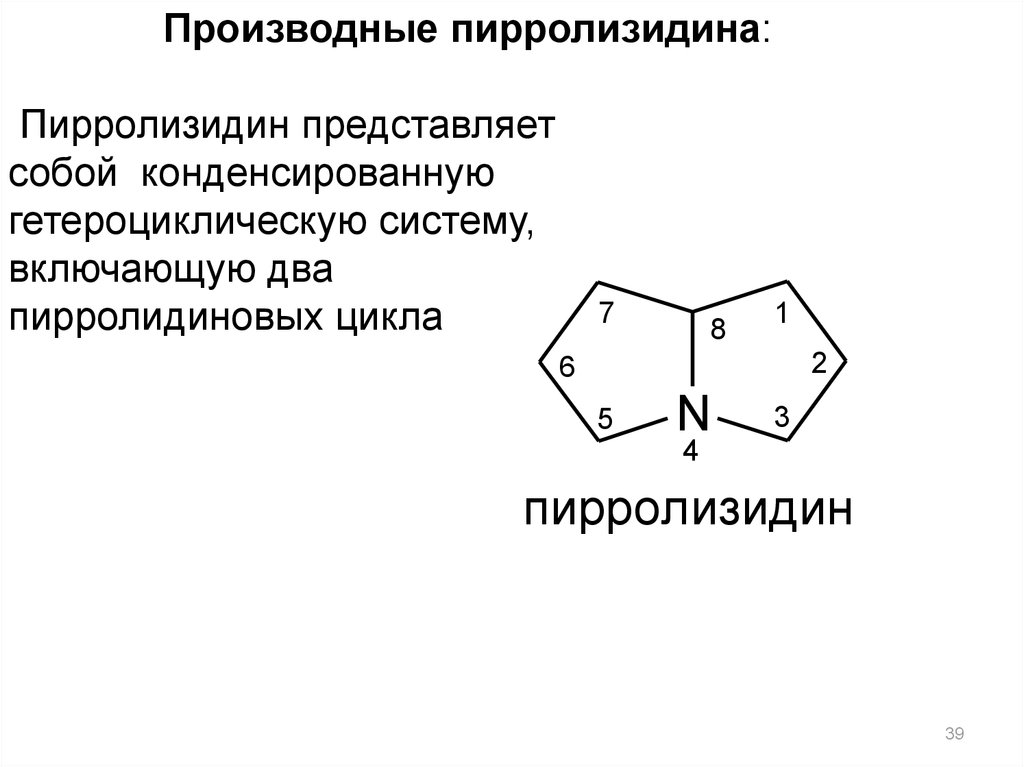
Производные пирролизидина:Пирролизидин представляет
собой конденсированную
гетероциклическую систему,
включающую два
пирролидиновых цикла
7
8
1
2
6
5
N
3
4
пирролизидин
39
40.
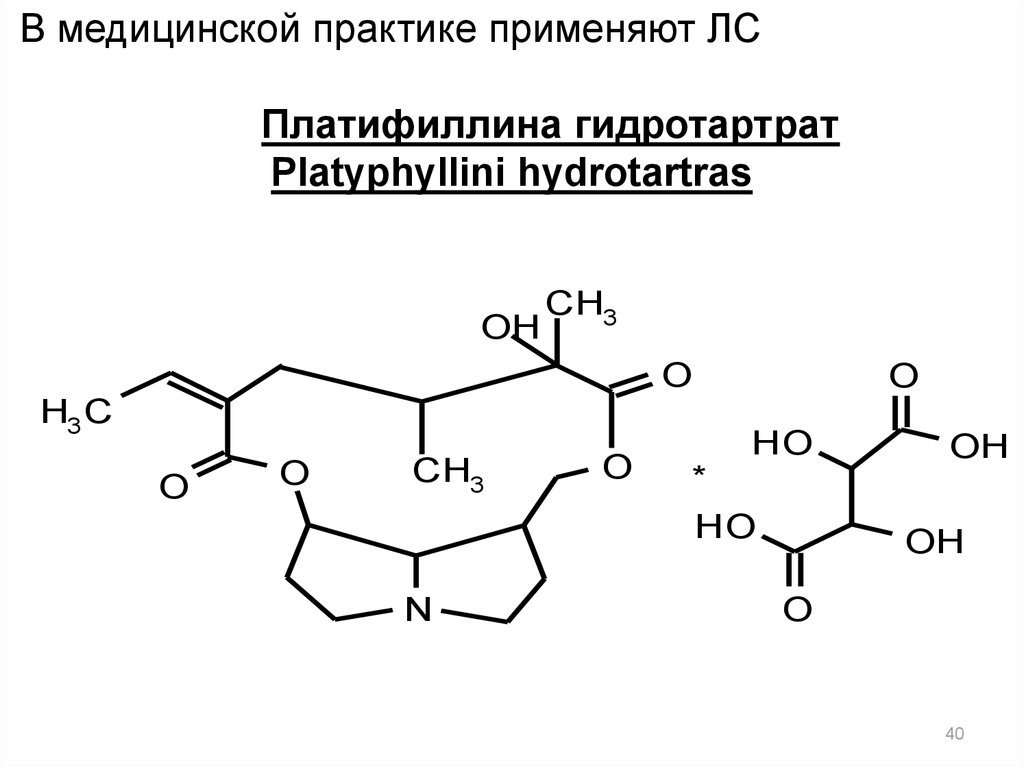
В медицинской практике применяют ЛСПлатифиллина гидротартрат
Platyphyllini hydrotartras
OH
CH3
O
O
H3 C
O
O
CH3
O
HO
*
HO
N
OH
OH
O
40
41.
Платифиллина гидротартрат легко р-рим в воде,очень мало растворим в этаноле. Практически
нерастворим в хлороформе и эфире.
Подлинность устанавливают:
1) по ИК-, и УФ-спектрам (
А
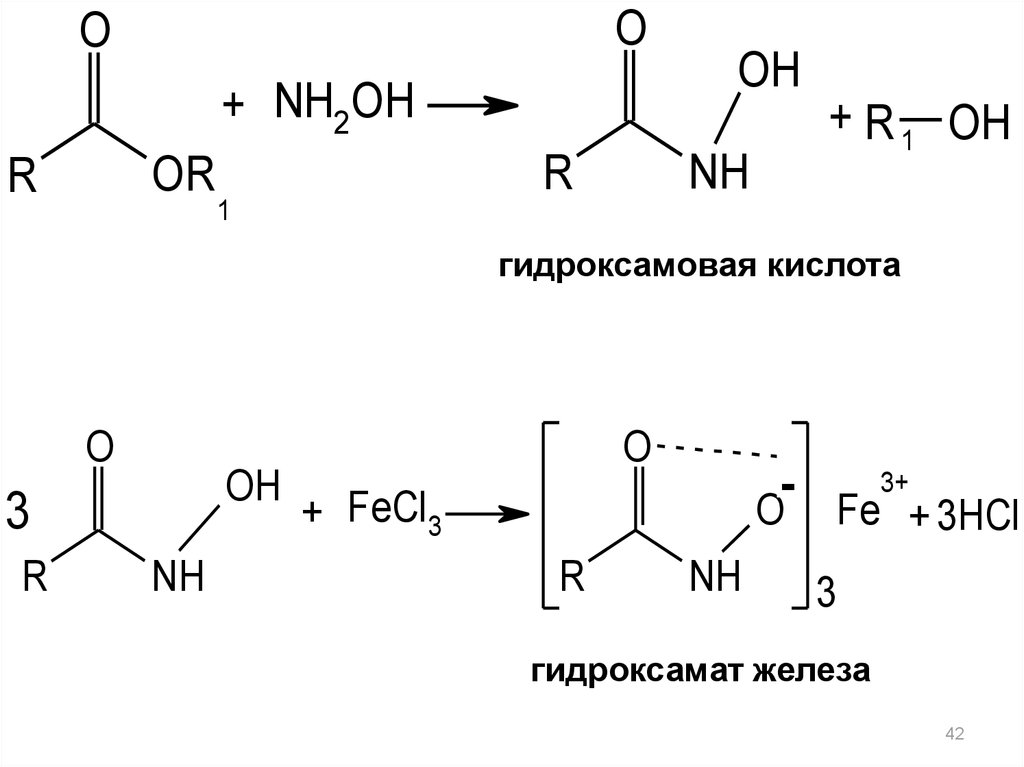
2) Как сложный эфир,
гидроксамовую реакцию.
1%
1см
равен 520).
платифиллин
С раствором гидроксиламина
дает
образуется
гидроксамовая кислота, которая с солями железа (III)
даёт
окрашенную
в
красно-фиолетовый
цвет
41
внутрикомплексную соль — гидроксамат железа (III):
42.
OO
+ NH2 OH
OR
R
NH
R
1
OH
+ R 1 OH
гидроксамовая кислота
O
OH
3
R
NH
O
3+
O Fe + 3HCl
+ FeCl3
R
NH
3
гидроксамат железа
42
43.
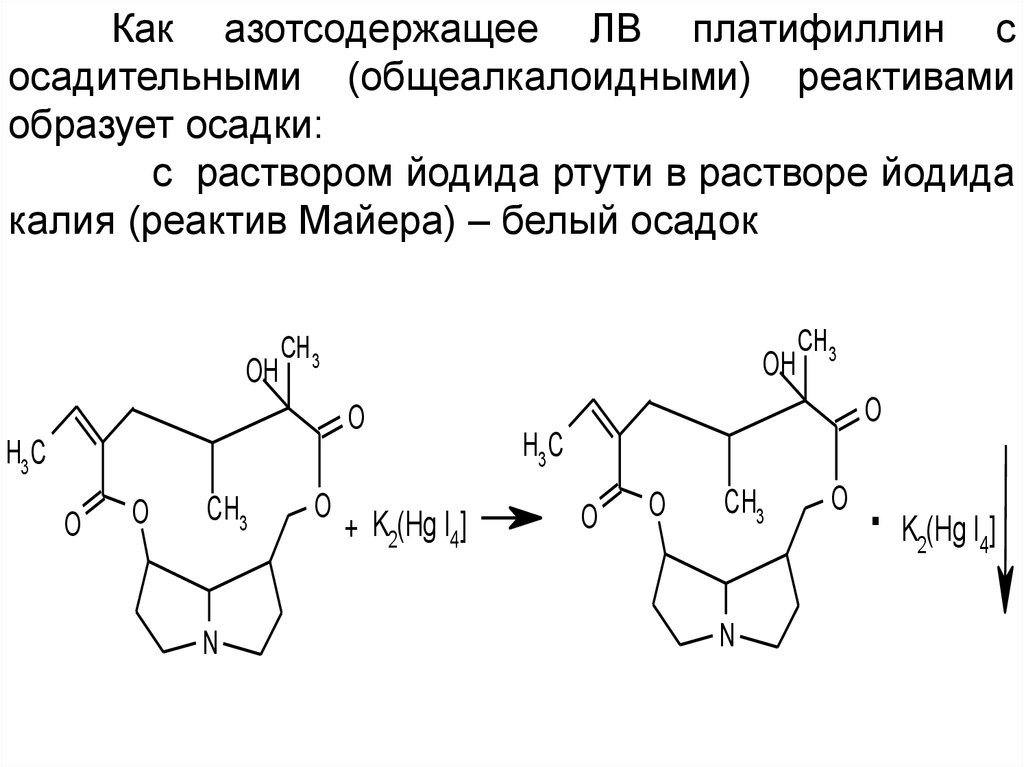
Как азотсодержащее ЛВ платифиллин сосадительными (общеалкалоидными) реактивами
образует осадки:
с раствором йодида ртути в растворе йодида
калия (реактив Майера) – белый осадок
OH
CH3
OH
O
H3 C
O
O
CH3
N
O
+ K2(Hg I4]
CH3
O
H3 C
O
O
CH3
N
O
.
K2(Hg I4]
44.
Наличие винной кислоты устанавливают:1) с ионом калия (белый осад. гидротартрата калия):
COOK
COOH
HC
OH
HC
OH
COOH
+
KCl
HC
OH
HC
OH
+
HCl
COOH
44
45.
Количественно платифиллина гидротартратопределяют:
1) методом титрования 0,1М раствором хлорной
кислоты в среде безводной уксусной кислоты
(индикатор кристаллический фиолетовый)
2) методом нейтрализации водного раствора в
присутствии
хлороформа
(индикатор
фенолфталеин).
3)
Обратным
йодометрическим
методом
(образование
полийодида
платифиллина
в
насыщенном растворе натрия хлорида)
45





















 Химия
Химия








