Похожие презентации:
Электролиз
1. Электролиз
2. УМК «ХИМИЯ»
Тема лекции:Электролиз
Лектор – Иванов М.Г.
3. Цель лекции: изложение основных понятий электролиза водных растворов и расплав электролитовий в рамках современной химической
теорииКомпетенции, формируемые у студента:
Умения:
прогнозировать на основе современных
представлений о строении атомов и
химической связи, реакции, протекающие при
электролизе в расплавах и растворах
электролитов.
4.
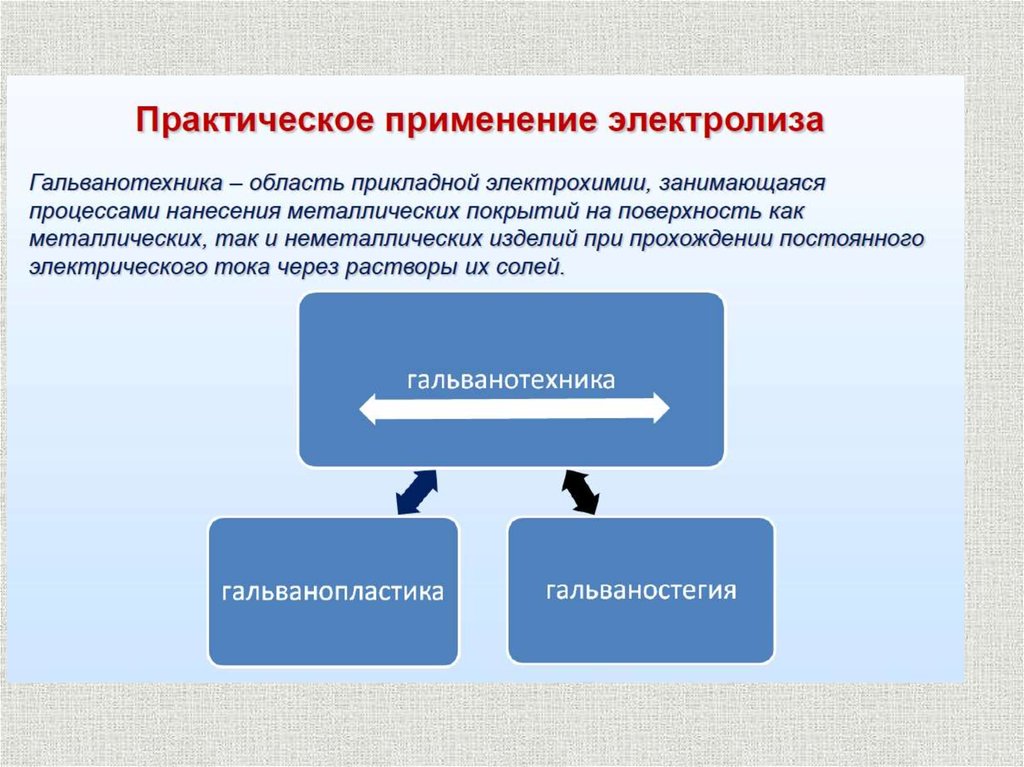
СОДЕРЖАНИЕОсновные понятия
Электролиз расплавов электролитов
Электролиз водных растворов электролитов
Катодные процессы
Поведение ионов металлов
Перенапряжение
Анодные процессы
Перенапряжение
Поведение анионов
Электролиз с растворимым анодом
Законы электролиза
Литература
5.
Основные понятиясодержание
Электролиз – это совокупность окислительно-восстановительных
процессов, которые протекают на электродах, помещенных в
раствор или расплав электролита, под действием постоянного
электрического тока, приложенного от внешнего источника.
Основные понятия:
Отрицательный полюс источника постоянного
тока присоединяют к электроду, который называют
катодом;
положительный полюс к электроду, который
называют анодом.
6.
Основные понятиясодержание
Е = -nF/ G
E > 0, ΔG < 0 -
самопроизвольный процесс протекает в
прямом направлении (гальванический элемент).
Если ЭДС будет отрицательной, то самопроизвольное
протекание ОВР становится невозможным.
E < 0, ΔG > 0 -
для проведения реакции в прямом
направлении необходимо приложить внешнюю ЭДС
(электролиз).
7.
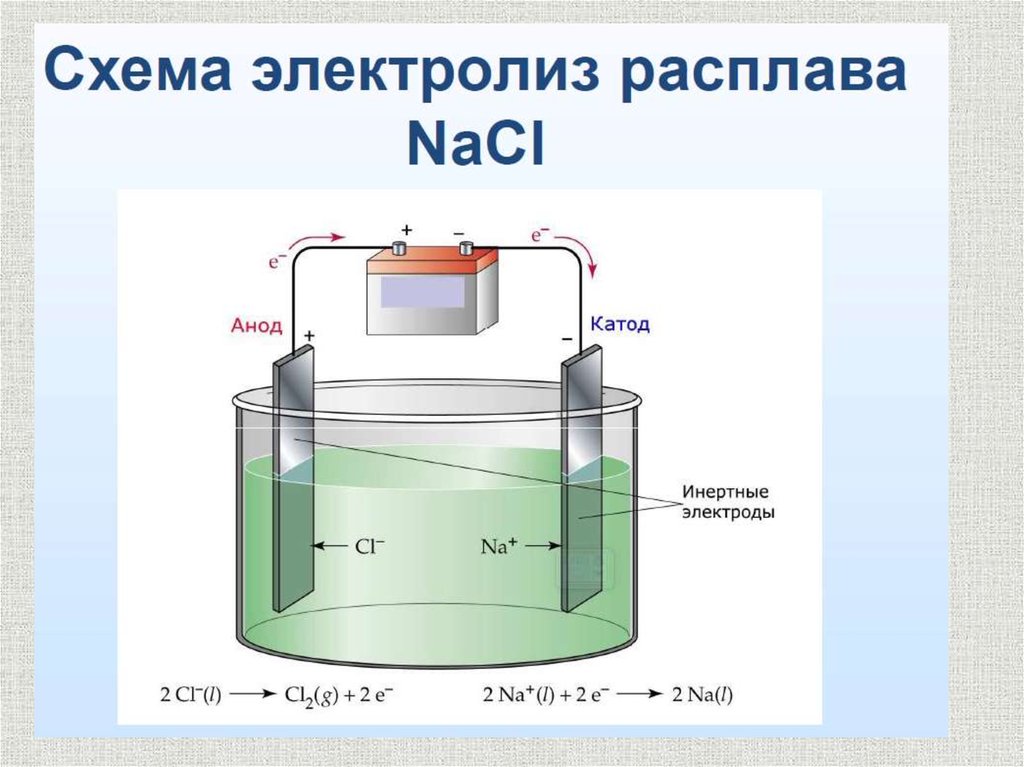
Электролиз расплавовэлектролитов
содержание
В простейших бинарных электролитах типа MeHal , MeHal2 (Me
– металл IA или IIA группы Пеpиодической системы, Hal –
галоген) на катоде выделяется свободный металл, а на аноде –
(галоген)
При этом на катоде протекает полуреакция восстановления
катиона металла:
Men+ + ne = Me
на аноде - полуреакция окисления галогенид-аниона:
2Cl- - 2e = Cl2
8.
9.
10.
Электролиз расплавовэлектролитов
содержание
При электролизе расплава гидродифторида калия (анод
– угольный, катод – никелевый) протекает следующие
реакции
На катоде:
На аноде:
2НF2- + 2е = Н2 + 4F-
2НF2- - 2е = F2 + 2HF
2НF + 2е = Н2 + 2F-
2F2- - 2е = F2
11.
12.
13.
14.
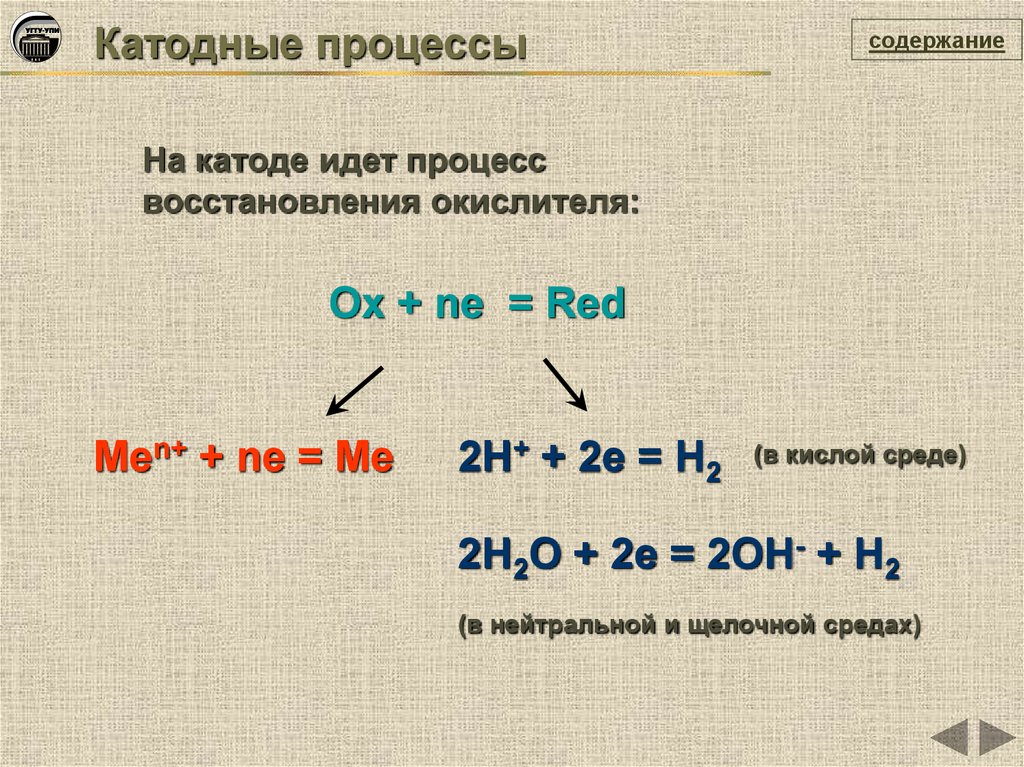
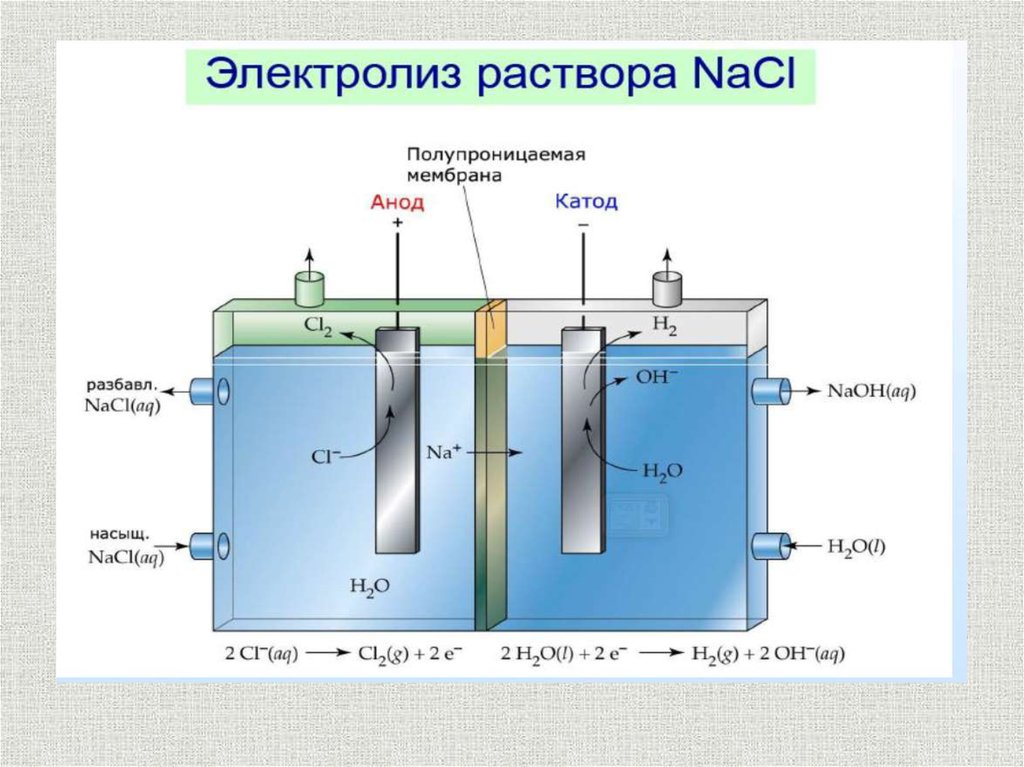
Катодные процессысодержание
На катоде идет процесс
восстановления окислителя:
Ox + ne = Red
Men+ + ne = Me
2Н+ + 2е = Н2
(в кислой среде)
2Н2О + 2е = 2ОН- + Н2
(в нейтральной и щелочной средах)
15.
16.
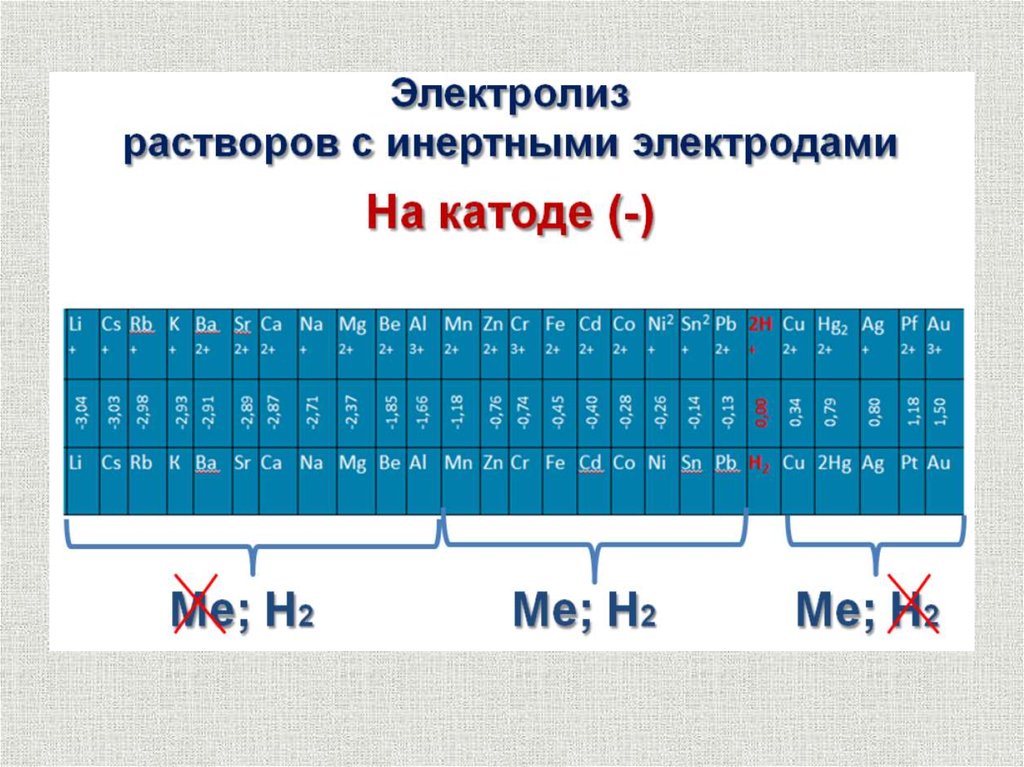
Катодные процессысодержание
При электролизе водных растворов все металлы можно
разделить на три группы:
1. Металлы, осаждение которых на катоде не сопровождается
выделением водорода. К ним относятся металлы, стоящие в ряду
стандартных потенциалов за водородом (медь, серебро, золото и др.).
2. Металлы, осаждение которых на катоде сопровождается
выделением водорода. В ряду стандартных потенциалов эти
металлы находятся между марганцем и водородом
(-1,0 ЕОМеn+/Ме 0).
3. Металлы, которые в водных растворах не могут быть получены.
В эту группу входят щелочные, щелочноземельные металлы, а
также магний и алюминий.
17.
18.
19.
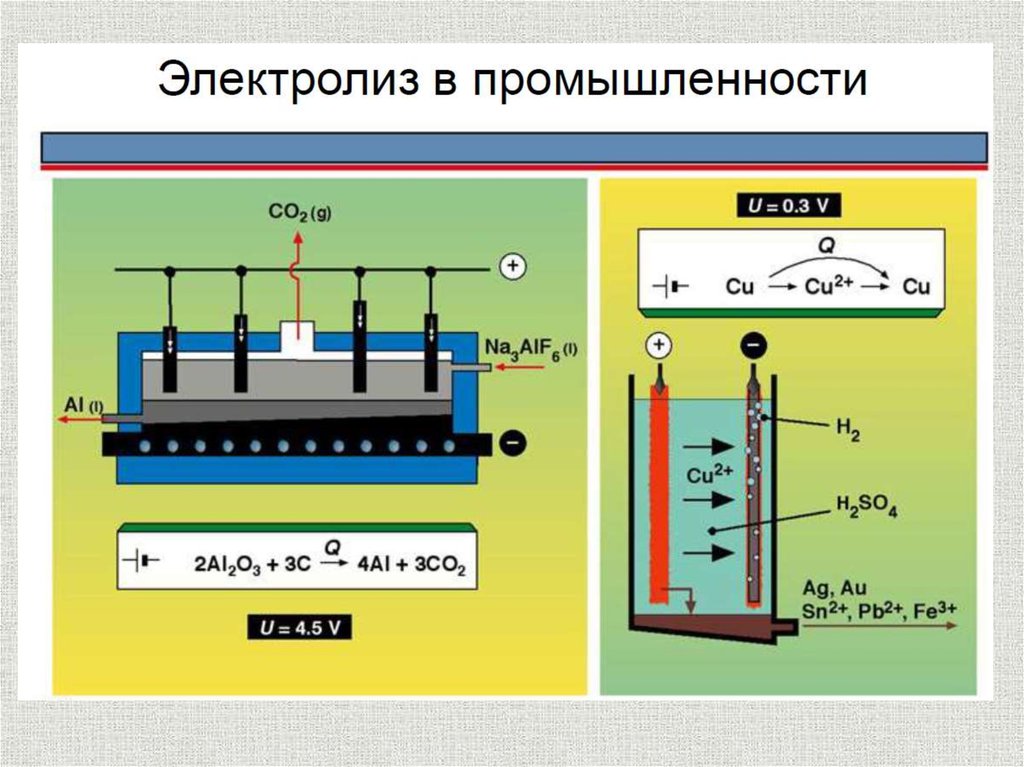
Электролиз с растворимыманодом
содержание
Электролиз с растворимым анодом используют для
рафинирования некоторых металлов – меди, никеля,
серебра, золота, свинца, олова и других, для нанесения
защитных и декоративных покрытий на поверхность
металлических изделий.
Процесс электролитического рафинирования состоит в
анодном растворении загрязненного примесями (чернового)
металла и последующем его катодном осаждении.
Me - ne = Men+
20.
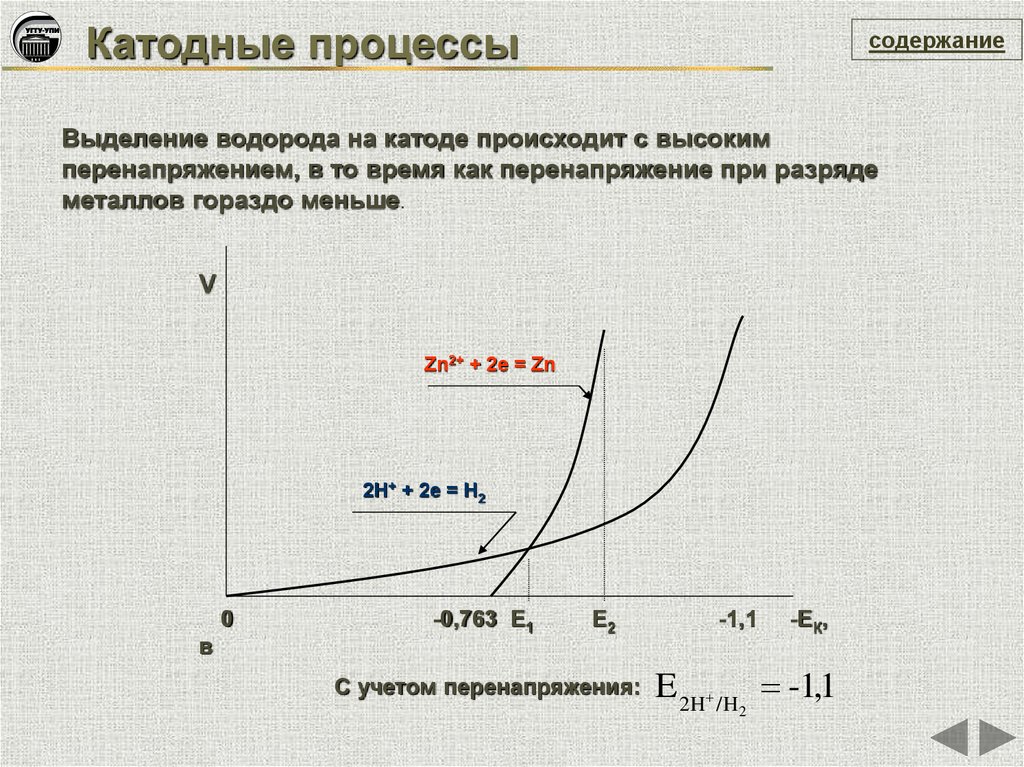
Катодные процессысодержание
Выделение водорода на катоде происходит с высоким
перенапряжением, в то время как перенапряжение при разряде
металлов гораздо меньше.
V
Zn2+ + 2e = Zn
2H+ + 2e = H2
0
в
-0,763 Е1
Е2
С учетом перенапряжения:
-1,1
-ЕК,
E 2H /H -1,1
2
21.
Анодные процессысодержание
На аноде идет процесс окисления
восстановителя:
Red – ne = Ох
Me - ne = Men+
Растворимый анод
2Cl- - 2e = Cl2
Разряд анионов
2Н2О – 4е = О2 + 4Н+
В кислой и нейтральной среде
4ОН- - 4е = О2 + 2Н2О
В щелочной среде
22.
Анодные процессысодержание
Выделение кислорода на аноде происходит с высоким
перенапряжением, в то время как перенапряжение при разряде
хлора гораздо меньше.
V
2Cl- - 2e = Cl2
2H2O – 4e = O2 + 4H+
1,23
1,36 E1
E2
С учетом перенапряжения:
1,8 EA, в
EO2/2H2O 1,8B.
23.
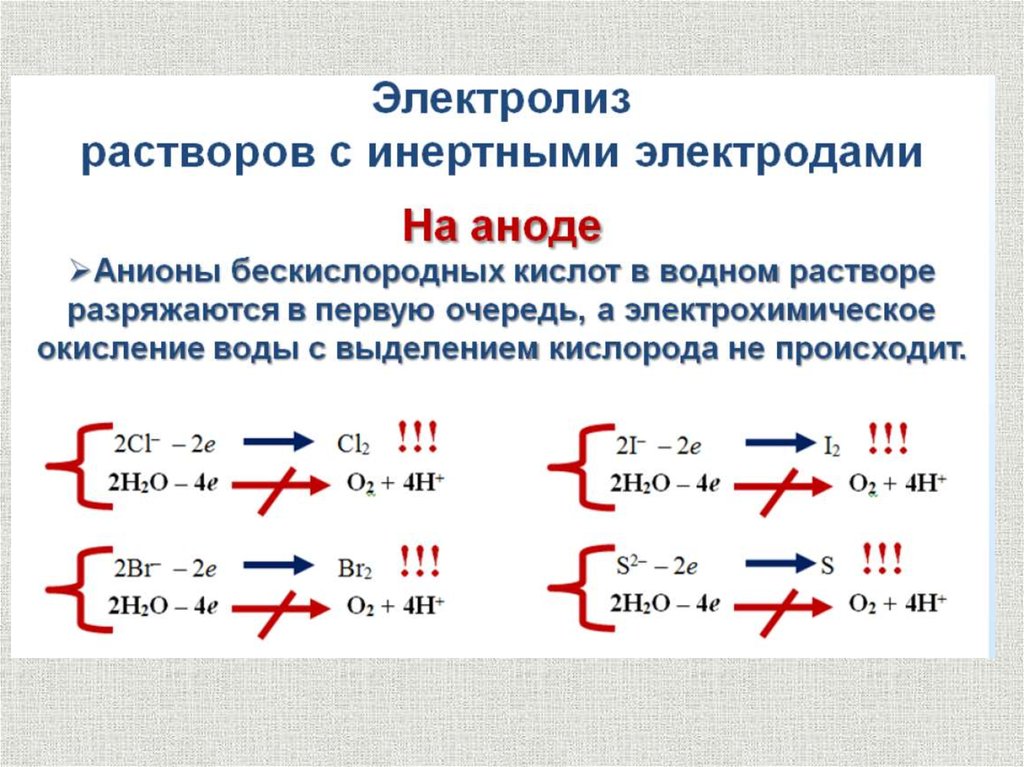
Анодные процессысодержание
Анионы кислородсодержащих кислот SO42-, PO43-, NO3- и др.,
в которых центральный атом имеет высшую степень
окисления, при электролизе водных растворов не
разряжаются.
Ионы галогенов: Cl-, Br-, I- в водном растворе легко
разряжаются:
2Hal- - 2e = Hal2
Фтор электролизом водных
растворов получить невозможно:
0
E F /2F
2
2,87B.
24.
Анодные процессысодержание
Пpи высоких анодных плотностях тока
некотоpые анионы могут окисляться до
пеpоксоанионов, напpимеp:
2SO42− − 2e = S2O82−
H2PO4− + 2OH−−2e = H2PO5− +H2O
25.
26.
Законы электролизасодержание
Установил (1833-1834) законы
электролиза, названные его
именем.
Фарадей (Faraday) Майкл
(1791-1867).
27.
28.
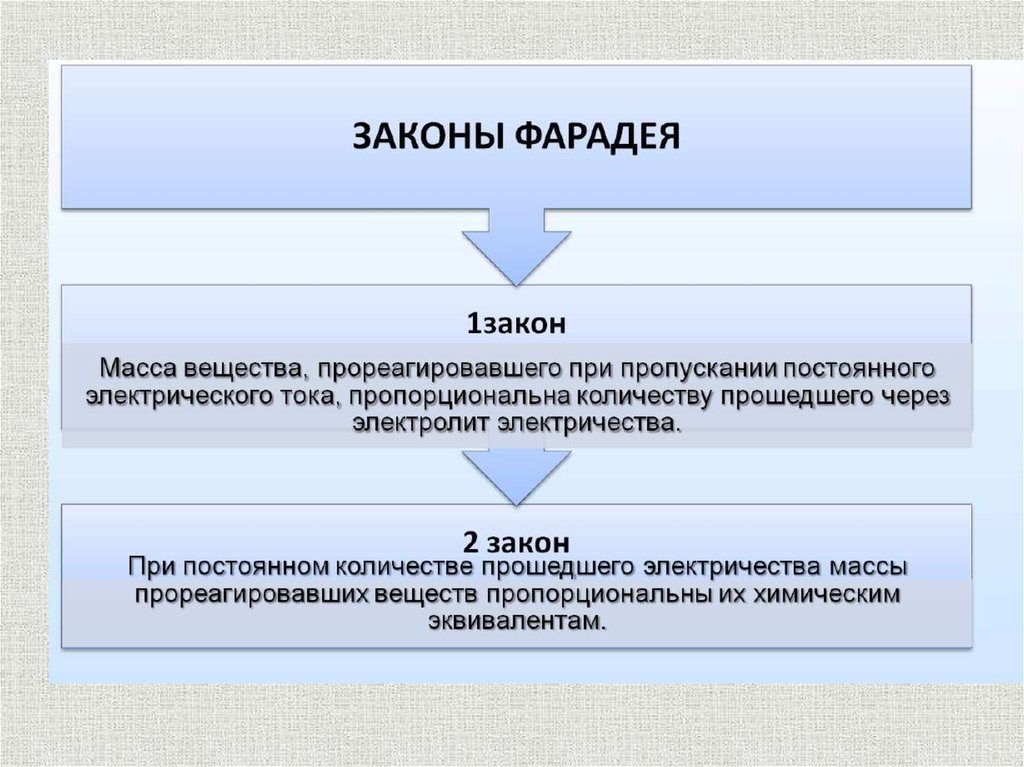
Законы электролизасодержание
I закон. Масса
вещества, окисленного на аноде или
восстановленного на катоде, пропорциональна количеству
прошедшего через раствор или расплав электричества.
m = kQ
II закон. Массы окисляющихся или восстанавливающихся на
электродах веществ при пропускании одного и того же
количества электричества пропорциональны их химическим
эквивалентам.
M(г) = MIT/nF
V(л) = 22,4IT/nF
29.
Законы электролизасодержание
Число Фарадея F
- это фундаментальная постоянная, равная
заряду одного моля электронов.
F = e·NA = 1,60218·10-19Кл·6,022045·1023моль-1 =
96484,6 Кл/моль ≈ ≈ 96500 Кл/моль
e – заряд одного электрона
NA – число Авогадро
30.
31.
32.
33.
Список литературысодержание
1. Ахметов Н.С. Общая и неорганическая химия. М.:
Высшая школа. 2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы
неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.:
МГУ, 1993.
4. А. Джонсон. Термодинамические аспекты в курсе
неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и
реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы
физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г.
Т.2. стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии.
М.: Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая
школа, 1987.
11. CRC Hand book of Chemistry and Physics. 82 издание.
2001-2002.























 Химия
Химия








