Похожие презентации:
Электролиз (лекция 12)
1.
Лекция 12Электролиз
2.
Электролиз – совокупность ОВР, которые идут наэлектродах при прохождении постоянного
электрического тока через расплавы и растворы
электролитов.
3.
На катоде – восстановлениеНа аноде – окисление
4.
Электролиз расплава NaCl5.
6.
Потенциал разложения – минимальноенапряжение, которое необходимо
устанавливать, чтобы электролиз шёл с
заметной скоростью.
очистка меди – 0,5 В
получение алюминия – 7 В
7.
Uразл .=|φок. – φвос.| + Uперен.На практике для проведения электролиза
всегда требуется более высокое
напряжение, чем вычисленное по
электродным потенциалам.
8.
Это объясняется наличием внутреннегосопротивления электролизера, явлением
концентрационной и электрохимической
поляризации электродов или
перенапряжением.
9.
Электрохимическая поляризация возникает в результате выделения наинертных электродах продуктов
электролиза, что меняет состояние
поверхности электродов и в электролизере
возникает гальванический элемент, ЭДС
которого необходимо преодолеть.
10.
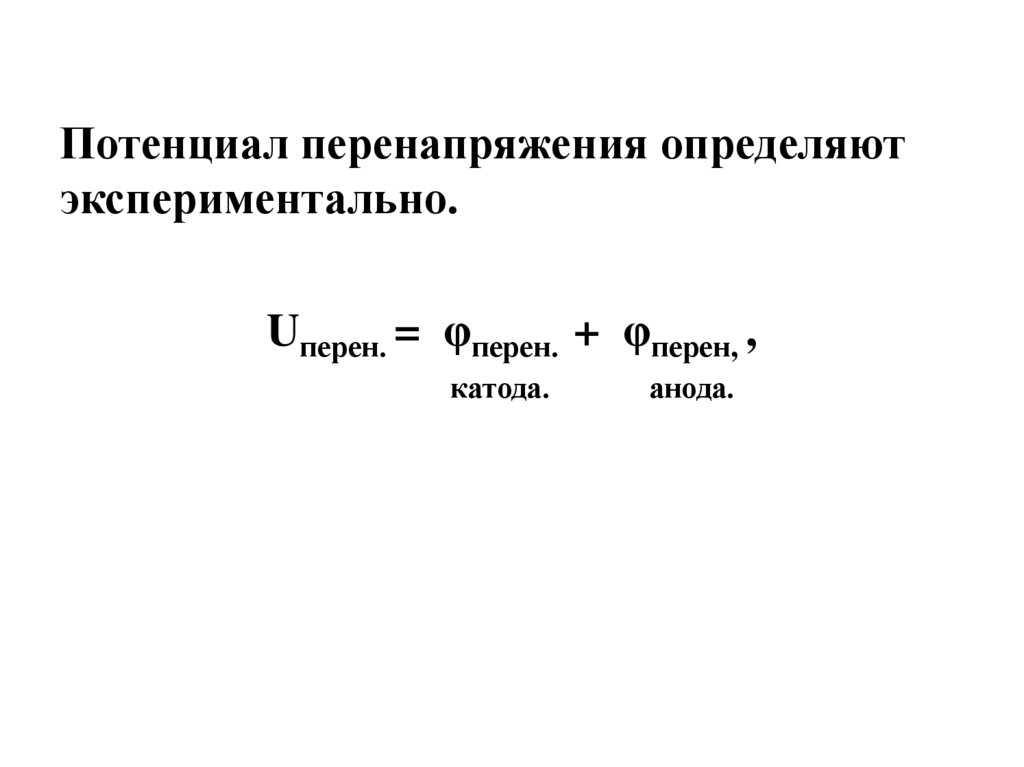
Потенциал перенапряжения определяютэкспериментально.
Uперен. = φперен. + φперен, ,
катода.
анода.
11.
Электролиз расплава гидроксида натрия! Электролиз расплавов возможен только для веществ, которые
плавятся без разложения.
12.
13.
На катоде в первую очередь восстанавливаетсяокислитель, у которого потенциал больше.
На аноде в первую очередь окисляется
восстановитель, у которого потенциал меньше.
14.
Ряд разряжаемости катионов на катодеI. Катионы активных металлов (от Li+ до Mn2+ )
катодная реакция 2Н2О + 2е Н2 + 2ОН–
II. Катионы металлов средней активности
(от Zn2+ до H) протекают одновременно две катодные реакции:
катодные 2Н2О + 2е Н2 + 2ОН–
реакции
Меn+ +ne Ме0
III. Катионы неактивных металлов (от H до Au3+) протекает только
осаждение металла, водород не выделяется:
катодная реакция Меn+ +ne Ме0
15.
Ряд разряжаемости анионов на анодеF–, NO3–, SO42–, PO43–… (Н2О) OH– Cl– Br– I– S2увеличивается легкость разряда аниона на аноде
Фторид-ионы и кислородсодержащие анионы элементов в высшей степени
окисления (NO3–, SO42- и др.) при электролизе водных растворов их солей не
разряжаются, на аноде протекает окисление воды или гидроксид ионов:
анодные 1) 2Н2О – 4е → О2 + 4Н+
реакции 2) 4ОН- – 4е → О2 + 2Н2О
Галогенид-ионы (Cl–, Br–, I–)
анодные
реакции
2Cl– – 2e → Cl2
2Br– – 2e → Br2
2I– – 2e → I2
16.
17.
Электролиз водного растворасульфата натрия Na2SO4
.
18.
19.
Электролиз водного растворайодида калия KI.
20.
21.
Электролиз водного растворасульфата меди(II) CuSO4
22.
23.
Электролиз водного растворасульфата меди(II) CuSO4
с активным анодом
24.
25.
Закон ФарадеяМасса электролита, подвергшаяся превращению при
электролизе, а также массы образующихся на электродах
веществ прямопропорциональны количеству электричества,
прошедшего через раствор или расплав электролита, и
эквивалентным массам соответствующих веществ.
26.
27.
28.
29.
Применение электролиза30.
1. Получение металлов.– получение щелочных и щелочно-земельных металлов из
расплавов их солей.
– получение алюминия электролизом расплавов бокситов (оксида
алюминия).
2. Получение различных химических веществ
– получение хлора (Cl2) электролизом хлорида натрия.
– получение фтора (F2)электролизом расплава его солей (СaF2)
– получение водорода (Н2) электролизом растворов солей
активных металлов
3. Очистка металлов
4. Получение металлических покрытий
5. Защита от коррозии
6. Зарядка аккумуляторов
31.
32.
Задачи к теме «Электролиз» по задачнику ГлинкаБ-18 688. 692, 693, 699, 703, 706. 707
33.
Вопросы к теме «Электролиз»1. Что такое электролиз?
2. Дать понятие о потенциале разложения
3. Как происходит поляризация электродов
а) концентрационная
б) электрохимическая (перенапряжение).
4. Вода – окислитель (вода на катоде)
Вода – восстановитель (вода на аноде)
5. Ряд разряжаемости катионов
6. Ряд разряжаемости анионов
7. Закон Фарадея
8. Выход по току
9. Применение электролиза
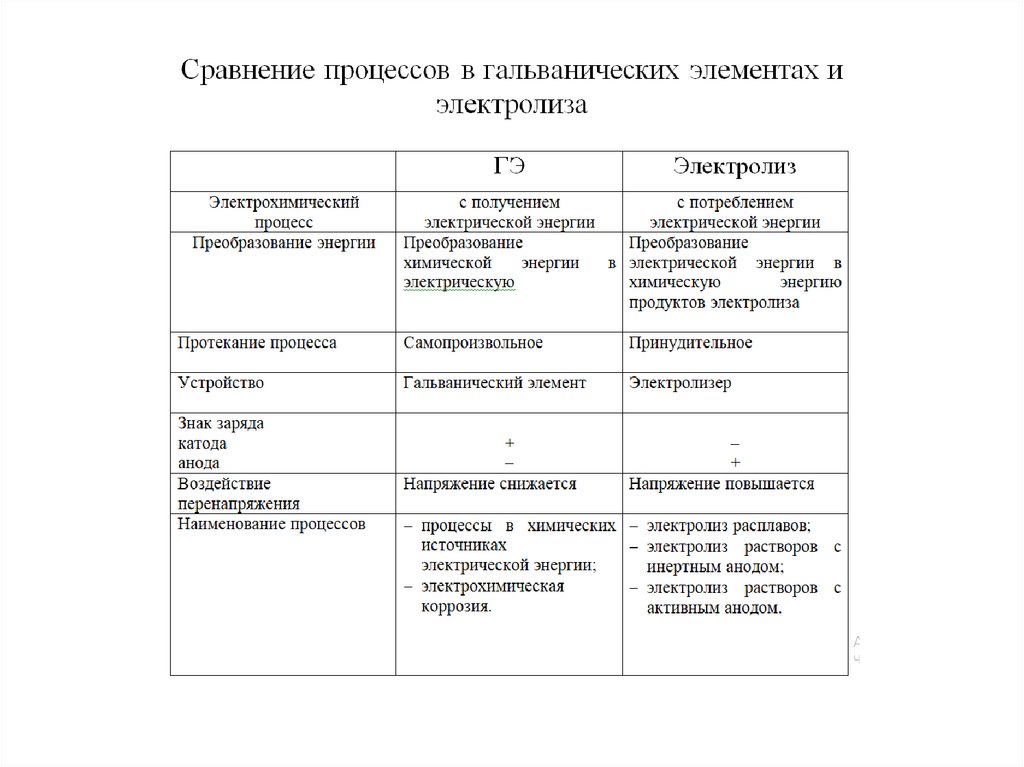
10. Сравнение процессов электролиза и гальванических элементов

























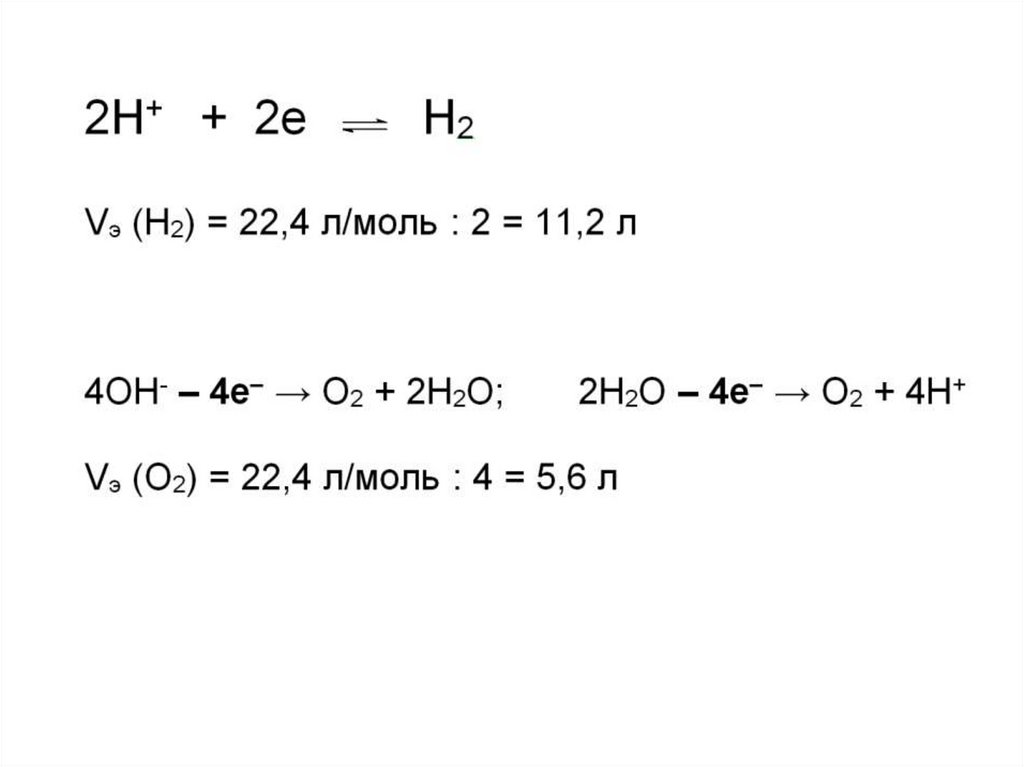
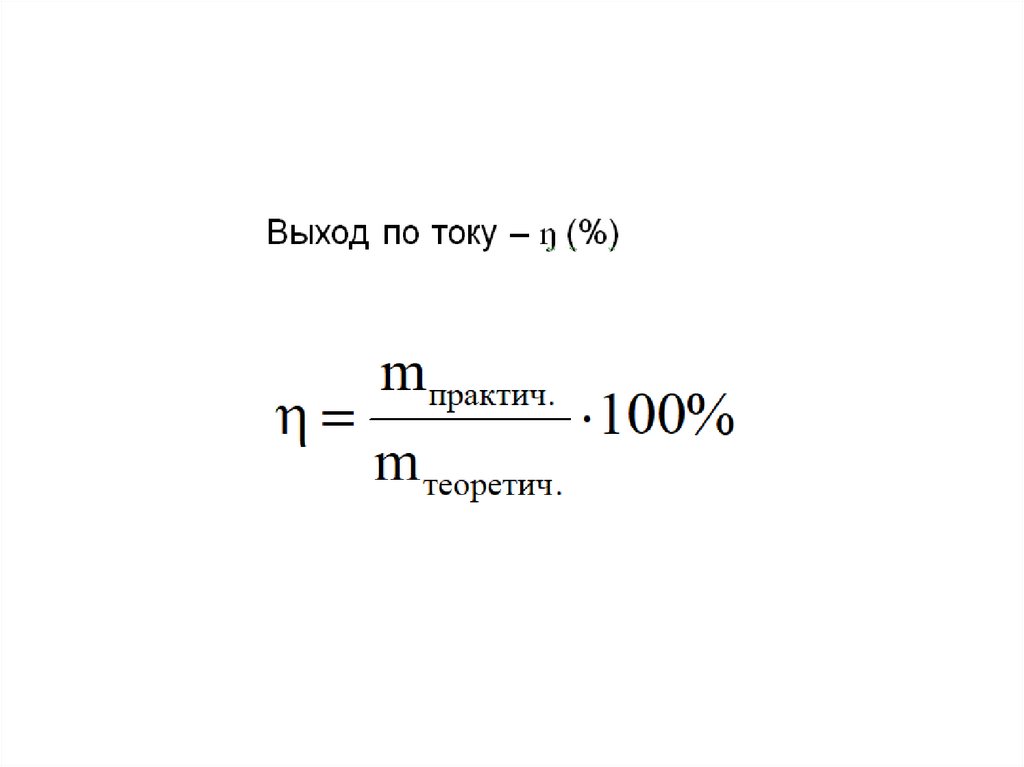






 Химия
Химия








