Похожие презентации:
Классификация углеводов. Глюкоза
1. Глюкоза
2.
Углеводы – это органические вещества,
молекулы которых состоят из атомов углерода,
водорода и кислорода, причем водород и
кислород находятся в них, как правило в таком
же соотношении, как и в молекуле воды (2:1).
Общая
формула:
CnH2nOn
(Исключение
дезоксирибоза C5H10O4)
3.
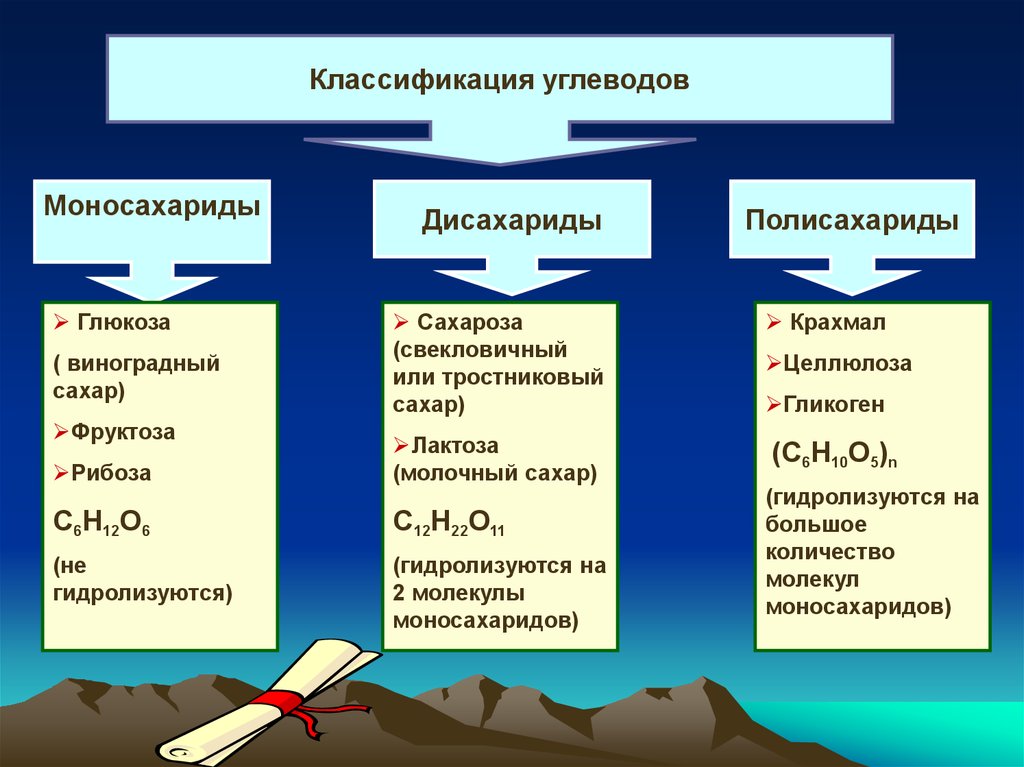
Классификация углеводовМоносахариды
Глюкоза
Дисахариды
Полисахариды
Сахароза
(свекловичный
или тростниковый
сахар)
Крахмал
Рибоза
Лактоза
(молочный сахар)
(С6Н10О5)n
С6Н12О6
С12Н22О11
(не
гидролизуются)
(гидролизуются на
2 молекулы
моносахаридов)
( виноградный
сахар)
Фруктоза
Целлюлоза
Гликоген
(гидролизуются на
большое
количество
молекул
моносахаридов)
4.
• ГЛЮКОЗА–
бесцветное
кристаллическое
вещество,
хорошо растворимое в воде,
сладкое на вкус.
• Она встречается почти во всех
органах растения: в плодах,
корнях, листьях, цветах.
• Особенно много глюкозы в соке
винограда и в спелых фруктах,
ягодах.
• Глюкоза есть и в животных
организмах. В крови человека её
содержится примерно 0,1%.
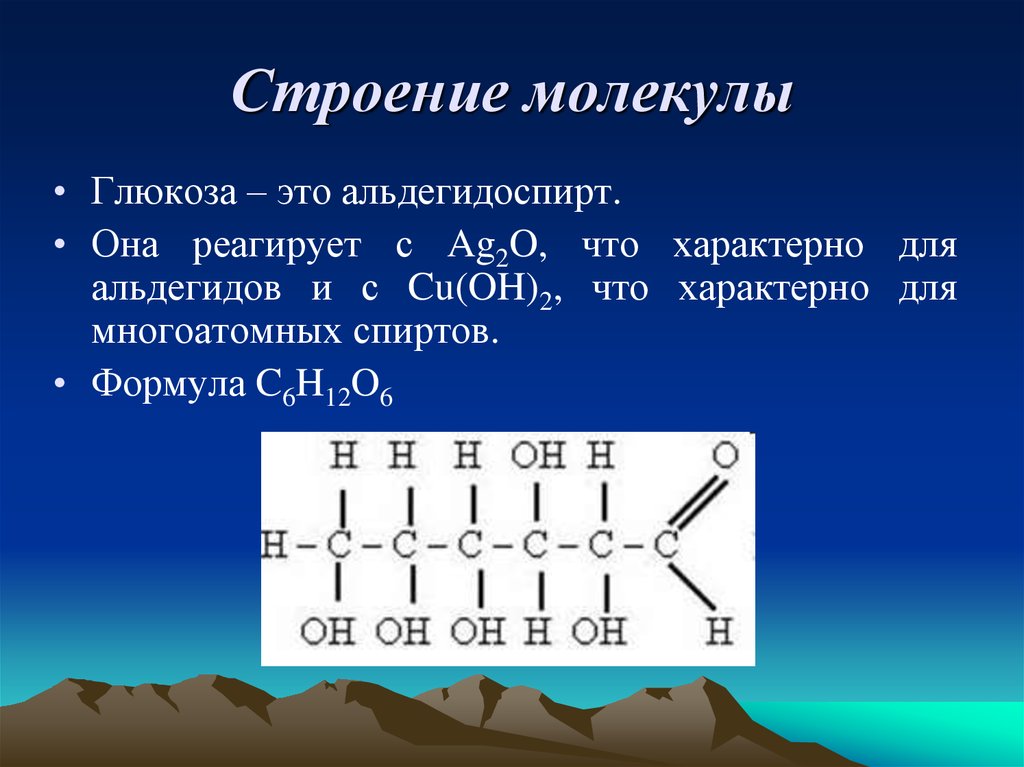
5. Строение молекулы
• Глюкоза – это альдегидоспирт.• Она реагирует с Ag2O, что характерно для
альдегидов и с Cu(OH)2, что характерно для
многоатомных спиртов.
• Формула C6H12O6
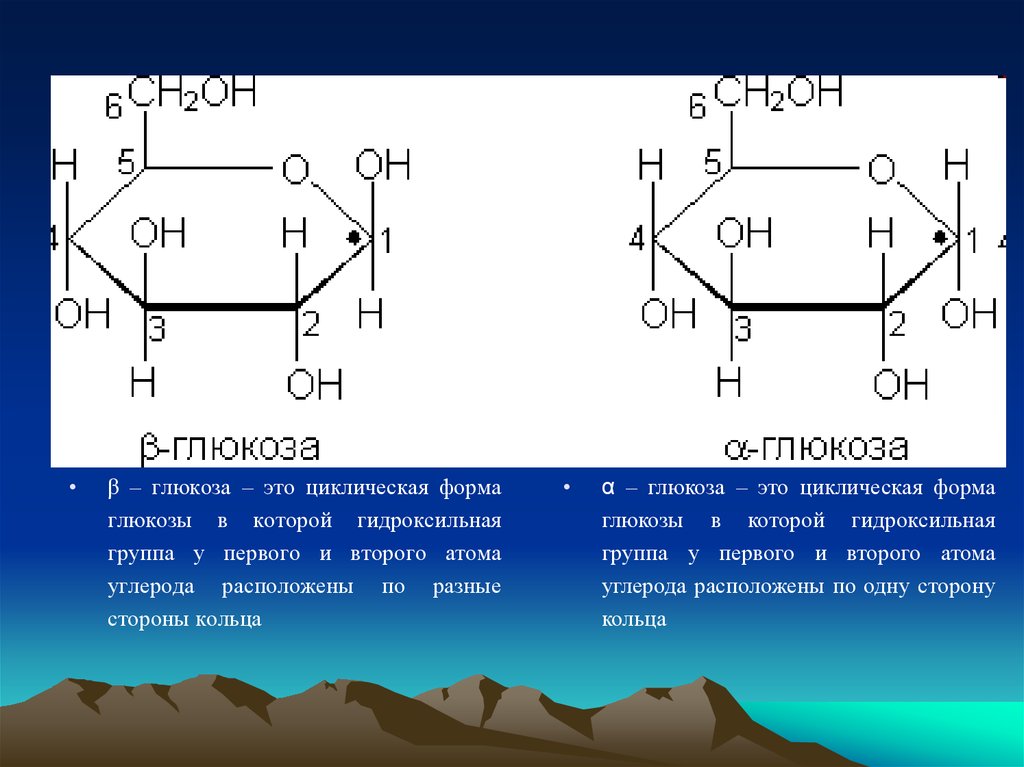
6.
β – глюкоза – это циклическая форма
глюкозы в которой гидроксильная
группа у первого и второго атома
углерода расположены по разные
стороны кольца
α – глюкоза – это циклическая форма
глюкозы в которой гидроксильная
группа у первого и второго атома
углерода расположены по одну сторону
кольца
7. Химические свойства
• С Cu(OH)2 глюкоза образует ярко-синийраствор.
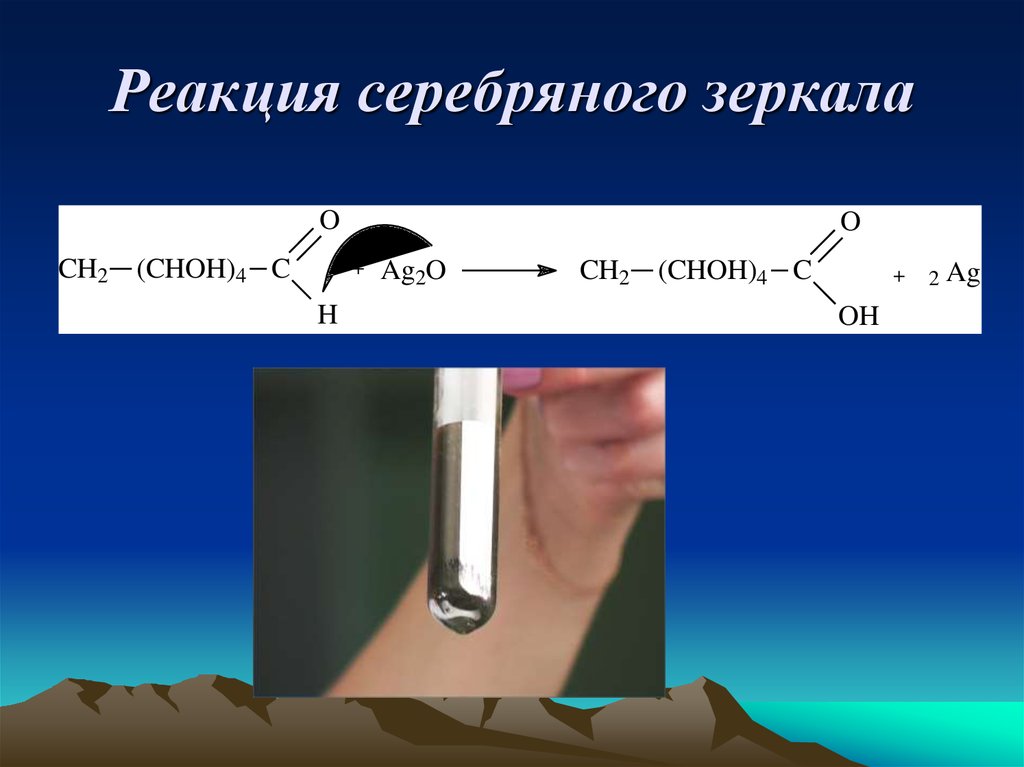
8. Реакция серебряного зеркала
OCH2
(CHOH)4 C
O
+
H
Ag2O
CH2
(CHOH)4 C
+
OH
2
Ag
9. Реакция медного зеркала
OO
CH2
+ 2
(CHOH)4 C
H
Cu(OH)2
CH2
(CHOH)4 C
+
OH
Cu2O
+ 2
H2O
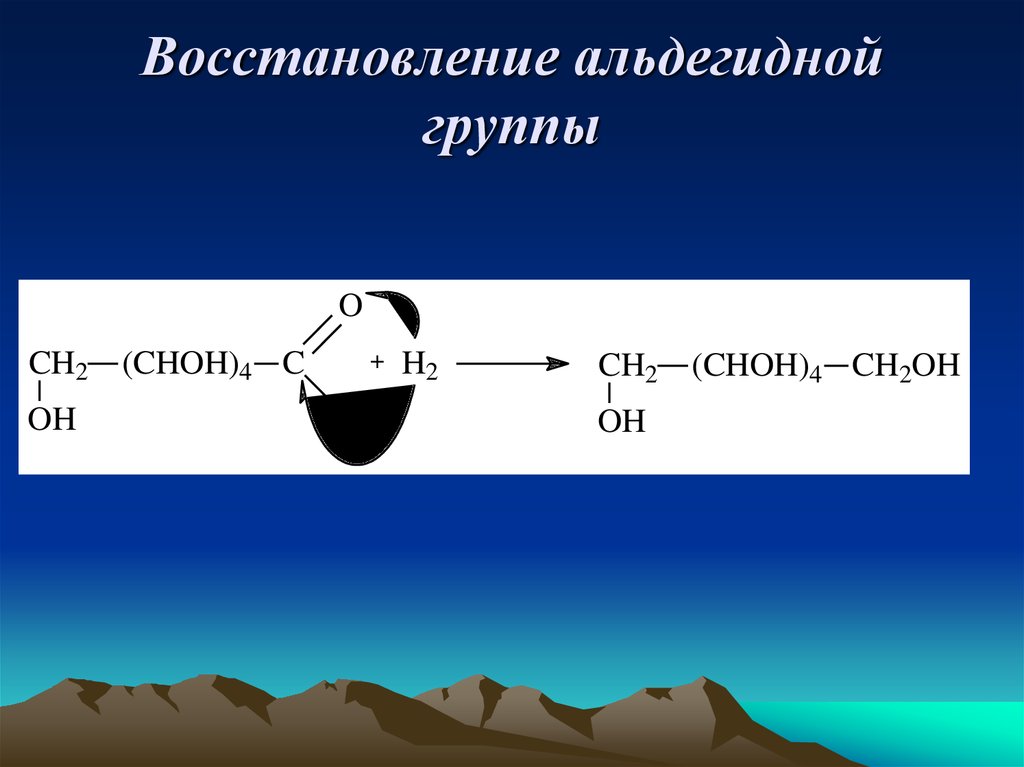
10. Восстановление альдегидной группы
OCH2
OH
(CHOH)4 C
+
H
H2
CH2
OH
(CHOH)4 CH2OH
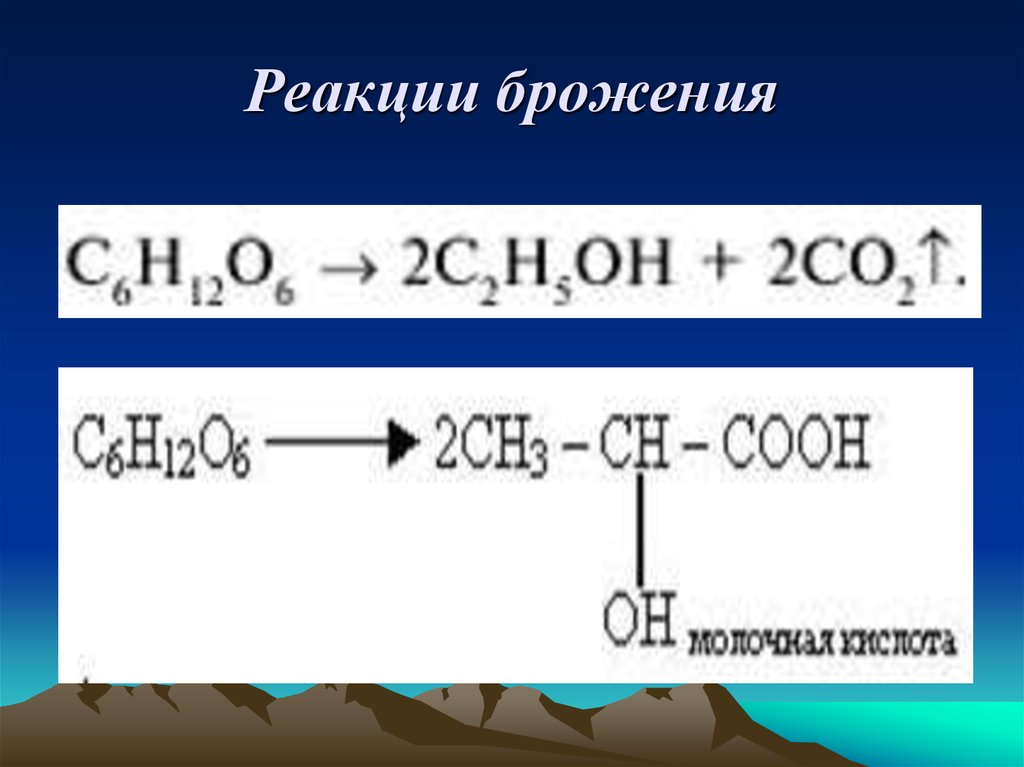
11. Реакции брожения
12. Применение глюкозы
• Источник энергии• Получение искусственного сахара
• Получение этилового спирта
• В кондитерской промышленности
• Для изготовления
украшений.
зеркал
и
елочных
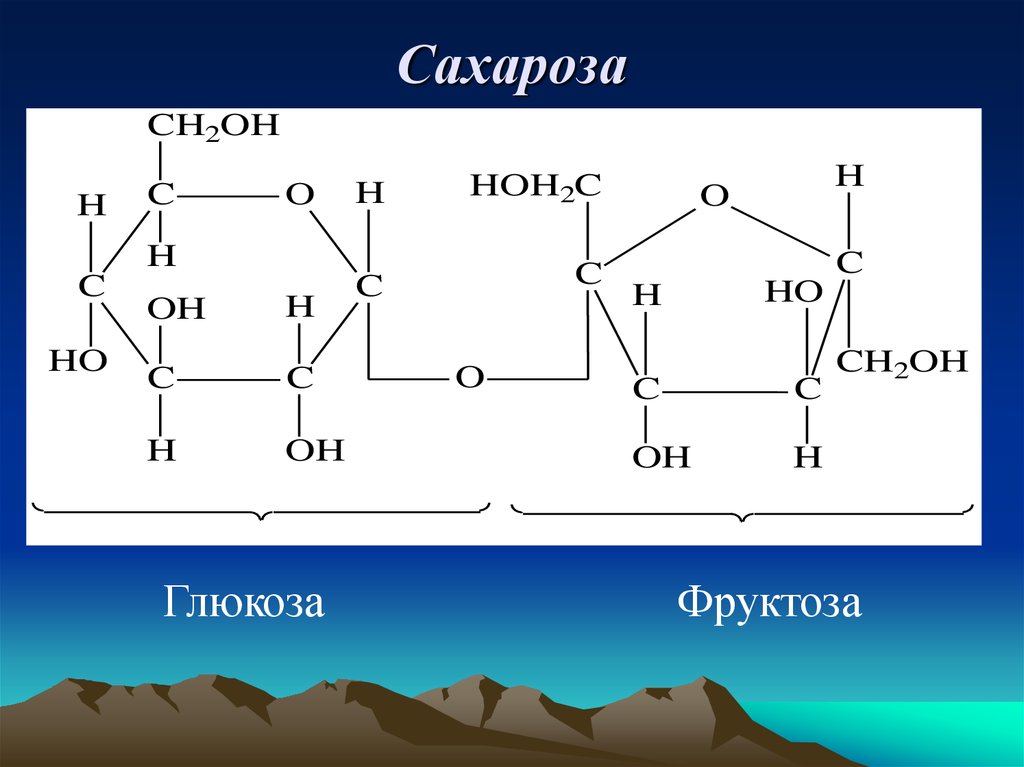
13. Сахароза
CH2OHH
C
O
H
HOH2C
C
C
H
C
HO
OH
H
C
C
H
OH
Глюкоза
O
H
O
HO
H
C
C
OH
H
C
CH2OH
Фруктоза
14. Нахождение в природе
• Сахарозавходит
в
состав
сахарного тростника (14-26 %) и
сока сахарной свеклы (16-20 %).
• В
больших
количествах
содержится вместе с глюкозой в
плодах и листьях растений.
• Получают
из
тростника и свеклы.
сахарного
15. Физические свойства
• Бесцветноекристаллическое
сладковатого вкуса.
• Хорошо растворимое в воде.
вещество
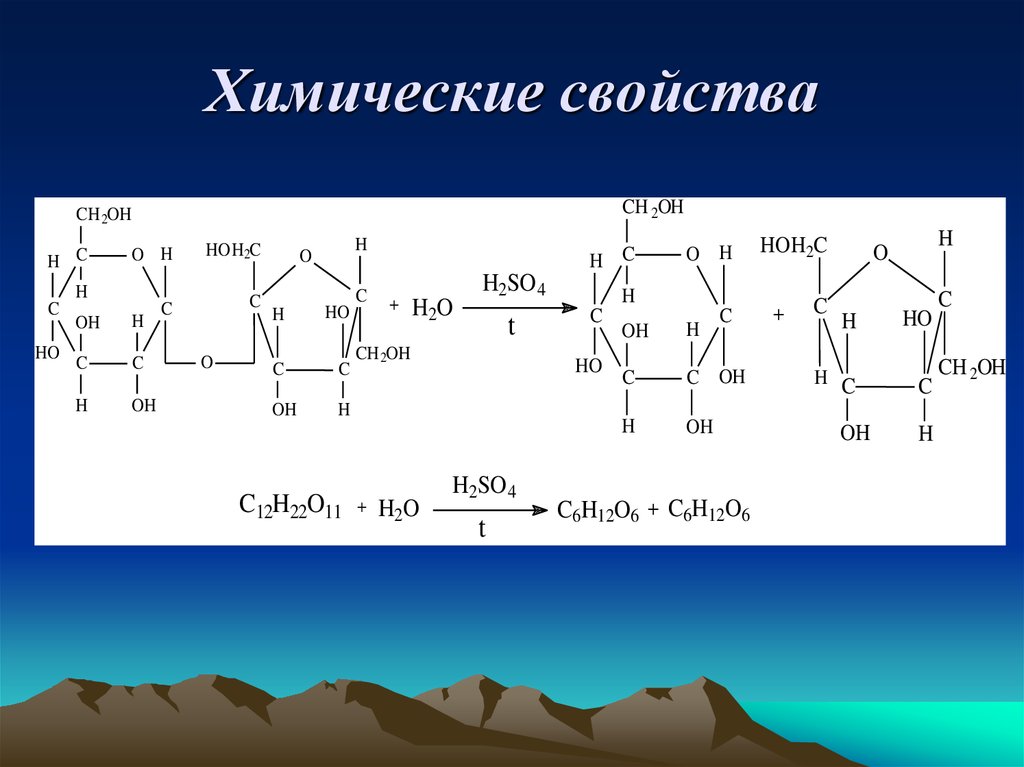
16. Химические свойства
CH 2OHCH 2OH
H C
O H
HOH2C
C
C
H
C
HO
OH
H
C
C
H
OH
O
H
O
H
HO
C
C
OH
H
C12H22O11
C
H C
+
H2O
H2SO 4
t
CH 2OH
+
H2O
H
C
HO
H2SO 4
t
O H
C
OH
H
C
C OH
H
OH
C6H12O6 + C6H12O6
HOH2C
+
C
H
O
H
H C
OH
HO
C
H
C
CH 2OH
17. Применение
• Как продукт питания• В кондитерской промышленности
• Для получения искусственного меда.










 Химия
Химия








