Похожие презентации:
Процессы переноса
1. Процессы переноса
Лекция 8Процессы переноса
2. §§ Время релаксации
Если система находится в неравновесномсостоянии, то, предоставленная самой
себе она будет постепенно переходить
к равновесному состоянию.
Переход системы в состояние равновесия
называют релаксацией, а время,
в течение которого оно достигается
– временем релаксации.
Различают время релаксации
распределения и всего вещества.
02
3.
Случайные отклонения физическойвеличины от ее среднего значения
будем называть флуктуациями
Чем больше отклонение, тем менее
оно вероятно.
Чем больше молекул в объеме, тем
меньше становятся флуктуации.
03
4. §§ Общее уравнение
Пусть G – характеризует некотороемолекулярное свойство, отнесенное
к одной молекуле (заряд, энергия,
импульс, концентрация и т.д.)
В равновесном состоянии
по объему.
G = const
При неоднородности G происходит
движение в направлении уменьшения
G
04
5.
Sx
x
x
Выберем ось x
вдоль направления
уменьшения G
Рассмотрим площадку ΔS, расположенную
в точке с координатой x и интервал
[ x , x ], где – средняя длина
свободного пробега молекул.
– в большинстве случаев, малая
величина
05
6.
ПредставимG(x) в виде ряда Тейлора
G
2
G( x ) G ( x)
o ( )
x
Поток молекул в (+) направлении оси x
(штук в ед. времени через ед. площади)
1
N n
6
Поток величины
IG
G:
1
G
N G ( x ) n G ( x)
6
x
06
7.
Поток в противоположном направлении:IG
1
G
N G ( x ) n G ( x)
6
x
Результирующий поток:
IG
IG
IG
1
G
n
3
x
– это основное уравнение процесса
переноса G
07
8. §§ Диффузия. Самодиффузия
В состоянии равновесия плотностькаждой из компонент во всех точках
фазы одинакова.
При отклонении плотности от
равновесного значения возникает
движение вещества, которое приводит
к равновесному состоянию.
Связанный с этим движением перенос
вещества называется диффузией
08
9.
Рассмотрим газ,содержащий молекулы
одного сорта.
Мысленно разделим молекулы на два
вида (например, белые и черные)
и проследим за выравниванием
концентрации.
n1 ( x) – конц. молекул I-го сорта
G
n0 – равновесное значение
n1 ( x)
1
1
n1
I n n0
x n0
3
3
x
09
10.
n1In D
x
– уравнение Фика
1
D – коэффициент
3
диффузии
При нормальных условиях для
O2 и N2
D ~ 10–5 м2/с
для жидкостей на пять порядков меньше
для твердых тел – еще на шесть
порядков меньше
10
11. §§ Теплопроводность
В состоянии равновесия температура вовсех точках системы одинакова
В неравновесном состоянии возникает
движение молекул с высокой энергией,
которое выравнивает температуру
Связанный с этим движением процесс
переноса теплоты называется
теплопроводностью
11
12.
G – средняя энергия, приходящаяся наодну молекулу
CV n m
CV
i
1 i
T
G k BT
T
RT
NA n m
2
NA
NA 2
1
c T
n
c
CV T – энергия одного
моля вещества
молярная теплоемкость
– удельная теплоемкость [Дж/кг∙К]
Уравнение переноса
1
T
I g c
3
x
12
13.
TI g q
– закон Фурье
x
1
q c – теплопроводность
3
S
Ig – это поток тепла,
Вт
Дж
I g 2 2
I g ( x x)
м с м I g ( x)
I g ( x) S t – количество теплоты,
поступающее в цилиндр за Δt
I g ( x x) S t – количество теплоты,
уходящее за это время
13
14.
Q I g ( x) I g ( x x) S tI g
x S t
t
С другой стороны:
Q c m T,
Получаем
c – удельная
теплоемкость
I g
T T
T
c
q
c
t
x
t x x
для O2: λq ≈ 24 мВт/м·К, Al: λq ≈ 235 Вт/м·К
14
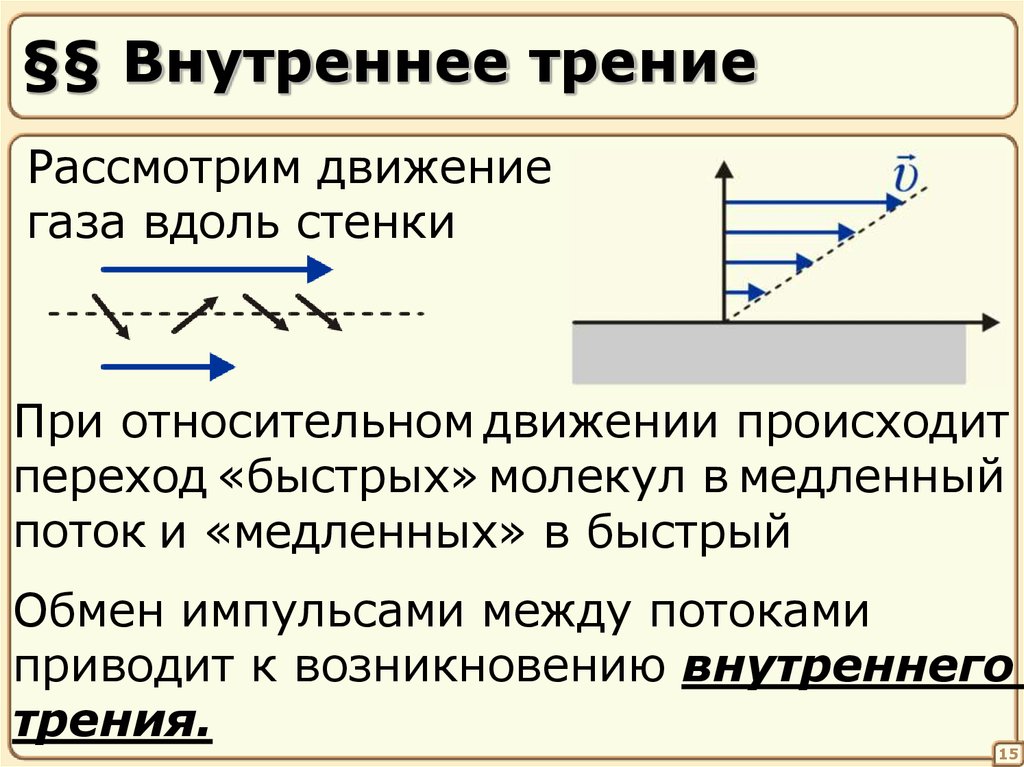
15. §§ Внутреннее трение
Рассмотрим движениегаза вдоль стенки
При относительном движении происходит
переход «быстрых» молекул в медленный
поток и «медленных» в быстрый
Обмен импульсами между потоками
приводит к возникновению внутреннего
трения.
15
16.
G m0u , где u – скорость «дрейфа»Следовательно
(m0u )
1
u
I g n
I g
3
x
x
– это закон внутреннего трения Ньютона
Величина Ig имеет смысл вязкого
касательного напряжения
1
n m0 – динамическая
3
вязкость
или коэффициент внутреннего трения
16















 Физика
Физика