Похожие презентации:
Химическая реакция
1.
ОСНОВНЫЕ ПОНЯТИЯ ОХИМИЧЕСКОЙ РЕАКЦИИ
2.
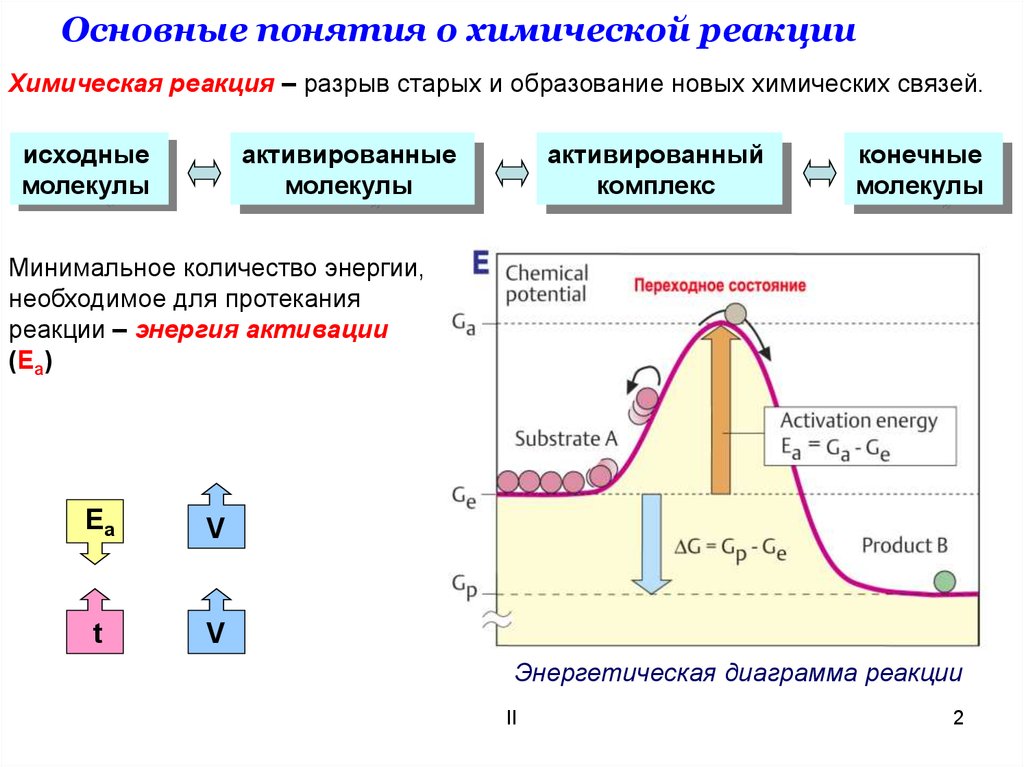
Основные понятия о химической реакцииХимическая реакция – разрыв старых и образование новых химических связей.
исходные
молекулы
активированные
молекулы
активированный
комплекс
конечные
молекулы
Минимальное количество энергии,
необходимое для протекания
реакции – энергия активации
(Еа)
Ea
V
t
V
Энергетическая диаграмма реакции
II
2
3.
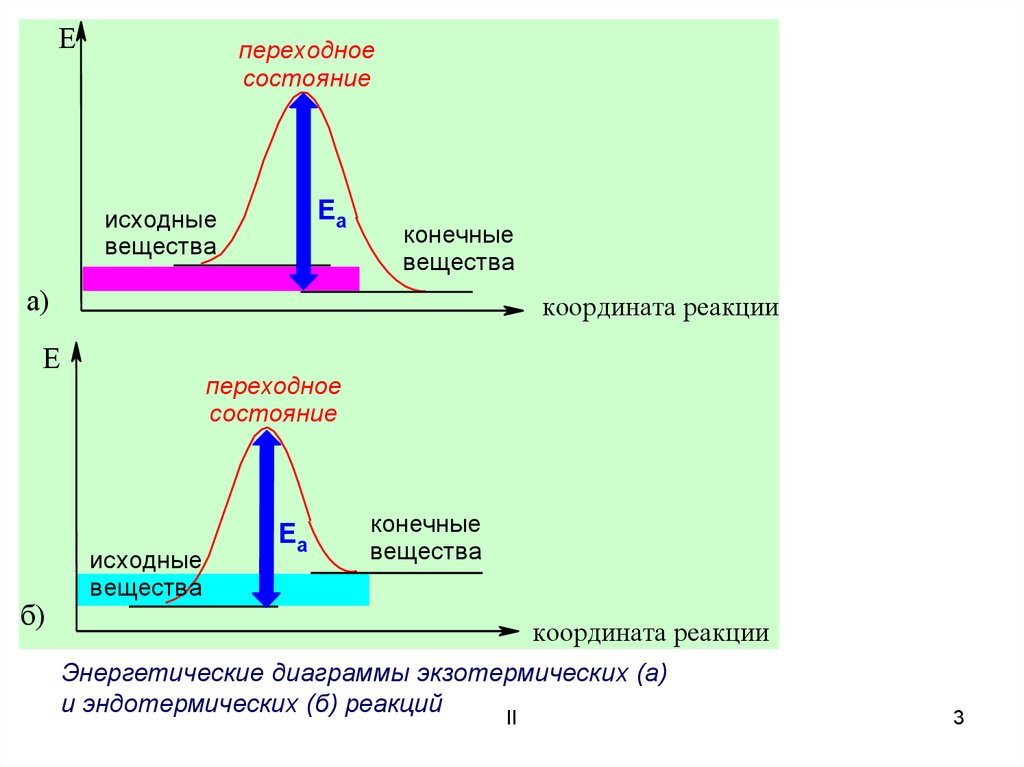
Епереходное
состояние
Ea
исходные
вещества
конечные
вещества
а)
координата реакции
Е
б)
переходное
состояние
исходные
вещества
Ea
конечные
вещества
координата реакции
Энергетические диаграммы экзотермических (а)
и эндотермических (б) реакций
II
3
4.
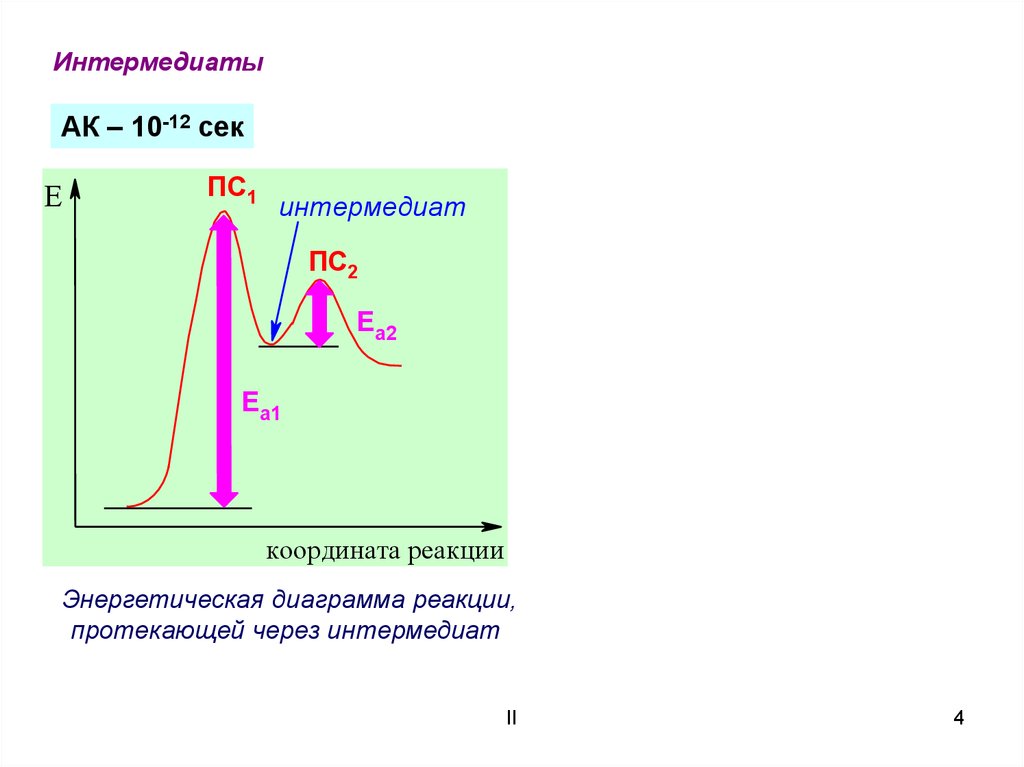
ИнтермедиатыАК – 10-12 сек
Е
ПС1
интермедиат
ПС2
Ea2
Ea1
координата реакции
Энергетическая диаграмма реакции,
протекающей через интермедиат
II
4
5.
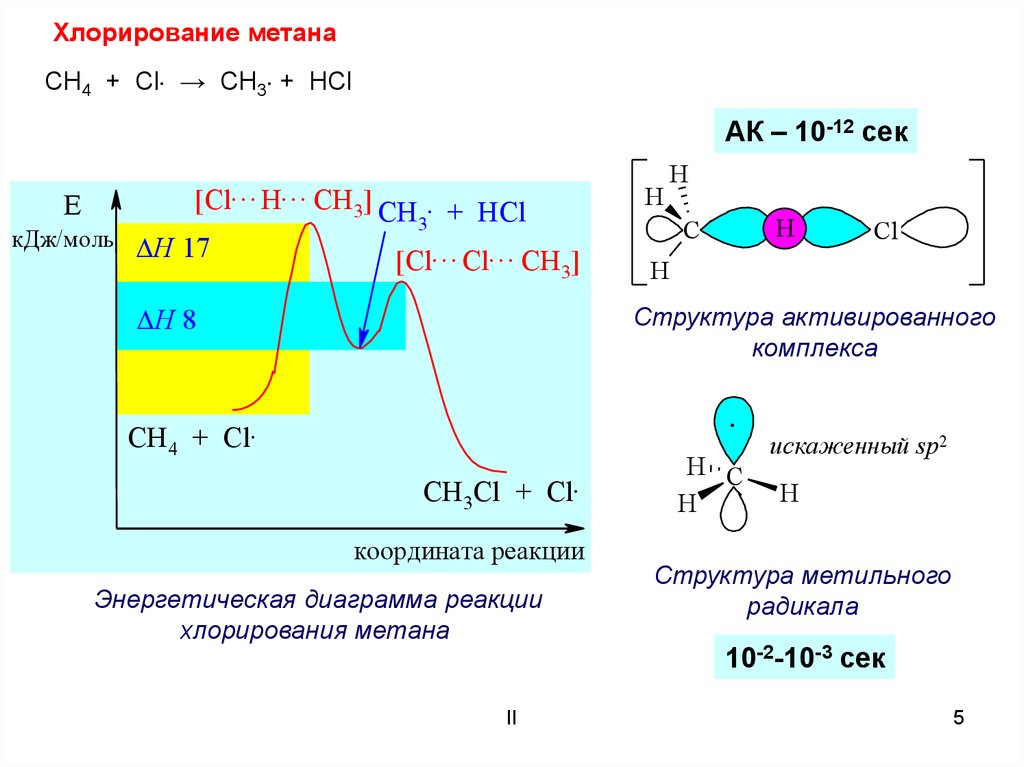
Хлорирование метанаCH4 + Cl → CH3 + HCl
АК – 10-12 сек
[Cl. . . H. . .
Е
кДж/моль
H 17
CH3] CH
3
.
H
+ HCl
H
H
C
[Cl. . . Cl. . . CH3]
H 8
Cl
H
Структура активированного
комплекса
.
CH4 + Cl.
CH3Cl +
Cl.
координата реакции
Энергетическая диаграмма реакции
хлорирования метана
II
H C
H
искаженный sp2
H
Структура метильного
радикала
10-2-10-3 сек
5
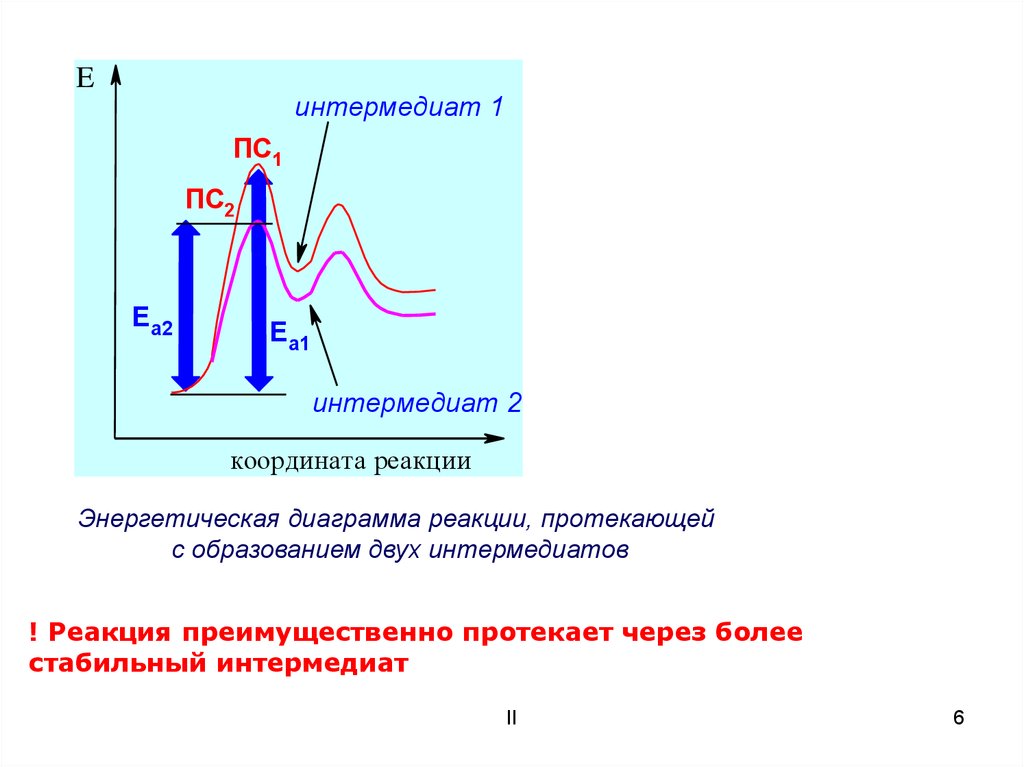
6.
Eинтермедиат 1
ПС1
ПС2
Ea2
Ea1
интермедиат 2
координата реакции
Энергетическая диаграмма реакции, протекающей
с образованием двух интермедиатов
! Реакция преимущественно протекает через более
стабильный интермедиат
II
6
7.
EПС2
ПС1
Ea1
B
A
H
Ea2
C
координата реакции
координата реакции
Энергетическая диаграмма конкурентной реакции В↔А→С
А↔В
А↔С
кинетический контроль
термодинамический контроль
II
7
8.
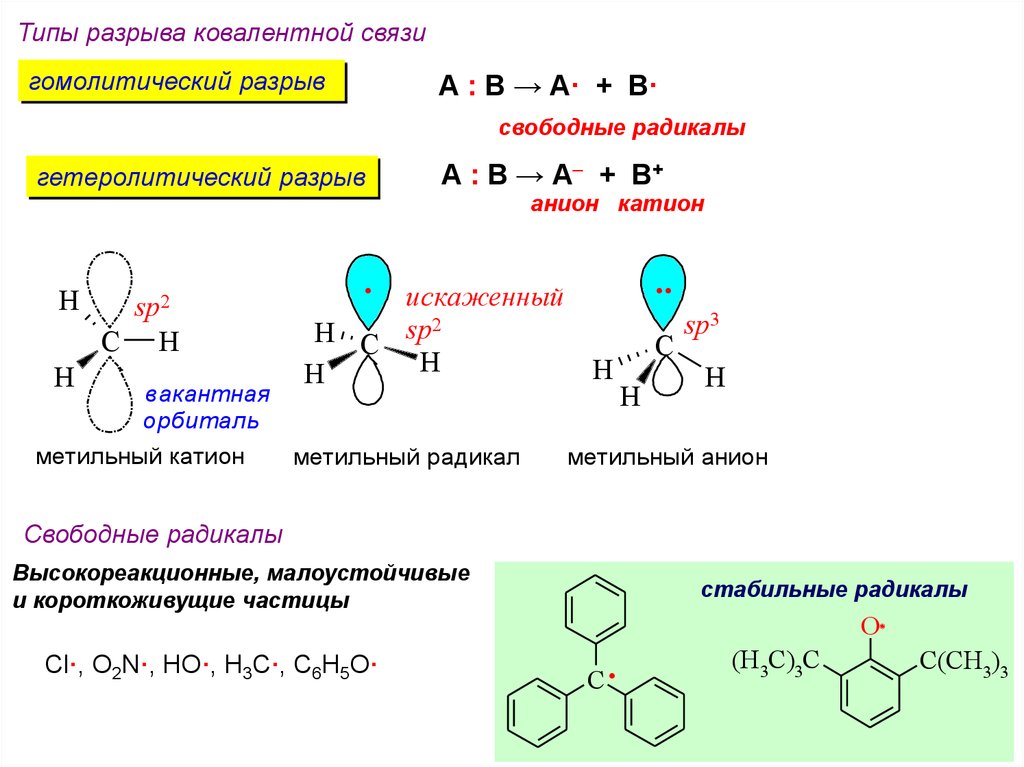
Типы разрыва ковалентной связигомолитический разрыв
А : В → А· + В·
свободные радикалы
гетеролитический разрыв
H
sp2
C
H
H
А : В → А + В+
анион катион
. искаженный
H C sp2
H
H
вакантная
орбиталь
метильный катион
метильный радикал
..
H
C
H
sp3
H
метильный анион
Свободные радикалы
Высокореакционные, малоустойчивые
и короткоживущие частицы
стабильные радикалы
O
C.
Cl·, O2N·, HO·, H3C·, C6H5O·
II
(H3C)3C
C(CH3)3
8
9.
Нуклеофилы – частицы с электрондонорными свойствами, способными отдаватьпару электронов на образование ковалентной связи с электрофильной частицей.
:Nu или Nu
Н , НО , HS , Hal , HC C
анионы, в т.ч. карбанионы
..
нейтральные соединения с атомами,
имеющими неподеленные пары
электронов
..
.. ..
..
H2O, ROH, H2S, NH3, RNH2
нейтральные соединения с сильно
полярной связью
H3C Mg Br , HC C MgI
углеводороды с -электронными
системами
H2C CH2 ,
II
9
10.
Электрофилы – частицы с электроноакцепторными свойствами, способныеобразовывать ковалентную связь с нуклеофильной компонентой за счет ее
электронной пары.
Е или Е+
катионы, включая карбокатионы
Н+, Br+, NO2+, ArN2+, R3C+
нейтральные соединения с атомами,
имеющими незаполненную орбиталь
BF3, FeBr3, AlCl3
нейтральные соединения с сильно
полярной связью
R2CHBr, R2C=O, R C N
нейтральные легко поляризующиеся
соединения
Cl2, Br2, I2
II
10
11.
Типы реакцийреакции присоединения
(А от англ. addition)
CH2=CH2 + Cl2 → CH2Cl CH2Cl
реакции замещения
(S от англ. substitution)
CH3Br + AgOH → CH3OH + AgBr
реакции отщепления
(Е от англ. elimination)
CH3CH2OH → CH2=CH2 + H2O
CH2
реакции циклоприсоединения
HC
HC
кислотно-основные реакции
HCl + NH2CH3 → CH3NH3+ Cl-
реакции изомеризации
CH2
+ CH
CH2
CN
СH2=C=CH2
II
Na
t
CN
HC C CH3
11
12.
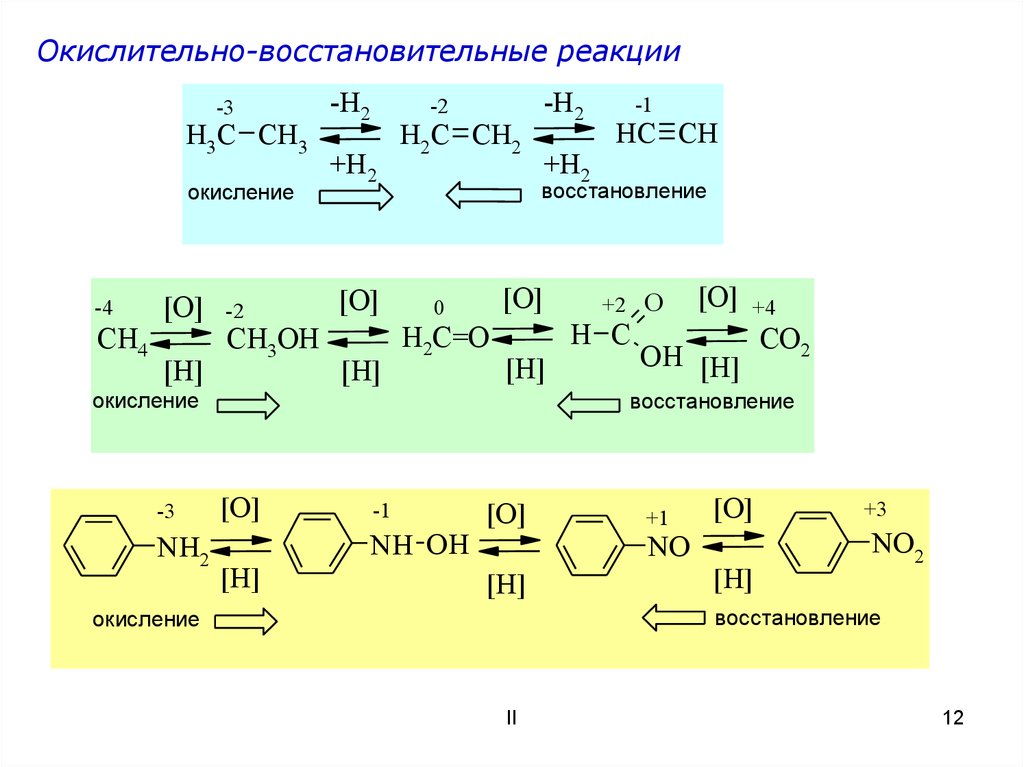
Окислительно-восстановительные реакции-3
H3C CH3
окисление
-4
CH4
[O]
[H]
-2
CH3OH
-H2
+H2
[O]
[H]
H2C CH2
NH2
+H2
-1
HC CH
восстановление
[O]
0
H2C=O
O
+2
H C
[H]
окисление
-3
-H2
-2
[O]
+4
OH [H]
CO2
восстановление
[O]
-1
NH OH
[H]
[O]
+1
NO
[H]
[O]
[H]
+3
NO2
восстановление
окисление
II
12
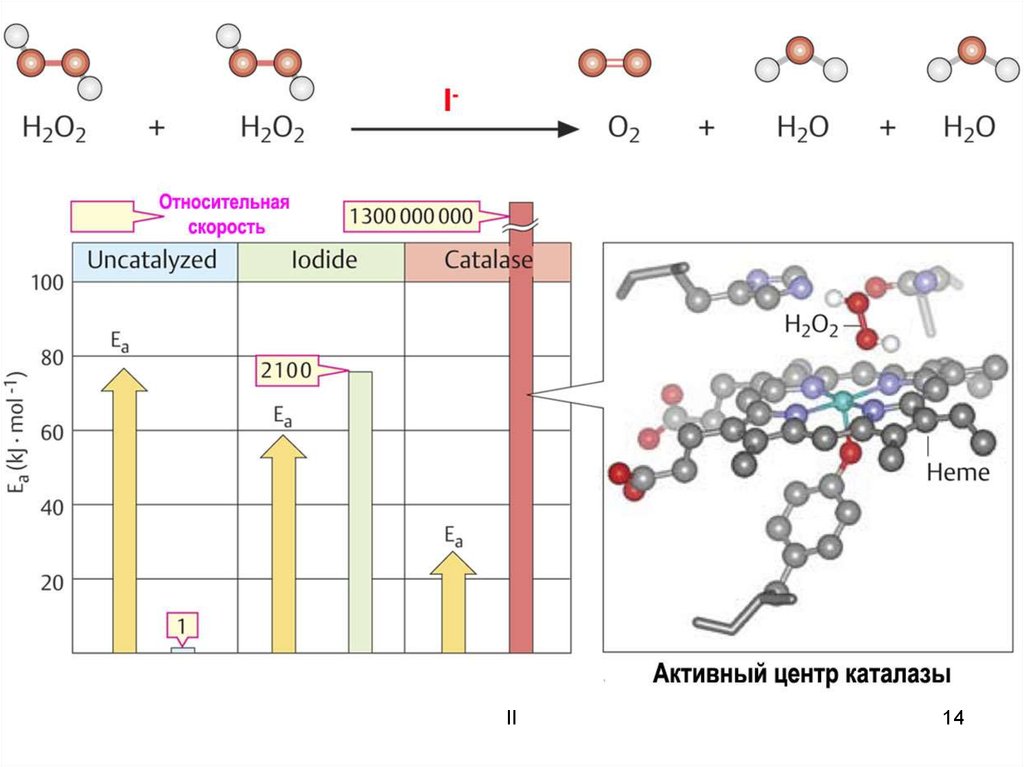
13.
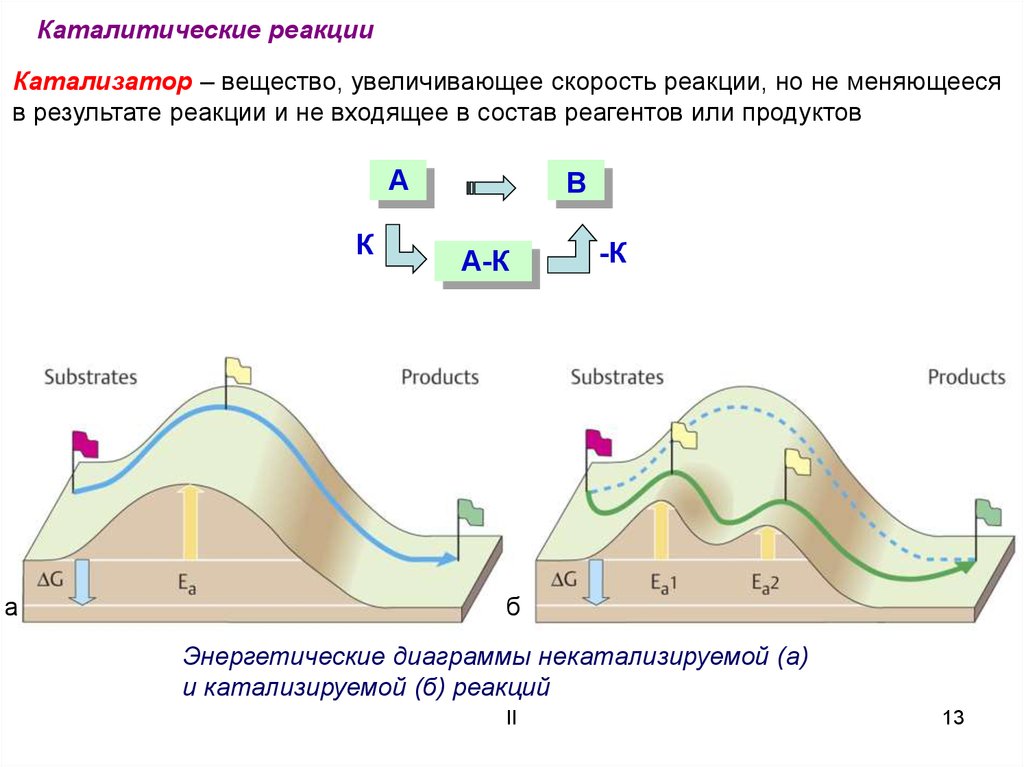
Каталитические реакцииКатализатор – вещество, увеличивающее скорость реакции, но не меняющееся
в результате реакции и не входящее в состав реагентов или продуктов
А
К
а
В
А-К
-К
б
Энергетические диаграммы некатализируемой (а)
и катализируемой (б) реакций
II
13
14.
II14
15.
КатализаторыГетерогенные катализаторы
Н2
H. . .H
H2C CH2
H2C CH2
H2C CH2
H H
H. . .H
поверхность
катализатора
Катализаторы
гидрирования:
платина мелкодисперсная
PtO2, PdO (катализаторы Адамса)
Роджер Адамс
(1889-1971) – амер. химик,
ун-т Иллинойса, руков. ~ 250 PhD
II
15
16.
Катализаторыгидрирования:
никель порошковый
никель Ренея (скелетный никель)
CuO Cr2O3 (катализатор Адкинса)
Поль Сабатье
(1854-1941) – фр. химик
Мюррей Реней
(1885-1966) – амер. инженер
Гомер Адкинс (1892-1949)
– амер. химик-органик
1912, химия
II
16
17.
Гомогенные катализаторы[(C6H5)3P]3RhCl катализатор Уилкинсона
[(C6H5)3P]3Ru.HCl и др.
Джефри Уилкинсон
(1921-1996) – англ. химик
1973, химия
II
17
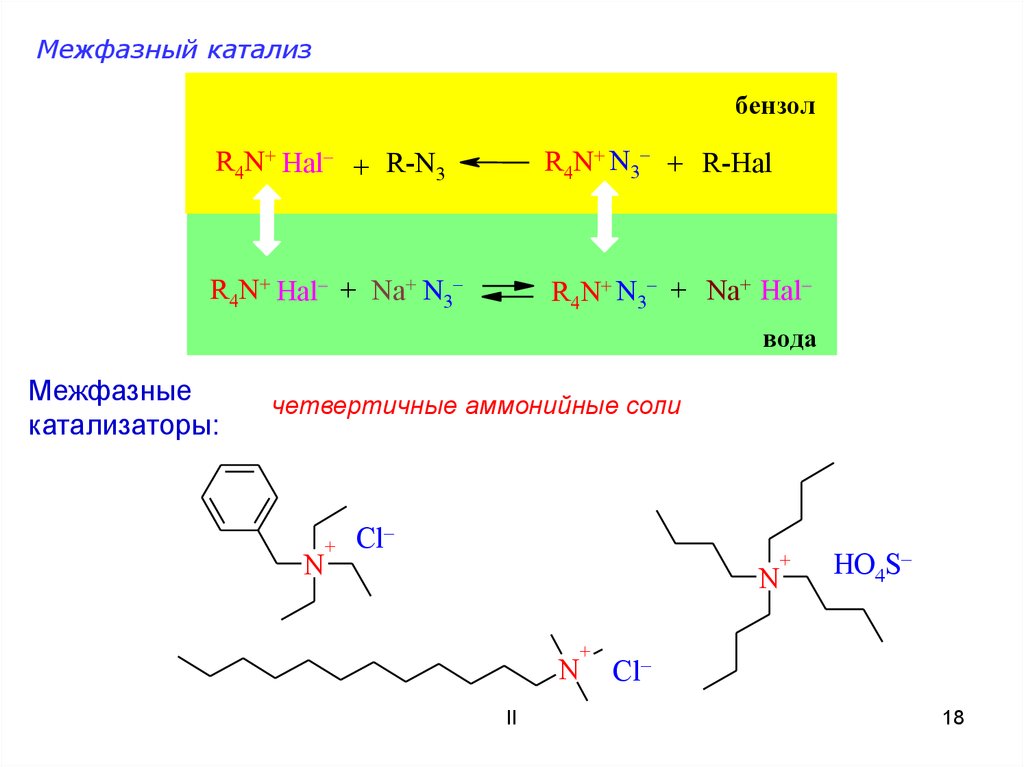
18.
Межфазный катализбензол
R4N+ Hal + R-N3
R4N+ N3 + R-Hal
R4N+ Hal + Na+ N3
R4N+ N3 + Na+ Hal
вода
Межфазные
катализаторы:
четвертичные аммонийные соли
N
+
Cl
N
N
II
+
+
HO4S
Cl
18
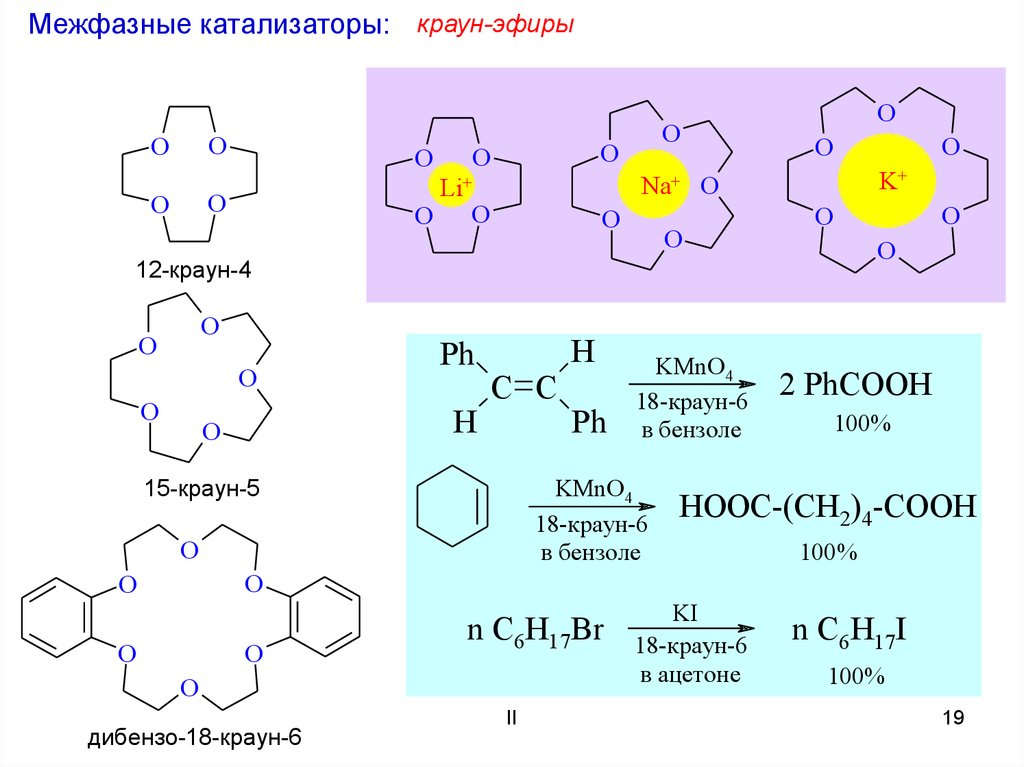
19.
Межфазные катализаторы: краун-эфирыO
O
O
O
O
O
O
Li+
O
O
O
O
O
K+
Na+ O
O
O
O
O
Ph
H
O
C C
H
Ph
KMnO4
18-краун-6
в бензоле
KMnO4
18-краун-6
в бензоле
15-краун-5
O
O
O
O
12-краун-4
O
O
O
2 PhCOOH
100%
НООС-(СН2)4-СООН
100%
O
O
O
O
n C6H17Br
O
дибензо-18-краун-6
II
KI
18-краун-6
в ацетоне
n C6H17I
100%
19
20.
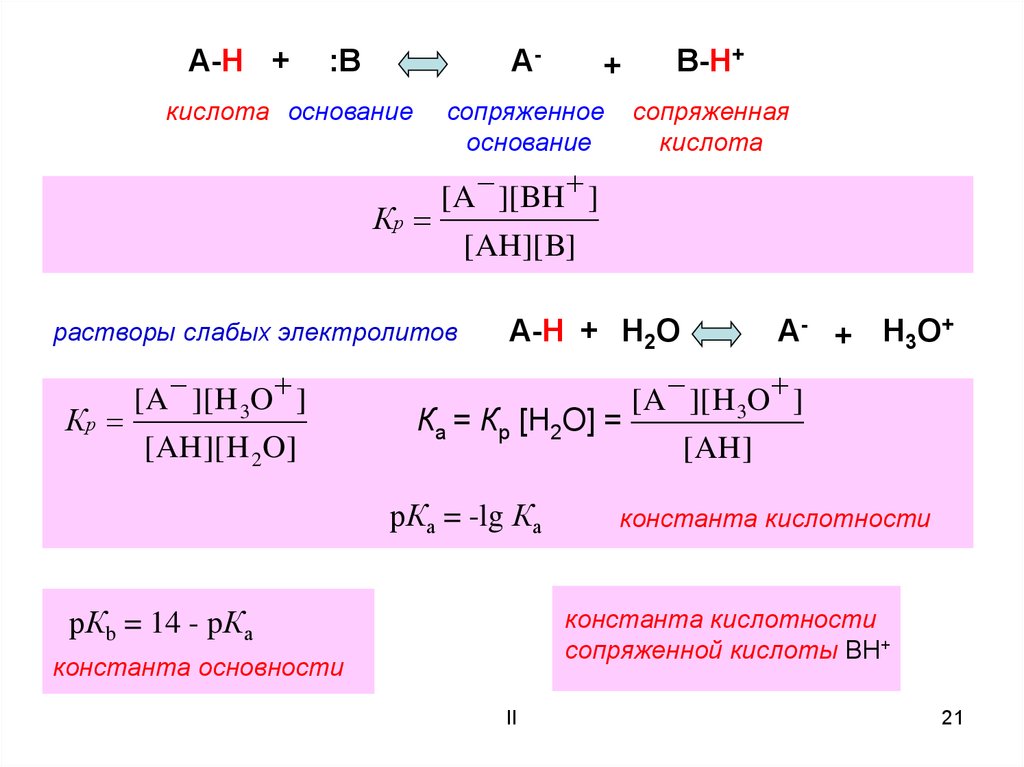
Кислотность и основностьТеория Брёнстеда-Лоури
A-H +
1923 г.
A-
:B
кислота основание
B-H+
+
сопряженное сопряженная
основание
кислота
Кислотность – способность отдавать протон.
Основность – способность присоединять протон.
! Сильной кислоте соответствует слабое сопряженное основание и т.д.
Томас Лаури (Лоури)
(1874-1936)
– брит. химик
Йоханнес Брёнстед
(1879 -1947)
- датский физикохимик
II
20
21.
A-H +A-
:B
кислота основание
сопряженное
основание
Кр
Кр
[ AH ][ H 2 O]
B-H+
сопряженная
кислота
[ A ][ BH ]
растворы слабых электролитов
[ A ][ H 3O ]
+
[ AH][ B]
A-H + Н2О
Ка = Кр [Н2О] =
рКа = -lg Ка
рКb = 14 - pКа
A- + Н3О+
[ A ][ H 3O ]
[ AH ]
константа кислотности
константа кислотности
сопряженной кислоты ВН+
константа основности
II
21
22.
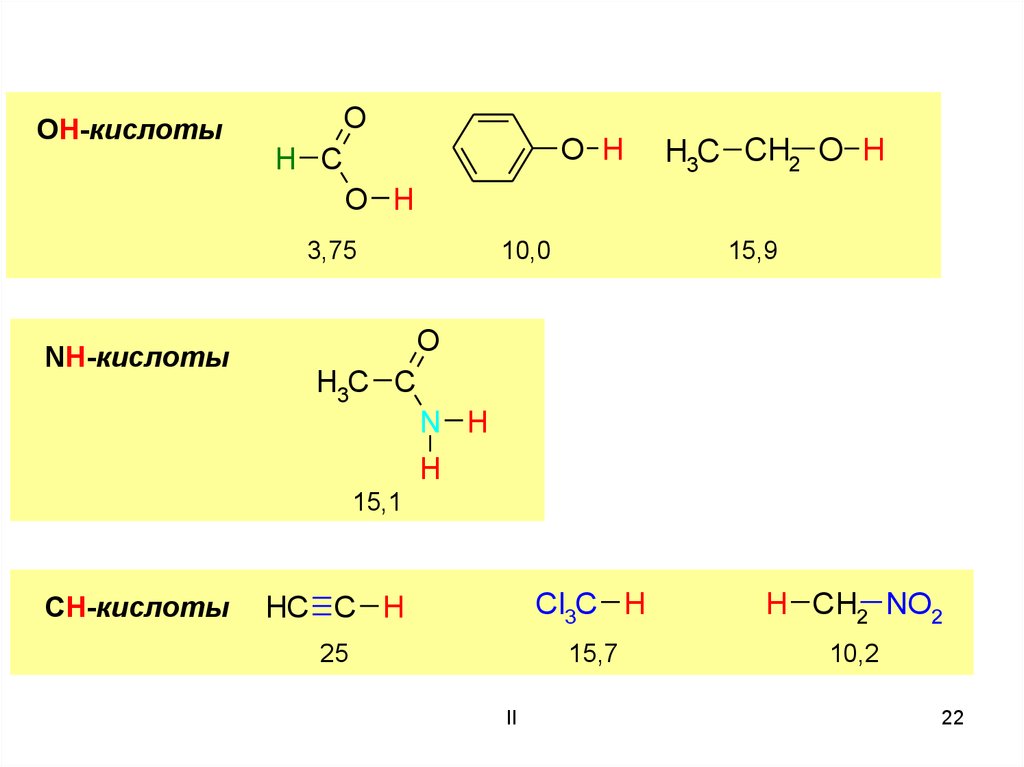
ОН-кислотыO
O H
H C
H3C CH2 O H
O H
3,75
NH-кислоты
10,0
15,9
O
H3C C
N H
H
15,1
СН-кислоты
HC C H
Cl3C H
H CH2 NO2
25
15,7
10,2
II
22
23.
Теория Льюиса1923 г.
Кислотность – способность соединения
принимать электронную пару на
свободную орбиталь.
Основность – способность соединения
отдавать электронную пару.
Гилберт Льюис (1875-1946)
– амер. физикохимик
Кислоты Льюиса
протон, имеющий вакантную орбиталь,
Н+
катионы металлов,
Na+, Ag+, Cu2+, Zn2+, Fe3+, Al3+
другие
катионы,
карбокатионы,
в
том
числе
галогениды элементов с вакантными
орбиталями
II
Br+, NO2+, R3C+
BF3, AlCl3, FeCl3, FeBr3, ZnCl2,
SnCl4
23
24.
Основания Льюисаn-основания Льюиса, в том числе,
НО , HS , Hal , HC C , RCOO
анионы, включая карбанионы,
нейтральные
соединения
с
атомами, имеющими неподеленные пары
электронов;
H2O, ROH, H2S, NH3, RNH2
-основания Льюиса – углеводороды с -
H2C CH2 ,
электронными системами
..
..
.. ..
..
Примеры кислотно-основных взаимодействий
R Cl
+ AlCl3
основание кислота
Льюиса
Льюиса
+ Br+
основание кислота
Льюиса
Льюиса
+
R Cl AlCl3
(С2H5)2O: + BF3
+
(C2 H5)2O BF3
основание кислота
Льюиса
Льюиса
Br+
-комплекс
II
24











 Химия
Химия








