Похожие презентации:
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
1. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ : ГИДРОКСИ- И ОКСОКАРБОНОВЫЕ КИСЛОТЫ
2.
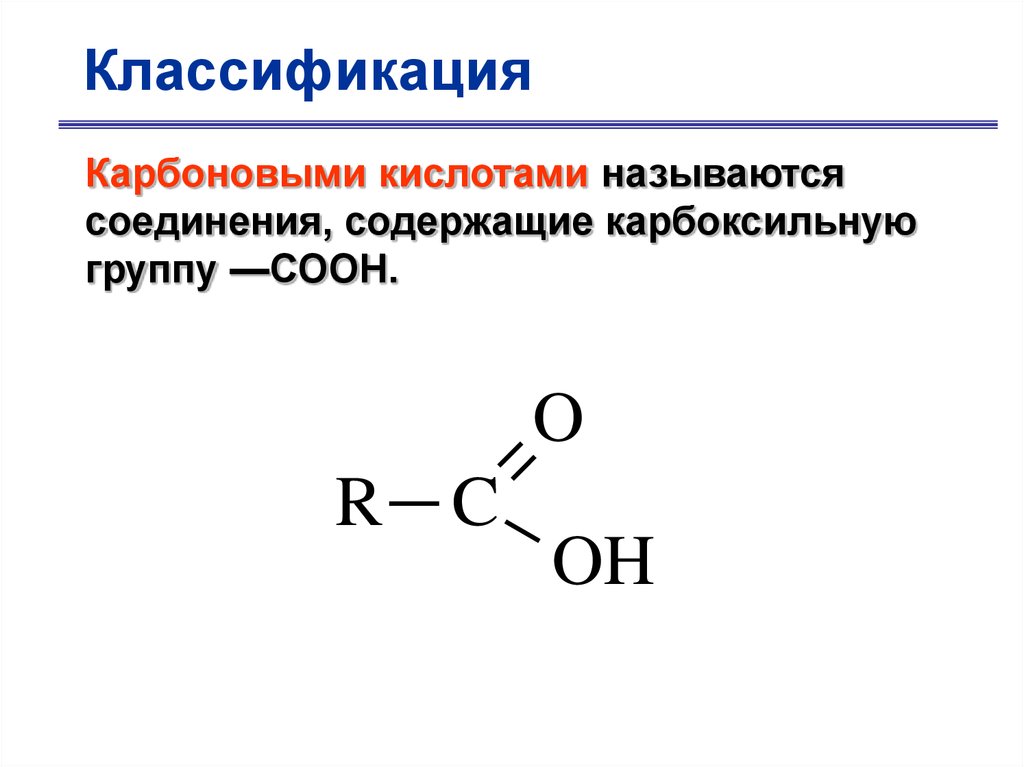
КлассификацияКарбоновыми кислотами называются
соединения, содержащие карбоксильную
группу —СООН.
O
R C
OH
3.
1. По числу карбоксильных групп :моно- , дикарбоновые кислоты и т.д.
2. В зависимости от строения радикала:
- алифатические предельные (ациклические, циклические )
- непредельные (содержат одну или несколько кратных связей)
- ароматические (карбо- и гетероароматические)
3. В связи с присутствием в радикале других функциональных
групп:
- гидроксикарбоновые (содержат одну или несколько
гидроксильных групп)
- оксокарбоновые (содержат карбонильную группу альдегидную или кетоновую)
- аминокислоты (содержат одну или несколько аминогрупп).
4. МОНОКАРБОНОВЫЕ КИСЛОТЫ
5.
ПОВТОРИТЬ!6. ХИМИЧЕСКИЕ СВОЙСТВА
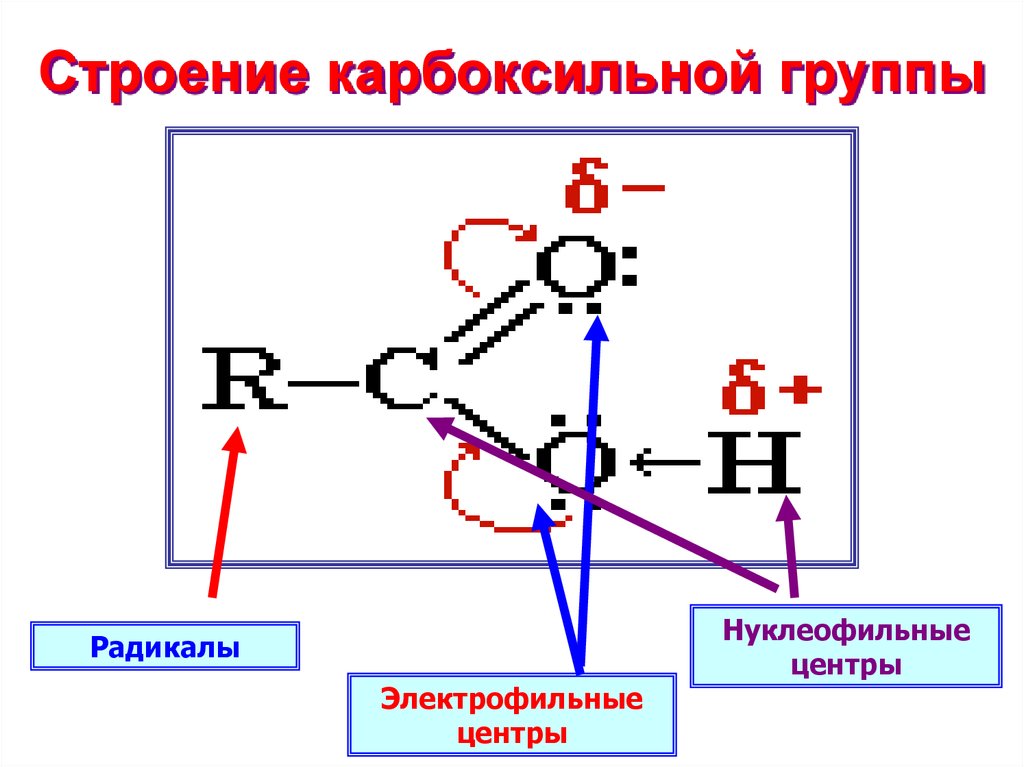
7. Строение карбоксильной группы
РадикалыЭлектрофильные
центры
Нуклеофильные
центры
8.
9.
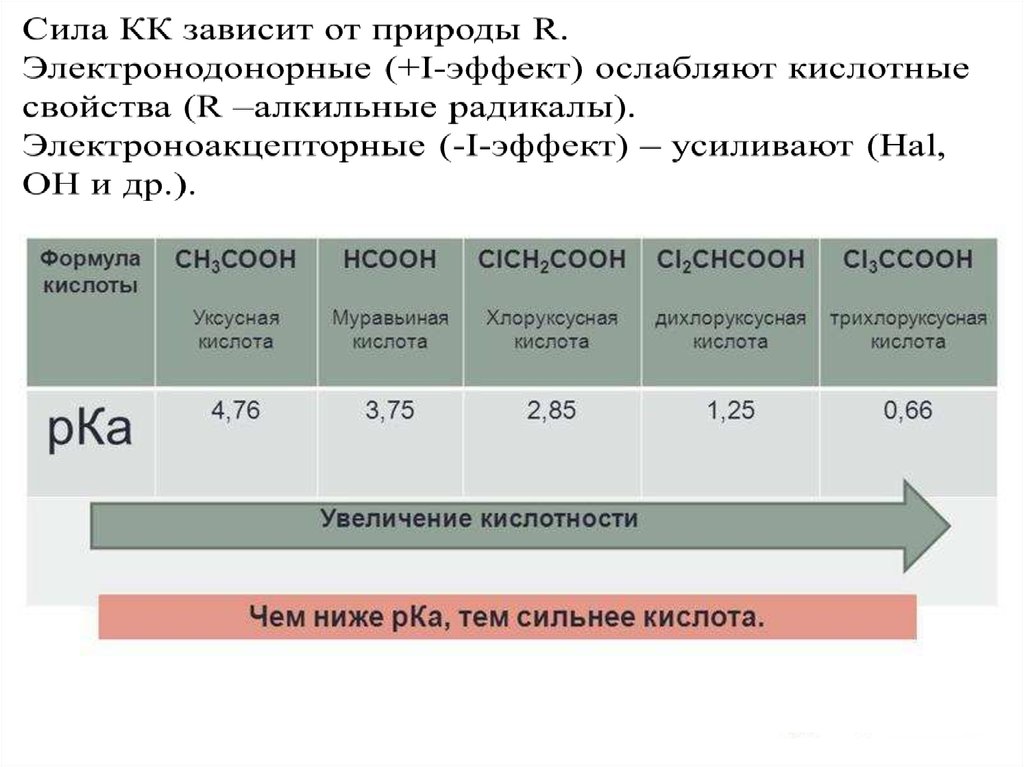
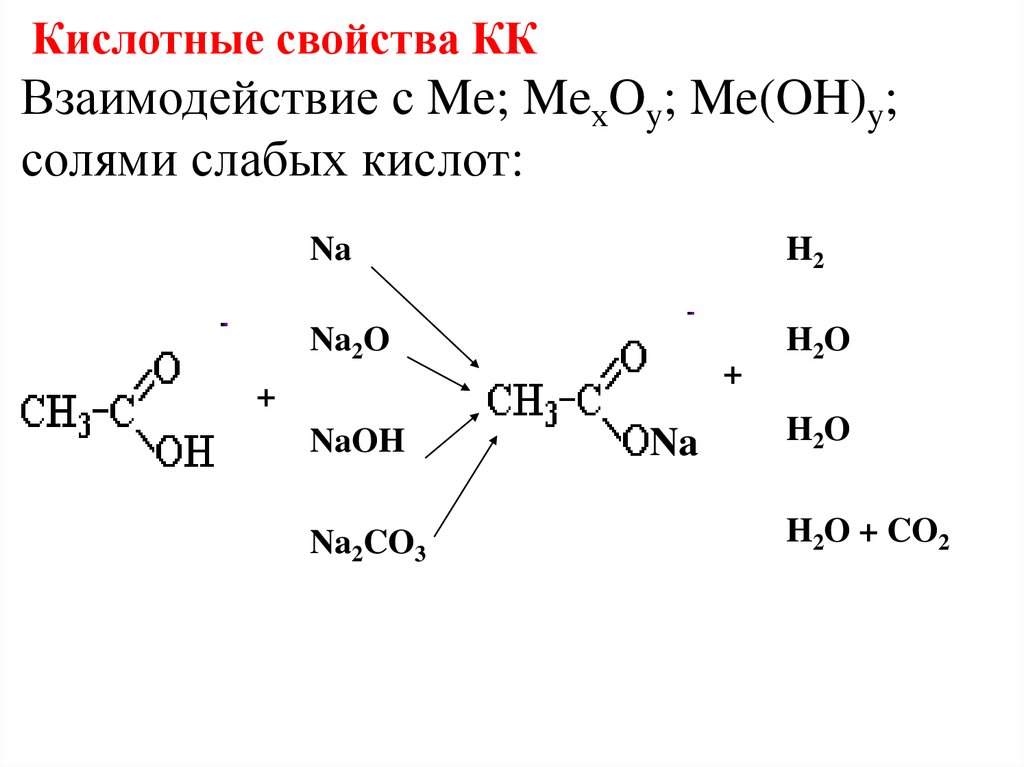
Кислотные свойства ККВзаимодействие с Me; MeхOy; Me(OH)y;
солями слабых кислот:
Na
H2
Na2O
H2O
+
+
NaOH
Na2CO3
Na
H2O
H2O + CO2
10.
Реакции ацилирования - это замещениелюбого атома или группы атомов на
ацил. В зависимости от атома к
которому присоединяют ацил различают
C-, N-, O-, S- ацилирование
ацильный
остаток
Ацилирование – реакция SN по карбонильному
углеродному атому, с образованием связи между
ацильным остатком и нуклеофилом.
11.
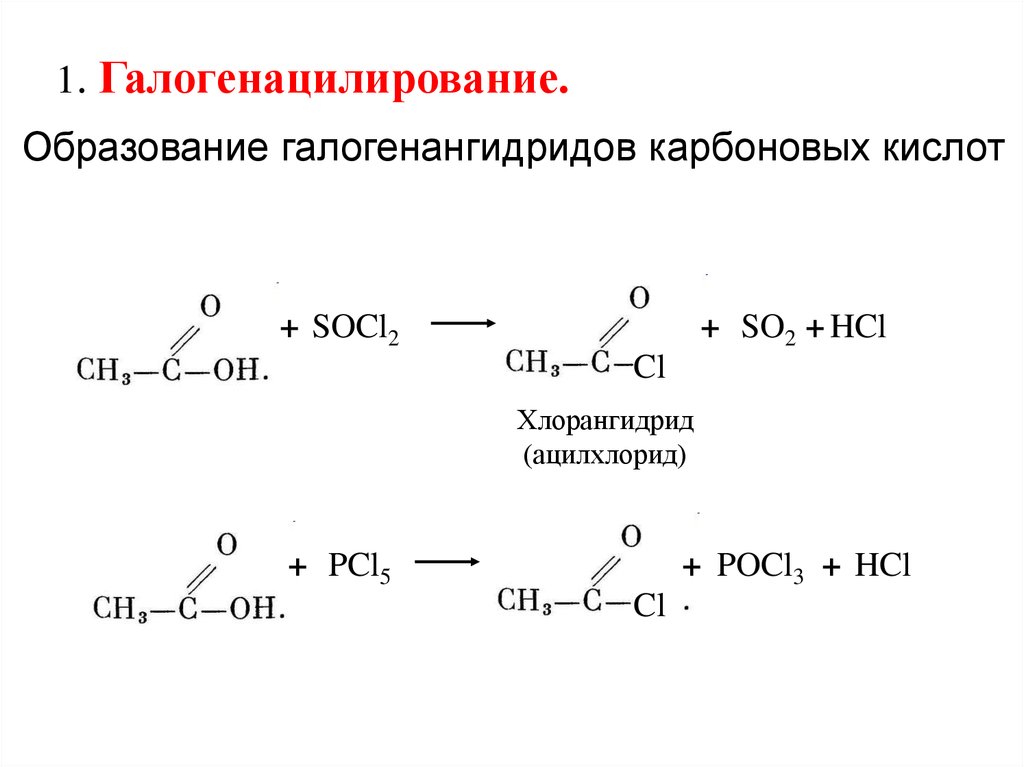
1. Галогенацилирование.Образование галогенангидридов карбоновых кислот
+ SOCl2
+ SO2 + HCl
Cl
Хлорангидрид
(ацилхлорид)
+ PCl5
+ POCl3 + HCl
Cl
12.
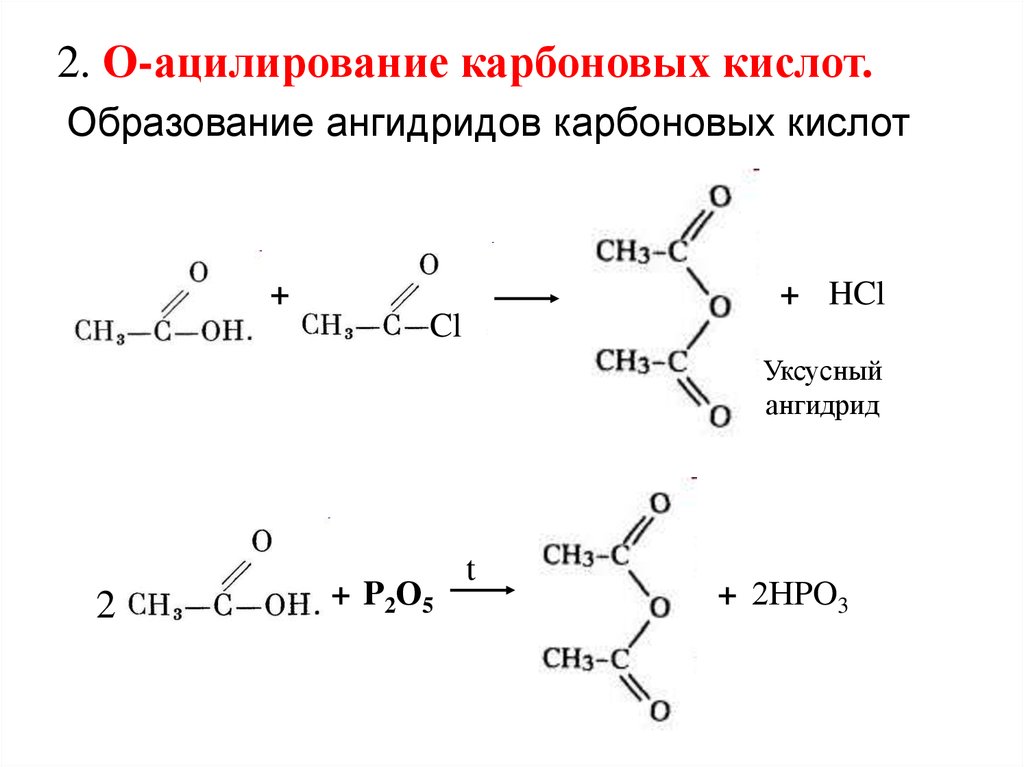
2. О-ацилирование карбоновых кислот.Образование ангидридов карбоновых кислот
+
+ HCl
Cl
Уксусный
ангидрид
2
+ P2О5
t
+ 2НPO3
13.
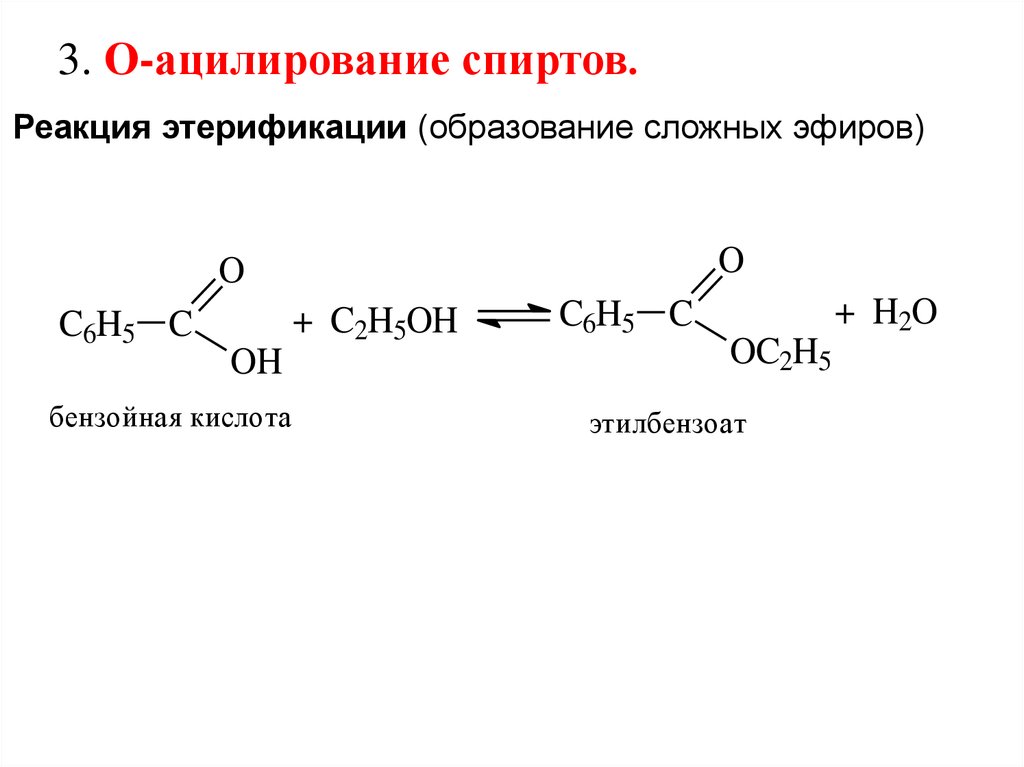
3. О-ацилирование спиртов.Реакция этерификации (образование сложных эфиров)
O
O
C6H5 C
+ C2H5OH
OH
бензойная кислота
C6H5 C
+ H2O
OC2H5
этилбензоат
14.
4. N-ацилирование аминов.Образование амидов карбоновых кислот
(этанамид, амид
уксусной кислоты)
Реакция образования амидов играет большую роль в
организме: за счет этой реакции происходит
обезвреживание токсичного аммиака.
15.
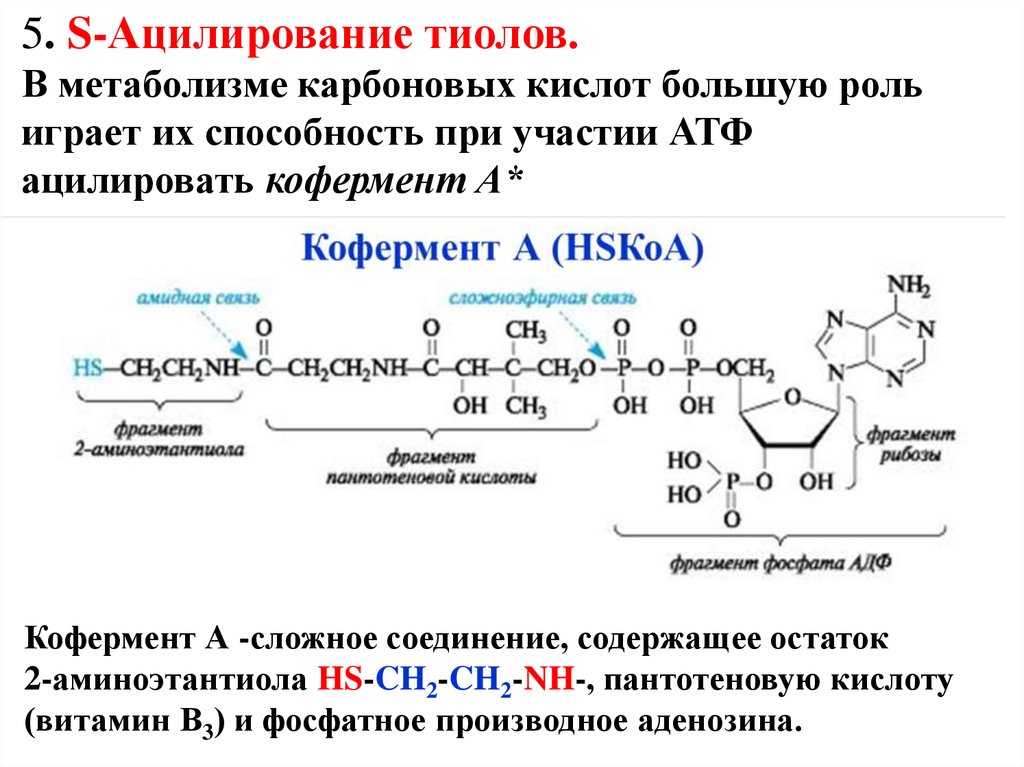
5. S-Ацилирование тиолов.В метаболизме карбоновых кислот большую роль
играет их способность при участии АТФ
ацилировать кофермент А*
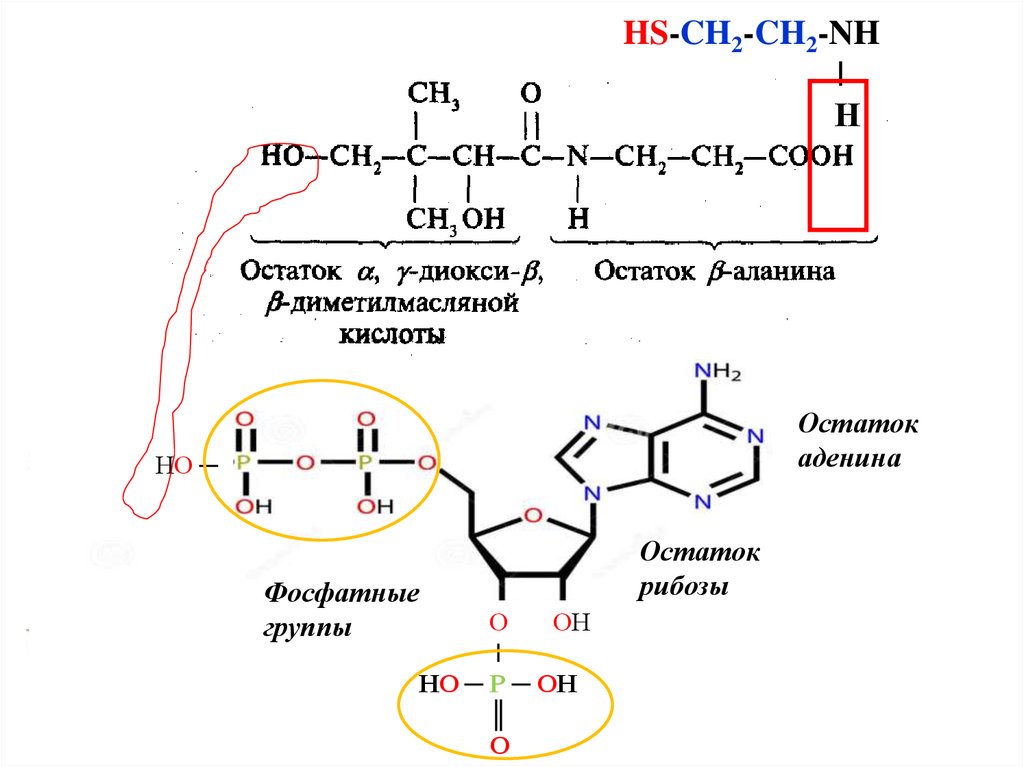
Кофермент А -сложное соединение, содержащее остаток
2-аминоэтантиола HS-CH2-CH2-NH-, пантотеновую кислоту
(витамин В3) и фосфатное производное аденозина.
16.
HS-CH2-CH2-NH|
Н
Остаток
аденина
НО ─
Фосфатные
группы
О
ОН
|
НО ─ Р ─ ОН
║
О
Остаток
рибозы
17.
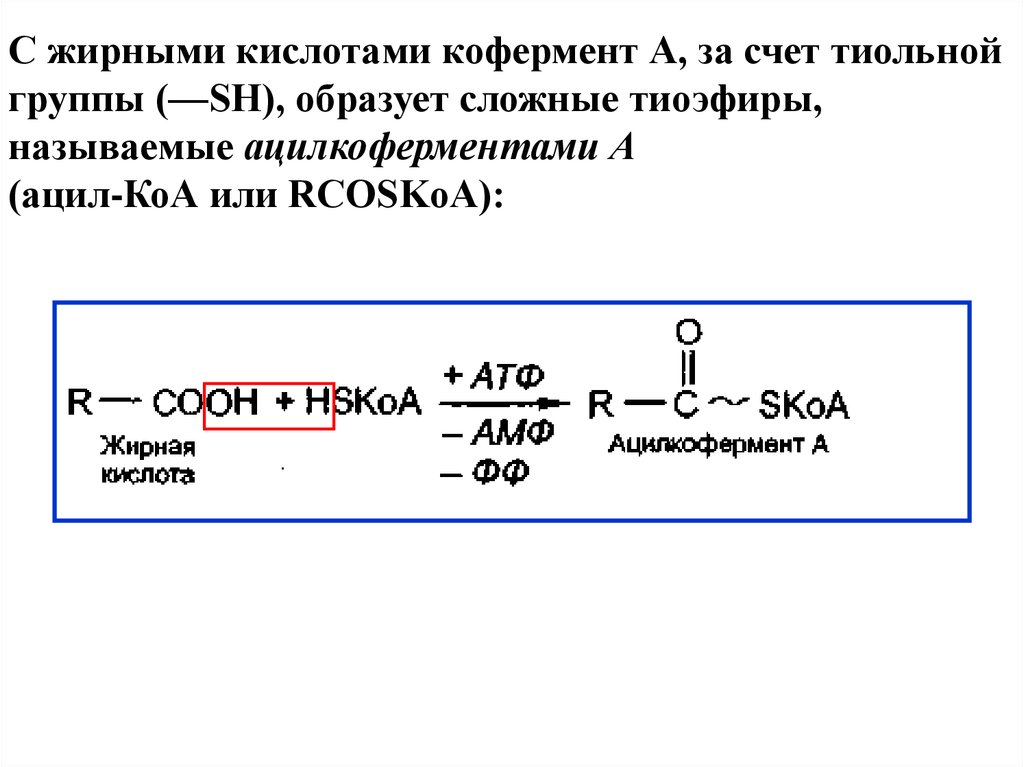
С жирными кислотами кофермент А, за счет тиольнойгруппы (—SH), образует сложные тиоэфиры,
называемые ацилкоферментами А
(ацил-КоА или RCOSKoA):
18.
19.
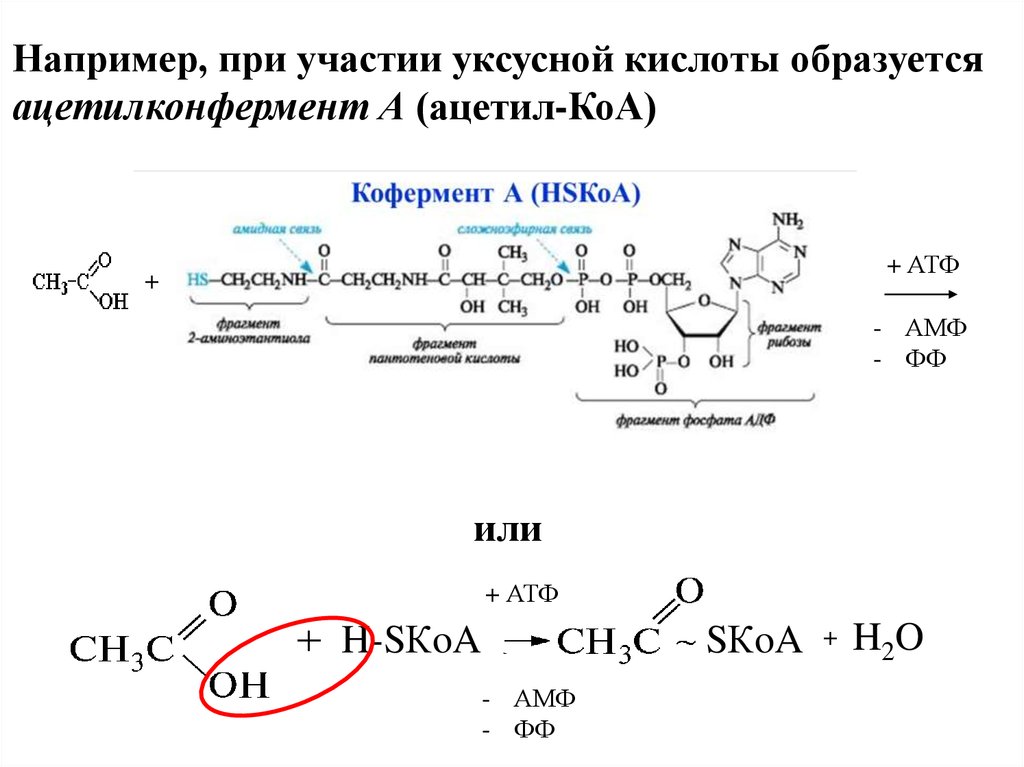
Например, при участии уксусной кислоты образуетсяацетилконфермент А (ацетил-КоА)
+ АТФ
+
- АМФ
- ФФ
или
+ АТФ
SКoA
H-SКoA
- АМФ
- ФФ
+
H2O
20.
21.
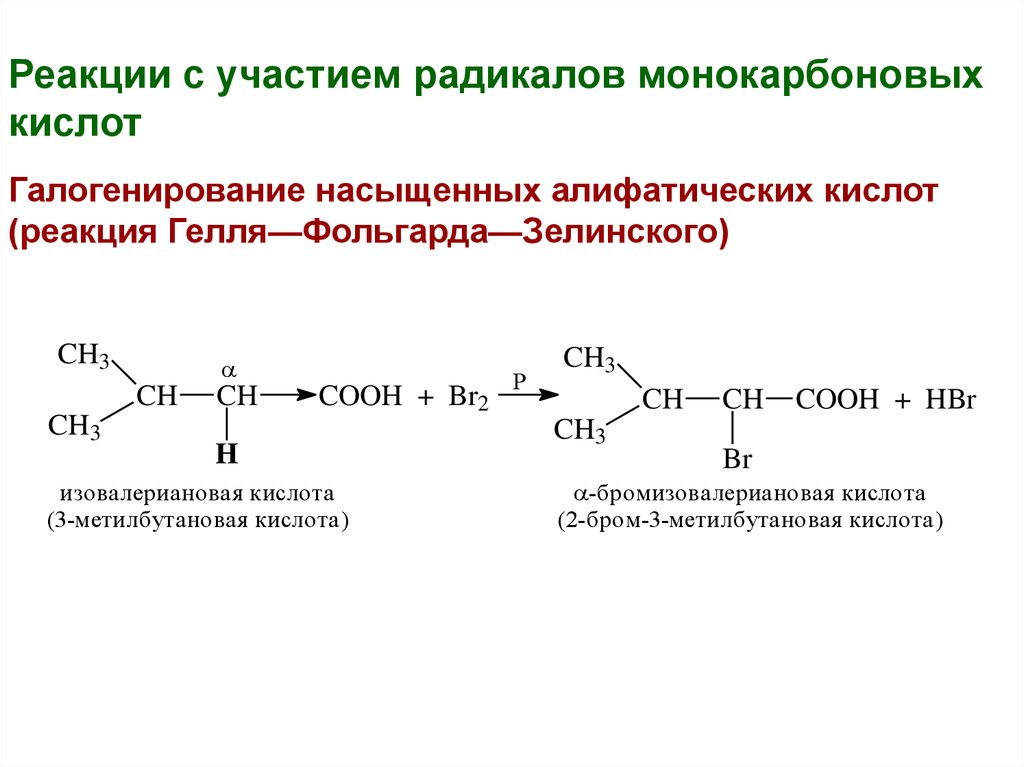
Реакции с участием радикалов монокарбоновыхкислот
Галогенирование насыщенных алифатических кислот
(реакция Гелля—Фольгарда—Зелинского)
CH3
CH
CH3
CH
COOH + Br2
H
изовалериановая кислота
(3-метилбутановая кислота)
P
CH3
CH
CH3
CH
COOH + HBr
Br
-бромизовалериановая кислота
(2-бром-3-метилбутановая кислота)
22. ДИКАРБОНОВЫЕ КИСЛОТЫ
23.
В живом мире наибольшее значение имеют:Диссоциируют ступенчато.
С
и
л
а
у
м
е
н
ь
ш
а
е
т
с
я
Кислотные свойства значительно выше, чем
монокарбоновых, из-за электроноакцепторного влияния
второй –СООН группы.
24.
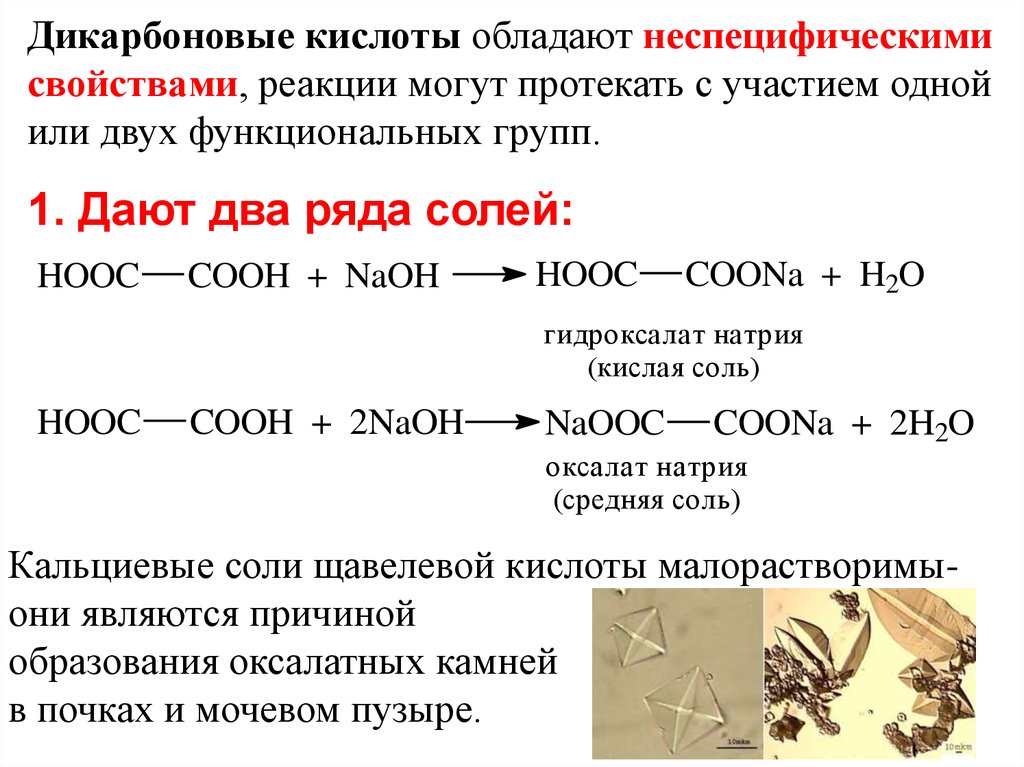
Дикарбоновые кислоты обладают неспецифическимисвойствами, реакции могут протекать с участием одной
или двух функциональных групп.
1. Дают два ряда солей:
HOOC
COOH + NaOH
HOOC
COONa + H2O
гидроксалат натрия
(кислая соль)
HOOC
COOH + 2NaOH
NaOOC
COONa + 2H2O
оксалат натрия
(средняя соль)
Кальциевые соли щавелевой кислоты малорастворимыони являются причиной
образования оксалатных камней
в почках и мочевом пузыре.
25.
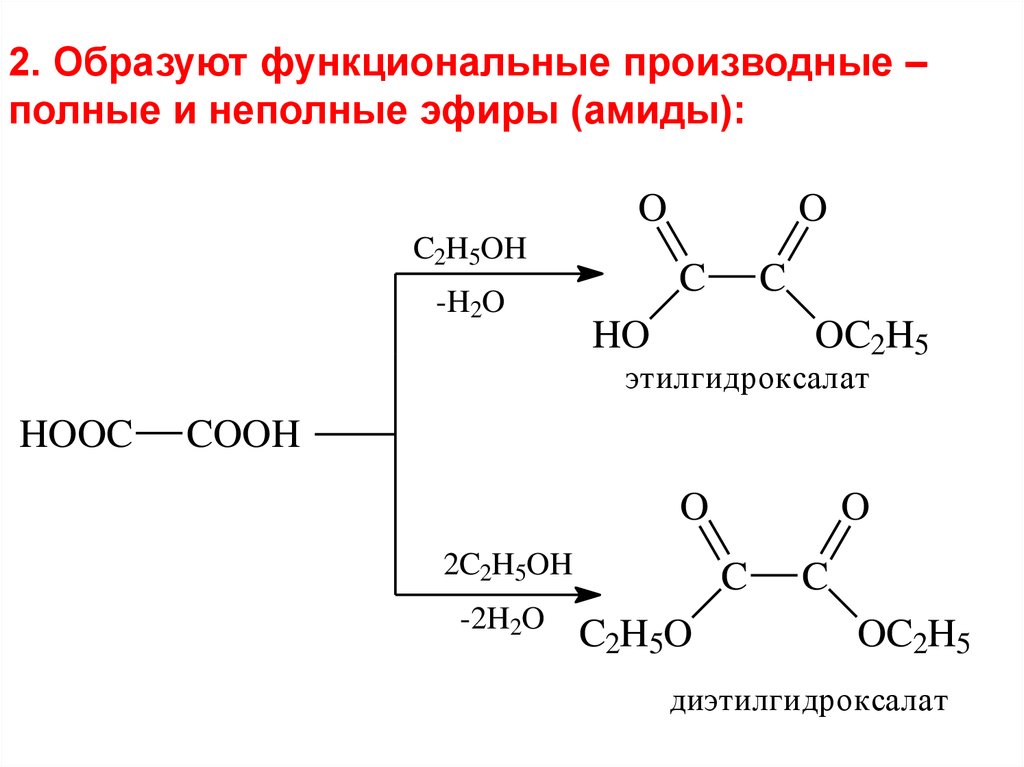
2. Образуют функциональные производные –полные и неполные эфиры (амиды):
O
C2H5OH
-H2O
O
C
C
HO
OC2H5
этилгидроксалат
HOOC
COOH
O
2C2H5OH
-2H2O
O
C
C2H5O
C
OC2H5
диэтилгидроксалат
26.
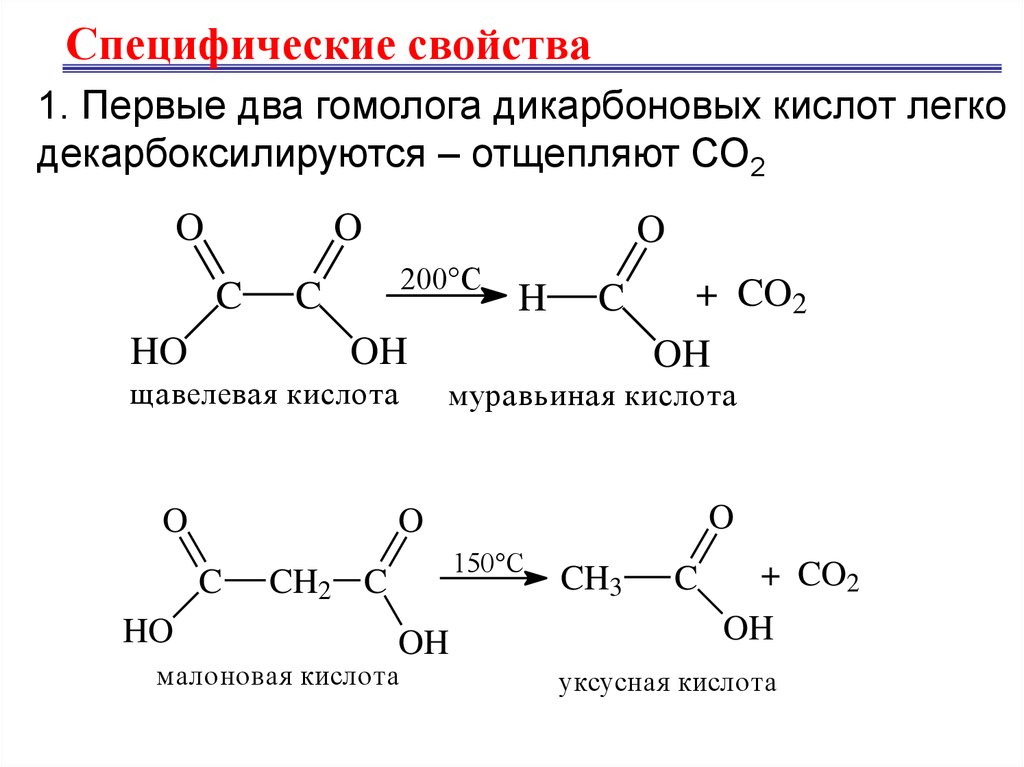
Специфические свойства1. Первые два гомолога дикарбоновых кислот легко
декарбоксилируются – отщепляют СО2
O
O
C
HO
O
200°С
C
C
OH
щавелевая кислота
O
+ CO2
OH
муравьиная кислота
O
O
C
HO
H
150°С
CH2 C
OH
малоновая кислота
CH3
C
+ CO2
OH
уксусная кислота
27.
2. Янтарная и глутаровая кислоты с более длиннойцепью изгибаются и при нагревании
не декарбоксилируются, а происходит
внутримолекулярное ацилирование, с
образованием циклических ангидридов.
O
O
CH2 C
CH2 C
OH
OH
CH2 C
O
янтарная кислота
220-230°C
-H2O
O
CH2 C
O
янтарный ангидрид
28.
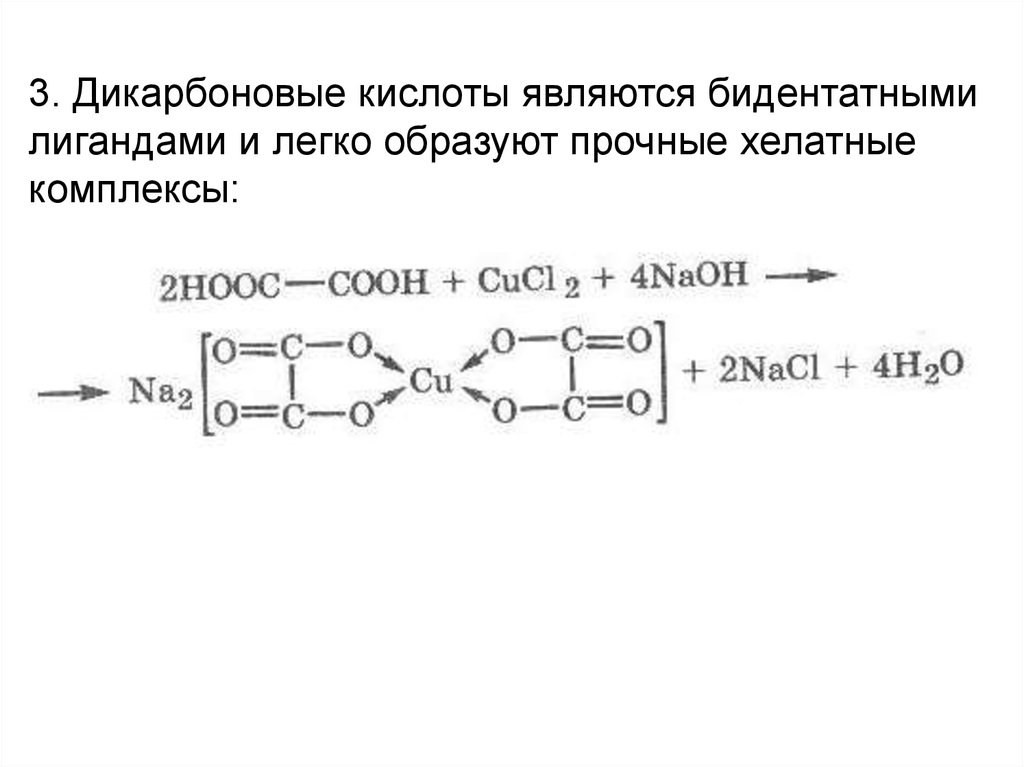
3. Дикарбоновые кислоты являются бидентатнымилигандами и легко образуют прочные хелатные
комплексы:
29.
Непредельные дикарбоновые кислотыПростейшими с одной двойной связью, являются
малеиновая и фумаровая кислоты:
t
Малеиновая к-та менее устойчива, при нагревании
и действии радикалобразующих веществ (иода,
оксида азота, азотистой к-ты) превращается в
фумаровую.
30.
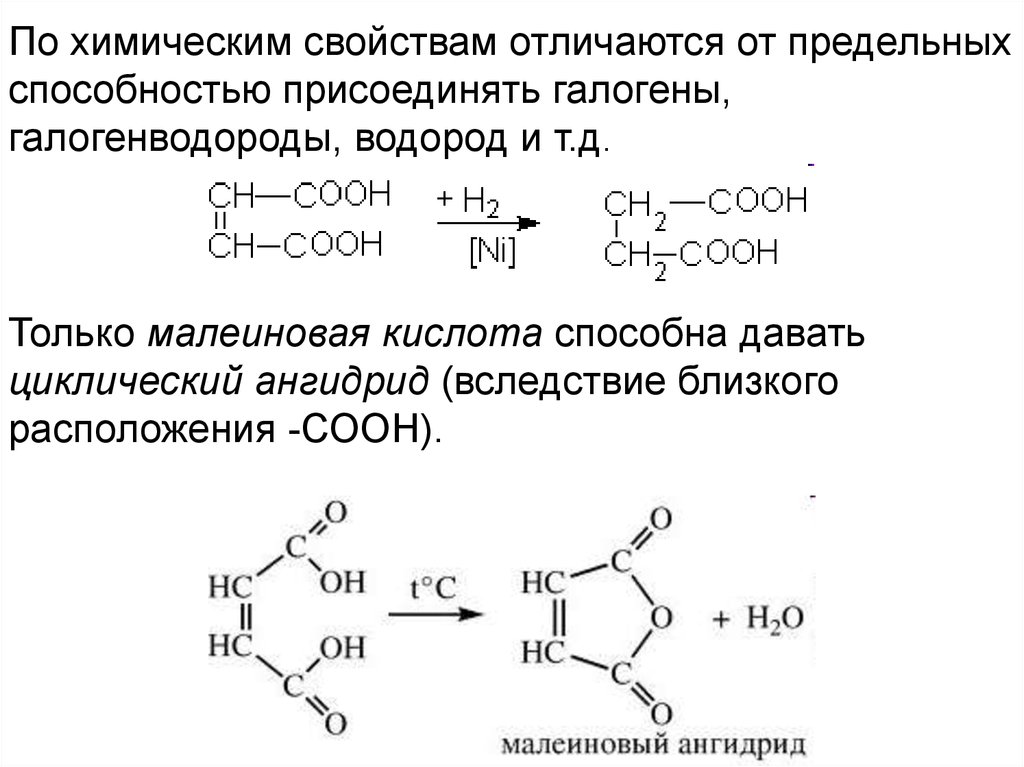
По химическим свойствам отличаются от предельныхспособностью присоединять галогены,
галогенводороды, водород и т.д.
Только малеиновая кислота способна давать
циклический ангидрид (вследствие близкого
расположения -СООН).











 Химия
Химия








