Похожие презентации:
Карбоновые кислоты и их функциональные производные
1. Карбоновые кислоты и их функциональные производные.
Кафедра общей и медицинской химииКарбоновые кислоты и их
функциональные производные.
1
2.
Карбоновые кислоты – органические соединения,содержащиеСООН- карбоксильную группу.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ.
классификация карбоновых кислот:
а) по строению углеводородного радикала:
- предельные (уксусная, стеариновая)
- непредельные (акриловая, олеиновая, линолевая)
- ароматические (бензойная, фенилуксусная)
- гетероциклические (никотиновая)
- алициклические
б) по числу карбоксильных групп:
- монокарбоновые (муравьиная)
- дикарбоновые (щавелевая)
- поликарбоновые (аконитовая)
2
3.
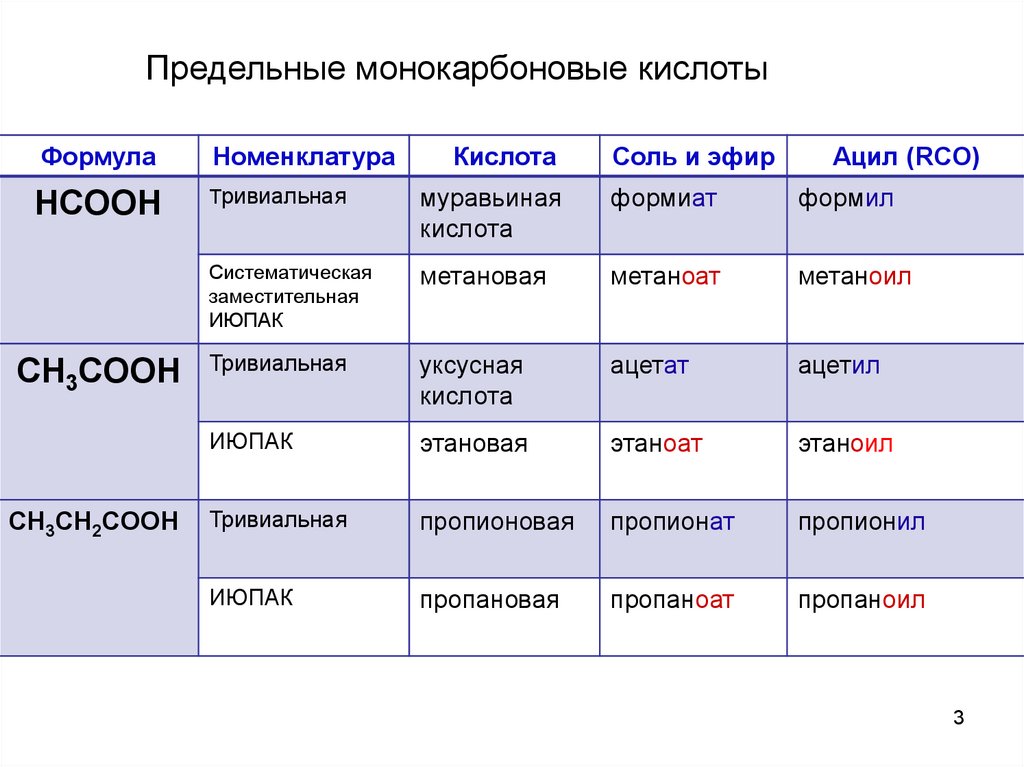
Предельные монокарбоновые кислотыФормула
Номенклатура
HCOOH
Тривиальная
муравьиная
кислота
формиат
формил
Систематическая
заместительная
ИЮПАК
метановая
метаноат
метаноил
Тривиальная
уксусная
кислота
ацетат
ацетил
ИЮПАК
этановая
этаноат
этаноил
Тривиальная
пропионовая
пропионат
пропионил
ИЮПАК
пропановая
пропаноат
пропаноил
CH3COOH
CH3CH2COOH
Кислота
Соль и эфир
Ацил (RCO)
3
4.
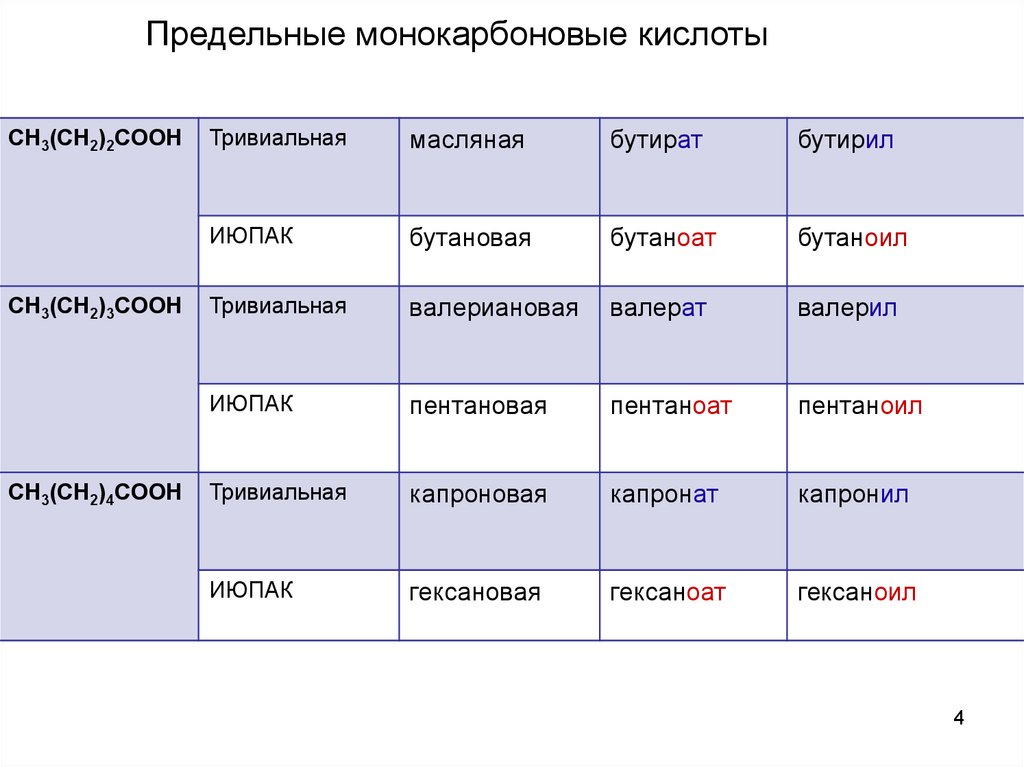
Предельные монокарбоновые кислотыCH3(CH2)2COOH
CH3(CH2)3COOH
CH3(CH2)4COOH
Тривиальная
масляная
бутират
бутирил
ИЮПАК
бутановая
бутаноат
бутаноил
Тривиальная
валериановая
валерат
валерил
ИЮПАК
пентановая
пентаноат
пентаноил
Тривиальная
капроновая
капронат
капронил
ИЮПАК
гексановая
гексаноат
гексаноил
4
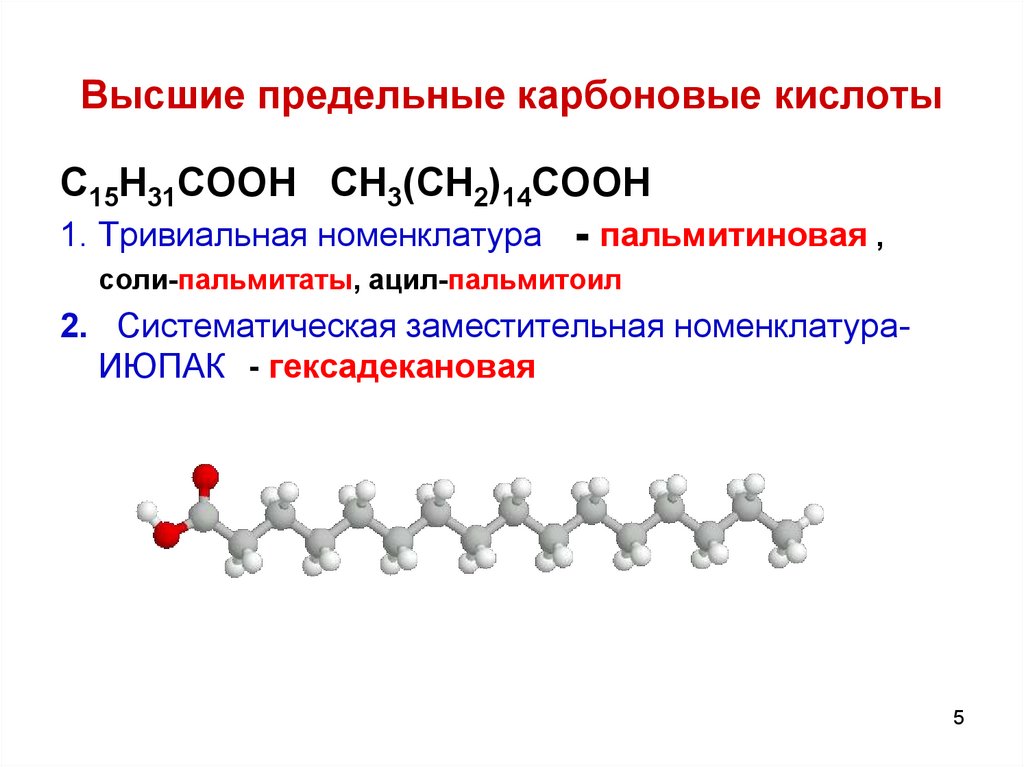
5. Высшие предельные карбоновые кислоты
C15H31COOH CH3(CH2)14COOH1. Тривиальная номенклатура
- пальмитиновая ,
соли-пальмитаты, ацил-пальмитоил
2. Систематическая заместительная номенклатураИЮПАК - гексадекановая
5
6. Высшие предельные карбоновые кислоты
C17H35COOH CH3(CH2)16COOH1. Тривиальная номенклатура стеариновая ,соли-стеараты, ацил-стеароил
2. Систематическая заместительная н-ра ИЮПАКоктадекановая
6
7.
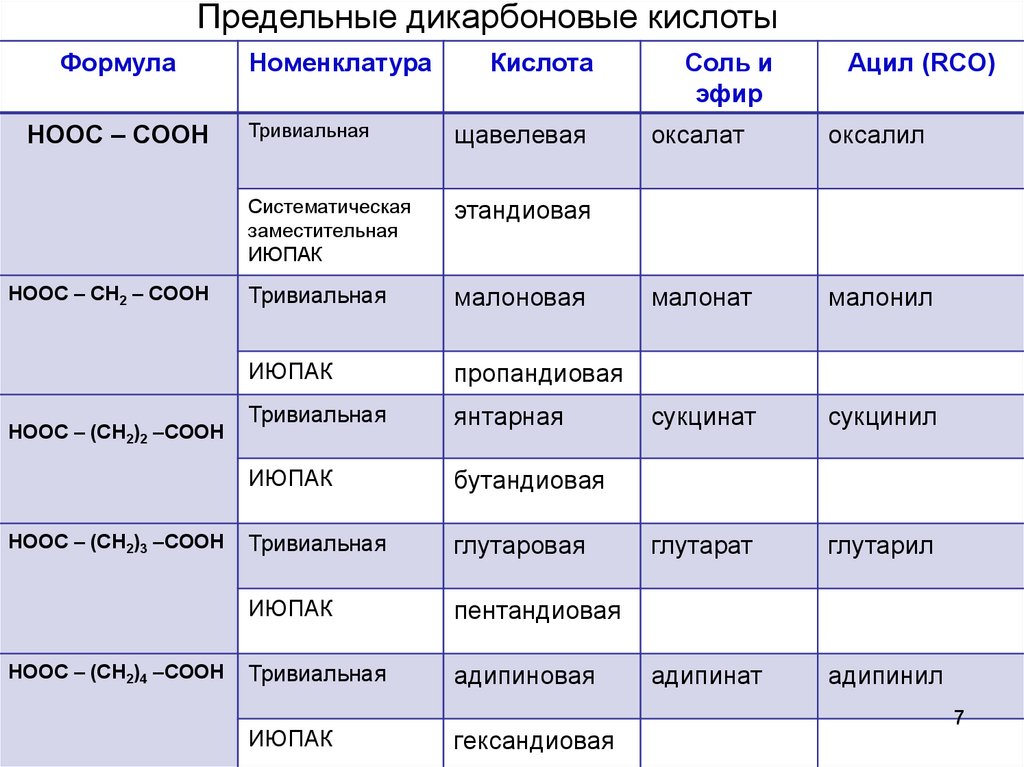
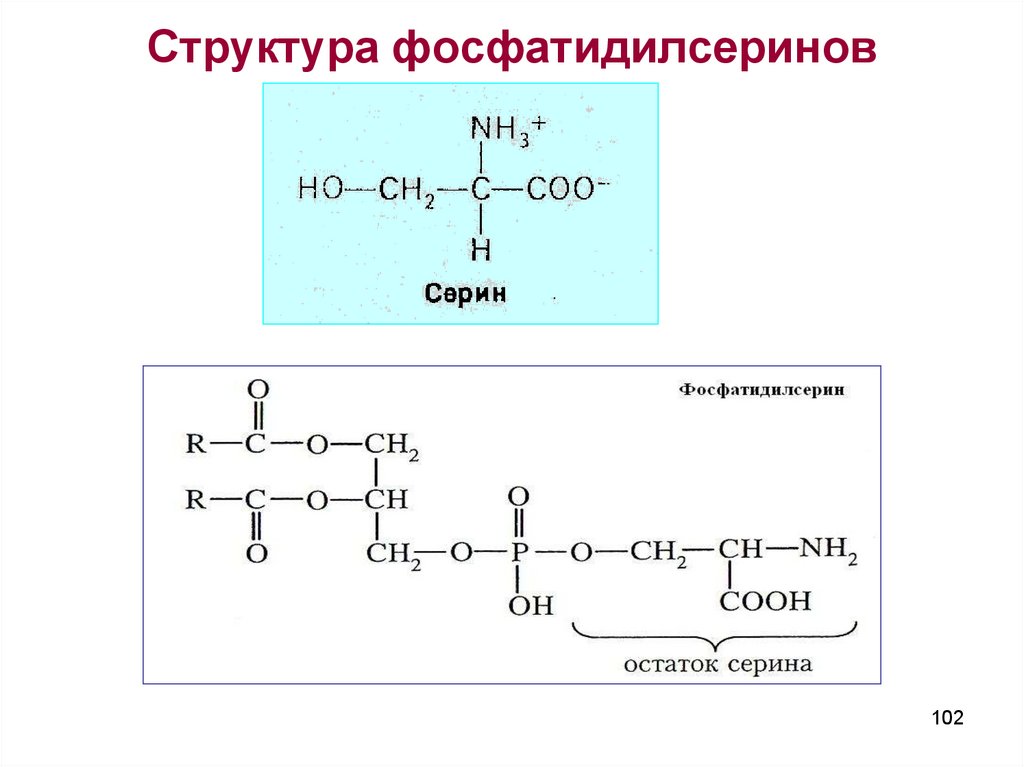
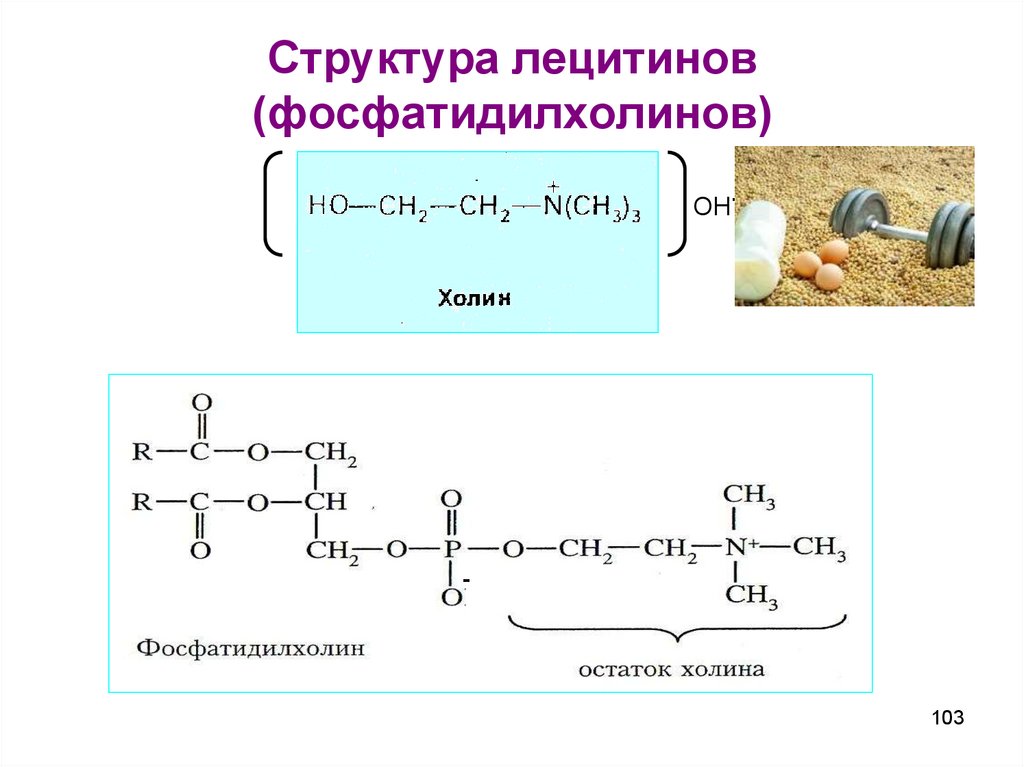
Предельные дикарбоновые кислотыФормула
HOOC – COOH
HOOC – CH2 – COOH
HOOC – (CH2)2 –COOH
HOOC – (CH2)3 –COOH
HOOC – (CH2)4 –COOH
Номенклатура
Кислота
Тривиальная
щавелевая
Систематическая
заместительная
ИЮПАК
этандиовая
Тривиальная
малоновая
ИЮПАК
пропандиовая
Тривиальная
янтарная
ИЮПАК
бутандиовая
Тривиальная
глутаровая
ИЮПАК
пентандиовая
Тривиальная
адипиновая
ИЮПАК
гександиовая
Соль и
эфир
Ацил (RCO)
оксалат
оксалил
малонат
малонил
сукцинат
сукцинил
глутарат
глутарил
адипинат
адипинил
7
8.
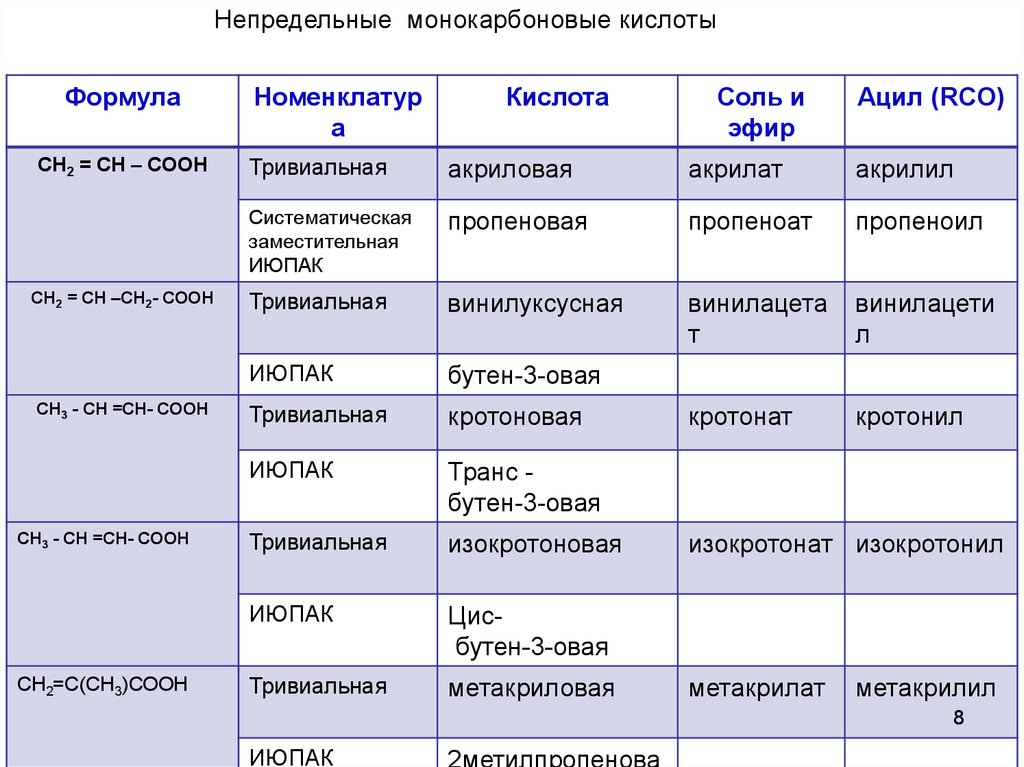
Непредельные монокарбоновые кислотыФормула
CH2 = CH – COOH
CH2 = CH –CH2- COOH
CH3 - CH =CH- COOH
CH3 - CH =CH- COOH
СН2=С(СН3)СООН
Номенклатур
а
Кислота
Соль и
эфир
Ацил (RCO)
Тривиальная
акриловая
акрилат
акрилил
Систематическая
заместительная
ИЮПАК
пропеновая
пропеноат
пропеноил
Тривиальная
винилуксусная
винилацета
т
винилацети
л
ИЮПАК
бутен-3-овая
Тривиальная
кротоновая
кротонат
кротонил
ИЮПАК
Транс бутен-3-овая
Тривиальная
изокротоновая
ИЮПАК
Цисбутен-3-овая
Тривиальная
метакриловая
изокротонат изокротонил
метакрилат
метакрилил
8
ИЮПАК
2метилпропенова
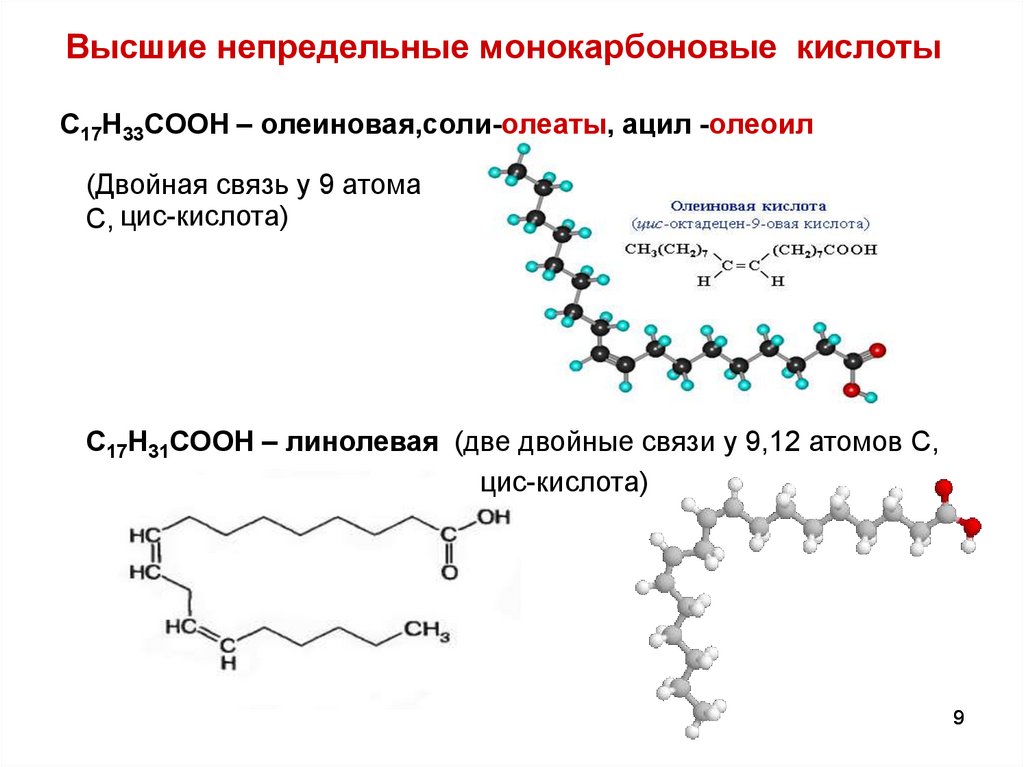
9. Высшие непредельные монокарбоновые кислоты
С17Н33СООН – олеиновая,соли-олеаты, ацил -олеоил(Двойная связь у 9 атома
С, цис-кислота)
С17Н31СООН – линолевая (две двойные связи у 9,12 атомов С,
цис-кислота)
9
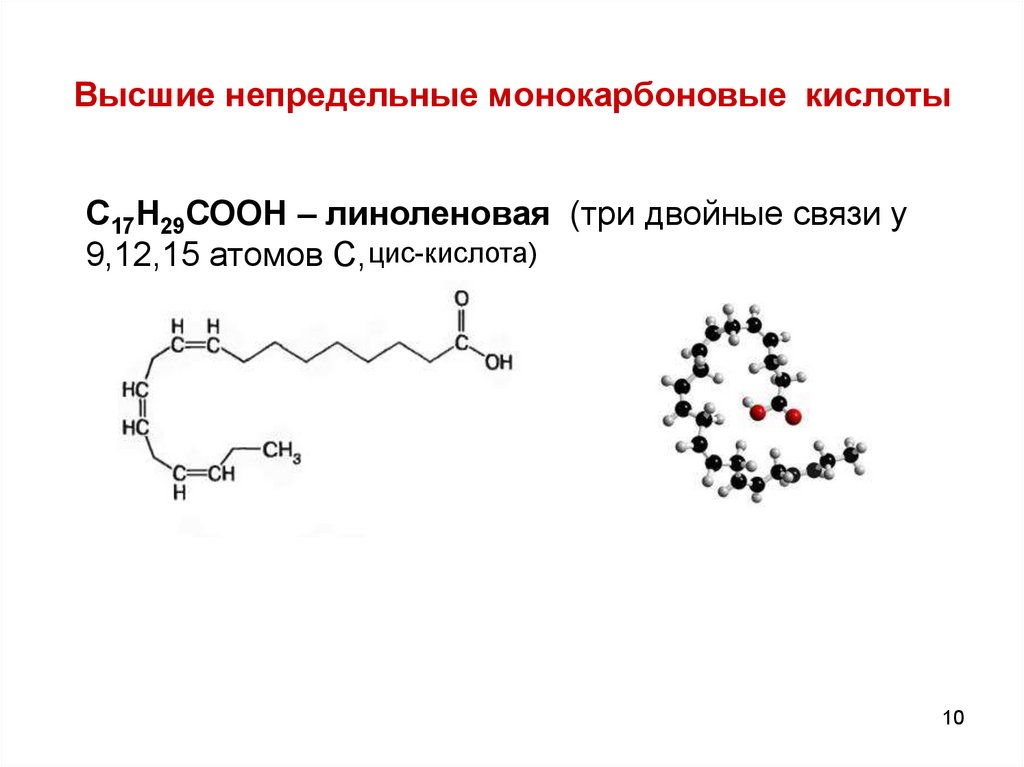
10.
Высшие непредельные монокарбоновые кислотыС17Н29СООН – линоленовая (три двойные связи у
9,12,15 атомов С, цис-кислота)
10
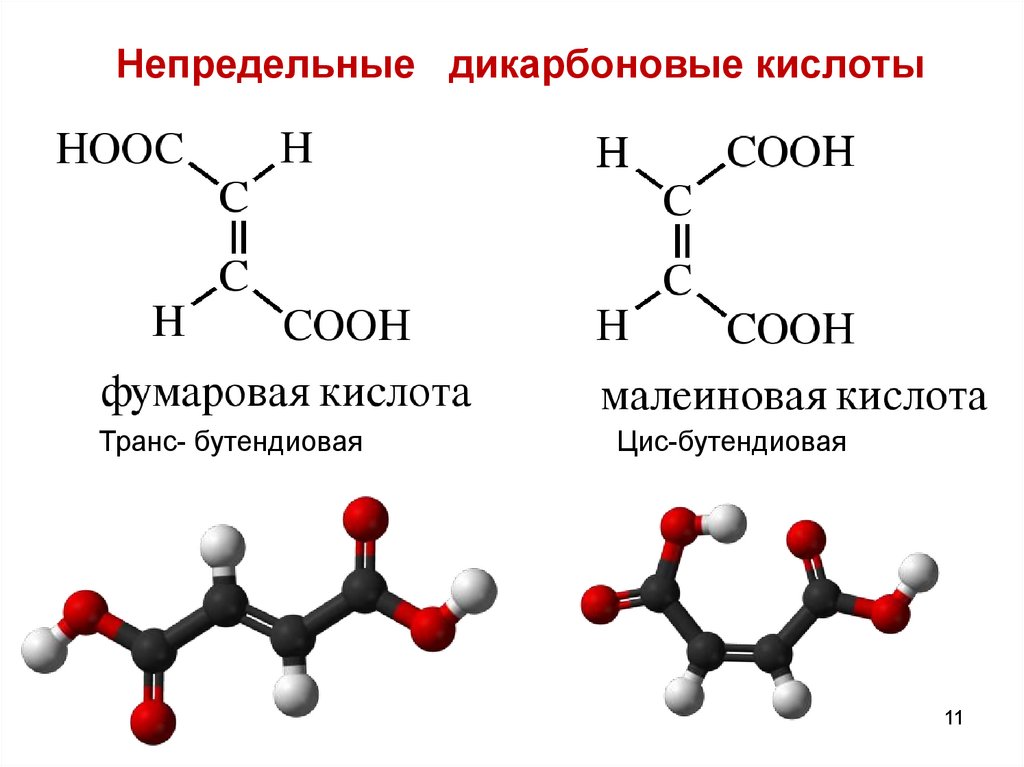
11. Непредельные дикарбоновые кислоты
Транс- бутендиоваяЦис-бутендиовая
11
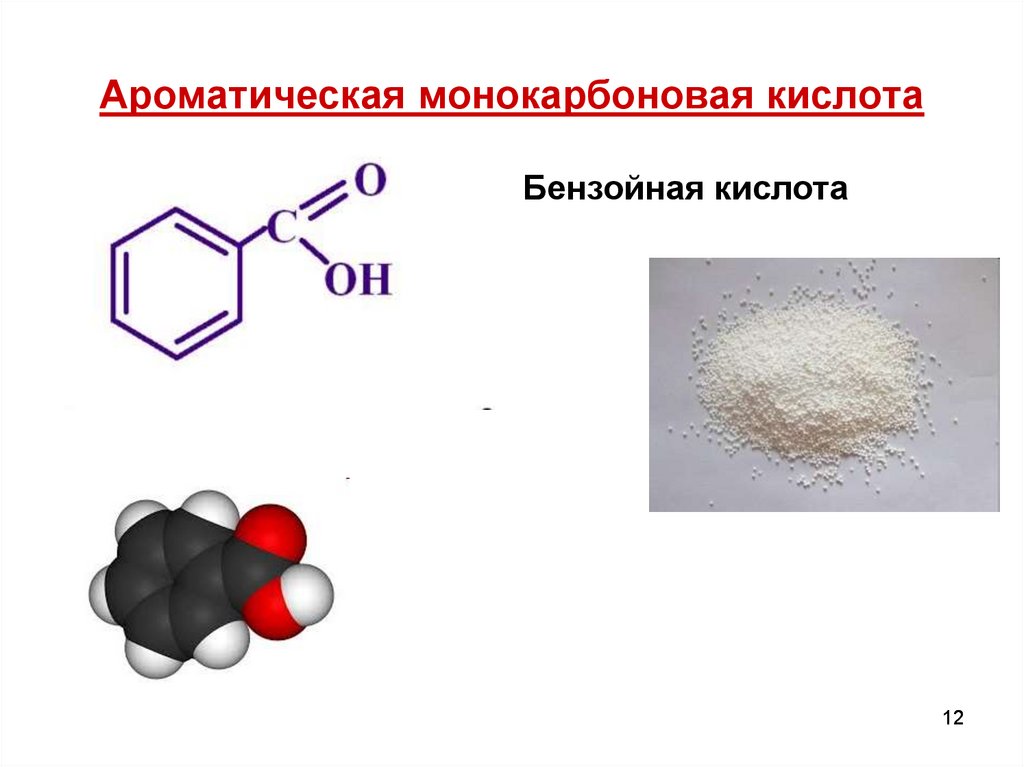
12. Ароматическая монокарбоновая кислота
Бензойная кислота12
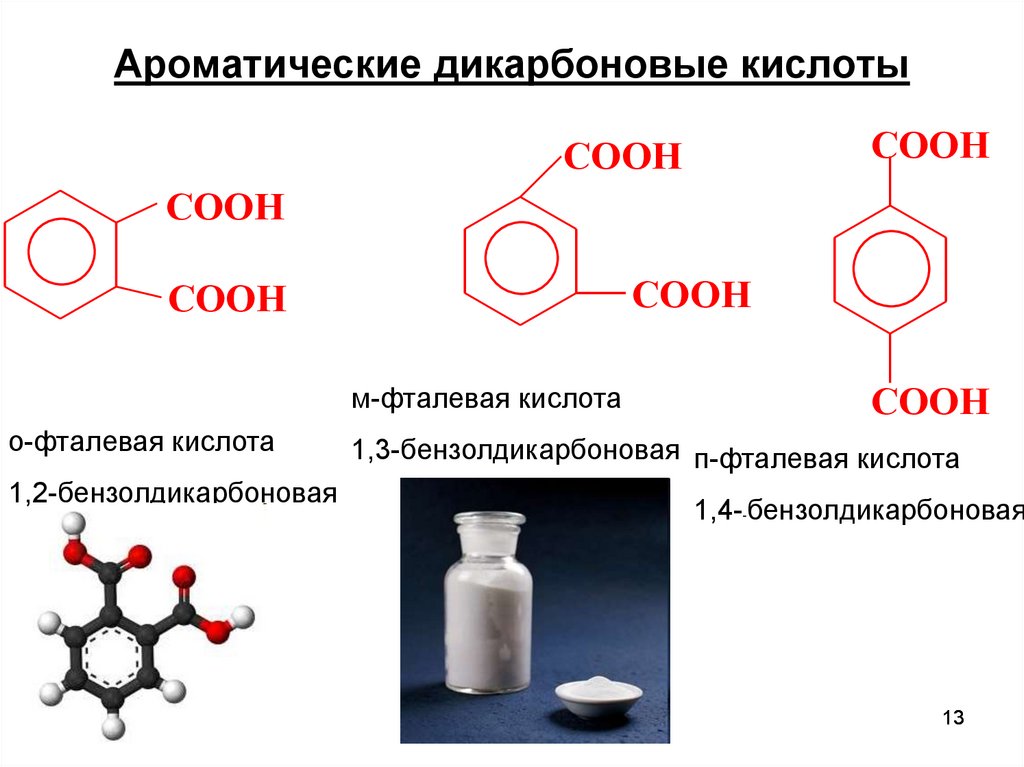
13. Ароматические дикарбоновые кислоты
COOHCOOH
COOH
COOH
COOH
м-фталевая кислота
о-фталевая кислота
1,2-бензолдикарбоновая
COOH
1,3-бензолдикарбоновая п-фталевая кислота
1,4--бензолдикарбоновая
13
14.
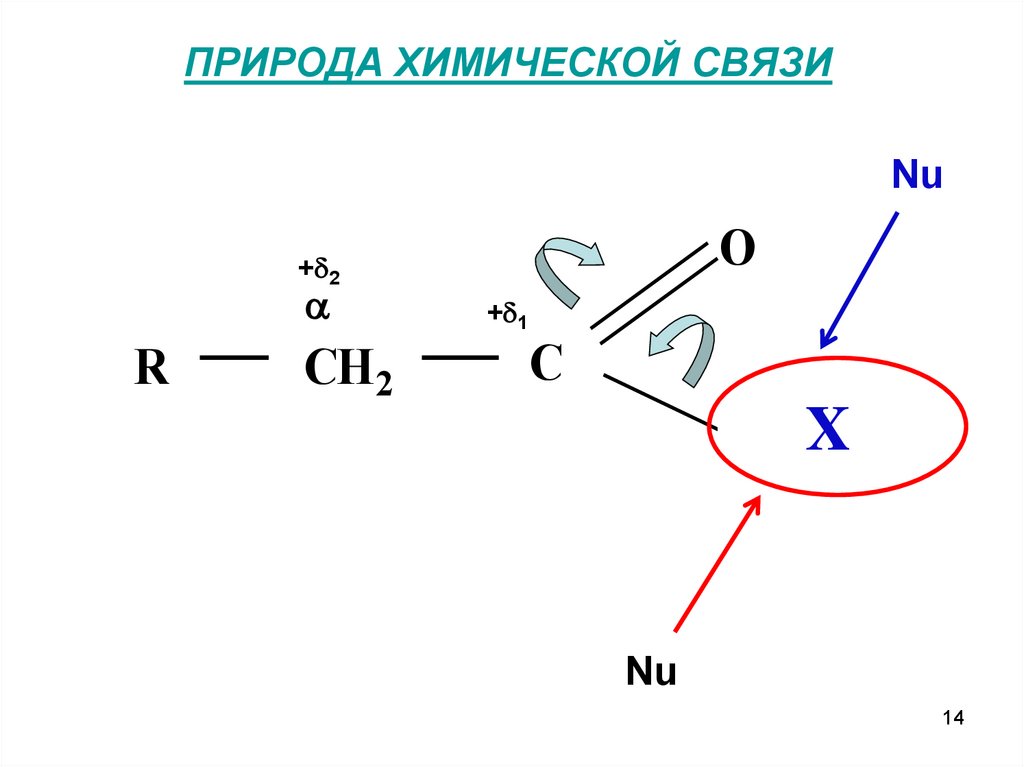
ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИNu
O
+ 2
R
CH 2
+ 1
C
O X HH
Nu
14
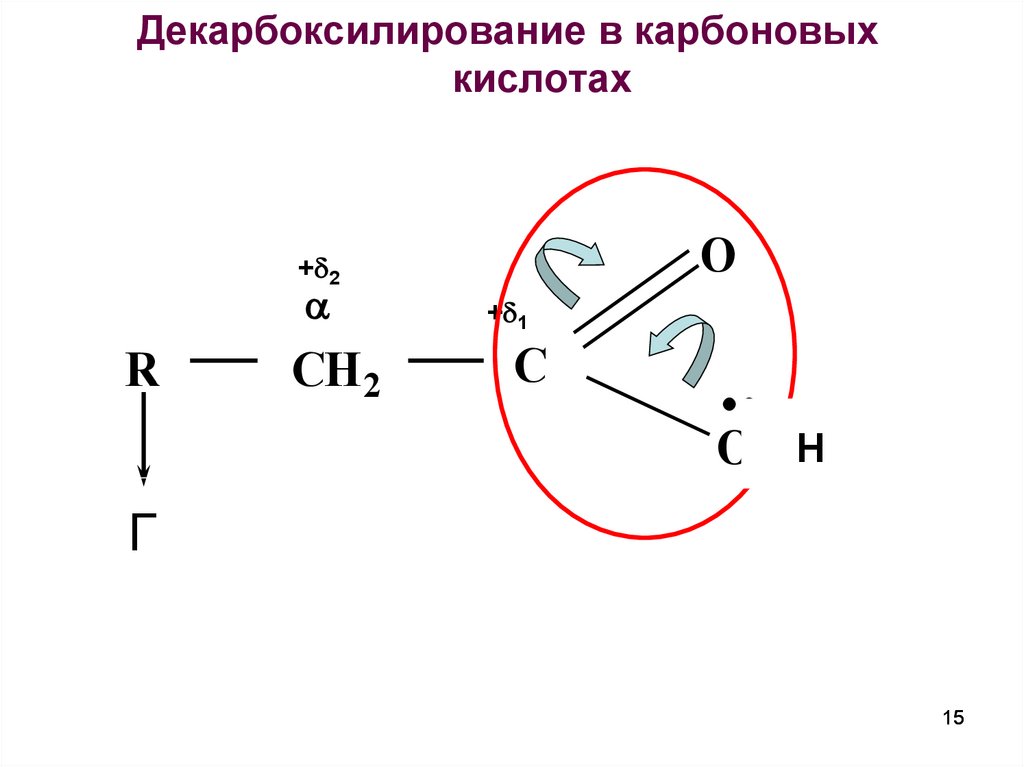
15.
Декарбоксилирование в карбоновыхкислотах
O
+ 2
R
CH 2
+ 1
C
O Н H
Г
15
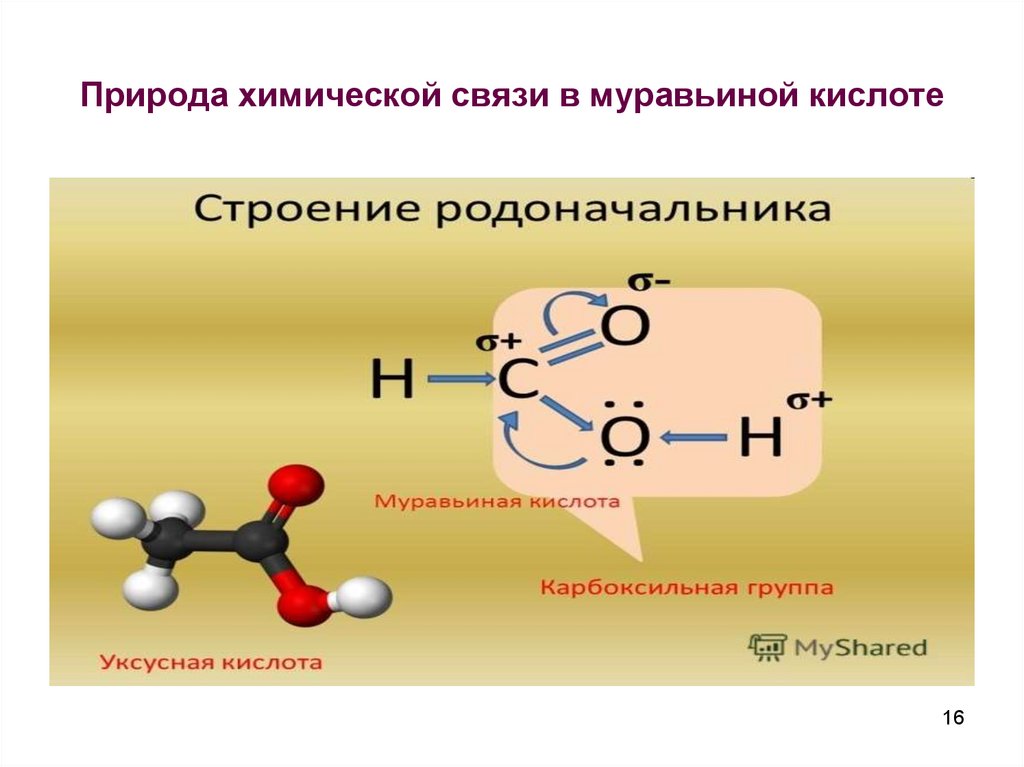
16. Природа химической связи в муравьиной кислоте
1617.
Большинство химических реакций карбоновыхкислот можно разделить на 4 типа:
I.
Реакции, связанные с разрывом связи О-Н кислотные свойства, образование солей.
II.
Реакции SN – образование сложных эфиров,
амидов, ангидридов и т.д .- функциональных
производных карбоновых кислот
III. Реакции декарбоксилирования (потеря СО2)
IV. Реакции с участием R (особенно по α-С атому)
17
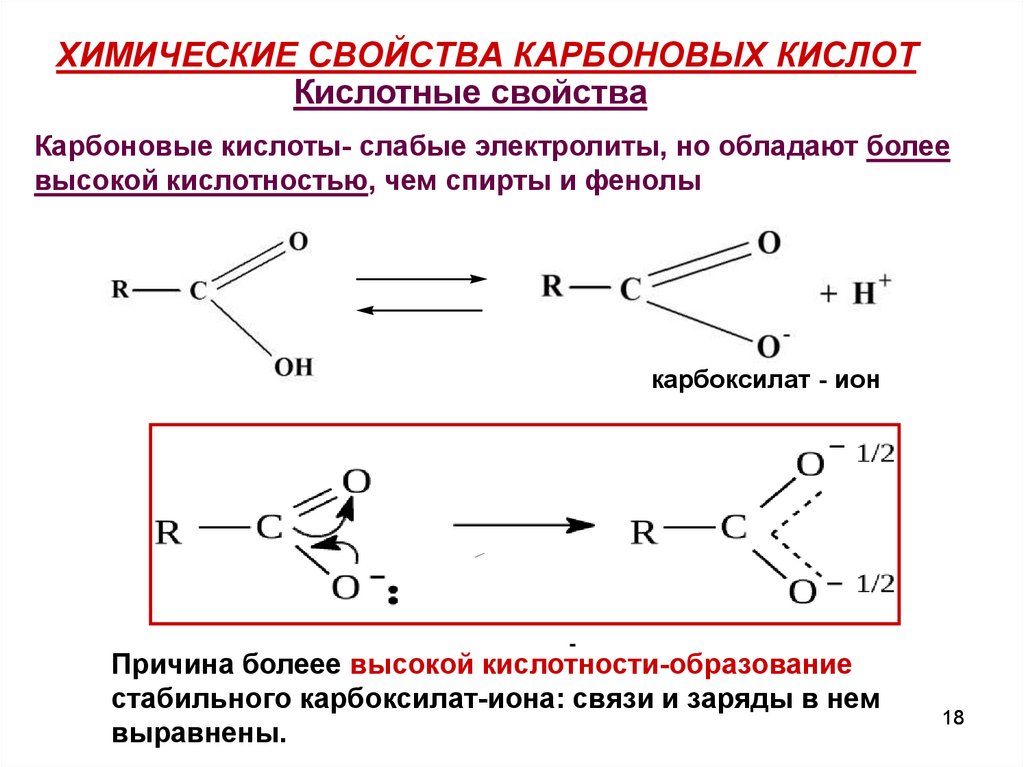
18. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
Кислотные свойстваКарбоновые кислоты- слабые электролиты, но обладают более
высокой кислотностью, чем спирты и фенолы
карбоксилат - ион
-
Причина болеее высокой кислотности-образование
стабильного карбоксилат-иона: связи и заряды в нем
выравнены.
18
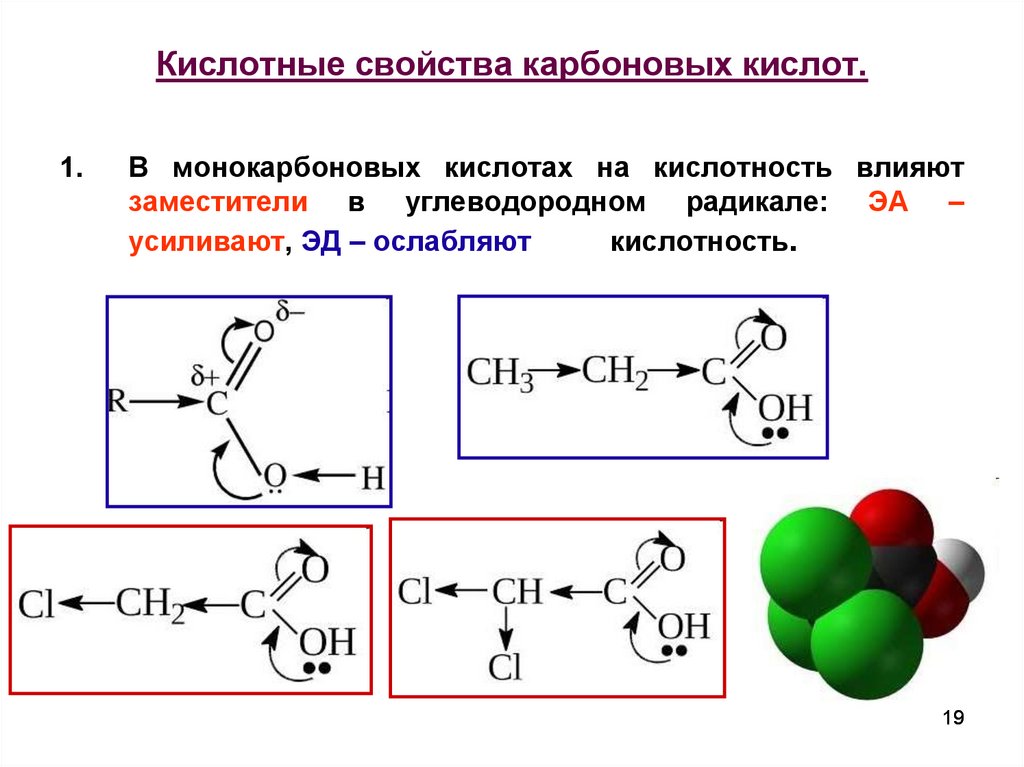
19. Кислотные свойства карбоновых кислот.
1.В монокарбоновых кислотах на кислотность влияют
заместители в углеводородном радикале: ЭА –
усиливают, ЭД – ослабляют
кислотность.
19
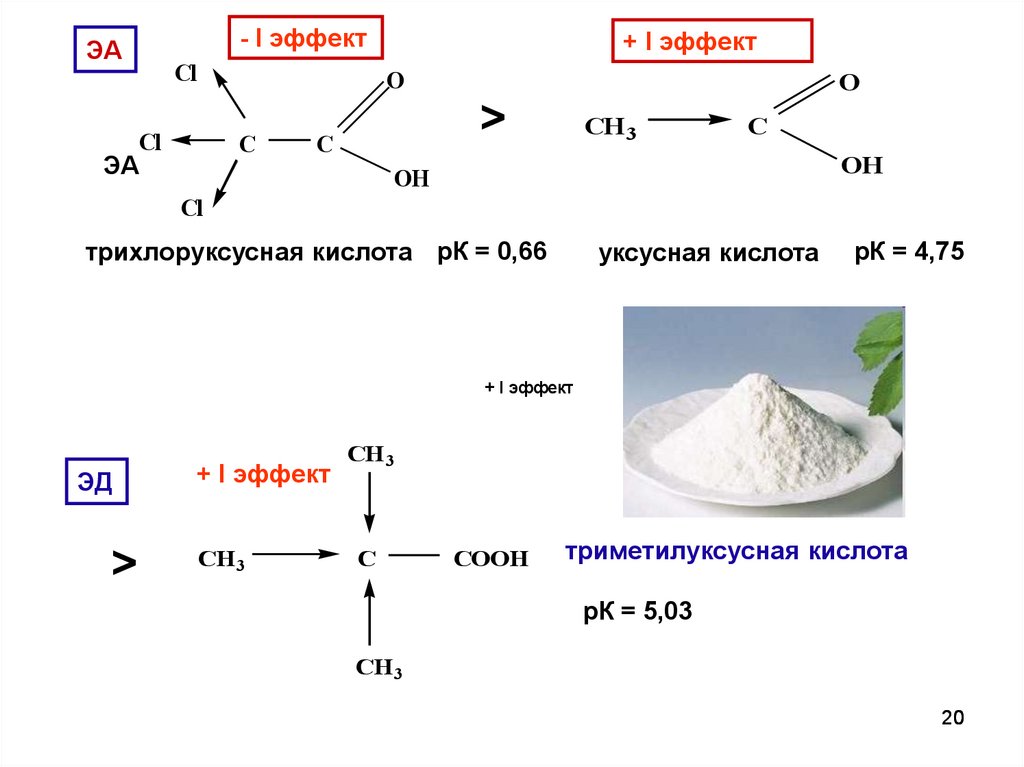
20.
- I эффектЭА
Cl
+ I эффект
O
Cl
C
ЭА
O
>
C
CH3
C
OH
OH
Cl
трихлоруксусная кислота рК = 0,66
уксусная кислота
рК = 4,75
+ I эффект
ЭД
>
+ I эффект
CH 3
CH 3
C
COOH
триметилуксусная кислота
рК = 5,03
CH 3
20
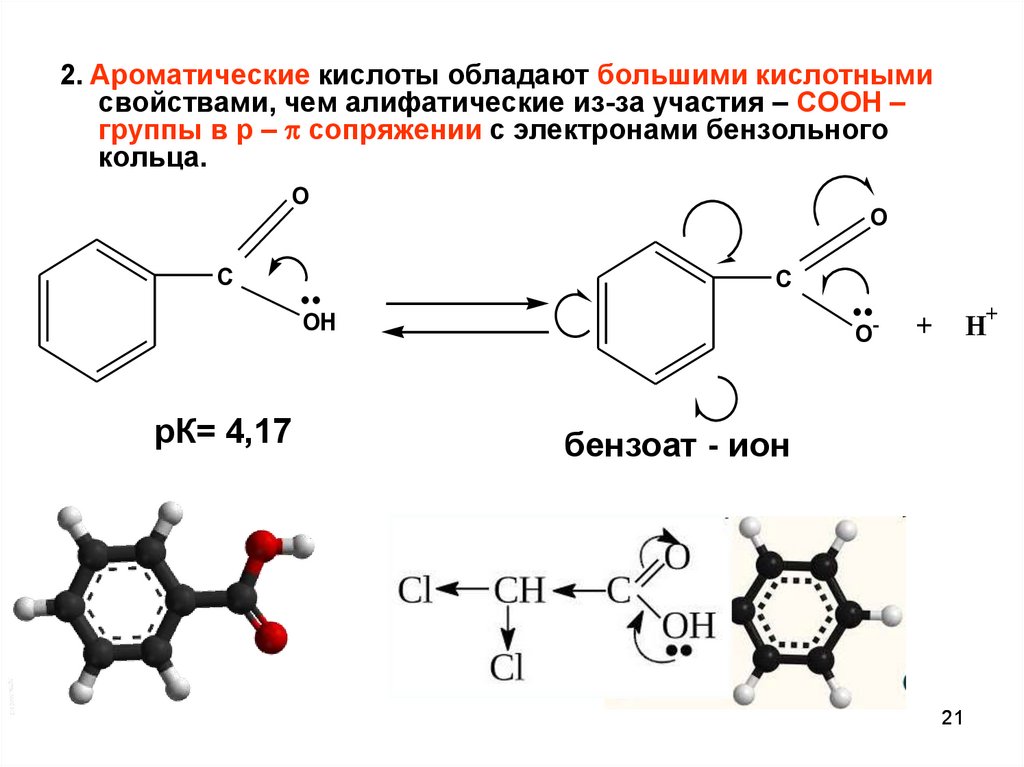
21.
2. Ароматические кислоты обладают большими кислотнымисвойствами, чем алифатические из-за участия – СООН –
группы в р – сопряжении с электронами бензольного
кольца.
O
C
O
C
OH
рК= 4,17
-
O
H+
+
бензоат - ион
21
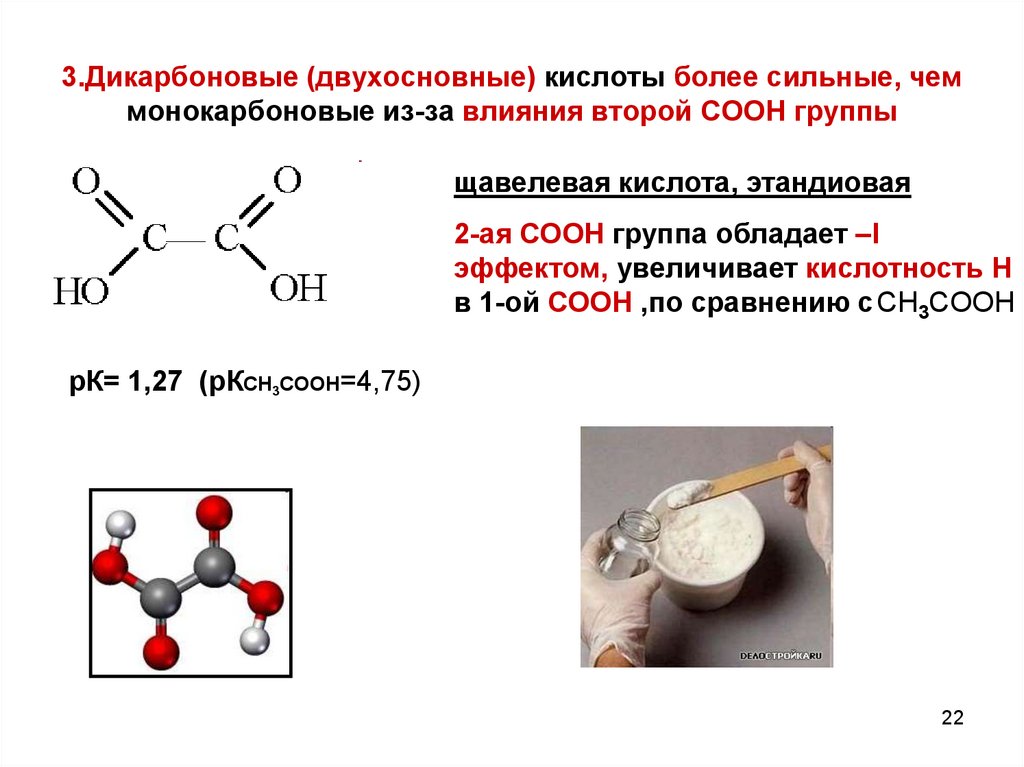
22. 3.Дикарбоновые (двухосновные) кислоты более сильные, чем монокарбоновые из-за влияния второй СООН группы
щавелевая кислота, этандиовая2-ая СООН группа обладает –I
эффектом, увеличивает кислотность Н
в 1-ой СООН ,по сравнению с CH3COOH
рК= 1,27 (рКCH3COOH=4,75)
22
23. Щавелевая кислота
Щавелевая кислота накапливается, когдалистья стареют, в молодых листьях ее немного
Щавелевая кислота и ее соли токсичны
Оксалатные камни в почках
23
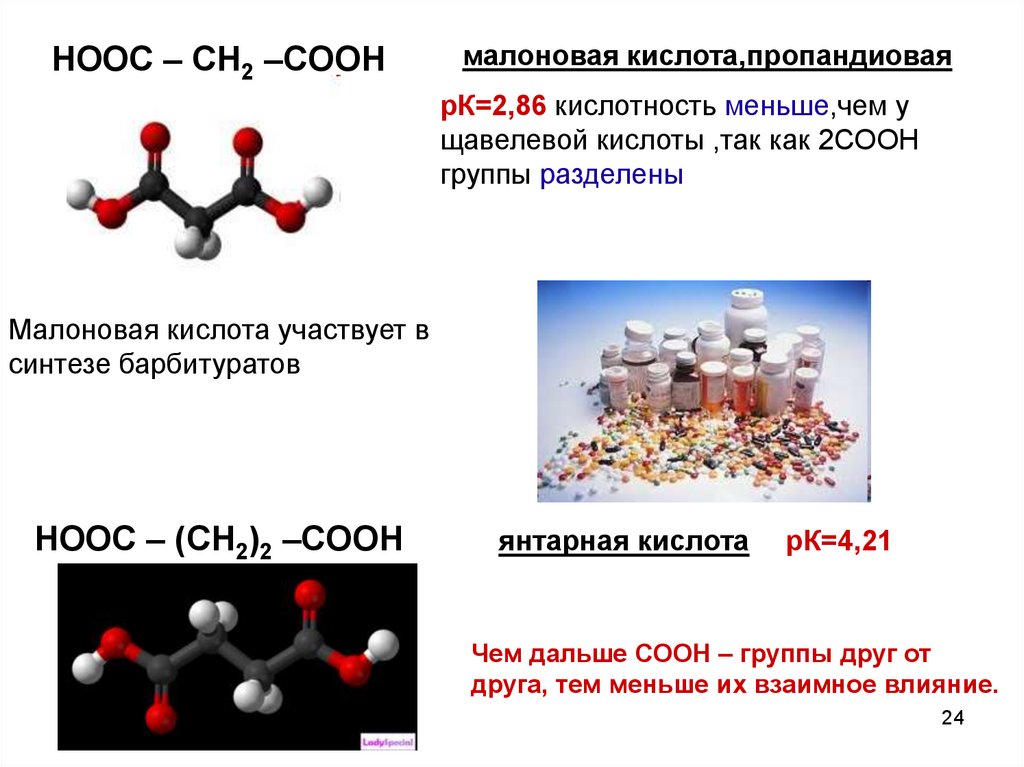
24.
HOOC – CH2 –COOHмалоновая кислота,пропандиовая
рК=2,86 кислотность меньше,чем у
щавелевой кислоты ,так как 2СООН
группы разделены
Малоновая кислота участвует в
синтезе барбитуратов
HOOC – (CH2)2 –COOH
янтарная кислота
рК=4,21
Чем дальше СООН – группы друг от
друга, тем меньше их взаимное влияние.
24
25.
Янтарная кислота оказывает мощное оздоровительное действиена организм
Получается в результате
переработки натурального
янтаря
Содержится в небольших
количествах- в сыре,
кисломолочных продуктах
и морепродуктах
Используется против
старения кожи
25
26.
Образование солей КАРБОНОВЫХ КИСЛОТNa
-H 2
CaO
CH3COOH
CH3COONa
(CH3COO)2Ca
-H2O
Cu(OH) 2
(CH3COO)2Cu
-H2O
NaHCO3
CH3COONa + H2O + CO2
26
27. Ледяная уксусная кислота (концентрация близка к 100%)
Действие уксусной кислоты на биологические ткани зависит от ееконцентрации .Опасная концентрация - свыше30%
Безводная СН3СООН при 15 С
переходит в кристаллическое
состояние,похожее на лед
27
28.
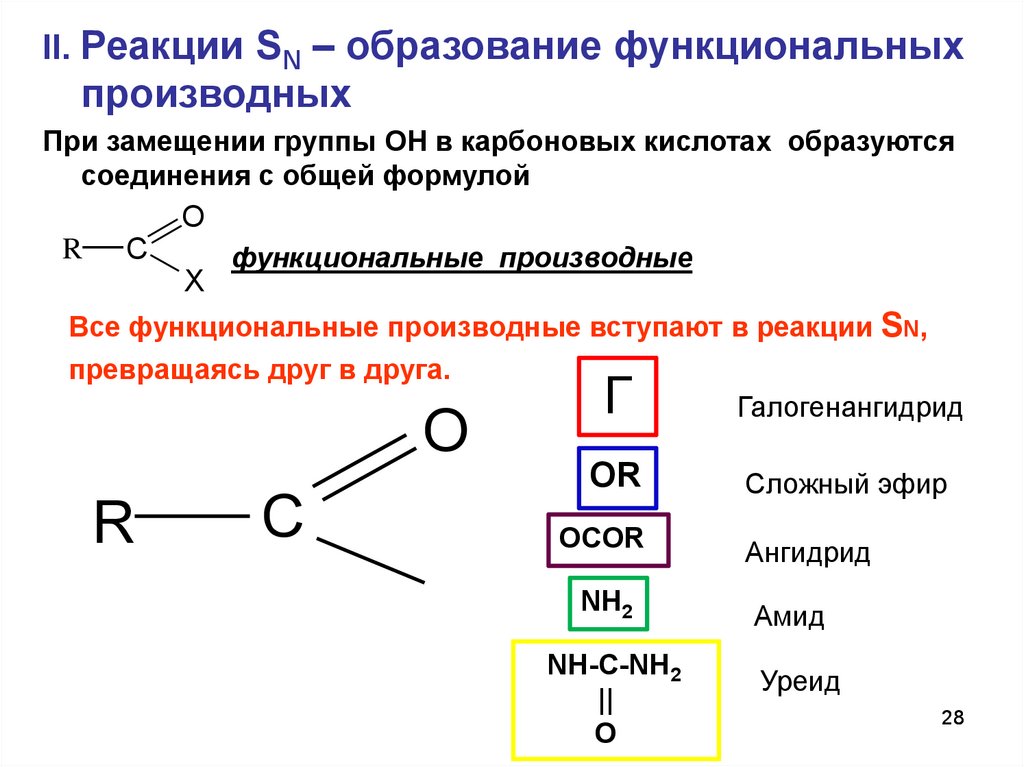
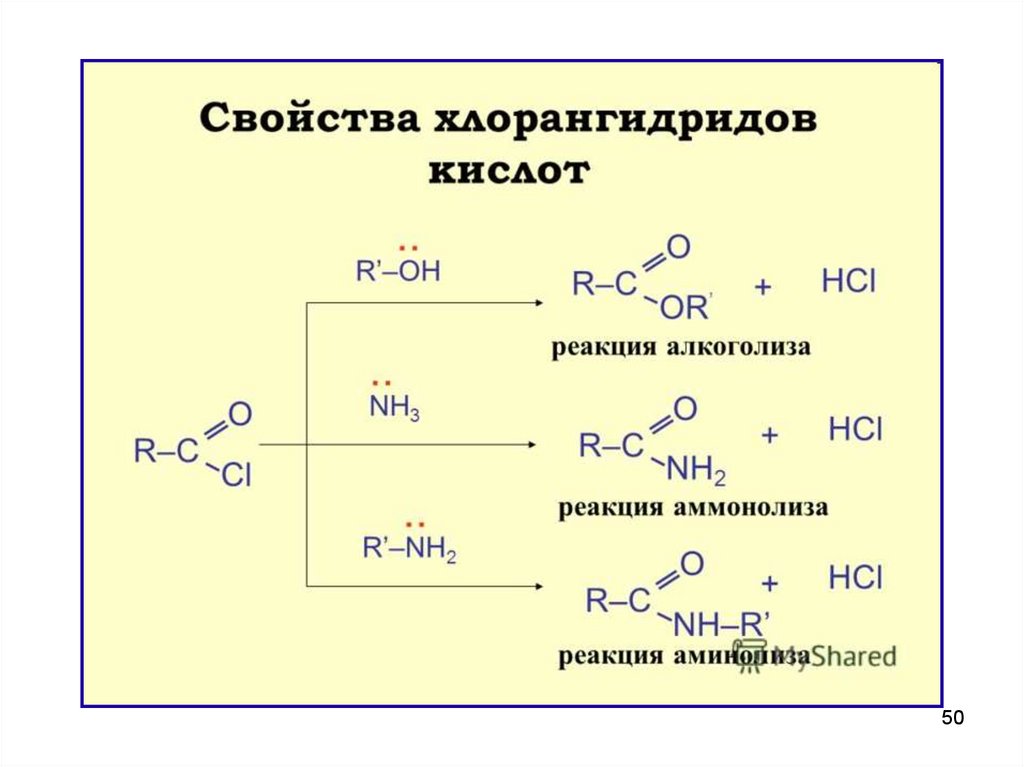
II. Реакции SN – образование функциональныхпроизводных
При замещении группы ОН в карбоновых кислотах образуются
соединения с общей формулой
O
R
C
X
функциональные производные
Все функциональные производные вступают в реакции SN,
превращаясь друг в друга.
Галогенангидрид
O
R
C
Г
OR
Сложный эфир
OCOR
Ангидрид
NH2
Амид
NH-C-NH2
||
O
Уреид
28
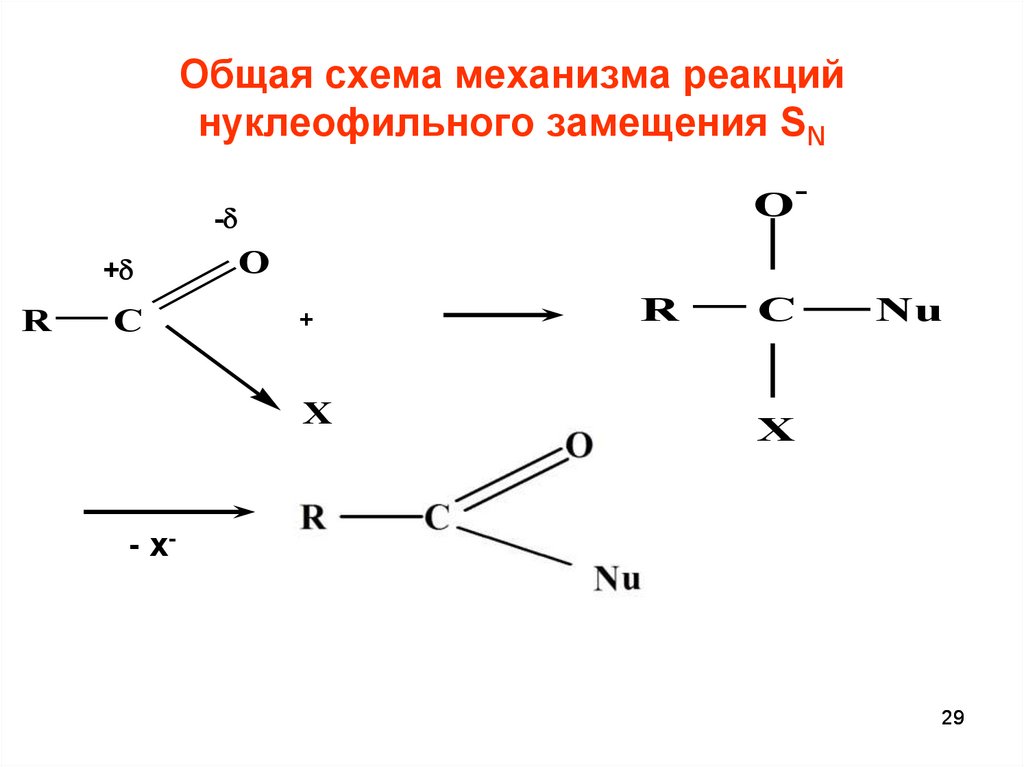
29. Общая схема механизма реакций нуклеофильного замещения SN
O--
+
R
C
O
+
X
R
C
Nu
X
- х-
29
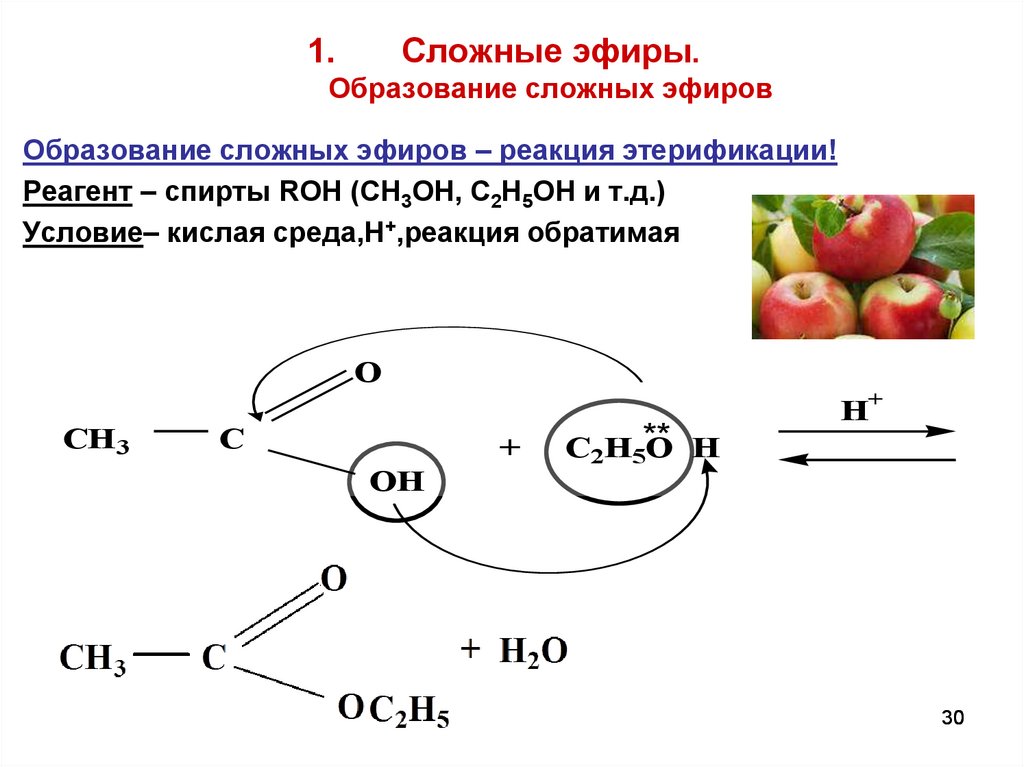
30. Сложные эфиры. Образование сложных эфиров
Сложные эфиры.1.
Образование сложных эфиров
Образование сложных эфиров – реакция этерификации!
Реагент – спирты ROH (CH3OH, C2H5OH и т.д.)
Условие– кислая среда,Н+,реакция обратимая
O
CH 3
C
+
OH
C2H5**
O H
H+
30
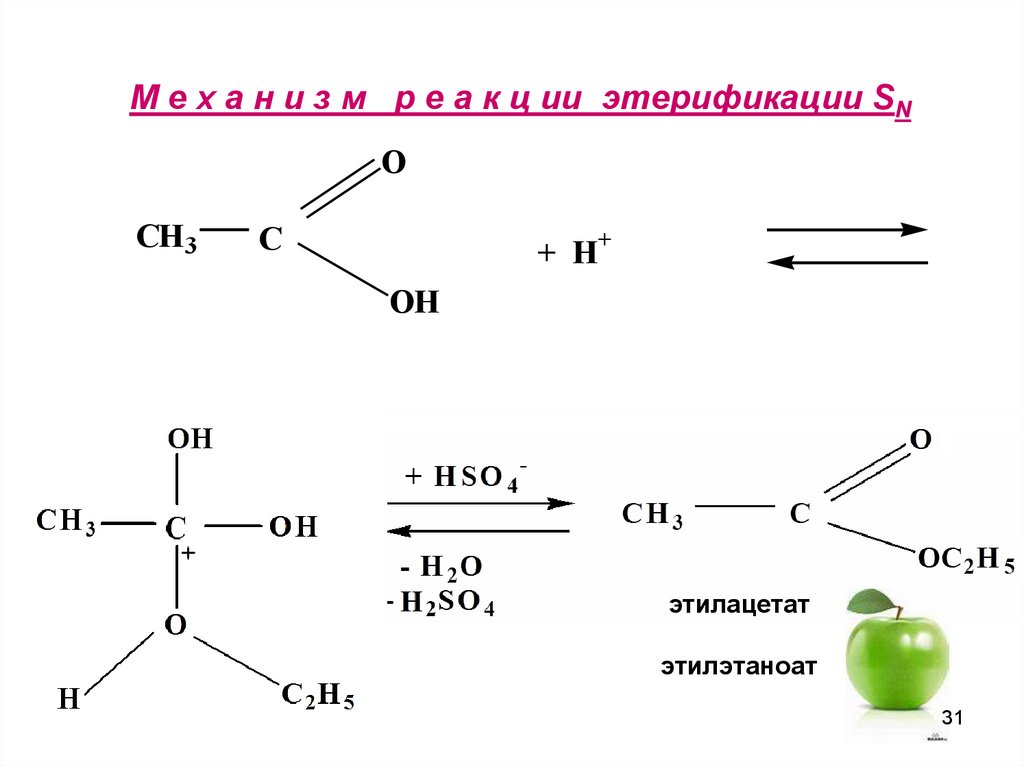
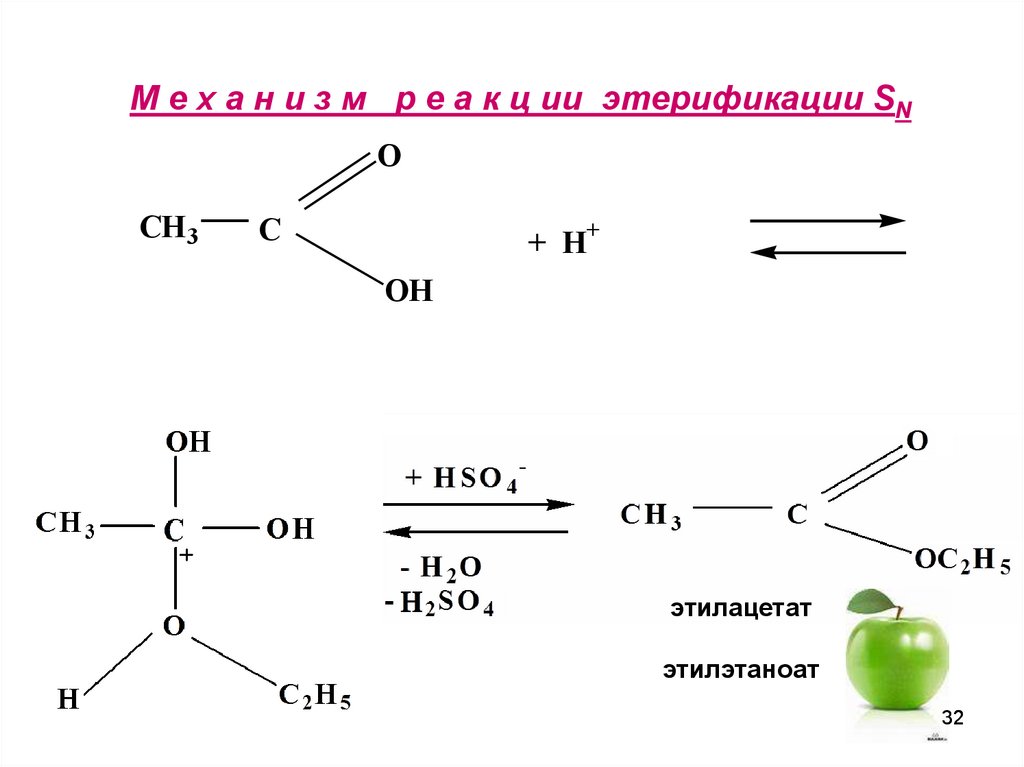
31. М е х а н и з м р е а к ц ии этерификации SN
OCH3
C
+ H+
OH
этилацетат
этилэтаноат
31
32. М е х а н и з м р е а к ц ии этерификации SN
OCH3
C
+ H+
OH
этилацетат
этилэтаноат
32
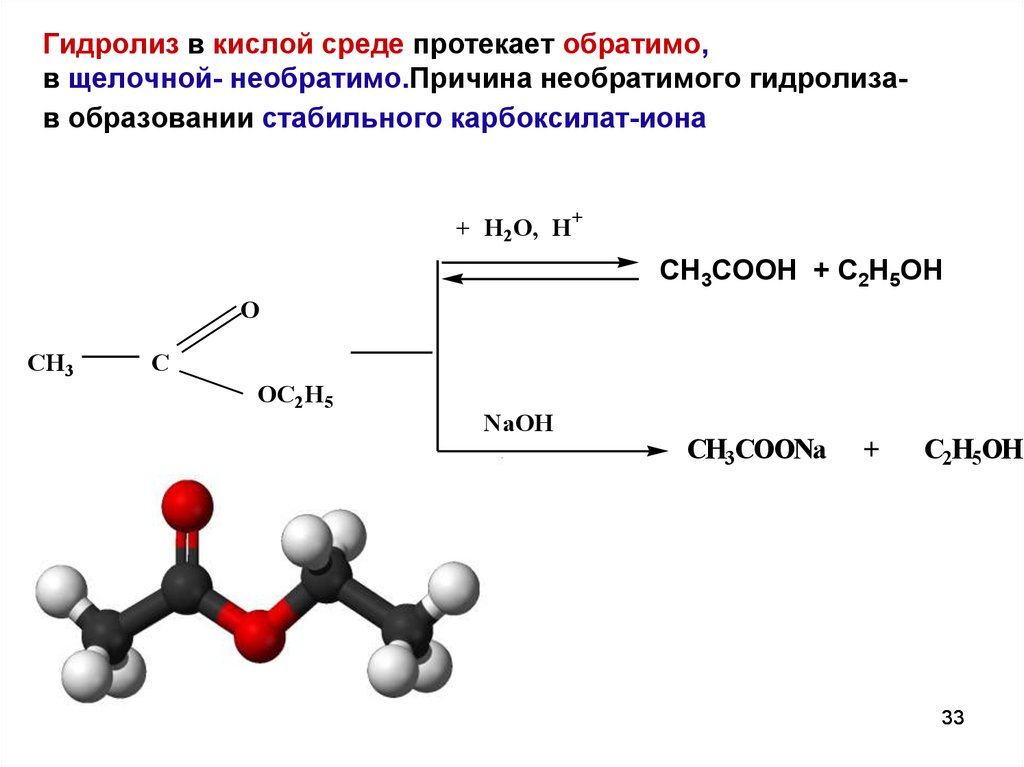
33.
Гидролиз в кислой среде протекает обратимо,в щелочной- необратимо.Причина необратимого гидролизав образовании стабильного карбоксилат-иона
+ H2O, H
+
CH3COOH + C2H5OH
O
CH3
C
OC 2H5
NaOH
CH3COONa
+
C2H5OH
33
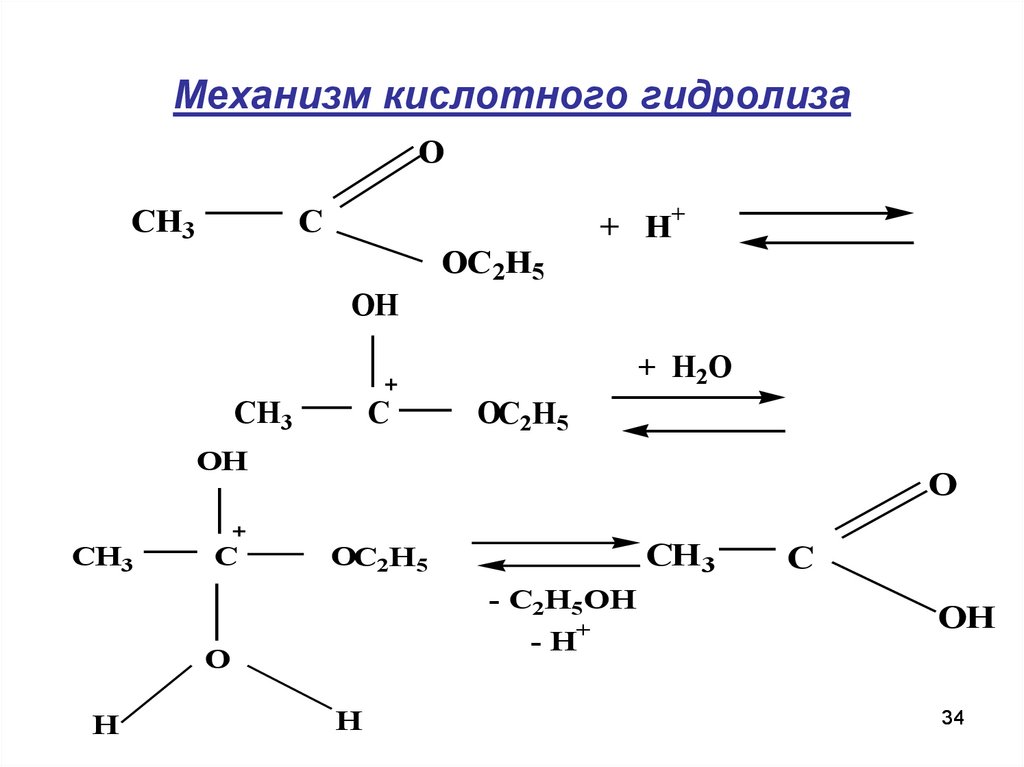
34. Механизм кислотного гидролиза
OCH3
C
+ H
OC 2H5
+
OH
+ H2O
CH3
C
OC2H5
OH
CH3
C
O
CH 3
OC2H5
- C2H5OH
-H
O
H
H
+
C
OH
34
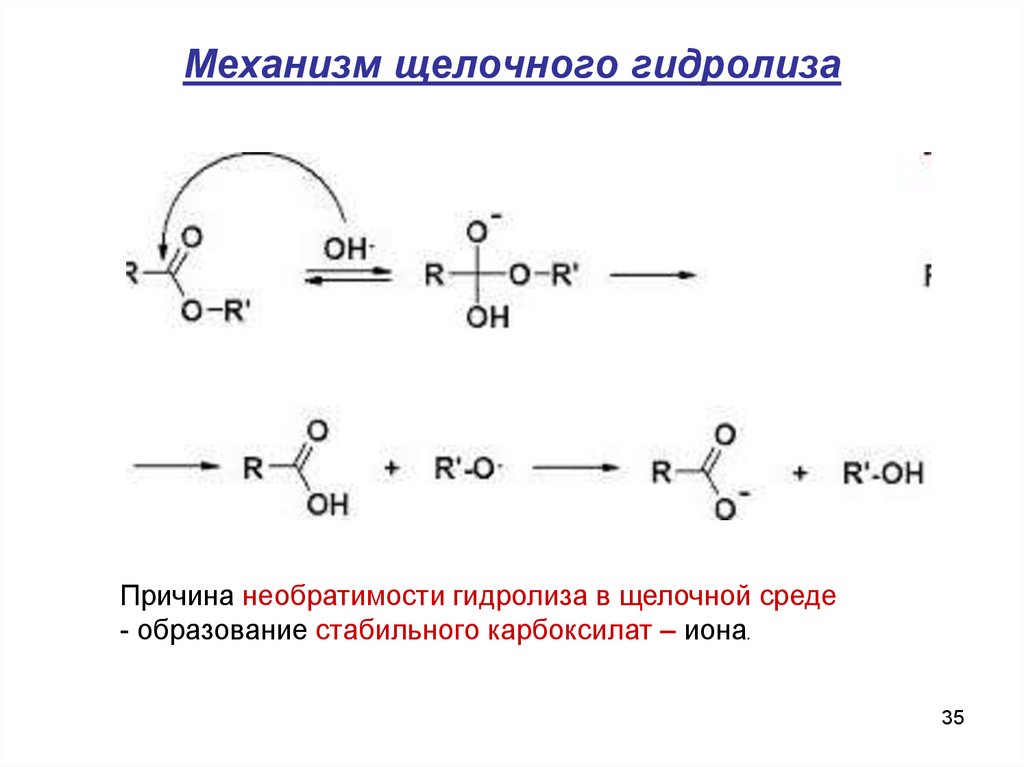
35. Механизм щелочного гидролиза
Причина необратимости гидролиза в щелочной среде- образование стабильного карбоксилат – иона.
35
36. СЛОЖНЫЕ ЭФИРЫ в природе и нашей жизни
Распространены в живой природе – входят в составцветов, ягод, фруктов, определяя аромат.
пентилацетат – банановый
этилбутират – абрикосовый
бензилацетат – жасминовый
этилбутаноат- ананасовый
36
37.
Когда число атомов С в исходных карбоновой кислоте испирте не превышает 6–8, соответствующие сложные эфиры
представляют собой бесцветные маслянистые жидкости, чаще
всего с фруктовым запахом. Они составляют группу
фруктовых эфиров.
Бутилацетатгрушевый аромат
Метилбутиратяблочный
37
Этилизовалератмалиновый
38.
Если в образовании сложного эфира участвует ароматическийспирт (содержащий ароматическое ядро), то такие соединения
обладают, как правило, цветочным запахом.
Бензилацетат-жасминовый
Некоторые из них вначале были выделены
из растений, а позже синтезированы
искусственно.
38
39.
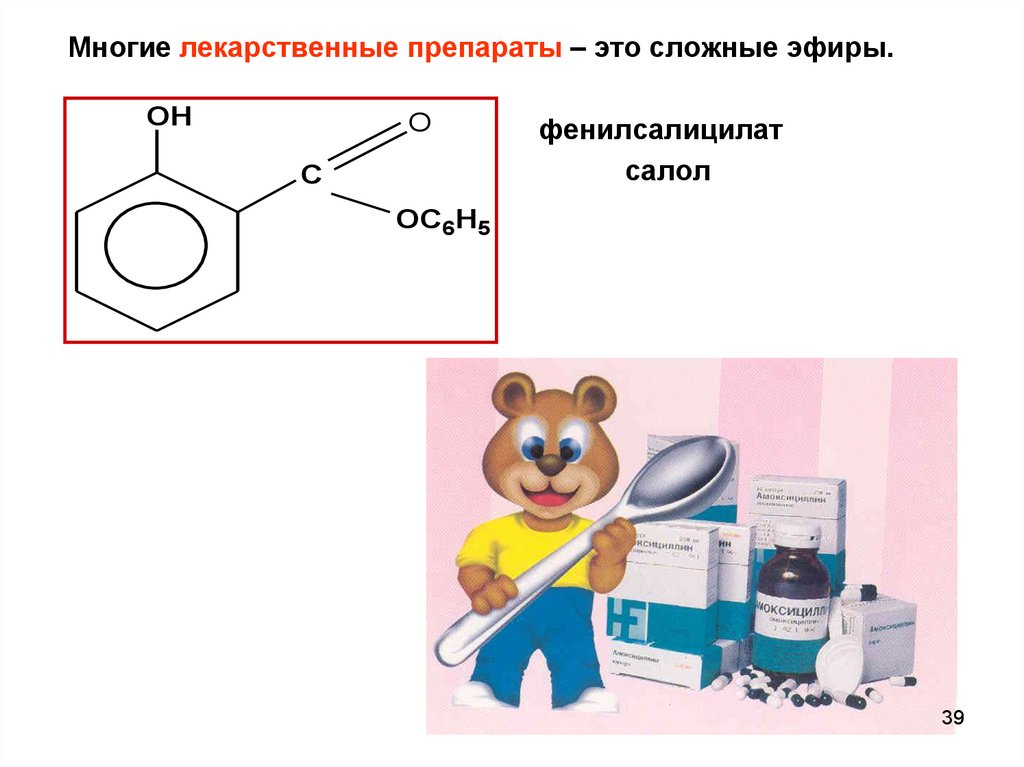
Многие лекарственные препараты – это сложные эфиры.OH
O
C
фенилсалицилат
салол
OC6H5
39
40. Диметилфталаты - сложные эфиры о-фталевой кислоты.
спасают от клещаспасают от комаров
(репелленты)
40
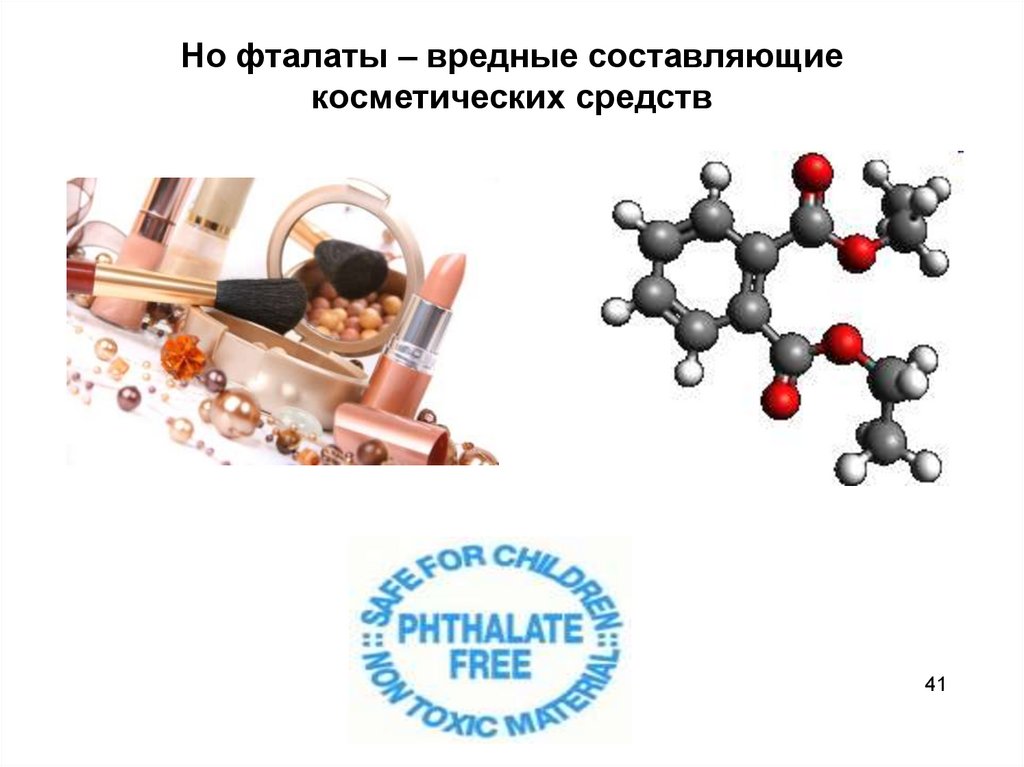
41. Но фталаты – вредные составляющие косметических средств
4142.
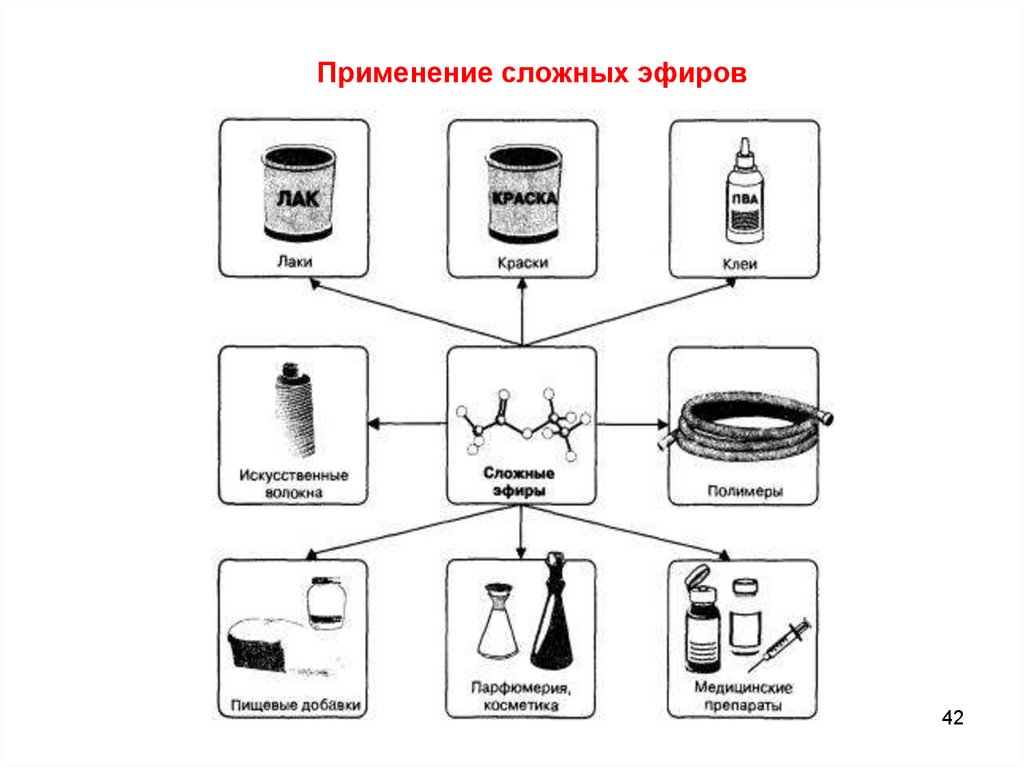
Применение сложных эфиров42
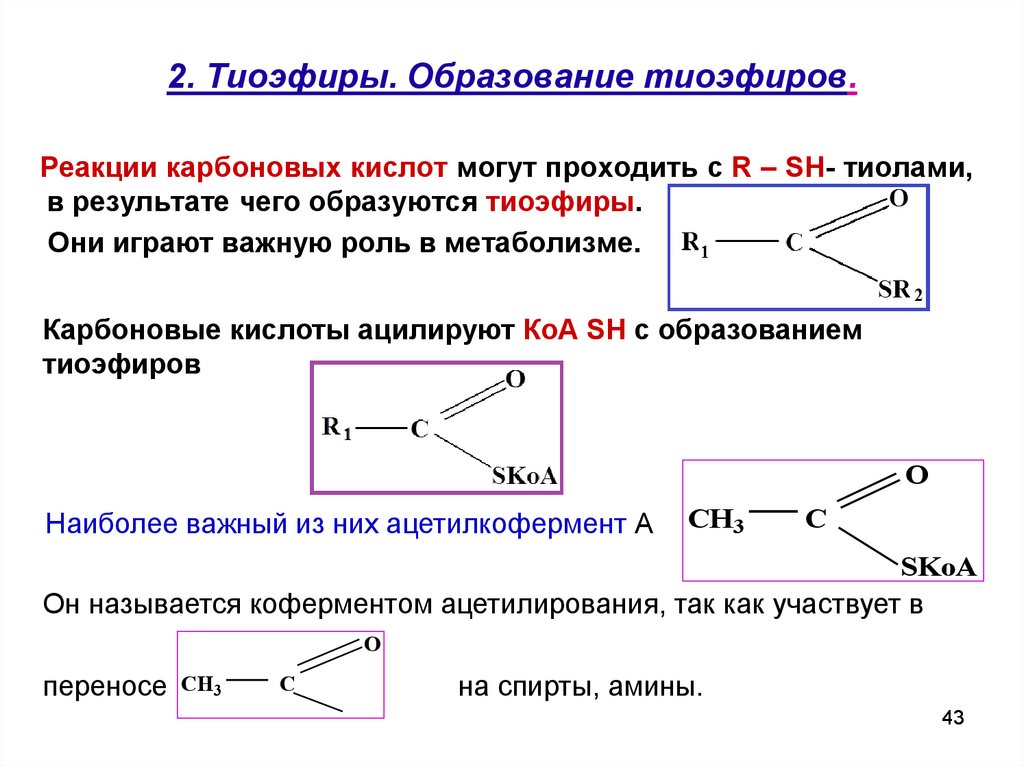
43. 2. Тиоэфиры. Образование тиоэфиров.
Реакции карбоновых кислот могут проходить с R – SH- тиолами,в результате чего образуются тиоэфиры.
Они играют важную роль в метаболизме.
Карбоновые кислоты ацилируют КоА SH с образованием
тиоэфиров
O
Наиболее важный из них ацетилкофермент А
CH3
C
SKoA
Он называется коферментом ацетилирования, так как участвует в
O
переносе CH3
C
на спирты, амины.
43
44.
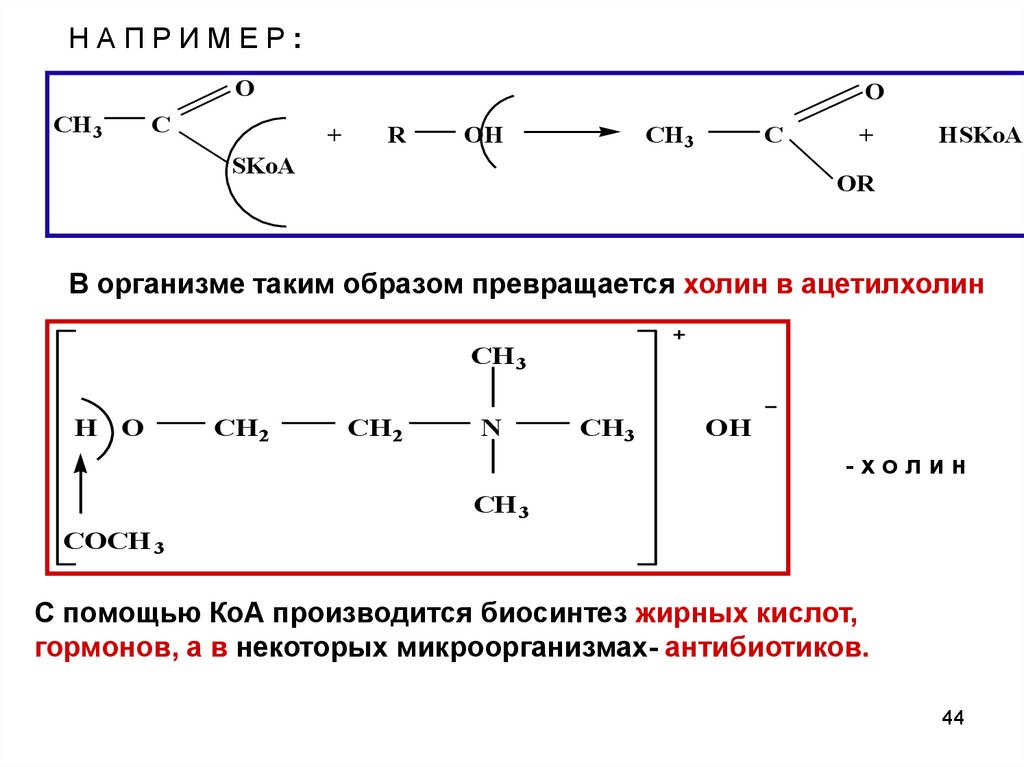
НАПРИМЕР:O
CH3
C
O
+
R
OH
CH3
C
SKoA
+
HSKoA
OR
В организме таким образом превращается холин в ацетилхолин
CH 3
H O
CH2
CH2
N
CH3
OH
-холин
CH 3
COCH 3
С помощью КоА производится биосинтез жирных кислот,
гормонов, а в некоторых микроорганизмах- антибиотиков.
44
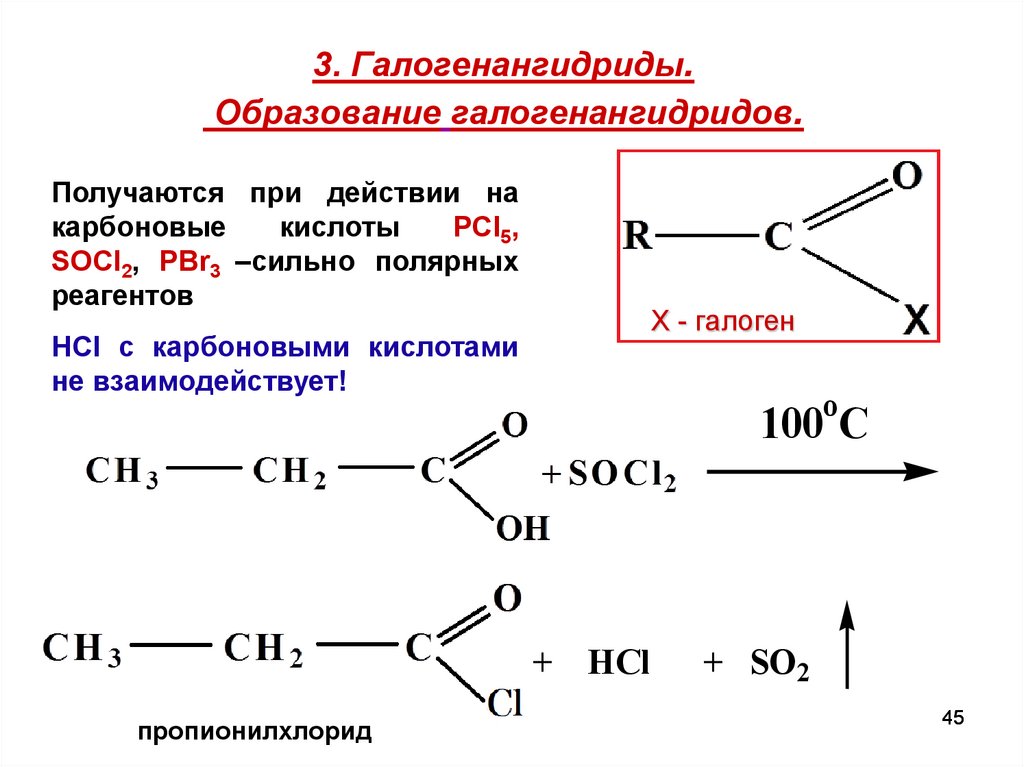
45. 3. Галогенангидриды. Образование галогенангидридов.
Получаются при действии накарбоновые
кислоты
РCl5,
SOCl2, PBr3 –сильно полярных
реагентов
Х - галоген
HCI c карбоновыми кислотами
не взаимодействует!
o
100 C
+ HCl
пропионилхлорид
+ SO2
45
46. Хлорангидриды или ацилхлориды простых карбоновых кислот – жидкости, часто лакриматоры (вызывают слёзы).
Хлорангидридуксусной кислоты
46
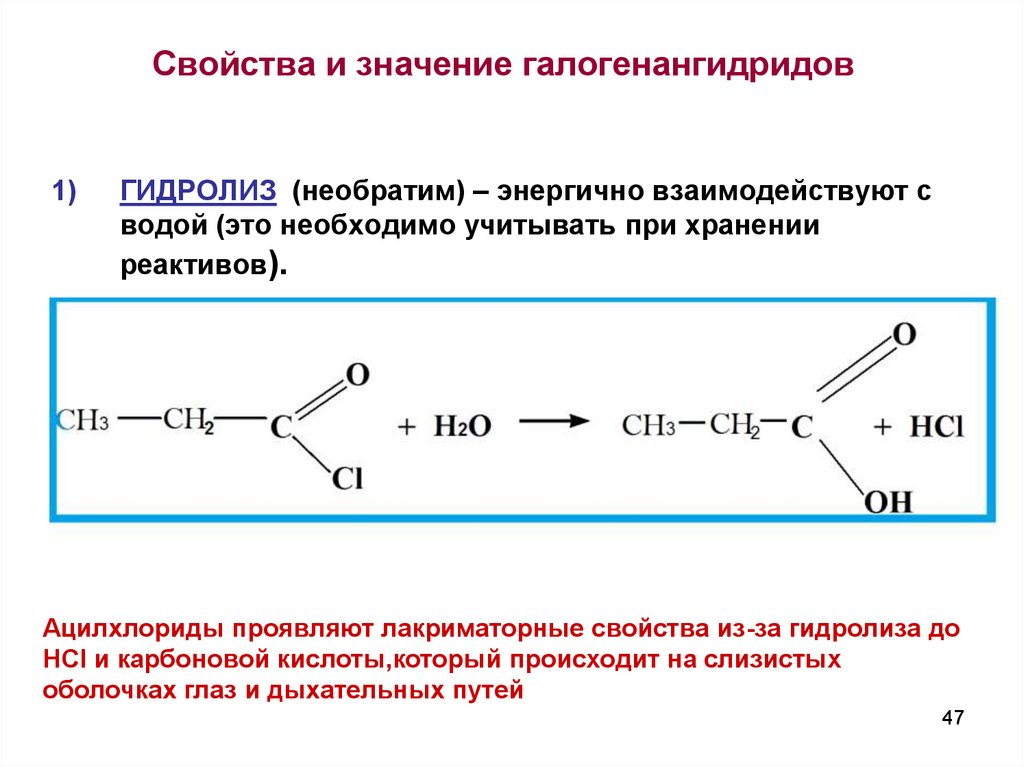
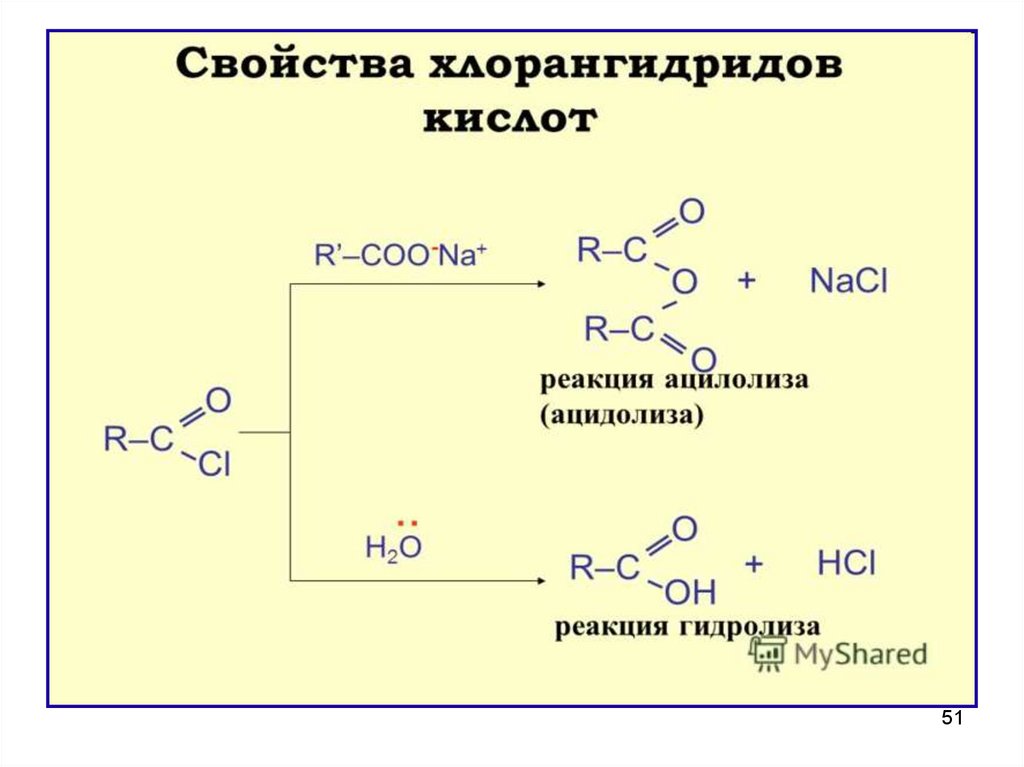
47. Свойства и значение галогенангидридов
1)ГИДРОЛИЗ (необратим) – энергично взаимодействуют с
водой (это необходимо учитывать при хранении
реактивов).
Ацилхлориды проявляют лакриматорные свойства из-за гидролиза до
HCI и карбоновой кислоты,который происходит на слизистых
оболочках глаз и дыхательных путей
47
48.
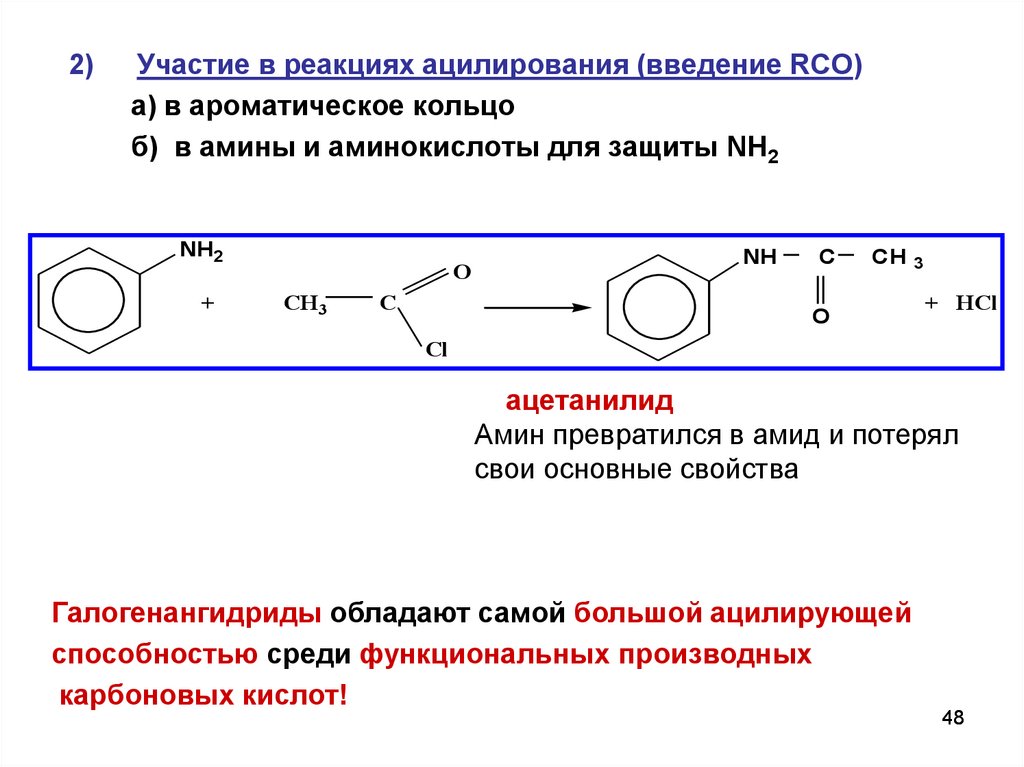
2)Участие в реакциях ацилирования (введение RCO)
а) в ароматическое кольцо
б) в амины и аминокислоты для защиты NH2
NH2
+
O
CH3
C
NH
C
CH 3
O
+ HCl
Cl
ацетанилид
Амин превратился в амид и потерял
свои основные свойства
Галогенангидриды обладают самой большой ацилирующей
способностью среди функциональных производных
карбоновых кислот!
48
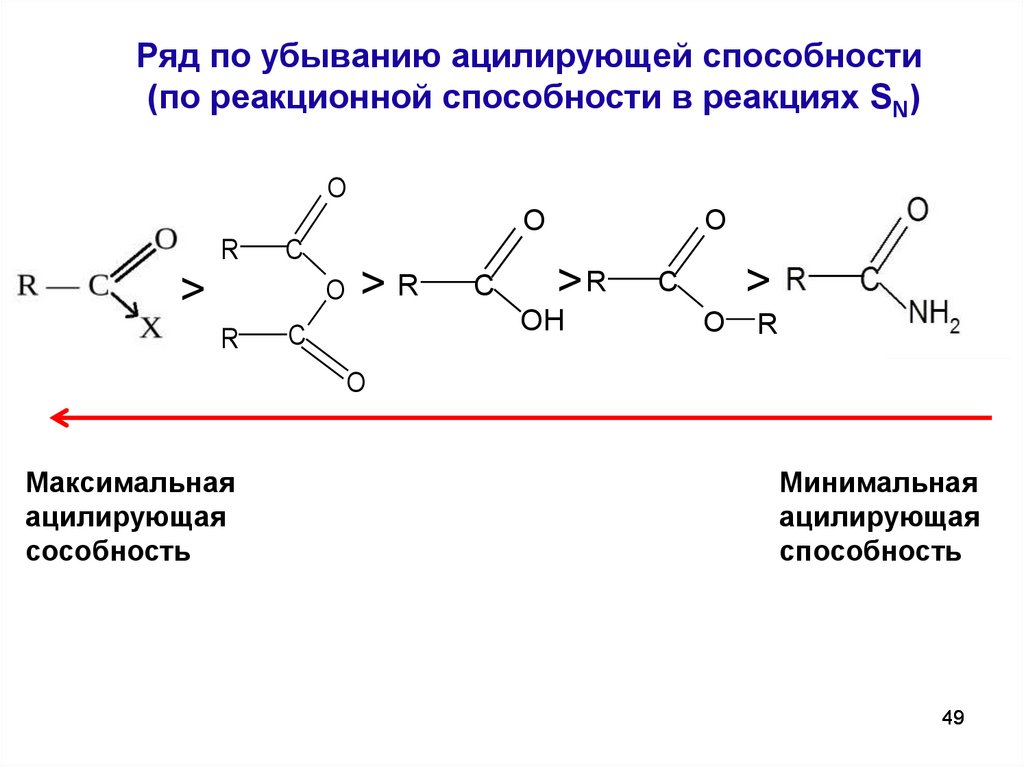
49. Ряд по убыванию ацилирующей способности (по реакционной способности в реакциях SN)
OO
R
C
>
O
R
>R
C
O
>R
OH
C
>
C
O
R
O
Максимальная
ацилирующая
сособность
Минимальная
ацилирующая
способность
49
50.
5051.
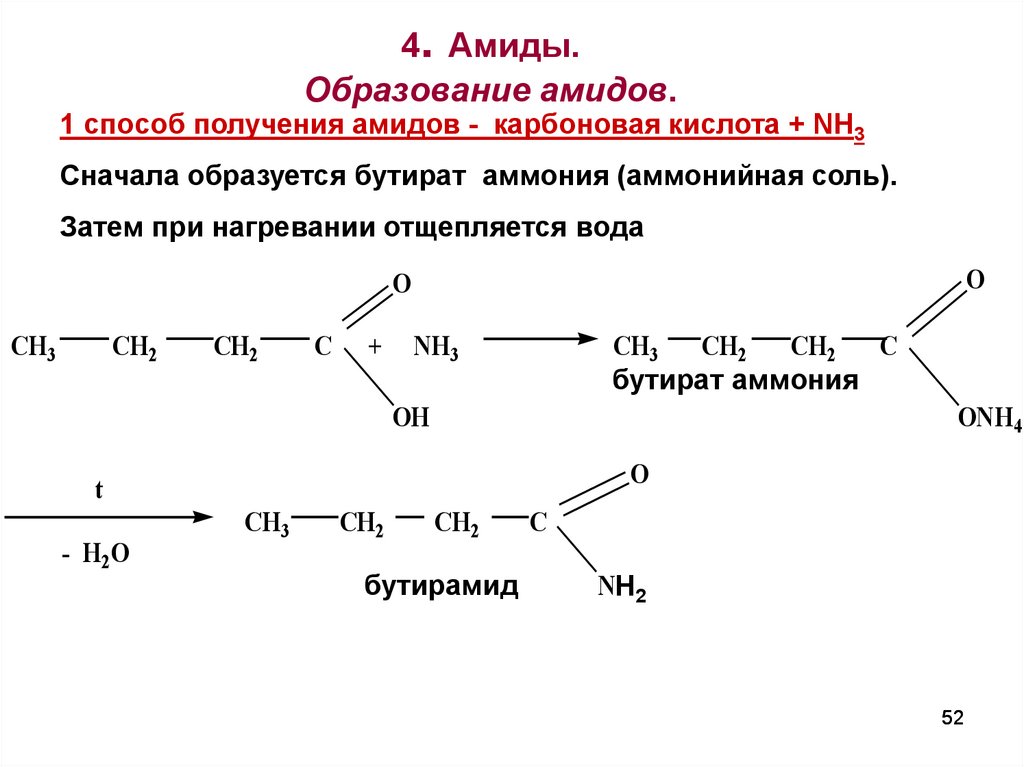
5152. 4. Амиды. Образование амидов.
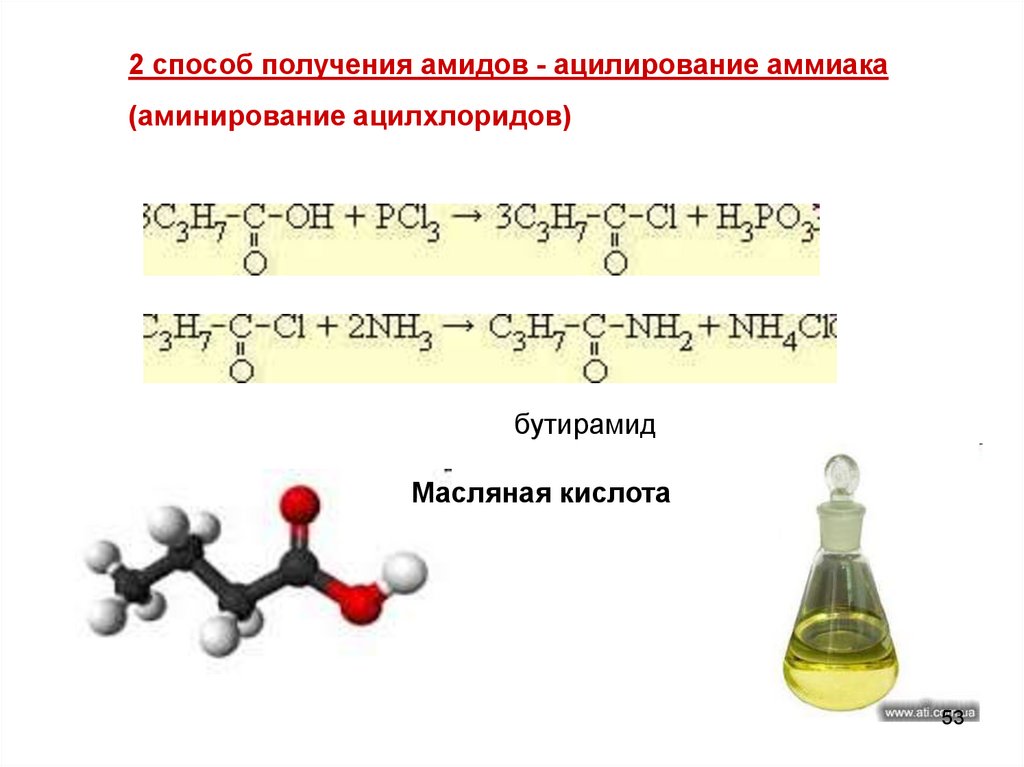
1 споcоб получения амидов - карбоновая кислота + NH3Сначала образуется бутират аммония (аммонийная соль).
Затем при нагревании отщепляется вода
O
O
CH3
CH2
CH2
C
+
NH3
CH3
CH2
CH2
C
бутират аммония
OH
ONH4
O
t
- H2O
CH3
CH2
CH2
бутирамид
C
NH
Н22
52
53.
2 способ получения амидов - ацилирование аммиака(аминирование ацилхлоридов)
бутирамид
Масляная кислота
53
54.
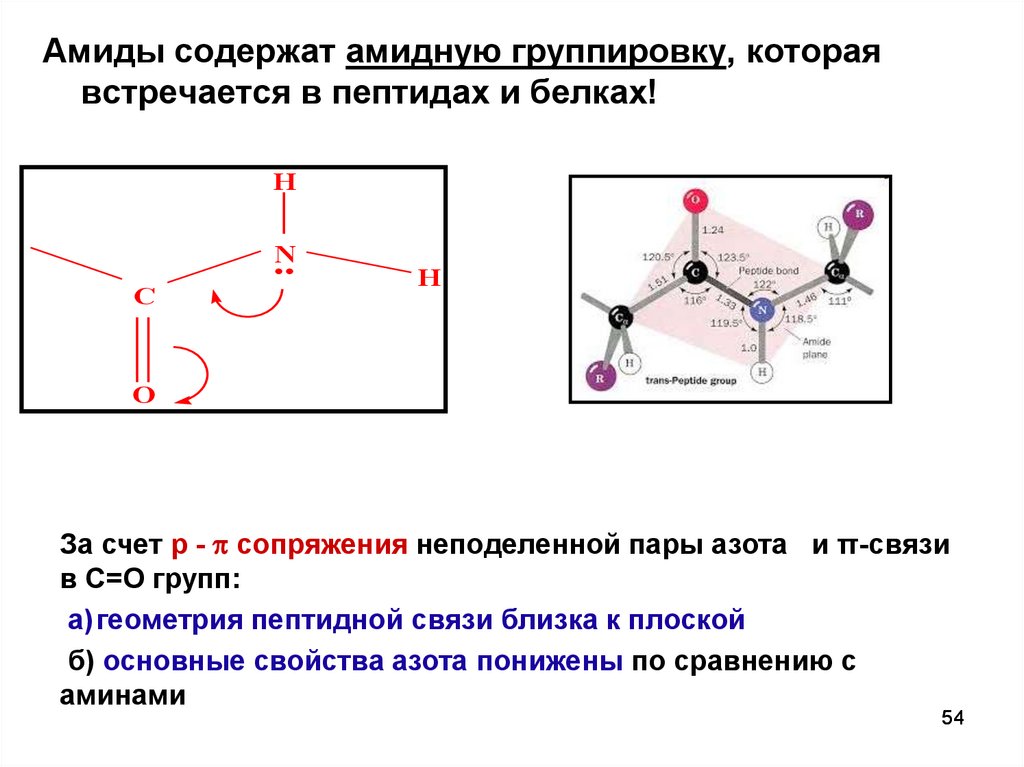
Амиды содержат амидную группировку, котораявстречается в пептидах и белках!
H
N
C
H
O
За счет р - сопряжения неподеленной пары азота и π-связи
в С=О групп:
а) геометрия пептидной связи близка к плоской
б) основные свойства азота понижены по сравнению с
аминами
54
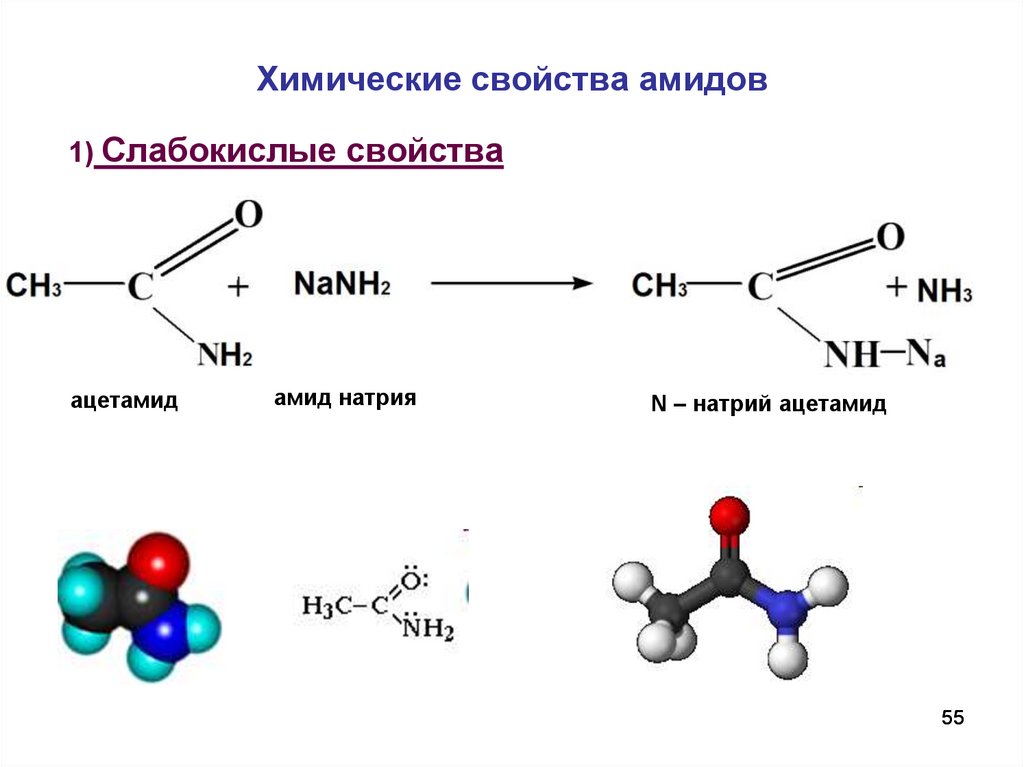
55. Химические свойства амидов
1) Слабокислые свойстваацетамид
амид натрия
N – натрий ацетамид
55
56.
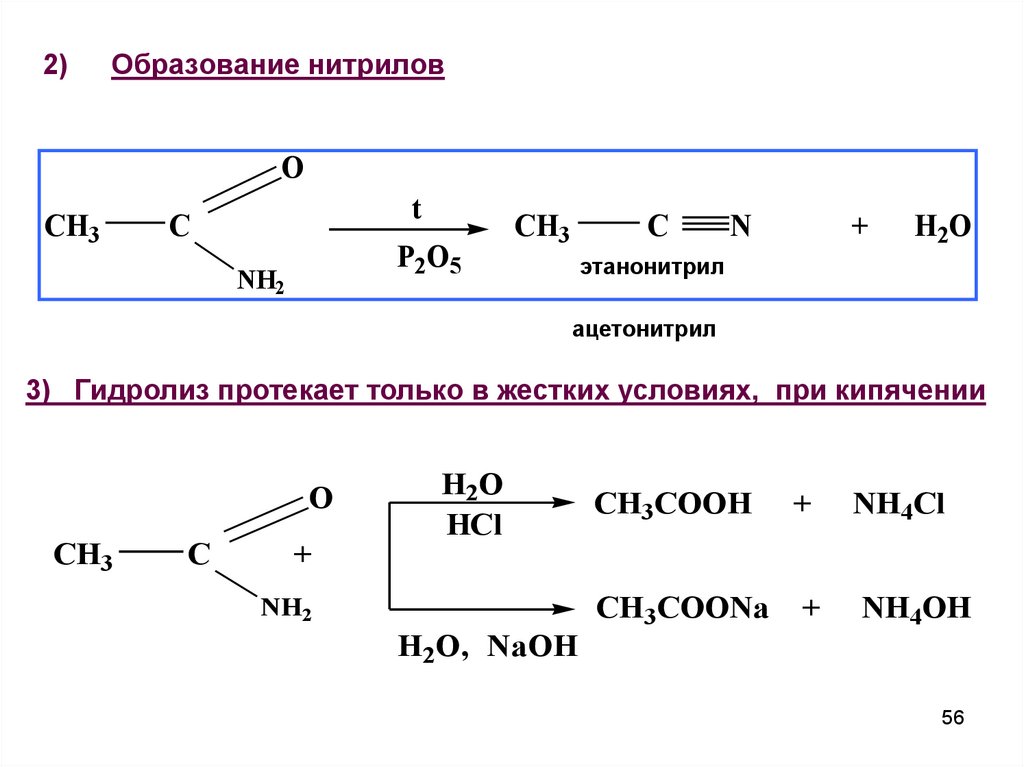
2)Образование нитрилов
O
CH3
t
C
P2O5
NH2
CH3
C
N
+
H2O
этанонитрил
ацетонитрил
3) Гидролиз протекает только в жестких условиях, при кипячении
O
CH3
C
+
H2O
HCl
NH2
CH3COOH
+
NH4Cl
CH3COONa
+
NH4OH
H2O, NaOH
56
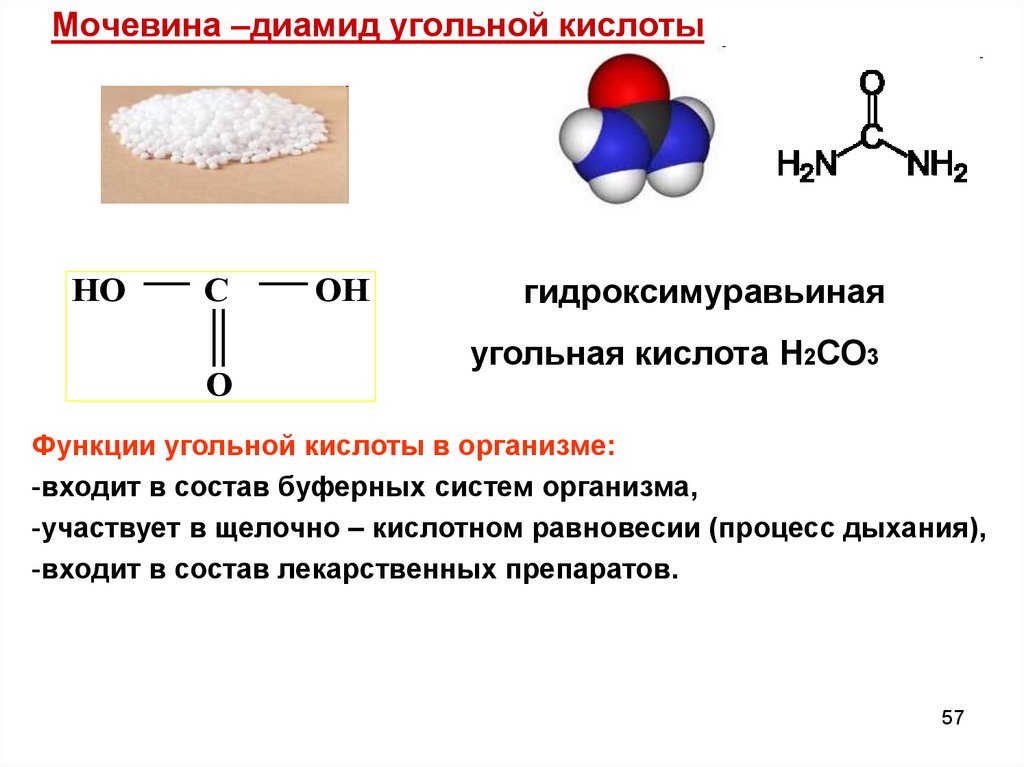
57.
Мочевина –диамид угольной кислотыHO
C
O
OH
гидроксимуравьиная
угольная кислота Н2СО3
Функции угольной кислоты в организме:
-входит в состав буферных систем организма,
-участвует в щелочно – кислотном равновесии (процесс дыхания),
-входит в состав лекарственных препаратов.
57
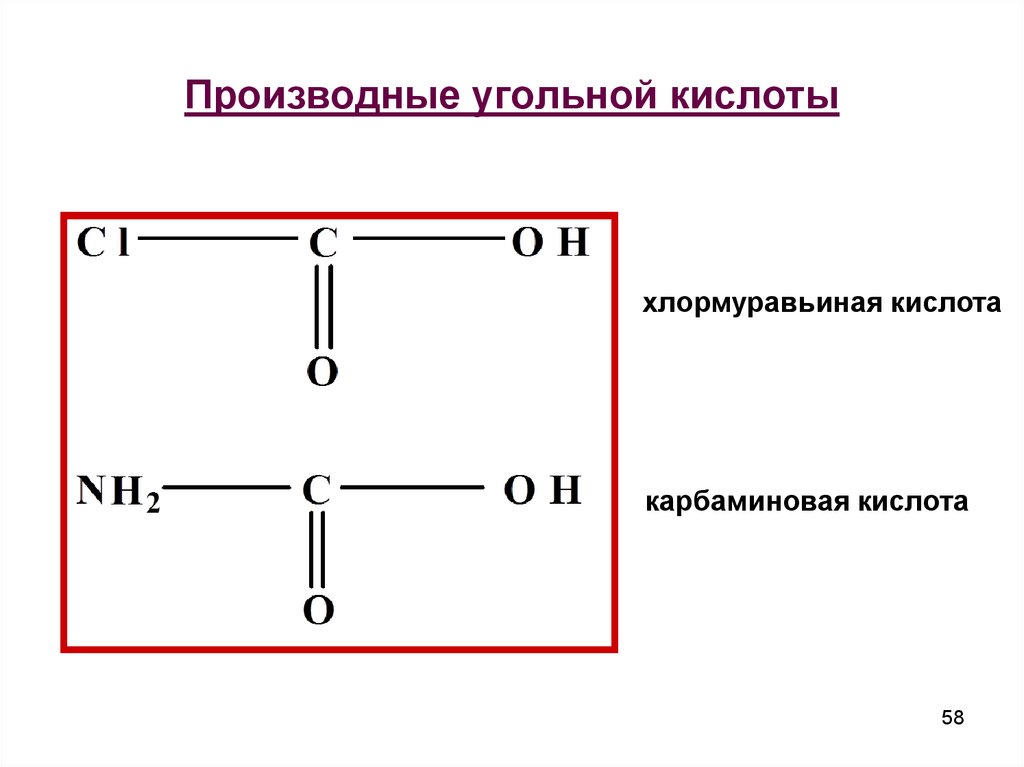
58. Производные угольной кислоты
хлормуравьиная кислотакарбаминовая кислота
58
59.
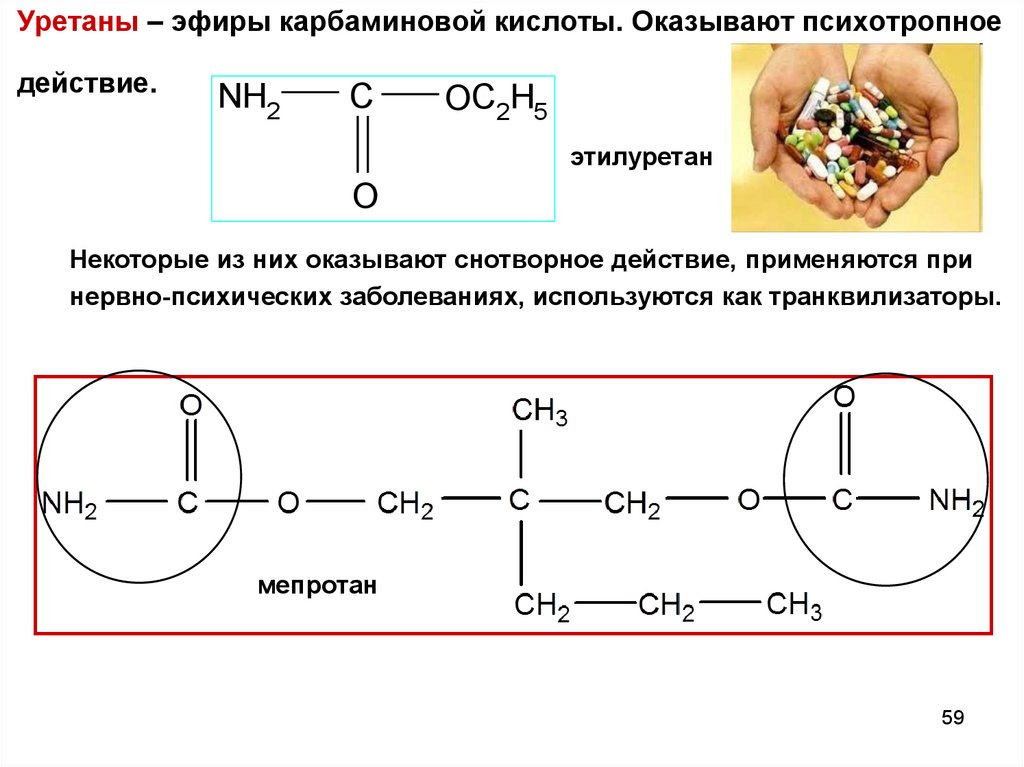
Уретаны – эфиры карбаминовой кислоты. Оказывают психотропноедействие.
NH2
C
OC2H5
этилуретан
O
Некоторые из них оказывают снотворное действие, применяются при
нервно-психических заболеваниях, используются как транквилизаторы.
мепротан
59
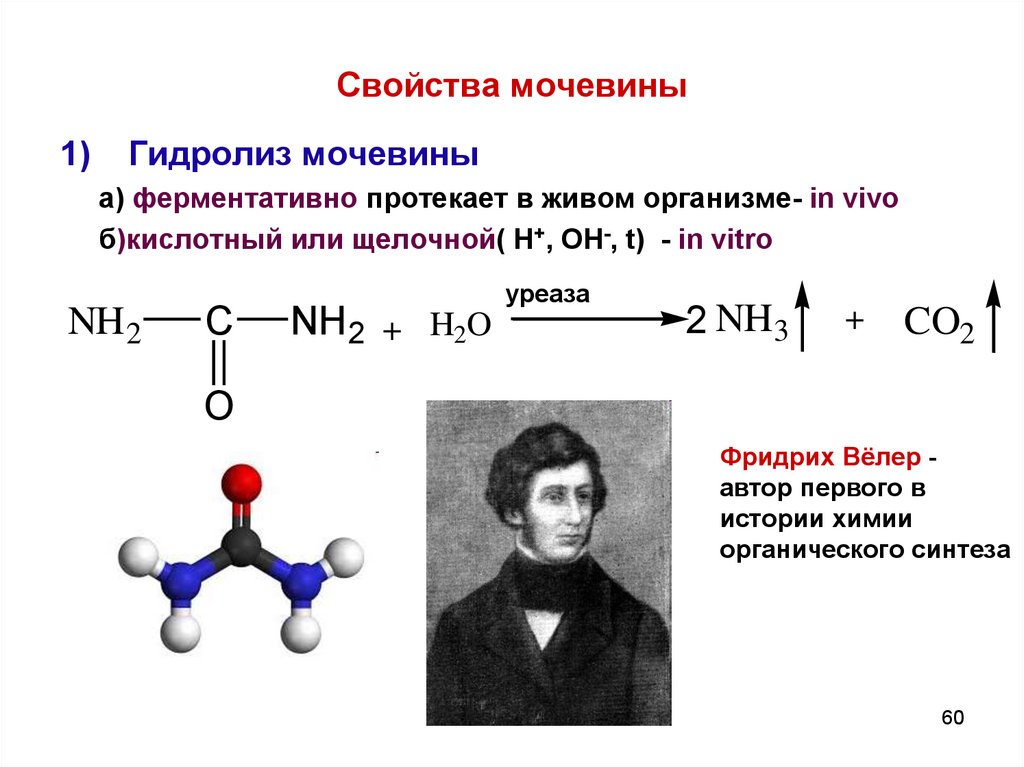
60. Свойства мочевины
1)Гидролиз мочевины
а) ферментативно протекает в живом организме- in vivo
б)кислотный или щелочной( Н+, ОН-, t) - in vitro
NH 2
C
NH2 + H2O
уреаза
2 NH3
+
CO2
O
Фридрих Вёлер автор первого в
истории химии
органического синтеза
60
61.
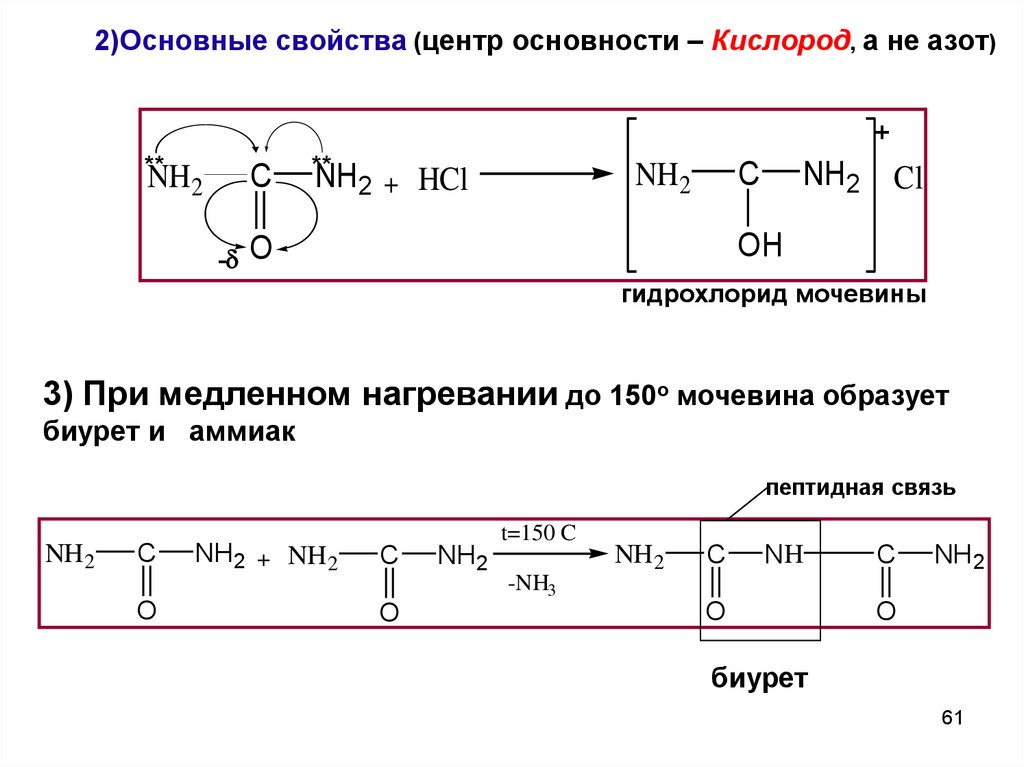
2)Основные свойства (центр основности – Кислород, а не азот)+
**
NH2
C
**
C
NH2
NH2 + HCl
NH2
Cl
OH
- O
гидрохлорид мочевины
3) При медленном нагревании до 150о мочевина образует
биурет и аммиак
пептидная связь
NH2
C
O
NH2 + NH2
C
NH2
t=150 C
NH2
C
NH
C
NH2
-NH3
O
O
O
биурет
61
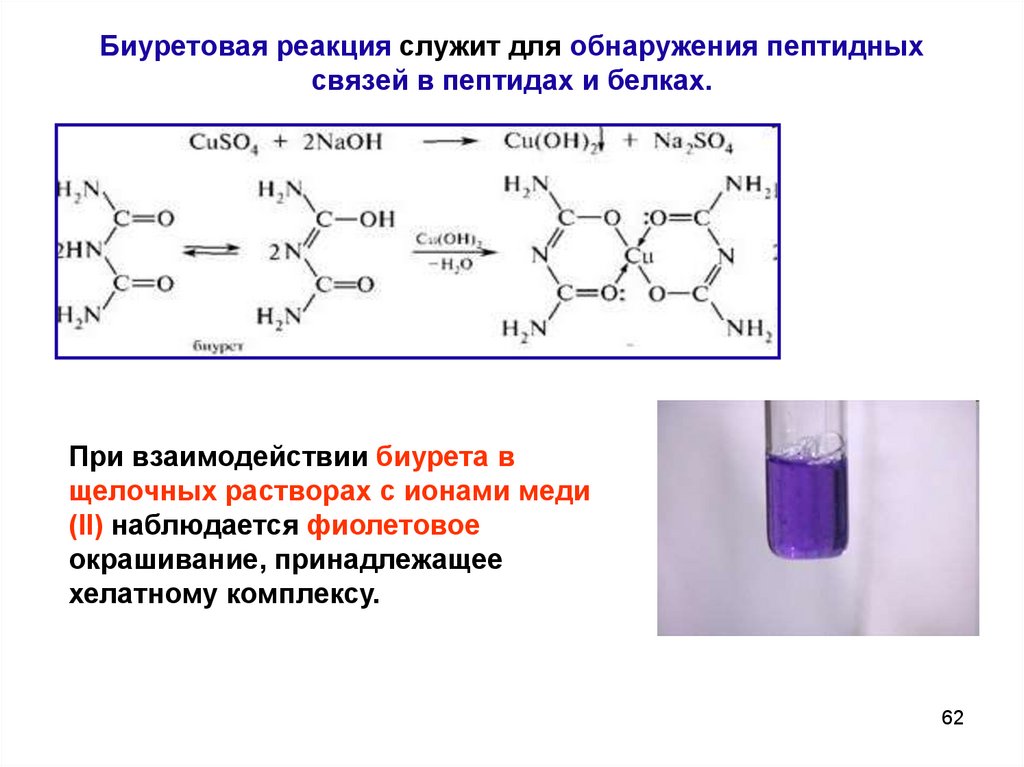
62. Биуретовая реакция служит для обнаружения пептидных связей в пептидах и белках.
При взаимодействии биурета вщелочных растворах с ионами меди
(II) наблюдается фиолетовое
окрашивание, принадлежащее
хелатному комплексу.
62
63. 5. Уреиды. Образование уреидов.
Важными производными карбоновых кислот,содержащими остаток мочевины в качестве
заместителя Х, являются уреиды.
Некоторые уреиды кислот, замещенных в αположении на галоген, применяются как снотворные
средства: уреид α-бромизовалериановой кислоты,
или бромурал (т. пл. 154).
уреид - бромизовалерьяновой кислоты
63
64.
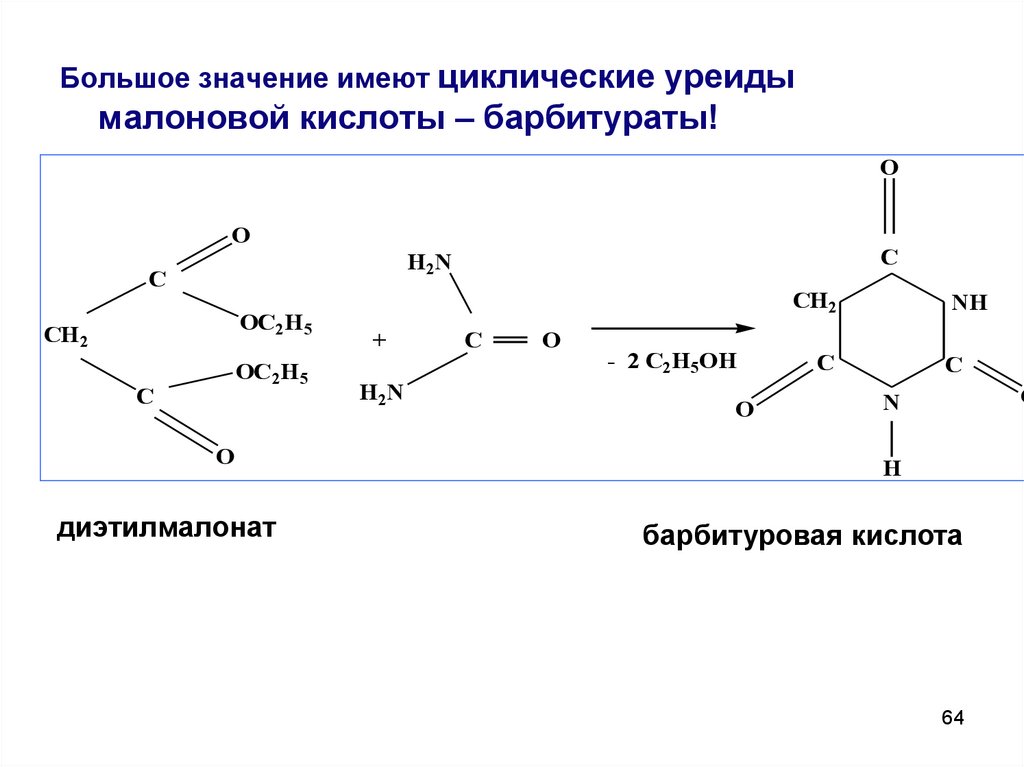
Большое значение имеют циклические уреидымалоновой кислоты – барбитураты!
O
O
C
H2N
C
OC2H5
CH 2
OC2H5
C
O
диэтилмалонат
+
H2N
C
O
- 2 C2H5OH
O
CH 2
NH
C
C
O
N
H
барбитуровая кислота
64
65.
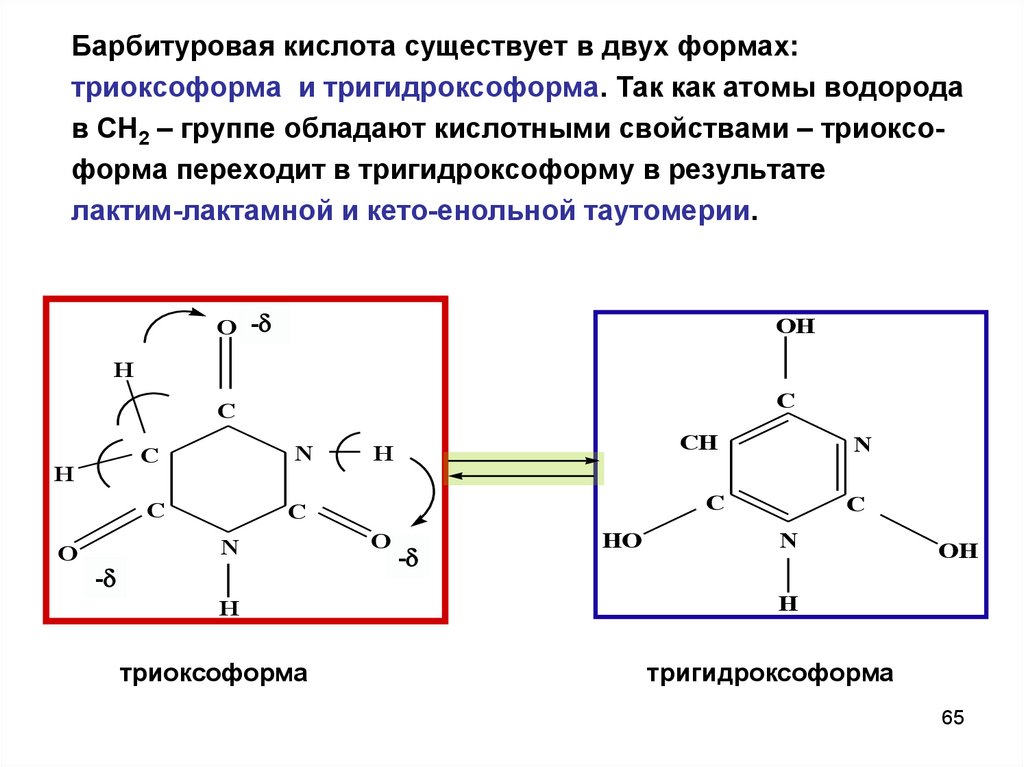
Барбитуровая кислота существует в двух формах:триоксоформа и тригидроксоформа. Так как атомы водорода
в СН2 – группе обладают кислотными свойствами – триоксоформа переходит в тригидроксоформу в результате
лактим-лактамной и кето-енольной таутомерии.
O -
OH
C
C
H
H
C
N
C
C
N
O
-
H
триоксоформа
H
O
-
HO
CH
N
C
C
N
OH
H
тригидроксоформа
65
66. Лекарственные препараты (барбитураты)
6667. Действие на организм
• Барбитуровая кислота неоказывает ни снотворного ни
наркотического действия; этой
способностью обладают её
производные.
• Барбитураты оказывают
тормозящие влияние на ЦНС и
используются в медицине в
качестве успокаивающих
средств, снотворных,
противосудорожных средств(
бензонал, бензобамил) и
средств для наркоза( гексенал,
тиопенталнатрий)
67
68.
• Сон вызываемый барбитуратами отличается от естественногосна. Они облегчают засыпание, но укорачивают фазу
интенсивного сна.
• В механизме действия барбитуратов играет роль их
влияние на метаболические процессы мозга и на
синоптическую передачу нервных импульсов, оказывают
стимулирующие влияние на систему тормозного
медиатора – ГАМК (гамма-аминомаслянной кислоты).
68
69.
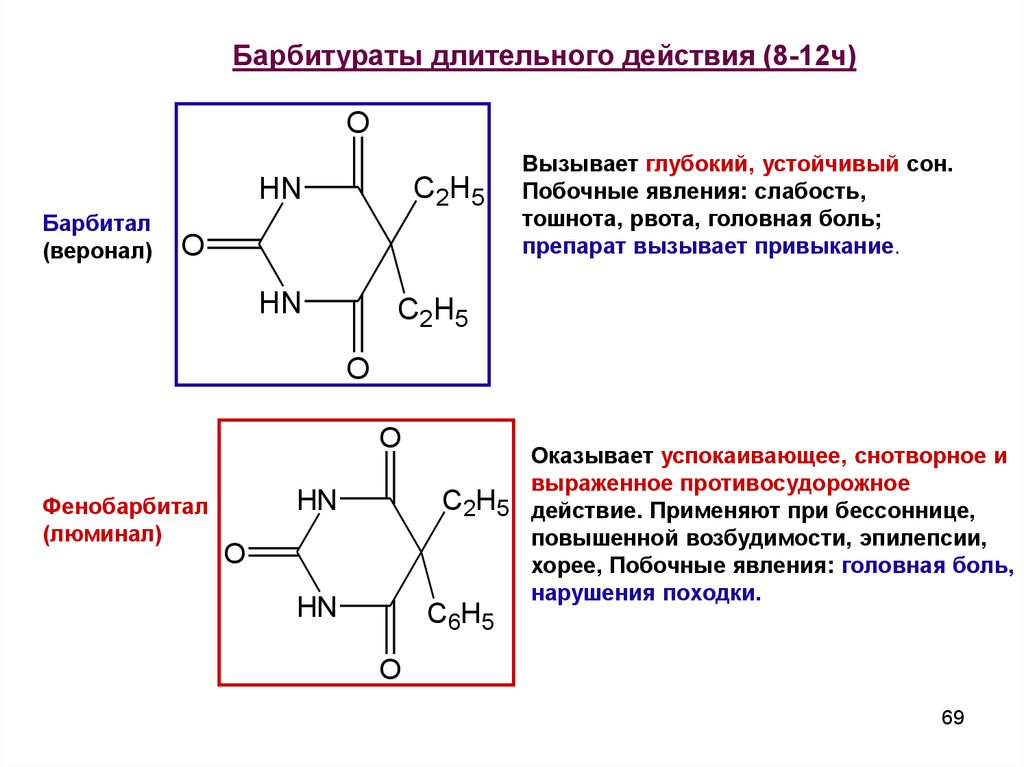
Барбитураты длительного действия (8-12ч)O
Барбитал
(веронал)
HN
C2H5
HN
C2H5
O
Вызывает глубокий, устойчивый сон.
Побочные явления: слабость,
тошнота, рвота, головная боль;
препарат вызывает привыкание.
O
O
Фенобарбитал
(люминал)
HN
O
HN
Оказывает успокаивающее, снотворное и
выраженное противосудорожное
C2H5 действие. Применяют при бессоннице,
повышенной возбудимости, эпилепсии,
хорее, Побочные явления: головная боль,
нарушения походки.
C6H5
O
69
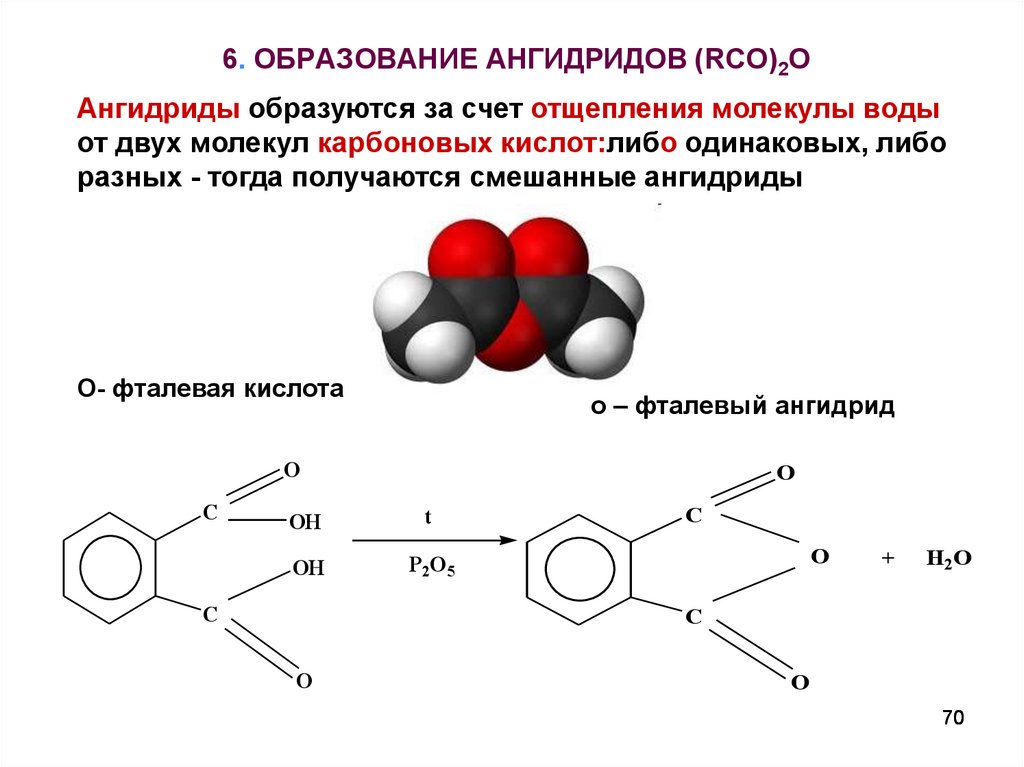
70. 6. ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2O
Ангидриды образуются за счет отщепления молекулы водыот двух молекул карбоновых кислот:либо одинаковых, либо
разных - тогда получаются смешанные ангидриды
О- фталевая кислота
о – фталевый ангидрид
O
C
O
OH
t
OH
P2O5
C
C
O
+
H2O
C
O
O
70
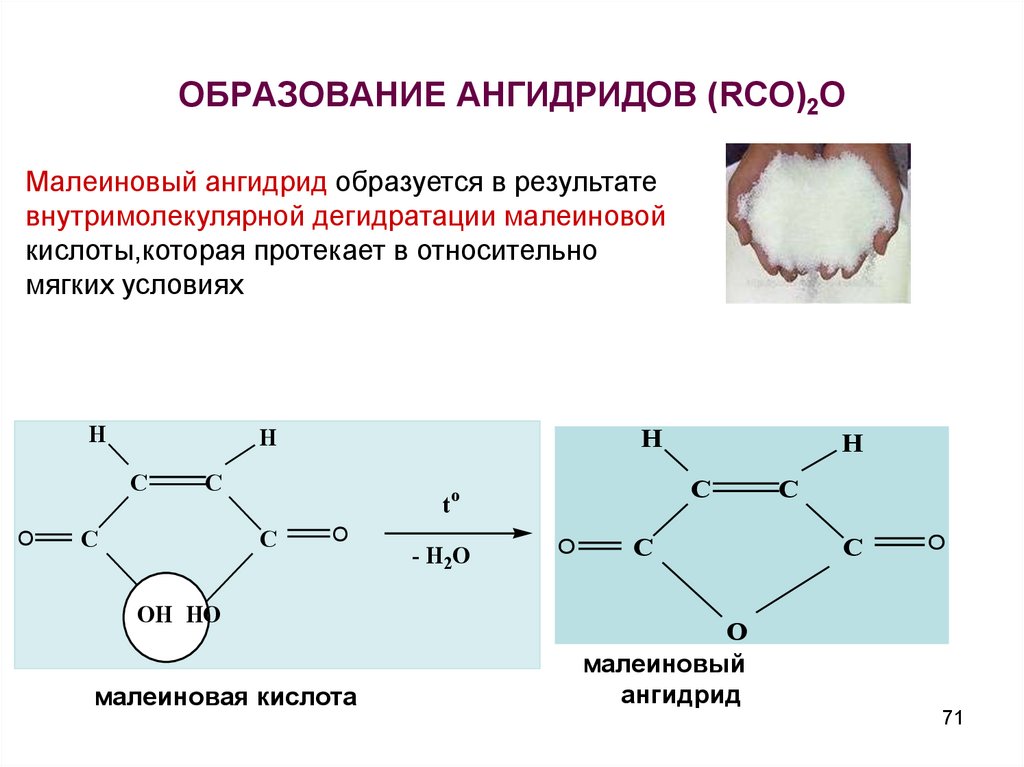
71. ОБРАЗОВАНИЕ АНГИДРИДОВ (RCO)2O
Малеиновый ангидрид образуется в результатевнутримолекулярной дегидратации малеиновой
кислоты,которая протекает в относительно
мягких условиях
H
H
C
O
H
C
C
C
to
C
O
OH HO
малеиновая кислота
- H2O
H
O
C
C
C
O
O
малеиновый
ангидрид
71
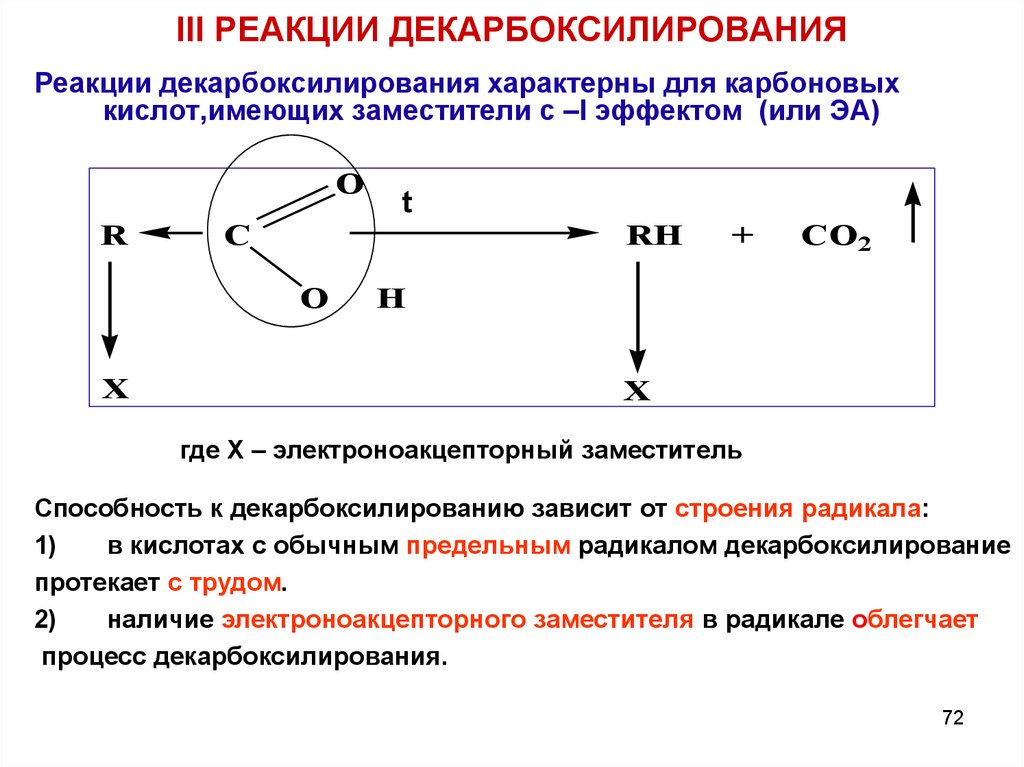
72. III РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ
Реакции декарбоксилирования характерны для карбоновыхкислот,имеющих заместители с –I эффектом (или ЭА)
O
R
C
RH
O
X
t
+
CO2
H
X
где Х – электроноакцепторный заместитель
Способность к декарбоксилированию зависит от строения радикала:
1)
в кислотах с обычным предельным радикалом декарбоксилирование
протекает с трудом.
2)
наличие электроноакцепторного заместителя в радикале облегчает
процесс декарбоксилирования.
72
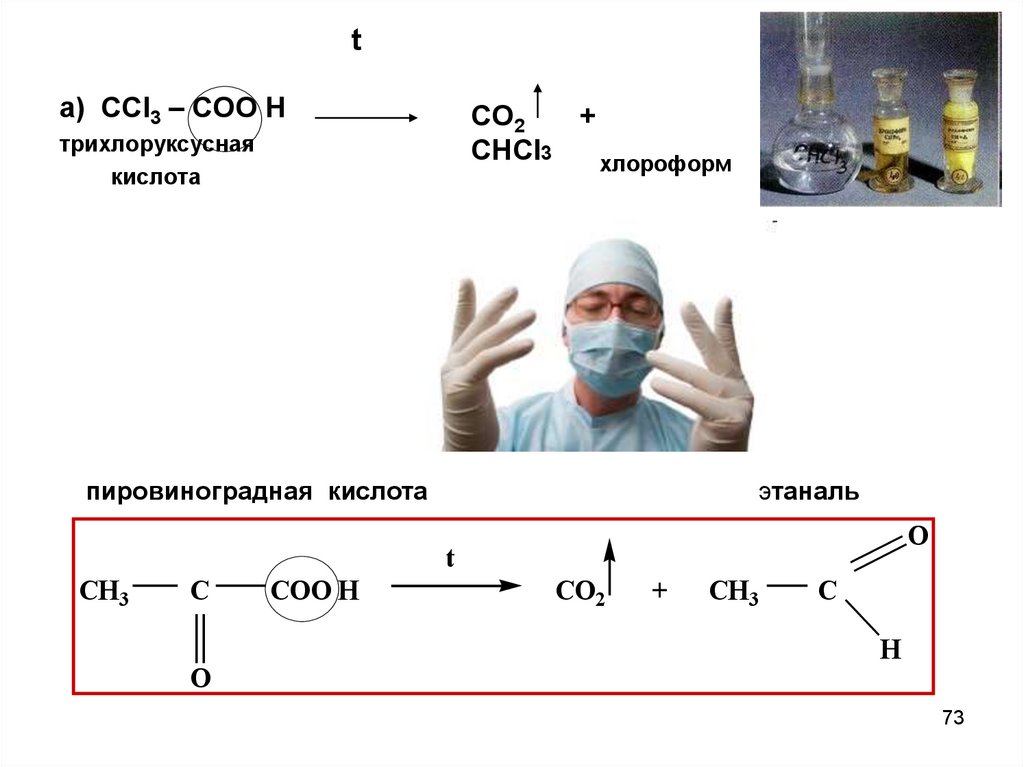
73.
tа) ССl3 – COO H
CO2
+
CHCl3
хлороформ
трихлоруксусная
кислота
пировиноградная кислота
этаналь
O
t
CH3
C
O
COO H
CO2
+
CH3
C
H
73
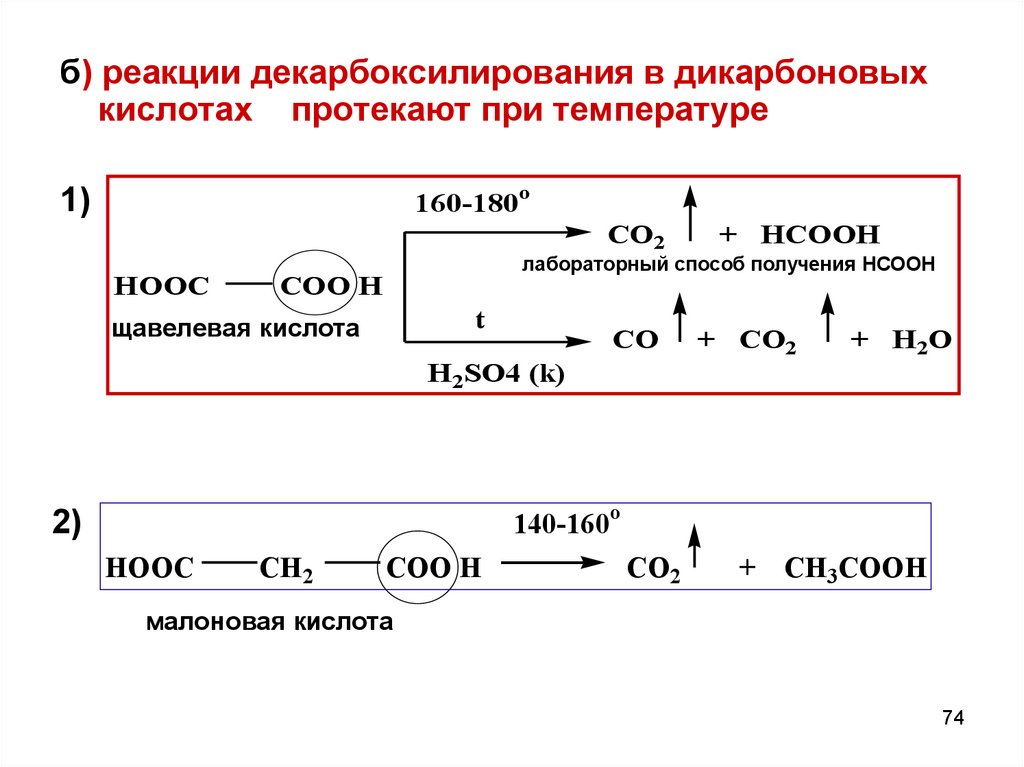
74.
б) реакции декарбоксилирования в дикарбоновыхкислотах протекают при температуре
160-180o
1)
CO2
HOOC
+ HCOOH
лабораторный способ получения НСООН
COO H
t
щавелевая кислота
CO
H2SO4 (k)
+ CO2
+ H2O
140-160o
2)
HOOC
CH2
COO H
CO2
+ CH3COOH
малоновая кислота
74
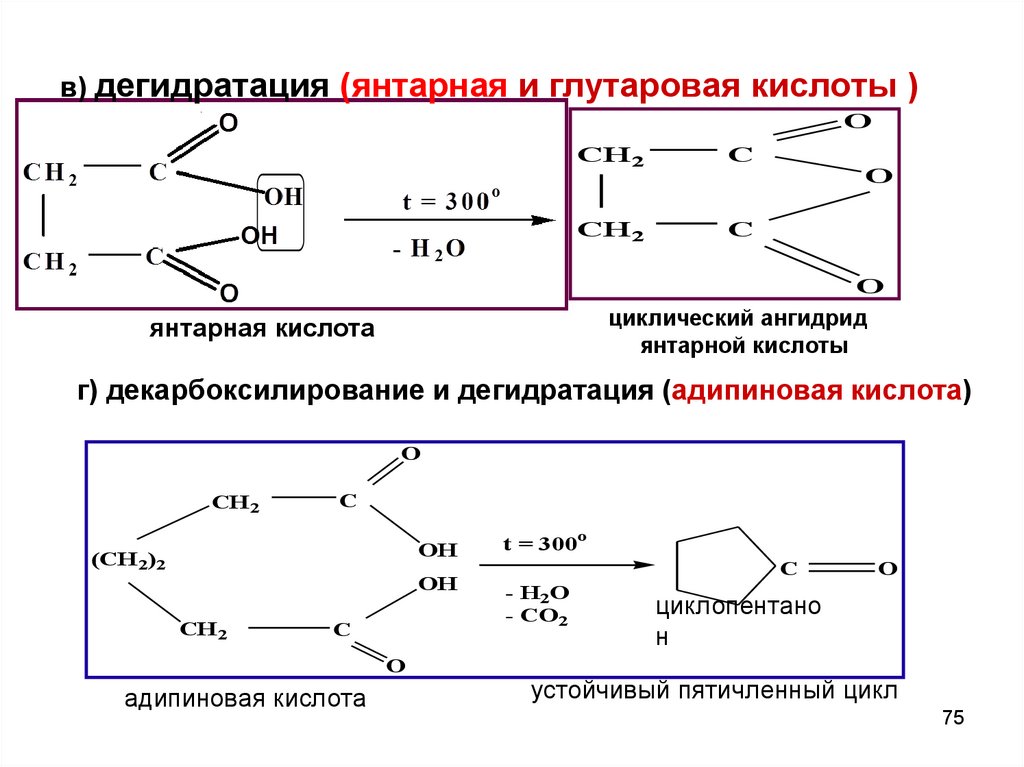
75.
в) дегидратация (янтарная и глутаровая кислоты )O
CH2
C
CH2
C
O
O
циклический ангидрид
янтарной кислоты
янтарная кислота
г) декарбоксилирование и дегидратация (адипиновая кислота)
O
CH 2
C
OH
(CH 2)2
OH
CH 2
C
O
адипиновая кислота
t = 300o
C
- H2O
- CO2
O
циклопентано
н
устойчивый пятичленный цикл
75
76. IV. Реакции в радикале
Для предельных карбоновых кислот характерны реакциирадикального замещения SR (в α-положении).
1.
Условия – Cl2, h или Br2, Pкрасный
h
CH3
CH2
COOH
+ Cl2
CH3
CH
COOH + HCl
пропионовая кислота
Cl
- хлорпропионовая кислота
Pкрасный
СH3
CH2
CH2
COOH
бутановая кислота
+
Br2
CH3
CH2
CH
COOH
+ HBr
Br
- бромбутановая кислота
76
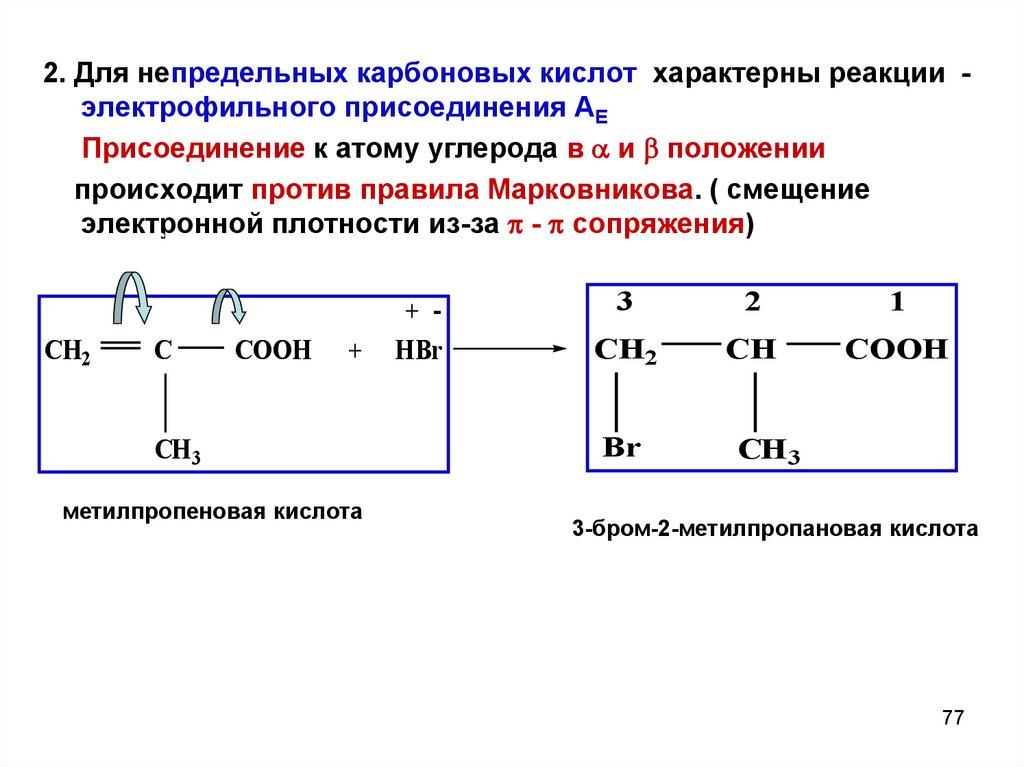
77.
2. Для непредельных карбоновых кислот характерны реакции электрофильного присоединения АЕПрисоединение к атому углерода в и положении
происходит против правила Марковникова. ( смещение
электронной плотности из-за - сопряжения)
+
CH2
-
C
COOH
+
CH 3
метилпропеновая кислота
+ HBr
3
2
1
CH2
CH
COOH
Br
CH 3
3-бром-2-метилпропановая кислота
77
78.
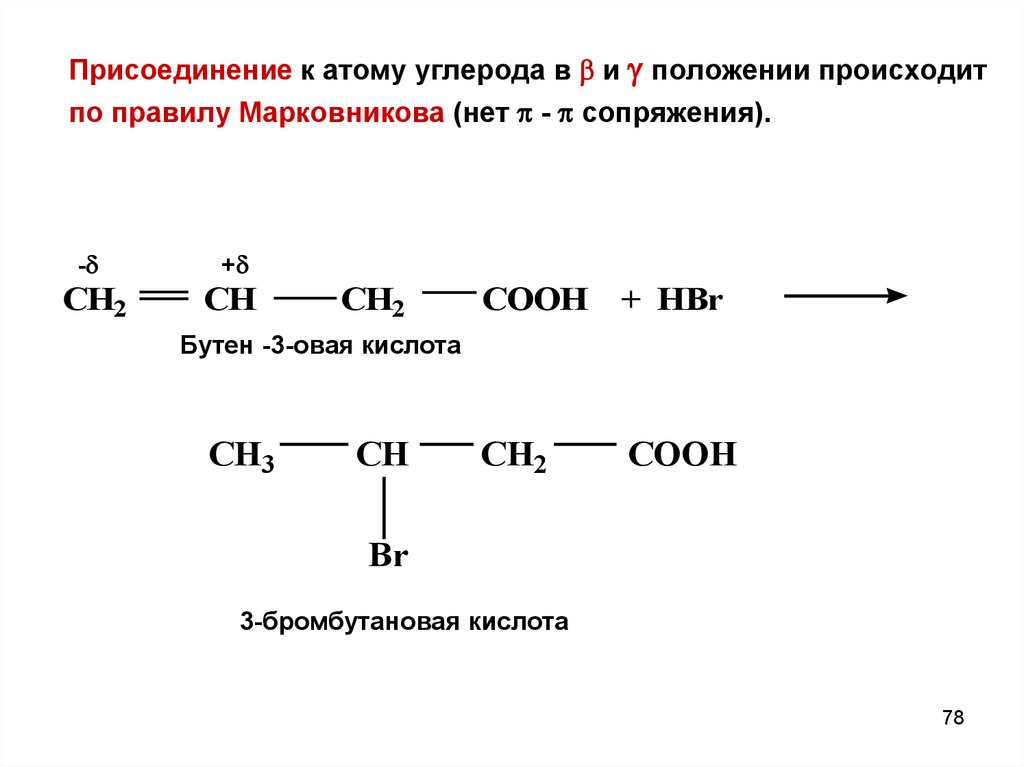
Присоединение к атому углерода в и положении происходитпо правилу Марковникова (нет - сопряжения).
-
+
CH2
CH
CH2
COOH + HBr
Бутен -3-овая кислота
CH3
CH
CH2
COOH
Br
3-бромбутановая кислота
78
79.
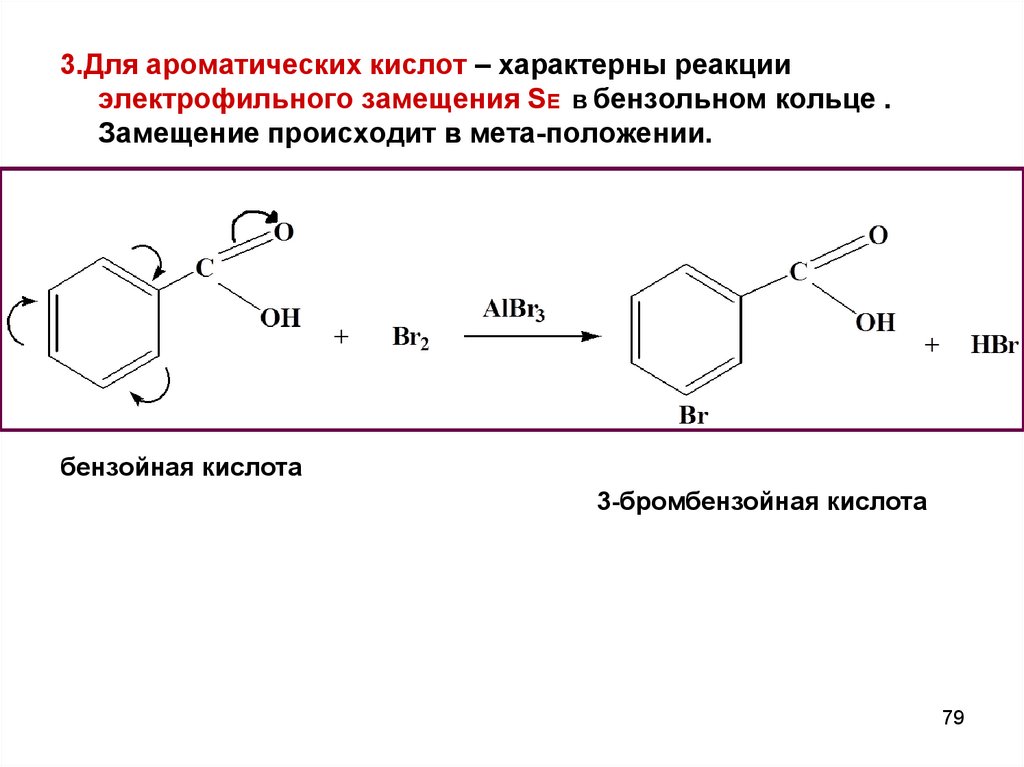
3.Для ароматических кислот – характерны реакцииэлектрофильного замещения SE в бензольном кольце .
Замещение происходит в мета-положении.
бензойная кислота
3-бромбензойная кислота
79
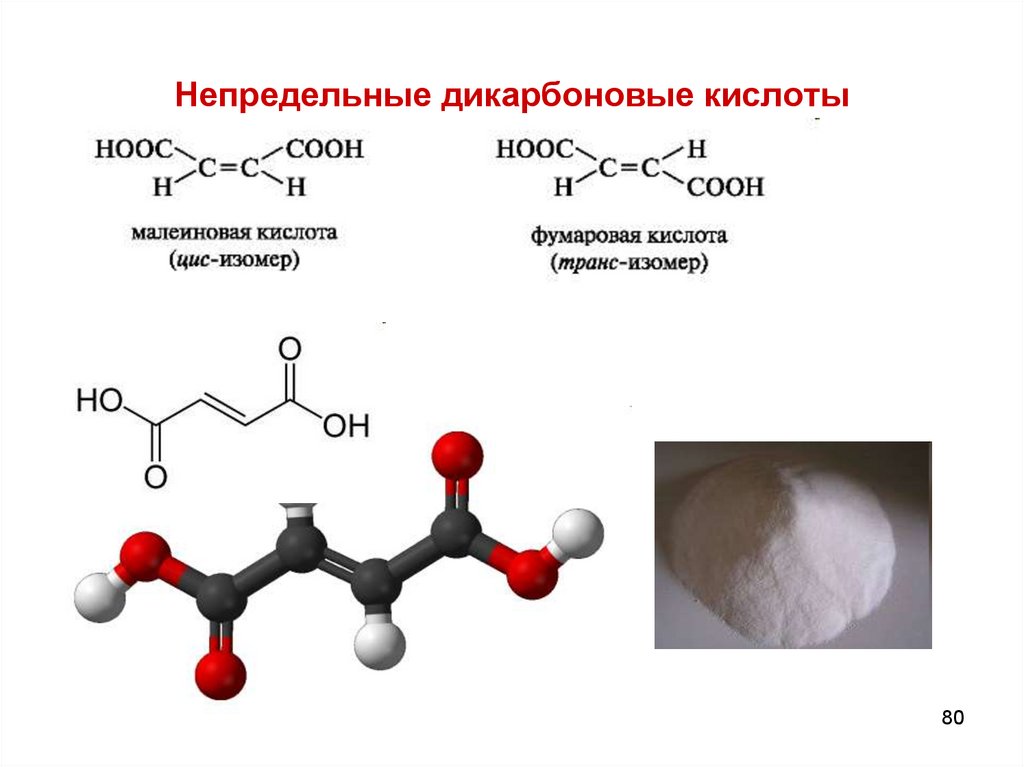
80. Непредельные дикарбоновые кислоты
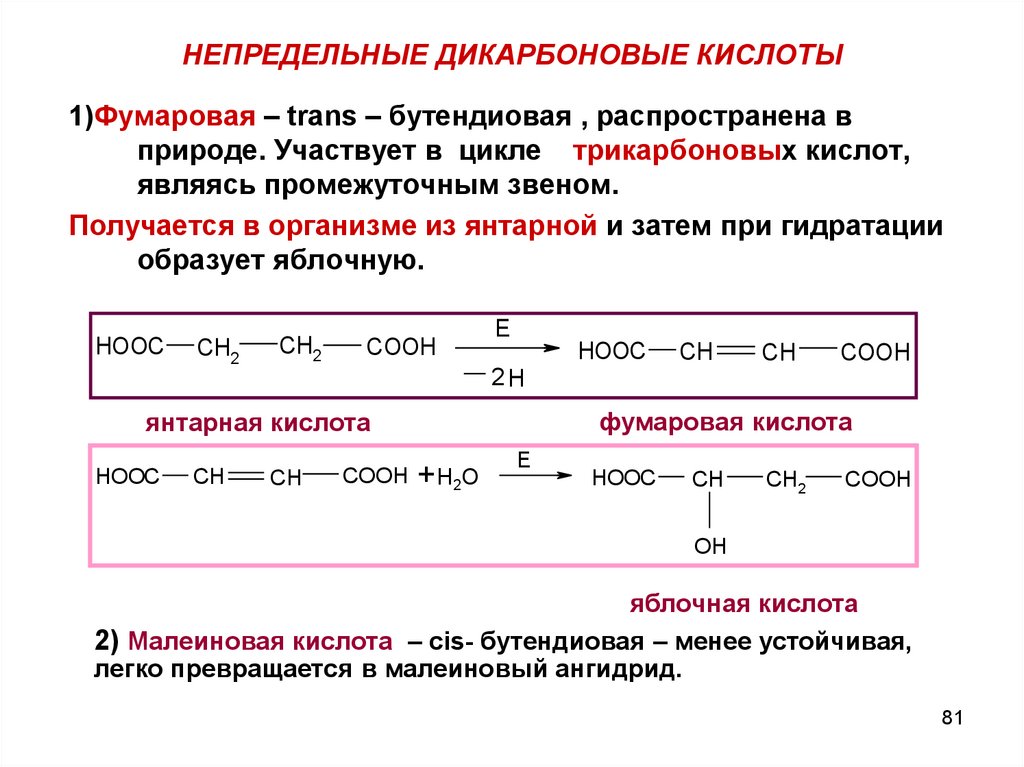
8081. НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
1)Фумаровая – trans – бутендиовая , распространена вприроде. Участвует в цикле трикарбоновых кислот,
являясь промежуточным звеном.
Получается в организме из янтарной и затем при гидратации
образует яблочную.
HOOC
CH2
CH2
COOH
E
HOOC
CH
CH
COOH
2H
фумаровая кислота
янтарная кислота
HOOC
CH
CH
COOH +Н2О
E
HOOC
CH
CH2
COOH
OH
яблочная кислота
2) Малеиновая кислота – cis- бутендиовая – менее устойчивая,
легко превращается в малеиновый ангидрид.
81
82.
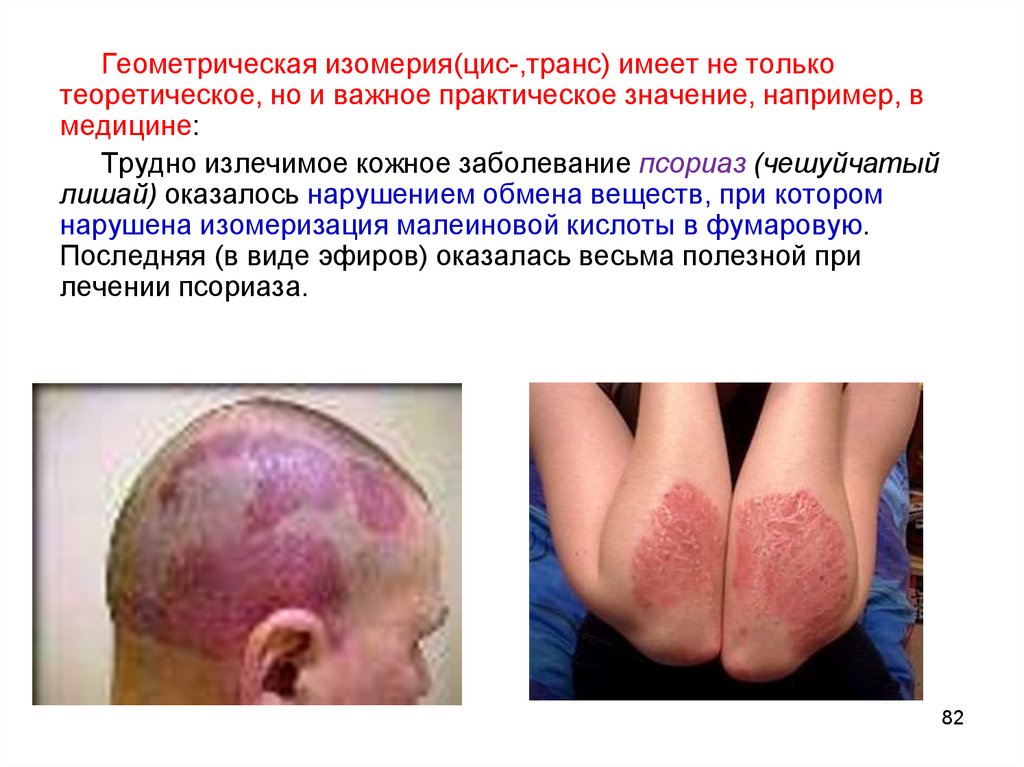
Геометрическая изомерия(цис-,транс) имеет не толькотеоретическое, но и важное практическое значение, например, в
медицине:
Трудно излечимое кожное заболевание псориаз (чешуйчатый
лишай) оказалось нарушением обмена веществ, при котором
нарушена изомеризация малеиновой кислоты в фумаровую.
Последняя (в виде эфиров) оказалась весьма полезной при
лечении псориаза.
82
83.
Хроматографические методы исследованияДля анализа и идентификации карбоновых кислот и их
функциональных производных используются методы:
Электронной спектроскопии.
ИК-спектроскопии
Спектроскопия ЯМР
Хроматография
Хроматографические методы исследования
Хроматограф газовый входит в состав
лабораторного
комплекса и осуществляет
хроматографический
анализ сложных
веществ.
83
84.
Высокоэффективная жидкостная хроматография являетсянезаменимым методом при проведении исследований в различных
областях органической, физической и аналитической химии,
биохимии и фармакологии.
Жидкостную хроматографию можно использовать для разделения
веществ, которые растворимы в каком-либо растворителе, таких как
нуклеотиды, нуклеозиды, антибиотики, витамины, пищевые добавки,
косметические средства, лекарственные препараты, гигиенические
средства, продукты органического синтеза, пестициды, биологические
жидкости и т.д.
84
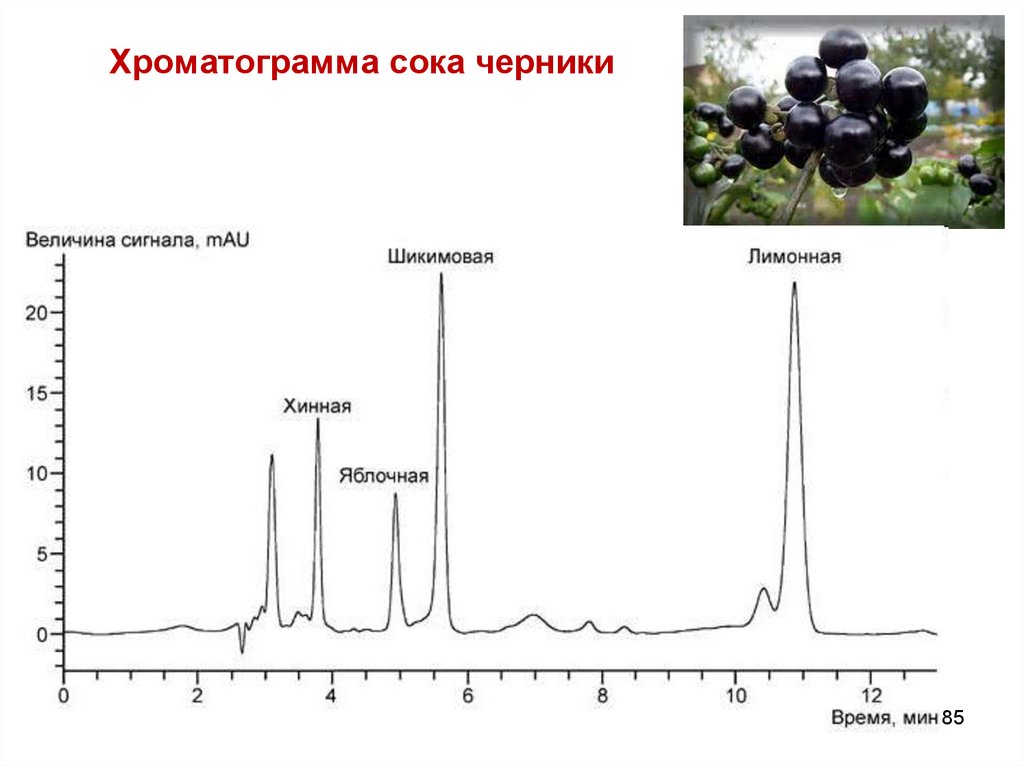
85. Хроматограмма сока черники
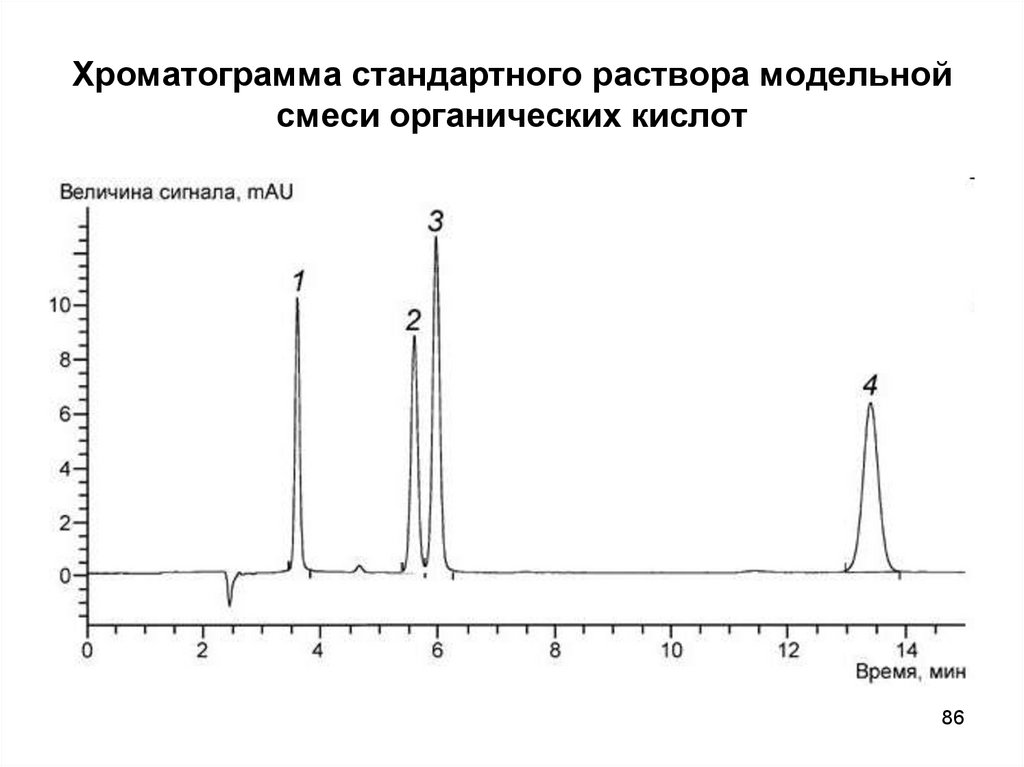
8586. Хроматограмма стандартного раствора модельной смеси органических кислот
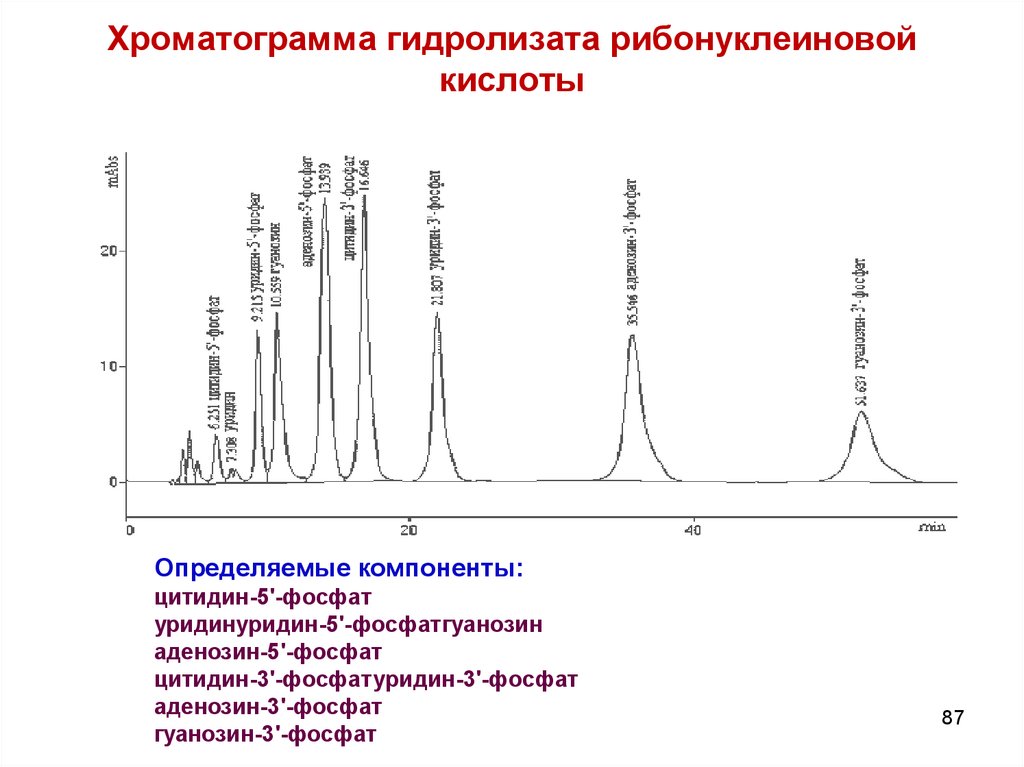
8687. Хроматограмма гидролизата рибонуклеиновой кислоты
Определяемые компоненты:цитидин-5'-фосфат
уридинуридин-5'-фосфатгуанозин
аденозин-5'-фосфат
цитидин-3'-фосфатуридин-3'-фосфат
аденозин-3'-фосфат
гуанозин-3'-фосфат
87
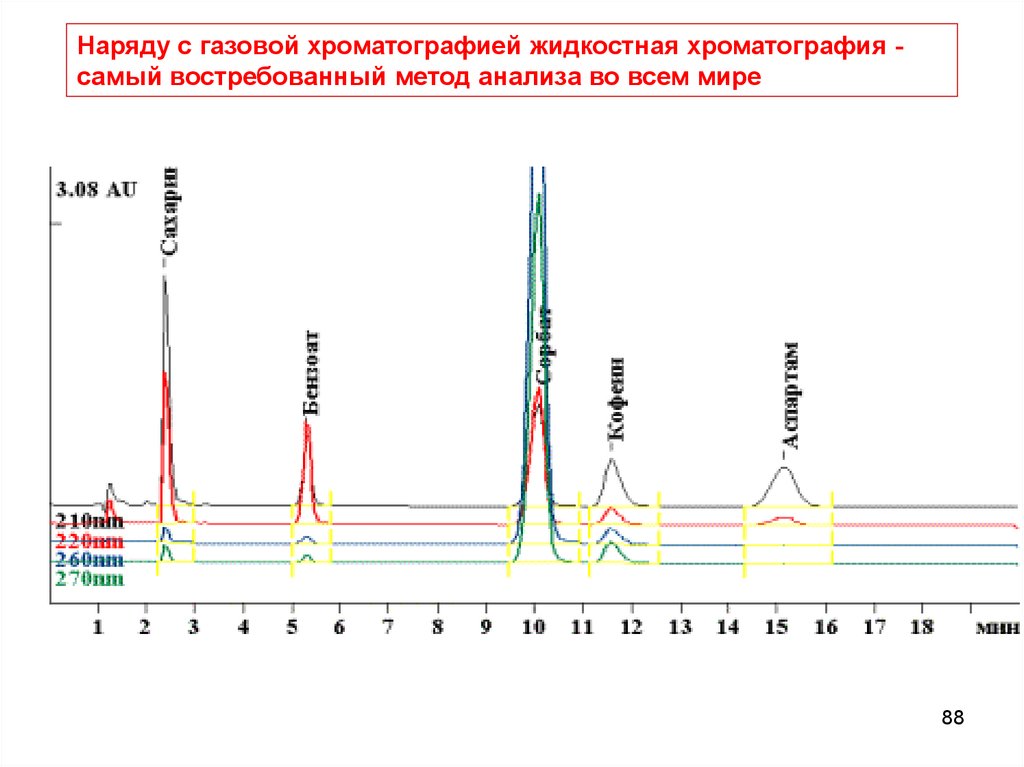
88.
Наряду с газовой хроматографией жидкостная хроматография самый востребованный метод анализа во всем мире88
89. Жиры. Фосфолипиды
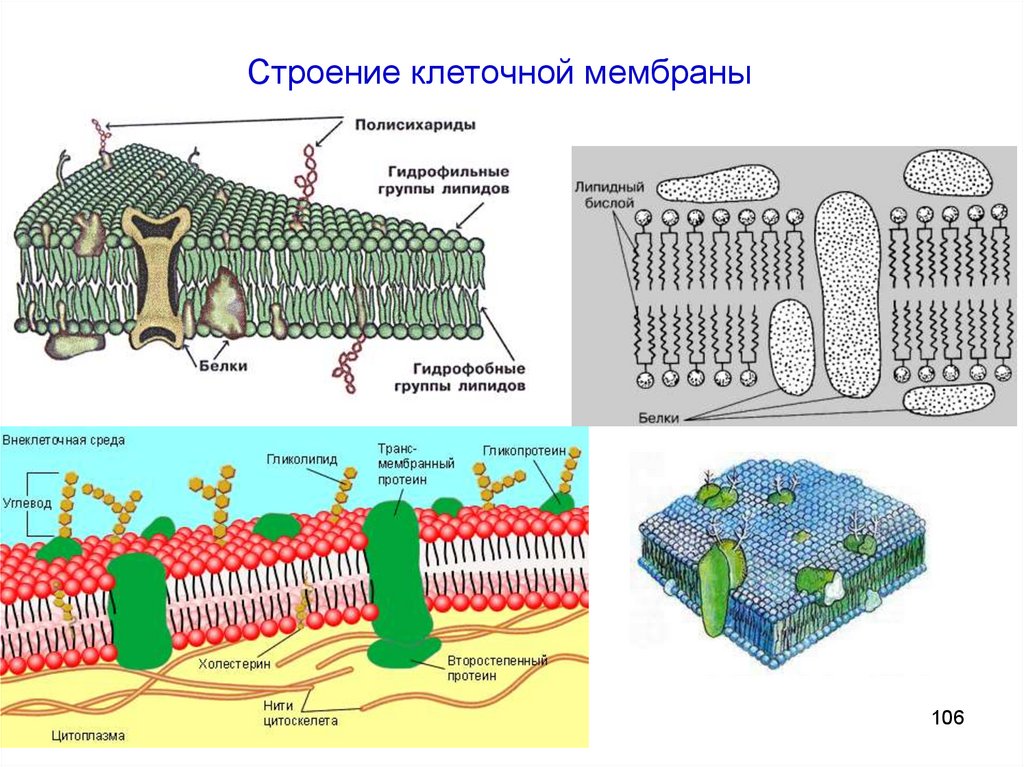
Липиды – большая и довольно разнообразная группа веществ,выполняющая чрезвычайно важные функции в организме:
- Липиды – структурные компоненты клеточных мембран
- Выполняют защитную функцию
- В форме липидов транспортируется и запасается
энергетическое топливо
89
90.
В молекулах липидов присутствуют одновременно полярные(гидрофильные) и неполярные (гидрофобные) группировки.
Дифильная структура позволяет им
осуществлять свои функции на границе раздела фаз.
Классифицируют липиды по способности гидролизоваться –
омыляемые(подвергающиеся гидролизу) и неомыляемые
(не гидролизующиеся).
В свою очередь омыляемые липиды делятся на простые и сложные.
ОМЫЛЯЕМЫЕ ЛИПИДЫ
простые
сложные
(фосфолипиды)
(жиры, масла)
продукты гидролиза:
глицерин, высшие карбоновые
кислоты
глицерин, высшие карбоновые
кислоты, аминоспирты,
фосфорная кислота
90
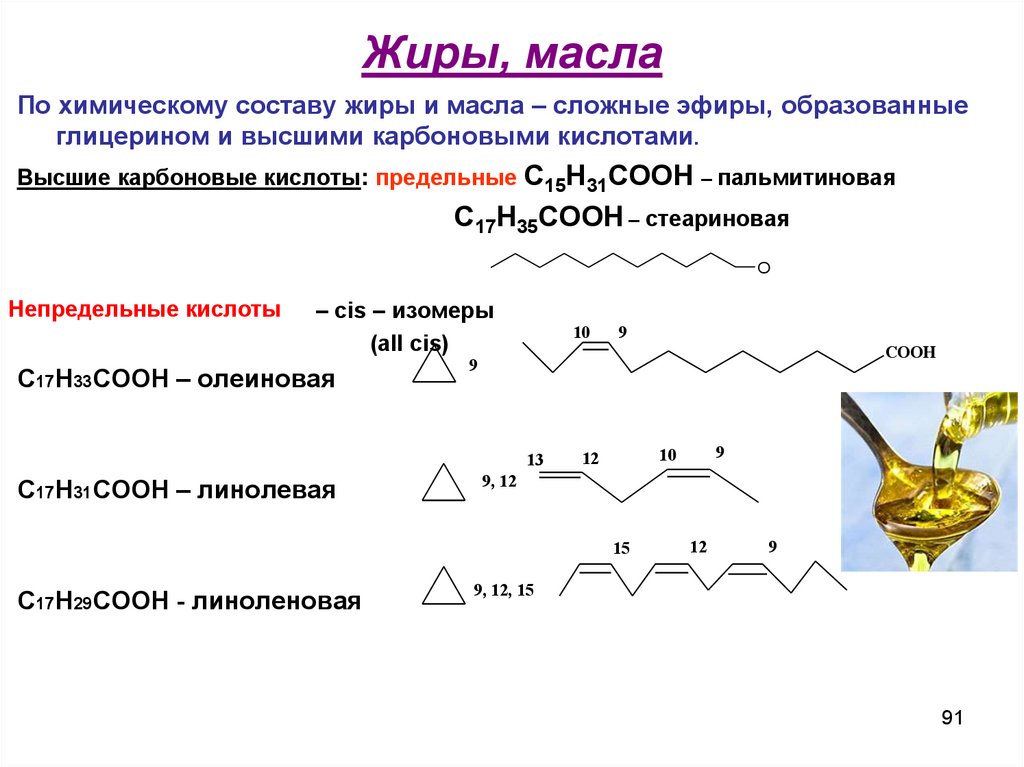
91. Жиры, масла
По химическому составу жиры и масла – сложные эфиры, образованныеглицерином и высшими карбоновыми кислотами.
Высшие карбоновые кислоты: предельные С15Н31СООН – пальмитиновая
С17Н35СООН – стеариновая
O
Непредельные кислоты
– cis – изомеры
(all cis)
С17Н33СООН – олеиновая
10
COOH
9
13
С17Н31СООН – линолевая
9
9, 12
15
С17Н29СООН - линоленовая
9
10
12
12
9
9, 12, 15
91
92. Значение жирных кислот липидов
Особо следует подчеркнуть роль полиненасыщенных линолевой илиноленовой кислот как соединений, незаменимых для человека
(в организме они не могут быть синтезированы и должны
поступать с пищей в количестве около 5 г в сутки).
Эти кислоты содержатся в основном в растительных маслах. Они
способствуют снижению содержания в крови холестерина –
одного из факторов развития атеросклероза, для профилактики и
лечения которого применяется линетол – смесь этиловых эфиров
высших жирных непредельных кислот льняного масла.
92
93.
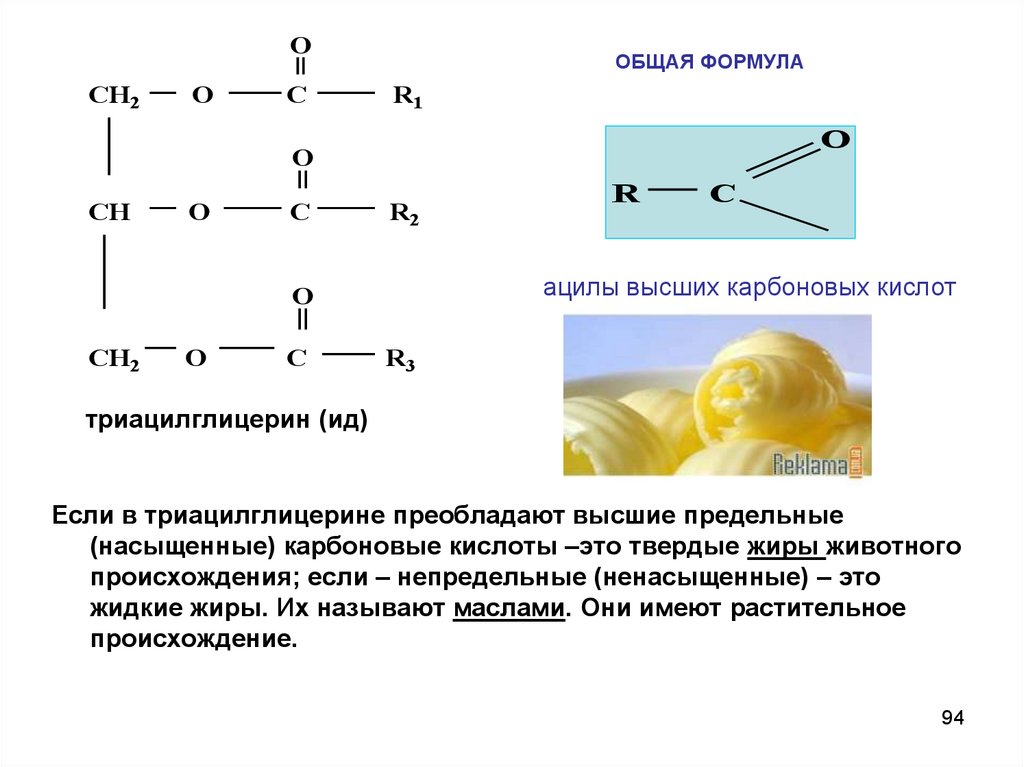
9394.
OCH2
O
C
ОБЩАЯ ФОРМУЛА
R1
O
O
CH
O
C
R2
O
C
C
ацилы высших карбоновых кислот
O
CH2
R
R3
триацилглицерин (ид)
Если в триацилглицерине преобладают высшие предельные
(насыщенные) карбоновые кислоты –это твердые жиры животного
происхождения; если – непредельные (ненасыщенные) – это
жидкие жиры. Их называют маслами. Они имеют растительное
происхождение.
94
95. ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ
Из химических свойств особенно интересны гидрирование(присоединение) по двойной связи жидких жиров и гидролиз
жиров.
1)
Гидрирование или гидрогенизация для получения твердых
жиров из масел
2)
Гидролиз имеет большое значение в технологических и
биохимических процессах
При гидролизе фосфолипидов получается больше веществ, чем при
гидролизе жиров: кроме высших карбоновых кислот и глицерина,
образуются Н3РО4 и аминоспирты, то есть 4 типа разных веществ.
95
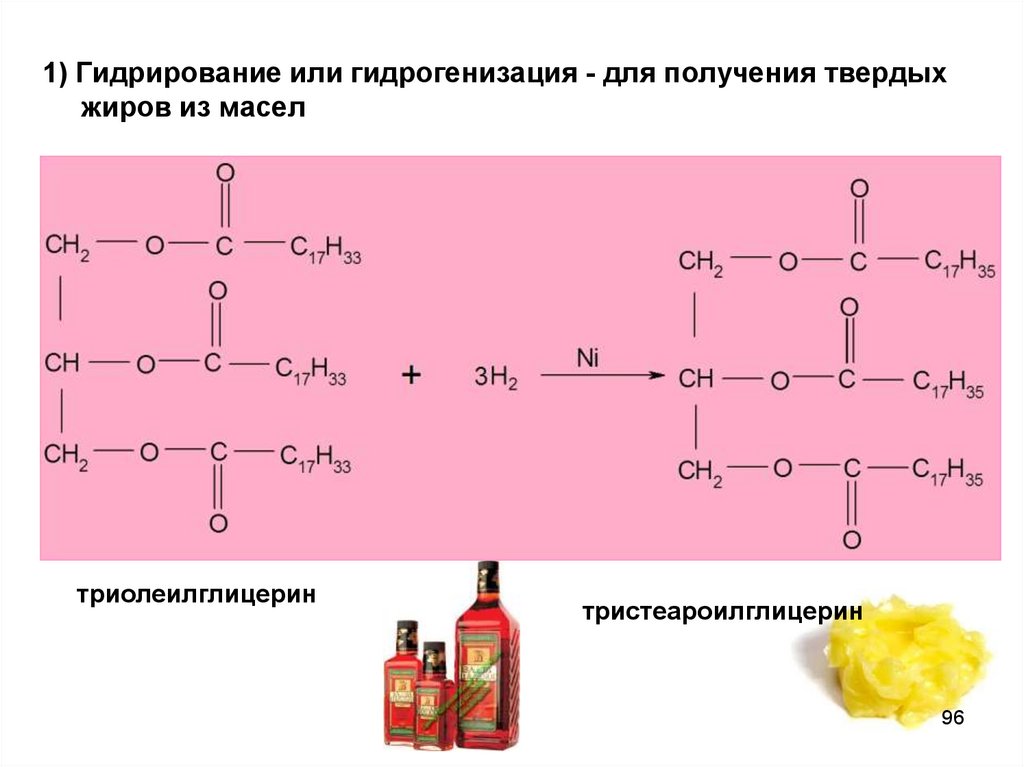
96.
1) Гидрирование или гидрогенизация - для получения твердыхжиров из масел
триолеилглицерин
тристеароилглицерин
96
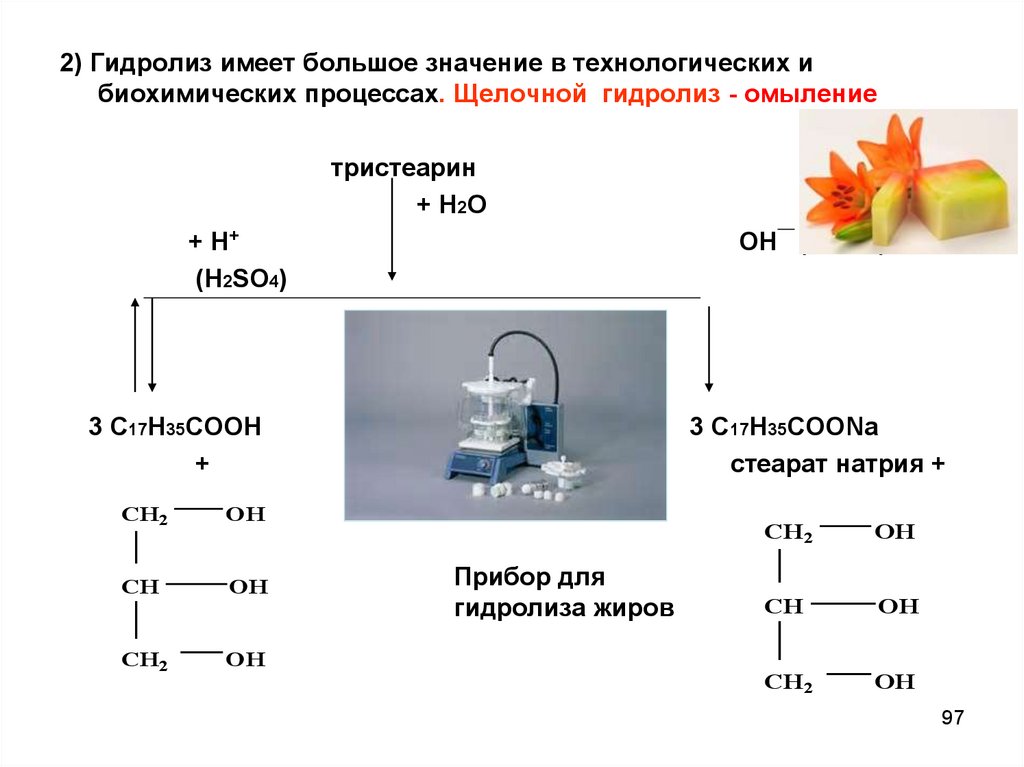
97.
2) Гидролиз имеет большое значение в технологических ибиохимических процессах. Щелочной гидролиз - омыление
тристеарин
+ Н2О
+ Н+
(H2SO4)
ОН (NaOH)
3 С17Н35СООН
+
CH2
OH
CH
OH
CH2
OH
3 С17Н35СООNa
стеарат натрия +
Прибор для
гидролиза жиров
CH2
OH
CH
OH
CH2
OH
97
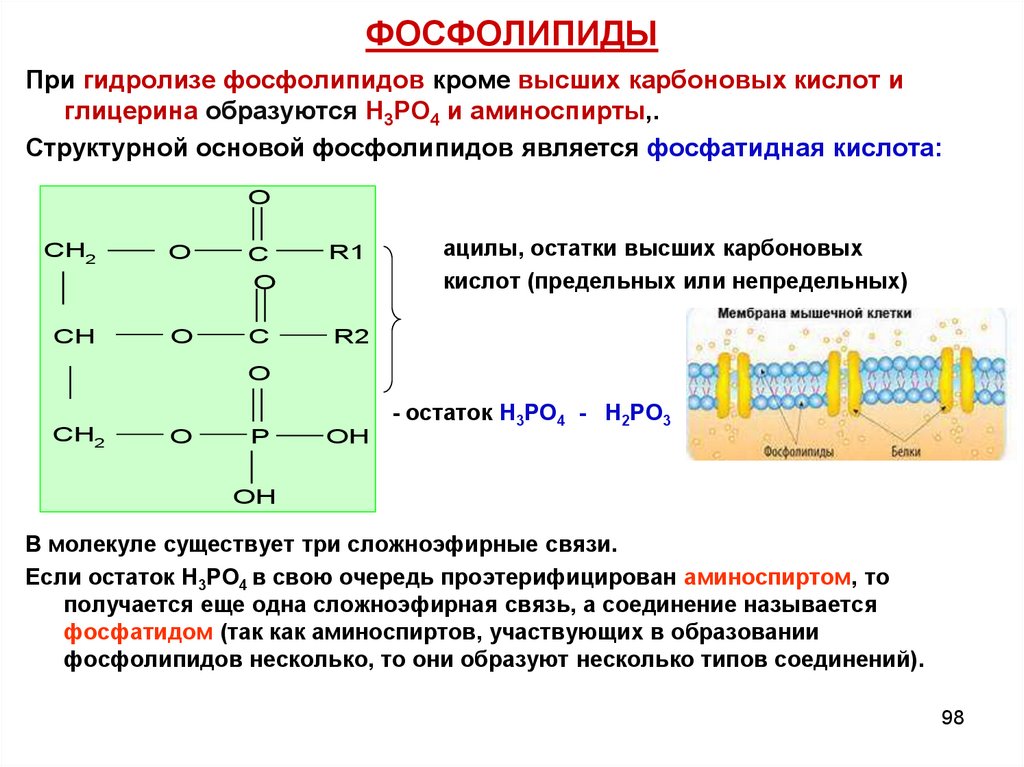
98. ФОСФОЛИПИДЫ
При гидролизе фосфолипидов кроме высших карбоновых кислот иглицерина образуются Н3РО4 и аминоспирты,.
Структурной основой фосфолипидов является фосфатидная кислота:
O
CH2
O
C
O
R1
CH
O
C
R2
ацилы, остатки высших карбоновых
кислот (предельных или непредельных)
O
CH2
- остаток Н3РО4 - Н2РО3 O
P
OH
OH
В молекуле существует три сложноэфирные связи.
Если остаток Н3РО4 в свою очередь проэтерифицирован аминоспиртом, то
получается еще одна сложноэфирная связь, а соединение называется
фосфатидом (так как аминоспиртов, участвующих в образовании
фосфолипидов несколько, то они образуют несколько типов соединений).
98
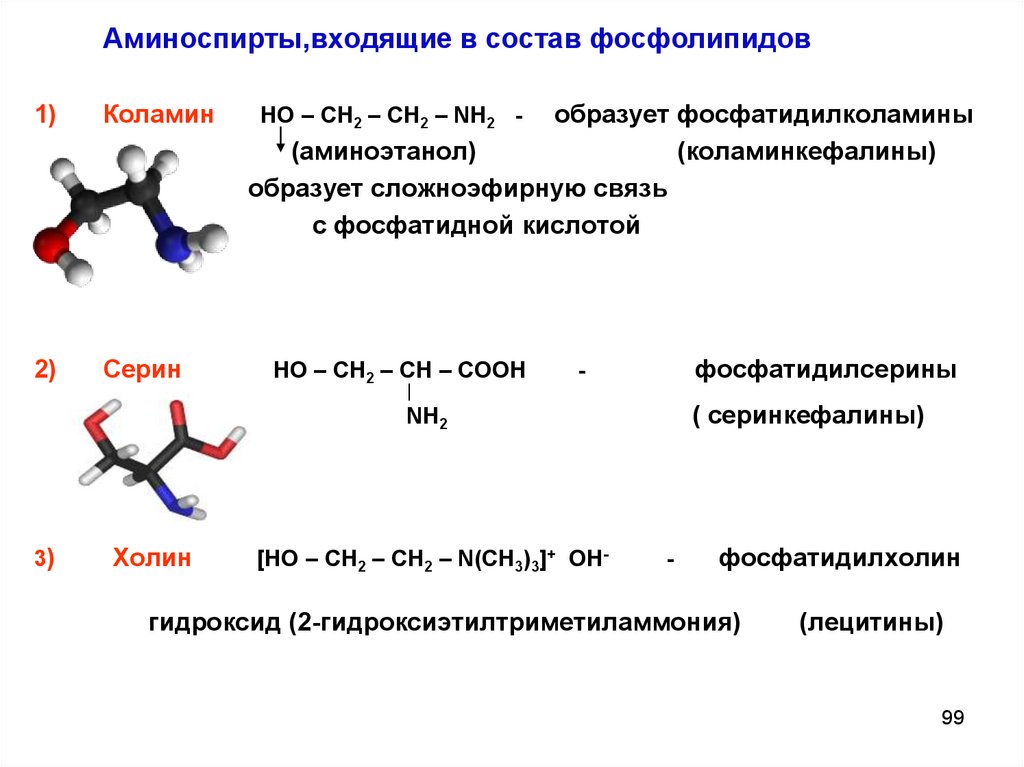
99.
Аминоспирты,входящие в состав фосфолипидов1)
Коламин
2)
Серин
образует фосфатидилколамины
(аминоэтанол)
(коламинкефалины)
образует сложноэфирную связь
с фосфатидной кислотой
НО – СН2 – СН2 – NH2 -
НО – СН2 – СН – СООН
фосфатидилсерины
-
( серинкефалины)
NH2
3)
Холин
[НО – СН2 – СН2 – N(CH3)3]+ ОН-
-
фосфатидилхолин
гидроксид (2-гидроксиэтилтриметиламмония)
(лецитины)
99
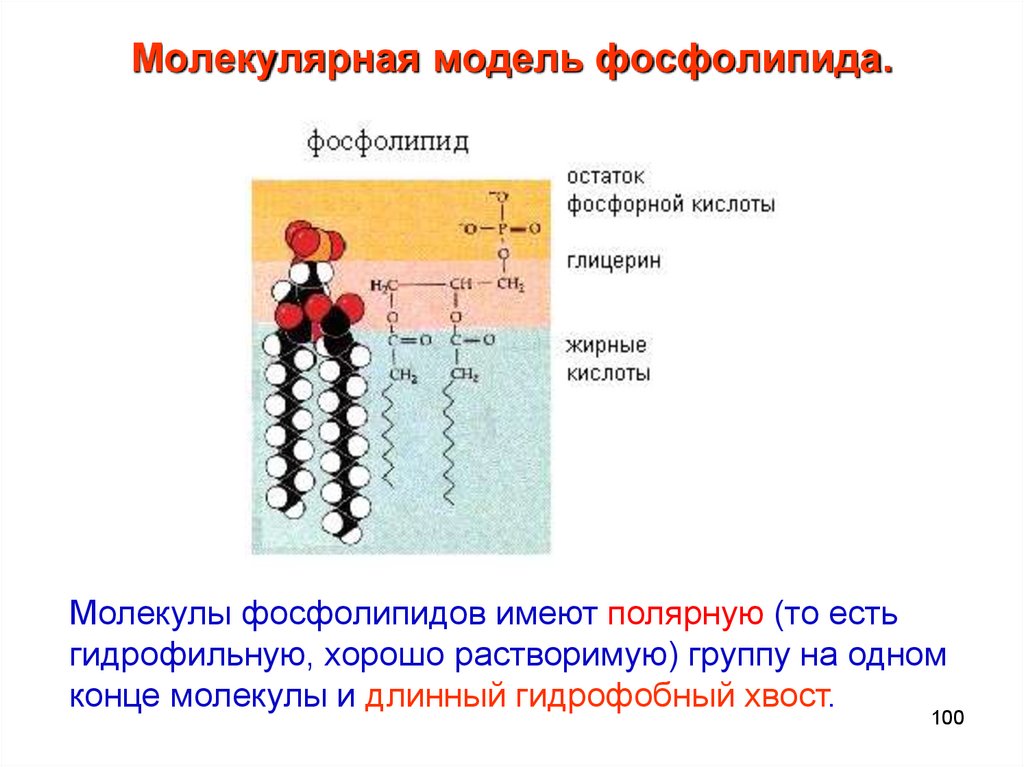
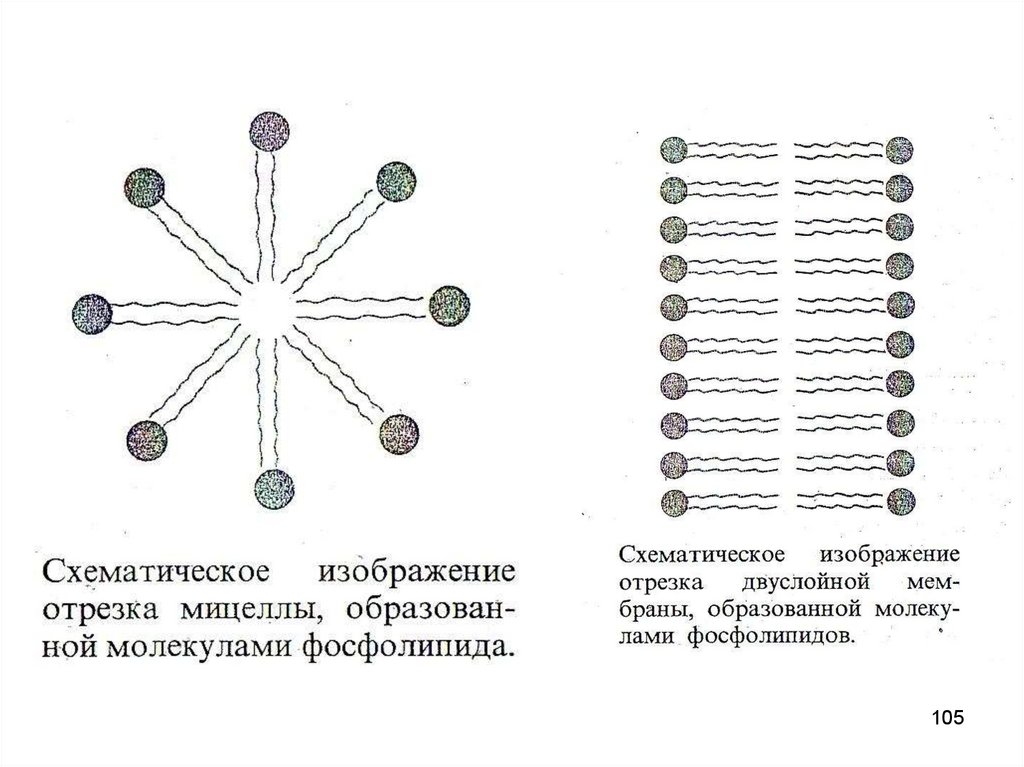
100. Молекулярная модель фосфолипида.
Молекулы фосфолипидов имеют полярную (то естьгидрофильную, хорошо растворимую) группу на одном
конце молекулы и длинный гидрофобный хвост.
100
101. Структура фосфатидилколаминов
H+O
CH2
O
C
O
C
OH
CH
OH
CH2
OH
R1
O
CH
CH2
R2
+ H2O
+ R1COOH
R2COOH
O
+
CH2
O
P
O
NH3
кислотный центр
CH2
NH2
CH2
OH
O
H3PO4 + HOCH2
CH2
-
глицерин
+
коламин + соли кислот
основный центр
Образовалась внутренняя соль
101
102. Структура фосфатидилсеринов
102103. Структура лецитинов (фосфатидилхолинов)
OH--
103
104. Фосфатидилхолины
Наиболее распространенные глицерофосфолипиды – этофосфатидилхолины (лецитины).
Лецитины - сложные эфиры глицерина с фосфорилхолином и
двумя остатками жирных кислот, из которых одна ненасыщенная; содержатся во всех клетках, преимущественно
в биологических мембранах, участвуя в процессах переноса
через них различных веществ.
104


























 Химия
Химия








