Похожие презентации:
Состав раствора количественно характеризуется величинами концентраций
1.
2. Состав раствора количественно характеризуется величинами концентраций
• Массовая, мольная, объемная доли[ доли,%]
• Массовая концентрация
[г/л]
• Молярная концентрация
[моль/л]
• Моляльная концентрация
[моль/кг растворителя]
• Нормальная (эквивалентная)
концентрация
[моль-экв/л]
3. Эквивалент Закон эквивалентов
4.
5. Основные определения
• Эквивалентом называется реальная илиусловная частица вещества, которая
может замещать, присоединять,
содержать, обменивать, высвобождать
или быть каким-либо иным образом
эквивалентна :
• Одному атому водорода (Н)
• Одному иону водорода (Н+) в кислотно-основных
или ионообменных реакциях
• Одному электрону в окислительно восстановительных реакциях.
6. Основные определения
• Эквивалентное число (Z) – это число, показывающее,какому числу ионов водорода (Н+) в кислотно-основных
или ионообменных реакциях или какому числу электронов
в ОВР, или какому числу атомов водорода эквивалентна
данная частица.
• Фактор эквивалентности (f) показывает, какая часть
частицы эквивалентна одному атому водорода (иону
водорода, электрону)
1
f=
Z
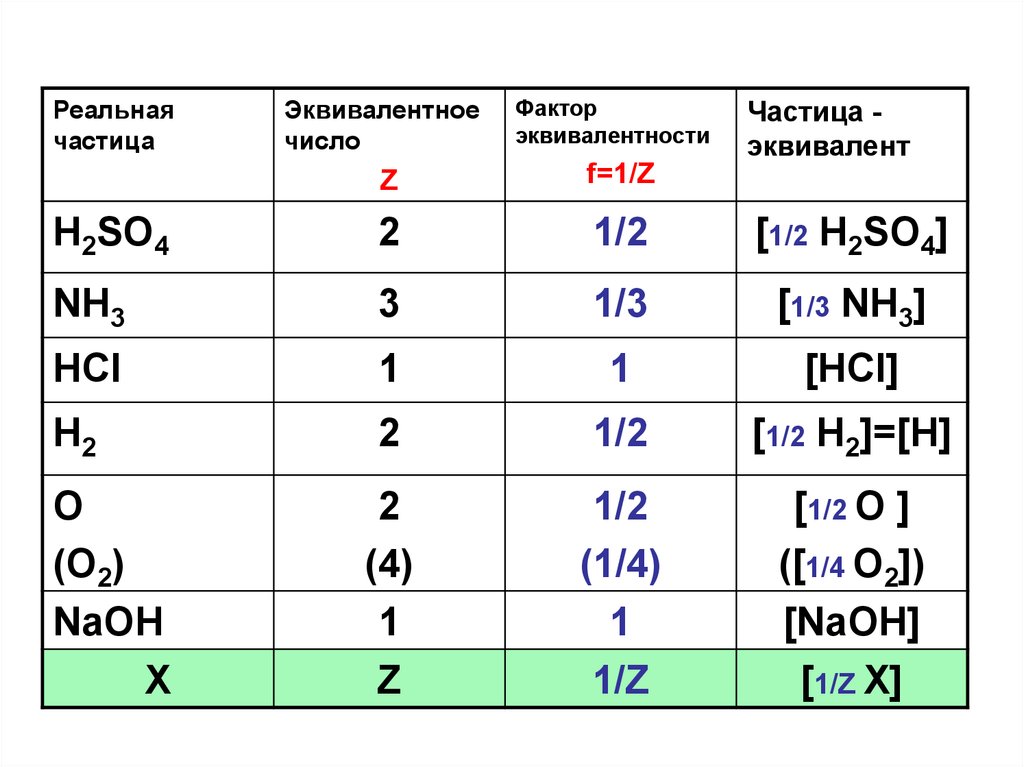
7.
Реальнаячастица
Эквивалентное
число
Фактор
эквивалентности
Частица эквивалент
Z
f=1/Z
H2SO4
2
1/2
[1/2 H2SO4]
NH3
3
1/3
[1/3 NH3]
HCl
1
1
[HCl]
H2
2
1/2
[1/2 H2]=[H]
2
(4)
1
Z
1/2
(1/4)
1
1/Z
[1/2 O ]
([1/4 O2])
[NaOH]
[1/Z X]
O
(O2)
NaOH
X
8. Фактор эквивалентности
КислотыОснования
Оксида (бинарного соединения)
Соли
Химического элемента
В ОВР
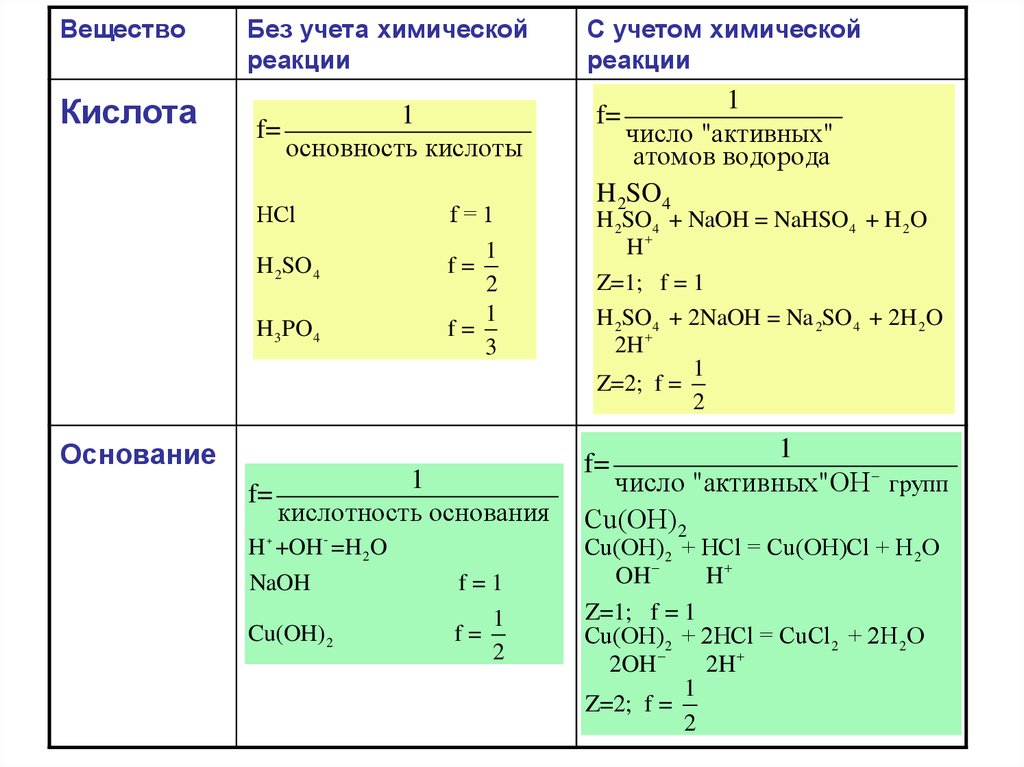
9.
ВеществоБез учета химической
реакции
Кислота
1
f=
основность кислоты
f=
НCl
f=1
H 2SO 4
f=
H 2SO 4 + NaOH = NaHSO 4 + H 2O
H
H 3PO 4
Основание
f=
1
2
1
f=
3
1
кислотность основания
H + +OH - =H 2O
NaOH
f=1
Cu(OH) 2
1
f=
2
С учетом химической
реакции
1
число "активных"
атомов водорода
H 2SO4
Z=1; f = 1
H 2SO 4 + 2NaOH = Na 2SO 4 + 2H 2O
2H
1
Z=2; f =
2
1
число "активных"OH групп
Сu(OH)2
f=
Сu(OH) 2 + HCl = Сu(OH)Cl + H 2 O
OH
H
Z=1; f = 1
Сu(OH) 2 + 2HCl = СuCl2 + 2H 2 O
2OH
2H
1
Z=2; f =
2
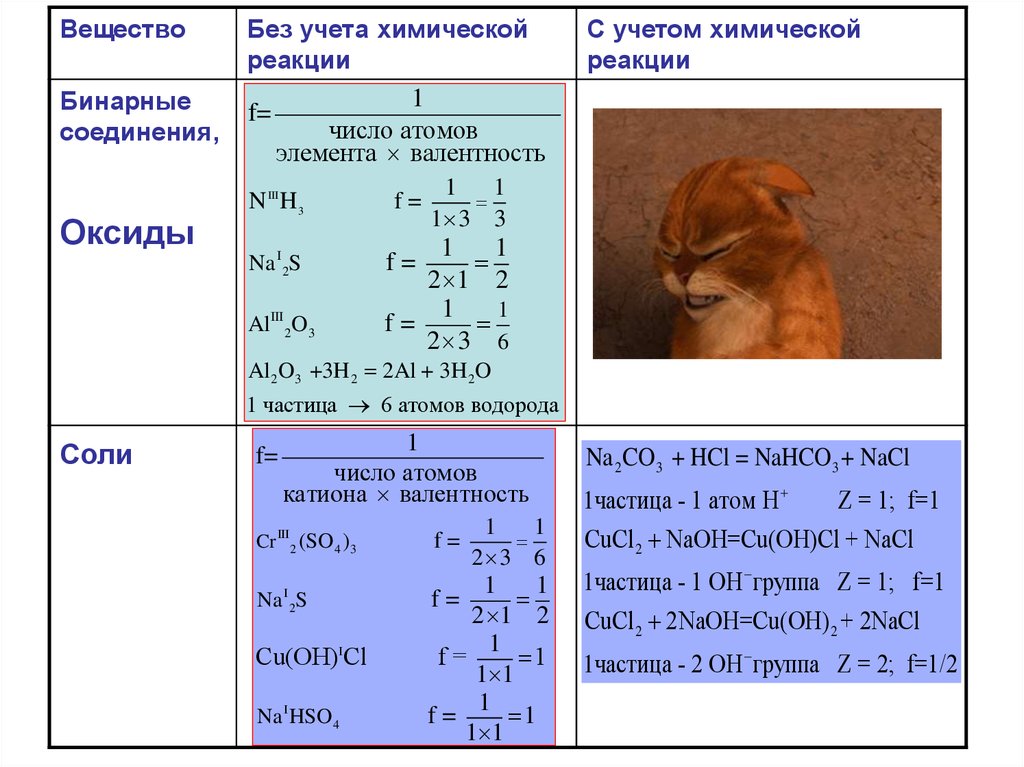
10.
ВеществоБинарные
соединения,
Оксиды
Без учета химической
реакции
1
f=
число атомов
элемента валентность
N III H 3
Na I 2S
AlIII 2O3
f=
С учетом химической
реакции
1 1
1 3 3
1
1
2 1 2
1
1
f=
2 3 6
f=
Al2 O3 +3H 2 2Al + 3H 2O
1 частица 6 атомов водорода
Соли
f=
1
число атомов
катиона валентность
Cr III 2 (SO 4 )3
I
Na 2S
Сu(OH)I Cl
Na I HSO 4
f=
1
1
2 3 6
1
1
f=
2 1 2
1
f=
1
1 1
1
f=
1
1 1
Na 2 CO3 + HCl = NaHCO3 + NaCl
1частица - 1 атом Н
Z = 1; f=1
СuCl2 NaOH=Сu(OH)Cl + NaCl
1частица - 1 OH группа Z = 1; f=1
СuCl2 2NaOH=Сu(OH) 2 + 2NaCl
1частица - 2 OH группа Z = 2; f=1/2
11.
ВеществоХимический элемент
Только с учетом химической реакции
f=
1
валентность
атома в образуемом
соединении
4Сu+O 2 = 2Cu I 2 O
f=1
2Сu+O 2 = 2Cu II O
f = 1/2
Окислительно –
восстановительные
реакции
f=
1
число принятых
(отданных) электронов
4Сu+O2 = 2Cu I 2O
Cu - 1e = Cu 1
f=1
2Сu+O2 = 2Cu II O
Cu - 2e = Cu 2
f = 1/2
12. Основные определения
• Количеством вещества эквивалентов называется такоеего количество:
которое может замещать, присоединять, содержать, обменивать,
высвобождать или быть каким-либо иным образом эквивалентно
одному молю атомов водорода (Н)
Которое соответствует одному молю ионов водорода (Н+) в
кислотно-основных или ионообменных реакциях
Одному молю электронов в окислительно - восстановительных
реакциях.
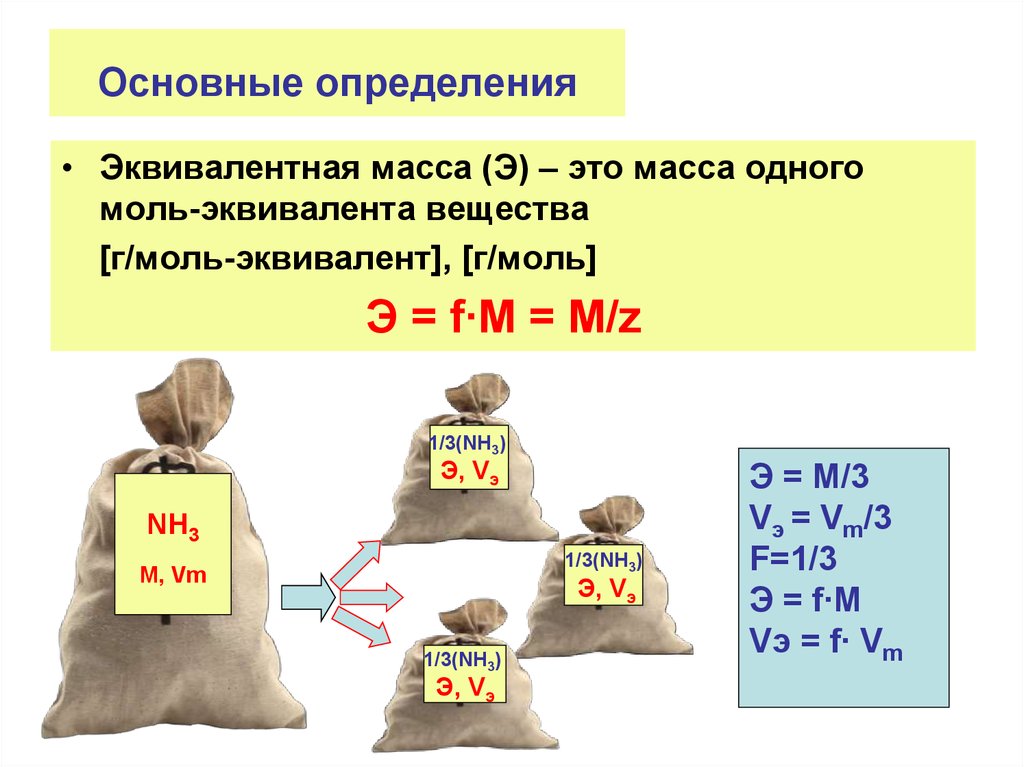
13. Основные определения
• Эквивалентная масса (Э) – это масса одногомоль-эквивалента вещества
[г/моль-эквивалент], [г/моль]
Э = f∙M = M/z
1/3(NH3)
Э, Vэ
NH3
1/3(NH3)
М, Vm
Э, Vэ
1/3(NH3)
Э, Vэ
Э = М/3
Vэ = Vm/3
F=1/3
Э = f∙М
Vэ = f∙ Vm
14. Основные определения
• 1 моль вещества содержит z мольэквивалентов
• n = z∙
• m = ∙M = n ∙Э
• Э = f∙M = M/z
• V = ∙ Vm= n ∙ Vэ
• Vэ = f∙ Vm
1/3(NH3)
Э, Vэ
NH3
М, Vm
1/3(NH3)
Э, Vэ
1/3(NH3)
Э, Vэ
15. Нормальная (эквивалентная) концентрация
nСн =
Vр-ра
n=z υ
Сm
n
z υ
Сн =
=
=z С m =
Vр-ра Vр-ра
f
Сн С m
16. Закон эквивалентов
N 2 + 3H 2 = 2NH32H 2 + O 2 = 2H 2 O
ν0
1
ν0
2
z
2 3
1 2
1 3
z
2 1
2 2
1 2
n
1 6 = 3 2
= 2 3
n
2 2 = 1 4
= 2 2
• Вещества взаимодействуют и образуются в
химических реакциях в количествах равных
эквивалентов
aA + bB = cC + dD
n(A) = n(B) = n(C) = n(D)
17. Массы реагирующих веществ относятся между собой, как эквивалентные массы
aA + bB = cC + dDn(A) = n(B)
m(A)
m(B)
=
Э(A)
Э(B)
m(A)
Э(A)
=
m(B)
Э(B)
aA + bB = cC + dD
n(A) = n(B)
C n (A) V(A) = C n (B) V(B)
18. Основные формулы
n=z νM
Э=
=f M;
Э M
z
m = n Э = ν M
V = n VЭ = ν Vm
Vm
VЭ
= f Vm
z
Cm
Cн =
= f Cm
z
n(A) = n(B)
VЭ Vm
Cн C m
m(A)
m(B)
=
Э(A)
Э(B)
C n (A) V(A) = C n (B) V(B)
19. Объемный анализ - титрование
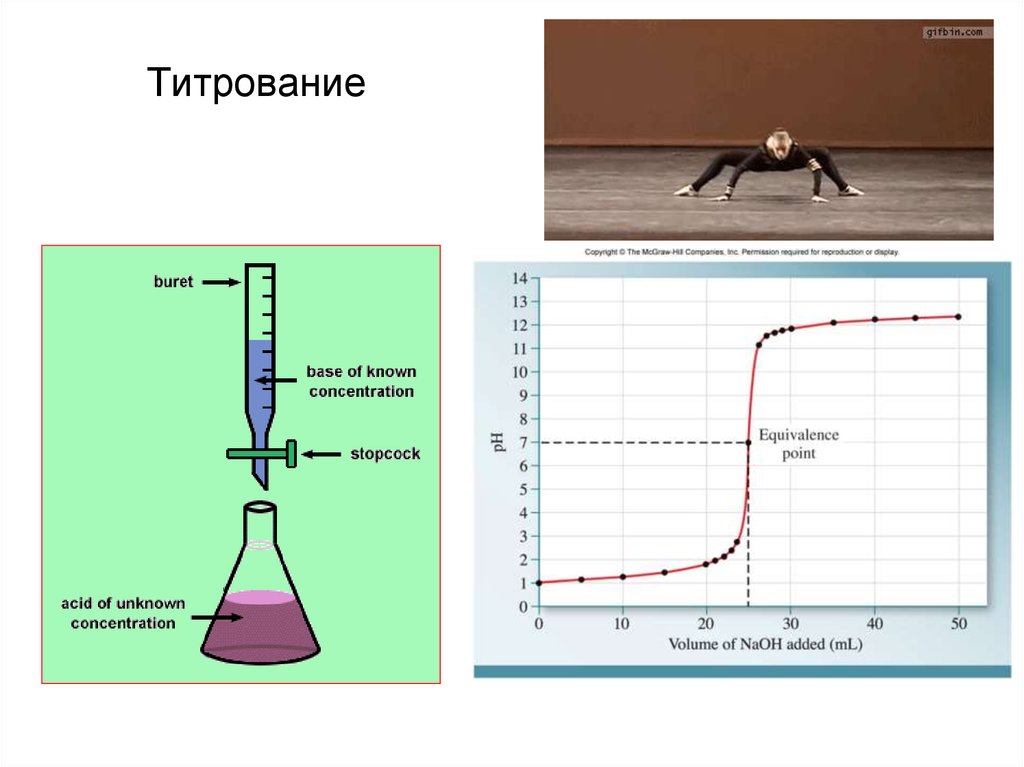
20. Титрование
21.
22. Закон разведения
ν(концентрированном р-ре) = ν (разбавленном р-ре)C m,k Vk = C m,r Vr
n (концентрированном р-ре) = n (разбавленном р-ре)
C n,k Vk = C n,r Vr
23. Задачи
• При окислении 2,81 г кадмия получено 3,21 г оксида кадмия.Вычислить эквивалентную массу кадмия.
• Определить эквивалентные массы металла и серы, если
3,24 г металла образуют 3,48 г оксида и 3,72 г сульфида.
• При растворении 1,11 г металла в кислоте выделилось
404,2 мл водорода, измеренного при 19оС и 770 мм ртутного
столба. Вычислить эквивалентную и атомную массы
металла, если металл двухвалентен.
• На реакцию с 0,4375 г соли израсходовали 0,1400 г NaOH.
Вычислить эквивалентную массу соли.
• Вычислить эквивалентную массу Са3(РО4)2, зная, что 6,2 г
его прореагировали с 3,923 г H2SO4, эквивалентная масса
которой 49,04. Чему равен фактор эквивалентности
Са3(РО4)2?
24. Задачи
• Определить фактор эквивалентности H2SO4 в реакциях сраствором КОН при образовании а) КНSO4, б) К2SO4.
• Сколько граммов Na2CO3 содержится в 1 мл 0,16 Н раствора,
если его нормальность вычислена по реакции
взаимодействия соли с сильной кислотой с образованием
Н2СО3 ?
• Для нейтрализации 30 мл 0,1 Н раствора щелочи
потребовалось 12 мл кислоты. Определить эквивалентную
концентрации кислоты.
• Вычислить эквивалентную массу гексафторкремниевой
кислоты (H2SiF6), если на нейтрализацию 25 мл раствора,
содержащего 0,18 г кислоты, пошло 50 мл раствора NaOH,
содержащего 0,1 г щелочи.
• В 1 кг Н2О растворено 666 г КОН, плотность раствора 1,395
г/мл. Найти а) процентную концентрацию; б) молярность; в)
нормальность полученного раствора.


















 Химия
Химия








