Похожие презентации:
Химическая связь в органических соединениях. (Лекция 3)
1.
T VasilievaХимическая связь в
органических соединениях
Лекция 3
2.
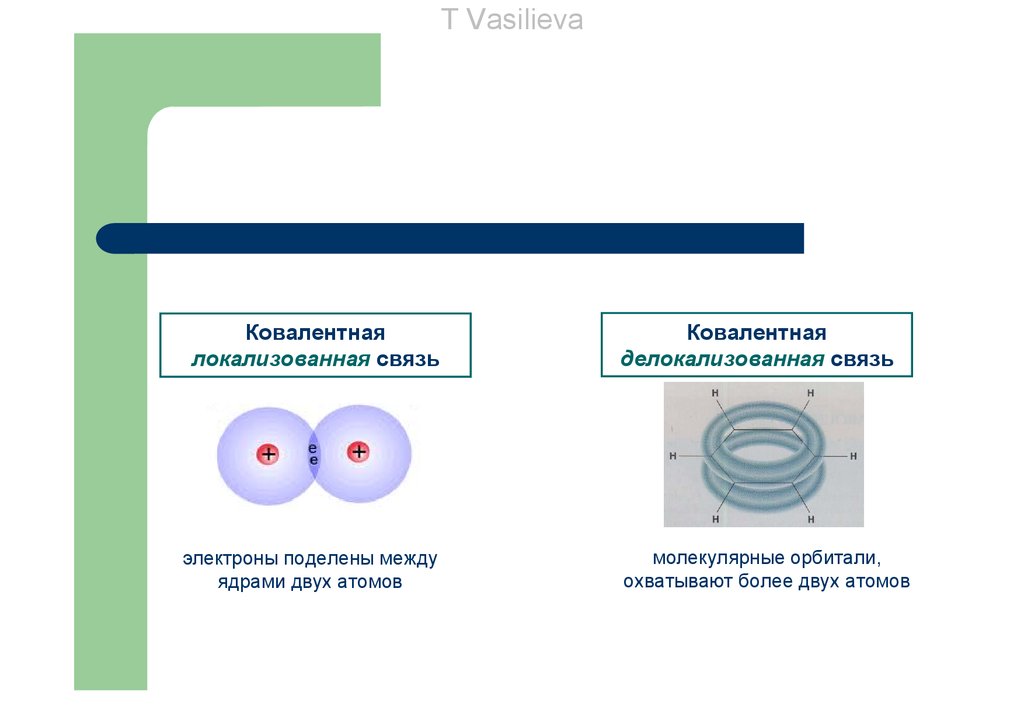
T VasilievaКовалентная
локализованная связь
электроны поделены между
ядрами двух атомов
Ковалентная
делокализованная связь
молекулярные орбитали,
охватывают более двух атомов
3.
T VasilievaКовалентная
делокализованная
связь
4.
T VasilievaОсновные понятия
Делокализованная связь – это ковалентная связь,
молекулярные орбитали которой, охватывают
более двух атомов
Характерны для соединений, содержащих открытые или
замкнутые системы сопряжения
H2C
CH
CH
Бутадиен-1,3
CH2
5.
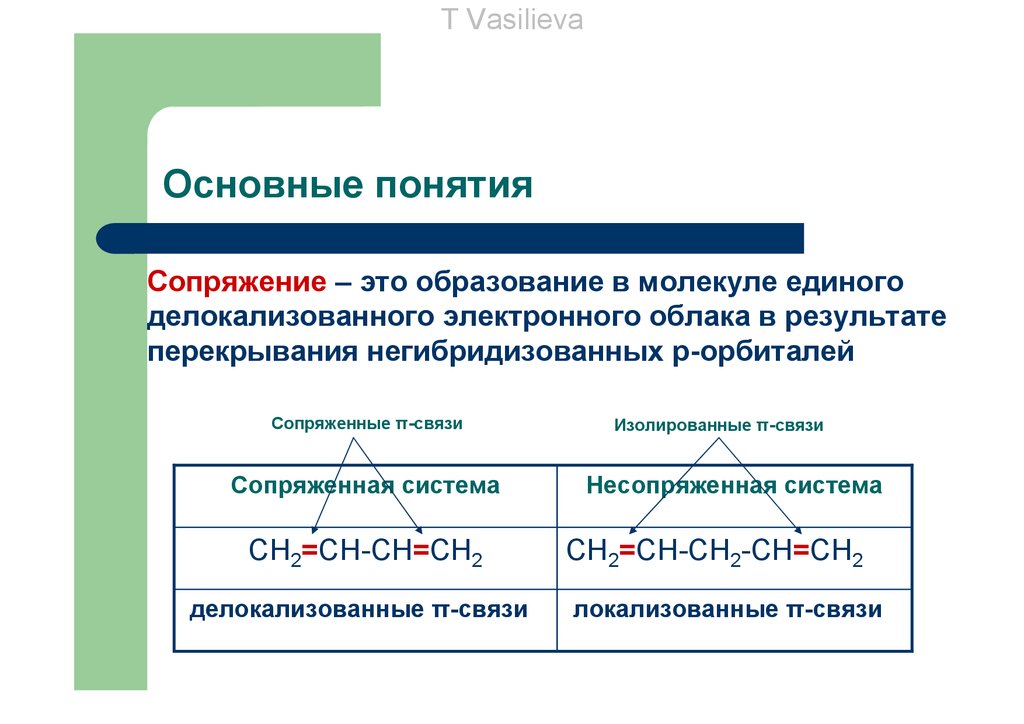
T VasilievaОсновные понятия
Сопряжение – это образование в молекуле единого
делокализованного электронного облака в результате
перекрывания негибридизованных р-орбиталей
Сопряженные π-связи
Сопряженная система
CH2=CH-CH=CH2
делокализованные π-связи
Изолированные π-связи
Несопряженная система
CH2=CH-СН2-CH=CH2
локализованные π-связи
6.
T Vasilievaπ,π-сопряженные системы
Делокализованные МО принадлежат двум или более π-связям
7.
T VasilievaУсловия π,π-сопряжения
1)
Кратные связи должны быть разделены одной (и только
одной) простой связью
2)
Максимальное сопряжение достигается, когда обе кратные
связи лежат в одной плоскости
3)
Если по пространственным соображениям две кратные связи
не могут лежать в одной плоскости, то сопряжение между
ними уменьшается с увеличением угла между плоскостями
этих связей
Кумулированные π-связи
4)
>С=С=С< аллены
>С=С=О кетены
Сопряжение невозможно
8.
T VasilievaОбразование двух π-связей в
кумулированных диенах
а – перекрывание р-орбиталей
б – взаимно перпендикулярные
плоскости π-связей
9.
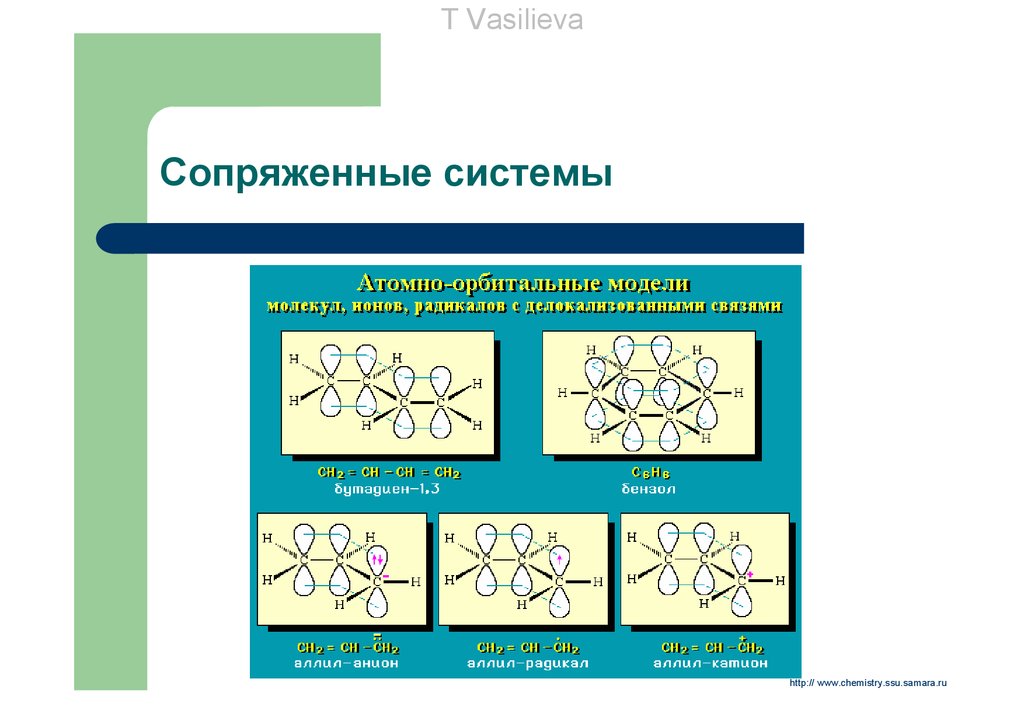
T VasilievaСопряженные системы
Система сопряжeния может быть открытой или замкнутой и
содержать атом (C, N, O, S, Cl и т.д.) с неподеленной электронной
парой (формулы I, II), с неспаренным электроном (III) или с
вакантной р-АО (IV):
10.
T Vasilievaр,π-сопряженные системы
Сопряжение π-связи и соседней р-орбитали, содержащей пару
электронов
..
C
C
X
Х – гетероатом, имеющий свободную (не участвующую в образовании ковалентной связи)
пару электронов
H2C
..
CH O
H2C
CH3
O
Винилметиловый эфир
H3C
C
..
NH2
Ацетамид
CH
..
Cl
Винилхлорид
11.
T VasilievaСопряженные системы
http:// www.chemistry.ssu.samara.ru
12.
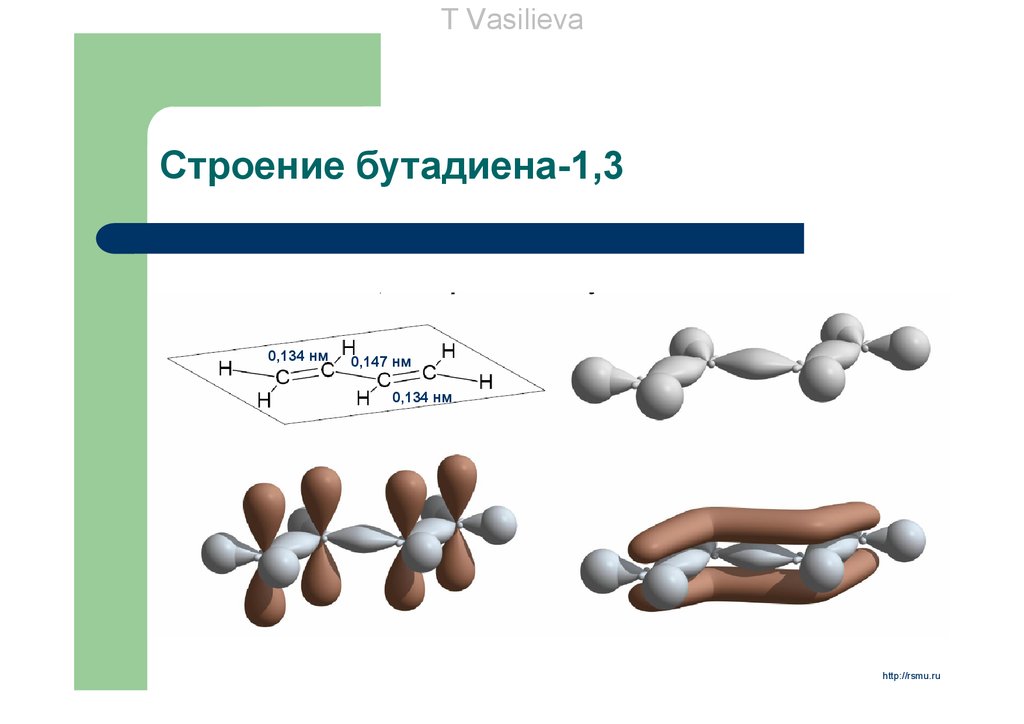
T VasilievaСтроение бутадиена-1,3
0,134 нм
0,147 нм
0,134 нм
http://rsmu.ru
13.
T VasilievaСравнение теплот гидрирования диенов
с сопряженными и изолированными
связями
Е
H2C
CH
CH2
CH
CH2
15 кДж/моль
H2C
CH
CH
CH2
+ 2Н2
+ 2Н2
H3C
CH2 CH2
CH3
H3C
CH2 CH2
CH2
CH3
14.
T VasilievaМетоды описания делокализованной
химической связи
1)
Метод молекулярных орбиталей
Хюккеля Э. Хюккель (1930)
2)
Метод резонансных структур
(метод резонанса, РС) К. Ингольд (1922),
Л. Полинг (1928)
15.
T VasilievaПрименение метода МО к описанию
делокализованных связей
1)
Пренебрегают взаимодействием σ- и π-электронов. Такое приближение
основано на различии в симметрии орбиталей (ортогональные орбитали).
σ-связи молекулы относят к ее остову.
2)
π-электроны описывают с помощью МО, состоящих исключительно из АО ртипа. Т.е. считают, что атомы углерода в сопряженной системе находятся в
состоянии идеальной sp2-гибридизации.
Систему
сопряженных
π-связей
рассматривают
независимо от σ-скелета и считают, что именно
π-система играет главную роль в проявлении
химических свойств сопряженных соединений
16.
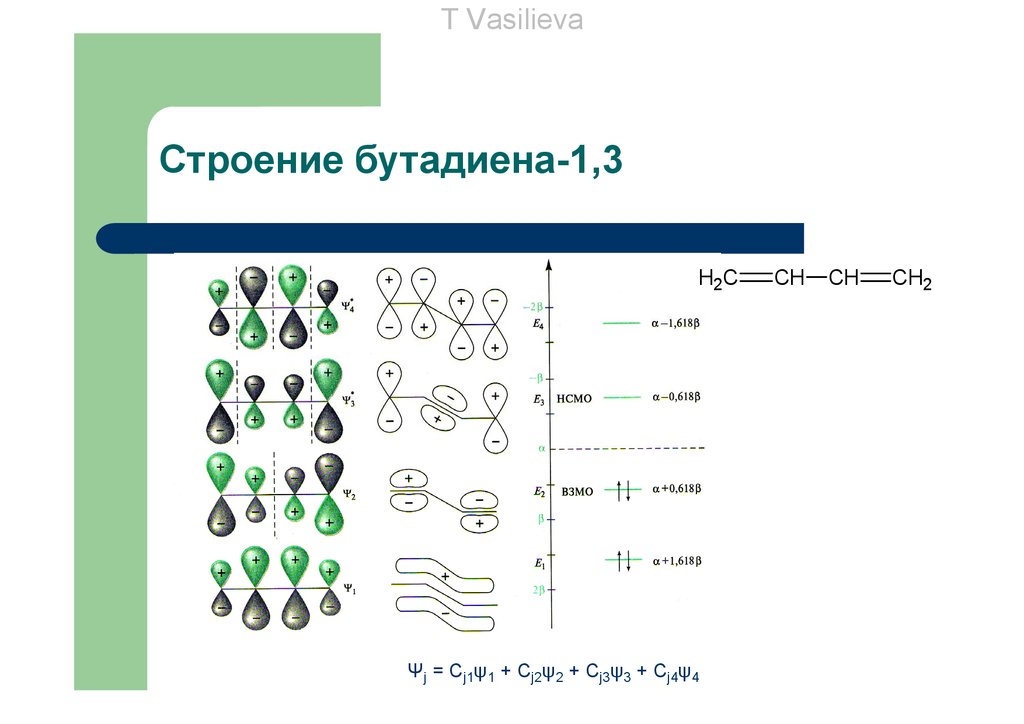
T VasilievaСтроение бутадиена-1,3
H2C
Ψj = Cj1ψ1 + Cj2ψ2 + Cj3ψ3 + Cj4ψ4
CH
CH
CH2
17.
T VasilievaПрименение метода резонанса к
описанию сопряженных систем
(бутадиен-1,3)
H2C
CH
CH
CH2
H2C
+
(I)
CH
CH
_
CH2
(II)
_
H2C
CH
CH
CH2
+
(III)
Вклад структур II и III в резонансный гибрид меньше, чем структуры I , из-за уменьшения
в них числа ковалентных связей и разделения зарядов
H2C
CH
CH
CH2
Резонансный гибрид
Резонансный гибрид – комбинация ряда структур (с локализованными
связями), называемых резонансными или каноническими
18.
T VasilievaВыводы
1) Перекрывание р-АО (сопряжение, делокализация π-электронов)
энергетически выгодно и осуществляется всегда, когда для
этого есть необходимые условия.
2) Сопряженные соединения стабильнее, чем соединения с
изолированными кратными связями.
3) Чем больше цепь сопряжения, тем стабильнее соединение.
4) Выигрыш энергии, получаемый в результате сопряжения,
называют энергией сопряжения (энергией делокализации).
19.
T Vasilievap,π-Сопряжение в винилдиметиламине
эфире и дивиниловом эфире
винилдиметиламин
дивиниловый эфир
20.
T VasilievaУсловия р,π-сопряжения
1)
Атом, несущий свободную электронную пару должен быть
отделен от кратной связи одной простой связью
2)
Наибольшей величины сопряжение достигает, если р-АО
перпендикулярна плоскости двойной связи
3)
Сопряжение невозможно, если р-АО лежит в плоскости двойной
связи
4)
Участие атома С в р,π-сопряжении с кратной связью возможно
только в том случае, если он превратится в радикал, катион или
анион
21.
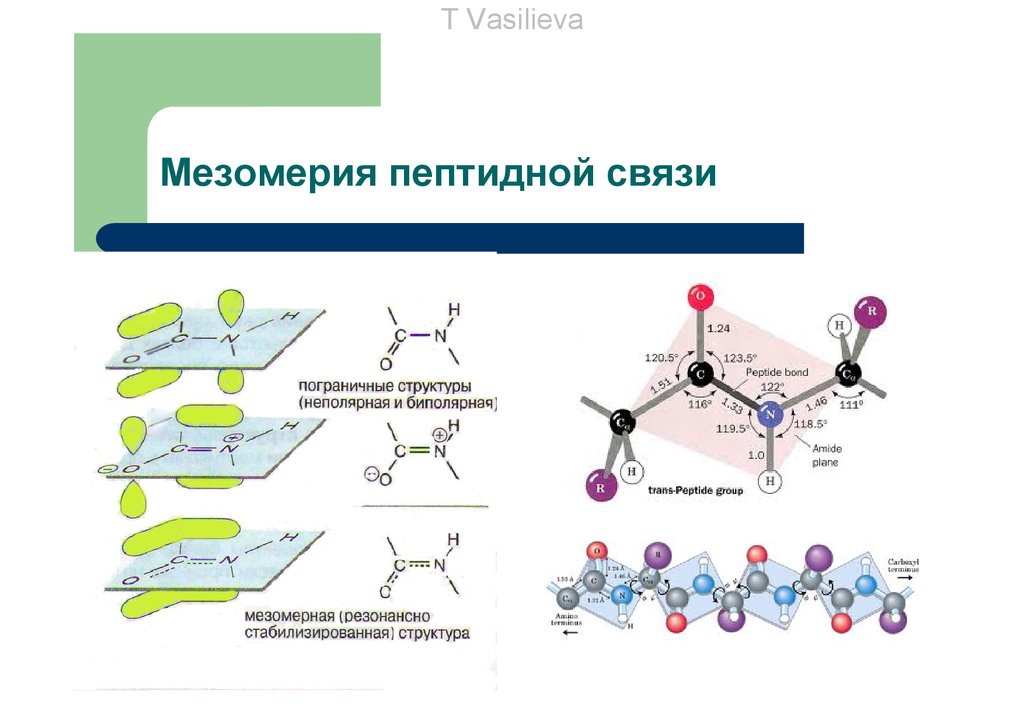
T VasilievaМезомерия пептидной связи
22.
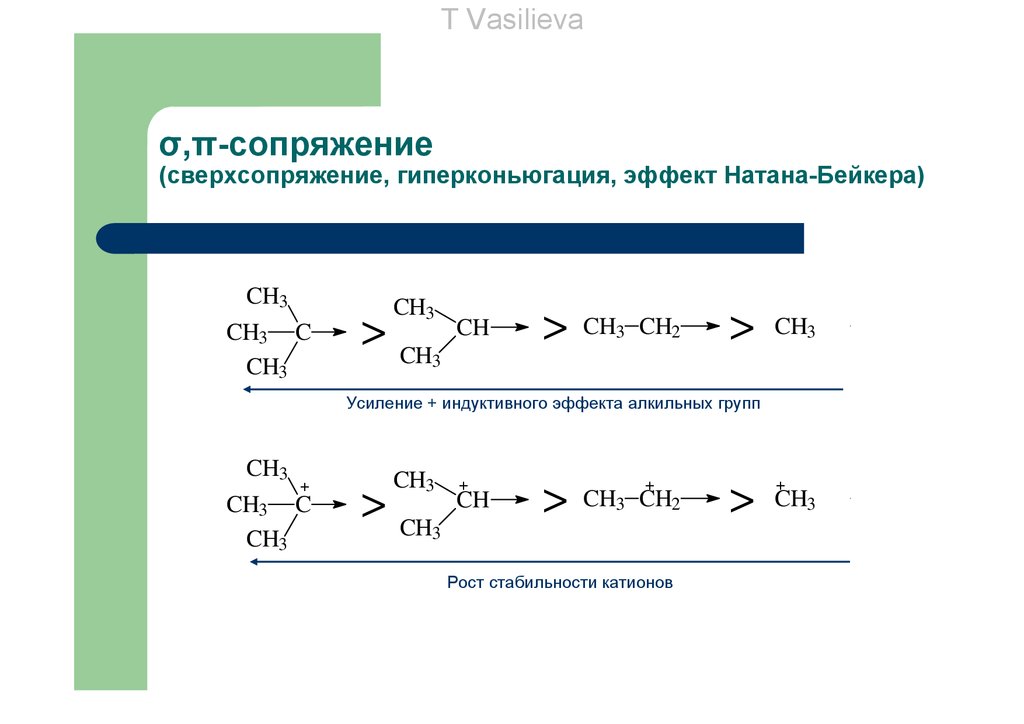
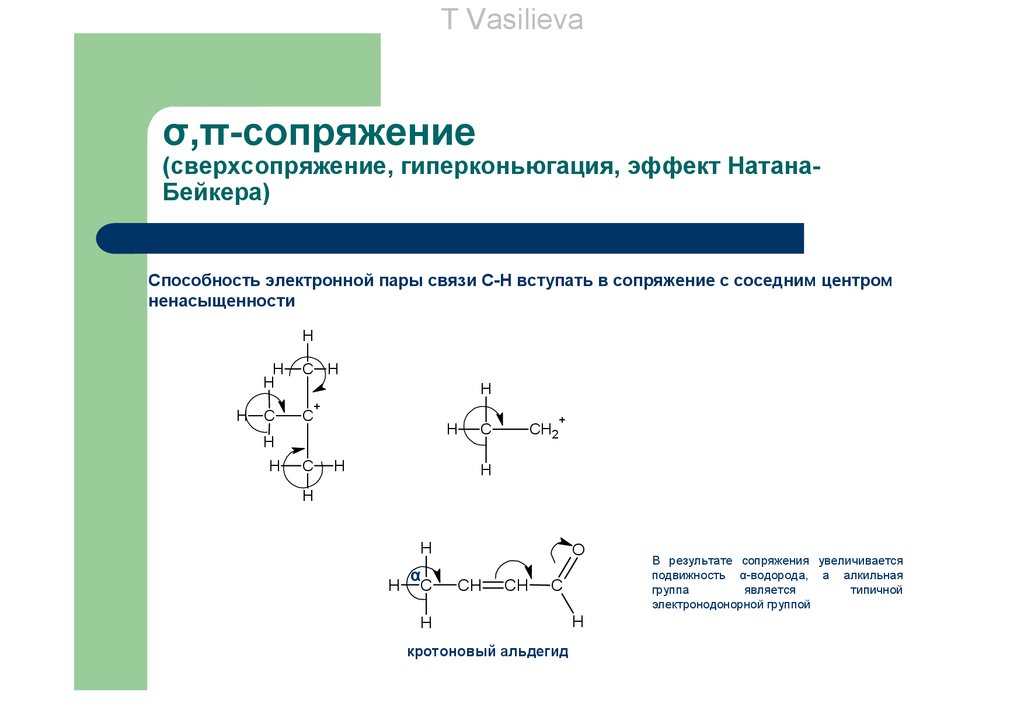
T Vasilievaσ,π-сопряжение
(сверхсопряжение, гиперконьюгация, эффект Натана-Бейкера)
CH3
CH3 C
CH3
>
CH3
CH
CH3
>
CH3 CH2
>
CH3
Усиление + индуктивного эффекта алкильных групп
CH3
+
CH3 C
CH3
>
CH3
CH3
+
CH
>
+
CH3 CH2
Рост стабильности катионов
>
+
CH3
23.
T Vasilievaσ,π-сопряжение
(сверхсопряжение, гиперконьюгация, эффект НатанаБейкера)
Способность электронной пары связи С-Н вступать в сопряжение с соседним центром
ненасыщенности
H
H
H
H
C
C H
H
C
H
H
H
C
H
+
H
C
CH2
+
H
H
C
CH
δ-
CH2
H
H
пропен
H
H
α
C
O
CH
CH
C
H
кротоновый альдегид
H
В результате сопряжения увеличивается
подвижность α-водорода, а алкильная
группа
является
типичной
электронодонорной группой
24.
T VasilievaГиперконьюгация
H+
H3C
CH2
CH
H
CH3
-H2O
OH
H
H
C
C
C
C
H
H
H
H
H
+
H
бутанол-2
-H
H
H
H
C
C
C
C
H
H
H
H
H
+
H
H
H
H
C
C
H
+
H
C
C
H
H
бутен-2
H
25.
T VasilievaАроматичность: особый вид
сопряжения
Химические свойства ароматических соединений
Высокая стабильность
Преимущественно вступают в реакции замещения
3
2
NH
4
1
Циклическая сопряженная система молекулы
5
N
Условия возникновения
1)
2)
3)
Система должна быть циклической (карбоциклы, гетероциклы)
Система должна быть плоской
Все атомы цикла должны находиться в состоянии sp2гибридизации
26.
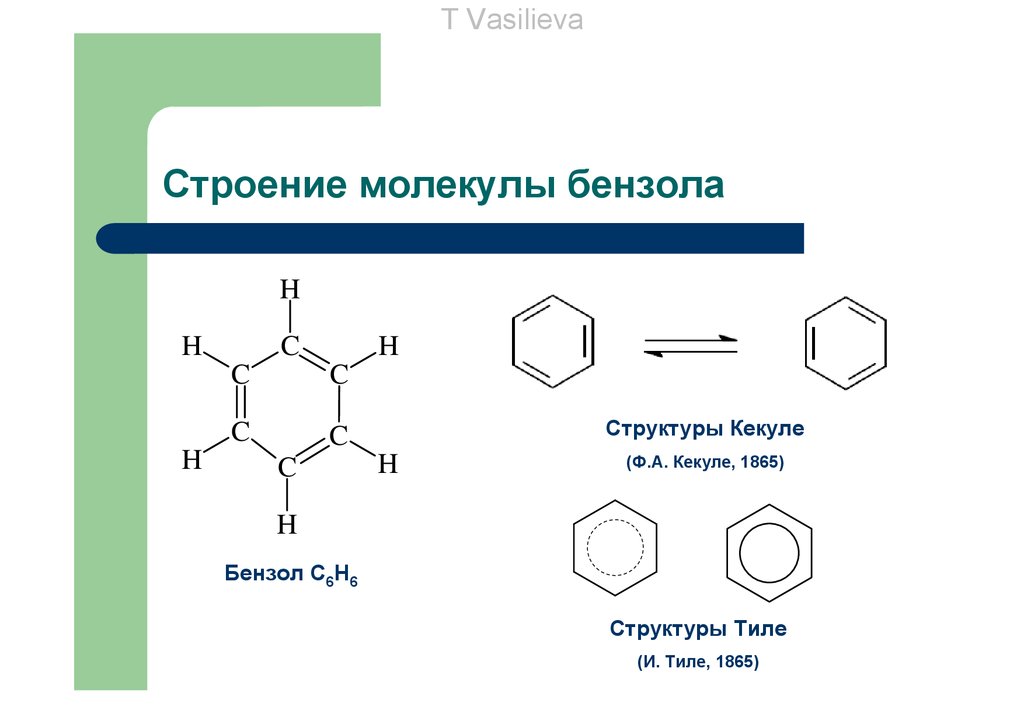
T VasilievaСтроение молекулы бензола
H
H
H
C
H
C
C
C
C
C
Структуры Кекуле
H
(Ф.А. Кекуле, 1865)
H
Бензол С6Н6
Структуры Тиле
(И. Тиле, 1865)
27.
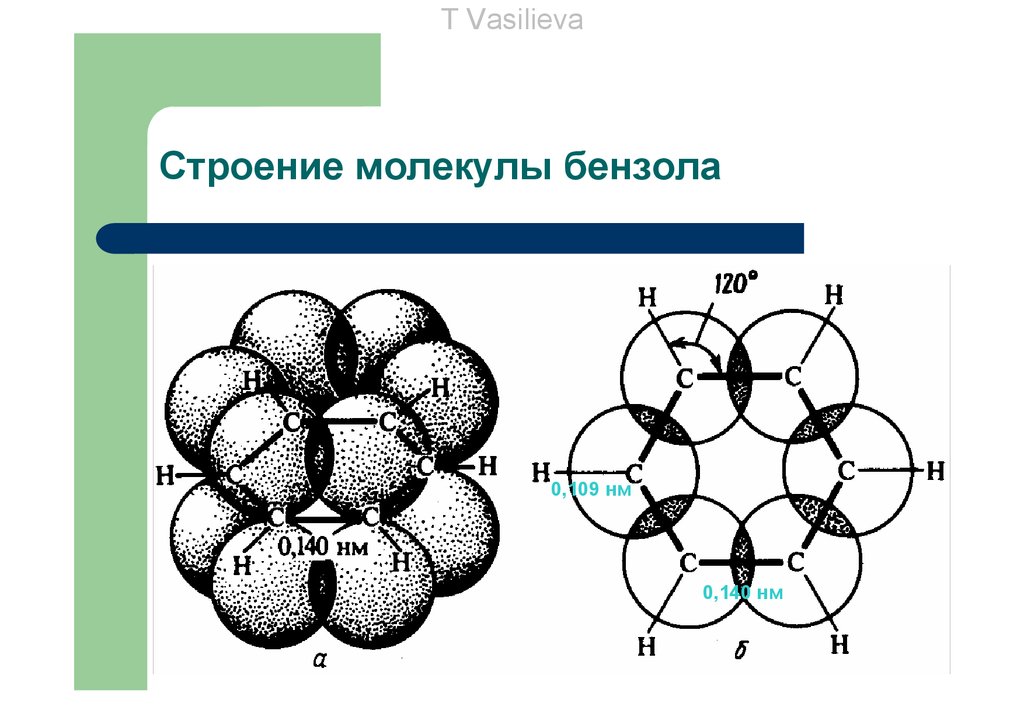
T VasilievaСтроение молекулы бензола
0,109 нм
0,140 нм
28.
T VasilievaСтроение молекулы бензола
Бензол – плоский правильный шестиугольник с
валентными углами 120°, все связи С-С равноценны
(0,140 нм) и все атомы углерода sp2-гибридизованы;
все связи С-С и С-Н лежат в одной плоскости
29.
T VasilievaСтроение молекулы бензола
H
H
C
H
C
C
C
H
29
C
C
H
H
6 электронов в
делокализованной
π связи
30.
T VasilievaПрименение метода резонанса для
описания структуры бензола
I
II
III
IV
V
I, II – структуры Кекуле (вклад в резонансную гибридизацию 0,39)
III, IV, V – структуры Дьюара (вклад в резонансную гибридизацию 0,07)
Бензол как резонансный гибрид стабильнее, чем любая из канонических
структур
31.
T VasilievaПрименение метода МО для описания
структуры бензола
Ароматический
секстет
32.
T VasilievaПравило Хюккеля
ПЛОСКИЕ, МОНОЦИКЛИЧЕСКИЕ, СОПРЯЖЕННЫЕ
углеводороды будут ароматическими, если цикл
содержит (4n+2) π – электронов
33.
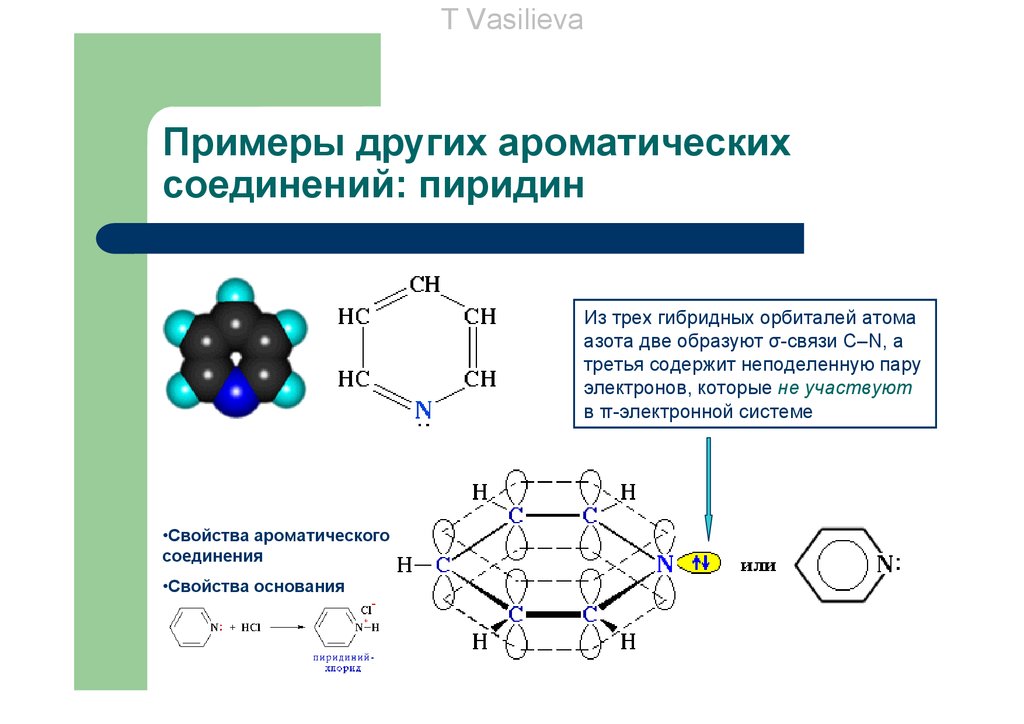
T VasilievaПримеры других ароматических
соединений: пиридин
Из трех гибридных орбиталей атома
азота две образуют σ-связи С–N, а
третья содержит неподеленную пару
электронов, которые не участвуют
в π-электронной системе
•Свойства ароматического
соединения
•Свойства основания
34.
T VasilievaПримеры других ароматических
соединений: пиррол
На негибридной р-орбитали азота
находится неподеленная пара электронов,
которые вступают в сопряжение с
четырьмя р-электронами атомов углерода.
В циклической системе сопряжения
находится 6 электронов, что определяет
ароматические свойства пиррола.
•Свойства ароматического
соединения
•Свойства кислоты
35.
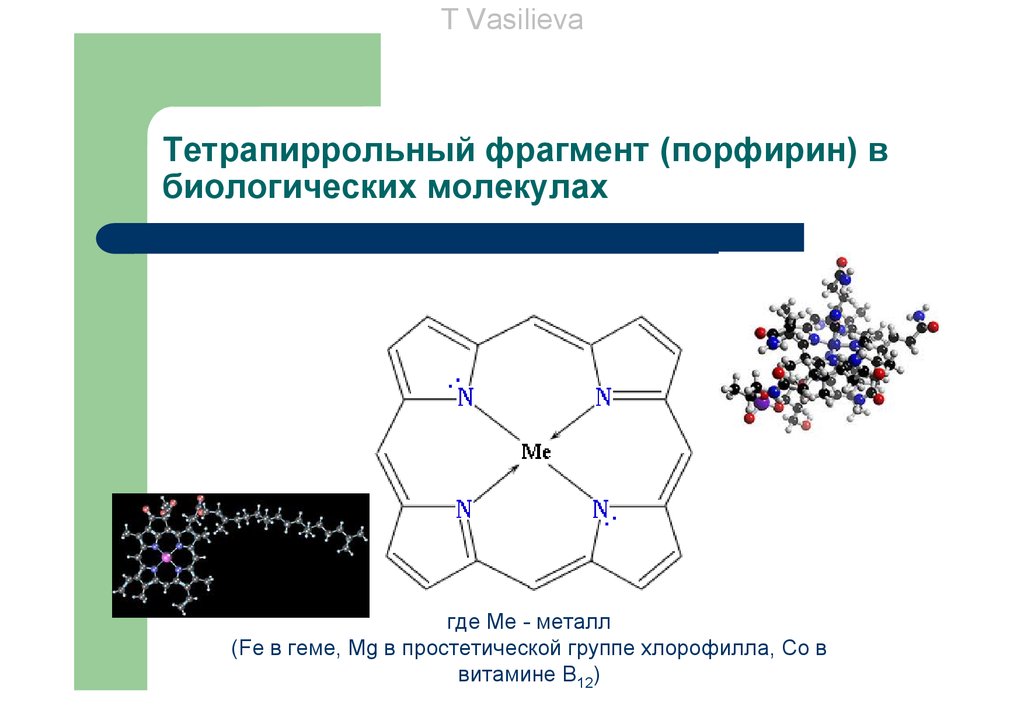
T VasilievaТетрапиррольный фрагмент (порфирин) в
биологических молекулах
где Ме - металл
(Fe в геме, Mg в простетической группе хлорофилла, Co в
витамине В12)
36.
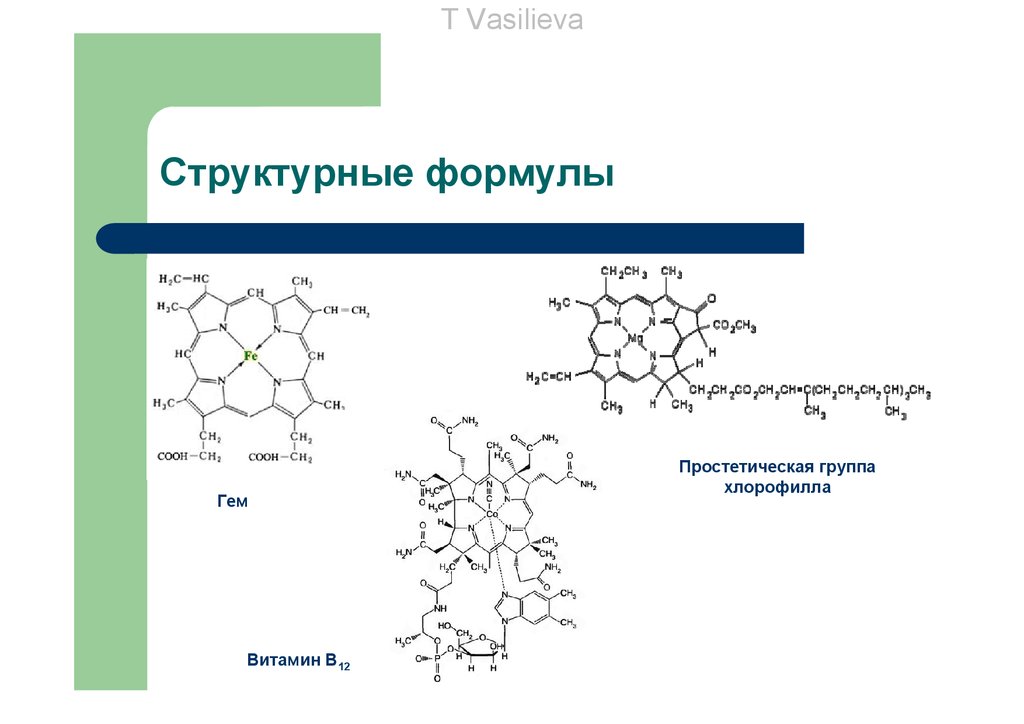
T VasilievaСтруктурные формулы
Гем
Витамин В12
Простетическая группа
хлорофилла
37.
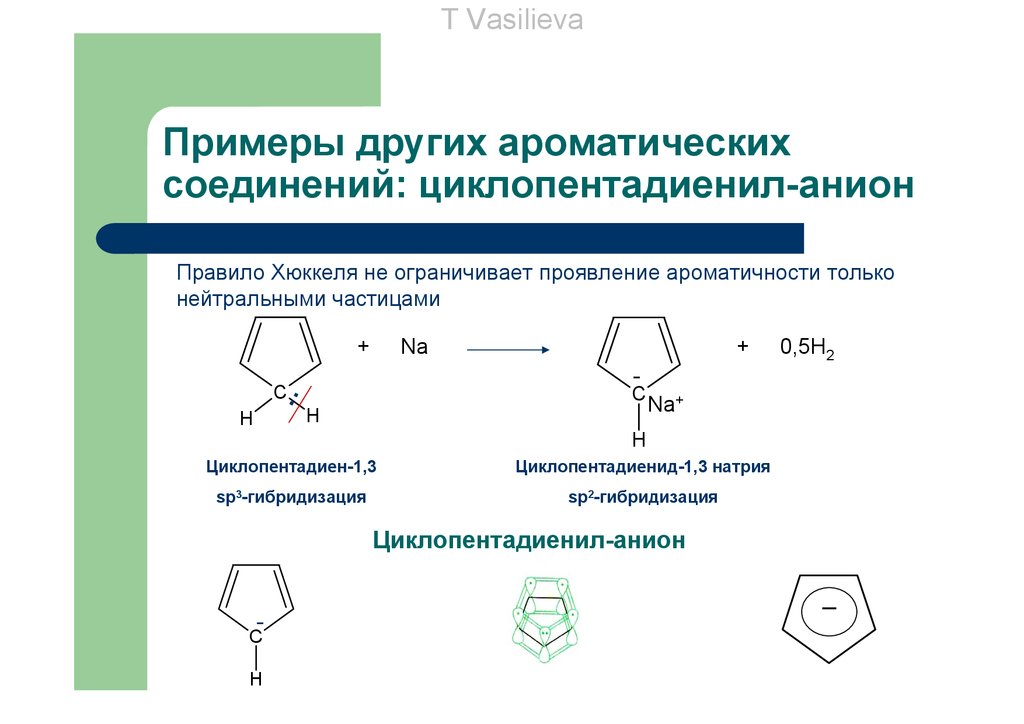
T VasilievaПримеры других ароматических
соединений: циклопентадиенил-анион
Правило Хюккеля не ограничивает проявление ароматичности только
нейтральными частицами
+
C:
H
Na
+
-
C
H
Na+
H
Циклопентадиен-1,3
Циклопентадиенид-1,3 натрия
sp3-гибридизация
sp2-гибридизация
Циклопентадиенил-анион
-
C
H
0,5H2
38.
T VasilievaДругие виды
связей
39.
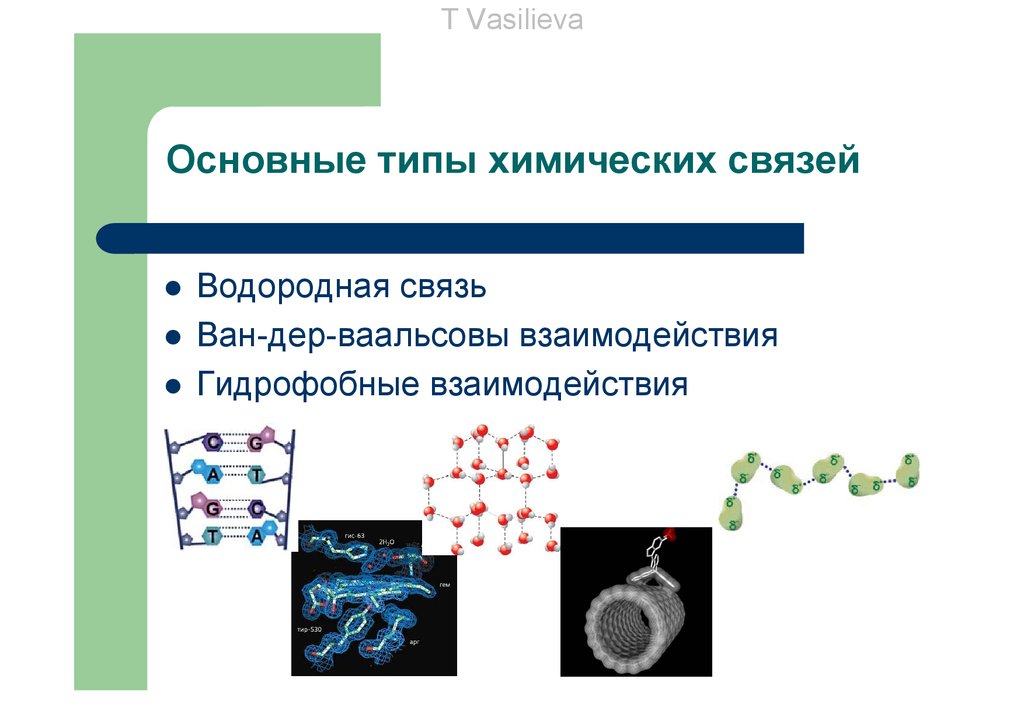
T VasilievaОсновные типы химических связей
z
z
z
Водородная связь
Ван-дер-ваальсовы взаимодействия
Гидрофобные взаимодействия
40.
T VasilievaВодородная связь
Природа водородной связи:
- электростатический характер
- донорно-акцепторный характер
Энергия водородной связи: 10-40 кДж/моль (слабое взаимодействие)
Ассоциация молекул
повышение Ткип
Повышение растворимости
Стабилизация ионизированных частиц в растворе
41.
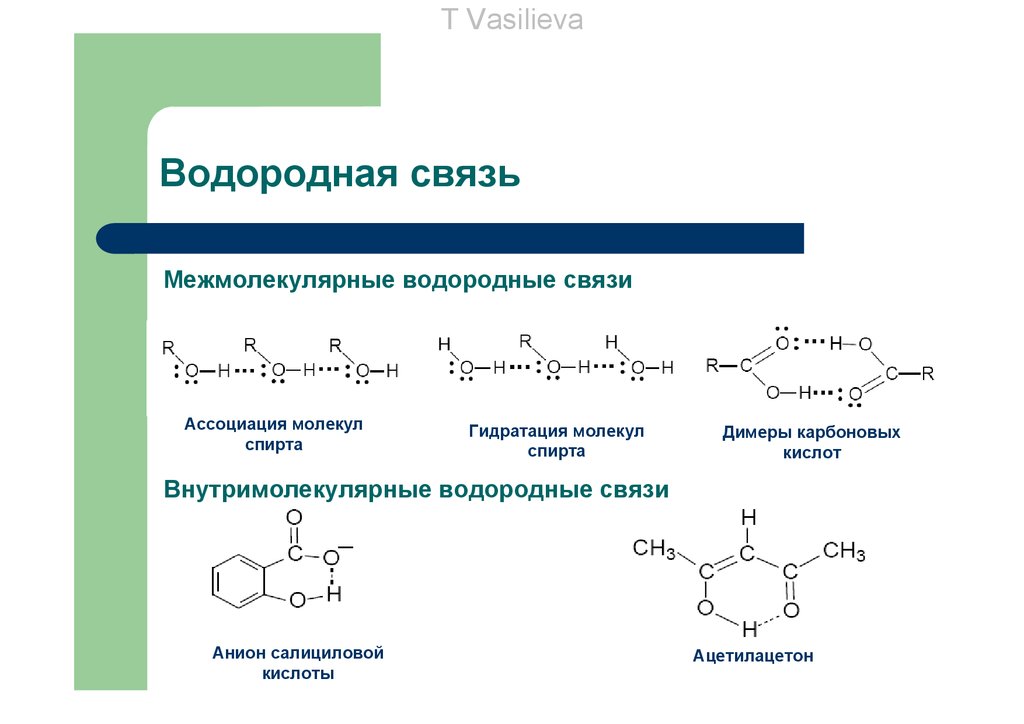
T VasilievaВодородная связь
Межмолекулярные водородные связи
Ассоциация молекул
спирта
Гидратация молекул
спирта
Димеры карбоновых
кислот
Внутримолекулярные водородные связи
Анион салициловой
кислоты
Ацетилацетон
42.
T VasilievaВлияние внутримолекулярных
водородных связей на свойства
соединений
O
Ткип, °С
Растворимость,
г/100 г воды
о-нитрофенол
216
0,21
м-нитрофенол
194
1,35
N
O
O
H
NO2
OH
о-нитрофенол
м-нитрофенол
H
CHO
C
O
O
H
о-гидроксибензальдегид
(салициловый альдегид)
рКа > рКа
OH
м-гидроксибензальдегид
43.
T VasilievaВодородные связи в биологических
молекулах
1)
2)
3)
Образование вторичной и третичной структуры белков
Образование двойной спирали ДНК
Связывание лекарственного препарата с рецептором
Водородные связи между СООН одного
витка и NH2 другого витка в α-спирали белка
44.
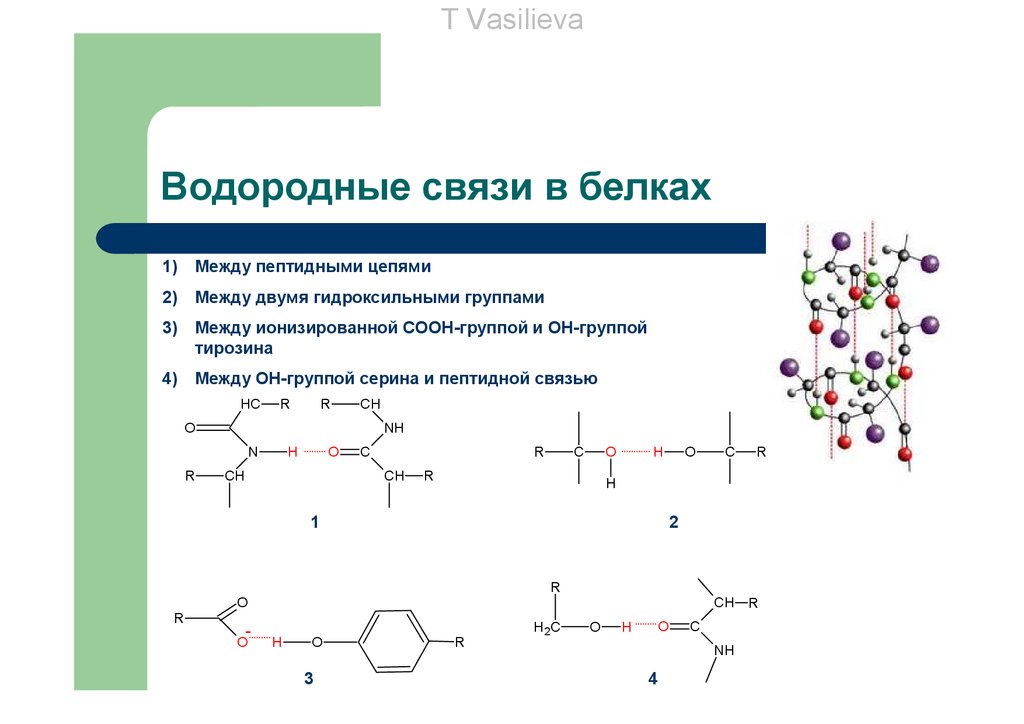
T VasilievaВодородные связи в белках
1)
Между пептидными цепями
2)
Между двумя гидроксильными группами
3)
Между ионизированной СООН-группой и ОН-группой
тирозина
4)
Между ОН-группой серина и пептидной связью
HC
R
R
CH
NH
O
N
R
H
O
C
R
CH
CH
C
O
R
H
-
R
H
O
3
R
2
O
O
C
H
1
R
O
R
H 2C
CH
O
H
O
C
NH
4
R
45.
T VasilievaВан-дер-ваальсовы взаимодействия
z
Ориентационные силы, диполь-дипольное притяжение
Осуществляется между молекулами, являющимися постоянными
диполями
E ~ 1/r3
z
Дисперсионное притяжение (лондоновские силы)
Взаимодействием между мгновенным и наведенным диполем
E ~ 1/r6
z
Индукционное притяжение
Взаимодействие между постоянным диполем и наведенным
(индуцированным) диполем
E ~ 1/r6
46.
T VasilievaВан-дер-ваальсовы взаимодействия
Связывание лекарственного вещества с рецептором
Стабилизация пространственной структуры белковой молекулы
Соединения включения, комплексы краун-эфиров
O
O
O
O
O
Дициклогексано-18-краун-6
(связывание К+)
O
Способность гекконов взбираться по гладким
поверхностям, например стеклу
http://ru.wikipedia.org
47.
T VasilievaГидрофобные взаимодействия
А
В
А, В – гидрофобные молекулы
- молекула воды
http://ru.wikipedia.org
А В
+ 6Н2О
48.
T VasilievaГибридные материалы





























 Химия
Химия








