Похожие презентации:
Классификация и номенклатура органических соединений. Гибридизация атома «С», химические связи
1.
Классификация иноменклатура
органических соединений.
Гибридизация атома «С»,
химические связи,
электронные эффекты.
2.
«Vita brevis,ars longa»
Жизнь коротка,
наука обширна.
3. Классификация орган. в-в
• 1. По углеродной цепи:Алифатические соед-я
Циклические соед-я
с открытой «С» цепью
Насыщ-е
Алканы
с замкнутой «С»цепью
Ненасыщ-е
Алкены,алкины
С развет- С неразветвлёнвлённой
ной цепью
Карбоциклические Гетероциклические
в цикл входит т. «С»
ЦАlk
Ar
в цикл входят «С,N,O,S»
насыщен-е ненасыщен-е
4. Классификация орган. в-в
• 2. По функциональным группам (ФГ)ФГ- это заместители неуглеводородного
характера, определяющие принадлежность в-ва к
определённому классу и его химические свойства.
Класс соединений ФГ Класс соединений ФГ
1.Галогенопроиз-е–I,-Сl,-Br 5.Нитропроизвод-е –NO2
2.Гидроксипроизв-е -ОН 6.Нитрилы
-СΞN
(спирты,фенолы)
7.Оксопроизводные
3.Алкоксипроизв-е -О- (альдегиды-CHO кетоны>C=O
(простые эфиры)
карбоновые к-ты –СООН)
4.Аминопроизв-е
8.Тиолы (тиоспирты)-SH
первич-е-NH2,втор.-NH-,третичн.амины-N<
5. Номенклатура ИЮПАК
• 1. Тривиальное (историческое) название• 2. Заместительная номенклатура:
Выбирается самая длинная углеводородная цепь и
нумеруется с того конца где:
а)больше разветвлений (алканы);
б) ближе кратные связи (алкены,алкадиены, алкины);
в)наличие старшей функциональной группы (ФГ)
(спирты, амины, кетоны и т.д.).
Далее перечисляются заместители в алфавитном
порядке с указанием порядкового номера, а в конце
указывается наименование углеводородной цепи .
6.
Названия в ненасыщенных соединенияхстроятся путем замены суффикса – ан в
соответствующем алкане на -ен (алкены),
Ξ –ин (алкины). При наличии двух и более
двойных связей применяются суффиксы –
адиен, -атриен и т.д.
• 3. Радикально-функциональная номен-ра:
Корень названия - старшая ФГ, остальные
радикалы перечисляют в приставке по
старшинству
7. Старшитство ФГ
O-COOH > -SO3H > -C N > -C
> C O > -OH > -SH >
H
-NH2 > -NO2 > -O- > C C > C C >-Br >-I >-Cl >-F
рост старшинства групп
8. Примеры номенклатуры
14 3
2 1
H3C CH C CH
2
3
H3C C CH3
ацетон (Т)
Br
O
пропанон-2 (З)
3-бромбутин-1 (З)
диметилкетон (РФ)
4
3
2
1
СН С СH CH2
бутен-1-ин-3 (З)
винилацетилен (РФ)
5 6
4
3
2
1
ментол (Т)
OH
5-метил2-изопропилциклогексанол-1 (З)
9. Гибридизация атома «С»
• Атом «С» в органич-х соед-ях 4-х валентен• ℓ⁻распологаются на S-АО
и p-АО
• При перекрывании АО образуются
гибридные АО, обеспечивающие более
прочные связи
гибридная AO
S-AO
+ p-AO
• В зависимости от числа всупивших в
гибридизацию АО атом «С» может
находиться в виде Sp3,Sp2,Sp - гибридизации
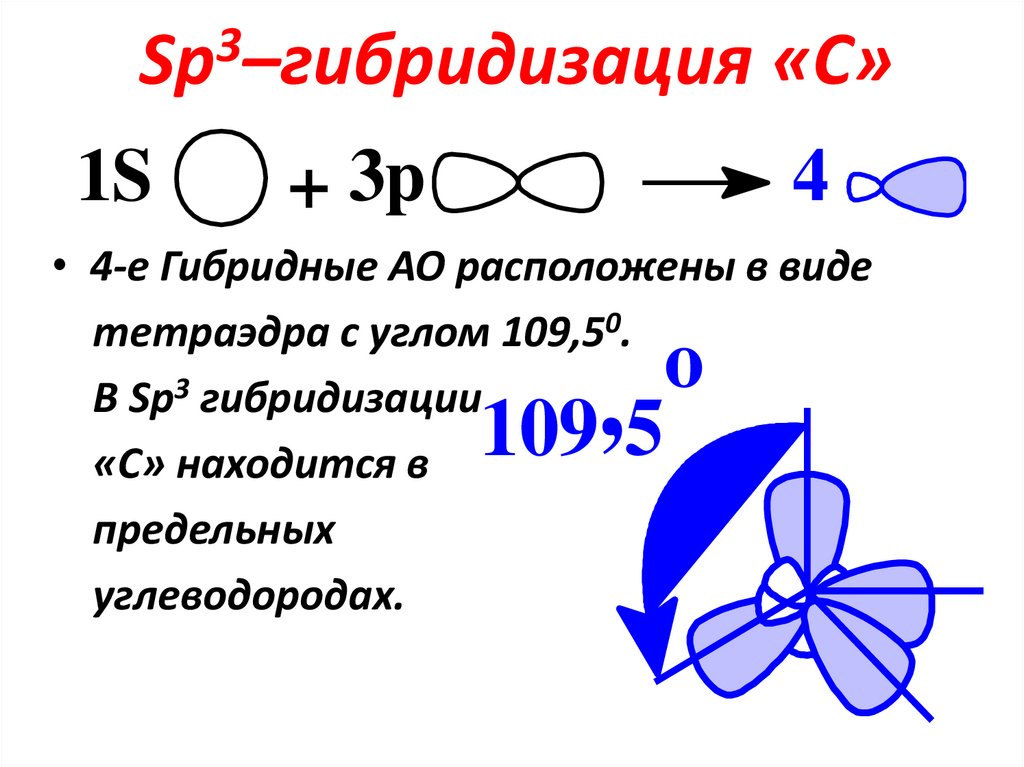
10. Sp3–гибридизация «С»
3Sp –гибридизация
1S
+ 3p
«С»
4
• 4-е Гибридные АО расположены в виде
тетраэдра с углом 109,50.
В Sp3 гибридизации
«С» находится в
предельных
углеводородах.
o
,
109 5
11. Sp3–гибридизация «С»,«О»,«N»
3Sp –гибридизация
«С»,«О»,«N»
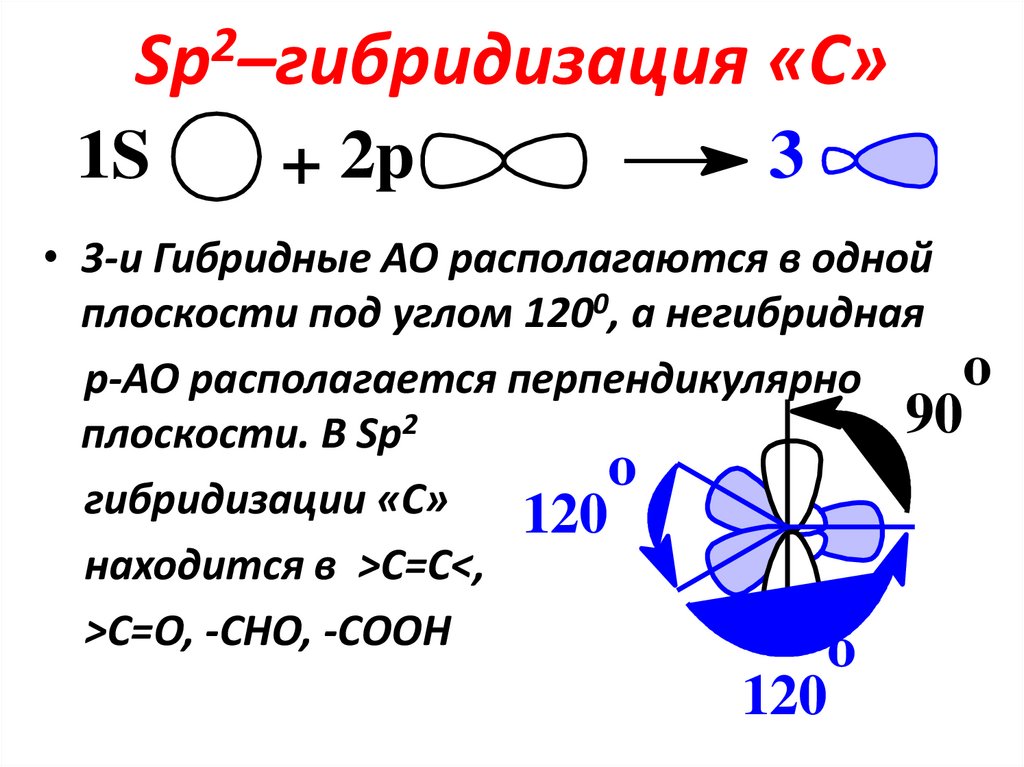
12. Sp2–гибридизация «С»
2Sp –гибридизация
1S
+ 2p
«С»
3
• 3-и Гибридные АО располагаются в одной
плоскости под углом 1200, а негибридная
o
p-АО располагается перпендикулярно
90
плоскости. В Sp2
o
гибридизации «С»
120
находится в >C=C<,
>C=O, -СНО, -СООН
o
120
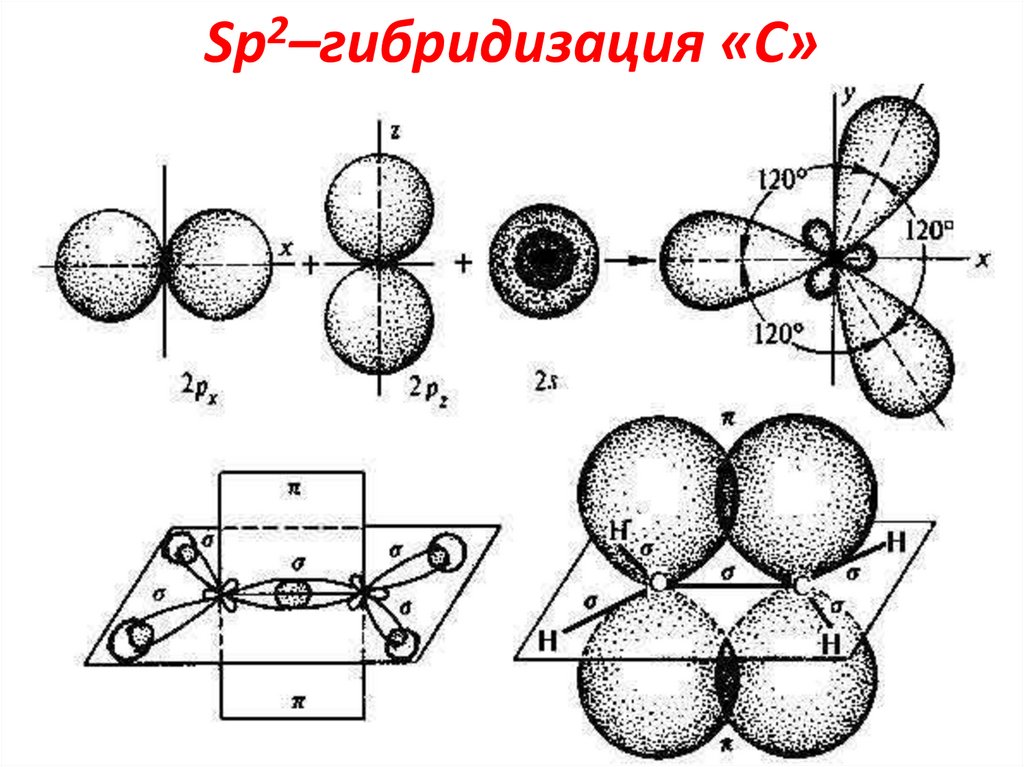
13. Sp2–гибридизация «С»
2Sp –гибридизация
«С»
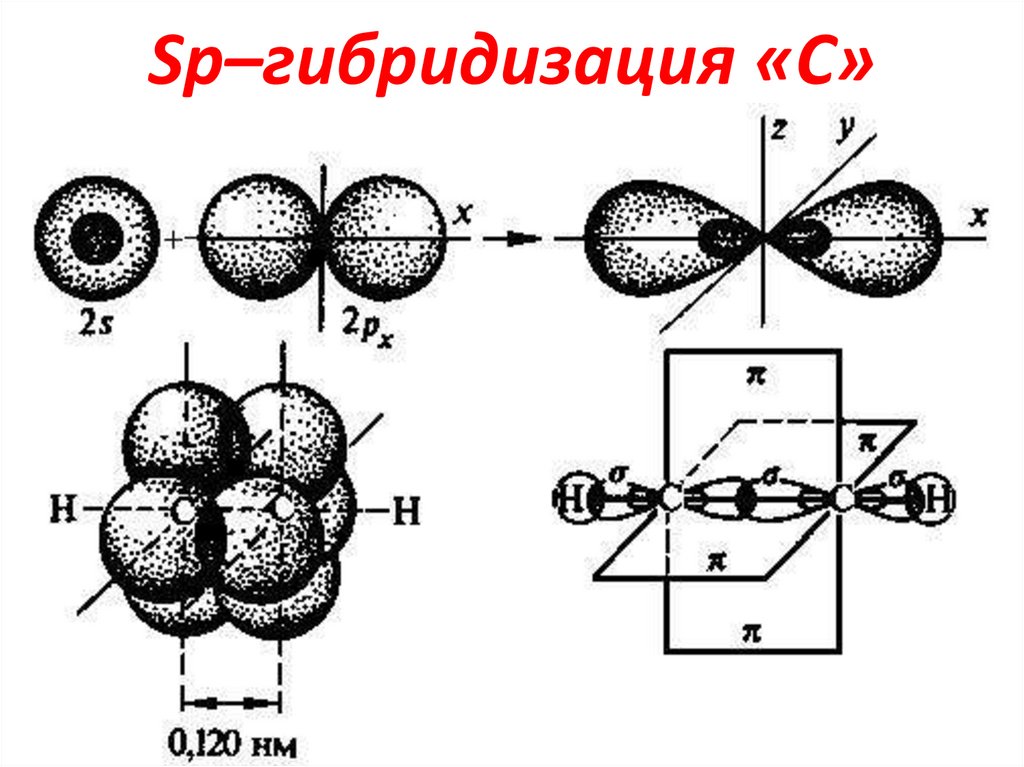
14. Sp–гибридизация «С»
1S2
+ 1p
• 2-е Гибридные АО расположены линейно в
одной плоскости под углом 1800, а 2-е
негибридные p-АО располагаются в 2-х
o
o
взаимоперпендикулярных
90
90
плоскостях. В Sp гибридизации «С» находится в
-СΞС-,-СΞN
o
180
15. Sp–гибридизация «С»
16. Химические связи:
• 1. Локализованная химическая связь:• 1.1. Ковалентная σ- и π-связь-образована за
счёт двух ℓ⁻ от каждого атома
• 1.2. Донорно-акцепторная (координацион-я)
связь - образована за счёт пары ℓ⁻одного
атома и вакантной орбитали другого атома
CH3
H3C N + HI
CH3
CH3
H3C NH
триметиламмоний
I
йодид
CH3
• 1.3. Семиполярная
• 1.4. Водородная
N
O
O
C2H5OH
OC2H5
H
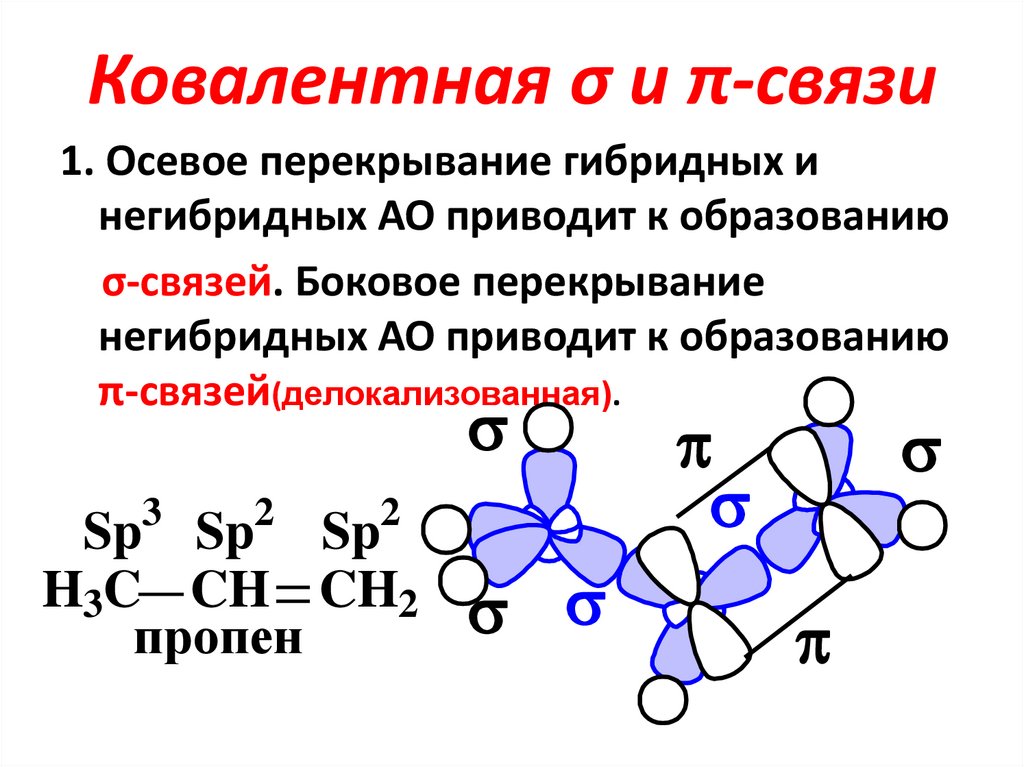
17. Ковалентная σ и π-связи
1. Осевое перекрывание гибридных инегибридных АО приводит к образованию
σ-связей. Боковое перекрывание
негибридных АО приводит к образованию
π-связей(делокализованная).
3
2
2
Sp Sp Sp
H3C CH CH2
пропен
18. Образование σ и π-связи
19. Характеристики ковалентной связи:
• 1. Энергия связи (Е) - мера прочности связи,чем↑Е, тем прочнее связь
C C
>
C C
>
C C
• 2. Длина связи - чем короче связь,тем ↑Е
2
3
Sp
Sp
Sp
связи
C C < C C
укорочение связи
<
C C
Связь укорачивается из-за перекрывания pАО,
чем короче связь, тем ↑Е связи, тем прочнее
связь
20. Характеристики ковалентной связи:
• 3. Полярность связи обусловленаэлектроотрицательностью атомов (ЭО)
• ЭО - это способность атома притягивать ℓ⁻
• Чем ↑разность ЭО, тем ↑полярность связи
F > O > N > Cl > Br > I > S = C > H
рост ЭО
2
3
CSp>CSp >CSp
• 4. Поляризуемость - мера смещения ℓ⁻связи
под действием внешнего электромагнитного
поля. Поляризуемость π-связи > σ-связи.
21. Электронные эффекты
• Смещение ℓ⁻плотности по σ-связи в сторонуболее ЭО атома называется индуктивным
эффектом (I)
• Заместитель стягивающий на себя из цепи
ℓ⁻плотность
H3C CH2
Cl I
проявляет –I
этилхлорид
• Заместитель нагнетающий в цепь
2 Sp3
ℓ⁻плотность
Sp
CH3
проявляет +I
толуол
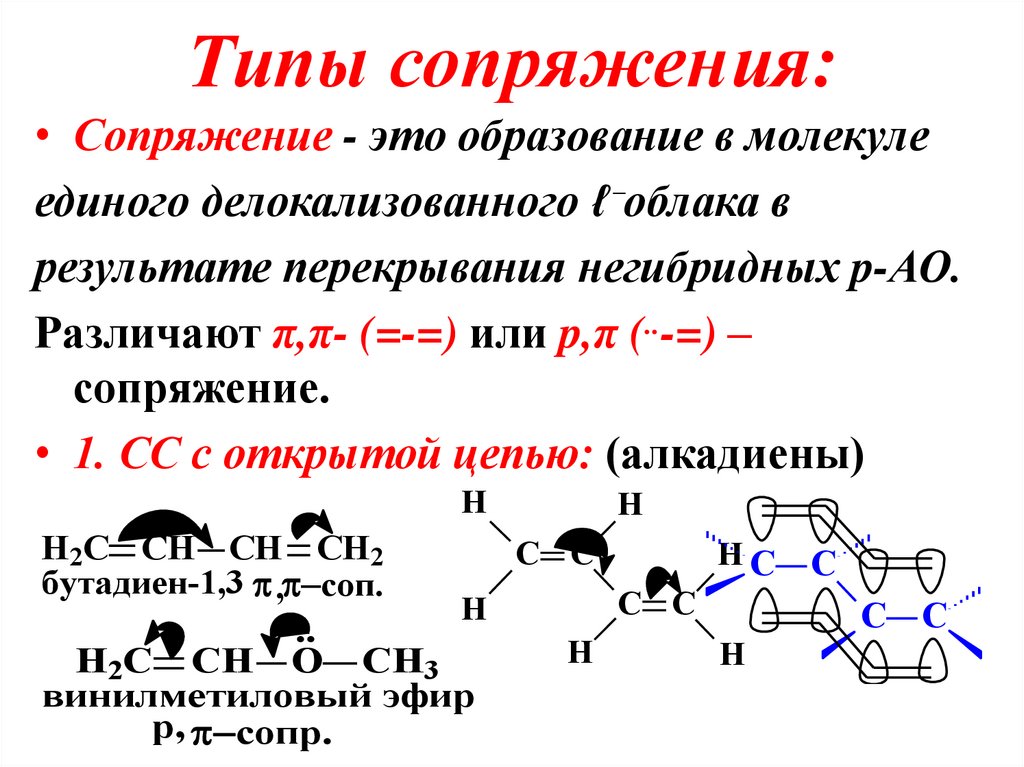
22. Типы сопряжения:
• Сопряжение - это образование в молекулеединого делокализованного ℓ⁻облака в
результате перекрывания негибридных p-АО.
Различают π,π- (=-=) или p,π (..-=) –
сопряжение.
• 1. СС с открытой цепью: (алкадиены)
H
H
H2C CH CH CH2
C C
HC C
бутадиен-1,3 , соп.
C C
H
C C
..
H
H
H2C CH O CH3
винилметиловый эфир
p, сопр.
23. Типы сопряжения
2. СС с замкнутой цепью:(арены,гетероциклы)
π,π-Сопряжение-перекрываются негибридные p-АО
π-связей
, сопряжение
p,π-Сопряжение – перекрываются негибридные pАО
гетероатома (N,O,S,Hal) и p-АО π-связи
p, сопр.
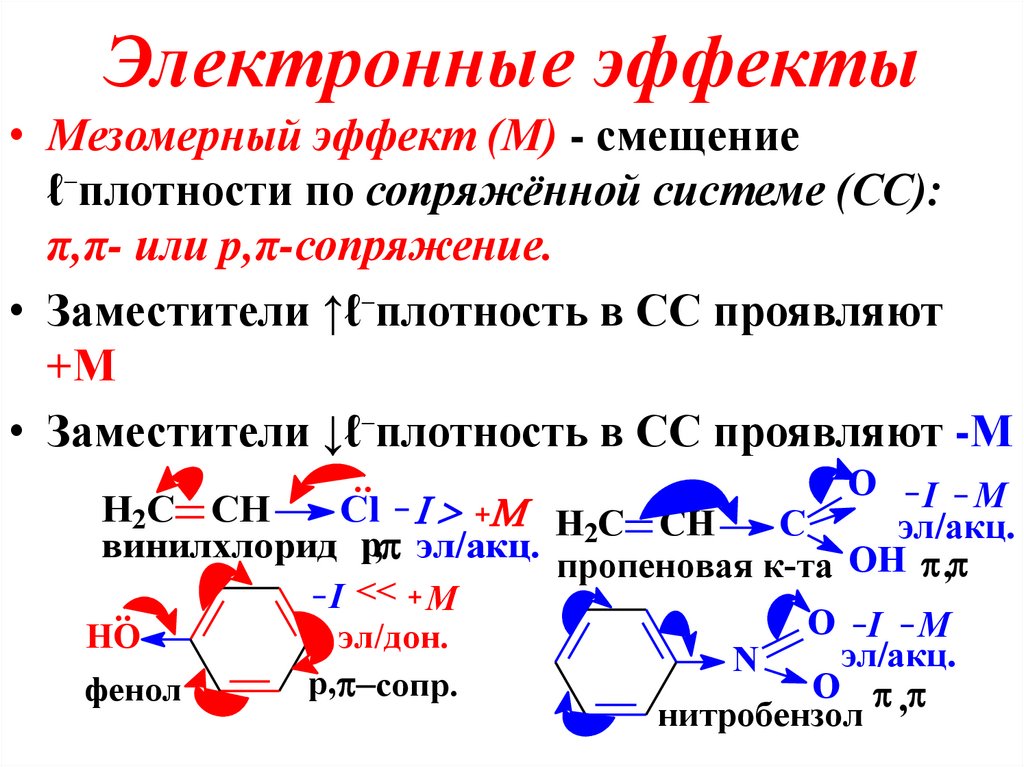
24. Электронные эффекты
• Мезомерный эффект (М) - смещениеℓ⁻плотности по сопряжённой системе (СС):
π,π- или p,π-сопряжение.
• Заместители ↑ℓ⁻плотность в СС проявляют
+М
• Заместители ↓ℓ⁻плотность в СС проявляют -М
O I M
H2C CH
Cl H C CH
C
эл/акц.
винилхлорид p, эл/акц. 2
пропеновая к-та OH ,
..
HO
фенол
I << M
эл/дон.
p, сопр.
O I M
эл/акц.
N
O ,
нитробензол
25. Заместители
• Заместители вытягивающие ℓ⁻плотность изцепи - электроно-акцепторные замест-ли
O
O
O
O
эл/акцепторы: N
, C
, C H , S OH, C N
O
OH
• Заместители нагнетающие
ℓ⁻плотность
в
O
цепь - электроно-донорные заместители
эл/доноры (Ar):
Alk,
..
NH2,
..
OH,
..
OAlk
26. Теория резонанса
• Резонансные структуры - это предельныеструктуры, вызванные смещением
ℓ⁻плотности по делокализованным
химическим связям:
H2C
CH
..
Cl
H2C
CH
Cl
27.
Спасибо завнимание!
Поздравляю с началом
учебного года!




















 Химия
Химия








