Похожие презентации:
Химические связи и взаимное влияние атомов в органических соединениях
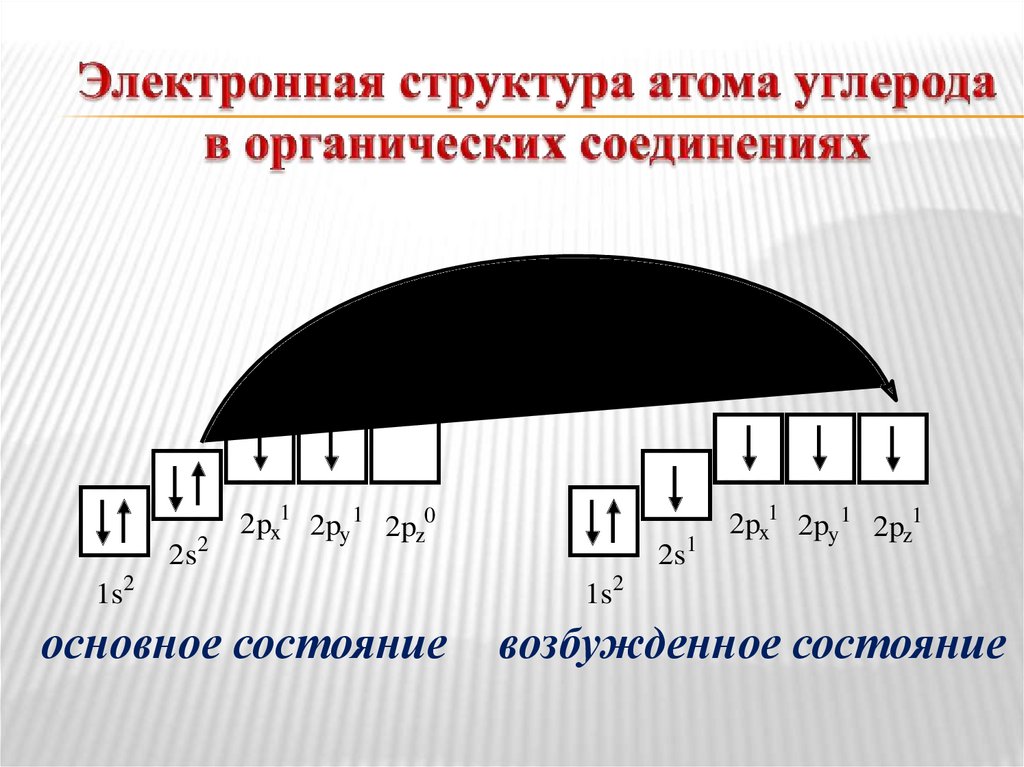
1.
2.
2s22px1 2py 1 2pz0
1s2
основное состояние
2s1
2px1 2py 1 2pz1
1s2
возбужденное состояние
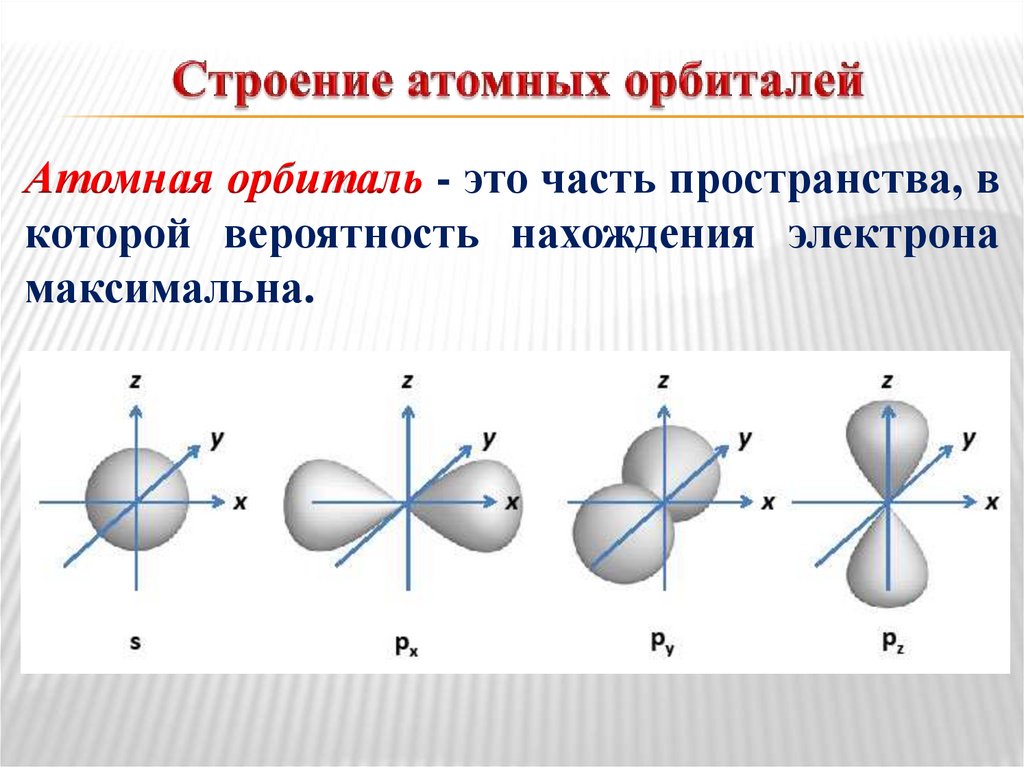
3.
Атомная орбиталь - это часть пространства, вкоторой вероятность нахождения электрона
максимальна.
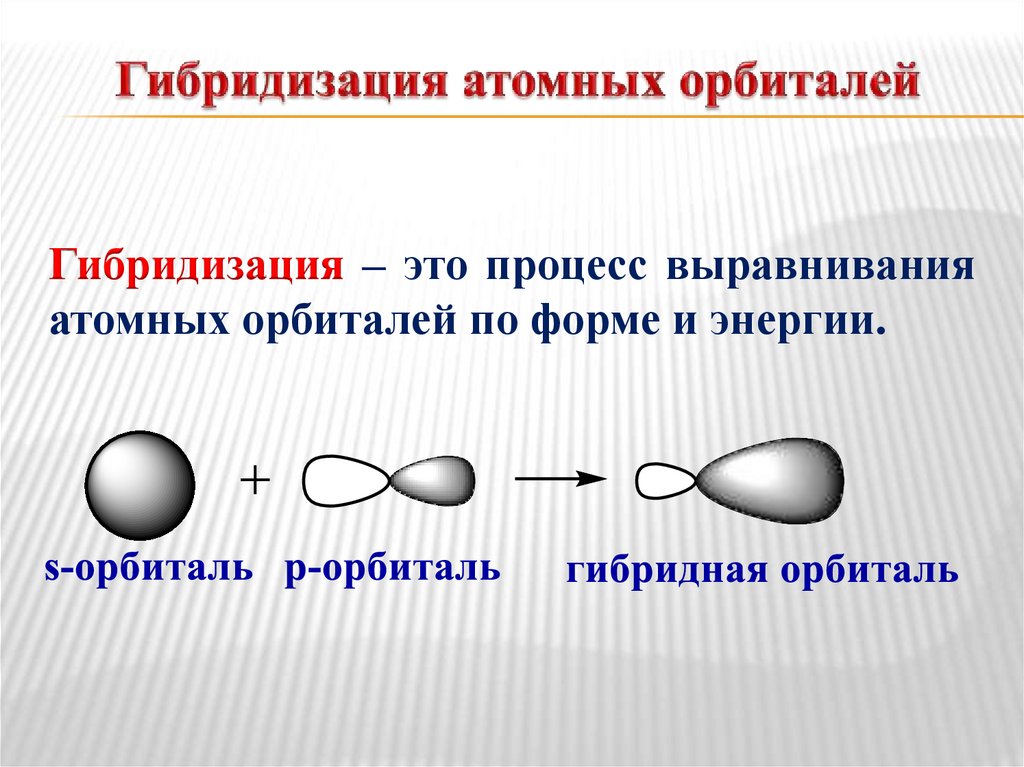
4.
Гибридизация – это процесс выравниванияатомных орбиталей по форме и энергии.
5.
Происходит смешение одной 2s- и трех 2р-орбиталей.Характерна для атомов углерода в насыщенных
углеводородах. Атом углерода в состоянии sp3гибридизации имеет тетраэдрическую конфигурацию.
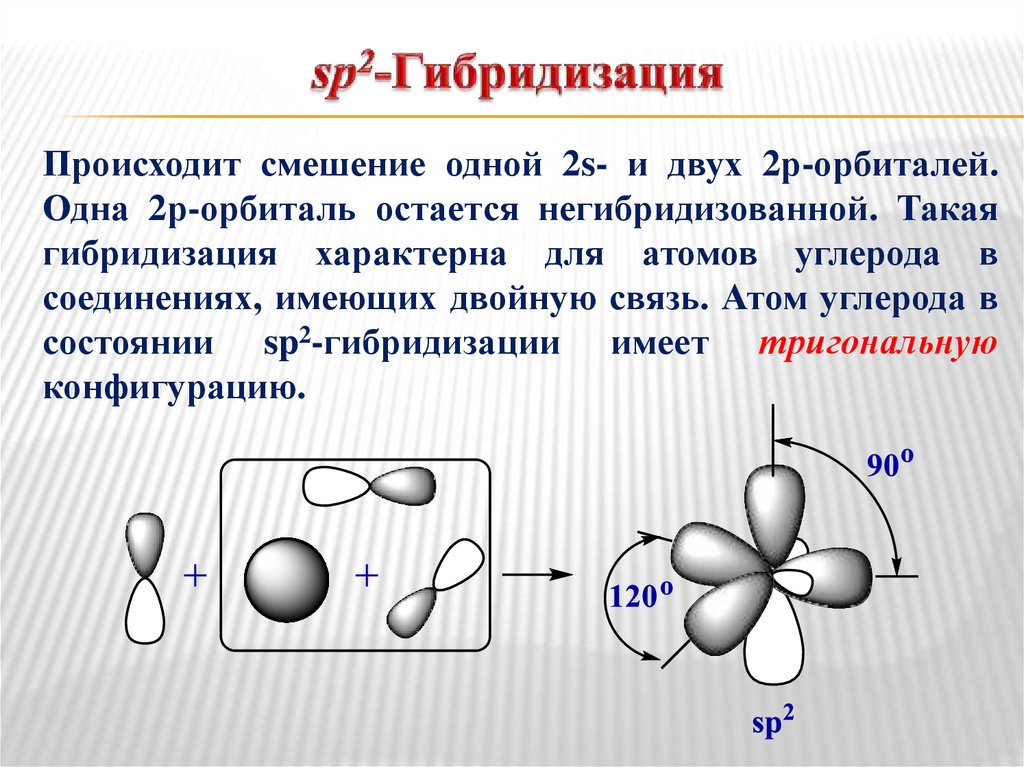
6.
Происходит смешение одной 2s- и двух 2р-орбиталей.Одна 2р-орбиталь остается негибридизованной. Такая
гибридизация характерна для атомов углерода в
соединениях, имеющих двойную связь. Атом углерода в
состоянии sp2-гибридизации имеет тригональную
конфигурацию.
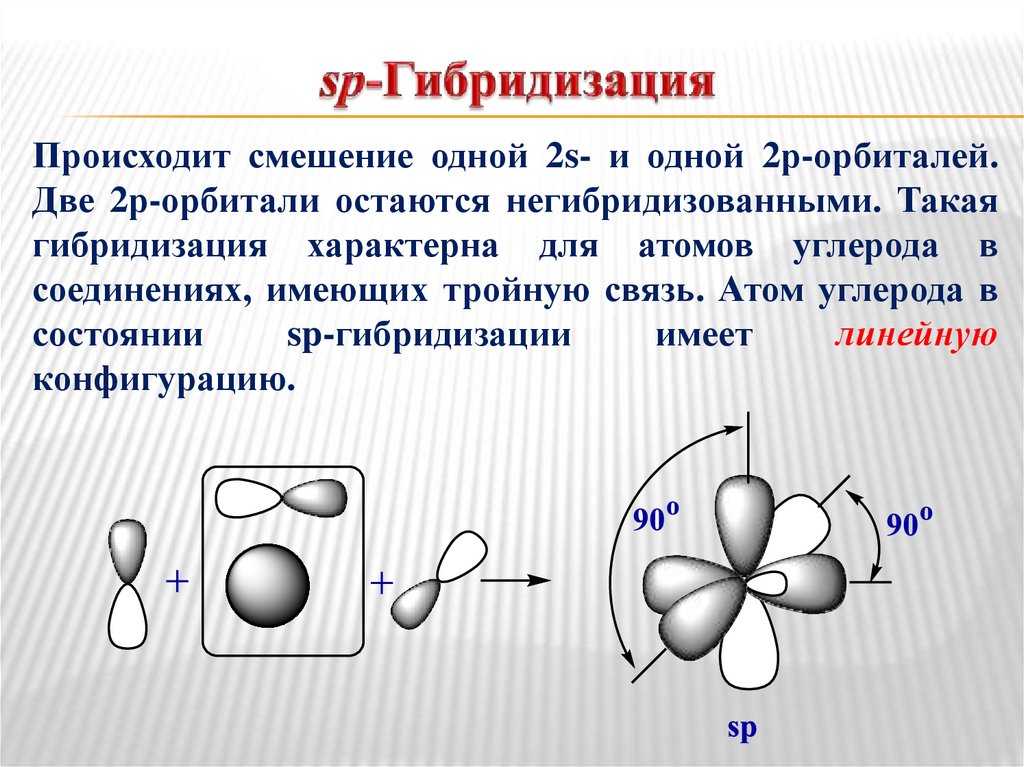
7.
Происходит смешение одной 2s- и одной 2р-орбиталей.Две 2р-орбитали остаются негибридизованными. Такая
гибридизация характерна для атомов углерода в
соединениях, имеющих тройную связь. Атом углерода в
состоянии
sp-гибридизации
имеет
линейную
конфигурацию.
8.
В органических соединениях преимущественновстречаются ковалентные связи – химические связи,
образованные
в
результате
обобществления
электронов связываемых атомов.
Ковалентные связи бывают двух видов:
- σ - связи;
- π - связи.
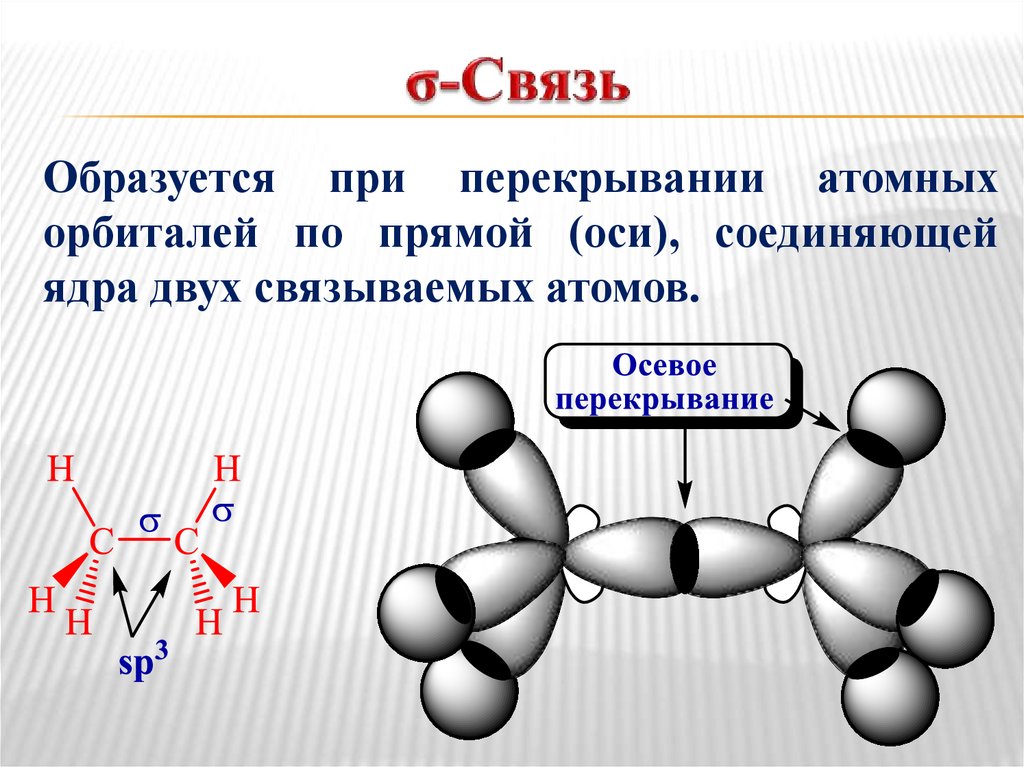
9.
Образуется при перекрывании атомныхорбиталей по прямой (оси), соединяющей
ядра двух связываемых атомов.
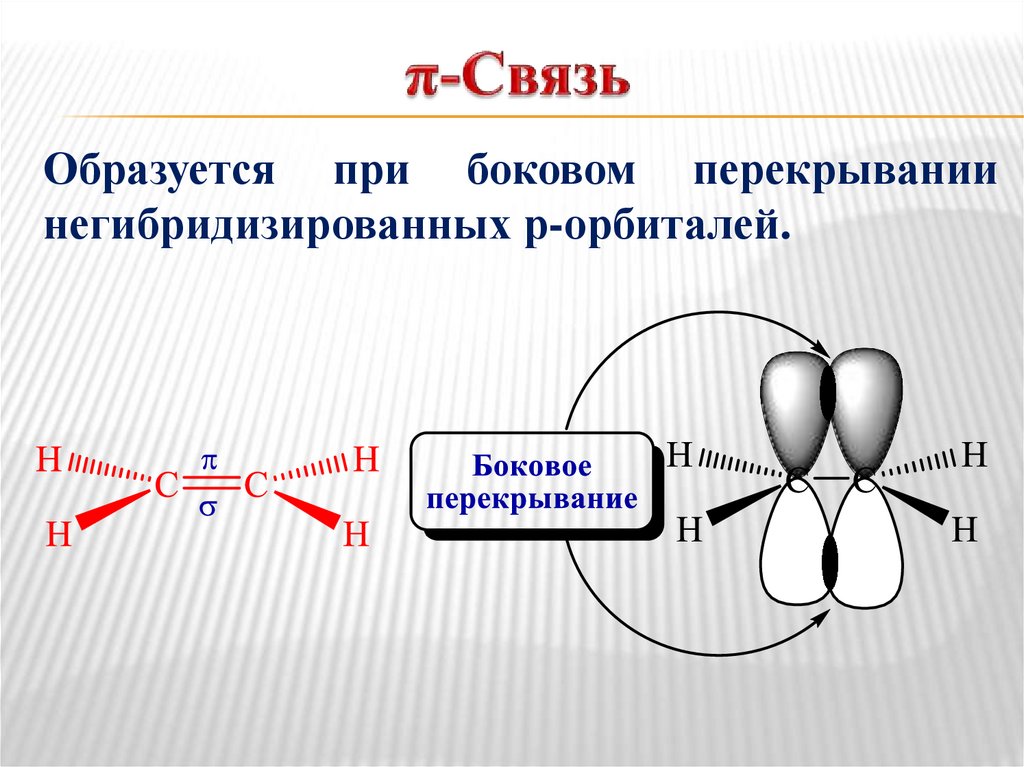
10.
Образуется при боковом перекрываниинегибридизированных р-орбиталей.
11.
Тип связиЭнергия связи,
кДж/моль
Длина связи,
нм
С–С
348
0,154
С=С
620
0,134
С≡С
814
0,120
12.
Электроотрицательность – это способность атома в молекулепритягивать электроны, участвующие в образовании
химической связи.
Лайнус
Полинг
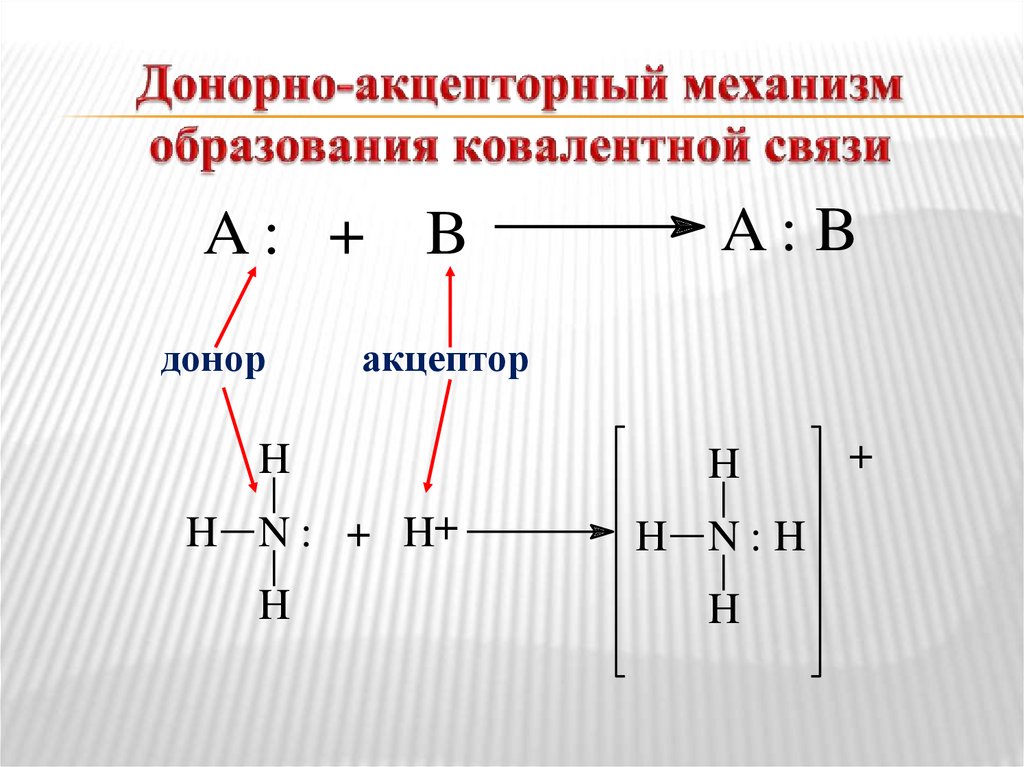
13.
A: + Bдонор
акцептор
H
H N : + H+
H
A: B
H
H N:H
H
+
14.
Характернадля
органических
соединений,
имеющих атомы водорода, связанные с сильно
электроотрицательными атомами (фтора, азота,
кислорода).
Энергия водородной связи — 12,5 - 20 кДж/моль
15.
Локализованная связь – это ковалентная связь,электронная пара которой находится в поле двух
ядер и охватывает только два атома.
Делокализованная связь – это ковалентная связь,
молекулярные орбитали которой охватывают
более двух атомов.
Сопряжение – это образование в молекуле
единого делокализованного электронного облака
в результате перекрывания р-орбиталей.
16.
Все атомы, участвующие в образованиисопряженной системы, находятся в sр2гибридизации;
рZ-орбитали всех атомов, образующих
сопряженную систему, перпендикулярны
плоскости -скелета, т. е. параллельны друг
другу.
17.
Наблюдается при чередовании в системепростых и кратных связей.
бутадиен-1,3
Гипотетическая структура
Выравнивание связей и
зарядов за счет сопряжения
18.
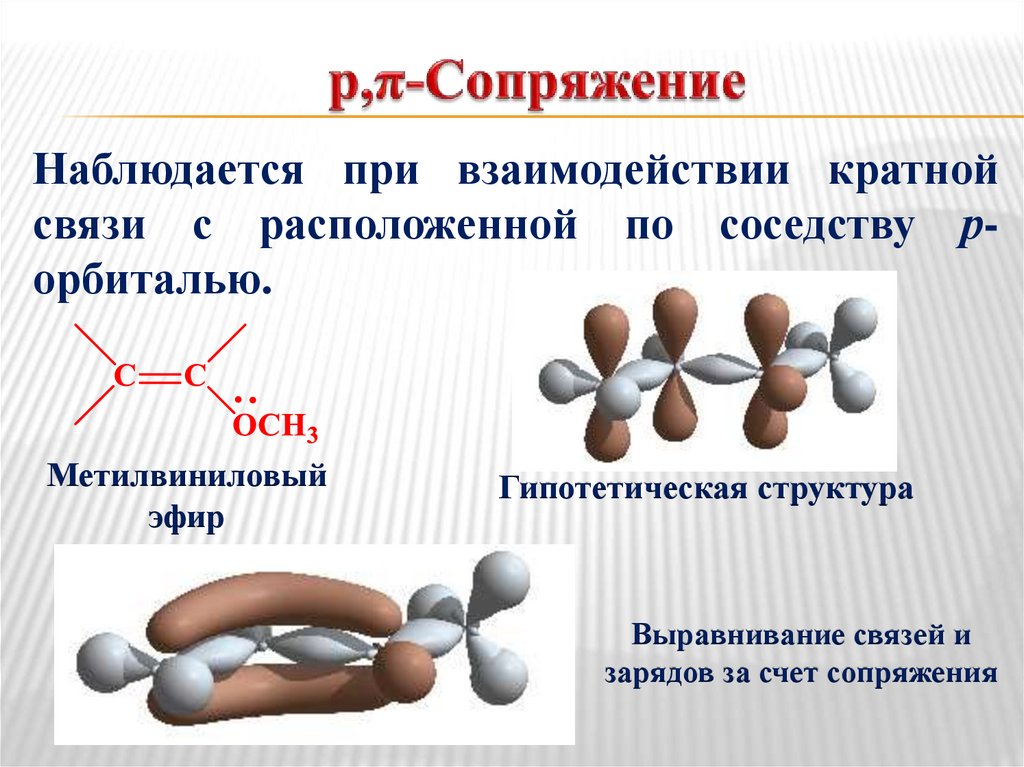
Наблюдается при взаимодействии кратнойсвязи с расположенной по соседству рорбиталью.
Метилвиниловый
эфир
Гипотетическая структура
Выравнивание связей и
зарядов за счет сопряжения
19.
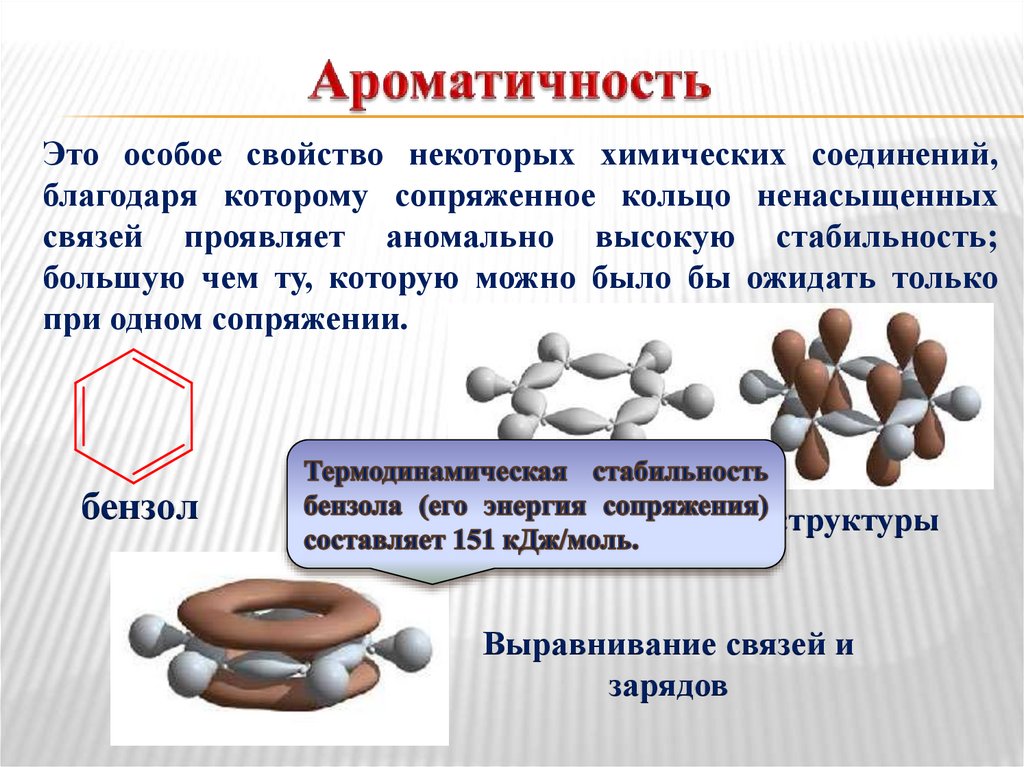
Это особое свойство некоторых химических соединений,благодаря которому сопряженное кольцо ненасыщенных
связей проявляет аномально высокую стабильность;
большую чем ту, которую можно было бы ожидать только
при одном сопряжении.
бензол
Гипотетические структуры
Выравнивание связей и
зарядов
20.
Ароматическиесоединения
бензоидные
небензоидные
гетероциклические
21.
22.
Взаимное влияние атомов в молекулахпередается с помощью электронных и
пространственных эффектов:
Индуктивный эффект
Эффект поля
Мезомерный эффект
23.
Индуктивный эффект (I) передача электронного влияниязаместителя в результате смещения электронов -связей.
присутствует в любой полярной молекуле;
является затухающим (распространяется не более чем на
три связи).
СН3 СН2 Сl
-I-эффект
CH3 CH2 MgCl
+I-эффект
Заместитель, притягивающий электронную плотность -связи сильнее,
чем атом водорода, проявляет отрицательный индуктивный эффект (–I).
Заместитель, смещающий электронную плотность -связи от себя,
проявляет положительный индуктивный эффект (+I).
24.
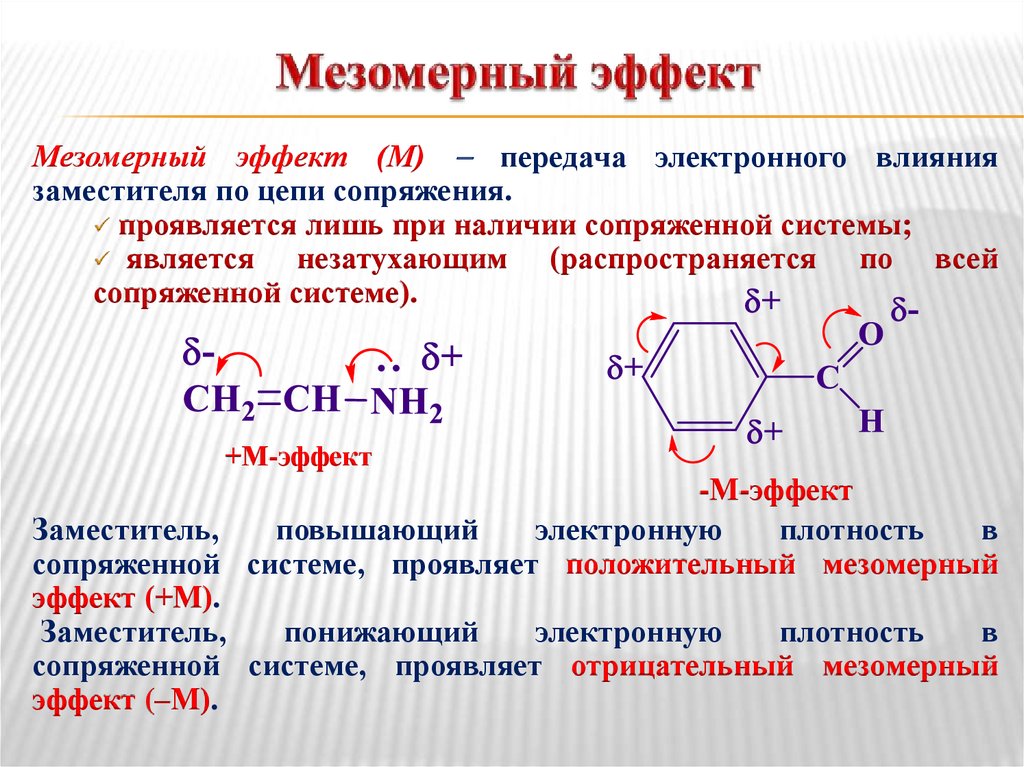
Мезомерный эффект (М) передача электронного влияниязаместителя по цепи сопряжения.
проявляется лишь при наличии сопряженной системы;
является
незатухающим (распространяется по всей
сопряженной системе).
+М-эффект
-М-эффект
Заместитель,
повышающий
электронную
плотность
в
сопряженной системе, проявляет положительный мезомерный
эффект (+М).
Заместитель,
понижающий
электронную
плотность
в
сопряженной системе, проявляет отрицательный мезомерный
эффект (–М).
25.
Электронные эффектыЗаместитель
Суммарное
электронное
влияние
заместителя
индуктивный
мезомерный
Алкил- (R)
+I
-
электронодонор
−NH2, −NHR, −NR2,
−OH, −OR
-I
+M
+M > −I
электронодонор
Галогены
-I
+M
−I > +M
электроноакцептор
−NO2, −COOH,
−CN, −SO3H, >C=O
-I
-M
электроноакцептор














 Химия
Химия








