Похожие презентации:
Типы химических реакций
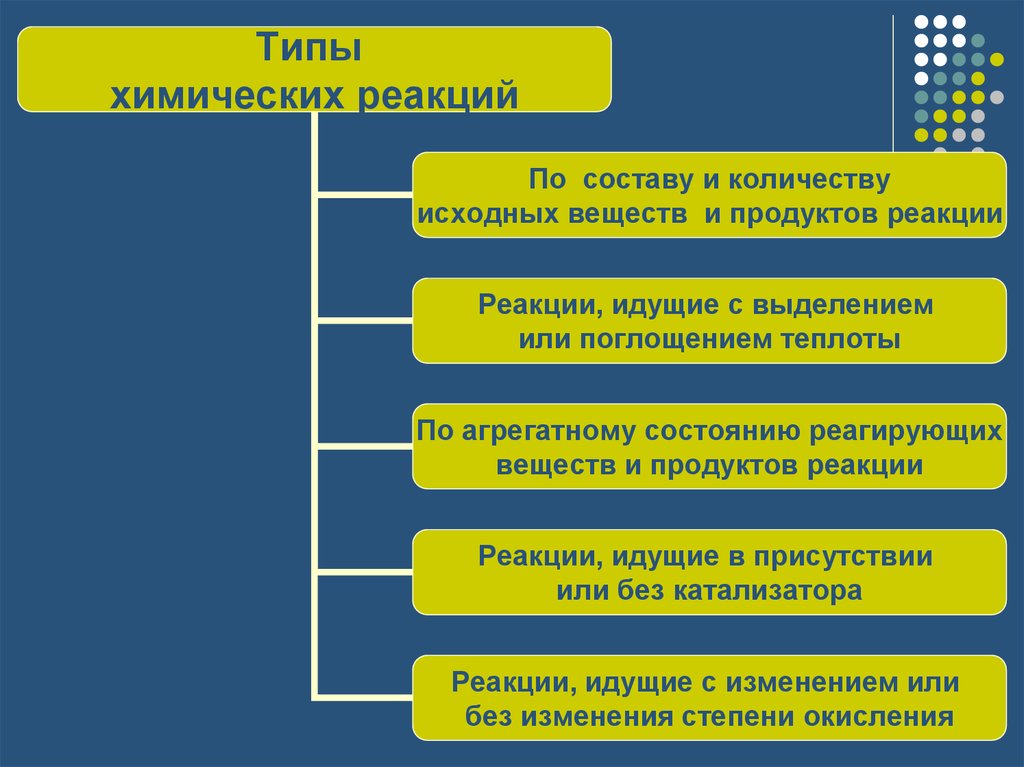
1. Типы химических реакций
2.
Типыхимических реакций
По составу и количеству
исходных веществ и продуктов реакции
Реакции, идущие с выделением
или поглощением теплоты
По агрегатному состоянию реагирующих
веществ и продуктов реакции
Реакции, идущие в присутствии
или без катализатора
Реакции, идущие с изменением или
без изменения степени окисления
3. По составу и количеству исходных веществ и продуктов реакции:
Реакции соединенияЭТО ТАКИЕ РЕАКЦИИ,
В РЕЗУЛЬТАТЕ КОТОРЫХ
ИЗ НЕСКОЛЬКИХ ПРОСТЫХ ИЛИ
СЛОЖНЫХ ВЕЩЕСТВ ПОЛУЧАЕТСЯ
ОДНО СЛОЖНОЕ ВЕЩЕСТВО
4. Fe + S FeS
Fe + S FeS5. Реакции разложения
ЭТО ТАКИЕ РЕАКЦИИ,В РЕЗУЛЬТАТЕ КОТОРЫХ
ИЗ ОДНОГО СЛОЖНОГО
ВЕЩЕСТВА ПОЛУЧАЮТСЯ
НЕСКОЛЬКО ПРОСТЫХ ИЛИ
СЛОЖНЫХ ВЕЩЕСТВ
6. 2KMnO4 K2MnO4 + MnO2 + O2
2KMnO4 K2MnO4 + MnO2 + O27. Реакции замещения
ЭТО РЕАКЦИИ МЕЖДУ ОДНИМПРОСТЫМ И ОДНИМ СЛОЖНЫМ
ВЕЩЕСТВАМИ, В РЕЗУЛЬТАТЕ
КОТОРЫХ АТОМЫ ПРОСТОГО
ВЕЩЕСТВА ЗАМЕЩАЮТ АТОМЫ
ОДНОГО ИЗ ЭЛЕМЕНТОВ В
СЛОЖНОМ ВЕЩЕСТВЕ
8. Fe + CuSO4 FeSO4 + Cu
Fe + CuSO4 FeSO4 + Cu9. Реакции обмена
ЭТО РЕАКЦИИ МЕЖДУ ДВУМЯСЛОЖНЫМИ ВЕЩЕСТВАМИ, В
РЕЗУЛЬТАТЕ КОТОРЫХ ОНИ
ОБМЕНИВАЮТСЯ СВОИМИ
СОСТАВНЫМИ ЧАСТЯМИ
10. Fe2O3 +3H2SO4Fe2 (SO4 )3+3H2O
Fe2O3 +3H2SO4 Fe2 (SO4 )3+3H2O11. Реакции, идущие с выделением или поглощением теплоты:
Экзотермические реакцииЭТО РЕАКЦИИ, ИДУЩИЕ
С ВЫДЕЛЕНИЕМ ТЕПЛОТЫ
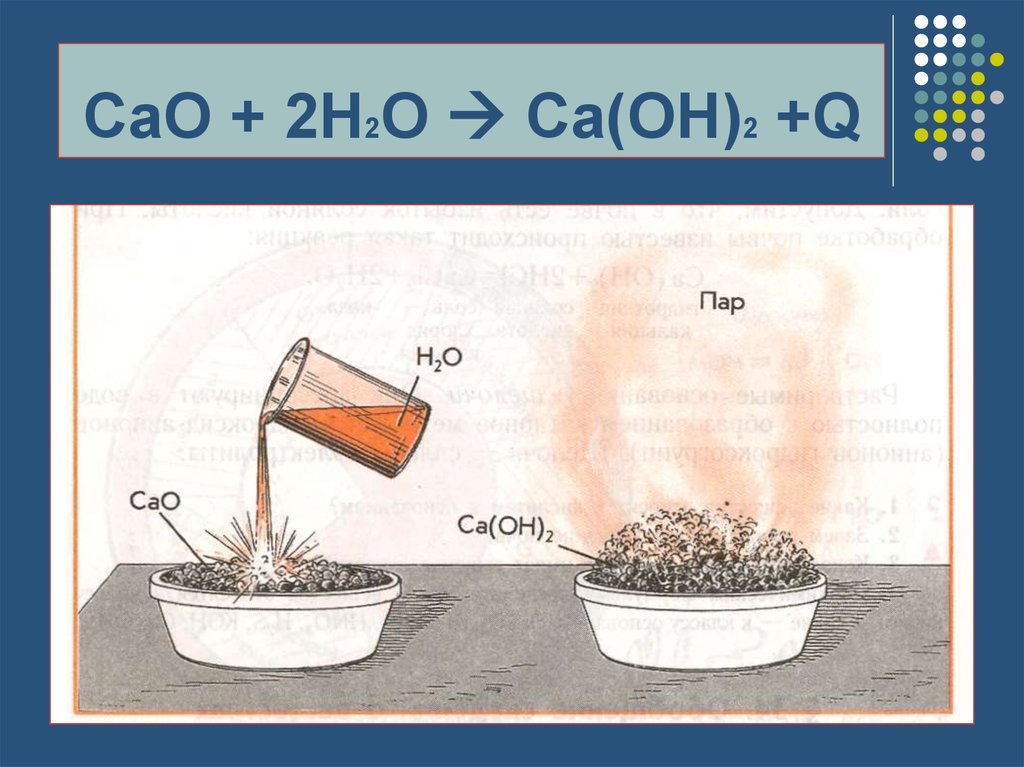
12. CaO + 2H2O Ca(OH)2 +Q
CaO + 2H2O Ca(OH)2 +Q13. Эндотермические реакции
ЭТО РЕАКЦИИ, ИДУЩИЕ СПОГЛОЩЕНИЕМ ТЕПЛОТЫ
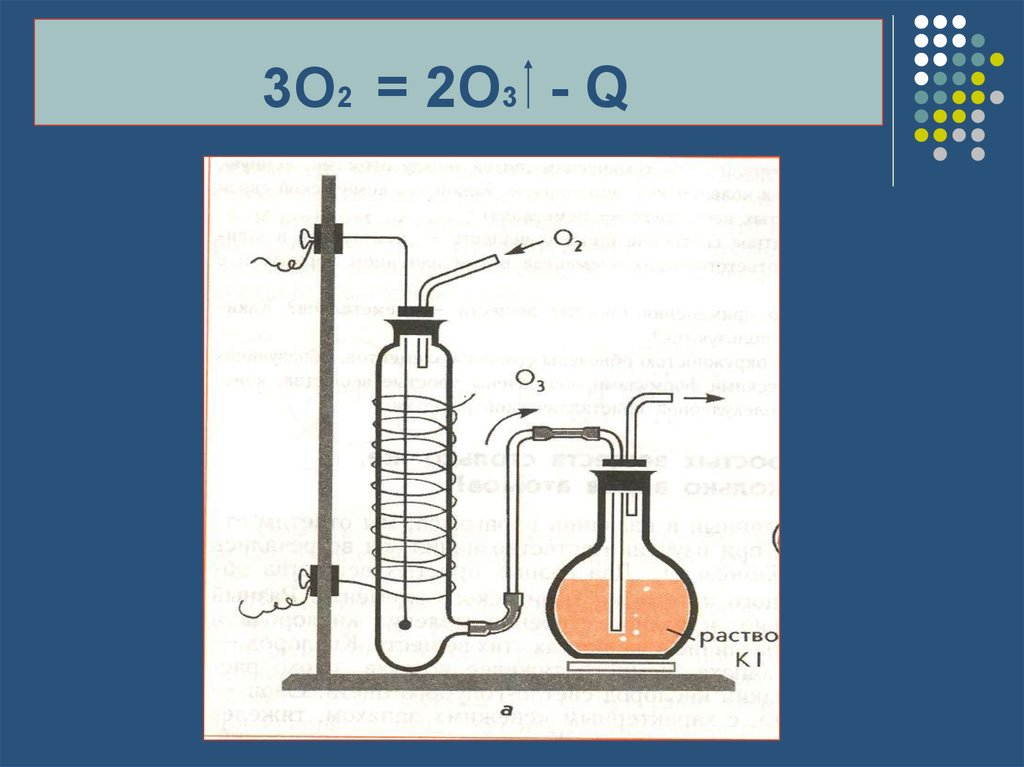
14. 3O2 = 2O3 - Q
15. По агрегатному состоянию исходных веществ и продуктов реакции:
Гетерогенные реакцииЭТО РЕАКЦИИ, В КОТОРЫХ
РЕАГИРУЮЩИЕ ВЕЩЕСТВА И
ПРОДУКТЫ РЕАКЦИИ НАХОДЯТСЯ В
РАЗНЫХ АГРЕГАТНЫХ
СОСТОЯНИЯХ
16. Гомогенные реакции
ЭТО РЕАКЦИИ, В КОТОРЫХРЕАГИРУЮЩИЕ ВЕЩЕСТВА И
ПРОДУКТЫ РЕАКЦИИ НАХОДЯТСЯ В
ОДНОМ АГРЕГАТНОМ СОСТОЯНИИ
17. Реакции, идущие в присутствии или без катализатора:
Каталитические реакцииЭТО РЕАКЦИИ, ИДУЩИЕ В
ПРИСУТСТВИИ КАТАЛИЗАТОРА
Некаталитические реакции
ЭТО РЕАКЦИИ, ИДУЩИЕ БЕЗ
КАТАЛИЗАТОРА
18. Реакции, идущие с изменением или без изменения степени окисления:
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕРЕАКЦИИ
ЭТО РЕАКЦИИ, В РЕЗУЛЬТАТЕ
КОТОРЫХ ИЗМЕНЯЕТСЯ СТЕПЕНЬ
ОКИСЛЕНИЯ НЕ МЕНЕЕ ЧЕМ У ДВУХ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
19. Реакции, идущие без изменения степени окисления
НАПРИМЕР, РЕАКЦИИ ИОННОГООБМЕНА
NaOH + HCl NaCl + H2O
20. Проверь себя. Определи к какому типу реакций можно отнести следующие:
a)р.соединения, гетерогеннаяокислительно-восстановит.;
b)р.разложения,гетерогенная
b) CaCO3 CaO + CO2
с)р.замещения,гетерогенная,
c) CuO + H2 H2O + Cu окислительно-восстановит.;
d) 2SO2 + O2 2SO3 +Q d)р.соединения,экзотермическая,окислит.-восстановител
е)р.обмена,гетерогенная;
e) Ca(OH)2 + H2SO4
f)р.разложения,эндотерми CaSO4 + 2H2O
ческая,гетнрогенная,окислиf) 2H2O 2H2 + O2 - Q
тельно-восстановительная.
a) 2Na + Cl2 2NaCl
21. ЖЕЛАЮ УСПЕХОВ В ИЗУЧЕНИИ УВЛЕКАТЕЛЬНОЙ НАУКИ - Х И М И И !
ЖЕЛАЮ УСПЕХОВ ВИЗУЧЕНИИ
УВЛЕКАТЕЛЬНОЙ НАУКИ
-ХИМИИ!


















 Химия
Химия








