Похожие презентации:
Алкени, їх ізомерія та номенклатура
1. Тема заняття: Характеристика будови та властивостей алкенів, їх ізомерія та номенклатура.
2. План заняття:
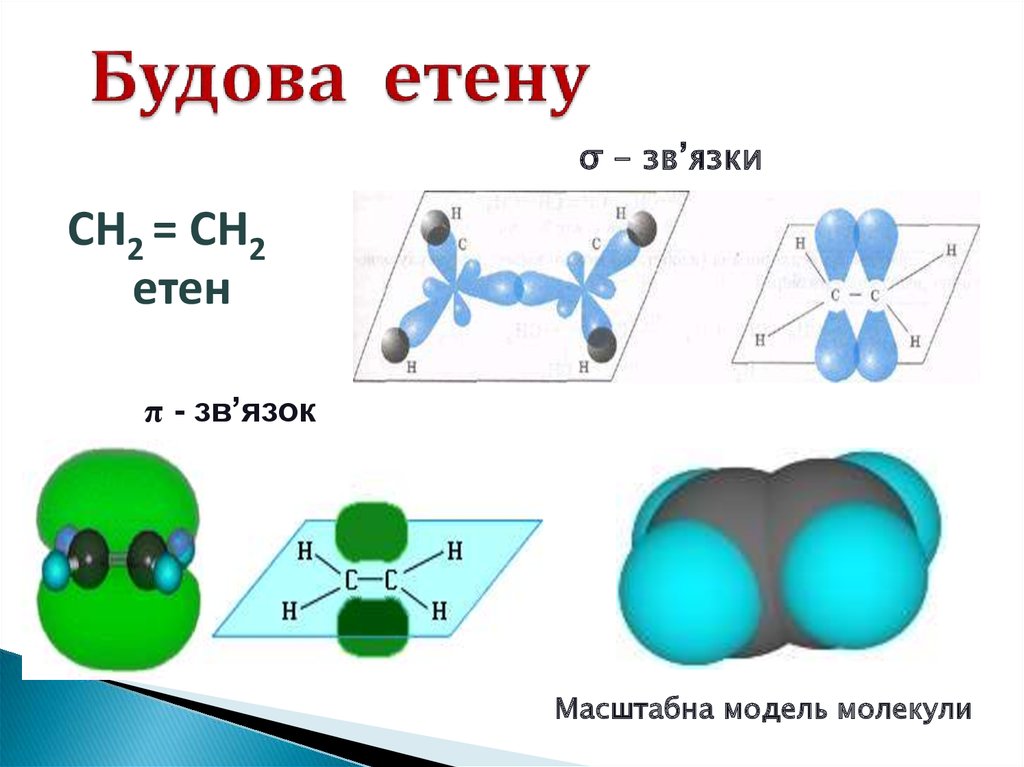
1. Будова молекули етену: структурна таелектронна. Поняття про подвійний зв’язок.
2. Фізичні та хімічні властивості етену.
3. Механізм реакції полімеризації. Добування
та використання етену.
4. Гомологічний ряд алкенів, загальна
формула та властивості.
5. Ізомерія та номенклатура ненасичених
вуглеводнів ряду алкенів.
3. Будова етену
σ - зв’язкиСН2 = СН2
етен
π - зв’язок
Масштабна модель молекули
4. Фізичні властивості етену
С2Н4безбарвний газ;
погано розчинний у воді, але добре
розчинний в органічних розчинниках;
tплавл = - 169,2 ̊С;
ρ=1,17г/л;
вибухонебезпечний.
tкип = - 103,7 ̊С;
5. Хімічні властивості етену
1. Горіння (з виділенням великої кількості теплоти):С2Н4 + 3O2 → 2СО2↑+2Н2О
Реакції приєднання по місцю розриву
π - зв’язку: СН2 = СН2
2. Гідрування - приєднання водню: С2Н4 + Н2→ С2Н6
3. Галогенування - приєднання галогенів:
СН2 = СН2 + Br2 →СН2 Br- СН2 Br 1,2-диброметан
4. Якісне визначення ненасичених
вуглеводнів - знебарвлення розчину
калій перманганату і бромної води.
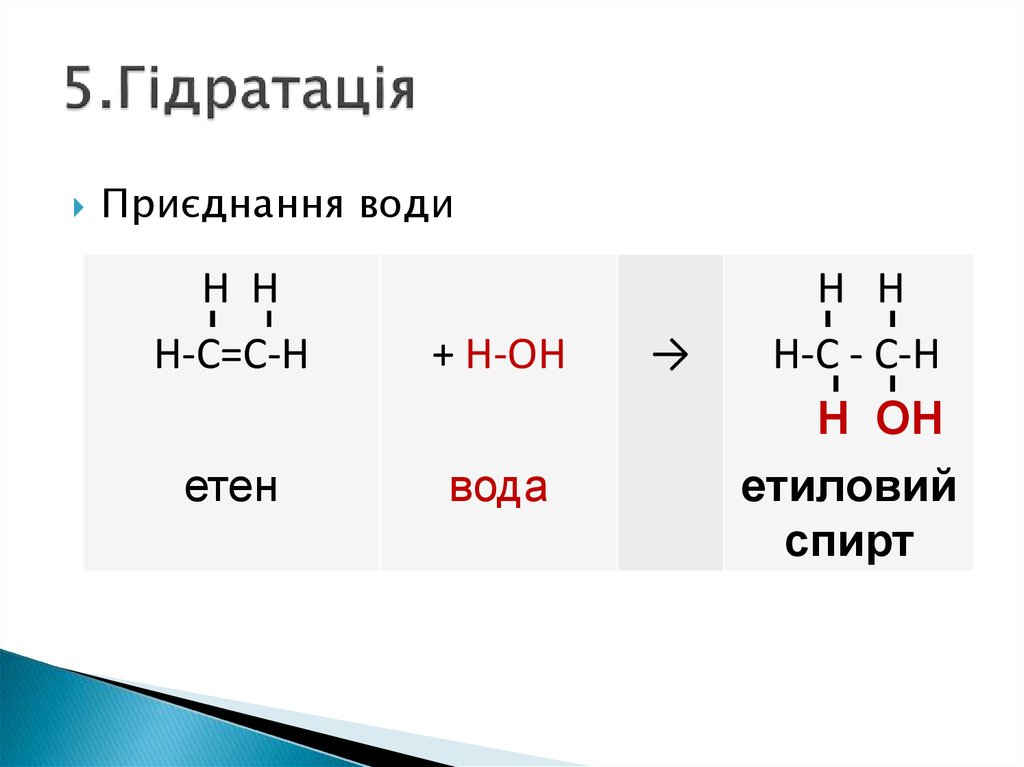
6. 5.Гідратація
Приєднання водиН Н
Н-С=С-Н
+ H-OН
етен
вода
→
Н Н
Н-С - С-Н
Н ОН
етиловий
спирт
7.
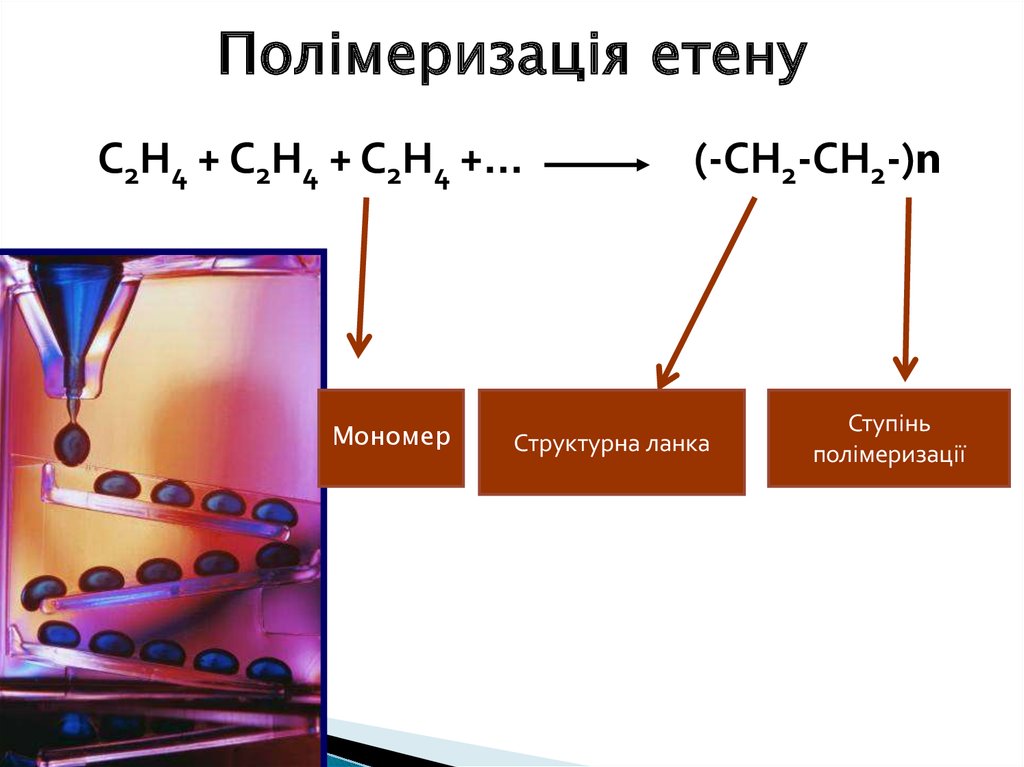
Хімічні властивості етену8.
Полімеризація етенуС2Н4 + С2Н4 + С2Н4 +…
Мономер
(-СН2-СН2-)n
Структурна ланка
Ступінь
полімеризації
9.
10.
СПОСОБИОТРИМАННЯ АЛКЕНІВ
ПРОМИСЛОВІ
КРЕКІНГ
АЛКАНІВ
ДЕГІДРУВАННЯ
АЛКАНІВ
ЛАБОРАТОРНІ
ДЕГІДРАТАЦІЯ
СПИРТІВ
ДЕГАЛОГЕНУВАННЯ
ДЕГІДРОГАЛОГЕНУВАННЯ
11.
12.
13.
14.
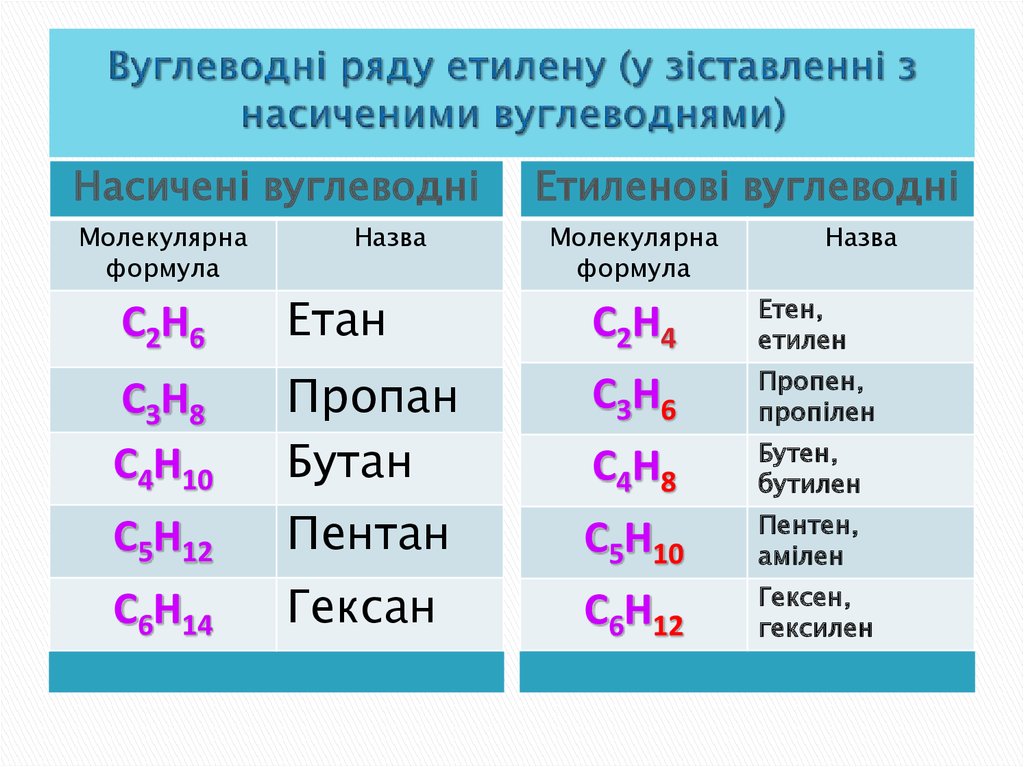
15. Вуглеводні ряду етилену (у зіставленні з насиченими вуглеводнями)
Насичені вуглеводніМолекулярна
формула
Назва
Етиленові вуглеводні
Молекулярна
формула
Назва
С2Н6
Етан
С2Н4
Етен,
етилен
С3Н8
С4Н10
Пропан
Бутан
С3Н6
Пропен,
пропілен
С4Н8
Бутен,
бутилен
С5Н12
Пентан
С5Н10
Пентен,
амілен
С6Н14
Гексан
С6Н12
Гексен,
гексилен
16. Фізичні властивості АЛКЕНІВ
• Алкени погано розчиняються у воді, аледобре в органічних розчинниках.
• Із зростанням карбонового ланцюга
збільшується температура кипіння та
плавлення, а також густина.
С2– С4 - гази
С5– С16 - рідини
С17… - тверді речовини
17.
18. 4.Гідрогенгалогенування
Правило МарковніковаРосійський хімік-органік.
Атом Гідрогену приєднується до
найбільш гідрогенізованого атома
Карбону, а атом галогену – до найменш
гідрогенізованого.
13.02.2017
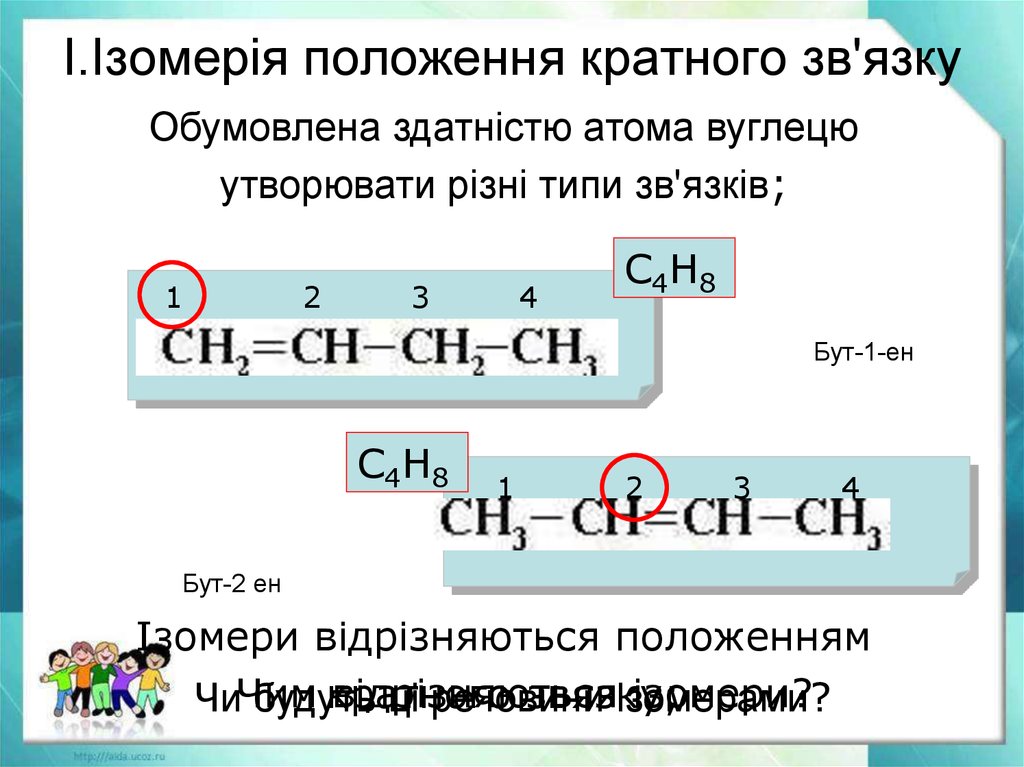
19. І.Ізомерія положення кратного зв'язку
Обумовлена здатністю атома вуглецюутворювати різні типи зв'язків;
1
2
3
4
С4Н8
Бут-1-ен
С4Н8
1
2
3
4
Бут-2 ен
Ізомери відрізняються положенням
відрізняються
ізомери?
кратного
звязку;
ЧиЧим
будуть
ці речовини
ізомерами?
20. ІІ. Ізомерія карбонового скелета
54
3
2
1
СН3─ СН2─ СН─ СН= СН2
│
СН3
3 метил пент-1-ен
1
2
3
4
5
СН2= СН─ СН ─ СН2─ СН2
│
СН3
3 метил пент-1-ен
СН3
4
│3 2 1
СН3─ С─ СН= СН2
│
СН3
3,3 диметил бут-1-ен
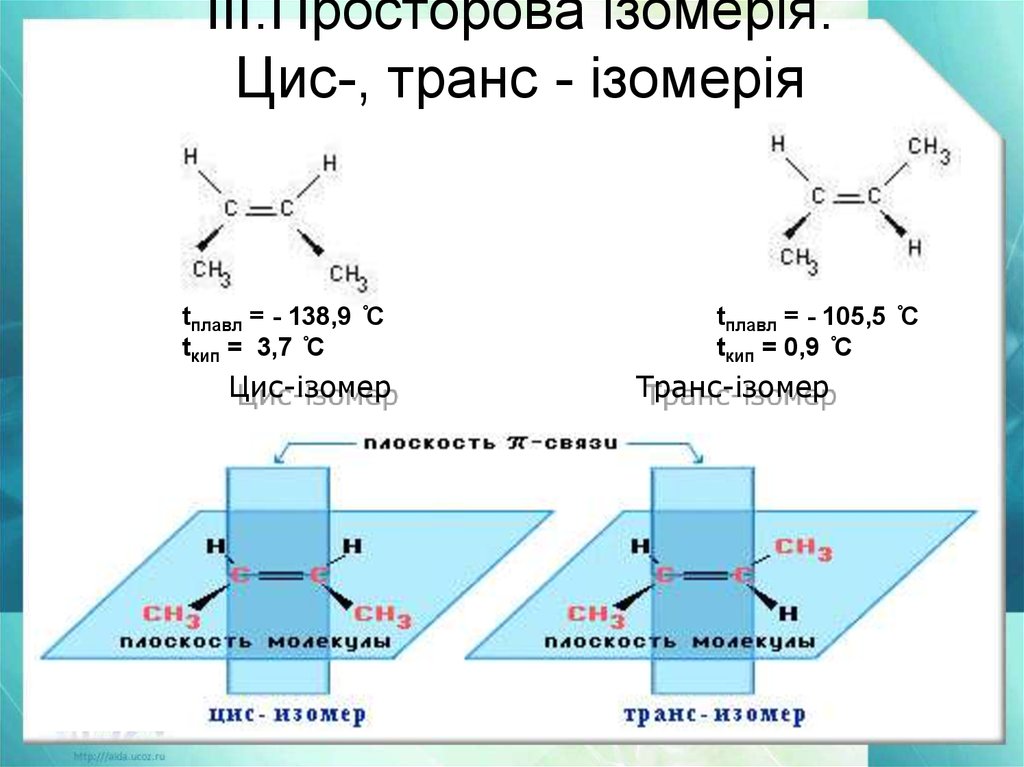
21. ІІІ.Просторова ізомерія. Цис-, транс - ізомерія
tплавл = - 138,9 ̊Сtкип = 3,7 ̊С
Цис-ізомер
tплавл = - 105,5 ̊С
tкип = 0,9 ̊С
Транс-ізомер
22. Домашнє завдання:
Буринська Н.М., Величко Л.П. Хімія 10 кл.§ 28, 29, впр. 180 с. 130
Григорович О.В., Мацаков О.Ю. Хімія
с. 286-293
Цвєтков Л.О. Органічна хімія
§9-12
















 Химия
Химия








