Похожие презентации:
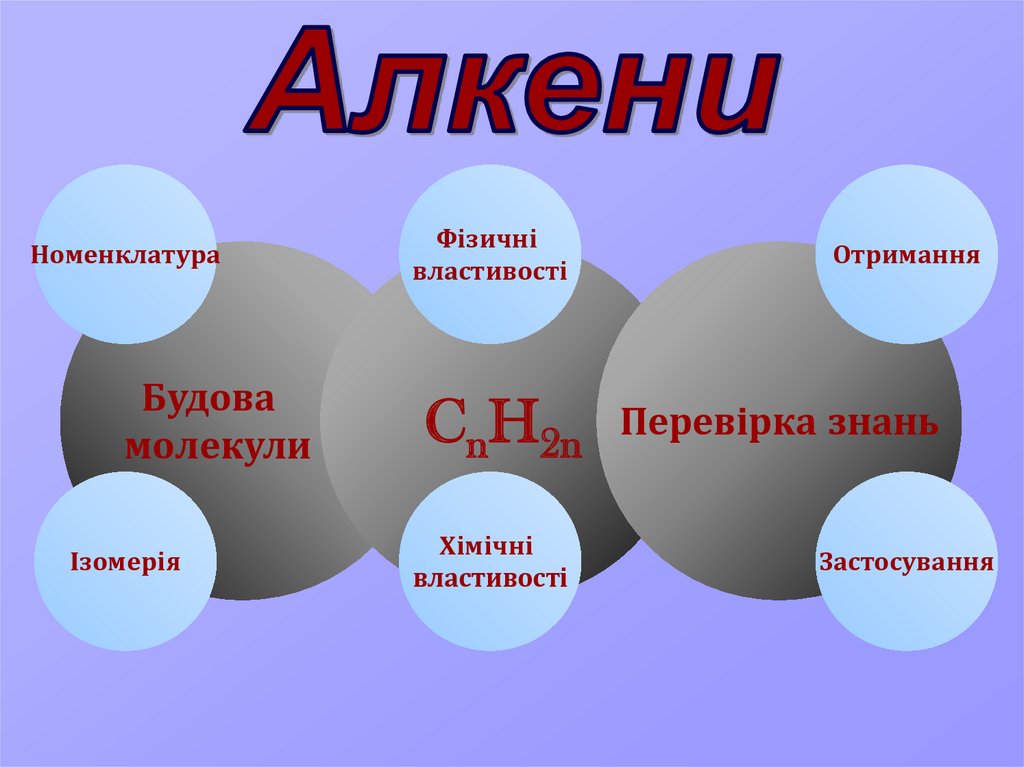
Алкени
1.
2.
НоменклатураБудова
молекули
Ізомерія
Фізичні
властивості
CnH2n
Хімічні
властивості
Отримання
Перевірка знань
Застосування
3.
CnH2nАлкени - ациклічні вуглеводні, в
молекулі яких крім одинарних
зв'язків міститься один
подвійний зв'язок між атомами
Карбону.
Загальна формула: СnH2n
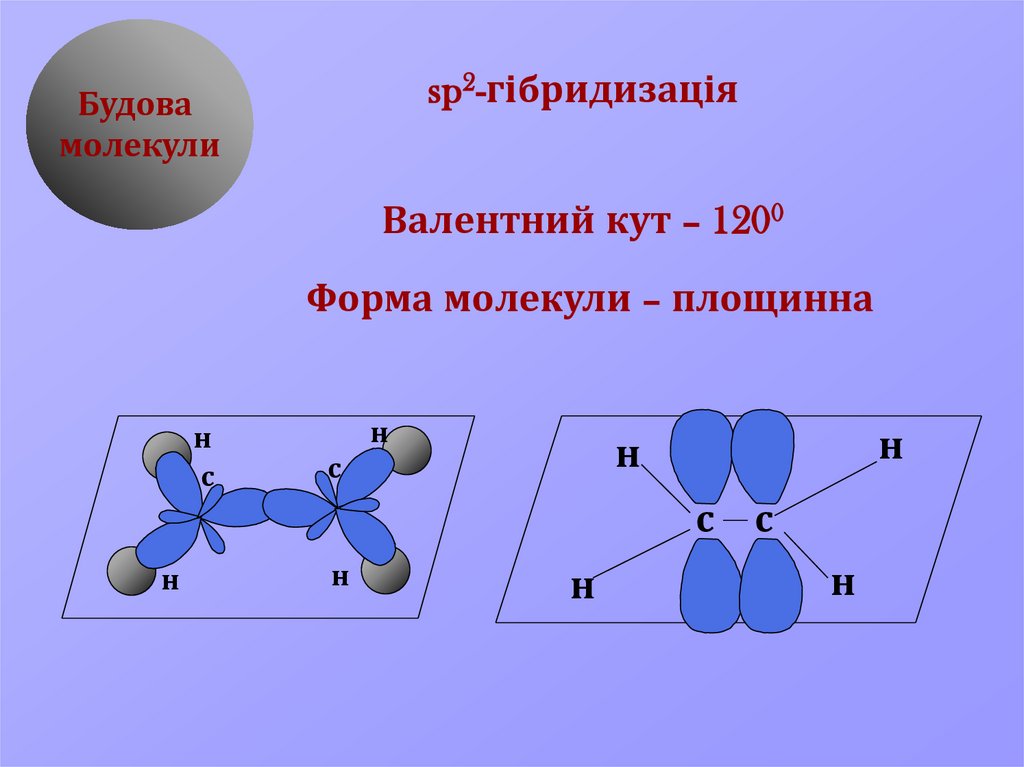
4.
sp2-гібридизаціяБудова
молекули
Валентний кут – 1200
Форма молекули – площинна
н
с
н
н
н
с
с
н
н
н
с
н
5.
1.Вибір головноголанцюга.
Номенклатура
С Н3 С Н С Н С Н С Н3
СН3
2. Нумерація атомів головного ланцюга.
5
4
3
2
1
ССН3 С Н С Н С Н С Н3
СН3
3. Формування назви.
С Н3 С Н С Н С Н С Н3
СН3
6.
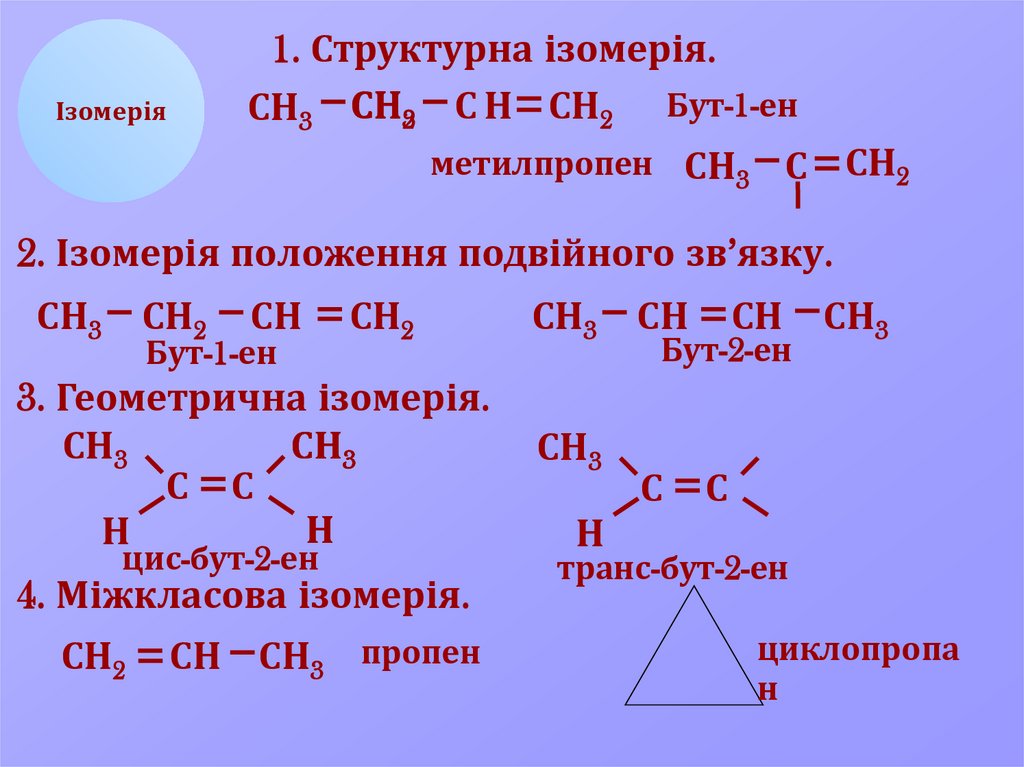
1. Структурна ізомерія.СН3 СН32 С Н СН2 Бут-1-ен
метилпропен СН3 С СН2
Ізомерія
2. Ізомерія положення подвійного зв’язку.
СН3
СН2
СН
Бут-1-ен
СН2
3. Геометрична ізомерія.
СН3
СН3
С С
Н
Н
цис-бут-2-ен
4. Міжкласова ізомерія.
СН2
СН СН3 пропен
СН3
СН3
Н
СН
СН
Бут-2-ен
С
СН3
С
транс-бут-2-ен
циклопропа
н
7.
Фізичнівластивості
Агрегатний стан:
С2Н4 – С4Н8
газоподібні речовини;
С5Н10 – С18Н36
с С19Н38
рідини;
тверді речовини.
Зі збільшенням молекулярної маси алкенів температури
кипіння і плавлення закономірно підвищуються.
Этилен С2Н4
Tпл = - 169,20С
Tкип = - 103,70С
8.
1. Гідрування :СН2
2. Галогенування :
СН2 + Н2
СН2
СН2 + Br2
3. Гідрогалогенування : СН2
4. Гідратація : СН2
СН2 + Н2О
5. Часткове окиснення : СН
7. Дегідрування:
СН2 + 3О2
СН2
8. Полімеризація: nСН2
СН2
СН2 + НСl
t, Н3РО4
CН3
СН2
cat
СН
(…
СН2Вr
CН3
2Н2О
2СО2
t, Ni
СН3
СН2Вr
СН2 + [О] +Н2О
2
6. Горіння: СН2
СН3
Pt, t
СН2Сl
СН2ОН
СН2
СН2
ОН
ОН
СН + Н2
СН2
СН2
…)n
9.
1. Крекінг нафтопродуктів :С16Н34
Отримання
С8Н18 + С8Н16
2. Дегідрування граничних вуглеводнів :
СН2
СН СН2 СН3 + Н2
СН3
СН2 СН2 СН3
СН3
СН
СН СН3 + Н2
3. Дегідратація спиртів (відщеплення води):
Н2SО4 , 140 – 1500С
СН3
СН2 ОН
СН2
СН2 + Н2О
4. Дегідрогалогенування (відщеплення галогеноводорода):
спирт, t
СН3 СН СН СН3 +NaBr +Н2О
СН3 СН СН2 СН3 + NaОН
Br
5. Дегалогенування:
СН3 СН СН СН3 +Zn
Br
Br
СН3
СН
СН
СН3 +ZnBr2
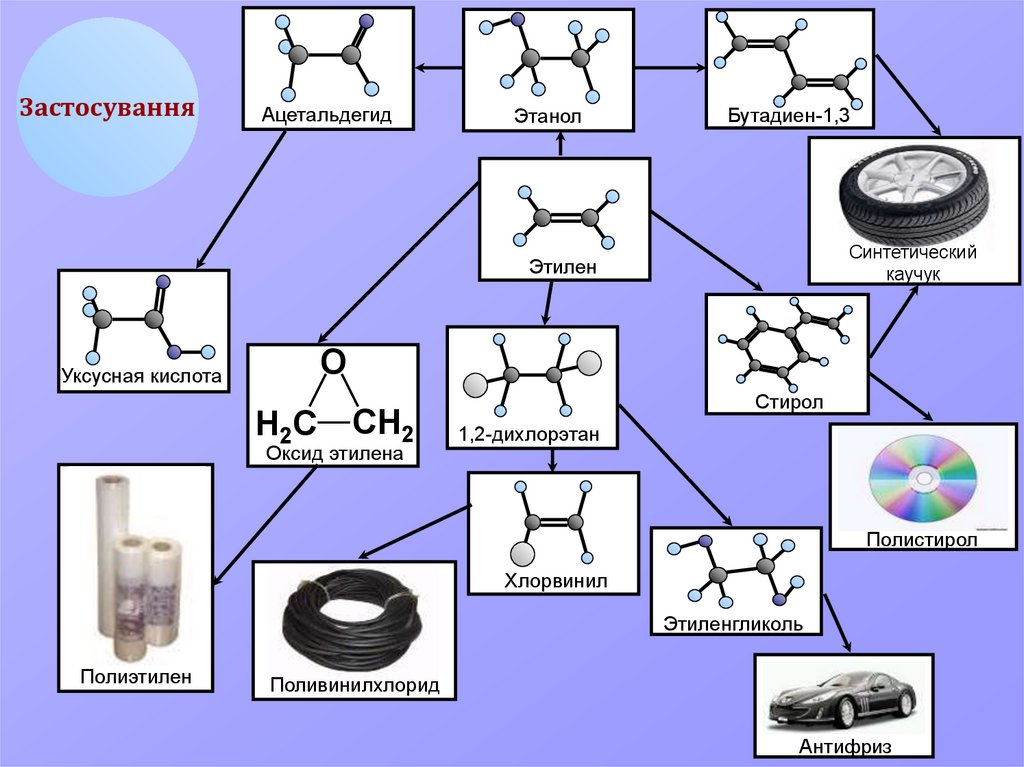
10.
ЗастосуванняАцетальдегид
Этанол
Бутадиен-1,3
Синтетический
каучук
Этилен
О
Уксусная кислота
Н2С
СН2
Оксид этилена
Стирол
1,2-дихлорэтан
Полистирол
Хлорвинил
Этиленгликоль
Полиэтилен
Поливинилхлорид
Антифриз
11.
Типгібридизації
Алкен
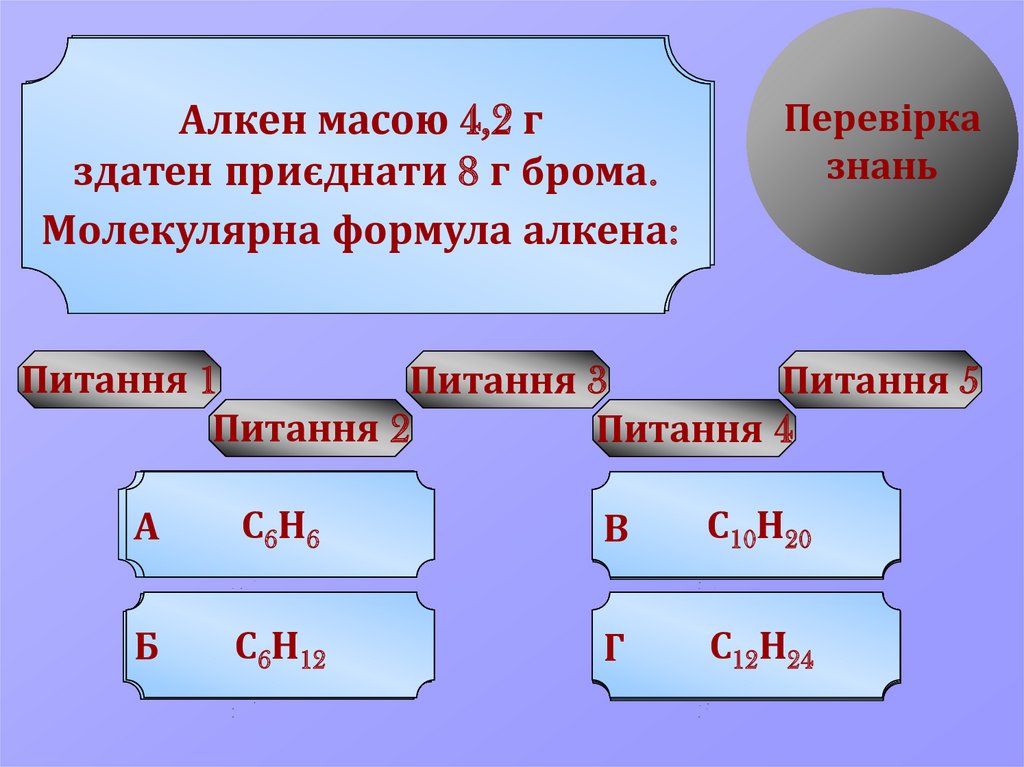
масою 4,2 г
Алкенам
Який
тип
не
характерні
ізомерії
здатен
приєднати
8 галкенів
брома.
атомів
вуглецю
Загальна
формула
відсутній
реакції
у
алкенів
Молекулярна
формула алкена:
в пропані
Перевірка
знань
Питання 1
Питання 3
Питання 5
Питання 2
Питання 4
вуглецевого
Попробуй
Попробуй
Попробуй
Попробуй
2
2,sp2
заміщення
С
Н
А sp
C
,sp
H
УРА!
6
n 6еще
2n+2
скелета
еще
еще
еще
положення
Попробуй
2
3
функціональної
СПопробуй
Н
В приєднання
УРА!
20
n10еще
2n
еще
групи
положення
Попробуй
Попробуй
Попробуй
2
окислення
С
Н
УРА!
Бкратного
sp,sp,sp
CnH
6 еще
12
2n-6
зв'язку
еще
еще
Попробуй
Попробуй
2
2,sp3
полімеризації
геометрична
С
Н
Г spC,sp
H
УРА!
24
n 12еще
2n-2
еще
spC,sp,sp
H







 Химия
Химия








