Похожие презентации:
Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения
1.
2.
Лекция 1Биологически важные классы поли- и
гетерофункциональных соединений.
Лекция 2
Витамины и коферменты.
Лекция 3
Лекция 4
Лекция 5
Лекция 6
Азотсодержащие и гетероциклические соединения.
Низкомолекулярные биологически-активные
соединения
3.
ЛЕКЦИЯ 3Азотсодержащие и
гетероциклические соединения.
Низкомолекулярные биологическиактивные соединения
4.
Химия гетероциклов представляет собой одну из самых увлекательных иважных областей биоорганической химии. Достаточно сказать, что из
наиболее известных и широко применяемых лекарственных средств
природного и синтетического происхождения более 60% являются
гетероциклическими соединениями.
Многообразие
гетероциклических
соединений
обусловлено
возможностями вариаций:
1. числа и характера гетероатомов в молекуле;
2. размера цикла;
3. степени ненасыщенности, которая определяет наличие или
отсутствие ароматичности;
4. возможностью существования конденсированных структур.
5.
Ароматические гетероциклы представляют собой плоские циклические системы,содержащие вместо одного или нескольких атомов углерода, атомы кислорода,
серы, азота.
фуран
тиофен
пиррол
Ароматическими их называют вследствие того, что они удовлетворяют всем
критериям, присущим любой ароматической системе, а именно:
- Система является циклической
- Цикл является плоским
-Имеется сопряжение по всему циклу, то есть возможность беспрепятственной
делокализации любого из p-электронов по всей системе, благодаря наличию
негибридизованных р-орбиталей.
Среди ароматических гетероциклических соединений наиболее широко
распространены и, соответственно, представляют наибольший интерес, пяти- и
шести-членные гетероциклы, включающие в своем составе азот, серу и кислород, а
также эти же системы, конденсированные с бензольным кольцом.
6.
Систематическая номенклатура,наиболее широко используемая для
моноциклических гетероциклов, основана на системе, введенной Ганчем
и Видеманом еще в XIX веке. Cовременная версия этой системы
опубликована в 1983 г. По этой системе название гетероцикла строится
путем
объединения
стандартного
префикса
или
префиксов,
обозначающих гетероатомы, и стандартной основы, указывающей на
размер цикла и на то, насыщенный он или нет.
Префикс
(гетероатом)
- O – окса
- S – тиа
- N – аза
Корень
(размер цикла)
3-ир
4-ет
5-ол
6-ин
7-ен
8-ок
Суффикс
(степень ненасыщенности)
-идин - насыщенный цикл с атомом N
-ан насыщенный цикл без атома N
-ин ненасыщенный цикл с атомом N
7.
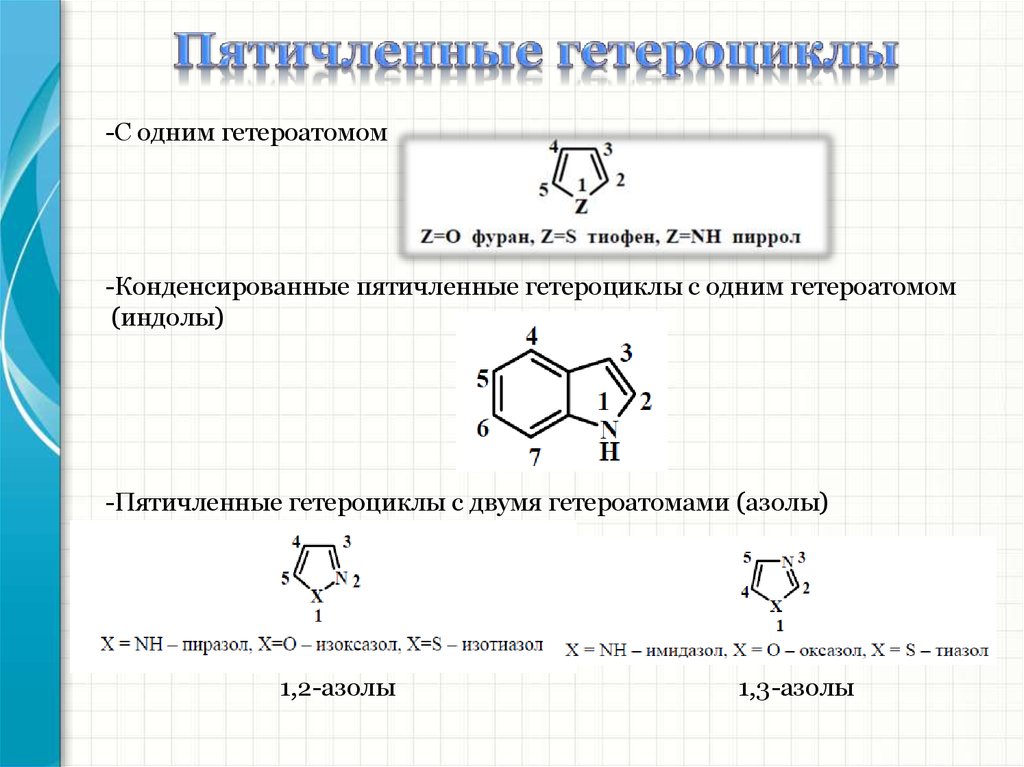
-С одним гетероатомом-Конденсированные пятичленные гетероциклы с одним гетероатомом
(индолы)
-Пятичленные гетероциклы с двумя гетероатомами (азолы)
1,2-азолы
1,3-азолы
8.
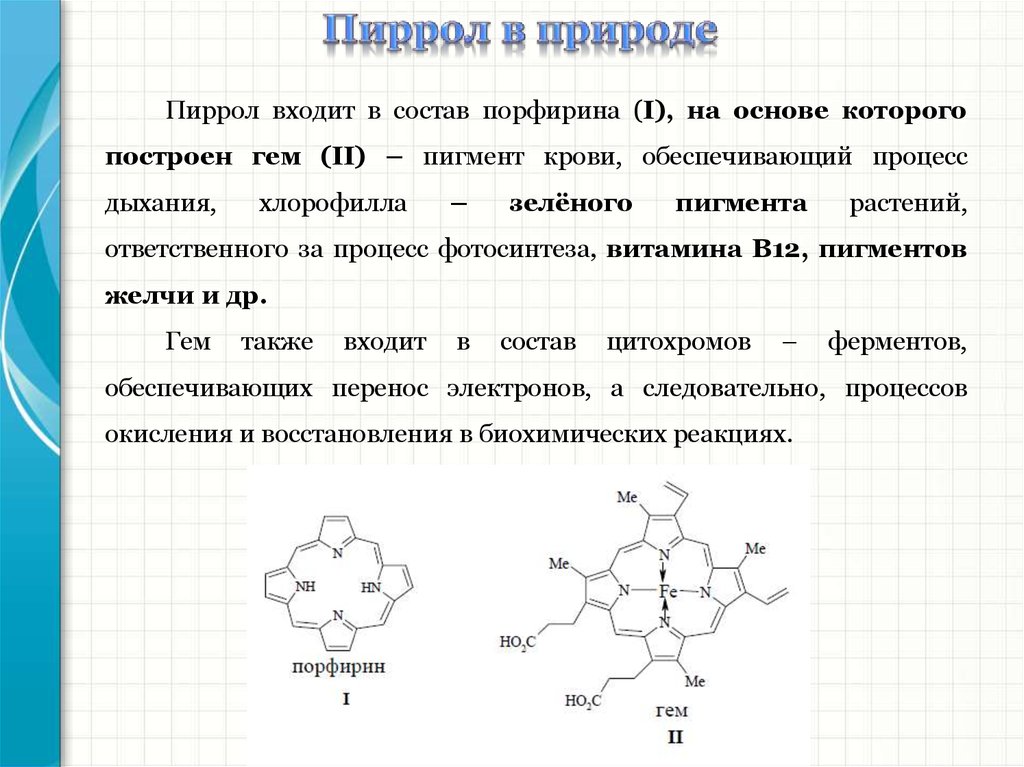
Пиррол входит в состав порфирина (I), на основе которогопостроен гем (II) – пигмент крови, обеспечивающий процесс
дыхания,
хлорофилла
–
зелёного
пигмента
растений,
ответственного за процесс фотосинтеза, витамина В12, пигментов
желчи и др.
Гем
также
входит
в
состав
цитохромов
–
ферментов,
обеспечивающих перенос электронов, а следовательно, процессов
окисления и восстановления в биохимических реакциях.
9.
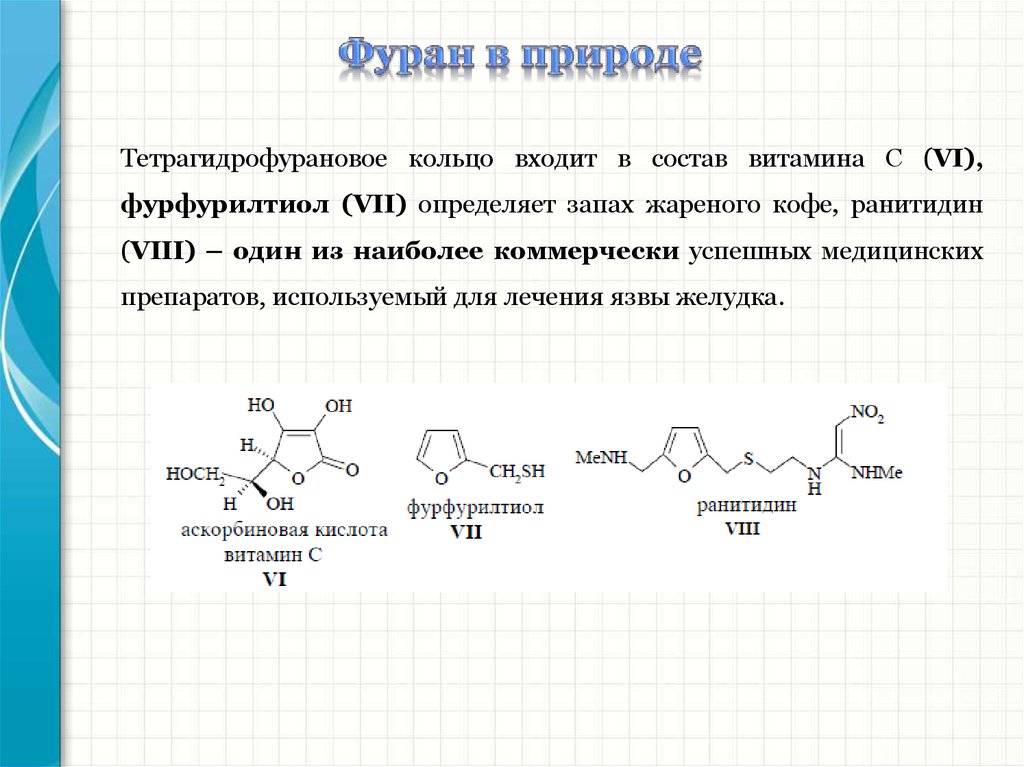
Тетрагидрофурановое кольцо входит в состав витамина С (VI),фурфурилтиол (VII) определяет запах жареного кофе, ранитидин
(VIII) – один из наиболее коммерчески успешных медицинских
препаратов, используемый для лечения язвы желудка.
10.
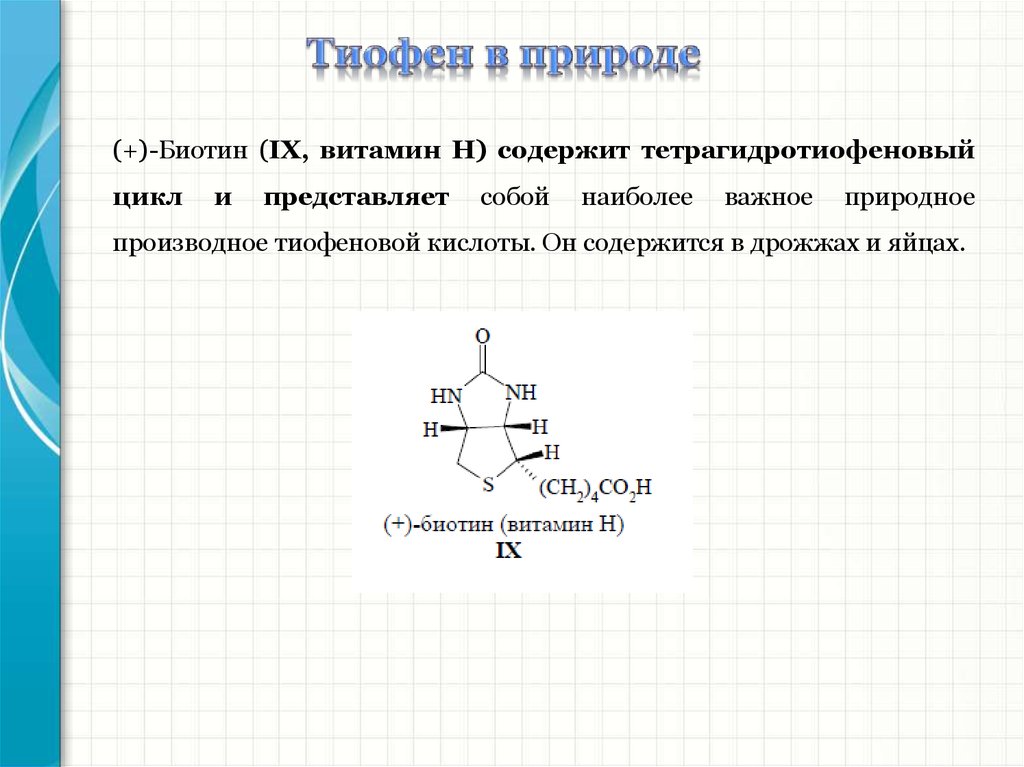
(+)-Биотин (IX, витамин Н) содержит тетрагидротиофеновыйцикл
и
представляет
собой
наиболее
важное
природное
производное тиофеновой кислоты. Он содержится в дрожжах и яйцах.
11.
Общие1. Метод Пааля-Кнорра (из 1,4-дикарбонильных соединений)
2. Реакция Юрьева (взаимопревращения гетероциклов)
Частные
3. Синтез Кнорра – циклоконденсация α-аминокарбонильных и 1,3дикарбонильных соединений в щелочных средах с получением пиррола
4.
Синтез
фурфурола
кислотным
гидролизом
пентозосодержащих
полисахаридов → реакция Канницаро с образованием фурана.
5. Метод Фейста-Бенáри – взаимодействие α-галогенкарбонильных и 1,3дикарбонильных соединений в присутствии оснований для получения фурана
6. Метод Хинсберга - взаимодействие диэтилтиоацетата 7 с 1,2дикарбонильными соединениями в присутствии оснований, в том числе и с
эфирами щавелевой кислоты для получения тиофена.
12.
Характерной особенностью пятичленных гетероциклическихсоединений является одновременное сочетание у них свойств как
ароматического соединения, так и диена. Склонность к реакциям того и
другого типов, однако, у них различна и связана с природой
гетероатома.
Пиррол, тиофен и фуран представляют собой 6π-электронные πизбыточные ароматические системы. Ароматический секстет
электронов образован за счет π-электронов двойных связей и
неподеленной пары электронов гетероатома.
Наибольшая электронная плотность сосредоточена на ближайших к
гетероатому атомах углерода (a- положения).
Наибольшей ароматичностью обладают
тиофен и пиррол, а в наименьшей степени фуран,
для которого свойства диена (1,4-присоединение, реакция ДильсаАдлера) являются весьма характерными.
13.
Особенностями пиррола, фурана и тиофена является их высокаяреакционная способность по отношению к классическим
электрофилам.
Электрофильное замещение идет, как правило, по положению 2.
Пиррол более реакционноспособен, чем фуран, тиофен
значительно менее реакционноспособен, чем фуран.
ПИРРОЛ > ФУРАН > ТИОФЕН
реакционноспособность
14.
1. Соли пиррола со щелочными металлами получают действием калияили натрия в жидком аммиаке:
2. Пирролнатрий легко вступает в реакции замещения натрия на алкилы
с образованием N-алкилпиррола
3. При нагревании N-алкилпиррол изомеризуется в С-алкилпирролы:
4. Амилнитрат реагирует с пирролом в присутствии этилата натрия с
образованием натриевой соли 3-нитропиррола:
15.
1. Бромирование диоксандибромидом:2. Сульфирование комплексом SO3 с пиридином (А.П. Терентьев, Л.А.
Яновская):
3. Ацилирование
4. Нитрование фурана ацетилнитратом с обработкой продукта
присоединения пиридином
16.
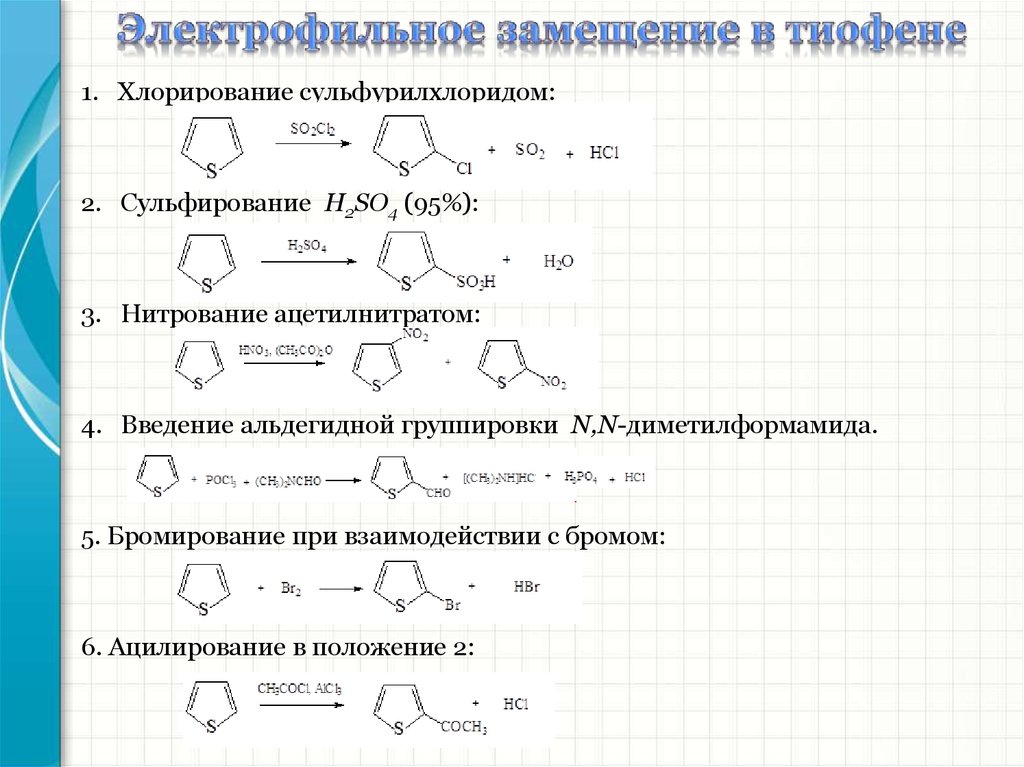
1. Хлорирование сульфурилхлоридом:2. Сульфирование H2SO4 (95%):
3. Нитрование ацетилнитратом:
4. Введение альдегидной группировки N,N-диметилформамида.
5. Бромирование при взаимодействии с бромом:
6. Ацилирование в положение 2:
17.
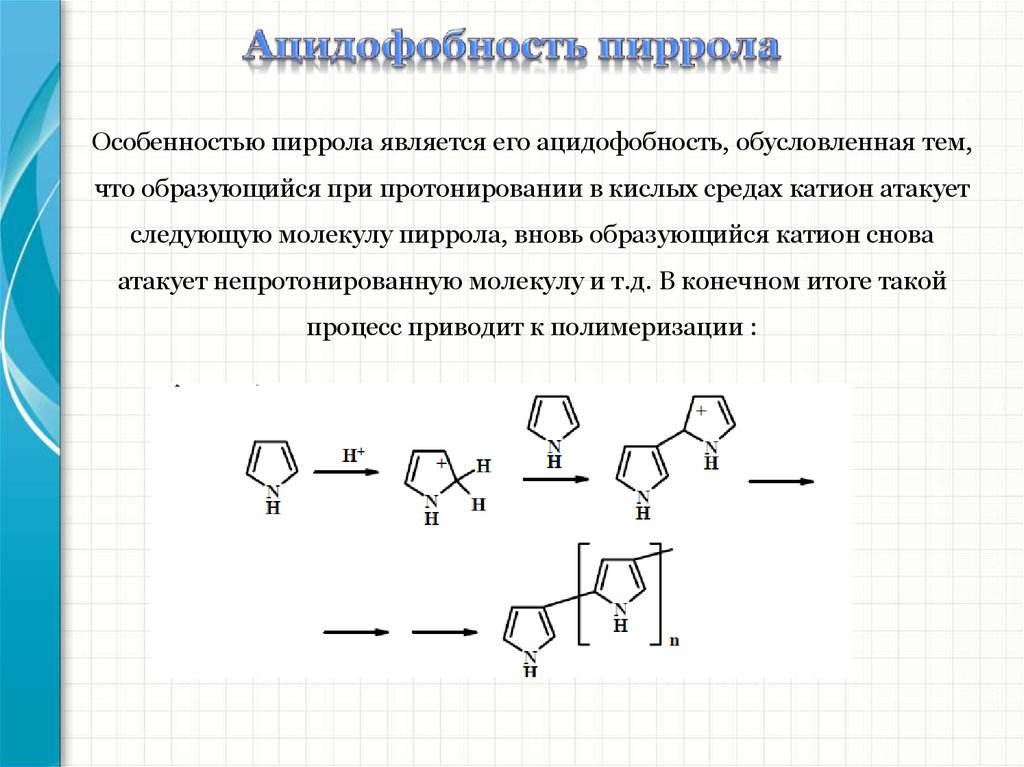
Особенностью пиррола является его ацидофобность, обусловленная тем,что образующийся при протонировании в кислых средах катион атакует
следующую молекулу пиррола, вновь образующийся катион снова
атакует непротонированную молекулу и т.д. В конечном итоге такой
процесс приводит к полимеризации :
18.
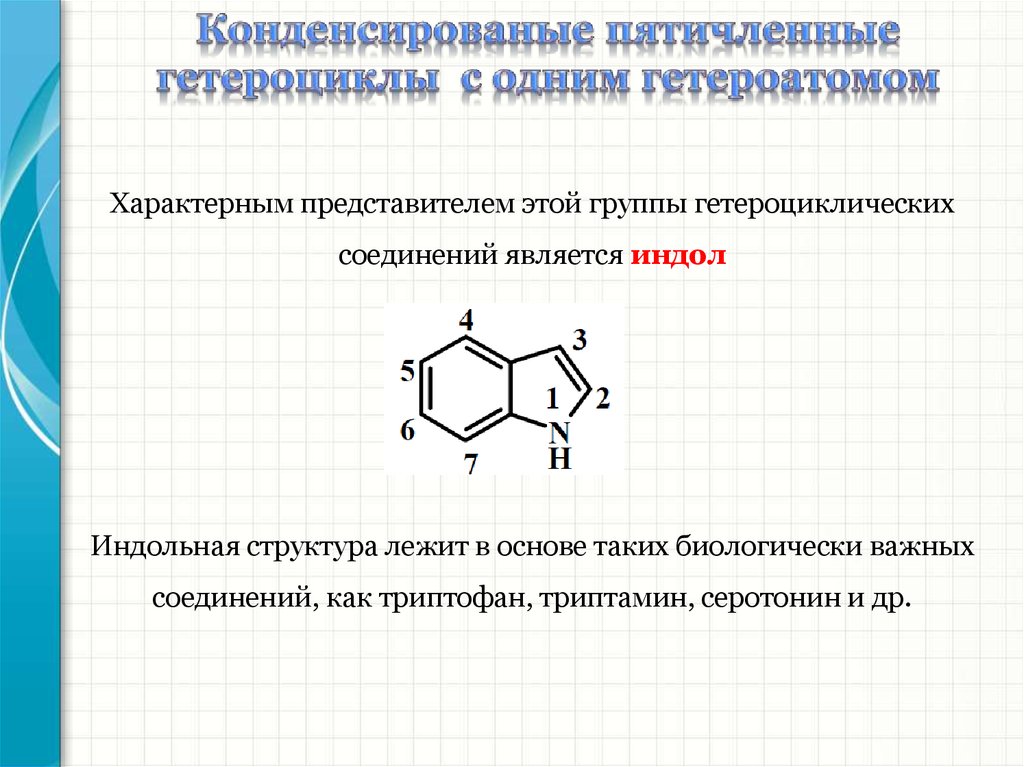
Характерным представителем этой группы гетероциклическихсоединений является индол
Индольная структура лежит в основе таких биологически важных
соединений, как триптофан, триптамин, серотонин и др.
19.
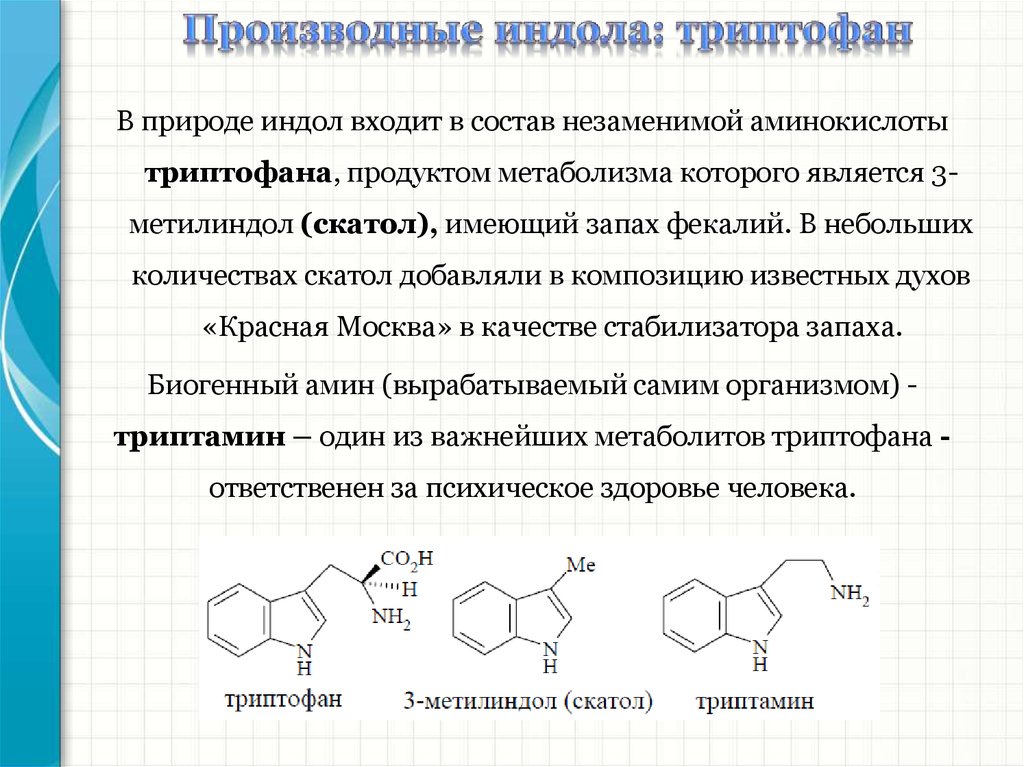
В природе индол входит в состав незаменимой аминокислотытриптофана, продуктом метаболизма которого является 3метилиндол (скатол), имеющий запах фекалий. В небольших
количествах скатол добавляли в композицию известных духов
«Красная Москва» в качестве стабилизатора запаха.
Биогенный амин (вырабатываемый самим организмом) триптамин – один из важнейших метаболитов триптофана -
ответственен за психическое здоровье человека.
20.
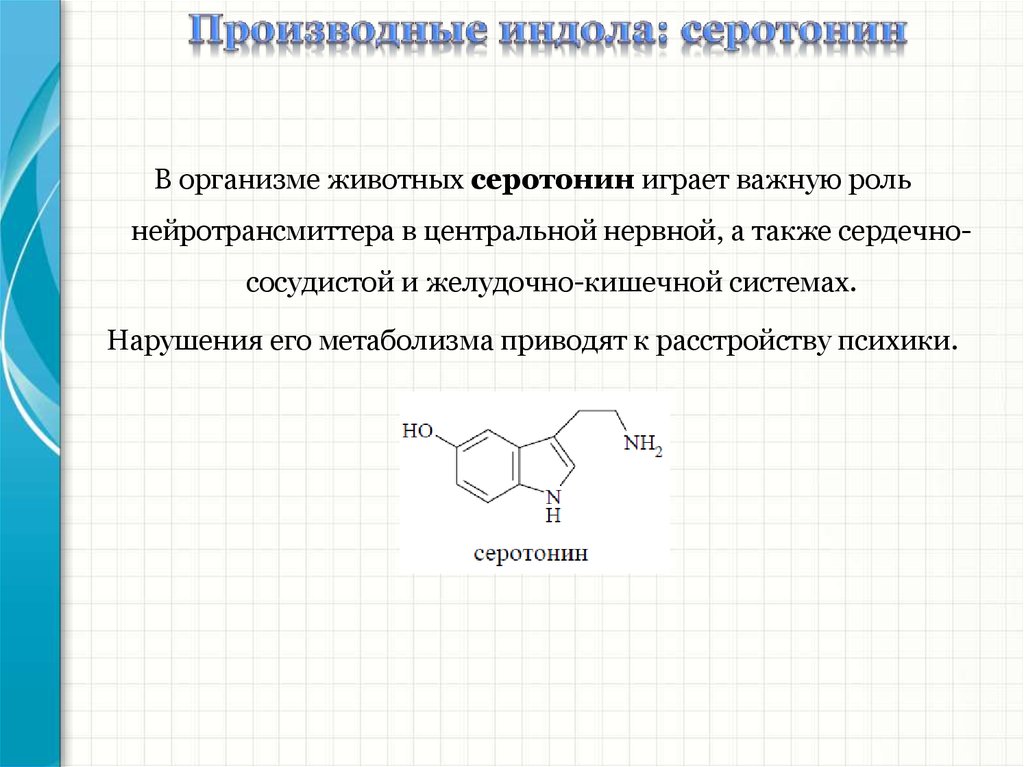
В организме животных серотонин играет важную рольнейротрансмиттера в центральной нервной, а также сердечнососудистой и желудочно-кишечной системах.
Нарушения его метаболизма приводят к расстройству психики.
21.
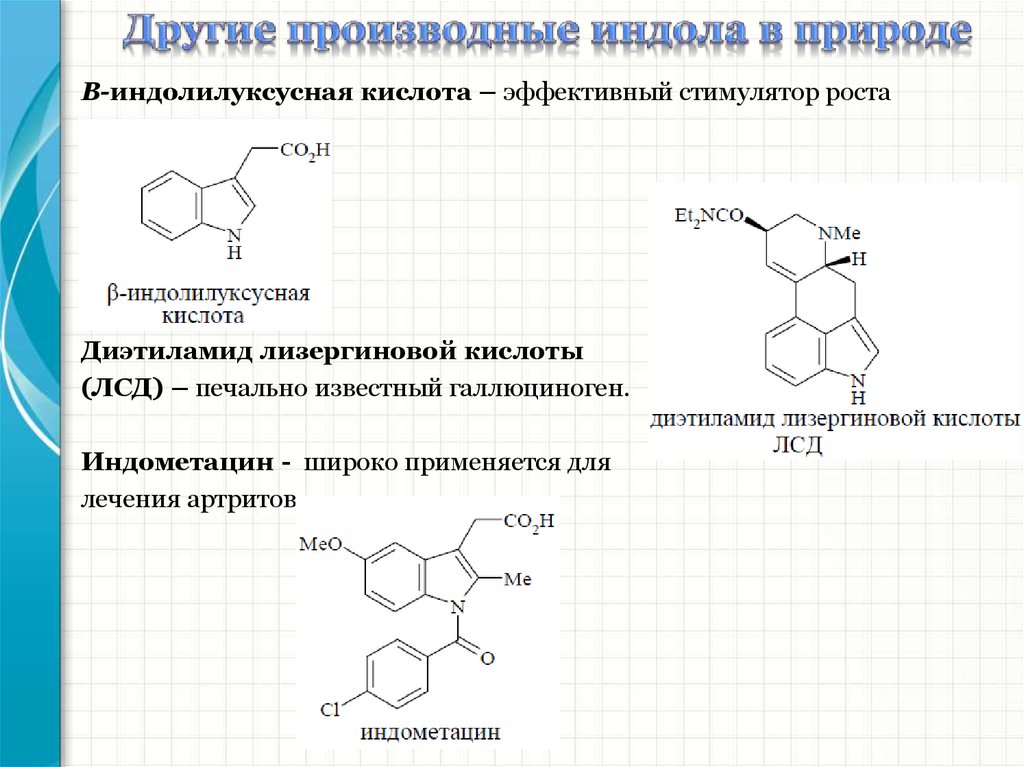
Β-индолилуксусная кислота – эффективный стимулятор ростаДиэтиламид лизергиновой кислоты
(ЛСД) – печально известный галлюциноген.
Индометацин - широко применяется для
лечения артритов.
22.
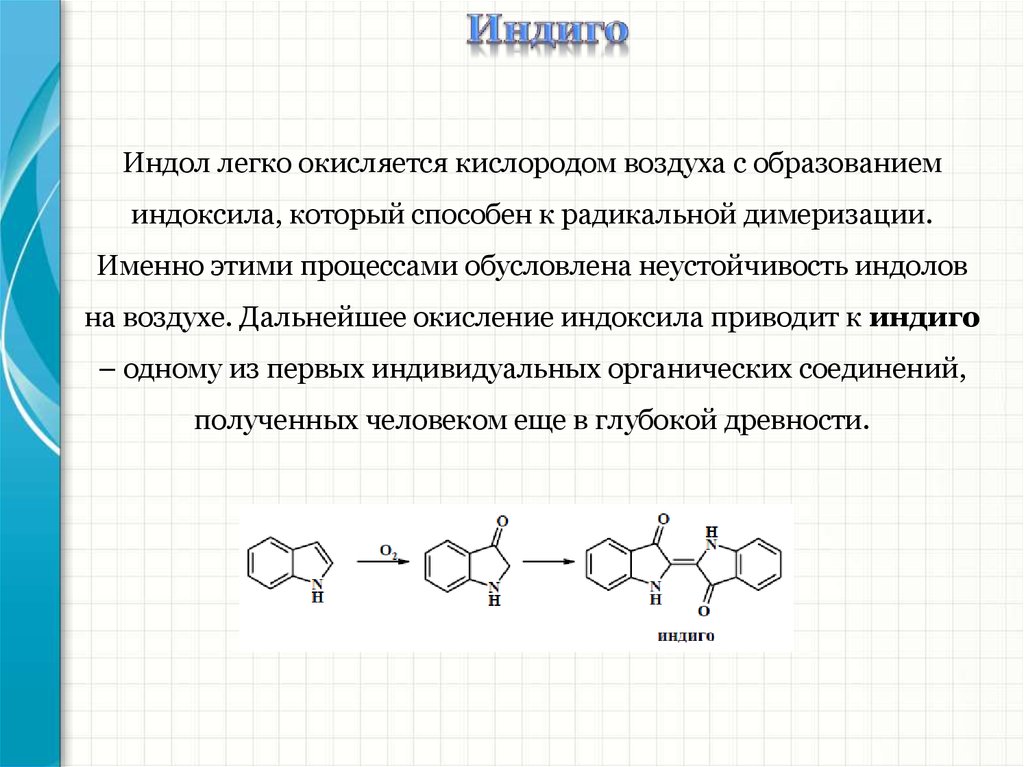
Индол легко окисляется кислородом воздуха с образованиеминдоксила, который способен к радикальной димеризации.
Именно этими процессами обусловлена неустойчивость индолов
на воздухе. Дальнейшее окисление индоксила приводит к индиго
– одному из первых индивидуальных органических соединений,
полученных человеком еще в глубокой древности.
23.
Пятичленные гетероциклы с 2 гетероатомами носят общее название азолы.По взаимному расположению гетероатомов в цикле различают 1,2- и 1,3азолы.
1,2-азолы
1,3-азолы
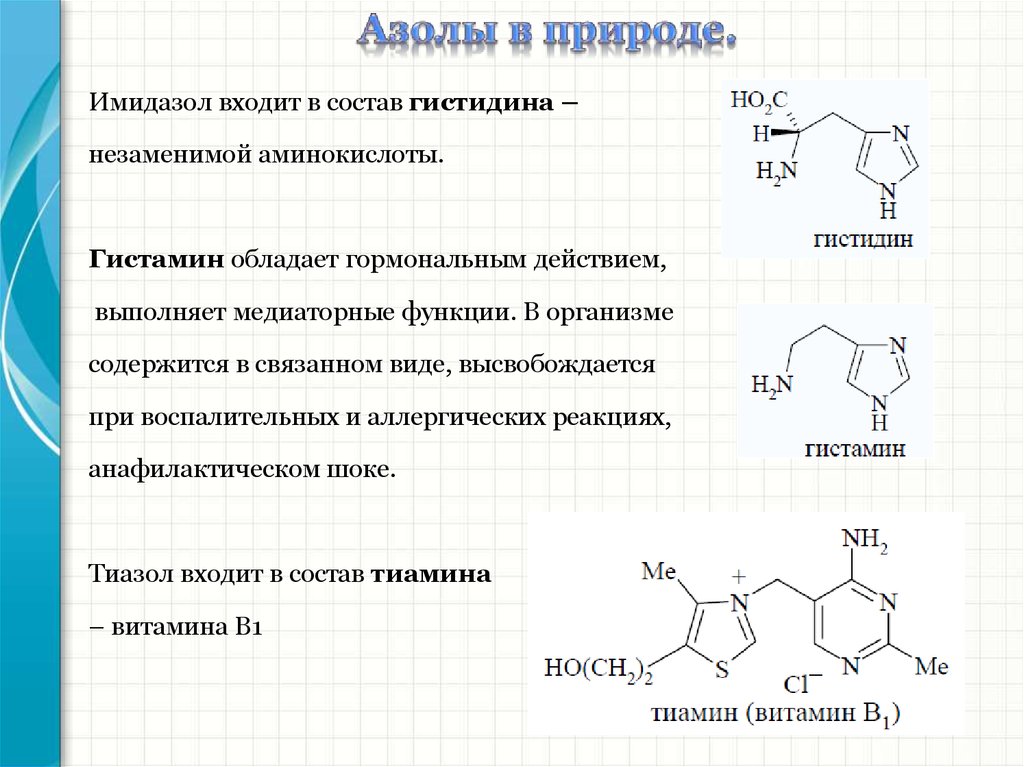
Одним из важнейших представителей азолов является имидазол.
24.
Имидазол входит в состав гистидина –незаменимой аминокислоты.
Гистамин обладает гормональным действием,
выполняет медиаторные функции. В организме
содержится в связанном виде, высвобождается
при воспалительных и аллергических реакциях,
анафилактическом шоке.
Тиазол входит в состав тиамина
– витамина В1
25.
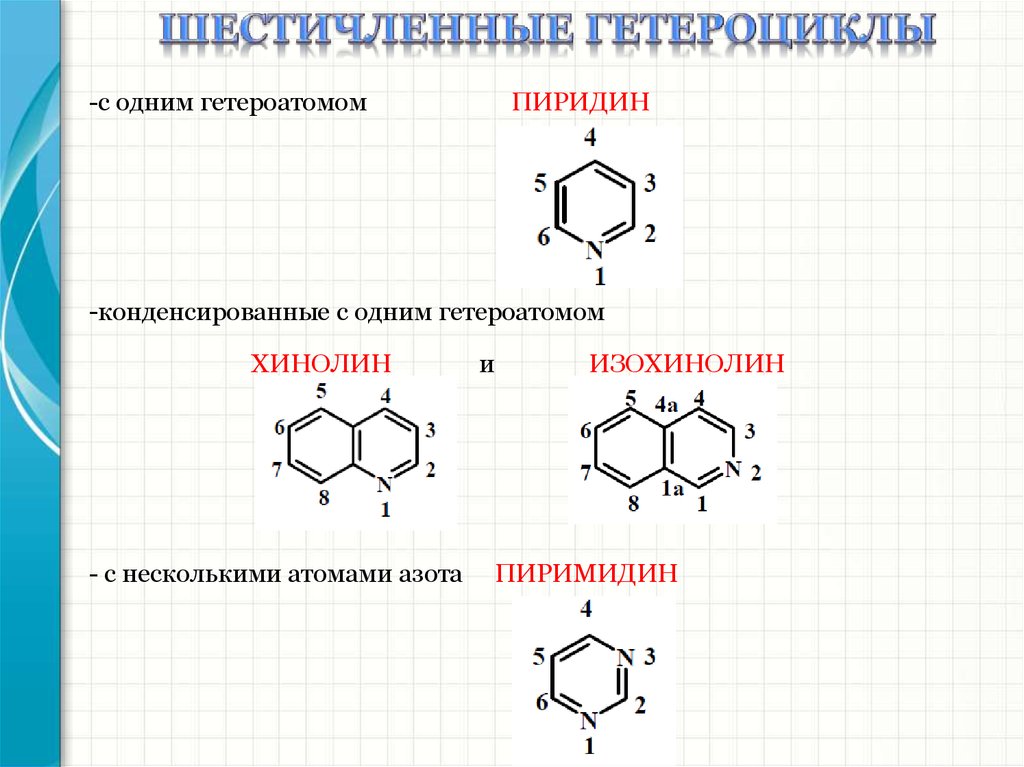
-с одним гетероатомомПИРИДИН
-конденсированные с одним гетероатомом
ХИНОЛИН
- с несколькими атомами азота
и
ИЗОХИНОЛИН
ПИРИМИДИН
26.
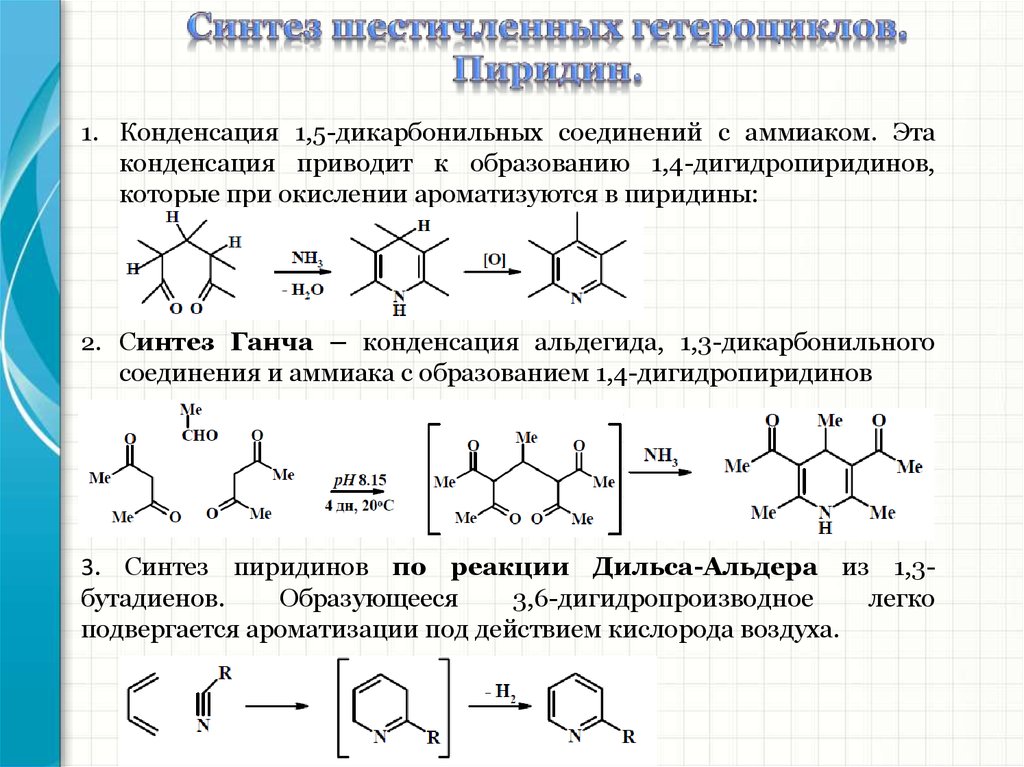
1. Конденсация 1,5-дикарбонильных соединений с аммиаком. Этаконденсация приводит к образованию 1,4-дигидропиридинов,
которые при окислении ароматизуются в пиридины:
2. Синтез Ганча – конденсация альдегида, 1,3-дикарбонильного
соединения и аммиака с образованием 1,4-дигидропиридинов
3. Синтез пиридинов по реакции Дильса-Альдера из 1,3бутадиенов.
Образующееся
3,6-дигидропроизводное
легко
подвергается ароматизации под действием кислорода воздуха.
27.
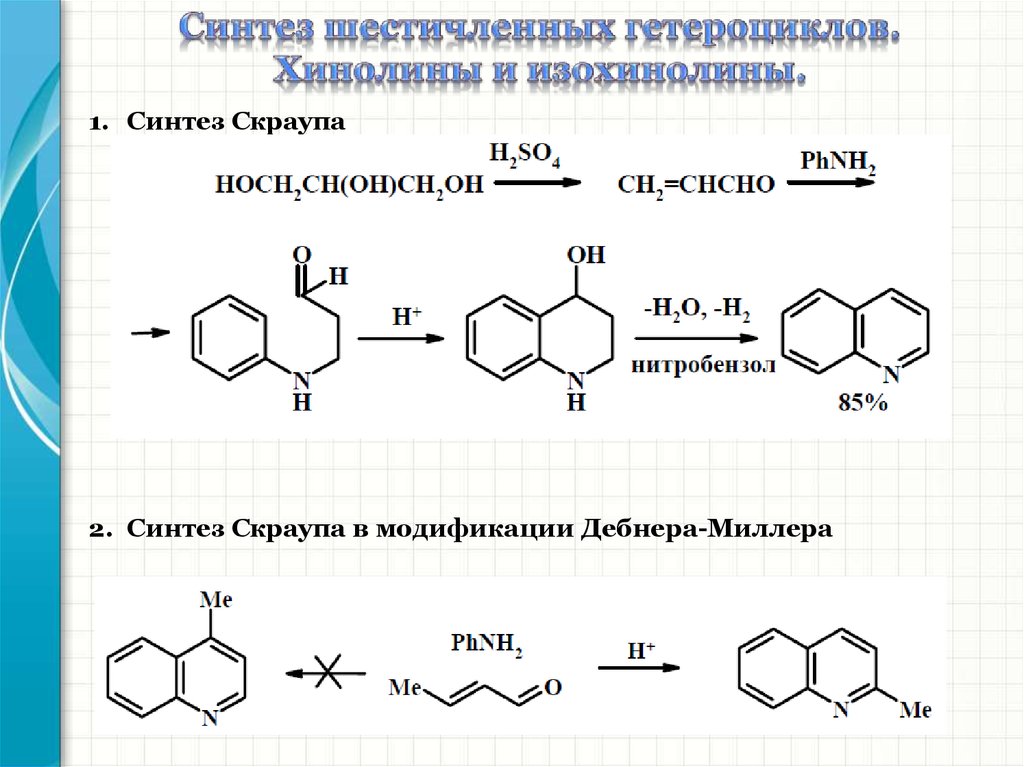
1. Синтез Скраупа2. Синтез Скраупа в модификации Дебнера-Миллера
28.
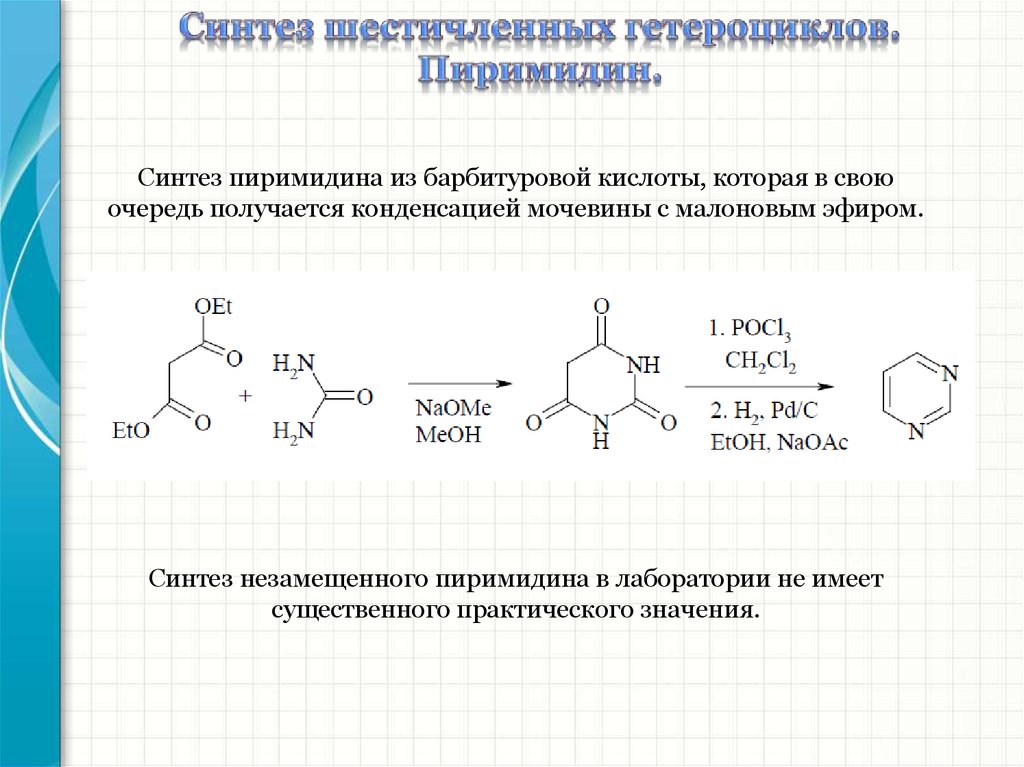
Синтез пиримидина из барбитуровой кислоты, которая в своюочередь получается конденсацией мочевины с малоновым эфиром.
Синтез незамещенного пиримидина в лаборатории не имеет
существенного практического значения.
29.
Пиридин представляет собой ароматическую 6π-электронную систему,которая образуется за счет π-электронов трех двойных связей кольца.
Неподеленная пара электронов атома азота лежит в плоскости,
перпендикулярной плоскости π-системы кольца и не принимает участия
в создании ароматического секстета. Отсюда вытекают два очень важных
для химии пиридина следствия: во-первых, атом азота обладает
основными и нуклеофильными свойствами, во-вторых, за счет большей,
чем у углерода, электроотрицательности атома азота ядро пиридина
приобретает π-дефицитность, так как электронная плотность в кольце
распределена неравномерно и частично локализована на атоме азота.
Наиболее характерными для пиридинов являются реакции
нуклеофильного замещения. Нуклеофильное замещение идет по
положениям 2 и 4. Механизм процесса – присоединение-отщепление.
Реакции электрофильного замещения для пиридина идут с
большим трудом, что обусловлено π-дефицитностью ядра и
способностью атома азота образовывать соли с протонными
кислотами. Атака электрофила идет по положению 3.
30.
Химические свойства хинолинов и изохинолинов имеют много общего сосвойствами пиридинов, однако, существуют некоторые особенности,
обусловленные наличием аннелированного бензольного кольца.
Нуклеофильное замещение для хинолина идет в положенях 2 и 4, а
для изохинолина – в положении 1, по механизму присоединенияэлиминирования
Электрофильное замещение в хинолинах и изохинолинах идет
только по бензольному кольцу в положения 5 и 8.
31.
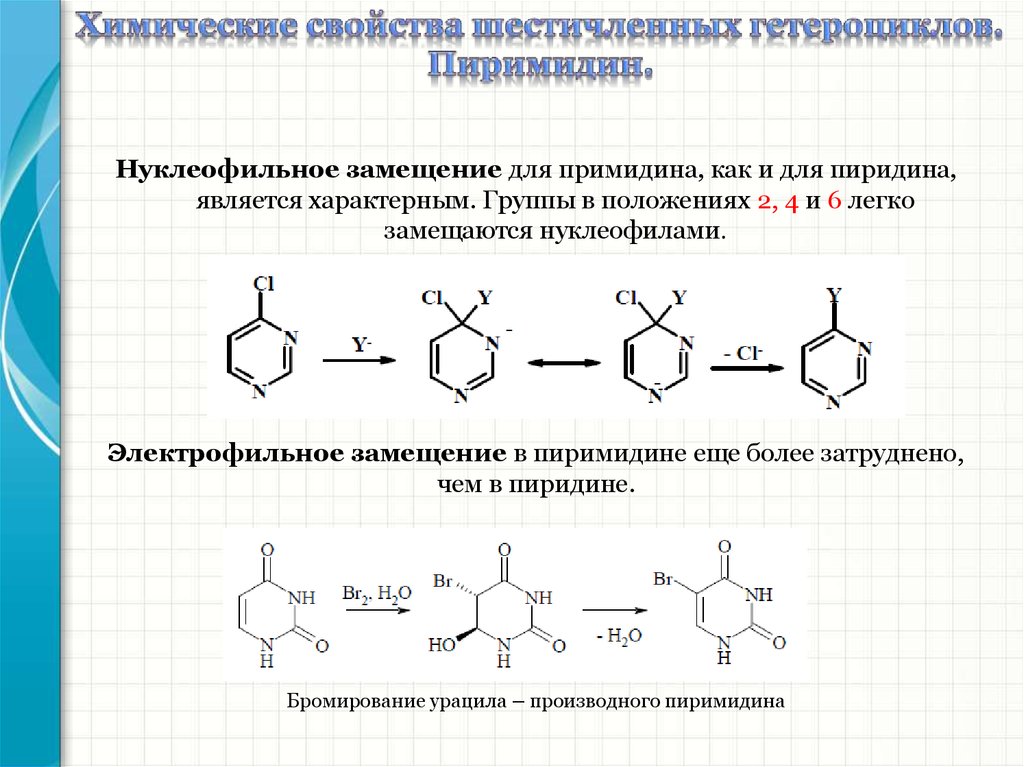
Нуклеофильное замещение для примидина, как и для пиридина,является характерным. Группы в положениях 2, 4 и 6 легко
замещаются нуклеофилами.
Электрофильное замещение в пиримидине еще более затруднено,
чем в пиридине.
Бромирование урацила – производного пиримидина
32.
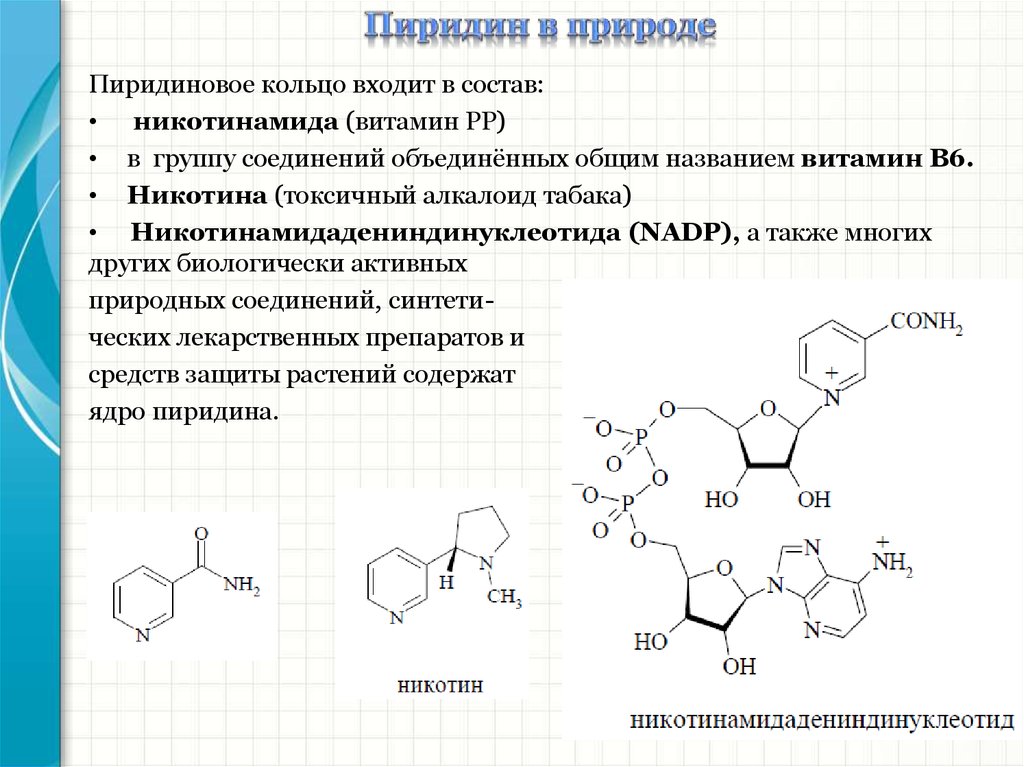
Пиридиновое кольцо входит в состав:• никотинамида (витамин РР)
• в группу соединений объединённых общим названием витамин В6.
• Никотина (токсичный алкалоид табака)
• Никотинамидадениндинуклеотида (NADP), а также многих
других биологически активных
природных соединений, синтетических лекарственных препаратов и
средств защиты растений содержат
ядро пиридина.
33.
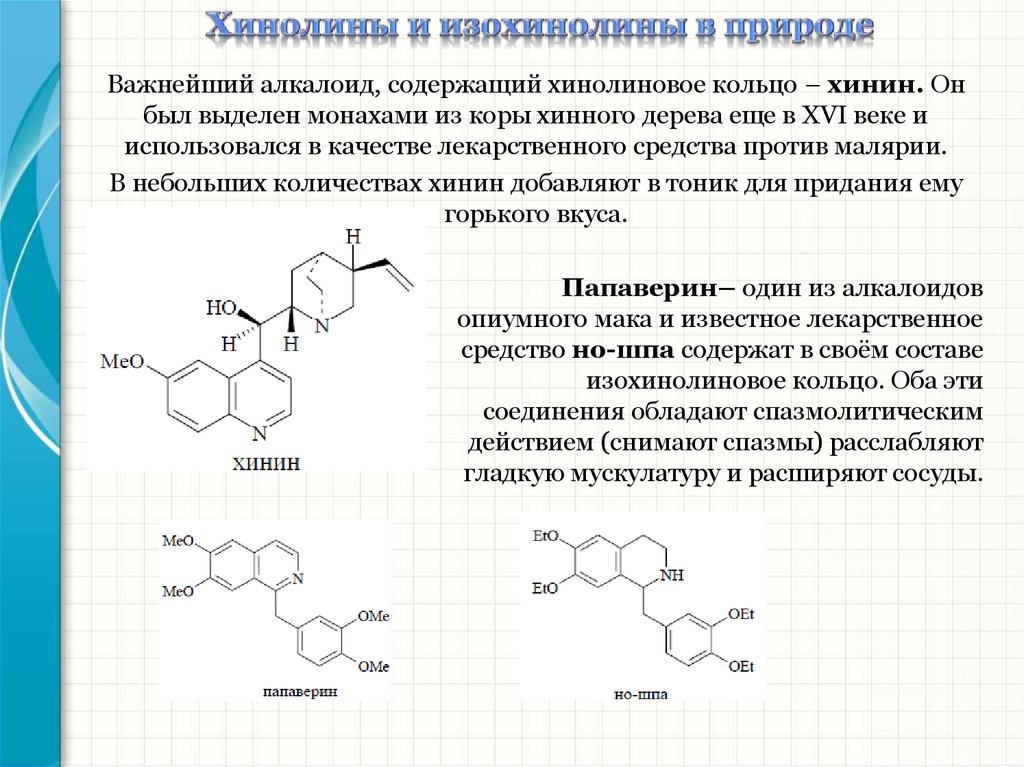
Важнейший алкалоид, содержащий хинолиновое кольцо – хинин. Онбыл выделен монахами из коры хинного дерева еще в XVI веке и
использовался в качестве лекарственного средства против малярии.
В небольших количествах хинин добавляют в тоник для придания ему
горького вкуса.
Папаверин– один из алкалоидов
опиумного мака и известное лекарственное
средство нo-шпа содержат в своём составе
изохинолиновое кольцо. Оба эти
соединения обладают спазмолитическим
действием (снимают спазмы) расслабляют
гладкую мускулатуру и расширяют сосуды.
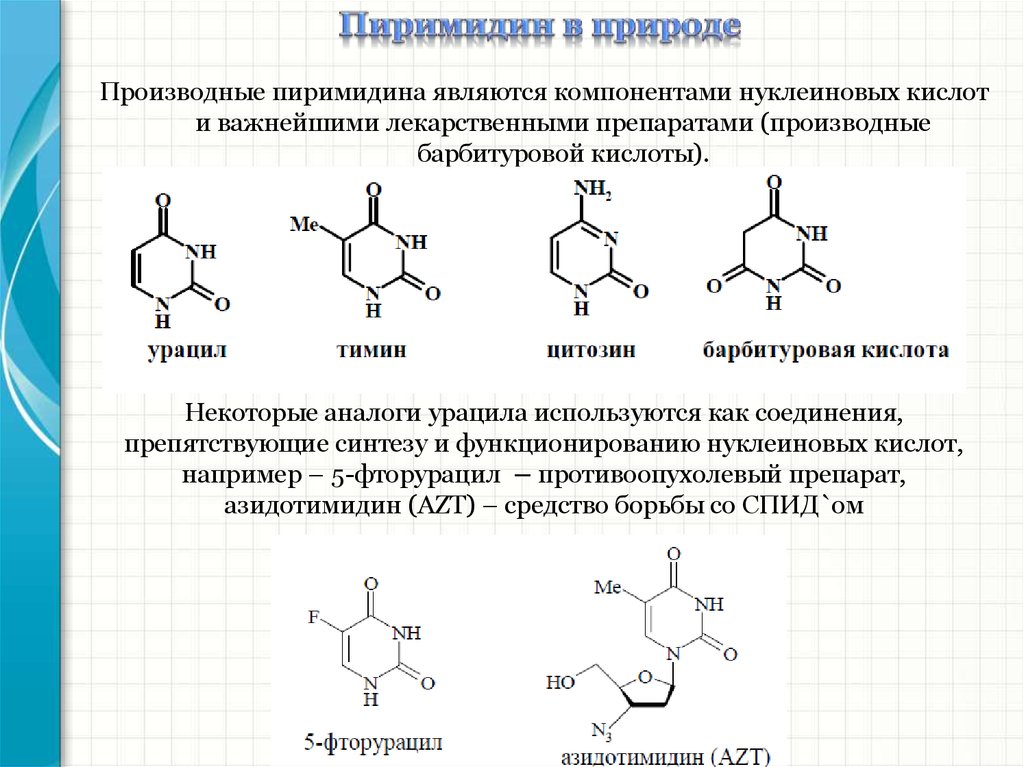
34.
Производные пиримидина являются компонентами нуклеиновых кислоти важнейшими лекарственными препаратами (производные
барбитуровой кислоты).
Некоторые аналоги урацила используются как соединения,
препятствующие синтезу и функционированию нуклеиновых кислот,
например – 5-фторурацил – противоопухолевый препарат,
азидотимидин (AZT) – средство борьбы со СПИД`ом
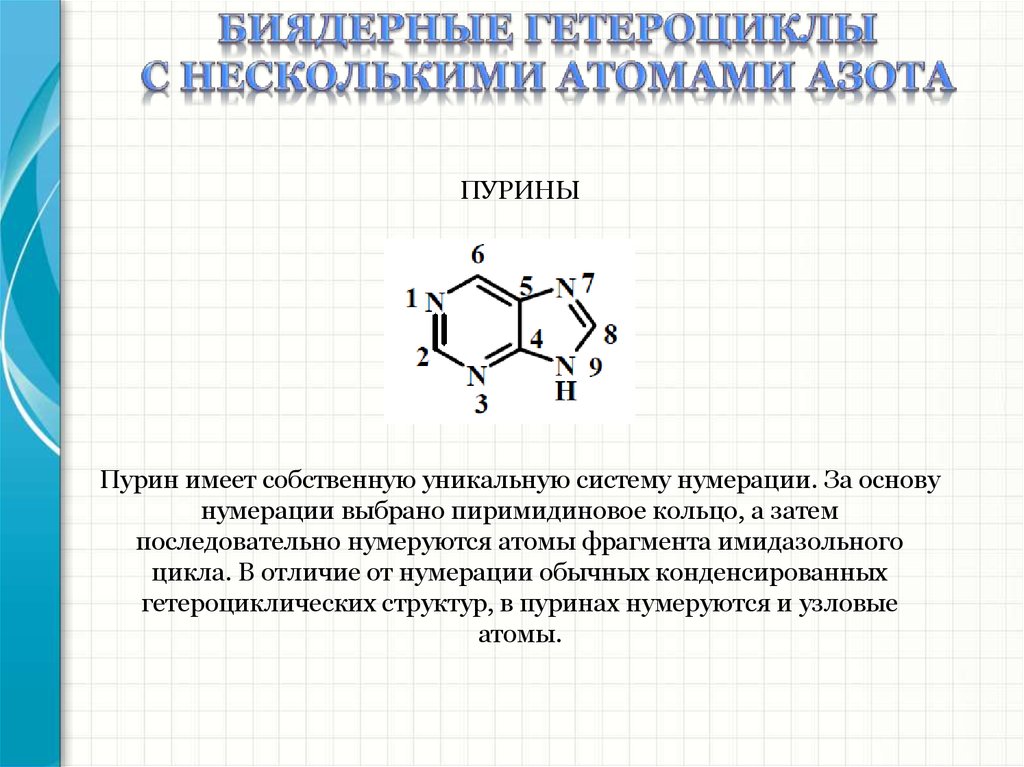
35.
ПУРИНЫПурин имеет собственную уникальную систему нумерации. За основу
нумерации выбрано пиримидиновое кольцо, а затем
последовательно нумеруются атомы фрагмента имидазольного
цикла. В отличие от нумерации обычных конденсированных
гетероциклических структур, в пуринах нумеруются и узловые
атомы.
36.
Среди производных пурина огромноебиологическое значение имеют аденин
и гуанин, мочевая кислота.
Широко известны такие производные
пурина, как кофеин и родственные ему
алкалоиды теобромин и теофиллин,
возбуждающие нервную систему и
повышающие умственную и физическую
работоспособность.
Препарат ацикловир служит для борьбы с вирусом Herpes.
Среди изостеров пуринов (производных
с другим расположением атомов азота
в пятичленном цикле) также известны
аллопуринол и виагра.
37.
Алкалоиды - азотсодержащие вещества оснóвного характера, являющиесявторичными метаболитами преимущественно растений. Обладают высокой
биологической и физиологической активностью.
Известно более 10000 алкалоидов, из них очень мало метаболитов животных,
морских организмов, высших и низших грибов, водорослей.
Иногда присутствуют в виде четвертичных солей или солей органических кислот
(лимонной, яблочной, янтарной, щавелевой, реже – уксусной, пропионовой и т.д.)
Различают истинные алкалоиды (как правило, азагетероциклические соединения;
биогенетически происходят от аминокислот) и протоалкалоиды (азот не включён в
циклический фрагмент молекулы, азотсодержащая функция находится вне
основного углеродного скелета молекулы).
Способность алкалоидов к солеобразованию используют для их выделения из
экстрактов растительного сырья.
Образуют интенсивно окрашенные соли и комплексы с пикриновой,
фосфорномолибденовой,
фосфорновольфрамовой
и
кремневольфрамовой
кислотами, что используется для аналитического (качественного) обнаружения
алкалоидов.
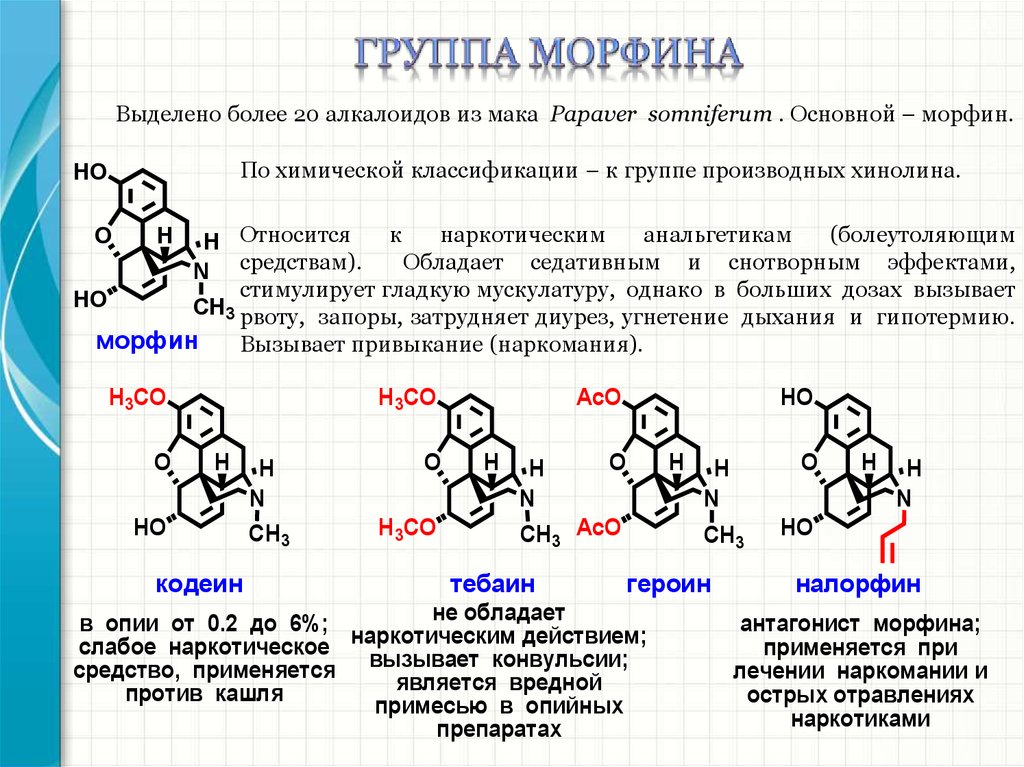
38.
Выделено более 20 алкалоидов из мака Papaver somniferum . Основной – морфин.По химической классификации – к группе производных хинолина.
HO
к
наркотическим
анальгетикам
(болеутоляющим
H Относится
Обладает седативным и снотворным эффектами,
N средствам).
стимулирует гладкую мускулатуру, однако в больших дозах вызывает
HO
CH3 рвоту, запоры, затрудняет диурез, угнетение дыхания и гипотермию.
морфин
Вызывает привыкание (наркомания).
O
H
H3CO
O
H3CO
H
HO
кодеин
H
N
CH3
O
H3CO
AcO
H
H
N
HO
O
H
CH3 AcO
тебаин
O
H
N
CH3
героин
не обладает
в опии от 0.2 до 6%;
слабое наркотическое наркотическим действием;
средство, применяется вызывает конвульсии;
является вредной
против кашля
примесью в опийных
препаратах
H
H
N
HO
налорфин
антагонист морфина;
применяется при
лечении наркомании и
острых отравлениях
наркотиками
39.
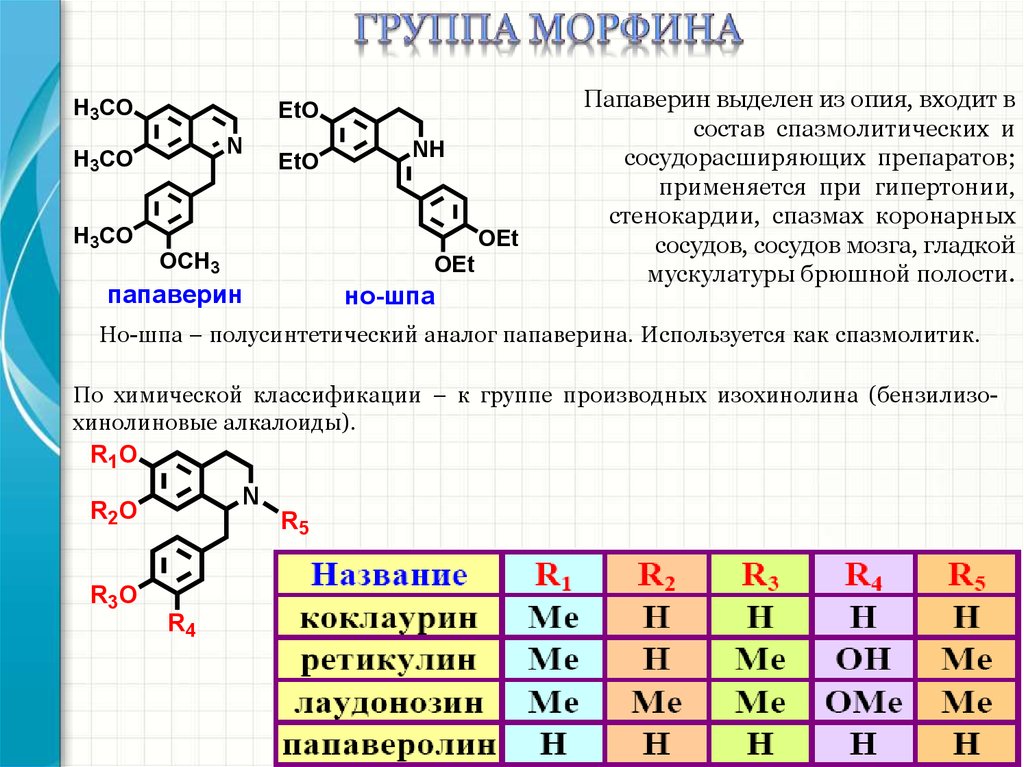
H3COEtO
N
H3CO
EtO
NH
H3CO
OEt
OCH3
OEt
папаверин
но-шпа
Папаверин выделен из опия, входит в
состав спазмолитических и
сосудорасширяющих препаратов;
применяется при гипертонии,
стенокардии, спазмах коронарных
сосудов, сосудов мозга, гладкой
мускулатуры брюшной полости.
Но-шпа – полусинтетический аналог папаверина. Используется как спазмолитик.
По химической классификации – к группе производных изохинолина (бензилизохинолиновые алкалоиды).
R1O
N
R2O
R3O
R4
R5
40.
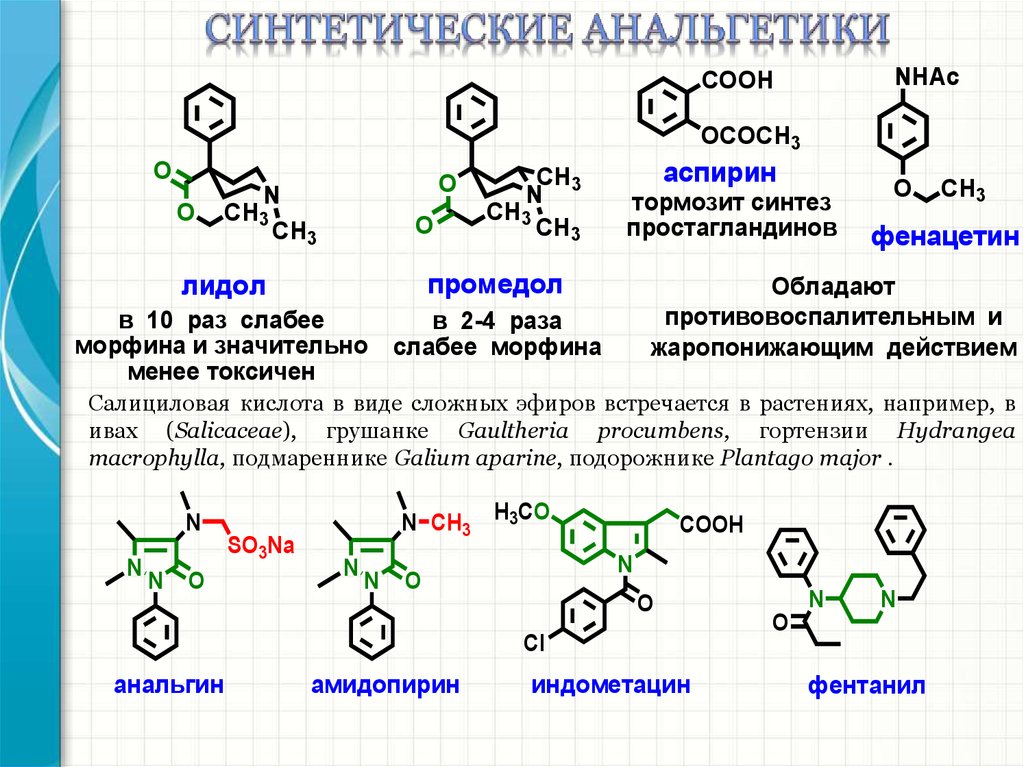
NHAcCOOH
OCOCH3
O
O
O
N
CH3
CH3
O
CH3
N
CH3
CH3
лидол
промедол
в 10 раз слабее
морфина и значительно
менее токсичен
в 2-4 раза
слабее морфина
аспирин
тормозит синтез
простагландинов
O
CH3
фенацетин
Обладают
противовоспалительным и
жаропонижающим действием
Салициловая кислота в виде сложных эфиров встречается в растениях, например, в
ивах (Salicaceae), грушанке Gaultheria procumbens, гортензии Hydrangea
macrophylla, подмареннике Galium aparine, подорожнике Plantago major .
N CH3 H3CO
N
N
SO3Na
N
O
N
N
COOH
N
O
O
Cl
анальгин
амидопирин
индометацин
N
N
O
фентанил
41.
NCH3
OH
O
O
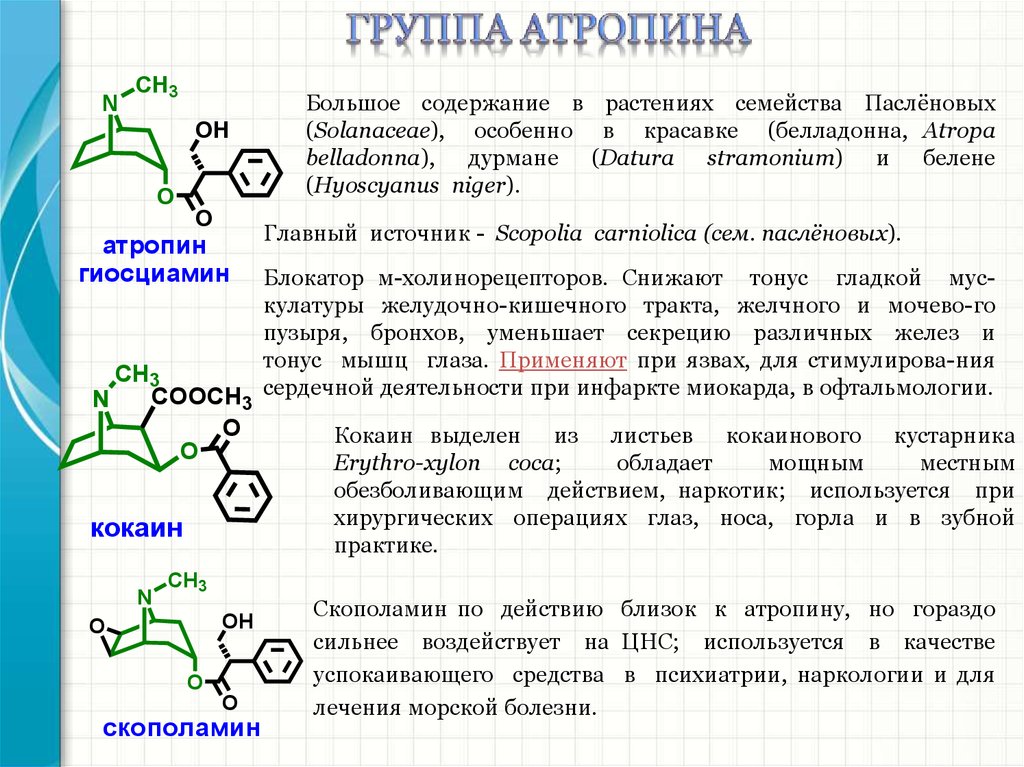
атропин
гиосциамин
Большое содержание в растениях семейства Паслёновых
(Solanaceae), особенно в красавке (белладонна, Atropa
belladonna), дурмане (Datura stramonium) и белене
(Hyoscyanus niger).
Главный источник - Scopolia carniolica (сем. паслёновых).
Блокатор м-холинорецепторов. Снижают тонус гладкой мускулатуры желудочно-кишечного тракта, желчного и мочево-го
пузыря, бронхов, уменьшает секрецию различных желез и
тонус мышц глаза. Применяют при язвах, для стимулирова-ния
CH3
COOCH3 сердечной деятельности при инфаркте миокарда, в офтальмологии.
N
O
O
кокаин
N
CH3
OH
O
O
O
скополамин
Кокаин выделен из листьев кокаинового кустарника
Erythro-xylon coca;
обладает
мощным
местным
обезболивающим действием, наркотик; используется при
хирургических операциях глаз, носа, горла и в зубной
практике.
Скополамин по действию близок к атропину, но гораздо
сильнее воздействует на ЦНС; используется в качестве
успокаивающего средства в психиатрии, наркологии и для
лечения морской болезни.
42.
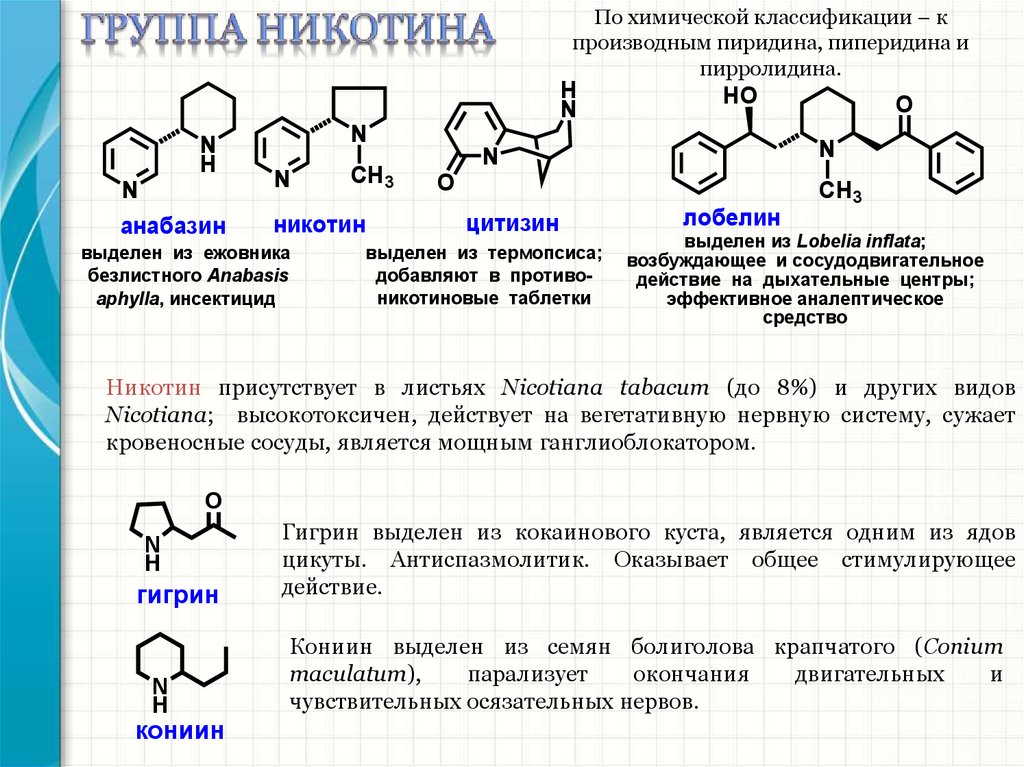
По химической классификации – кпроизводным пиридина, пиперидина и
пирролидина.
H
N
N
H
HO
N
CH3
N
N
анабазин
никотин
выделен из ежовника
безлистного Anabasis
aphylla, инсектицид
N
N
O
цитизин
выделен из термопсиса;
добавляют в противоникотиновые таблетки
O
лобелин
CH3
выделен из Lobelia inflata;
возбуждающее и сосудодвигательное
действие на дыхательные центры;
эффективное аналептическое
средство
Никотин присутствует в листьях Nicotiana tabacum (до 8%) и других видов
Nicotiana; высокотоксичен, действует на вегетативную нервную систему, сужает
кровеносные сосуды, является мощным ганглиоблокатором.
O
N
H
гигрин
N
H
кониин
Гигрин выделен из кокаинового куста, является одним из ядов
цикуты. Антиспазмолитик. Оказывает общее стимулирующее
действие.
Кониин выделен из семян болиголова крапчатого (Conium
maculatum),
парализует
окончания
двигательных
и
чувствительных осязательных нервов.
43.
OH HN
H
Ph
(R) OH
(S)
H 3C
CH3
NHCH3
H
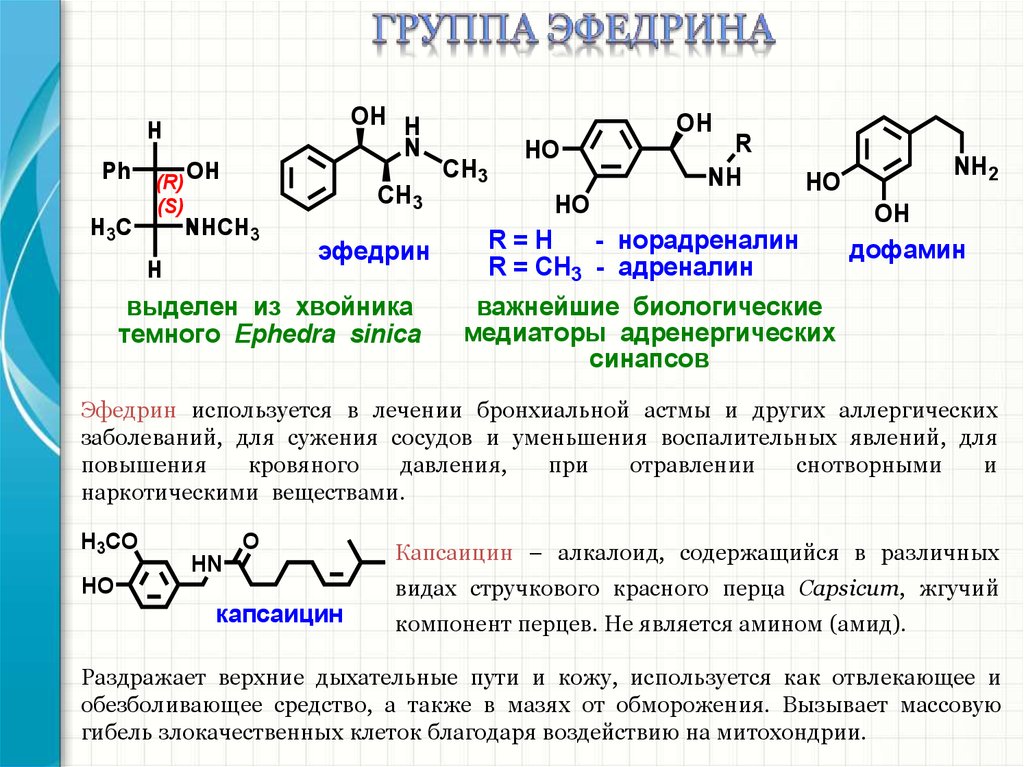
эфедрин
выделен из хвойника
темного Ephedra sinica
OH
CH3
HO
HO
R
NH
NH2
HO
R=H
- норадреналин
R = СH3 - адреналин
важнейшие биологические
медиаторы адренергических
синапсов
OH
дофамин
Эфедрин используется в лечении бронхиальной астмы и других аллергических
заболеваний, для сужения сосудов и уменьшения воспалительных явлений, для
повышения
кровяного
давления,
при
отравлении
снотворными
и
наркотическими веществами.
H3CO
O
HN
HO
капсаицин
Капсаицин – алкалоид, содержащийся в различных
видах стручкового красного перца Capsicum, жгучий
компонент перцев. Не является амином (амид).
Раздражает верхние дыхательные пути и кожу, используется как отвлекающее и
обезболивающее средство, а также в мазях от обморожения. Вызывает массовую
гибель злокачественных клеток благодаря воздействию на митохондрии.
44.
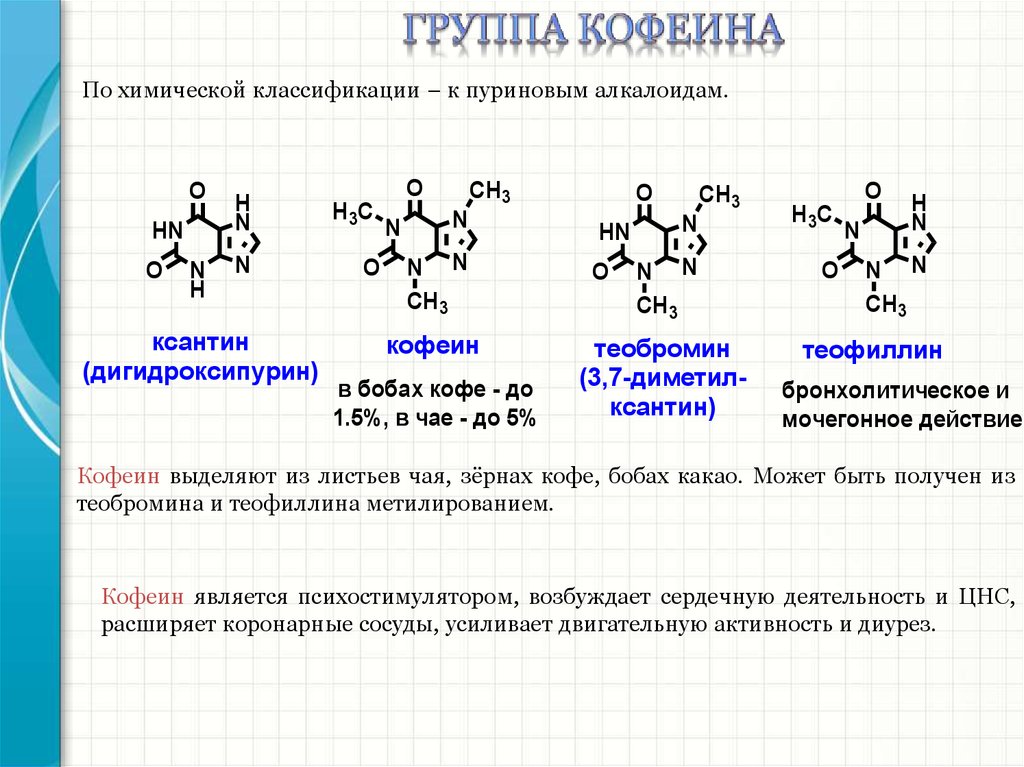
По химической классификации – к пуриновым алкалоидам.O
HN
O
N
H
H
N
H3C
N
O
ксантин
(дигидроксипурин)
O
N
N
CH3
N N
CH3
кофеин
в бобах кофе - до
1.5%, в чае - до 5%
O
HN
O
N
CH3
N N
CH3
теобромин
(3,7-диметилксантин)
H3C
O
O
N
H
N
N N
CH3
теофиллин
бронхолитическое и
мочегонное действие
Кофеин выделяют из листьев чая, зёрнах кофе, бобах какао. Может быть получен из
теобромина и теофиллина метилированием.
Кофеин является психостимулятором, возбуждает сердечную деятельность и ЦНС,
расширяет коронарные сосуды, усиливает двигательную активность и диурез.















 Химия
Химия








