Похожие презентации:
Гетероциклические соединения
1. Гетероциклические соединения
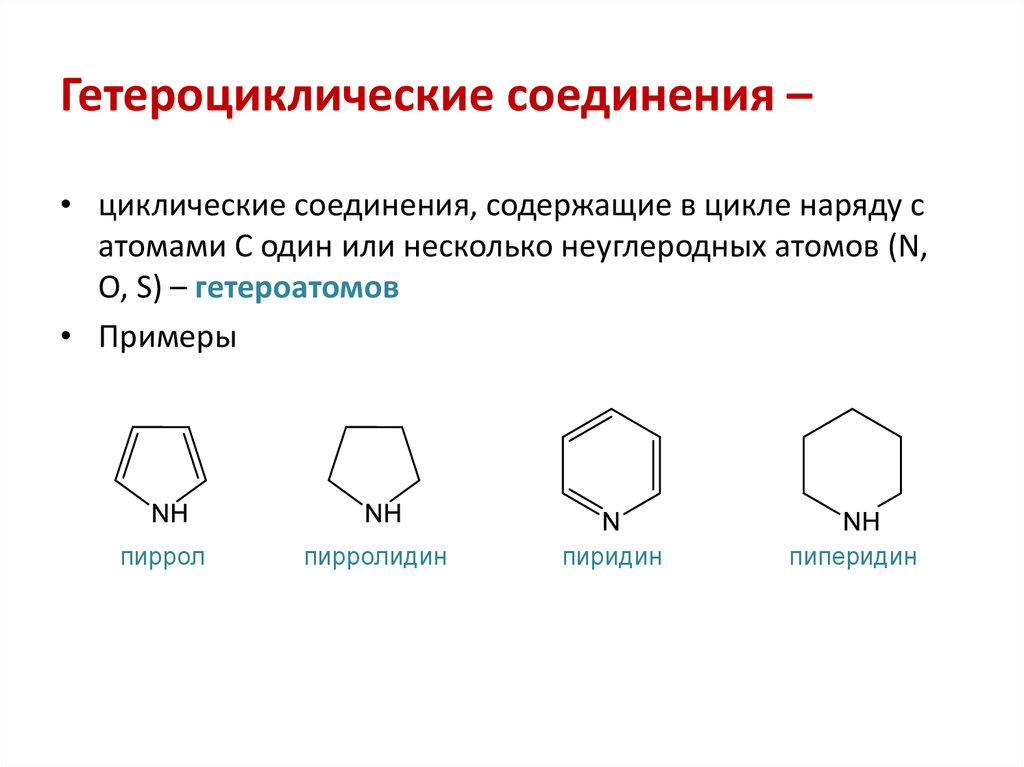
2. Гетероциклические соединения –
• циклические соединения, содержащие в цикле наряду сатомами С один или несколько неуглеродных атомов (N,
O, S) – гетероатомов
• Примеры
пиррол
пирролидин
пиридин
пиперидин
3. Классификации гетероциклов
4.
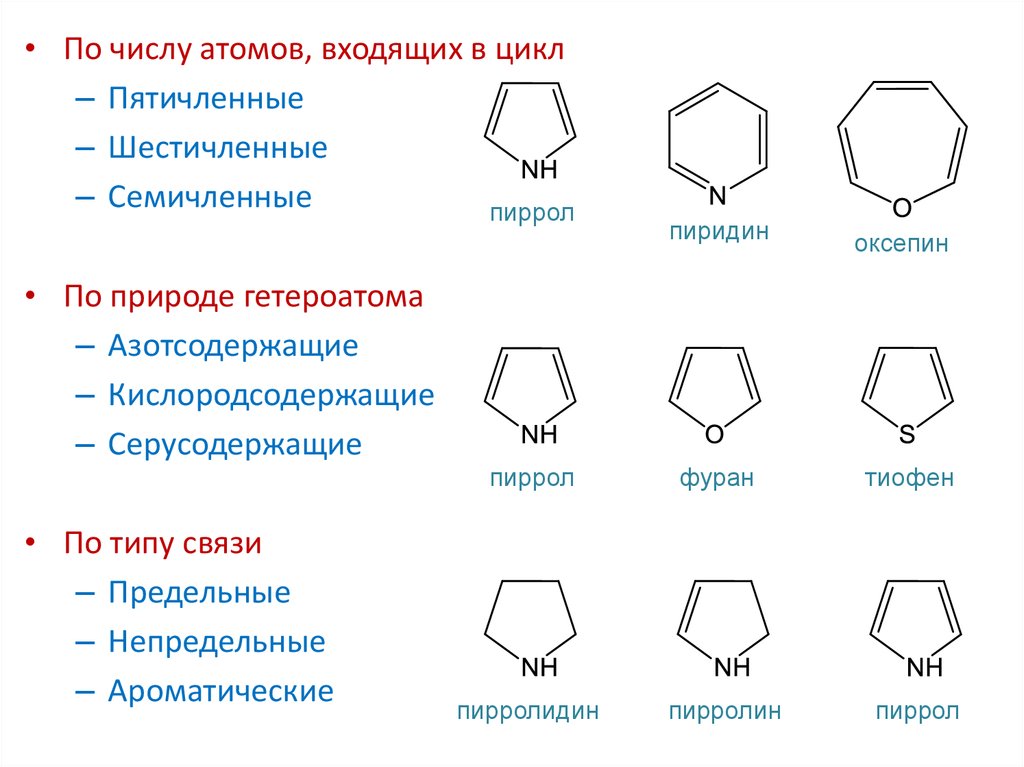
• По числу атомов, входящих в цикл– Пятичленные
– Шестичленные
– Семичленные
пиррол
пиридин
оксепин
• По природе гетероатома
– Азотсодержащие
– Кислородсодержащие
– Серусодержащие
пиррол
• По типу связи
– Предельные
– Непредельные
– Ароматические
пирролидин
фуран
пирролин
тиофен
пиррол
5.
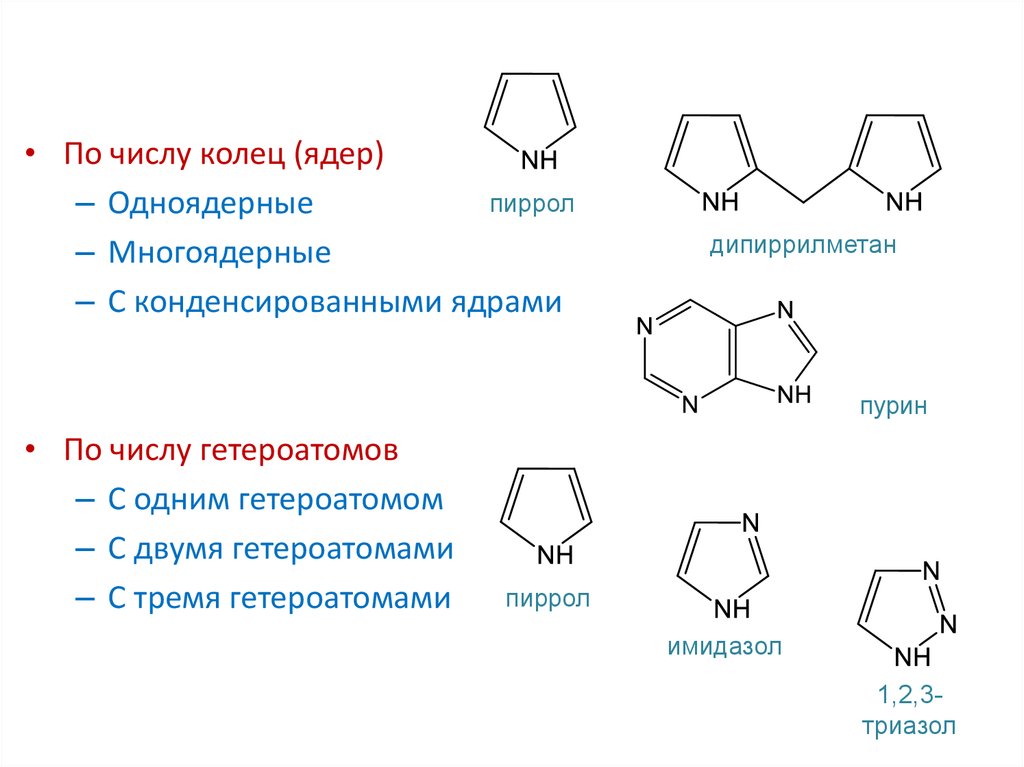
• По числу колец (ядер)пиррол
– Одноядерные
– Многоядерные
– С конденсированными ядрами
дипиррилметан
пурин
• По числу гетероатомов
– С одним гетероатомом
– С двумя гетероатомами
– С тремя гетероатомами
пиррол
имидазол
1,2,3триазол
6. Пятичленные гетероциклы с одним гетероатомом
7.
фурантиофен
пиррол
2,3- и 2,5-дигидропиррол
(пирролин)
пирролидин
• Фуран, тиофен, пиррол и их гидрированные производные
• 2, 5 – -положения; 3, 4 – -положения
• (4n+2) -электронов – ароматические соединения
• Электронная плотность распределена неравномерно: > в
-положениях
• У N, O, S электронная пара вовлекается в общий
электронный секстет:
• Реакции SE идут в -положения и легче, чем у бензола
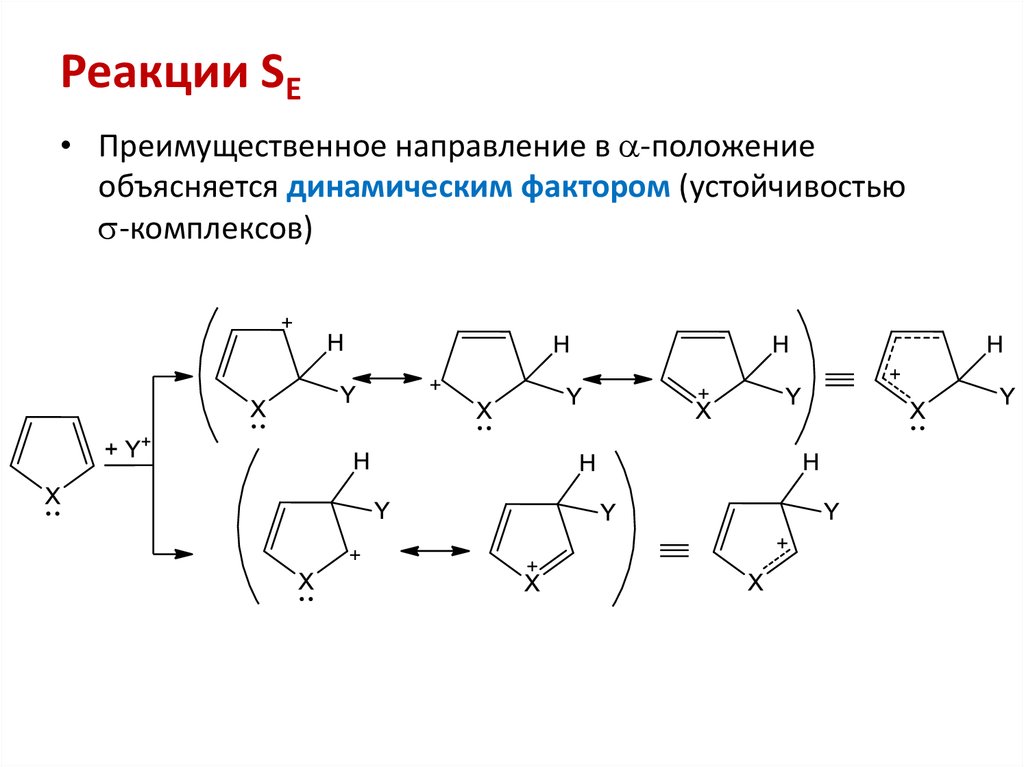
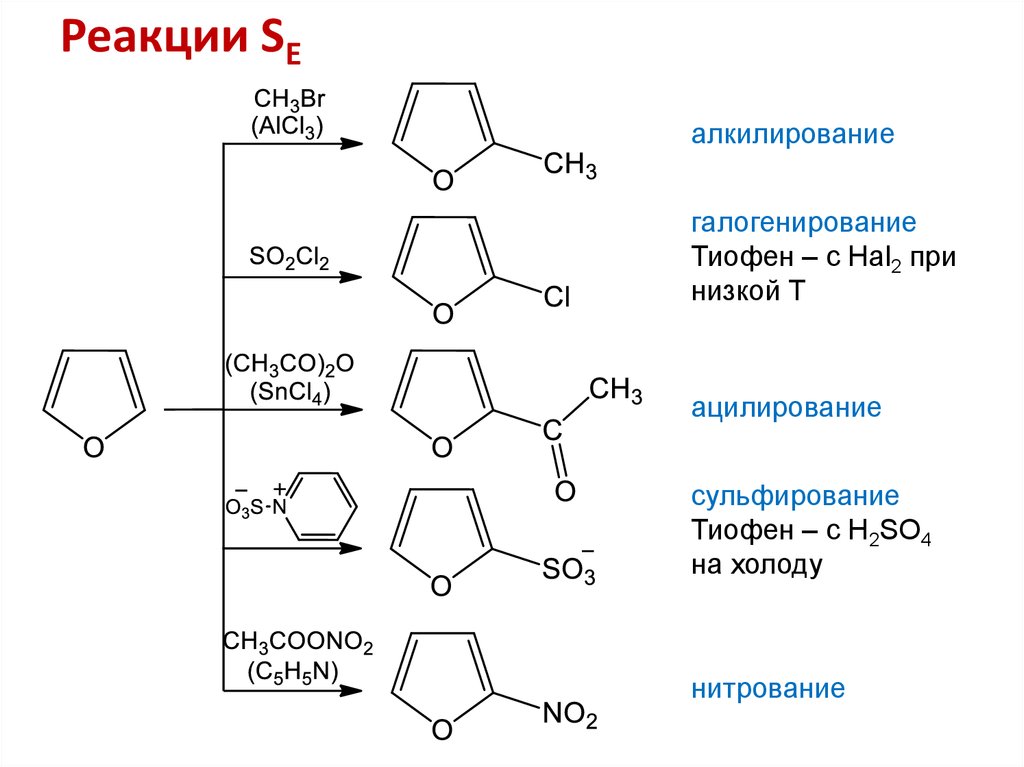
8. Реакции SE
• Преимущественное направление в -положениеобъясняется динамическим фактором (устойчивостью
-комплексов)
9. Реакции SE
алкилированиегалогенирование
Тиофен – с Hal2 при
низкой Т
ацилирование
сульфирование
Тиофен – с H2SO4
на холоду
нитрование
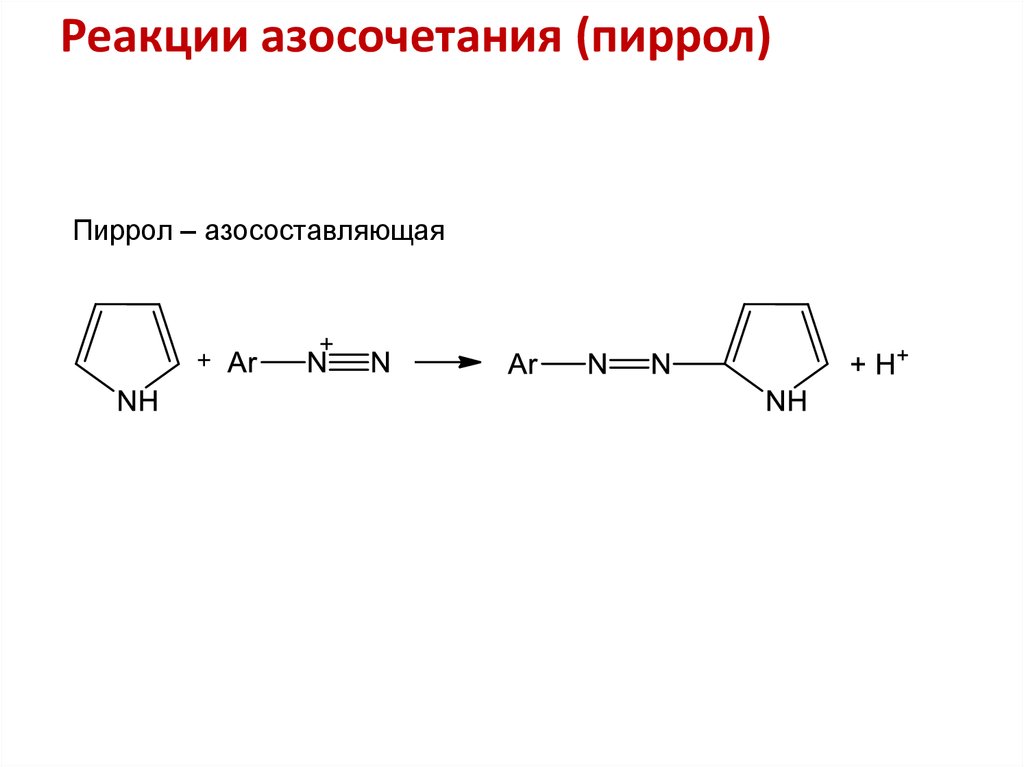
10. Реакции азосочетания (пиррол)
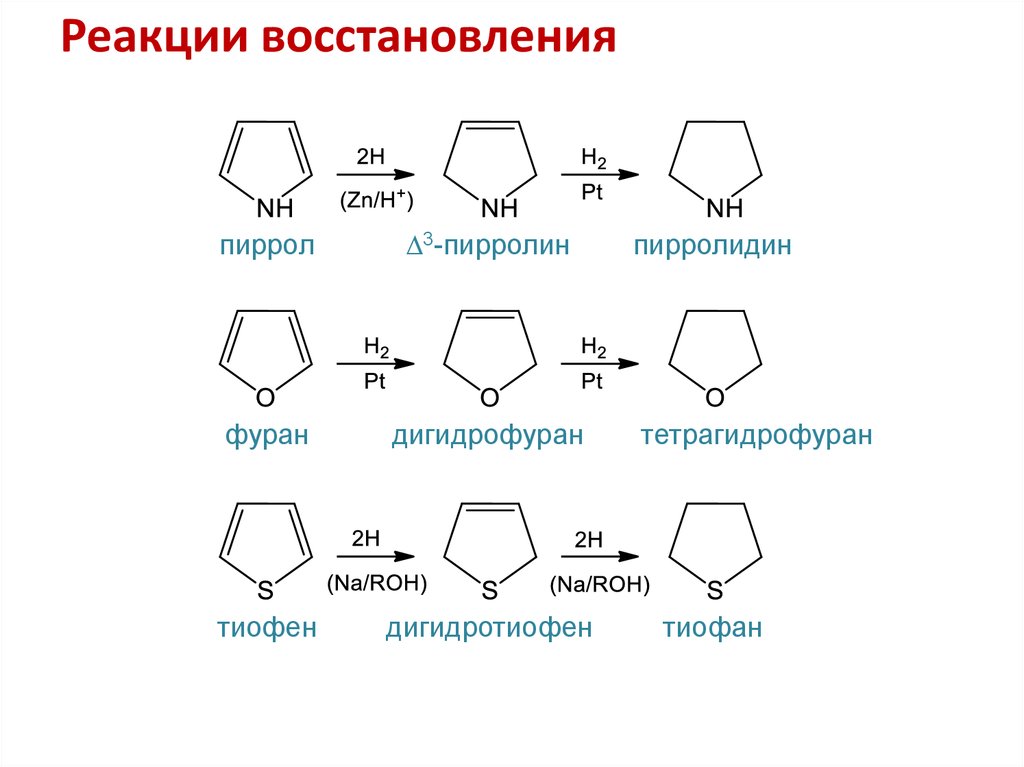
Пиррол – азосоставляющая11. Реакции восстановления
пиррол3-пирролин
фуран
дигидрофуран
тиофен
дигидротиофен
пирролидин
тетрагидрофуран
тиофан
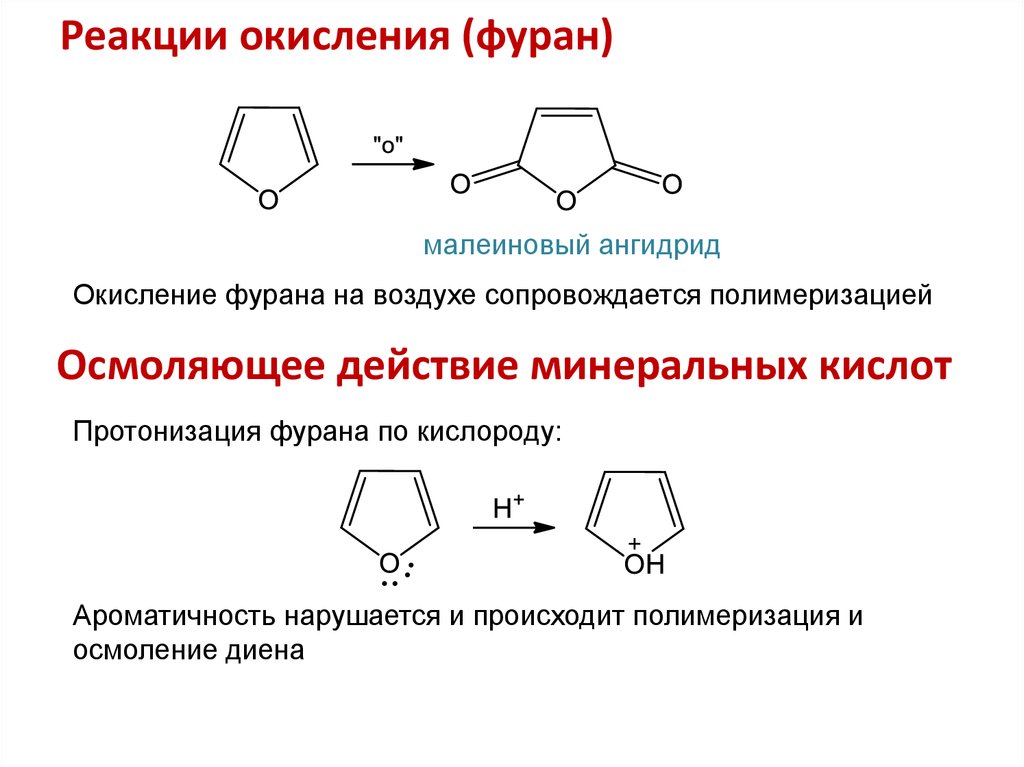
12. Реакции окисления (фуран)
малеиновый ангидридОкисление фурана на воздухе сопровождается полимеризацией
Осмоляющее действие минеральных кислот
Протонизация фурана по кислороду:
Ароматичность нарушается и происходит полимеризация и
осмоление диена
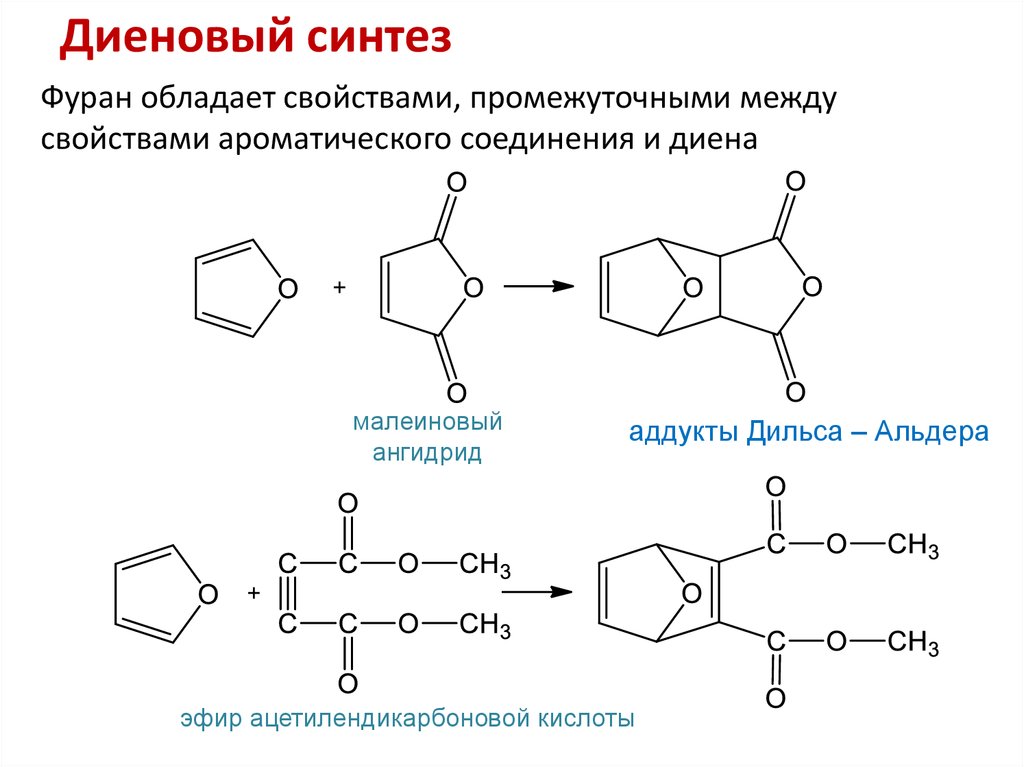
13. Диеновый синтез
Фуран обладает свойствами, промежуточными междусвойствами ароматического соединения и диена
малеиновый
ангидрид
аддукты Дильса – Альдера
эфир ацетилендикарбоновой кислоты
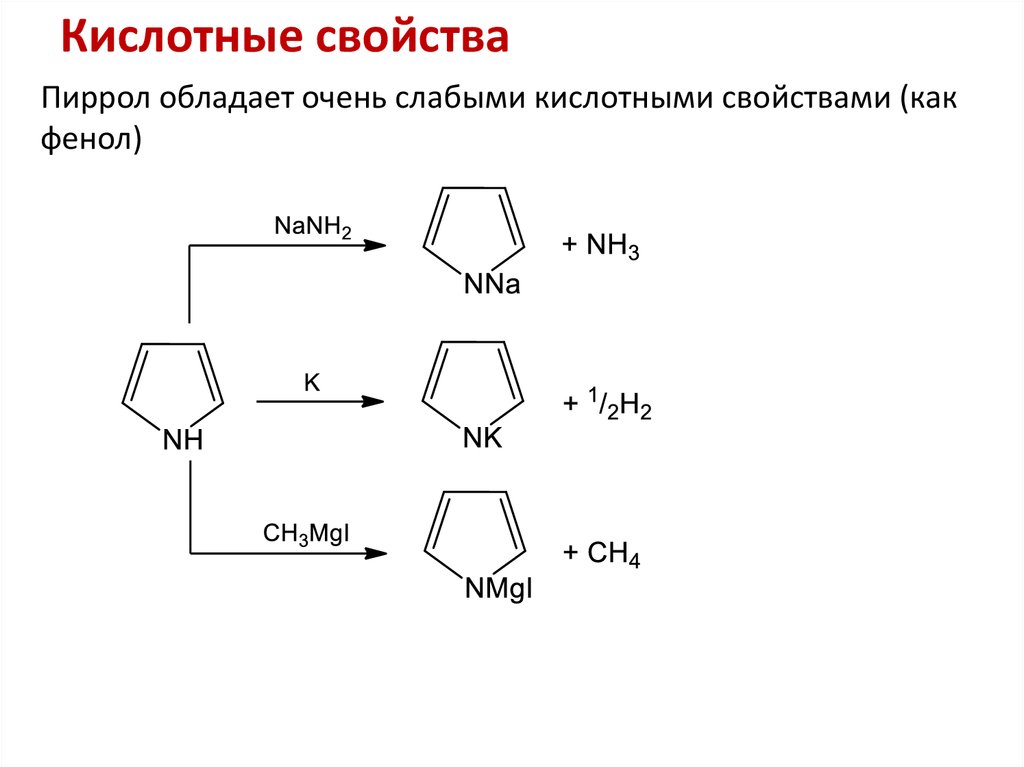
14. Кислотные свойства
Пиррол обладает очень слабыми кислотными свойствами (какфенол)
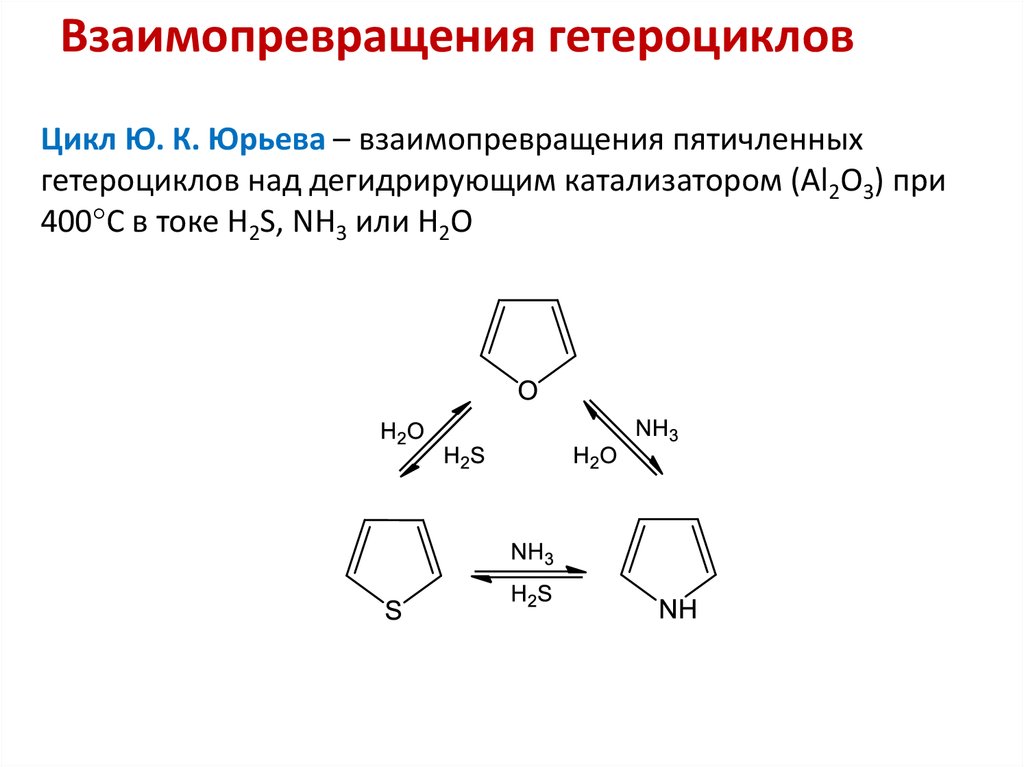
15. Взаимопревращения гетероциклов
Цикл Ю. К. Юрьева – взаимопревращения пятичленныхгетероциклов над дегидрирующим катализатором (Al2O3) при
400 С в токе H2S, NH3 или Н2О
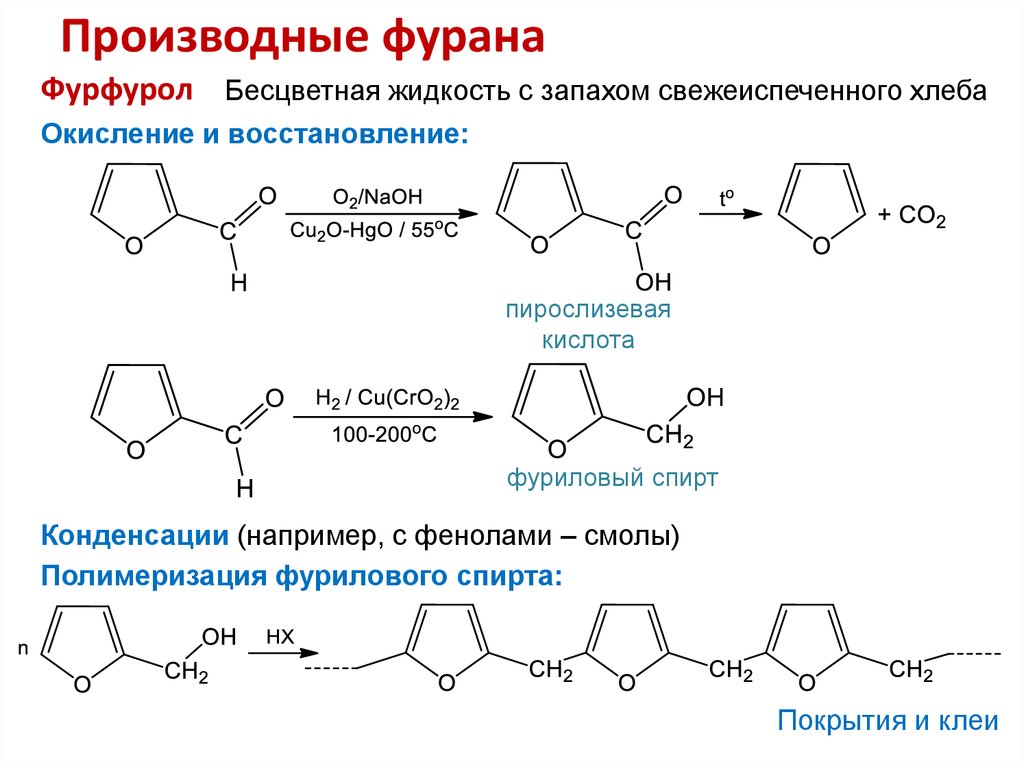
16. Производные фурана
Фурфурол Бесцветная жидкость с запахом свежеиспеченного хлебаОкисление и восстановление:
пирослизевая
кислота
фуриловый спирт
Конденсации (например, с фенолами – смолы)
Полимеризация фурилового спирта:
Покрытия и клеи
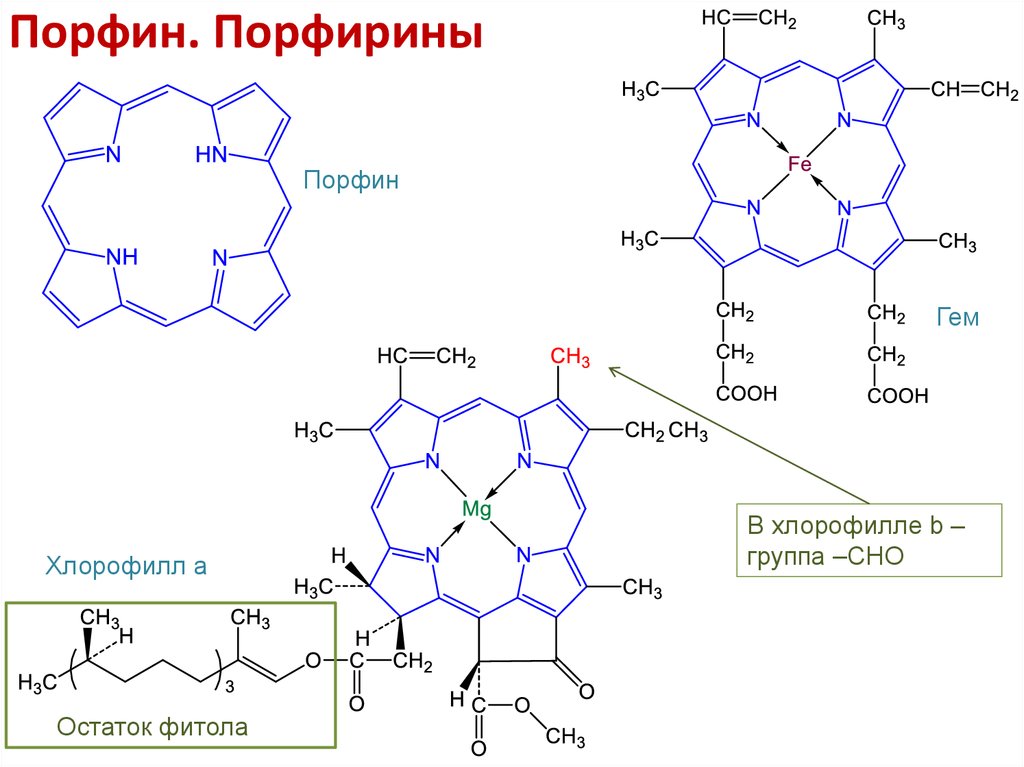
17. Порфин. Порфирины
ПорфинГем
Хлорофилл а
Остаток фитола
В хлорофилле b –
группа –СНО
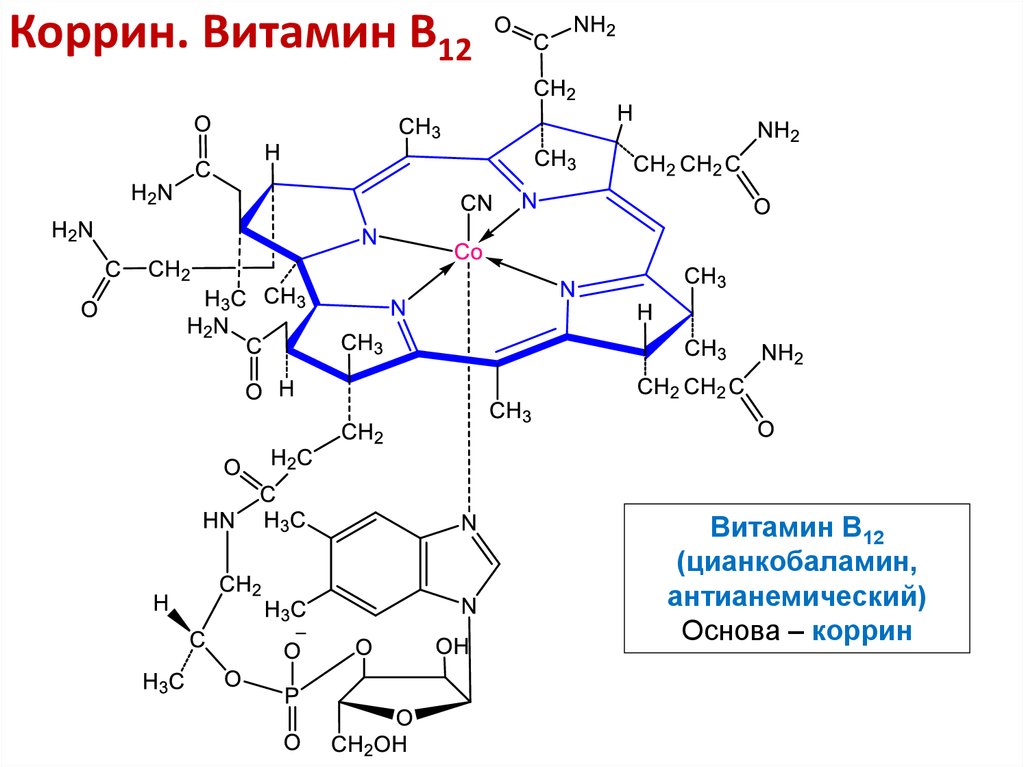
18. Коррин. Витамин В12
Витамин В12(цианкобаламин,
антианемический)
Основа – коррин
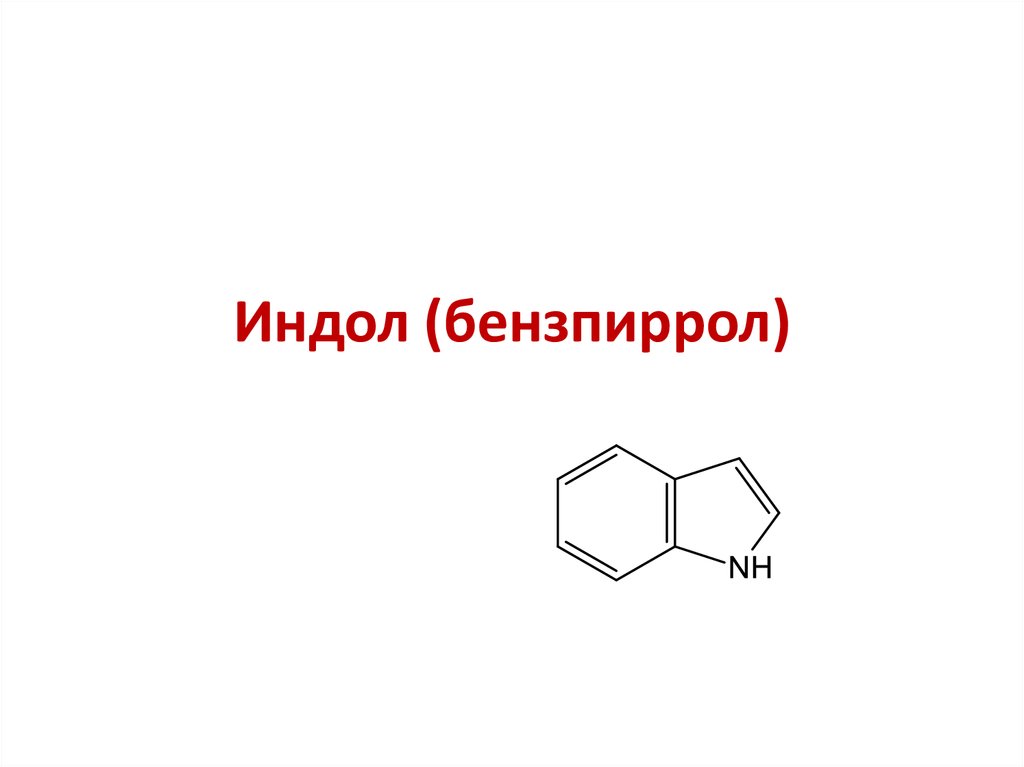
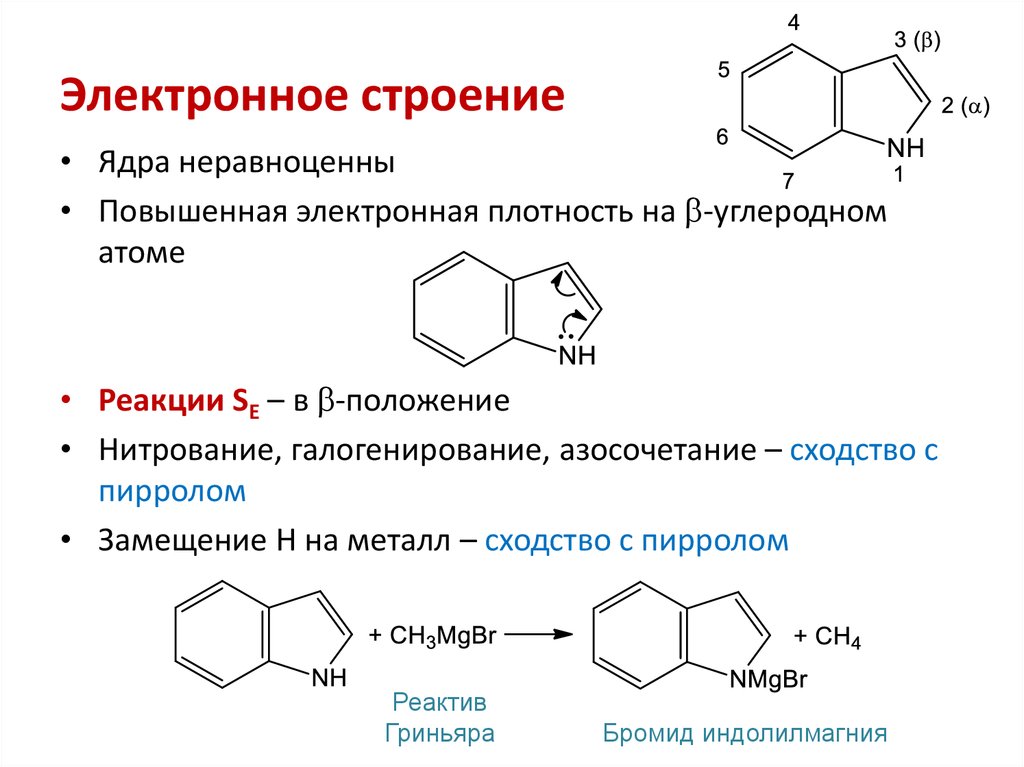
19. Индол (бензпиррол)
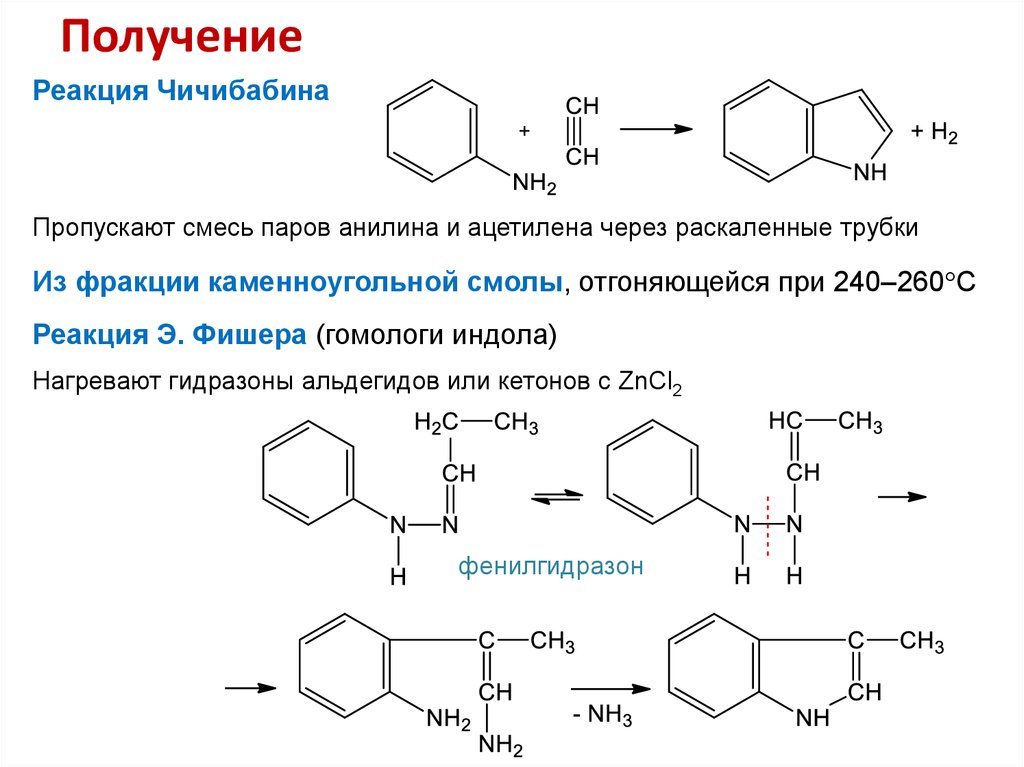
20. Получение
Реакция ЧичибабинаПропускают смесь паров анилина и ацетилена через раскаленные трубки
Из фракции каменноугольной смолы, отгоняющейся при 240–260 С
Реакция Э. Фишера (гомологи индола)
Нагревают гидразоны альдегидов или кетонов с ZnCl2
фенилгидразон
21. Электронное строение
• Ядра неравноценны• Повышенная электронная плотность на -углеродном
атоме
• Реакции SE – в -положение
• Нитрование, галогенирование, азосочетание – сходство с
пирролом
• Замещение Н на металл – сходство с пирролом
Реактив
Гриньяра
Бромид индолилмагния
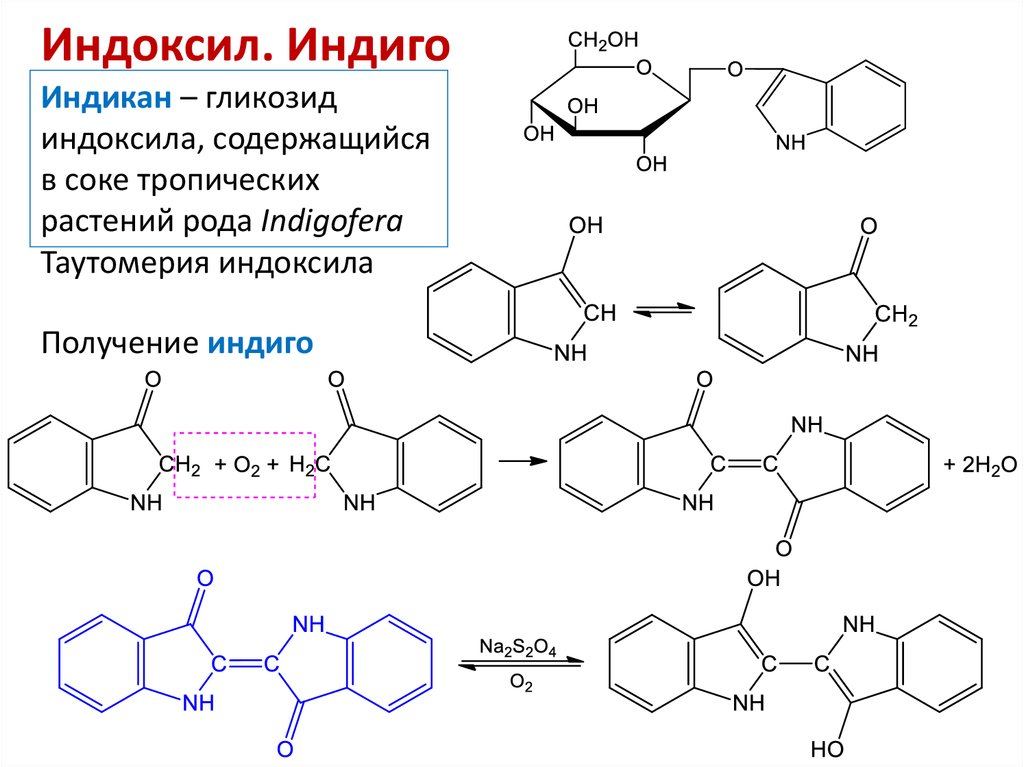
22. Индоксил. Индиго
Индикан – гликозидиндоксила, содержащийся
в соке тропических
растений рода Indigofera
Таутомерия индоксила
Получение индиго
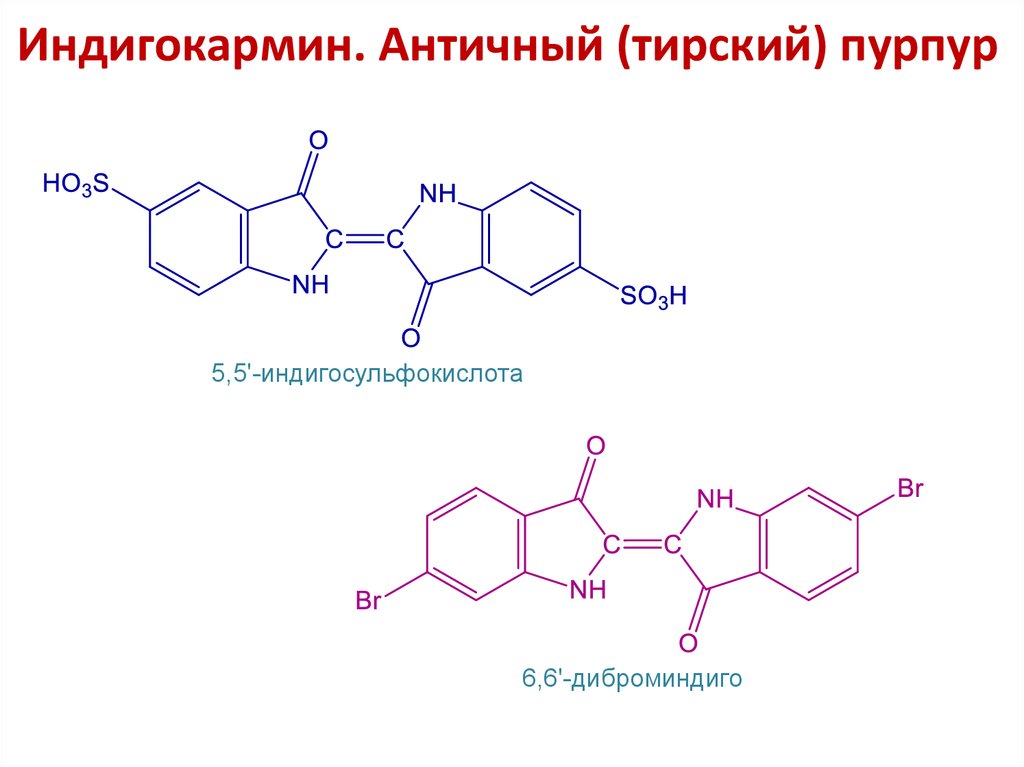
23. Индигокармин. Античный (тирский) пурпур
5,5'-индигосульфокислота6,6'-диброминдиго
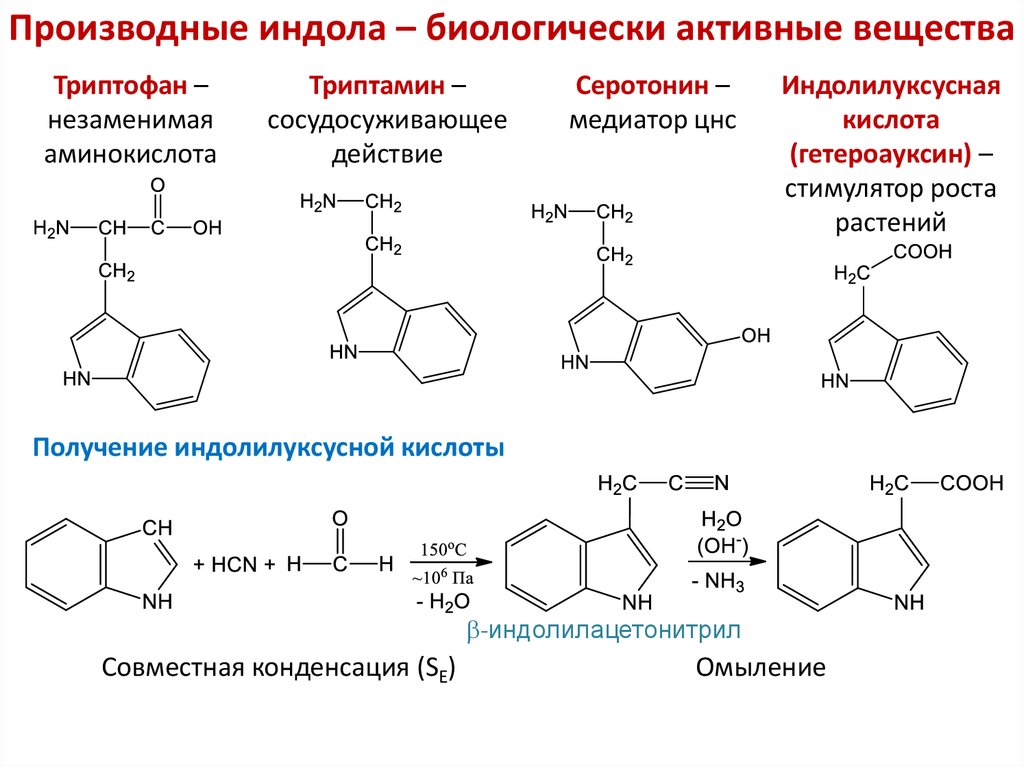
24. Производные индола – биологически активные вещества
Триптофан –незаменимая
аминокислота
Триптамин –
сосудосуживающее
действие
Серотонин –
медиатор цнс
Индолилуксусная
кислота
(гетероауксин) –
стимулятор роста
растений
Получение индолилуксусной кислоты
-индолилацетонитрил
Совместная конденсация (SE)
Омыление
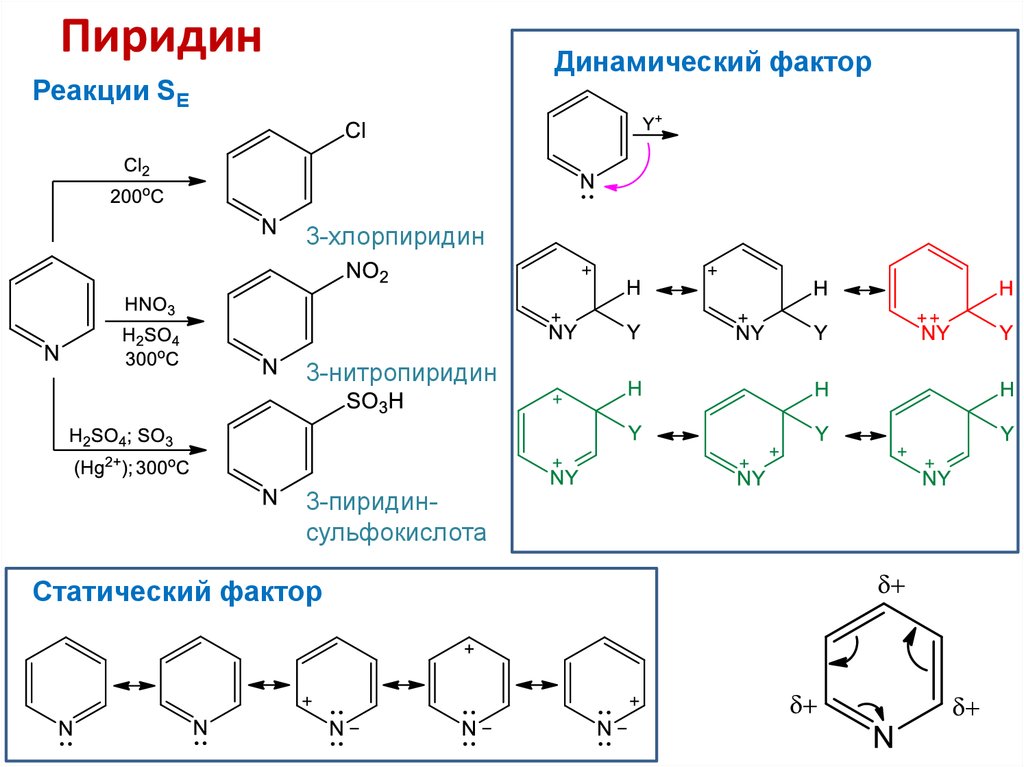
25. Шестичленные гетероциклы с одним гетероатомом. Пиридин
26. Пиридин
Динамический факторРеакции SE
3-хлорпиридин
3-нитропиридин
3-пиридинсульфокислота
Статический фактор
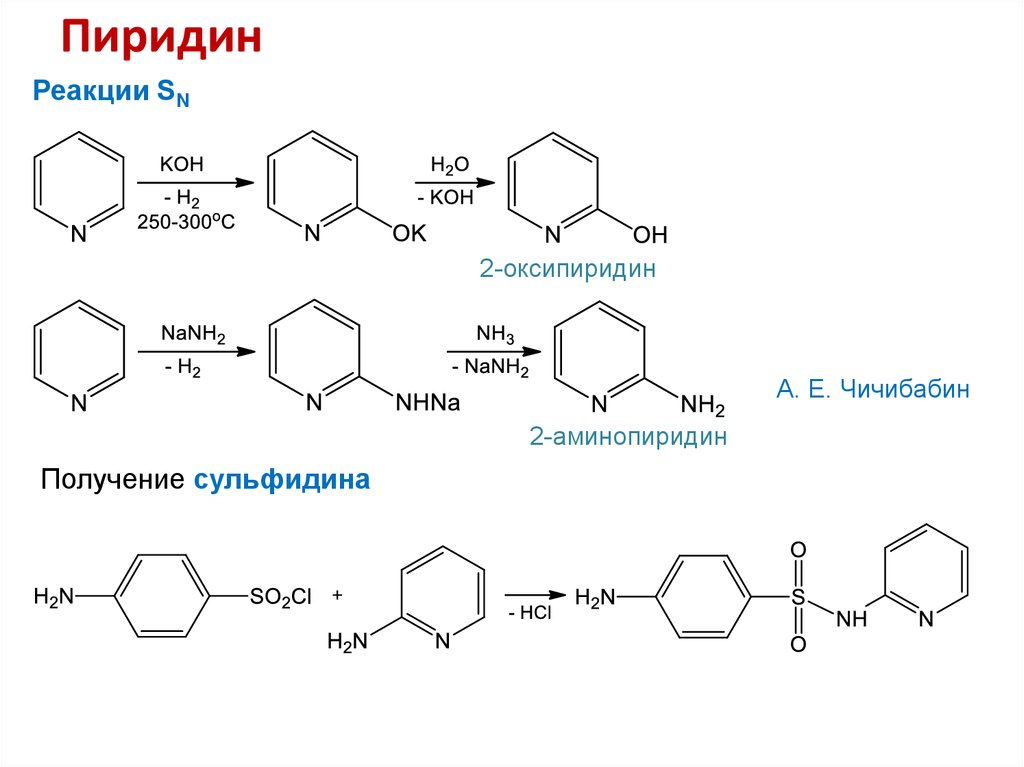
27. Пиридин
Реакции SN2-оксипиридин
А. Е. Чичибабин
2-аминопиридин
Получение сульфидина
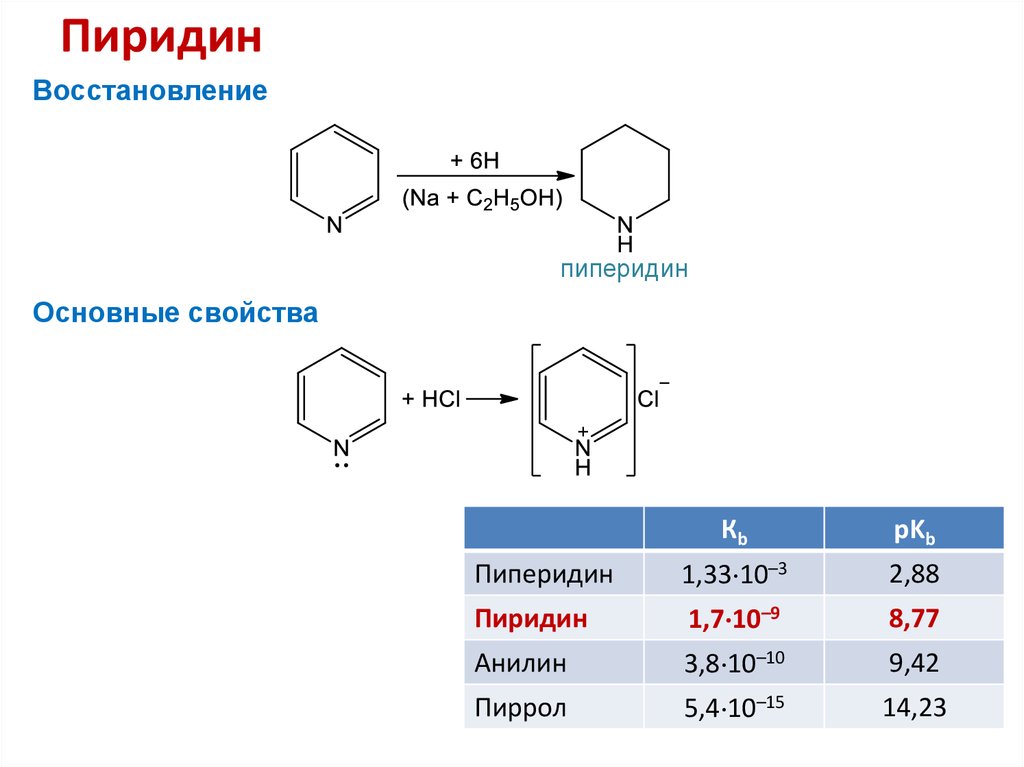
28. Пиридин
Восстановлениепиперидин
Основные свойства
Кb
pKb
Пиперидин
1,33 10–3
2,88
Пиридин
1,7 10–9
8,77
Анилин
3,8 10–10
9,42
Пиррол
5,4 10–15
14,23
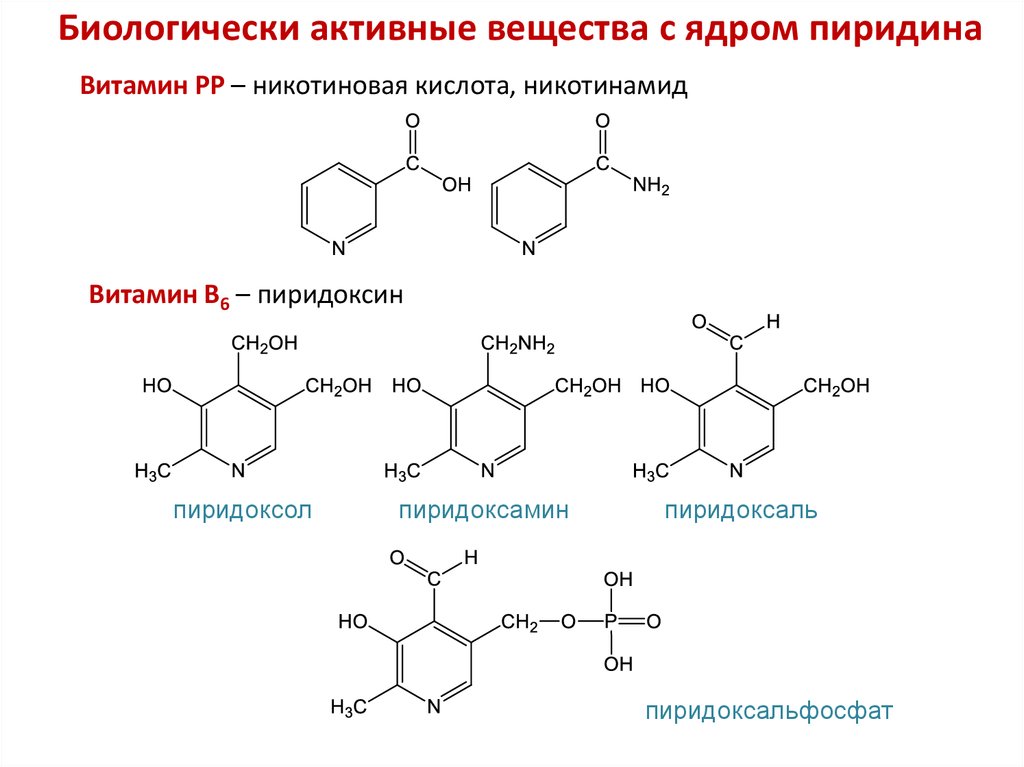
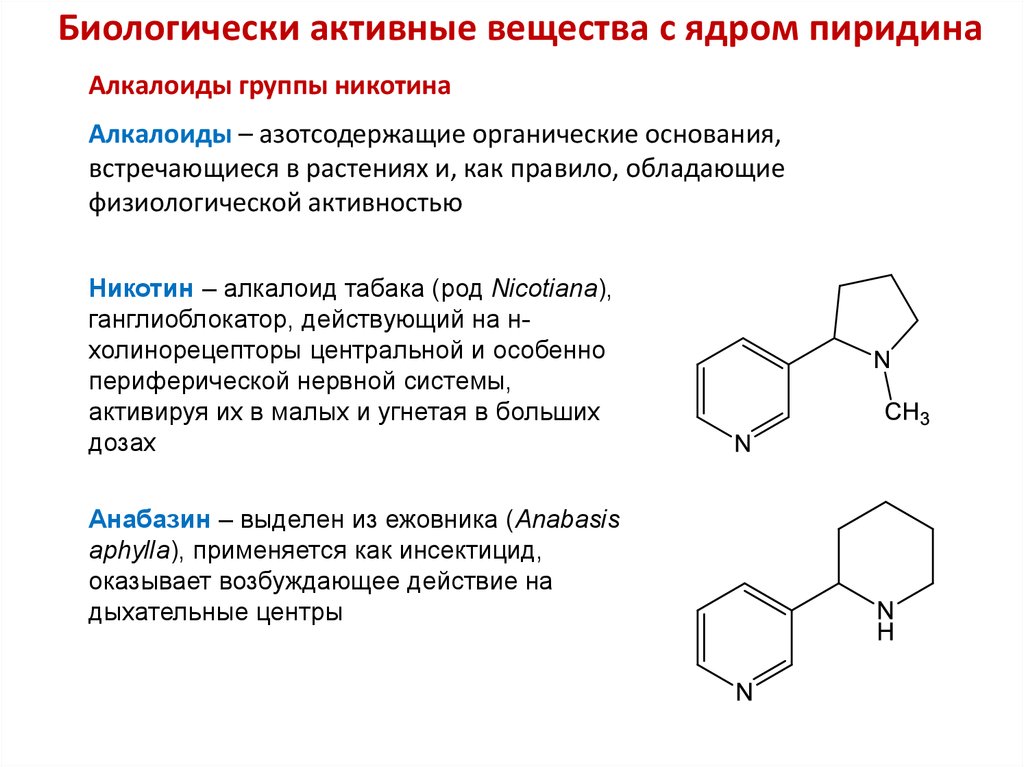
29. Биологически активные вещества с ядром пиридина
Витамин РР – никотиновая кислота, никотинамидВитамин В6 – пиридоксин
пиридоксол
пиридоксамин
пиридоксаль
пиридоксальфосфат
30. Биологически активные вещества с ядром пиридина
Алкалоиды группы никотинаАлкалоиды – азотсодержащие органические основания,
встречающиеся в растениях и, как правило, обладающие
физиологической активностью
Никотин – алкалоид табака (род Nicotiana),
ганглиоблокатор, действующий на нхолинорецепторы центральной и особенно
периферической нервной системы,
активируя их в малых и угнетая в больших
дозах
Анабазин – выделен из ежовника (Anabasis
aphylla), применяется как инсектицид,
оказывает возбуждающее действие на
дыхательные центры
31. Пятичленные гетероциклы с двумя гетероатомами
32.
фурантиофен
пиррол
оксазол
тиазол
имидазол
изоксазол
изотиазол
пиразол
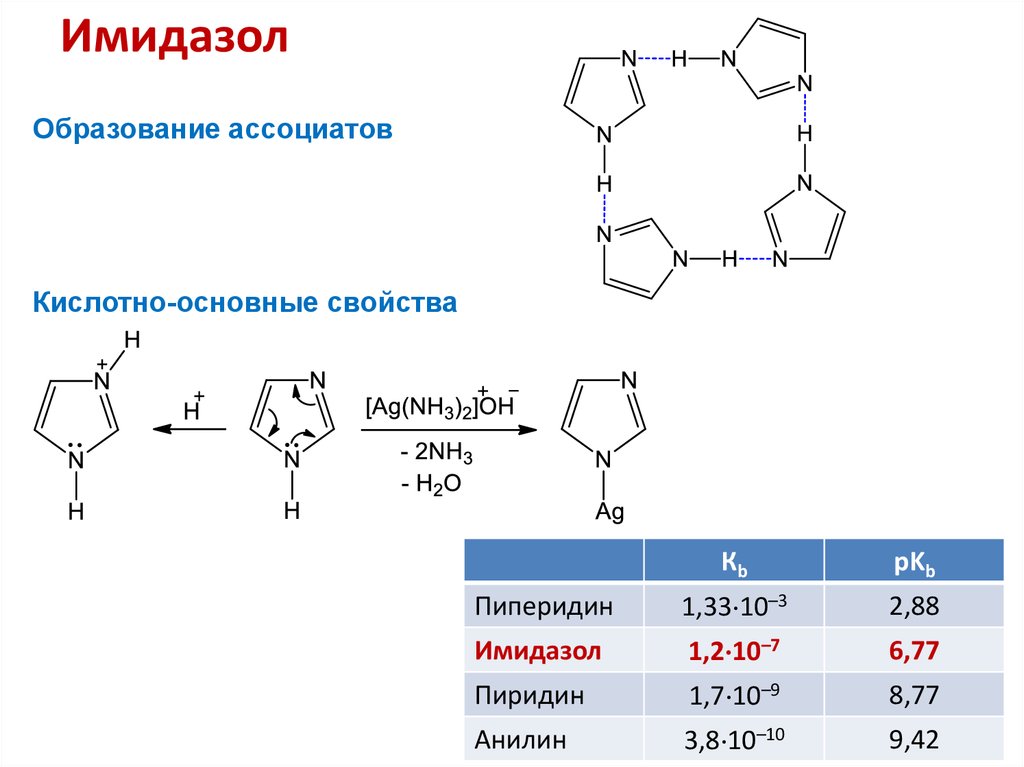
33. Имидазол
Образование ассоциатовКислотно-основные свойства
Кb
pKb
Пиперидин
1,33 10–3
2,88
Имидазол
1,2 10–7
6,77
Пиридин
1,7 10–9
8,77
Анилин
3,8 10–10
9,42
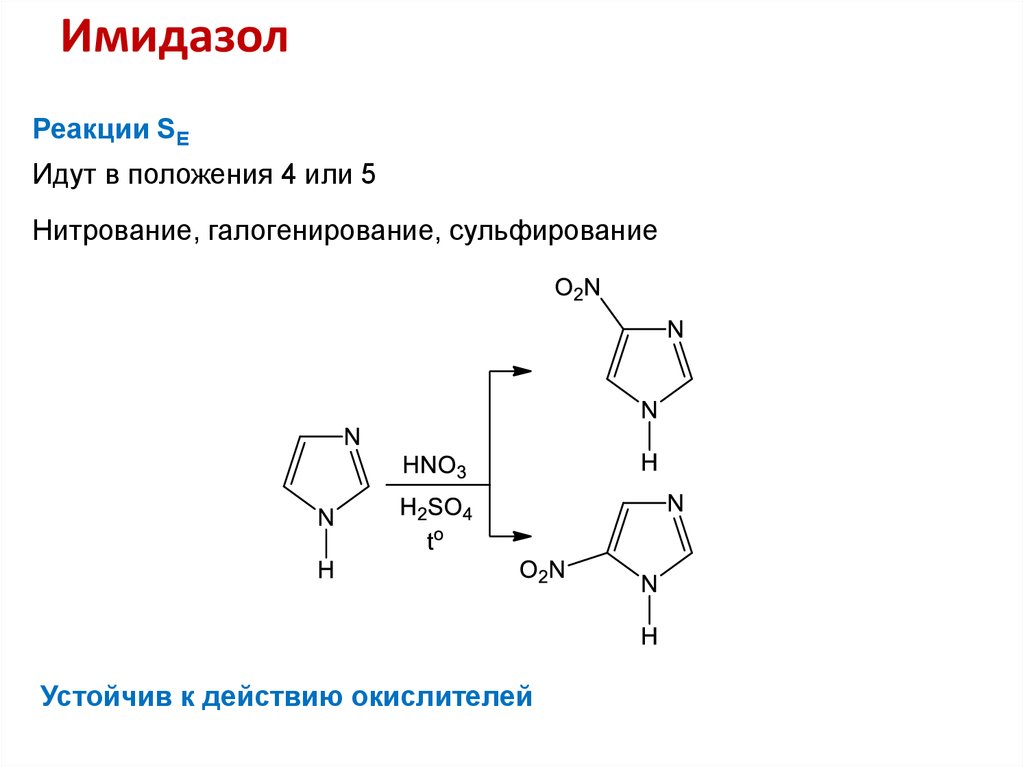
34. Имидазол
Реакции SEИдут в положения 4 или 5
Нитрование, галогенирование, сульфирование
Устойчив к действию окислителей
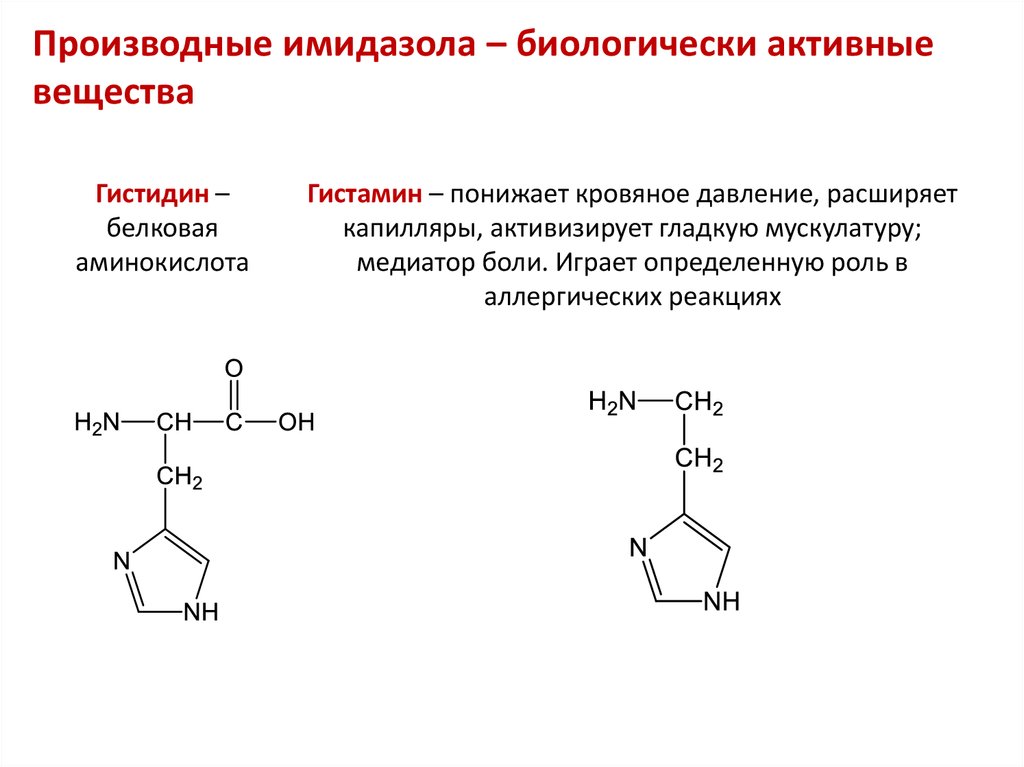
35. Производные имидазола – биологически активные вещества
Гистидин –белковая
аминокислота
Гистамин – понижает кровяное давление, расширяет
капилляры, активизирует гладкую мускулатуру;
медиатор боли. Играет определенную роль в
аллергических реакциях
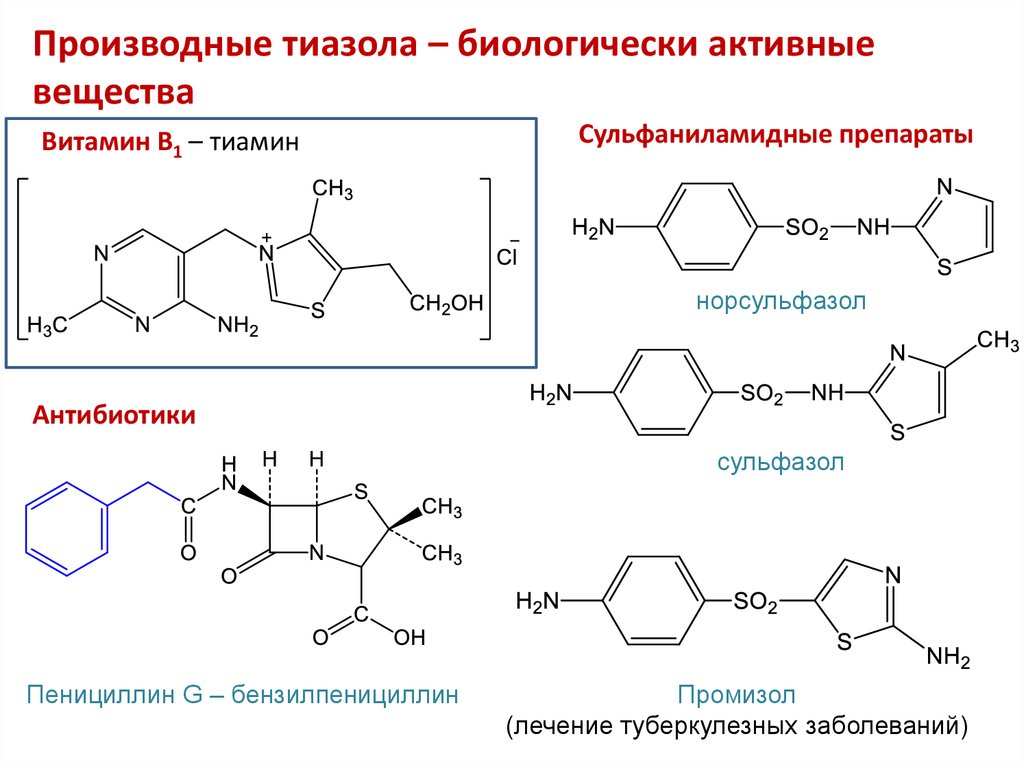
36. Производные тиазола – биологически активные вещества
Витамин В1 – тиаминСульфаниламидные препараты
норсульфазол
Антибиотики
сульфазол
Пенициллин G – бензилпенициллин
Промизол
(лечение туберкулезных заболеваний)
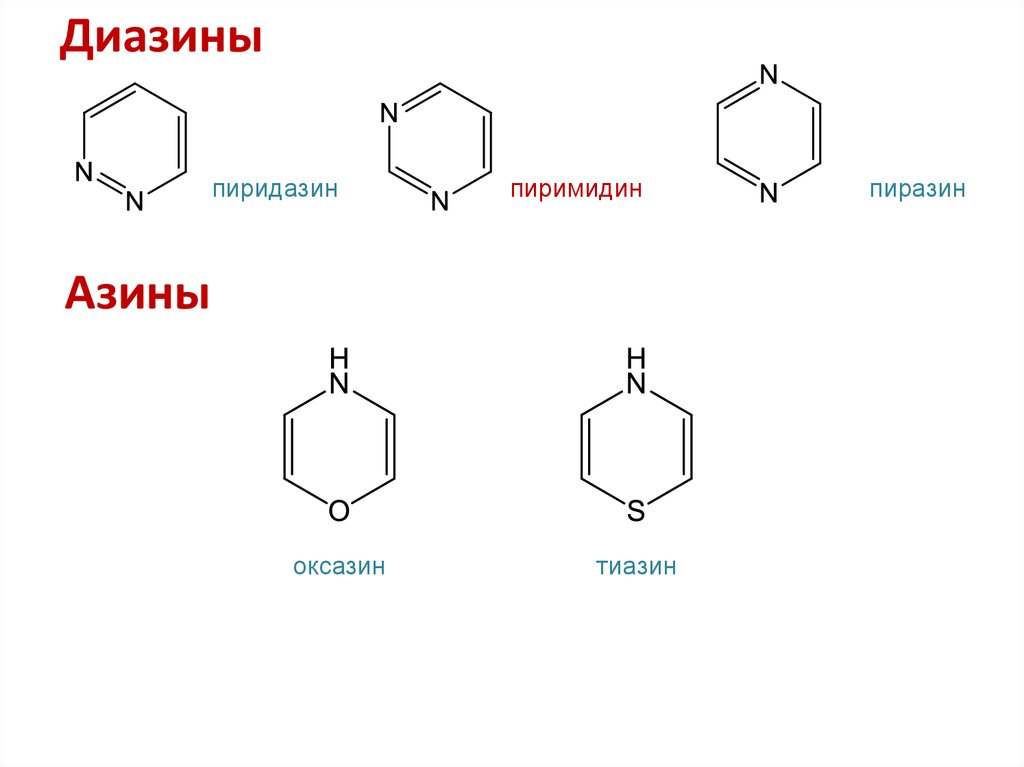
37. Шестичленные гетероциклы с двумя гетероатомами
38. Диазины
пиридазинпиримидин
Азины
оксазин
тиазин
пиразин
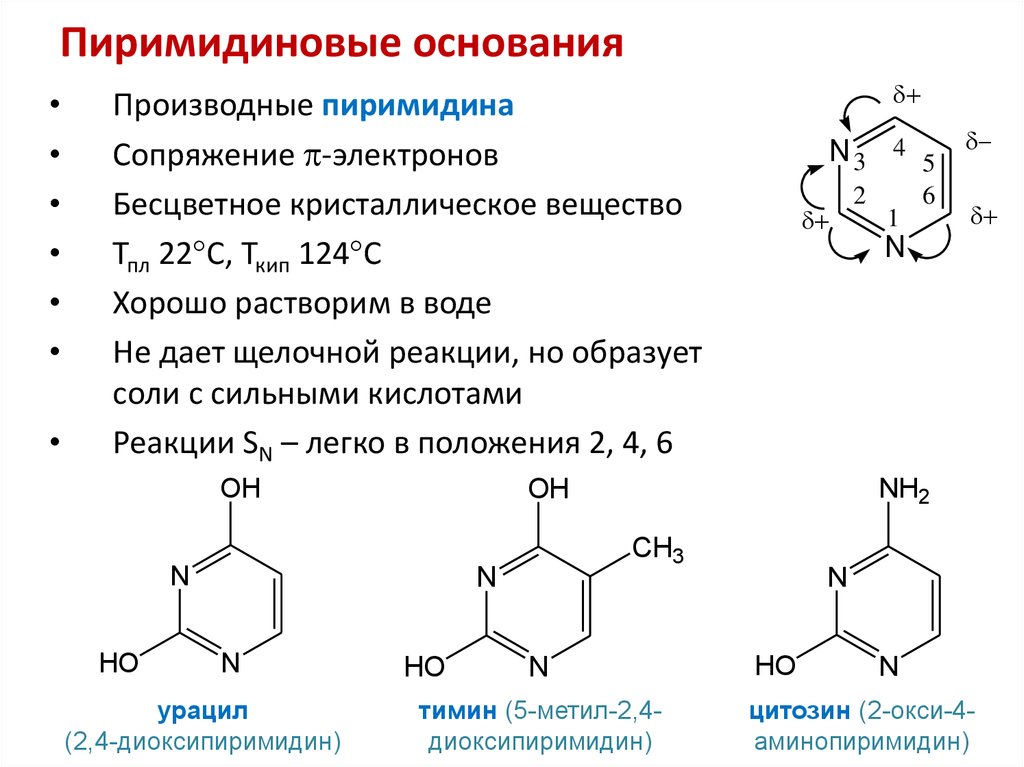
39. Пиримидиновые и пуриновые основания
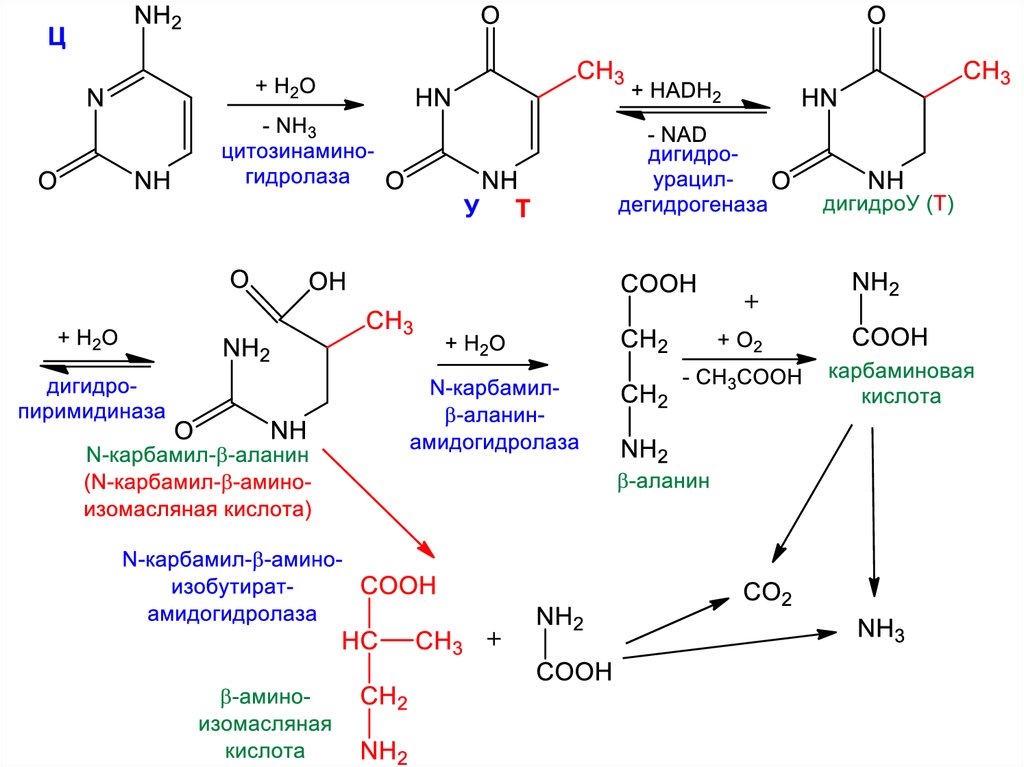
40. Пиримидиновые основания
Производные пиримидина
Сопряжение -электронов
Бесцветное кристаллическое вещество
Тпл 22 С, Ткип 124 С
Хорошо растворим в воде
Не дает щелочной реакции, но образует
соли с сильными кислотами
Реакции SN – легко в положения 2, 4, 6
OH
урацил
(2,4-диоксипиримидин)
HO
2
1
6
N
NH2
CH3
N
N
OH
N
HO
N3 4 5
N
тимин (5-метил-2,4диоксипиримидин)
N
HO
N
цитозин (2-окси-4аминопиримидин)
41.
Лактим-лактамная таутомерияOH
O
N
HO
HN
O
N
OH
O
CH3
N
HO
N
H
N
CH3
HN
O
N
H
NH2
NH2
N
HO
N
N
O
N
H
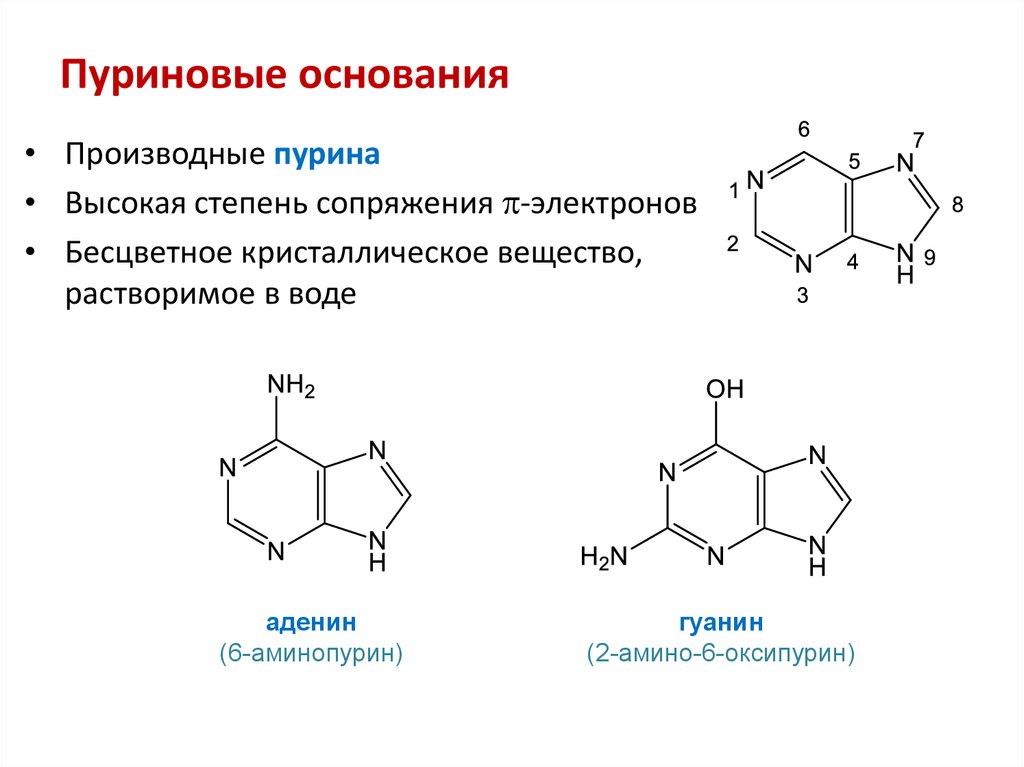
42. Пуриновые основания
• Производные пурина• Высокая степень сопряжения -электронов
• Бесцветное кристаллическое вещество,
растворимое в воде
аденин
(6-аминопурин)
гуанин
(2-амино-6-оксипурин)
43.
ТаутомерияO
OH
N
H2N
HN
N
N
N
H
H2N
N
N
N
H
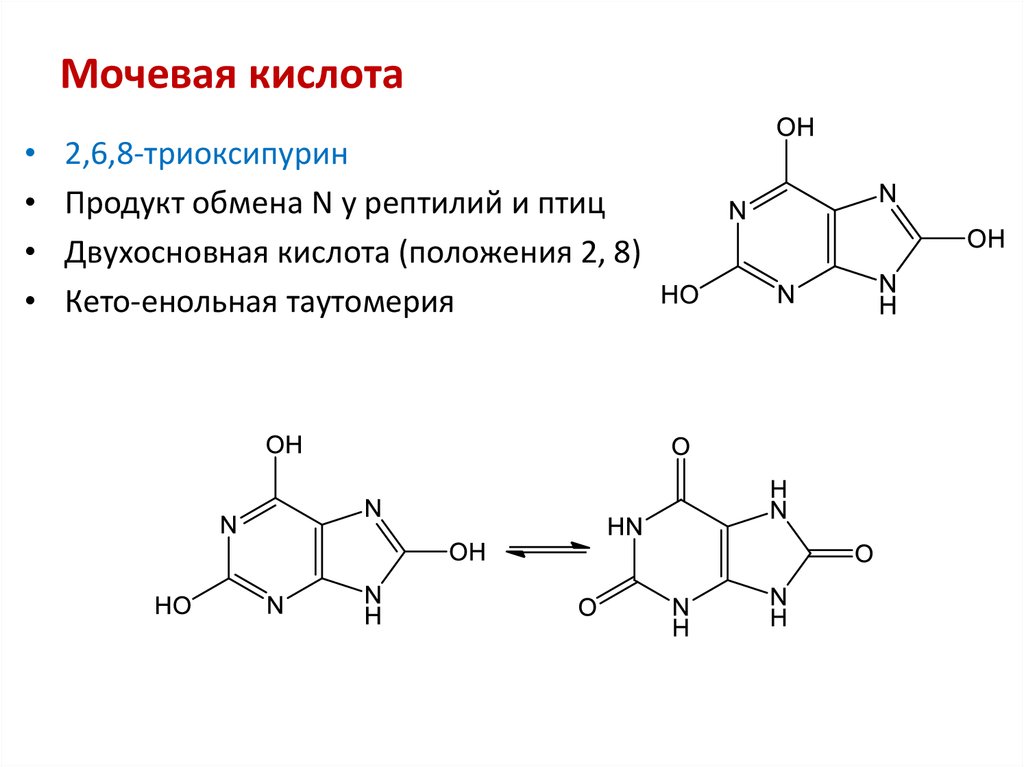
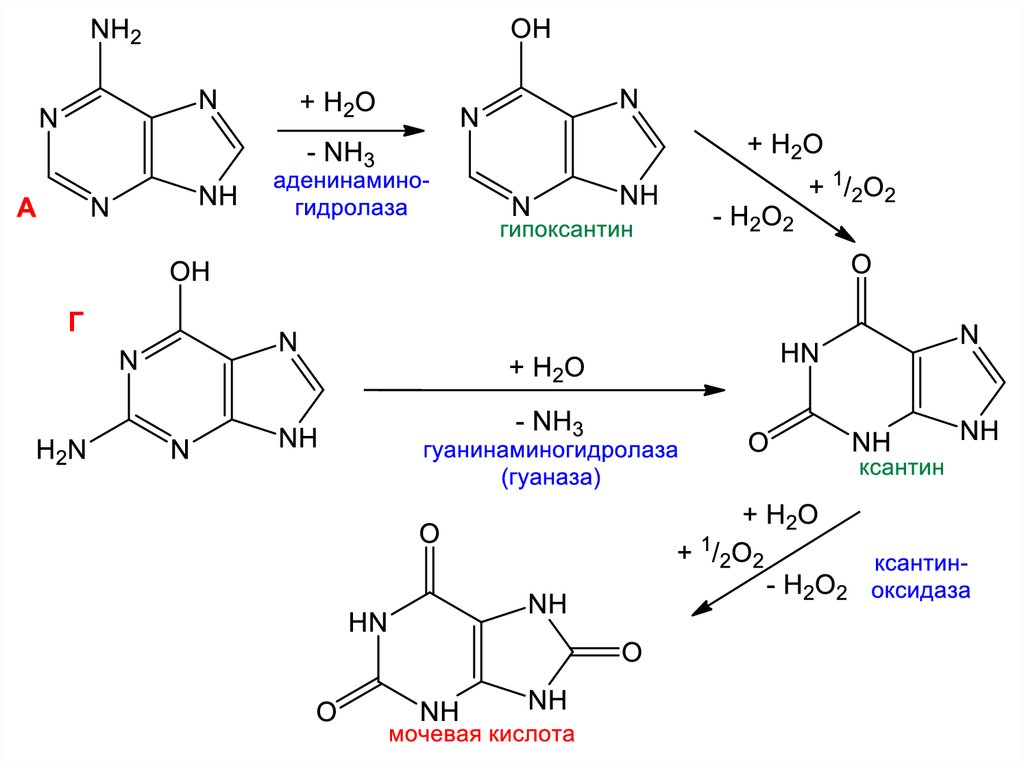
44. Мочевая кислота
2,6,8-триоксипурин
Продукт обмена N у рептилий и птиц
Двухосновная кислота (положения 2, 8)
Кето-енольная таутомерия













 Химия
Химия








