Похожие презентации:
Гетероциклические соединения
1. Гетероциклические соединения
Гетероциклическимисоединениями называют
циклические системы,
содержащие гетероатом в цикле
– насыщенном, ненасыщенном,
ароматическом.
2. Классификация и номенклатура
• Циклы классифицируют:1. По размеру цикла
Циклы могут быть разного размера:
3-, 4-членные(малые)
5- 8-членные (нормальные),
циклы, содержащие 8-12 атомов, и
больше 12 атомов (макроциклы).
3.
• 2. По характеру гетероатома• В качестве гетероатома может
выступать любой атом, кроме
элементов 1 группы и углерода.
Наибольшее значение и
распространение в природе имеют
гетероциклы, содержащие в качестве
гетероатома O ,N, S.
4.
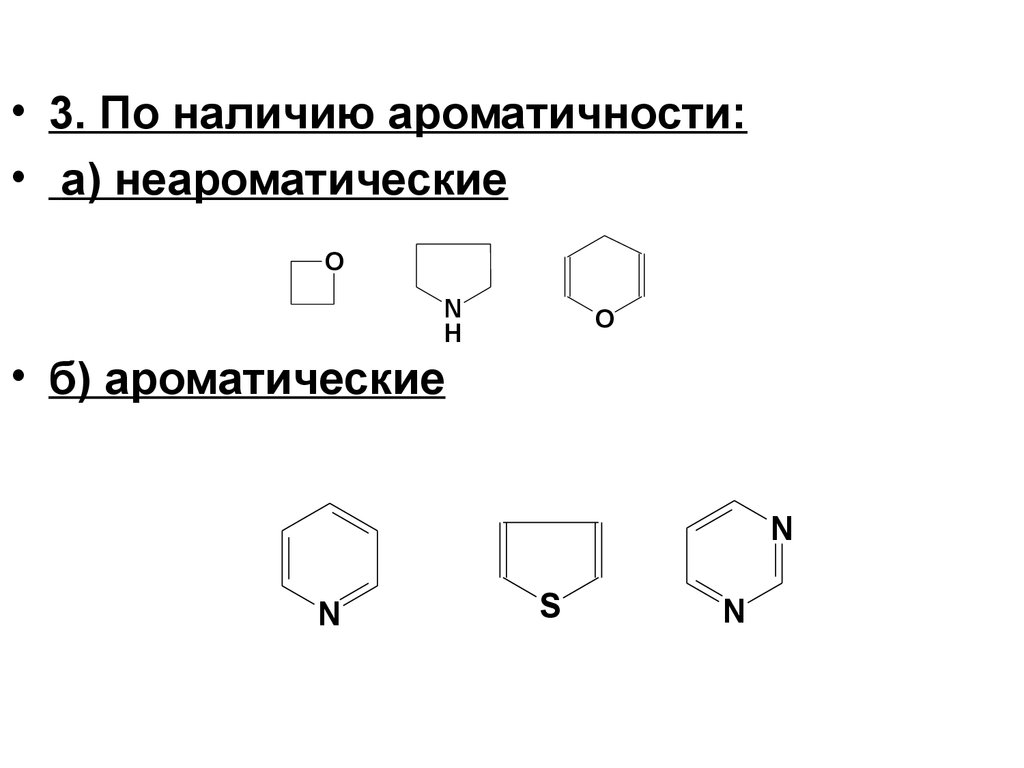
• 3. По наличию ароматичности:• а) неароматические
O
N
H
O
• б) ароматические
N
N
S
N
5.
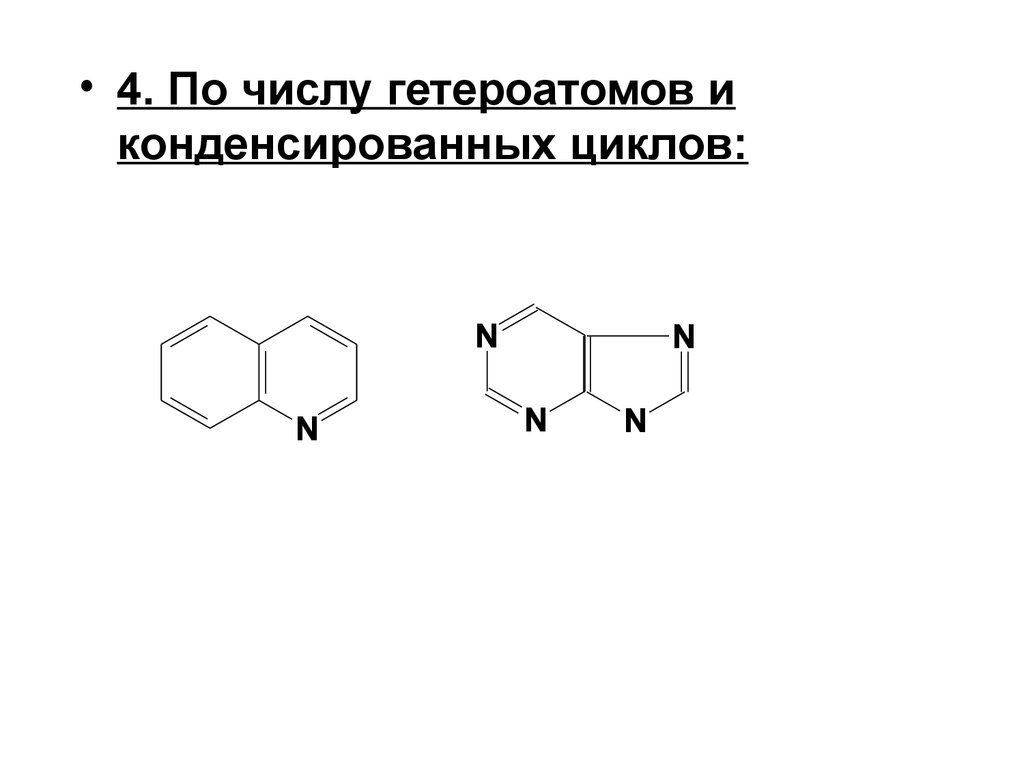
• 4. По числу гетероатомов иконденсированных циклов:
N
N
N
N
N
6. Номенклатура
• Размер цикла обозначаетсясоответствующим корнем и суффиксом, а
природа гетероатома – префиксом.
Наибольшее значение и распространение
в природе имеют гетероциклы,
содержащие в качестве гетероатома
O - (окса-),
N - (аза-), S - (тиа). -;
если гетероатом не один, применяют
перед префиксами умножающие
приставки ди-, три-, тетра-и т.д.
7.
• Когда в цикле присутствуют разныегетероатомы, они перечисляются в
порядке старшинства: O > S > N.
• Степень ненасыщенности гетероцикла
выражают суффиксами, которые
несколько отличаются в зависимости
от того, содержит или не содержит
цикл азот.
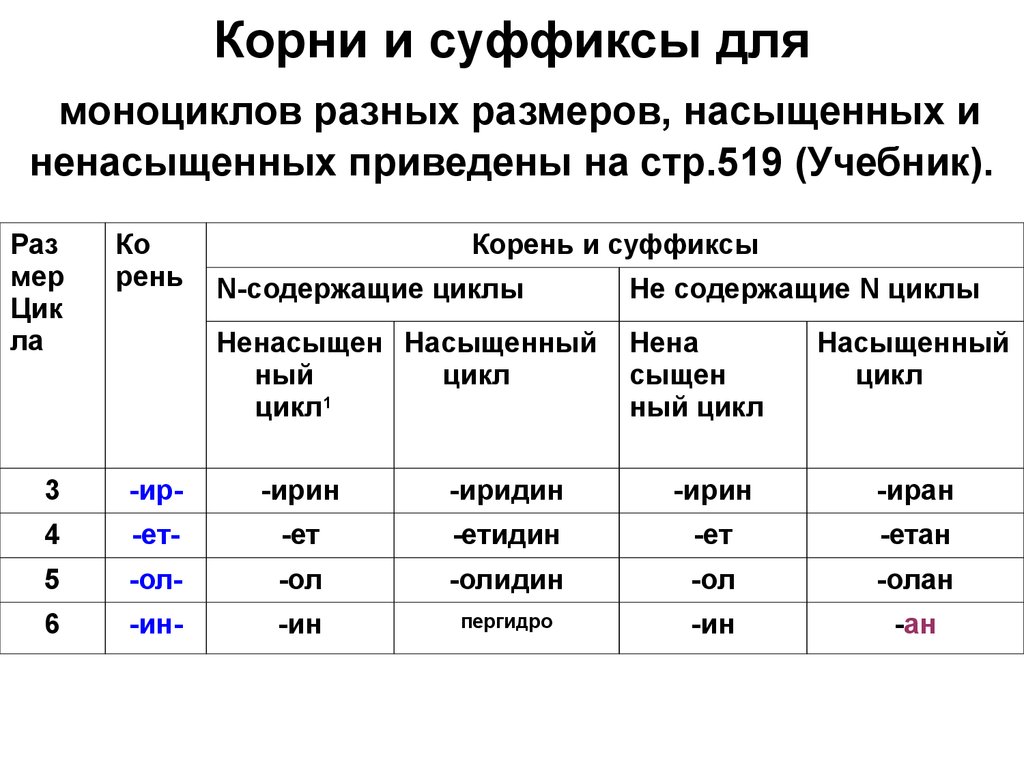
8. Корни и суффиксы для моноциклов разных размеров, насыщенных и ненасыщенных приведены на стр.519 (Учебник).
Размер
Цик
ла
Ко
рень
Корень и суффиксы
3
-ир-
-ирин
-иридин
-ирин
-иран
4
-ет-
-ет
-етидин
-ет
-етан
5
-ол-
-ол
-олидин
-ол
-олан
6
-ин-
-ин
пергидро
-ин
-ан
N-содержащие циклы
Не содержащие N циклы
Ненасыщен Насыщенный
ный
цикл
цикл1
Нена
cыщен
ный цикл
Насыщенный
цикл
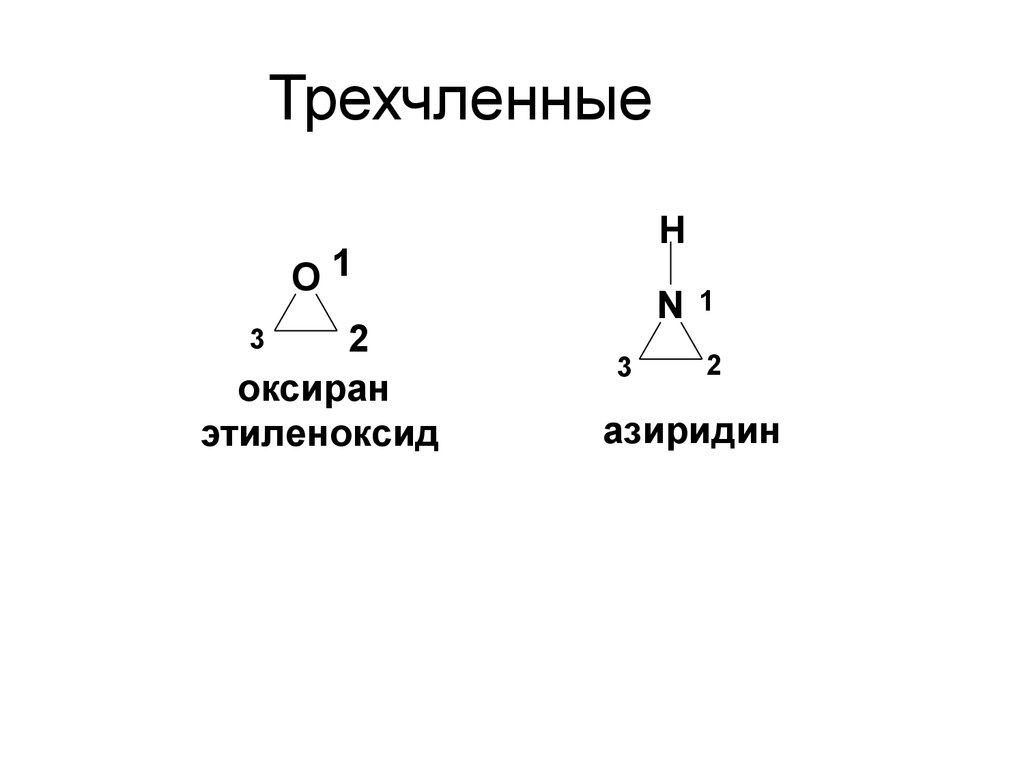
9. Трехчленные
HO1
2
оксиран
этиленоксид
3
N
3
1
2
азиридин
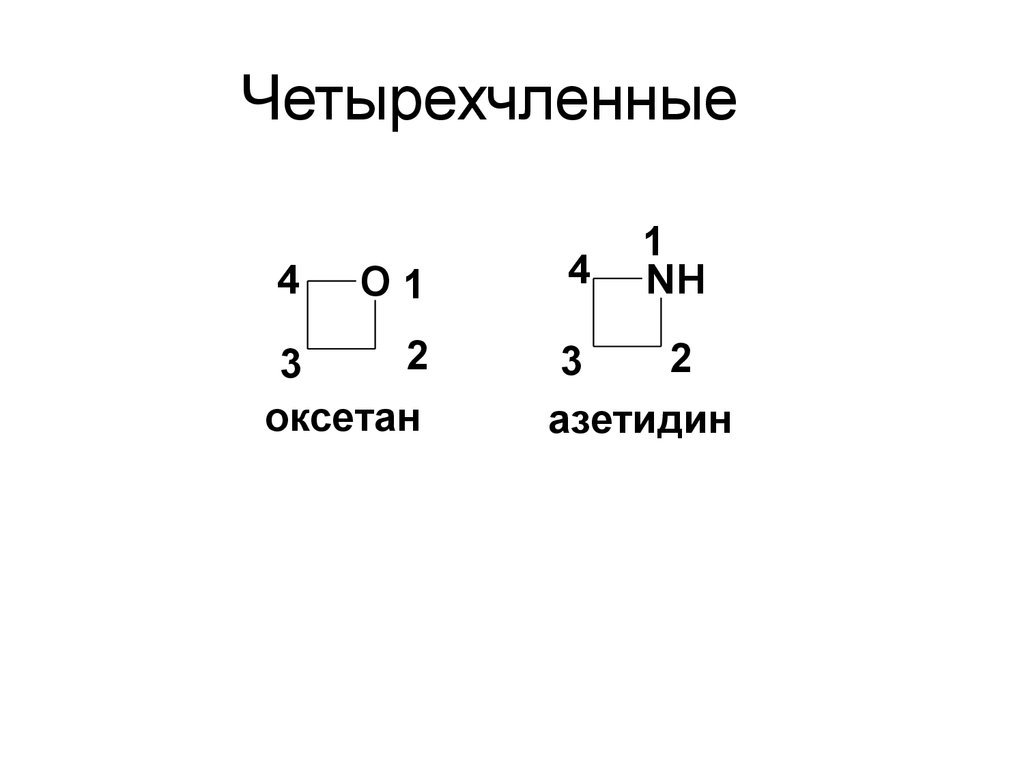
10. Четырехчленные
4O1
2
3
оксетан
4
1
NH
2
3
азетидин
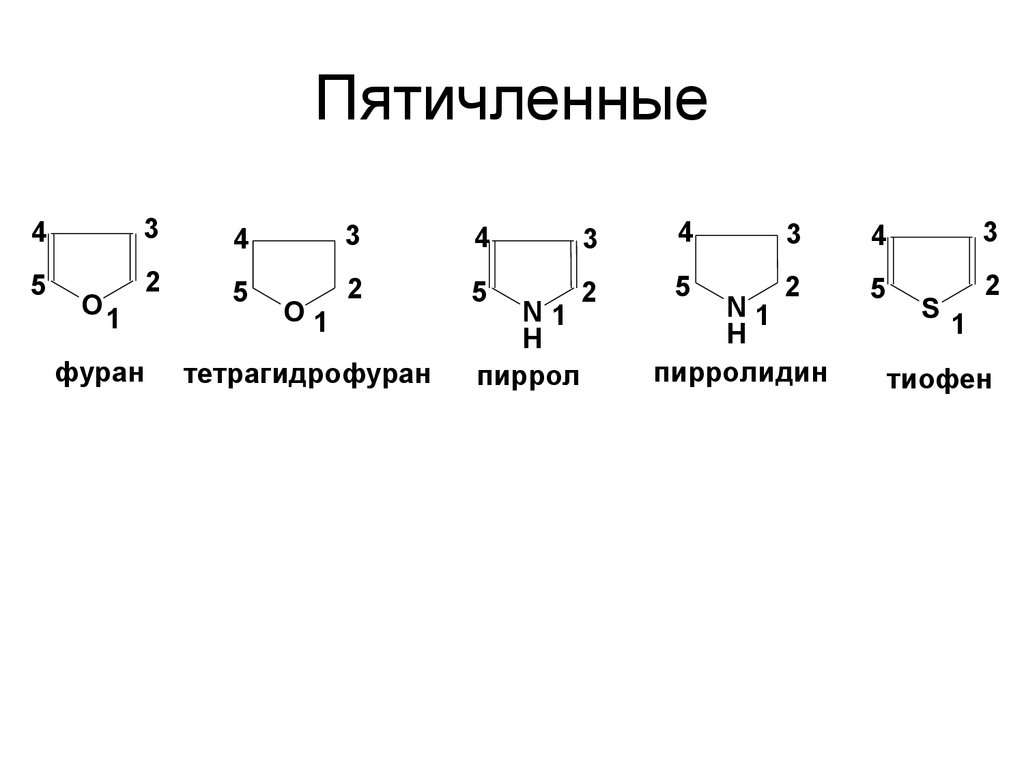
11. Пятичленные
43
4
3
4
3
4
3
4
3
5
2
5
2
5
2
5
2
5
2
O1
фуран
O1
тетрагидрофуран
N1
H
пиррол
N1
H
пирролидин
S
1
тиофен
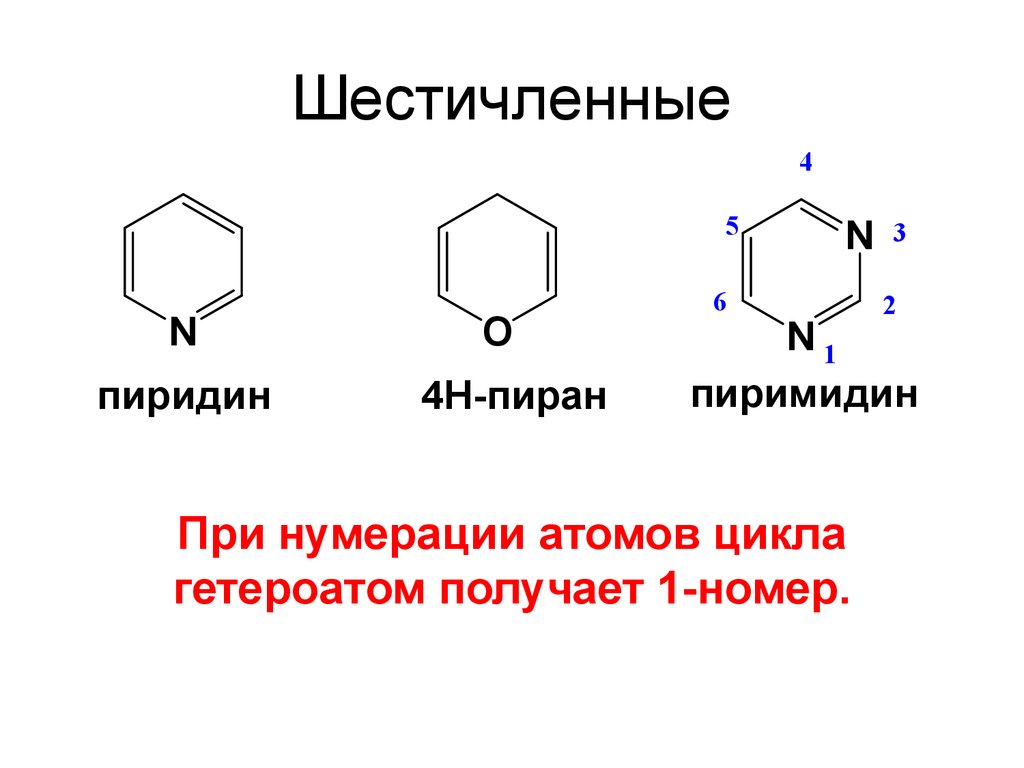
12. Шестичленные
45
N
пиридин
O
4Н-пиран
N
6
3
2
N1
пиримидин
При нумерации атомов цикла
гетероатом получает 1-номер.
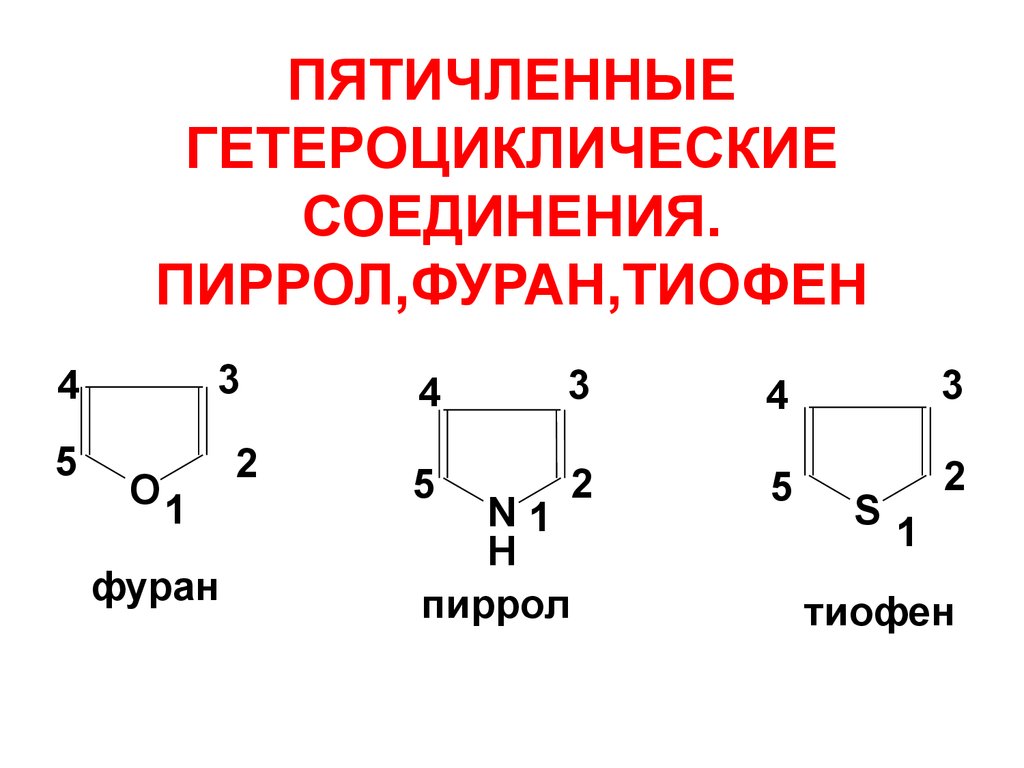
13. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. ПИРРОЛ,ФУРАН,ТИОФЕН
34
5
O1
фуран
2
4
3
4
3
5
2
5
2
N1
H
пиррол
S
1
тиофен
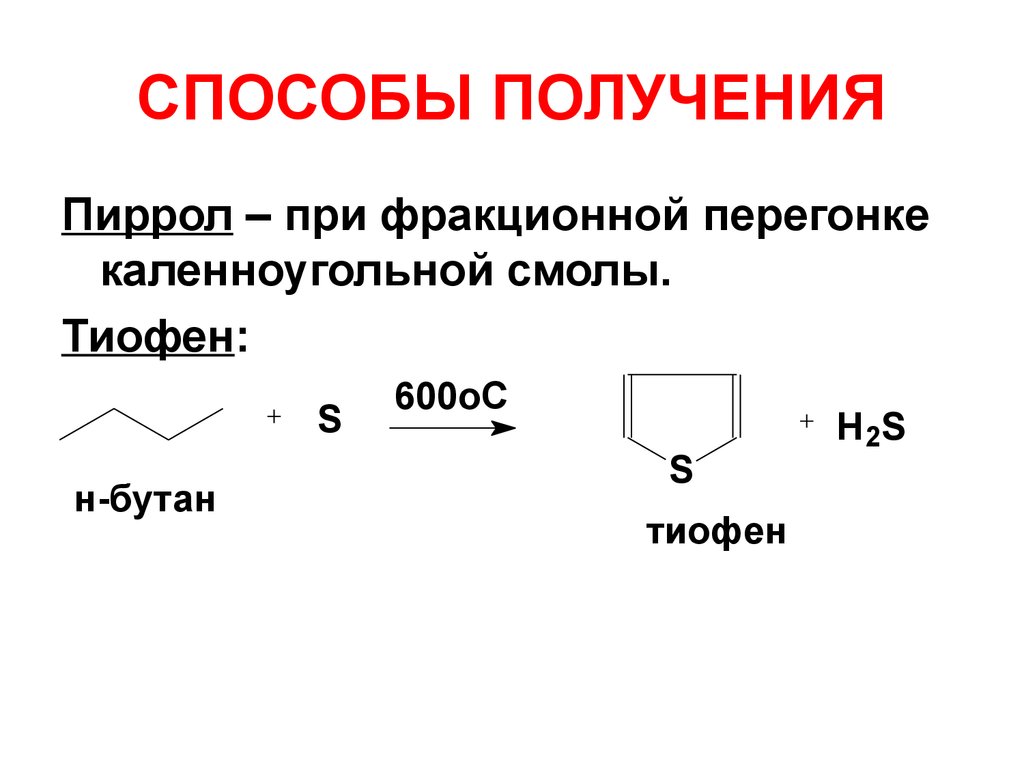
14. СПОСОБЫ ПОЛУЧЕНИЯ
Пиррол – при фракционной перегонкекаленноугольной смолы.
Тиофен:
S
н-бутан
600oC
S
тиофен
H 2S
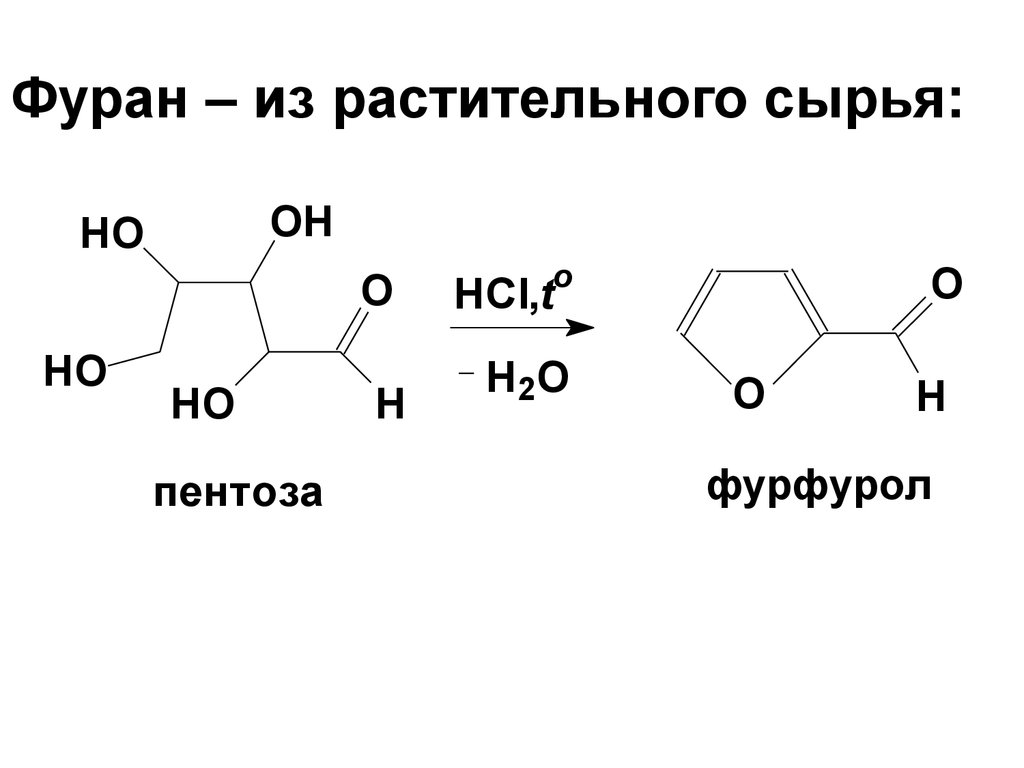
15. Фуран – из растительного сырья:
OHHO
O
HO
HO
пентоза
H
o
O
HCl,t
H2O
O
H
фурфурол
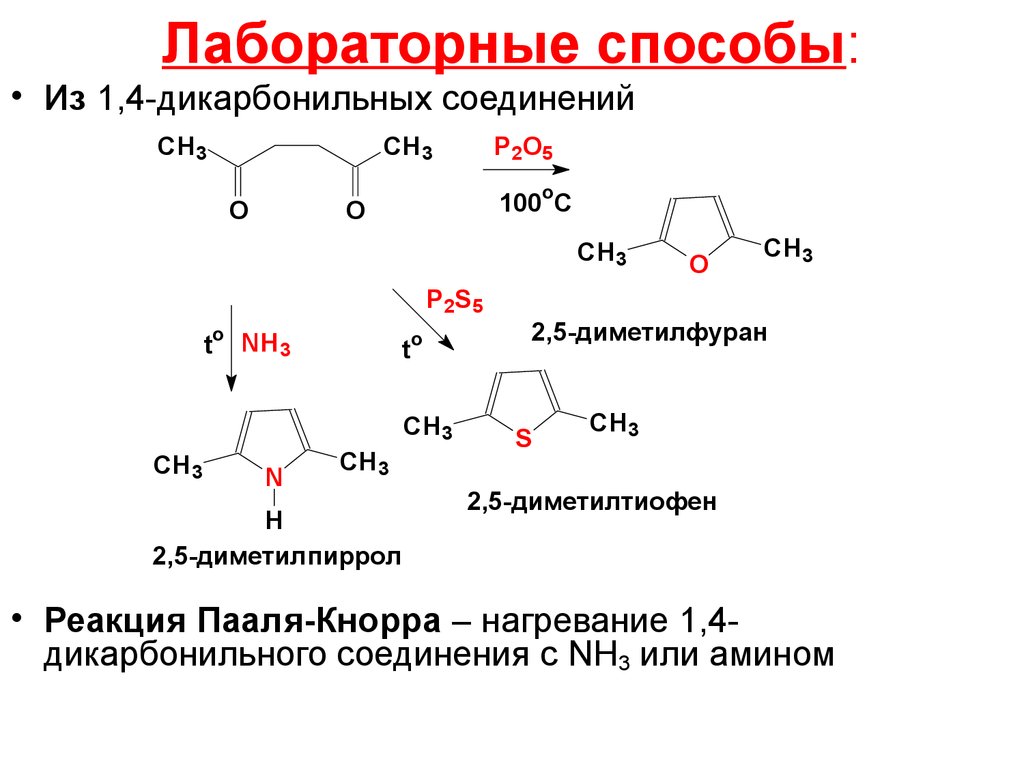
16. Лабораторные способы:
• Из 1,4-дикарбонильных соединенийCH3
CH3
O
P2O5
o
100 C
O
CH 3
O
CH3
P2S5
o
t
o
NH3
t
CH3
CH3
N
CH3
H
2,5-диметилпиррол
2,5-диметилфуран
S
CH3
2,5-диметилтиофен
• Реакция Пааля-Кнорра – нагревание 1,4дикарбонильного соединения с NH3 или амином
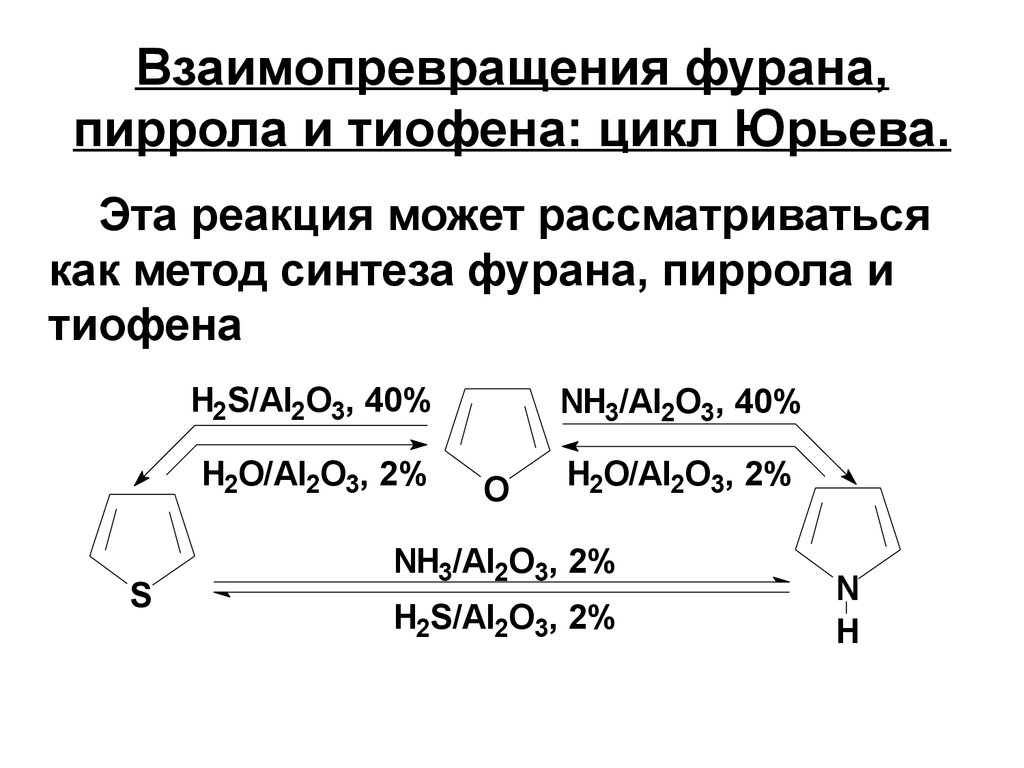
17. Взаимопревращения фурана, пиррола и тиофена: цикл Юрьева.
Эта реакция может рассматриватьсякак метод синтеза фурана, пиррола и
тиофена
H2S/Al2O3, 40%
H2O/Al2O3, 2%
S
NH3/Al2O3, 40%
O
H2O/Al2O3, 2%
NH3/Al2O3, 2%
H2S/Al2O3, 2%
N
H
18. Синтез пиррола по Кнорру:
• α- Aминокарбонильное соединениеподвергают конденсации с β-кетоэфиром:
C
O
O
C
2H
5 C
3 C
O
O
C
2H
5
C
H
O
O
HH
3C
C
H
C
O
CN
H
3
2H
5O
2O
C
O
CN
2H
5O
H
д,и
ти
-3
,б
5-о
д
етаи
2
4э
-д
ил
ка
р
ки
см
ил
тлпиррол-
O
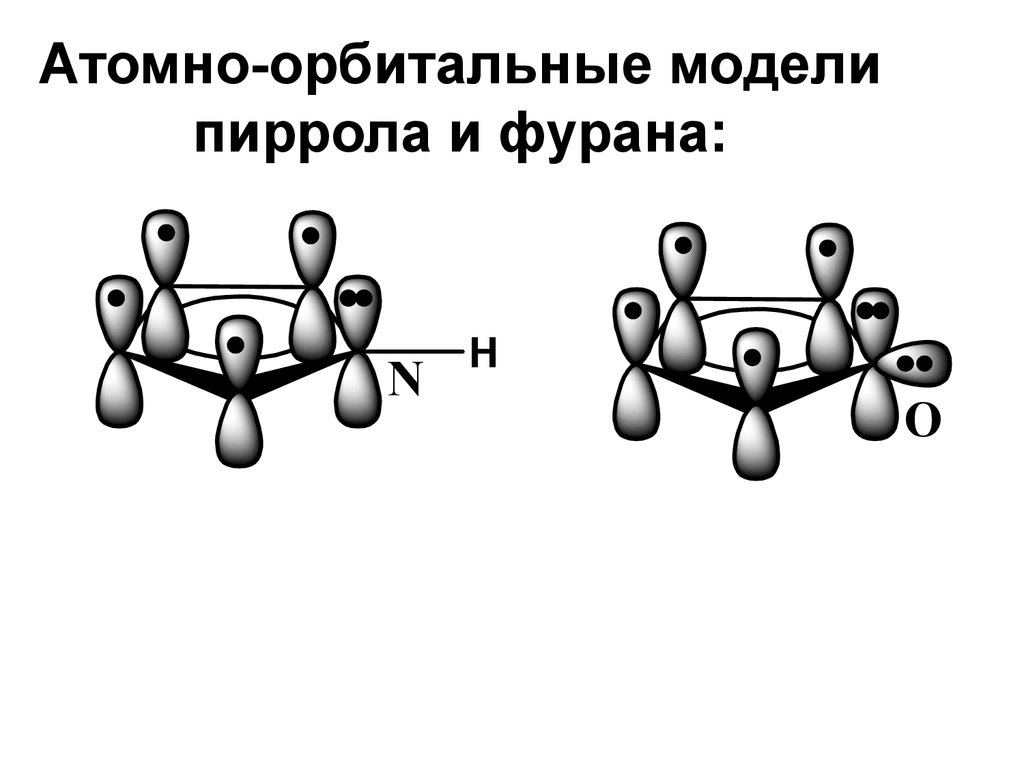
19. ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ
• Молекулы всех этих гетероцикловимеют плоское строение.
Ароматический секстет π-электронов
образуется за счет 4е атомов С и 2-e
неподеленных электронных пар
гетероатомов, находящихся на
негибридизованных pz-орбиталях.
20. Атомно-орбитальные модели пиррола и фурана:
NH
O
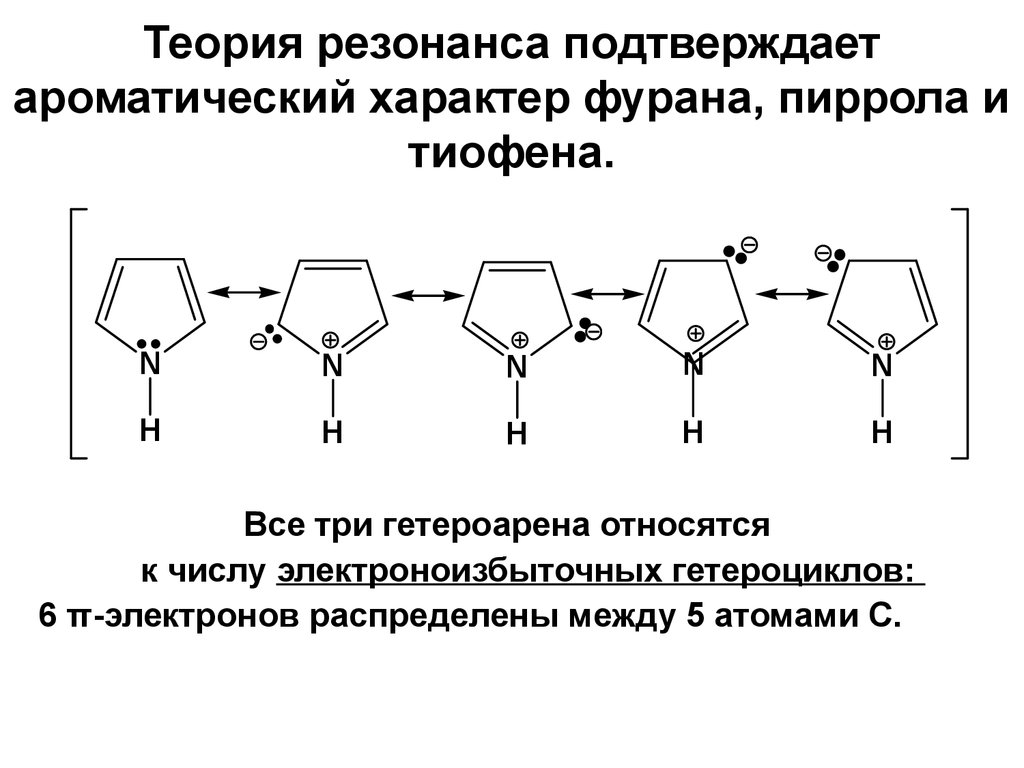
21. Теория резонанса подтверждает ароматический характер фурана, пиррола и тиофена.
NN
N
N
N
H
H
H
H
H
Все три гетероарена относятся
к числу электроноизбыточных гетероциклов:
6 π-электронов распределены между 5 атомами С.
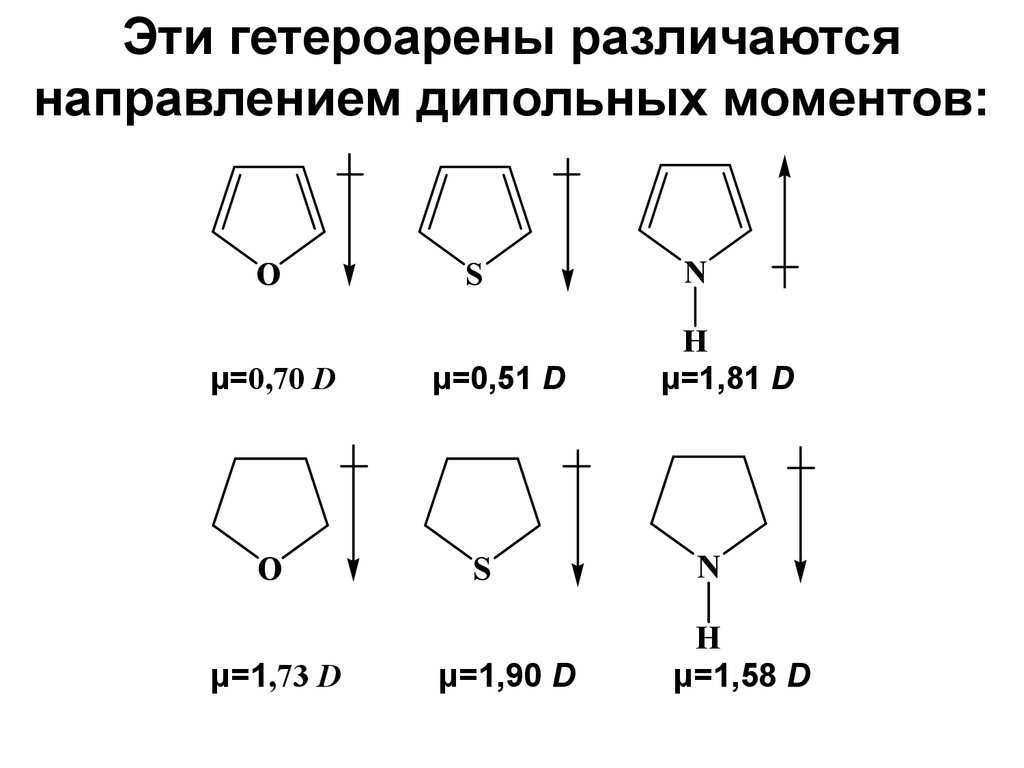
22. Эти гетероарены различаются направлением дипольных моментов:
Oμ=0,70 D
O
μ=1,73 D
S
μ=0,51 D
S
μ=1,90 D
N
H
μ=1,81 D
N
H
μ=1,58 D
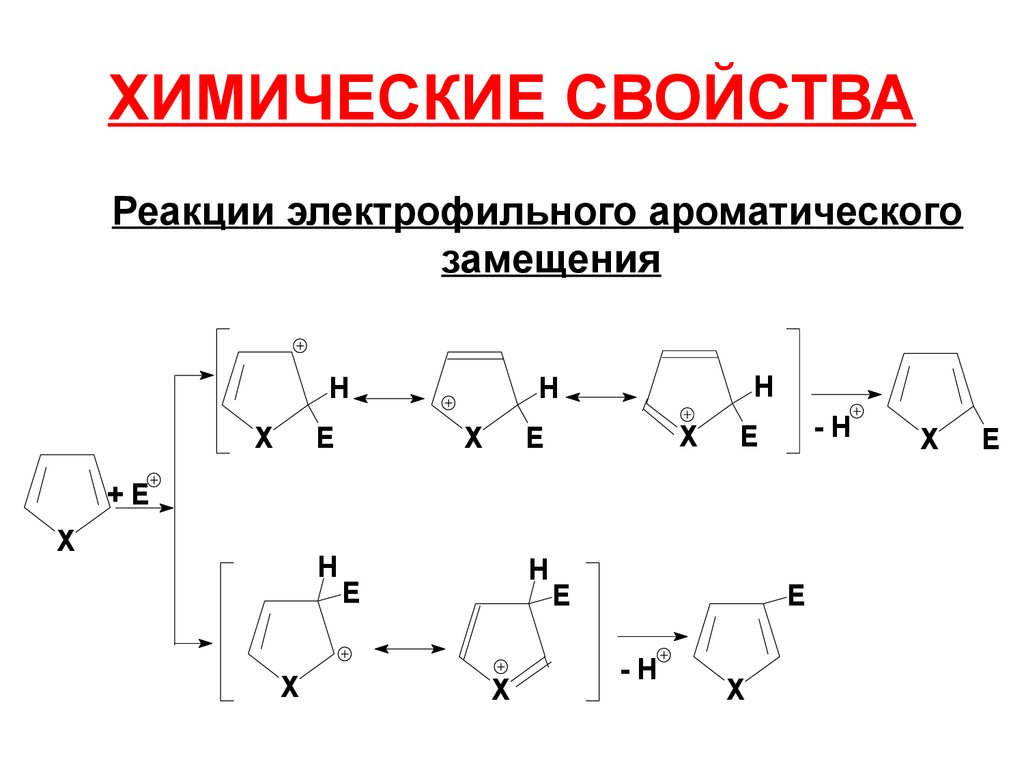
23. ХИМИЧЕСКИЕ СВОЙСТВА
Реакции электрофильного ароматическогозамещения
H
E
X
H
H
X
E
X
-H
E
+E
X
H
X
H
E
X
E
E
-H
X
X
E
24.
• Относительная активность гетероареновв SE реакциях:
Пиррол >
> фуран
фуран >
> тиофен
тиофен
Пиррол
Но даже тиофен превосходит бензол по
реакционной способности.
25.
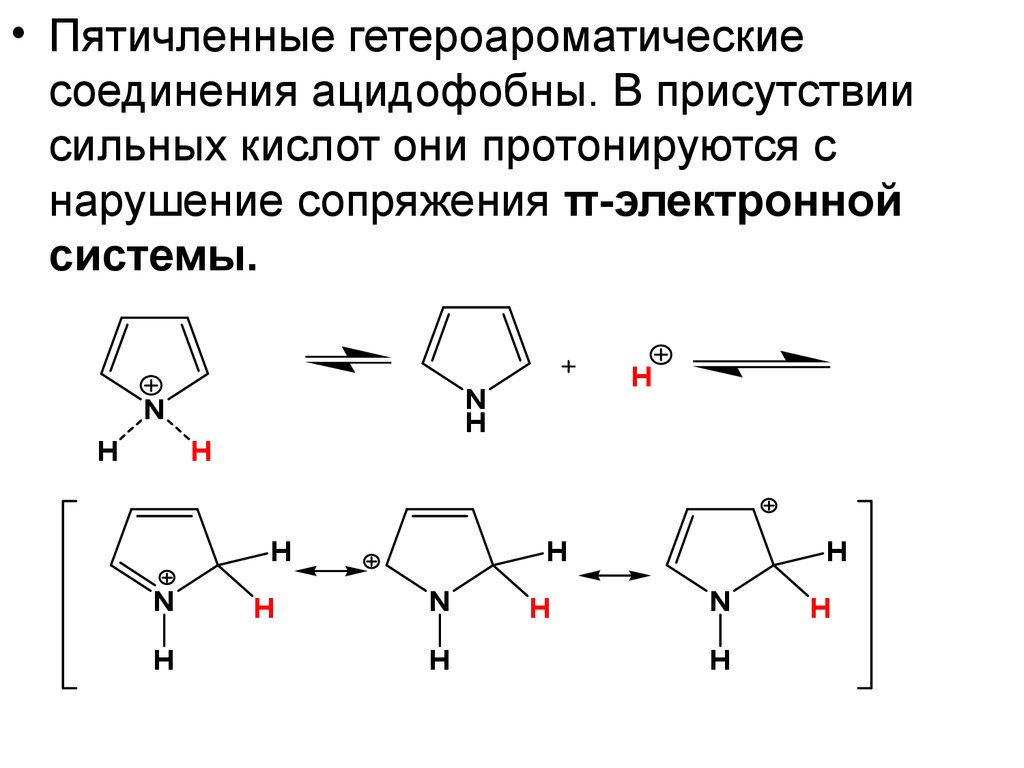
• Пятичленные гетероароматическиесоединения ацидофобны. В присутствии
сильных кислот они протонируются с
нарушение сопряжения π-электронной
системы.
N
H
N
H
H
H
N
H
H
H
H
N
H
H
H
N
H
H
26.
• Поскольку протонированию подвергаетсясопряженная π-система пиррола,
основность этого соединения
оказывается значительно ниже , чем
основность любого из аминов, которые
протонируются по N-атому.
• Из-за чувствительности к кислотам в
ряде SE реакций гетероаренов
используют специфические реагенты.
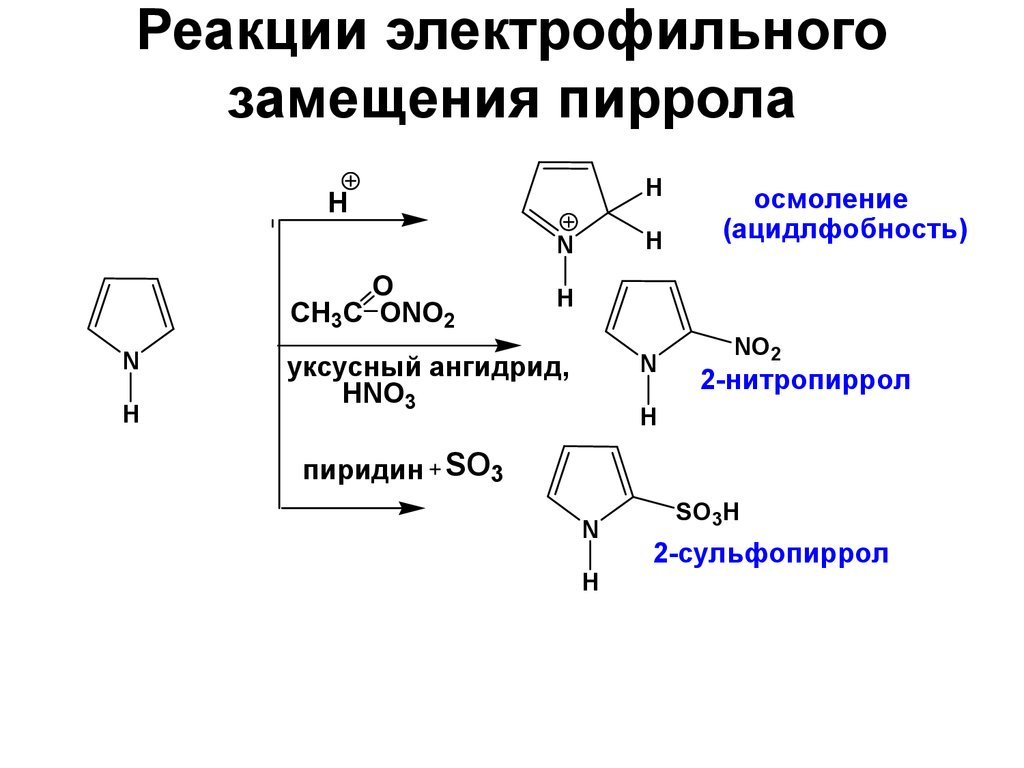
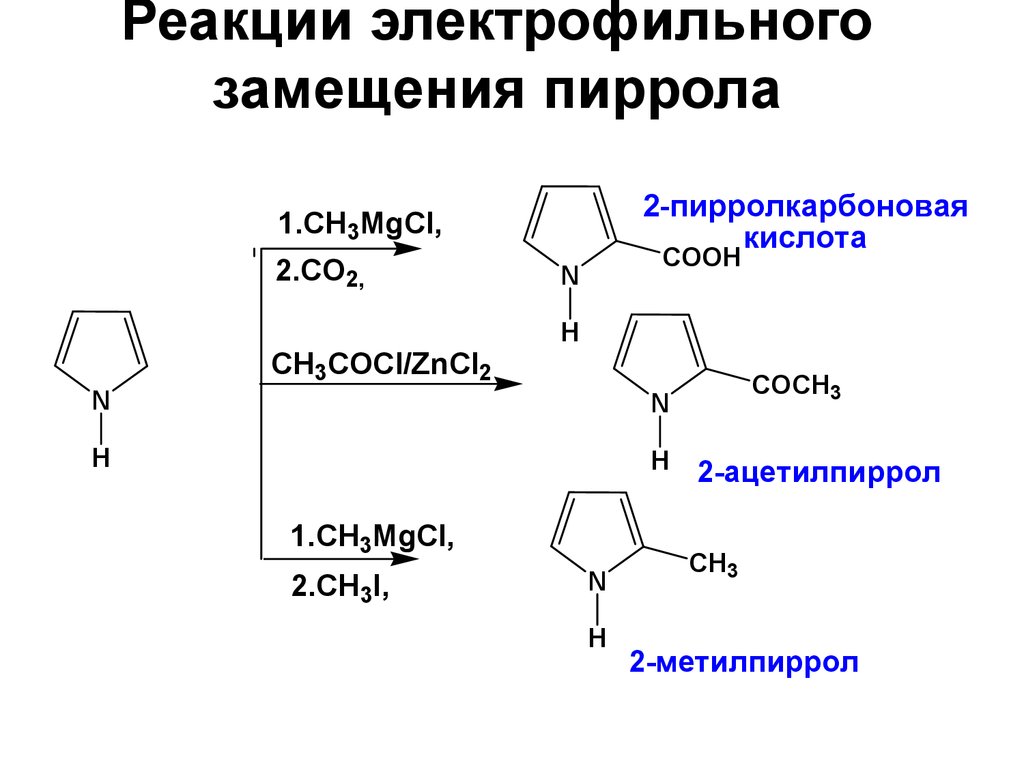
27. Реакции электрофильного замещения пиррола
HH
H
N
O
CH3C ONO2
N
H
осмоление
(ацидлфобность)
H
N
уксусный ангидрид,
HNO3
NO2
2-нитропиррол
H
пиридин SO3
N
H
SO3H
2-сульфопиррол
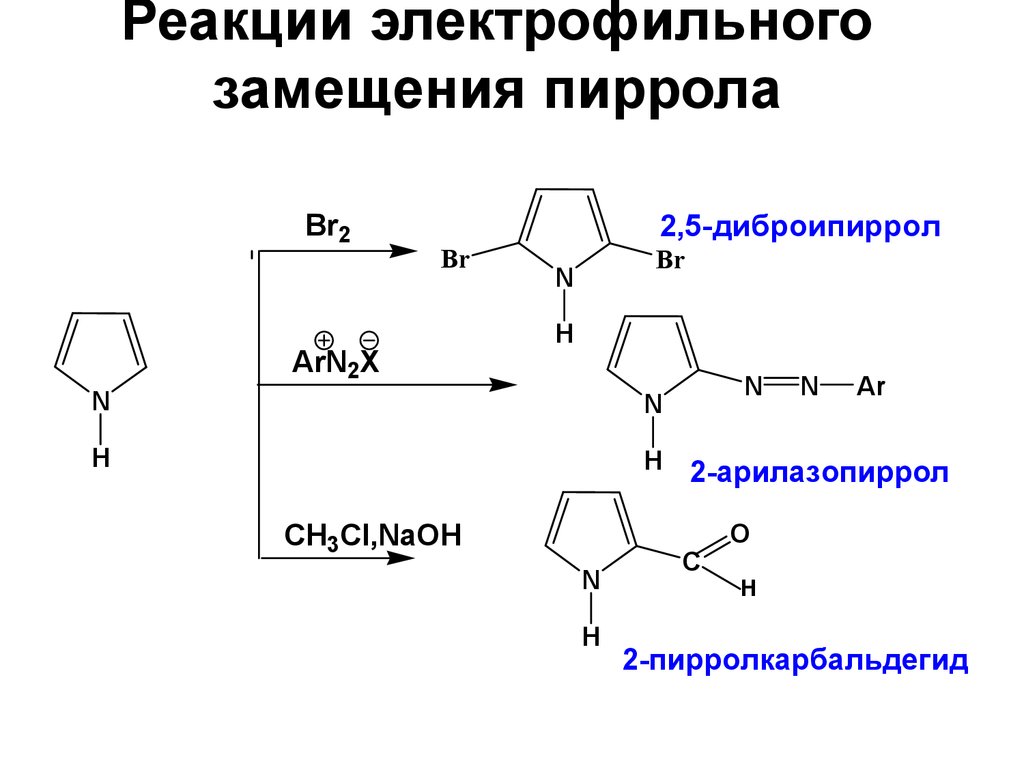
28. Реакции электрофильного замещения пиррола
Br22,5-диброипиррол
Br
ArN2X
Br
N
H
N
N
H
H
СH3Cl,NaOH
N
H
N
N
Ar
2-арилазопиррол
C
O
H
2-пирролкарбальдегид
29. Реакции электрофильного замещения пиррола
2-пирролкарбоноваякислота
1.СH3MgCl,
2.СO2,
СH3COCl/ZnCl2
COOH
N
H
N
N
H
H
1.СH3MgCl,
2.СH3I,
N
H
СOCH3
2-ацетилпиррол
CH3
2-метилпиррол
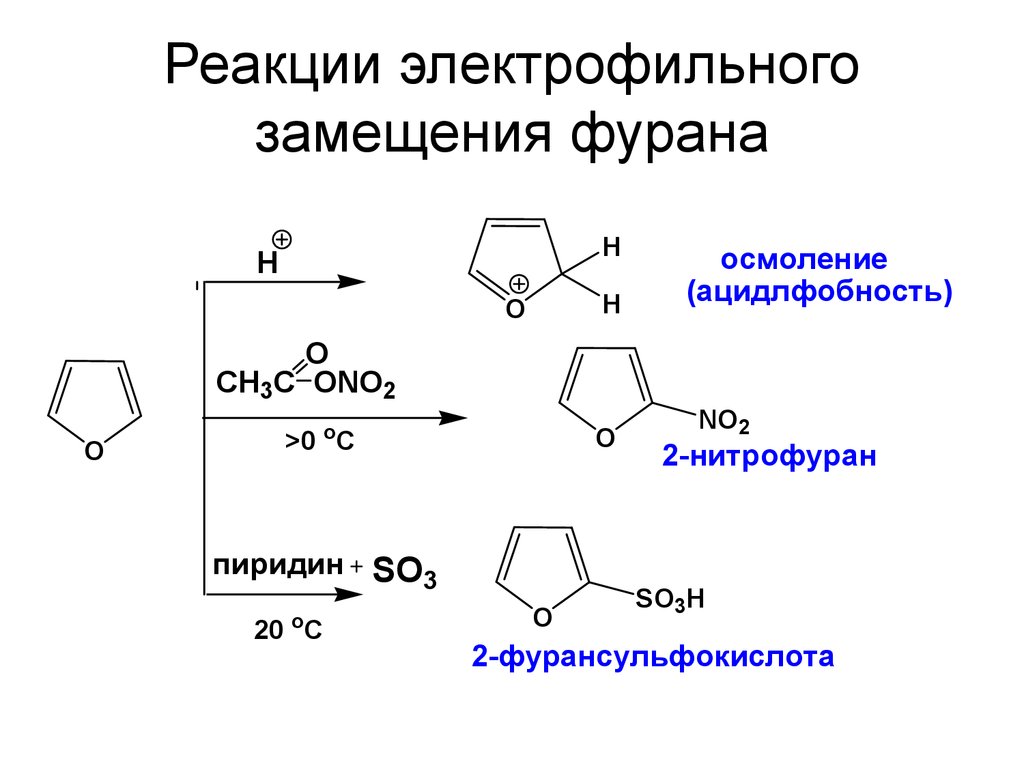
30. Реакции электрофильного замещения фурана
HH
H
O
осмоление
(ацидлфобность)
O
CH3C ONO2
O
o
O
>0 C
пиридин SO3
20 oC
O
NO2
2-нитрофуран
SO3H
2-фурансульфокислота
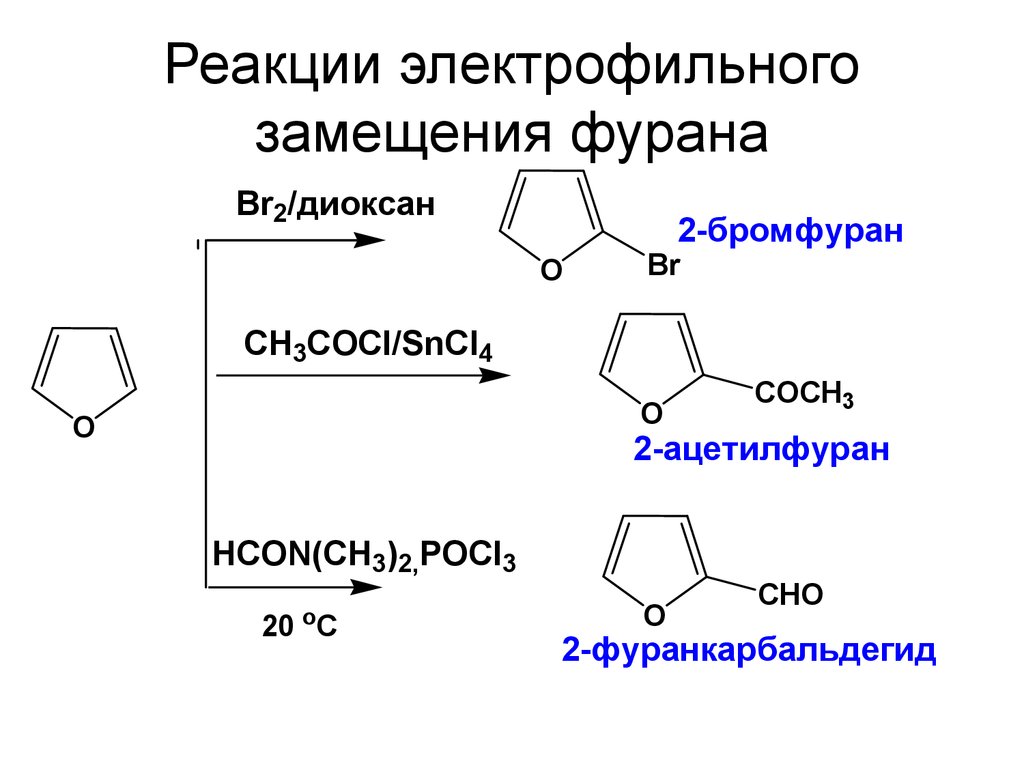
31. Реакции электрофильного замещения фурана
Br2/диоксан2-бромфуран
O
Br
СH3COCl/SnCl4
O
O
СOCH3
2-ацетилфуран
HCON(CH3)2,POCl3
o
20 C
O
CHO
2-фуранкарбальдегид
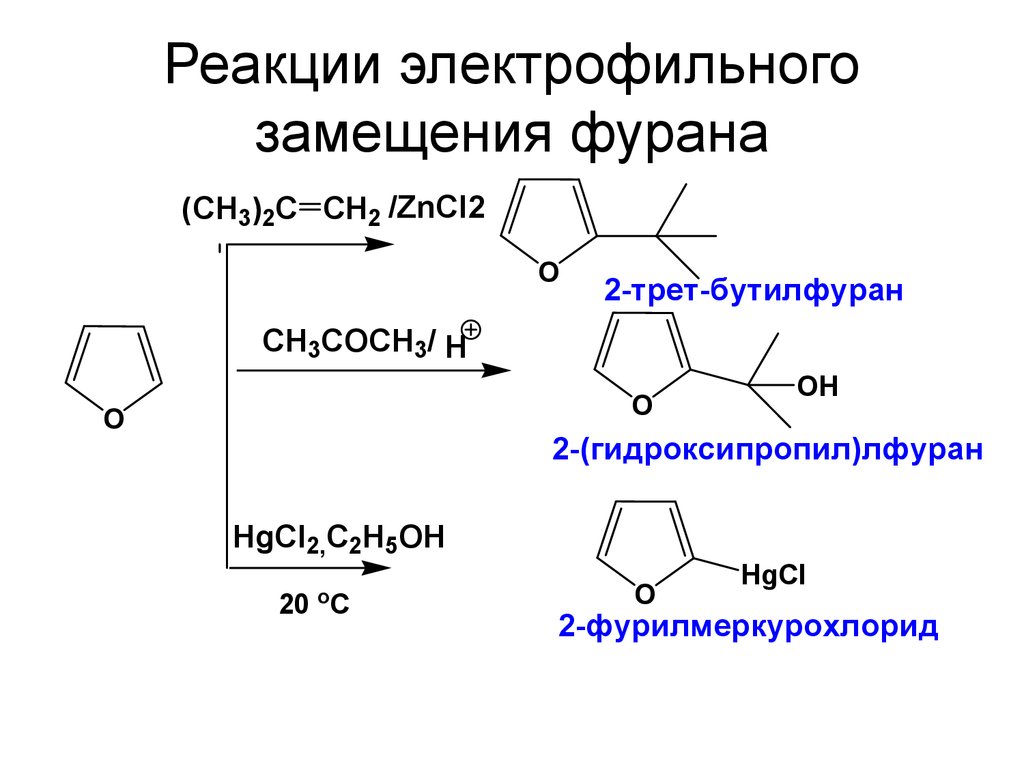
32. Реакции электрофильного замещения фурана
(CH3)2C CH2 /ZnCl2O
2-трет-бутилфуран
СH3COСH3/ H
O
O
OH
2-(гидроксипропил)лфуран
HgCl2,C2H5OH
20 oC
O
HgCl
2-фурилмеркурохлорид
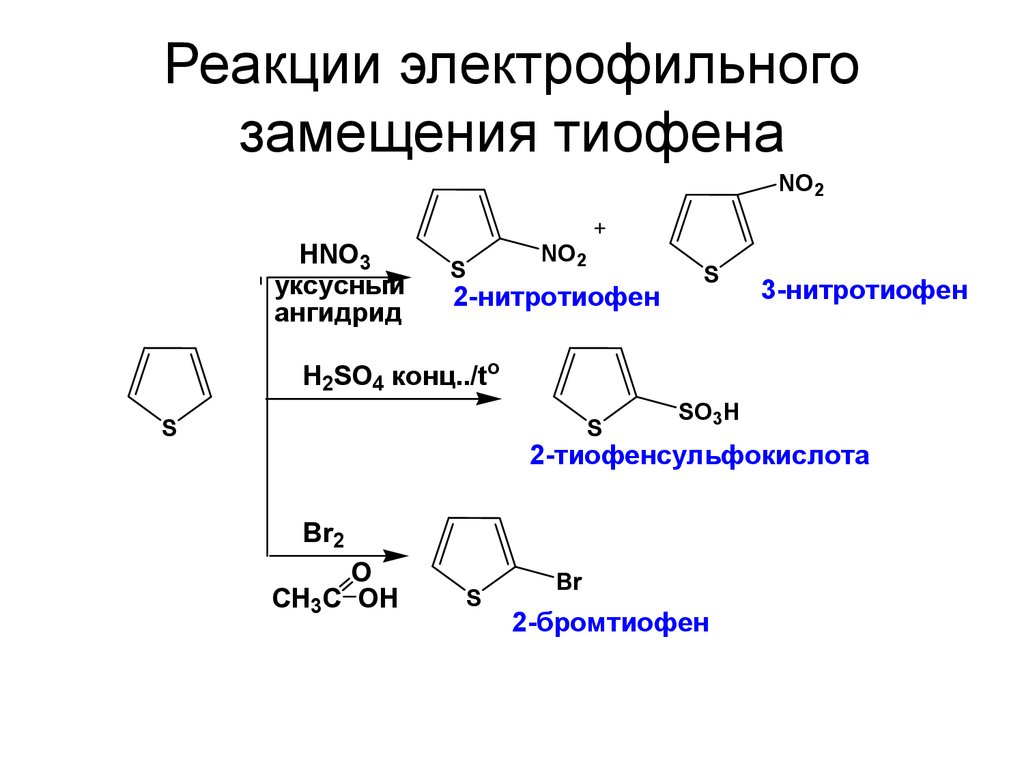
33. Реакции электрофильного замещения тиофена
NO2HNO3
уксусный
ангидрид
S
NO2
2-нитротиофен
S
3-нитротиофен
H2SO4 конц../to
S
S
SO3H
2-тиофенсульфокислота
Br2
O
CH3C OН
S
Br
2-бромтиофен
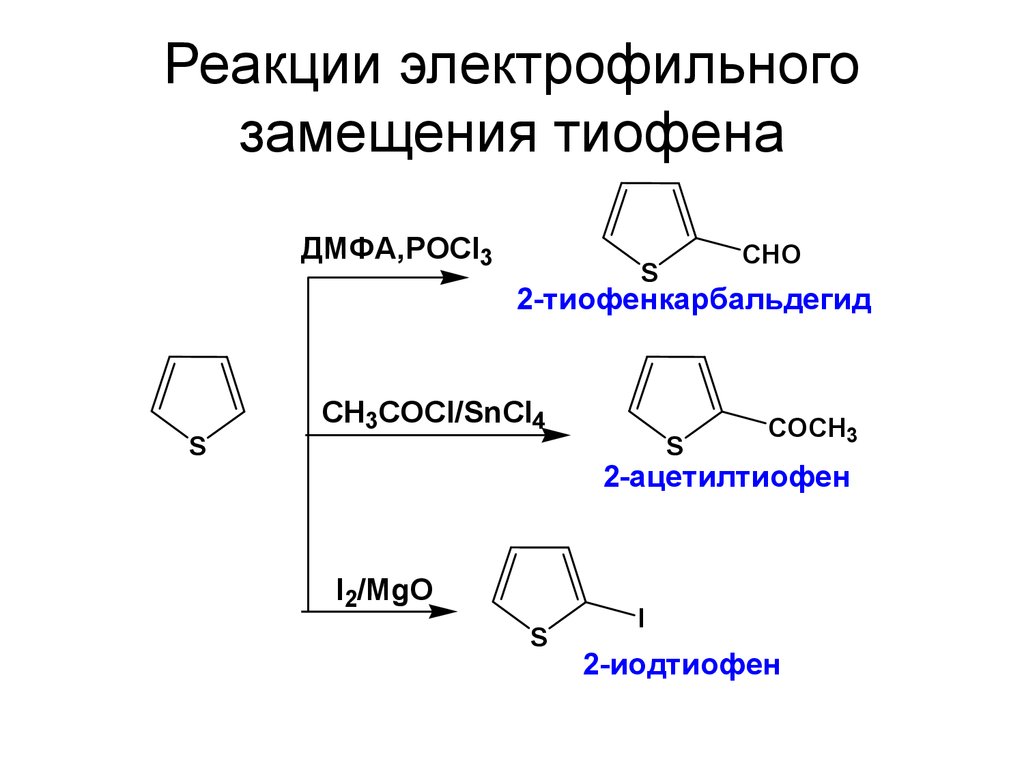
34. Реакции электрофильного замещения тиофена
ДМФА,РОСl3CHO
S
2-тиофенкарбальдегид
S
CH3COCl/SnCl4
S
COCH3
2-ацетилтиофен
I2/MgO
S
I
2-иодтиофен
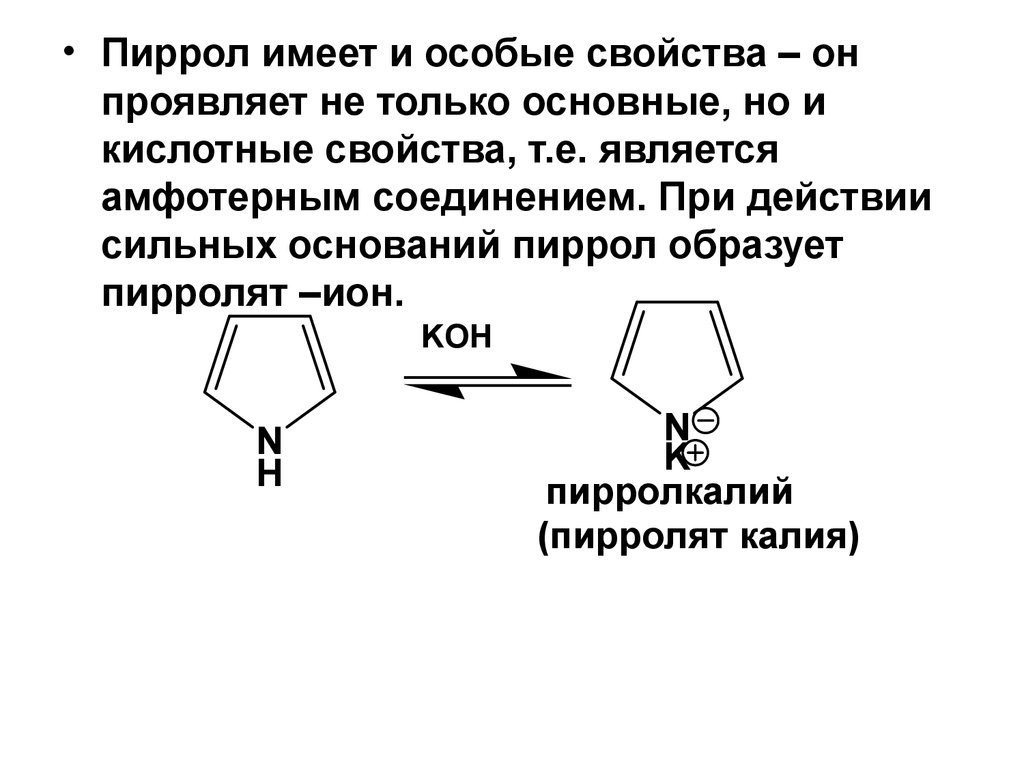
35.
• Пиррол имеет и особые свойства – онпроявляет не только основные, но и
кислотные свойства, т.е. является
амфотерным соединением. При действии
сильных оснований пиррол образует
пирролят –ион.
KOH
N
H
N
K
пирролкалий
(пирролят калия)
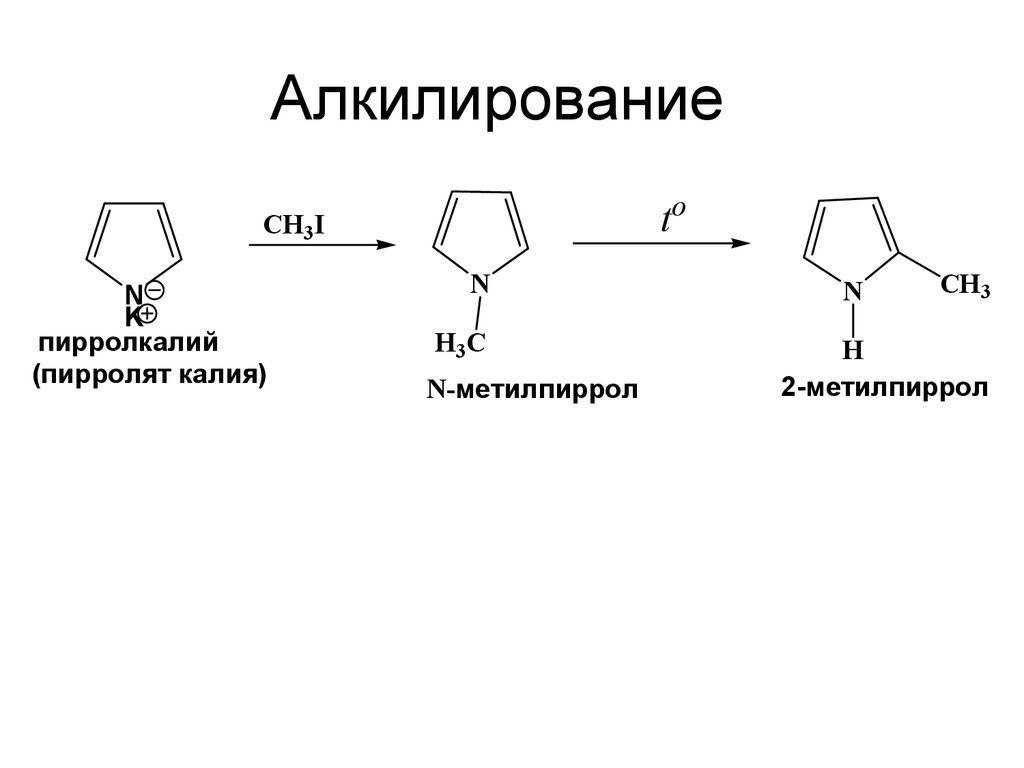
36. Алкилирование
toCH3I
N
K
пирролкалий
(пирролят калия)
N
H3 C
N-метилпиррол
N
CH3
H
2-метилпиррол
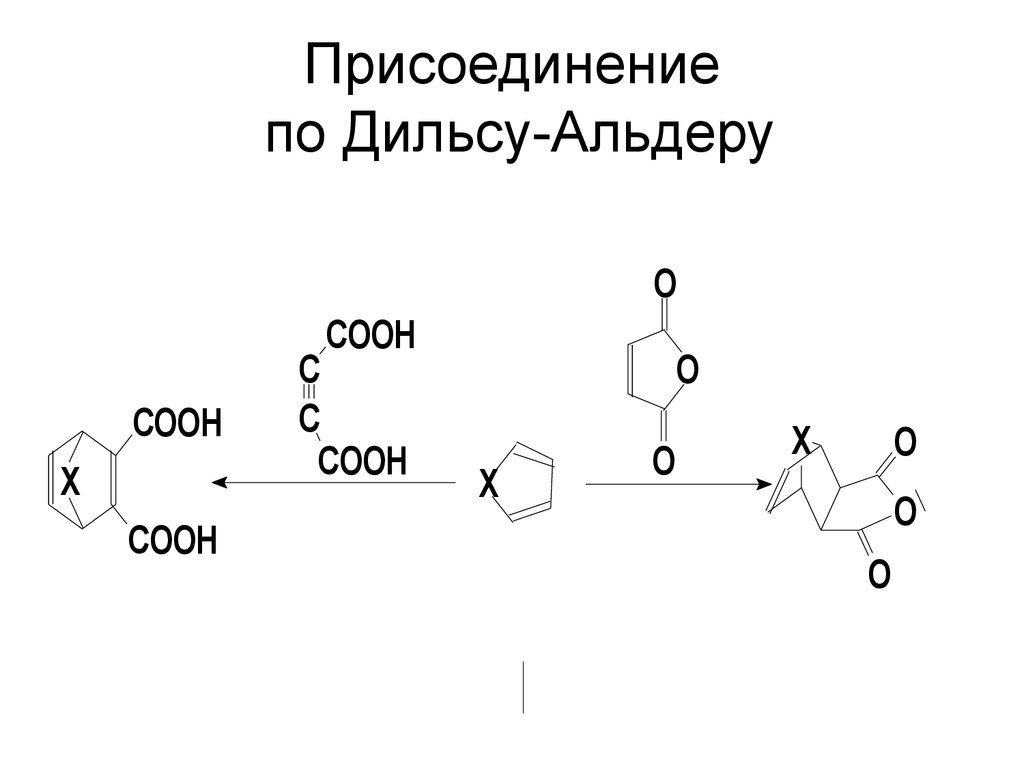
37. РЕАКЦИИ РАЗРУШЕНИЕМ АРОМАТИЧЕСКОЙ СИСТЕМЫ
• Способность вступать в реакции• 1,4-циклоприсоединения наиболее
выражена у фурана и наименее у
тиофена, что вполне согласуется с
изменением ароматичности этих
соединений.
38. Присоединение по Дильсу-Альдеру
OCOOH
COOH
X
COOH
C
C
COOH
O
X
O
X
O
O
O
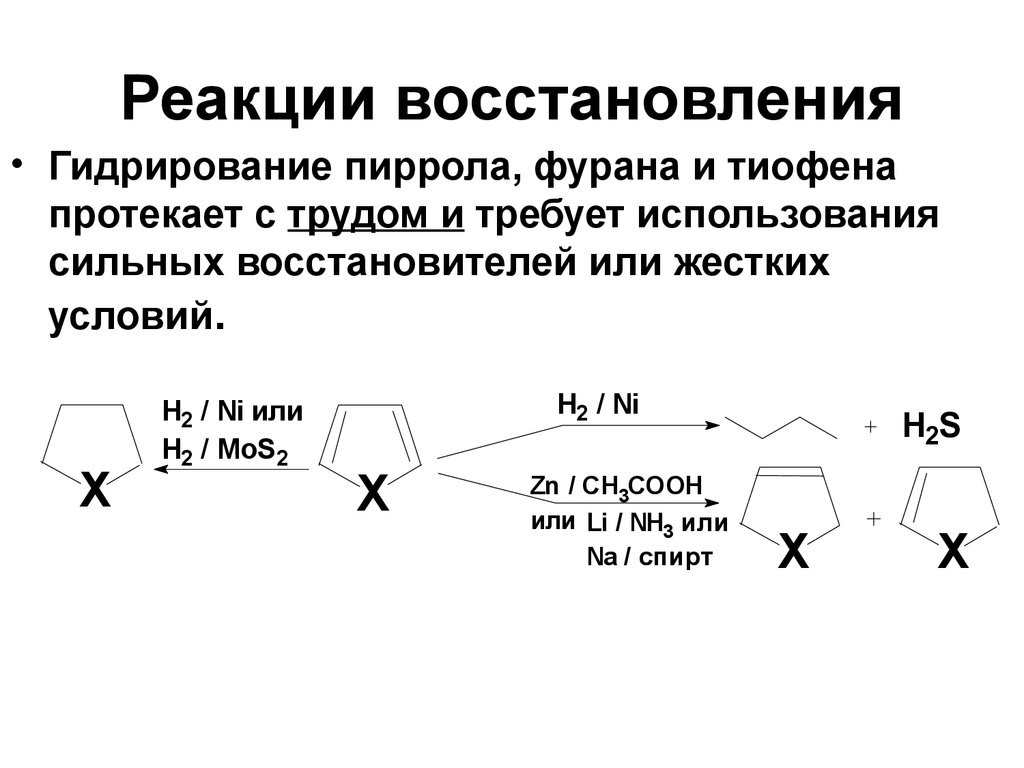
39. Реакции восстановления
• Гидрирование пиррола, фурана и тиофенапротекает с трудом и требует использования
сильных восстановителей или жестких
условий.
X
H2 / Ni или
H2 / MoS2
H2 / Ni
X
Zn / CH3COOH
или Li / NH3 или
Na / спирт
H2S
X
X
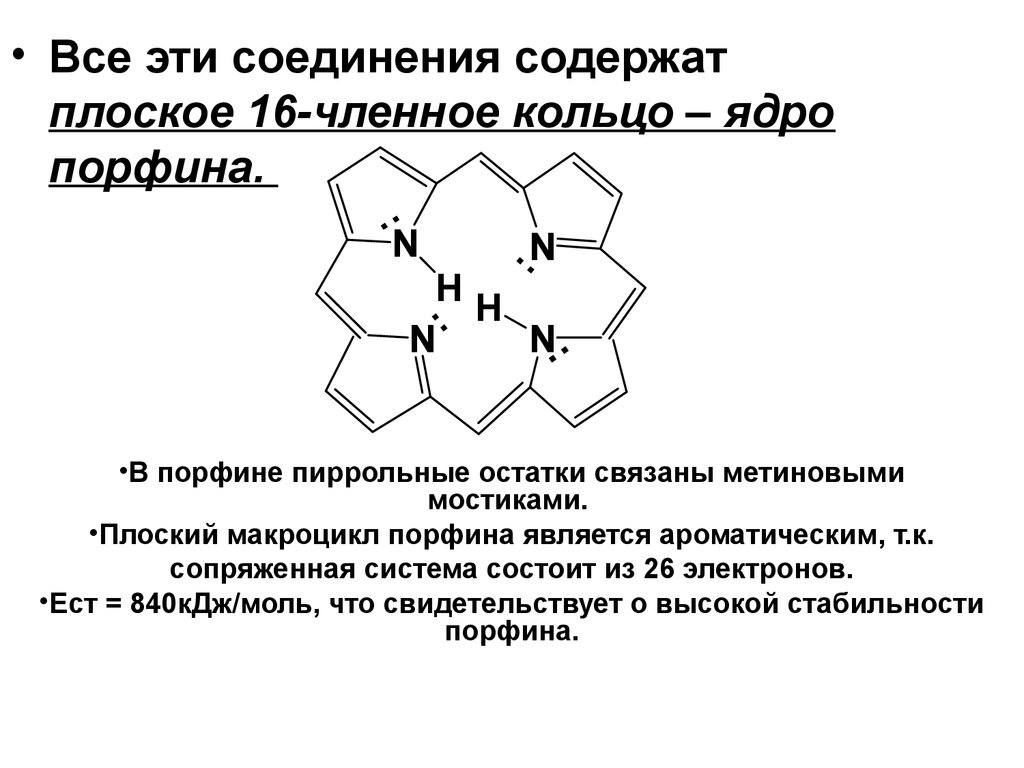
40. Биологическое значение пиррола
Пиррольные ядра образуют основу многихбиологически важных пигментов
(красящих в-в):
- пигментов крови (гемоглобин),
- зеленых частей растений (хлорофилл),
- желчи,
- витамина В12.
Все эти соединения содержат плоское 16членное кольцо – ядро порфина.
41.
• Все эти соединения содержатплоское 16-членное кольцо – ядро
порфина.
N
N
H
H
N
N
•В порфине пиррольные остатки связаны метиновыми
мостиками.
•Плоский макроцикл порфина является ароматическим, т.к.
сопряженная система состоит из 26 электронов.
•Ест = 840кДж/моль, что свидетельствует о высокой стабильности
порфина.
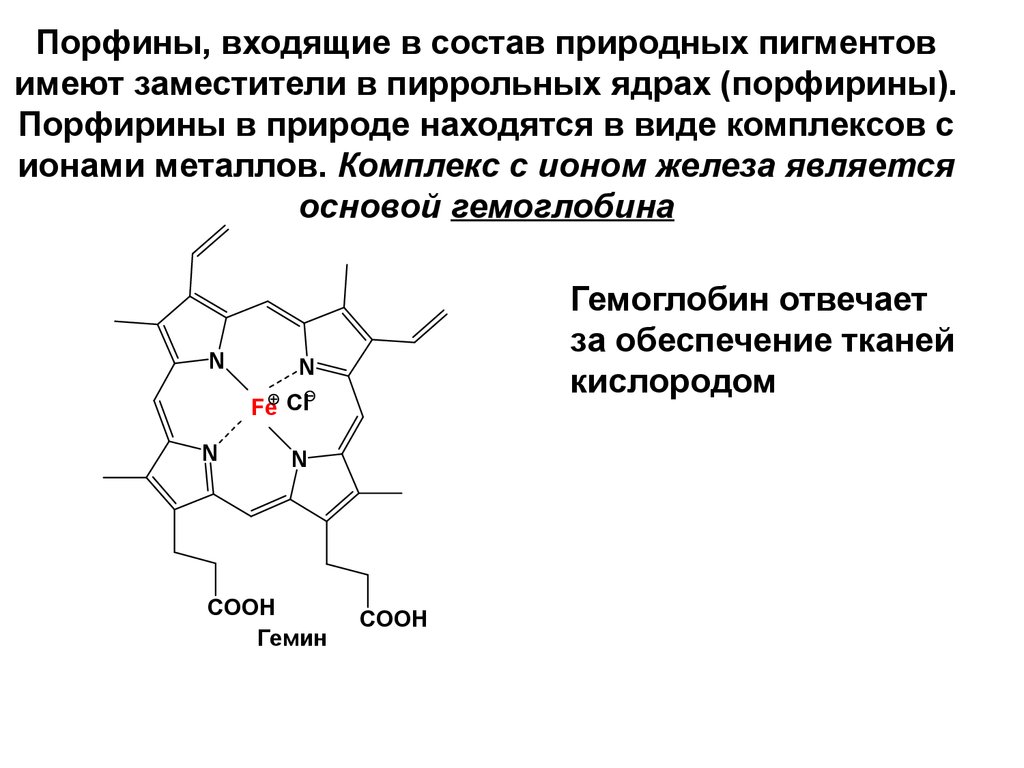
42. Порфины, входящие в состав природных пигментов имеют заместители в пиррольных ядрах (порфирины). Порфирины в природе находятся в виде комп
Порфины, входящие в состав природных пигментовимеют заместители в пиррольных ядрах (порфирины).
Порфирины в природе находятся в виде комплексов с
ионами металлов. Комплекс с ионом железа является
основой гемоглобина
N
Гемоглобин отвечает
за обеспечение тканей
кислородом
N
Fe Cl
N
N
COOH
Гемин
COOH
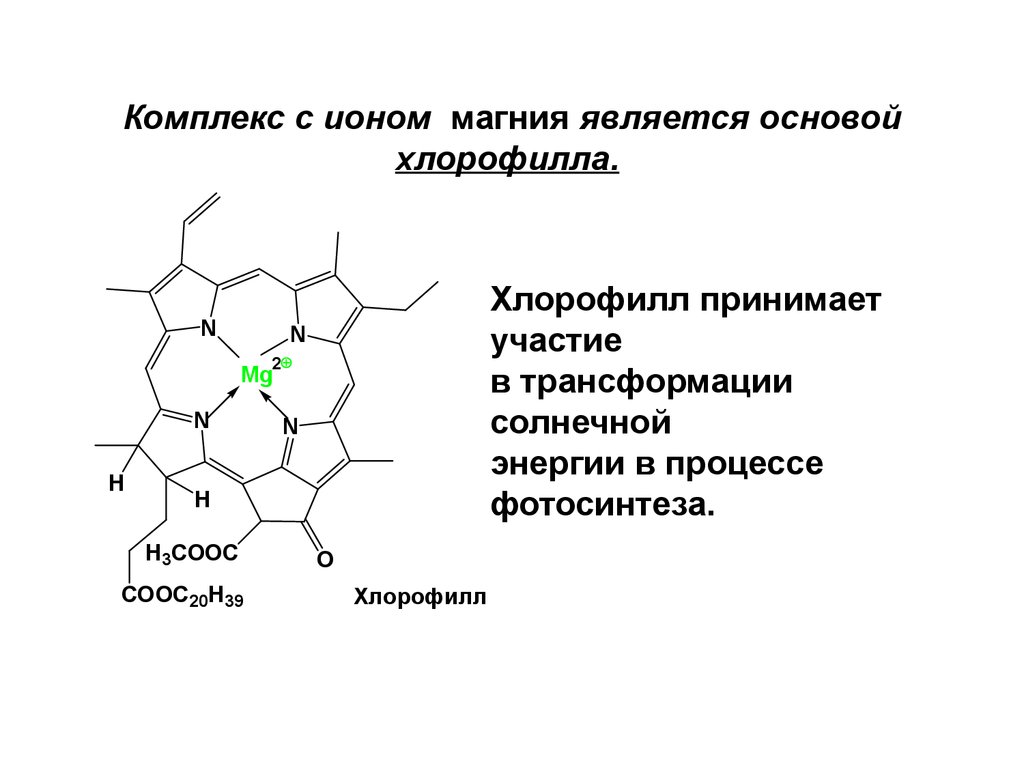
43. Комплекс с ионом магния является основой хлорофилла.
NХлорофилл принимает
участие
в трансформации
солнечной
энергии в процессе
фотосинтеза.
N
2
Mg
N
H
N
H
H3COOC
COOС20H39
O
Хлорофилл
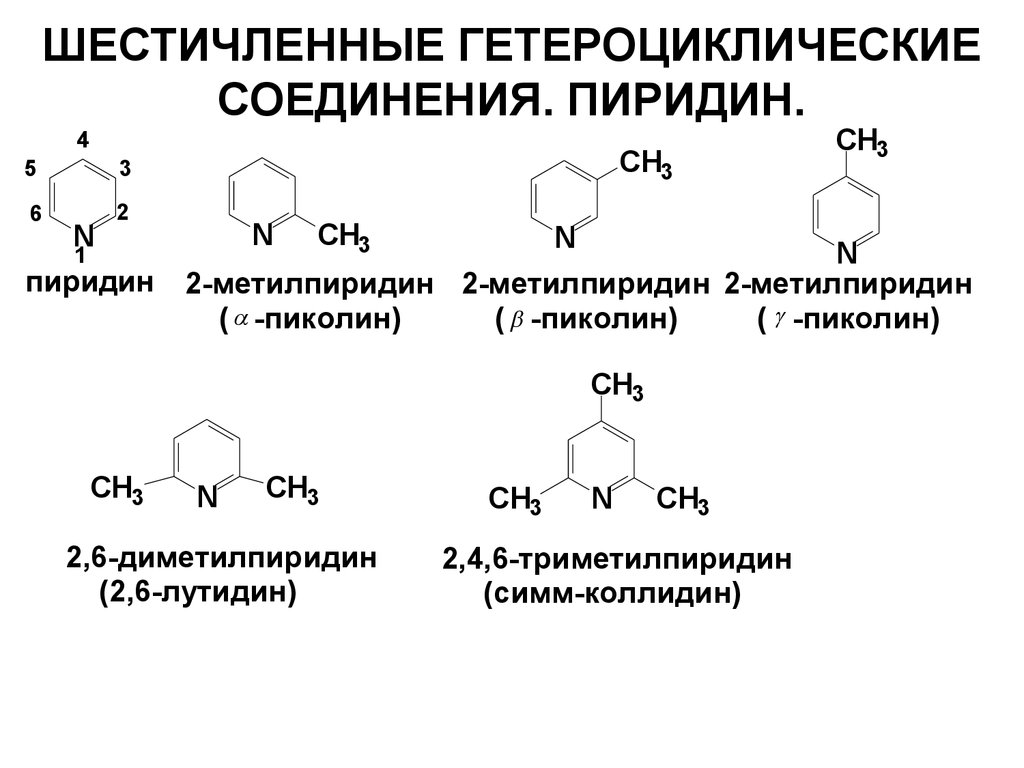
44. ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. ПИРИДИН.
45
3
6
2
N
1
пиридин
CH3
N
CH3
N
N
2-метилпиридин 2-метилпиридин 2-метилпиридин
( -пиколин)
( -пиколин)
( -пиколин)
CH3
CH3
CH3
N
CH3
2,6-диметилпиридин
(2,6-лутидин)
CH3
N
CH3
2,4,6-триметилпиридин
(симм-коллидин)
45. Способы получения
• В промышленных масштабах пиридин иего гомологи получают при
коксохимической переработке
каменного угля.
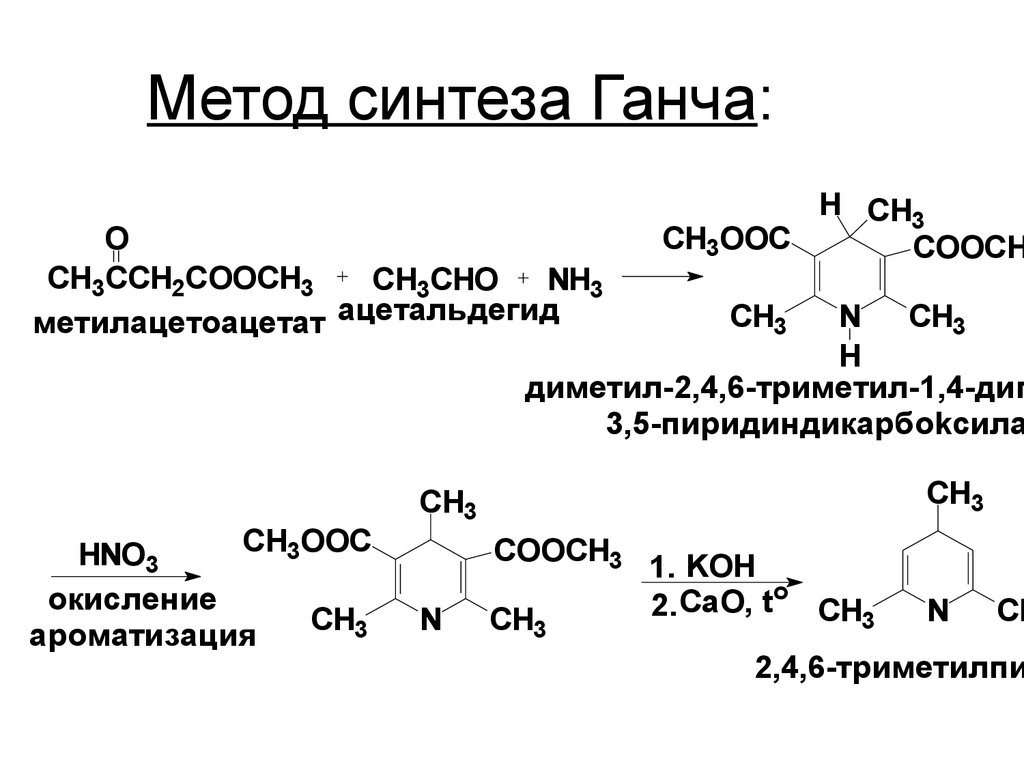
46. Метод синтеза Ганча:
OCH3CCH2COOCH3
CH3CHO
NH3
метилацетоацетат ацетальдегид
H CH3
СH3OOC
COOCH
N CH3
H
диметил-2,4,6-триметил-1,4-диг
3,5-пиридиндикарбоkсила
СH3OOC
HNO3
окисление
CH3
ароматизация
CH3
СH3
СH3
COOCH3
N
CH3
1. KOH
o
2. CaO, t CH3
N
CH
2,4,6-триметилпи
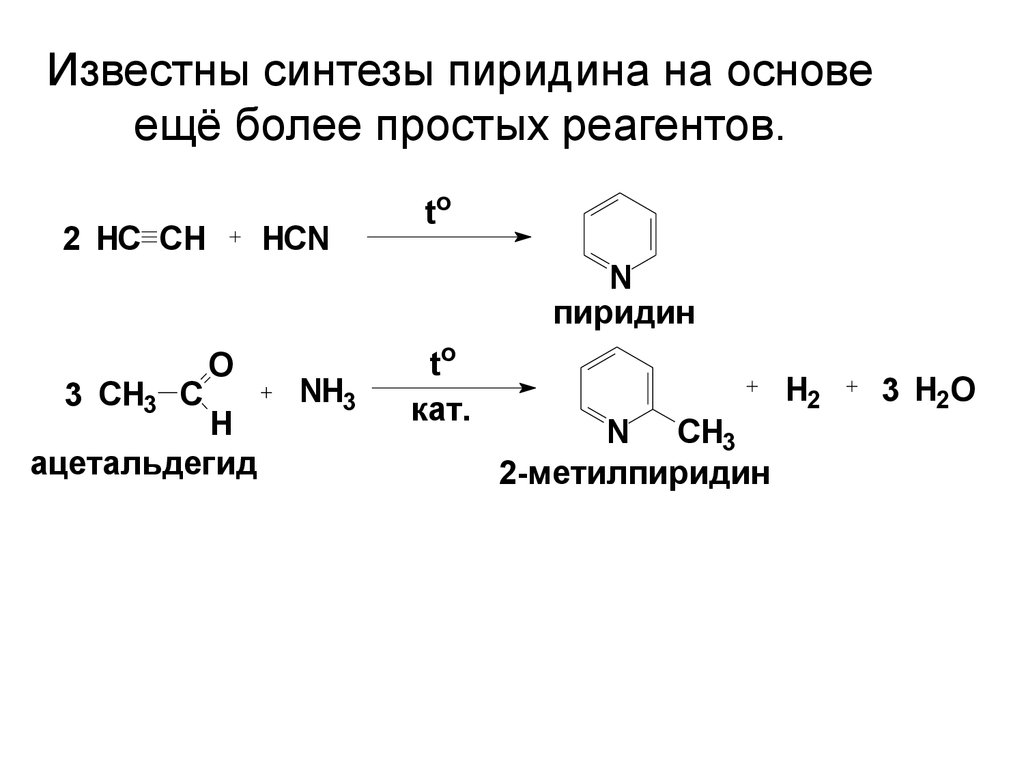
47. Известны синтезы пиридина на основе ещё более простых реагентов.
2 HC СHHCN
to
N
пиридин
3 CH3 C
O
H
ацетальдегид
NH3
to
кат.
N CH3
2-метилпиридин
H2
3 H2O
48. Физические свойства
• Пиридин представляет собойбесцветную жидкость с Ткип. 115,3оС.
Он обладает характерным неприятным
запахом, смешивается во всех
отношениях с водой, этанолом,
диэтиловым эфиром; устойчив при
хранении.
49. СТРОЕНИЕ МОЛЕКУЛЫ ПИРИДИНА
Пиридин является шестичленным
гетероароматическим аналогом
бензола. Его плоская молекула имеет
сопряжённую систему из шести
-электронов. Все атомы цикла (и С, и N)
находятся в состоянии
sp2-гибридизации и вносят по одному
электрону в ароматический секстет.
50.
пиридинN
Неподеленная Электронная Пара (НЭП) атома азота
находится вне сопряженной системы и занимает sp2 –
орбиталь, ориентированную в плоскости цикла и
имеющую σ-симметрию.
51.
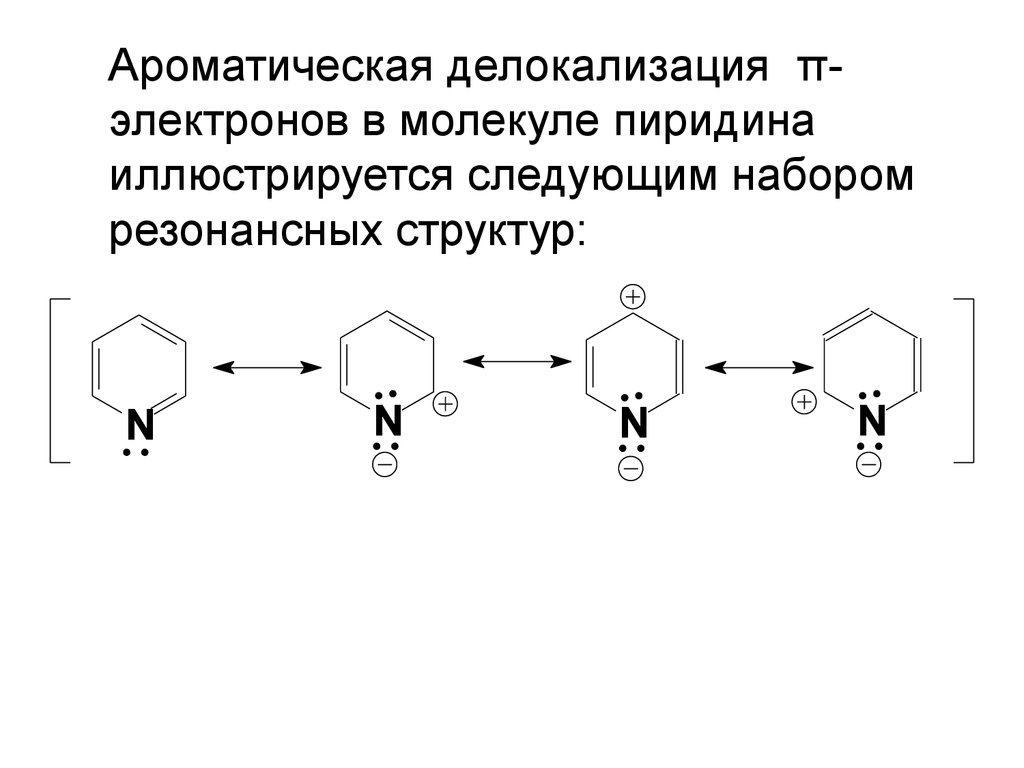
Ароматическая делокализация πэлектронов в молекуле пиридинаиллюстрируется следующим набором
резонансных структур:
N
N
N
N
52.
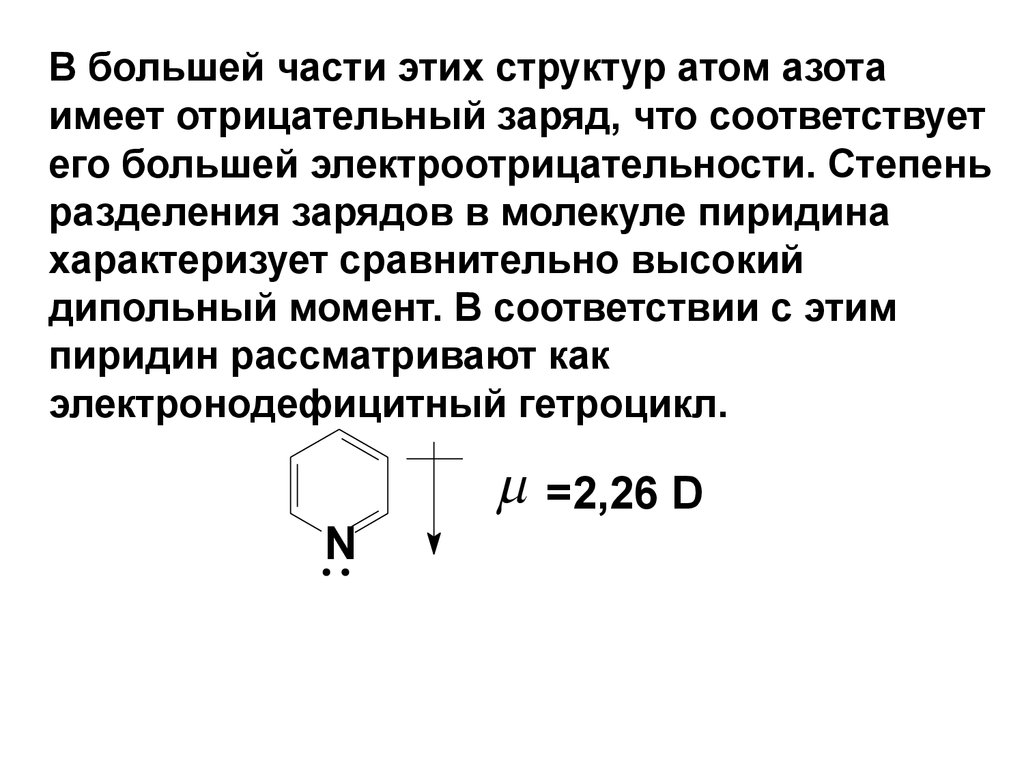
В большей части этих структур атом азотаимеет отрицательный заряд, что соответствует
его большей электроотрицательности. Степень
разделения зарядов в молекуле пиридина
характеризует сравнительно высокий
дипольный момент. В соответствии с этим
пиридин рассматривают как
электронодефицитный гетроцикл.
N
=2,26 D
53. ХИМИЧЕСКИЕ СВОЙСТВА
I. Основные и нуклеофильныесвойства
Поскольку НЭП азота в молекуле
пиридина не входит в ароматический
секстет, пиридин обнаруживает и
основные, и нуклеофильные свойства.
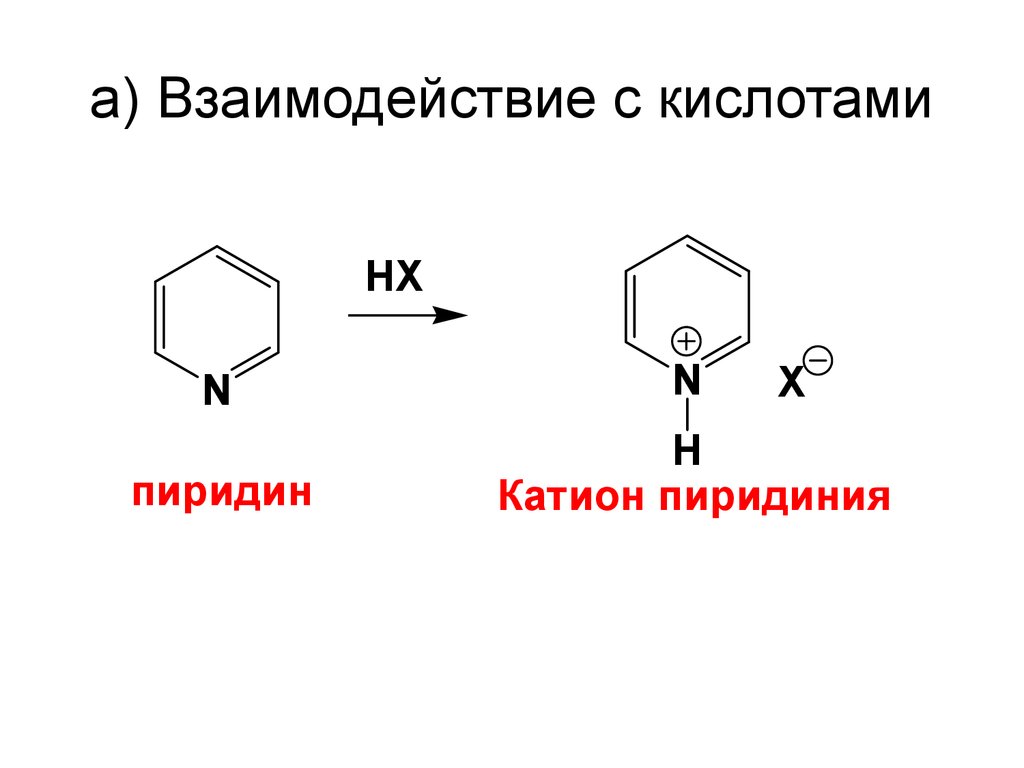
54. a) Взаимодействие с кислотами
HXN
N
пиридин
H
Катион пиридиния
X
55.
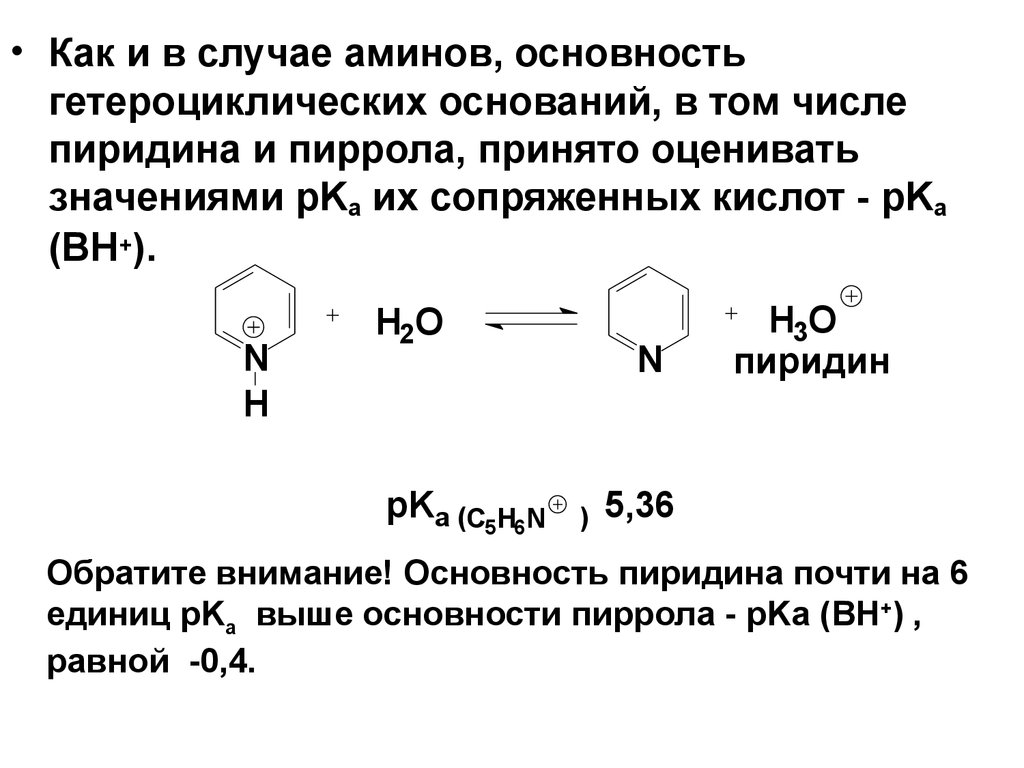
• Как и в случае аминов, основностьгетероциклических оснований, в том числе
пиридина и пиррола, принято оценивать
значениями pKa их сопряженных кислот - pKa
(ВН+).
N
H
H2O
pKa (C5H6N
N
)
H3O
пиридин
5,36
Обратите внимание! Основность пиридина почти на 6
единиц pKa выше основности пиррола - pKa (ВН+) ,
равной -0,4.
56.
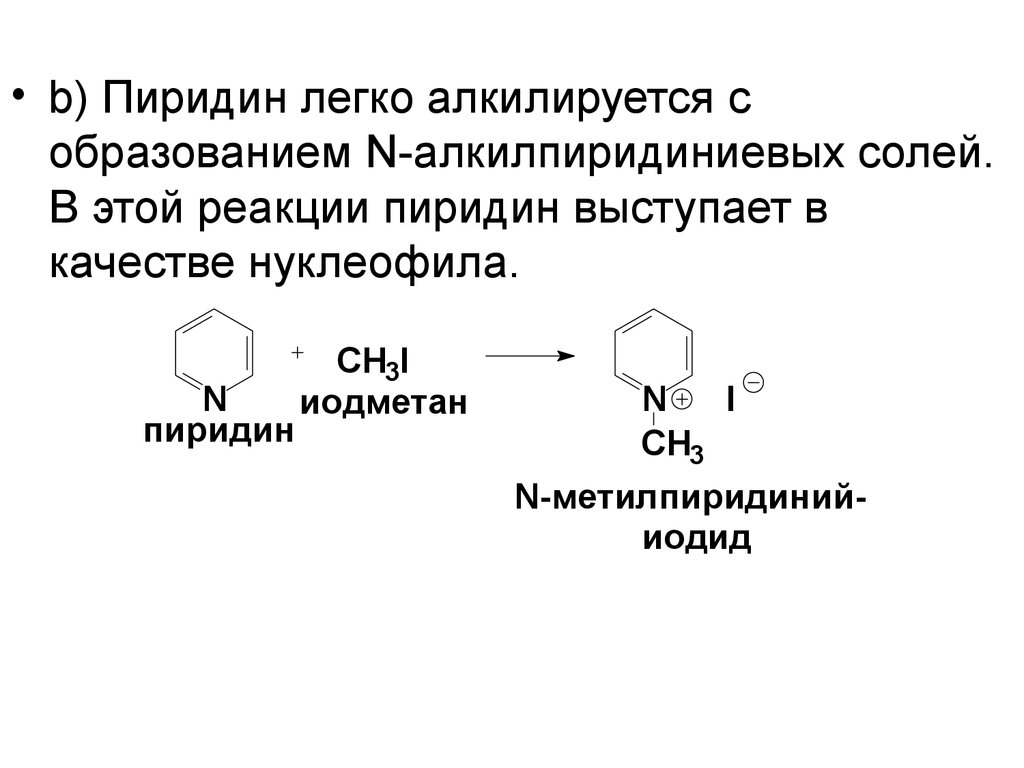
• b) Пиридин легко алкилируется собразованием N-алкилпиридиниевых солей.
В этой реакции пиридин выступает в
качестве нуклеофила.
N
пиридин
CH3I
иодметан
N
I
CH3
N-метилпиридинийиодид
57.
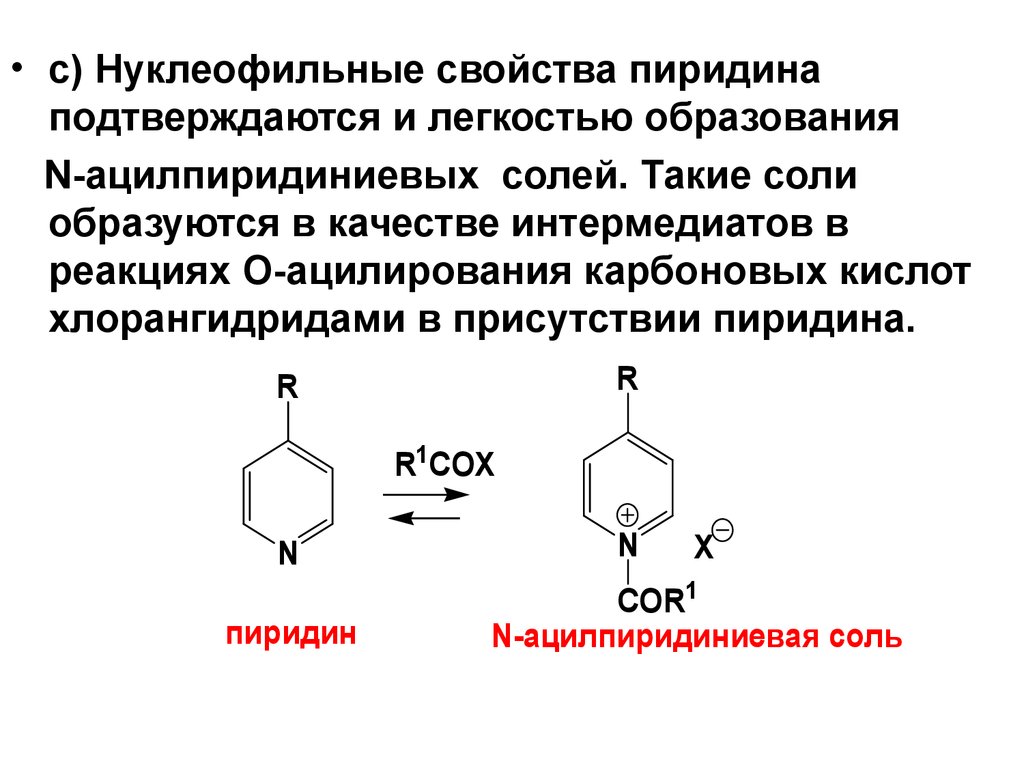
• c) Нуклеофильные свойства пиридинаподтверждаются и легкостью образования
N-ацилпиридиниевых солей. Такие соли
образуются в качестве интермедиатов в
реакциях О-ацилирования карбоновых кислот
хлорангидридами в присутствии пиридина.
R
R
R1COX
N
пиридин
N
X
COR1
N-ацилпиридиниевая соль
58.
• Вследствие солеобразования пиридиниевоекольцо сильно дезактивируется к
электрофильной атаке. Скорость реакции
нитрования соли пиридина по сравнению с
пиридином уменьшается в 1013 раз.
• Пиридин вступает в реакции электрофильного
замещения гораздо медленней, чем бензол,
напоминая в этом отношении нитробензол.
Активность же пиридиний- катиона еще ниже.
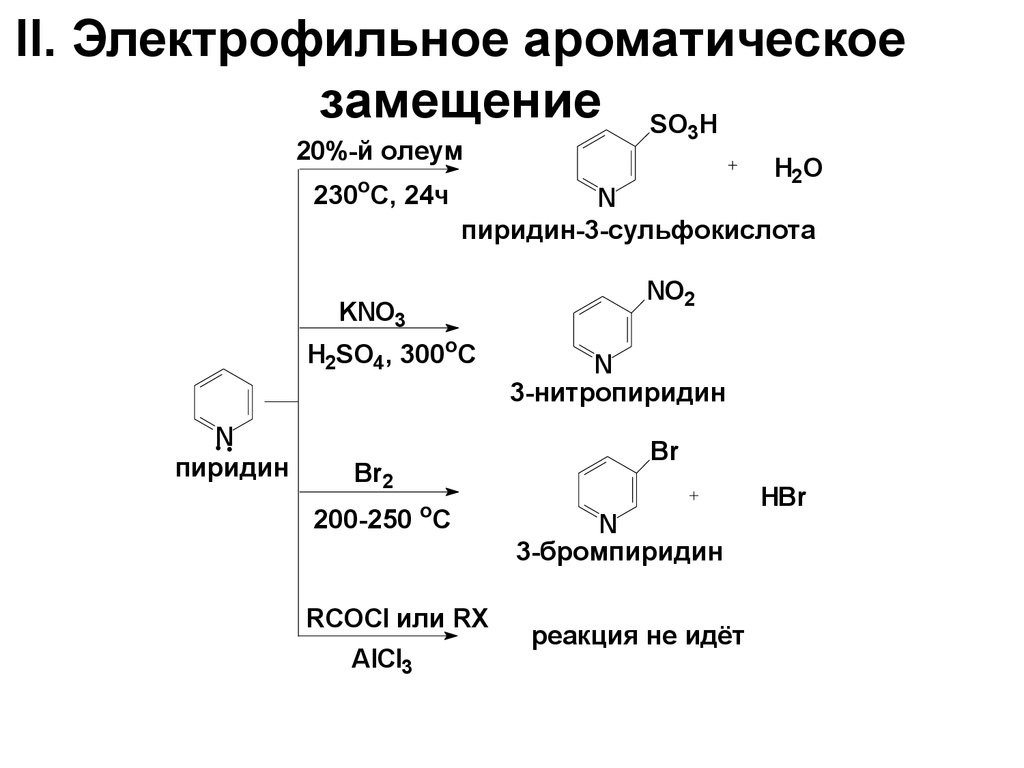
59. II. Электрофильное ароматическое замещение
SO H3
20%-й олеум
о
230 С, 24ч
N
пиридин-3-сульфокислота
NO2
KNO3
H2SO4, 300oC
N
пиридин
N
3-нитропиридин
Br
Br2
o
200-250 C
RCOCl или RX
AlCl3
H2O
N
3-бромпиридин
реакция не идёт
HBr
60.
• SE в пиридинах протекаетисключительно в β-положения, и только
когда эти положения заняты
электронодонорными заместителями,
возможна ориентация в α- или γположения. Преимущество атаки в βположение объясняется строением
промежуточных σ-аддуктов. Только при
β-атаке нет резонансных структур с
положительным зарядом на N и заряд
делокализован между 3-мя атомами С.
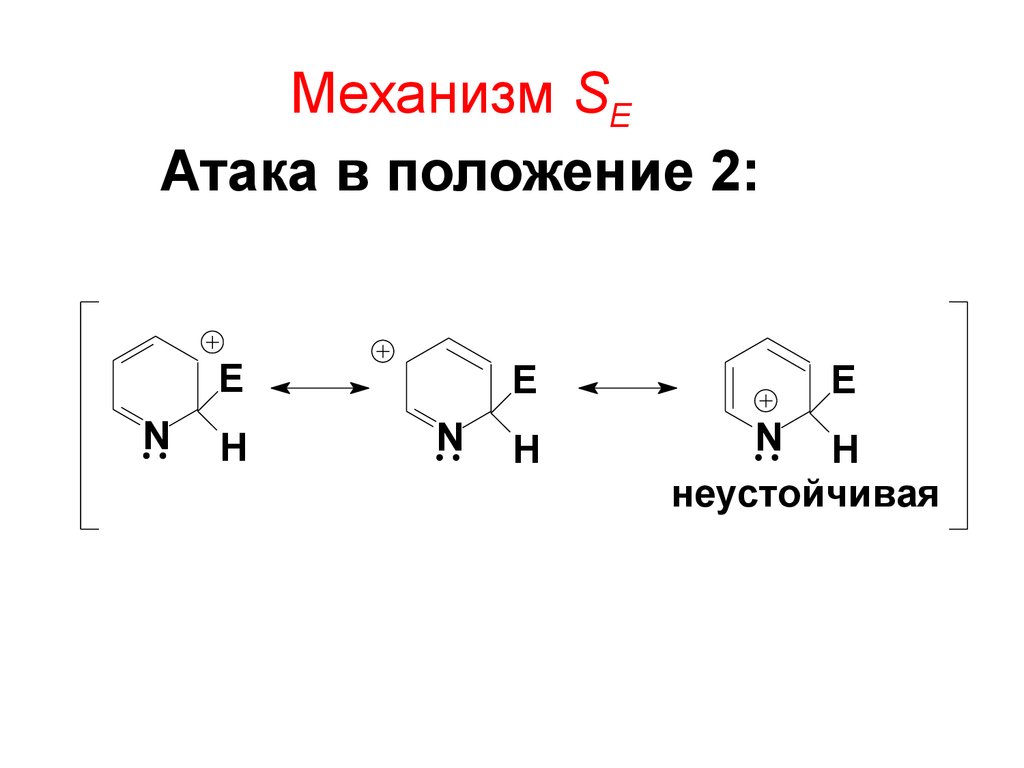
61. Mеханизм SE Атака в положение 2:
EN
H
E
N
H
E
N H
неустойчивая
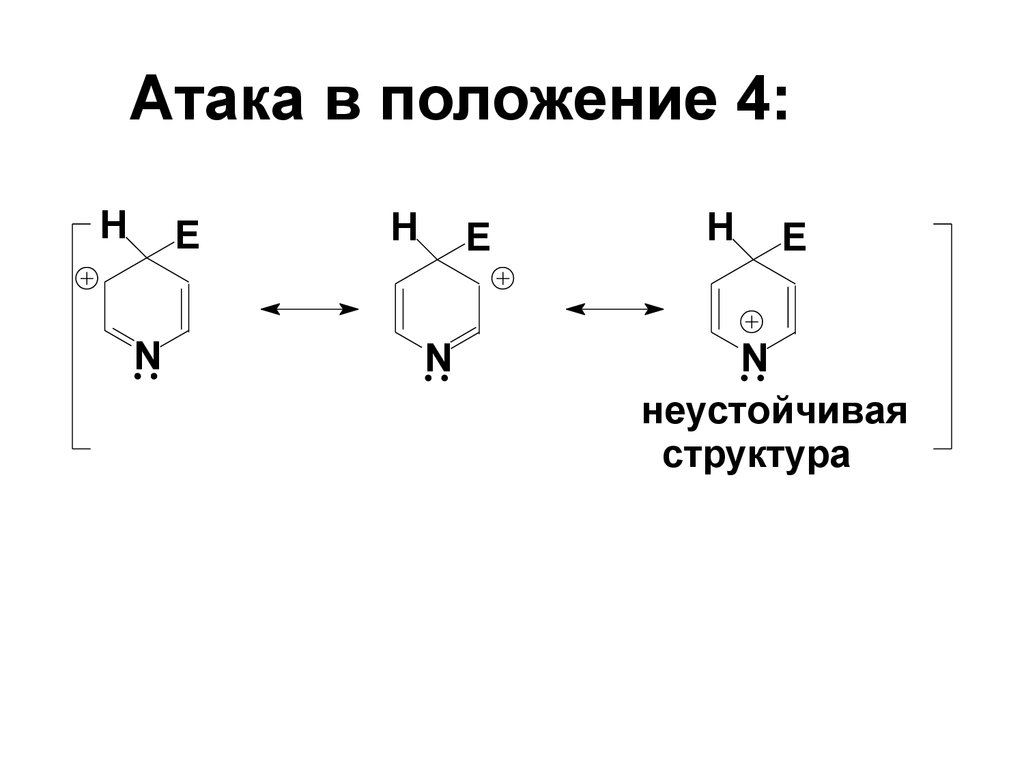
62. Атака в положение 4:
HE
N
H
E
N
H
E
N
неустойчивая
структура
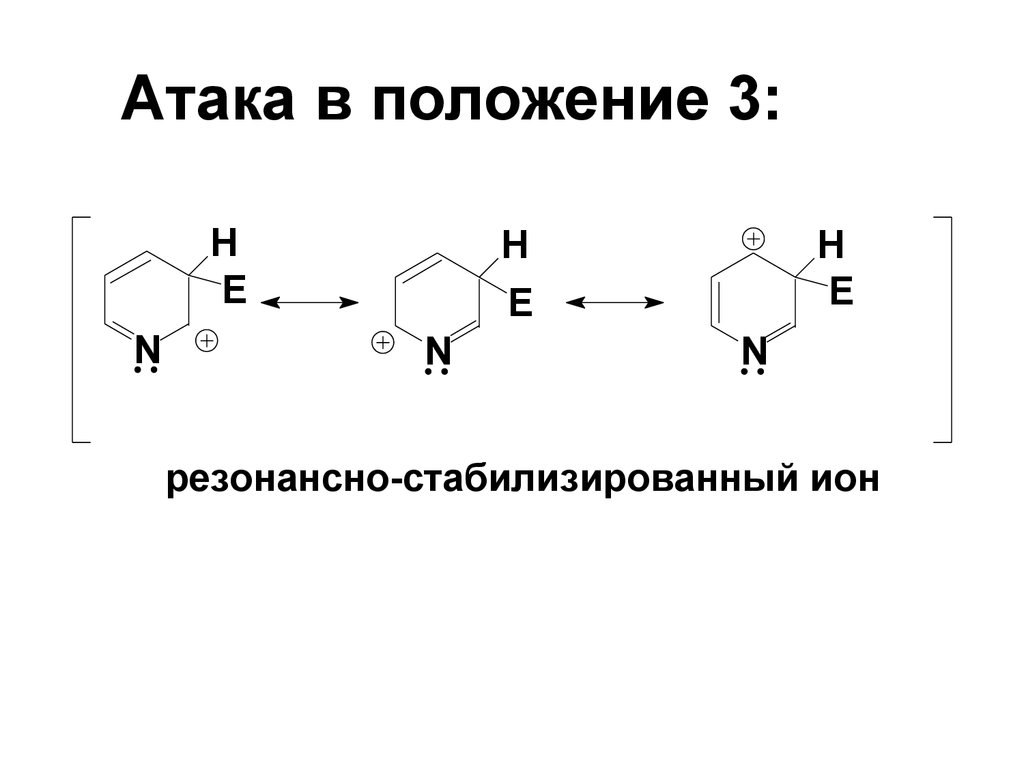
63. Атака в положение 3:
HE
N
H
H
E
E
N
N
резонансно-стабилизированный ион
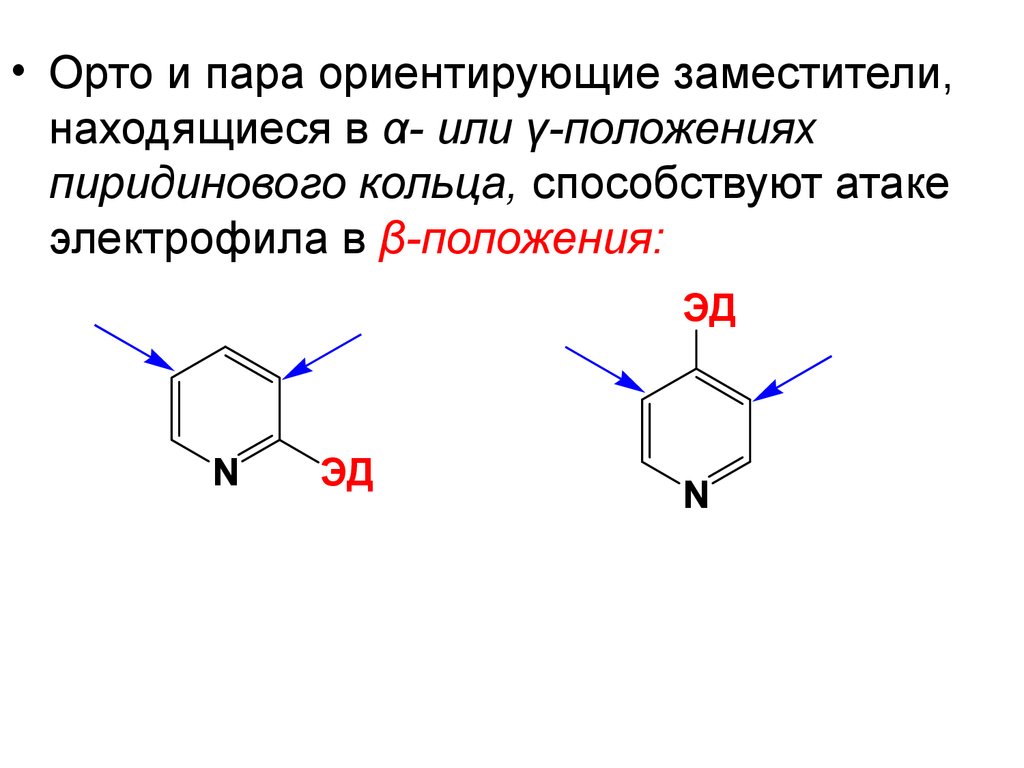
64.
• Орто и пара ориентирующие заместители,находящиеся в α- или γ-положениях
пиридинового кольца, способствуют атаке
электрофила в β-положения:
ЭД
N
ЭД
N
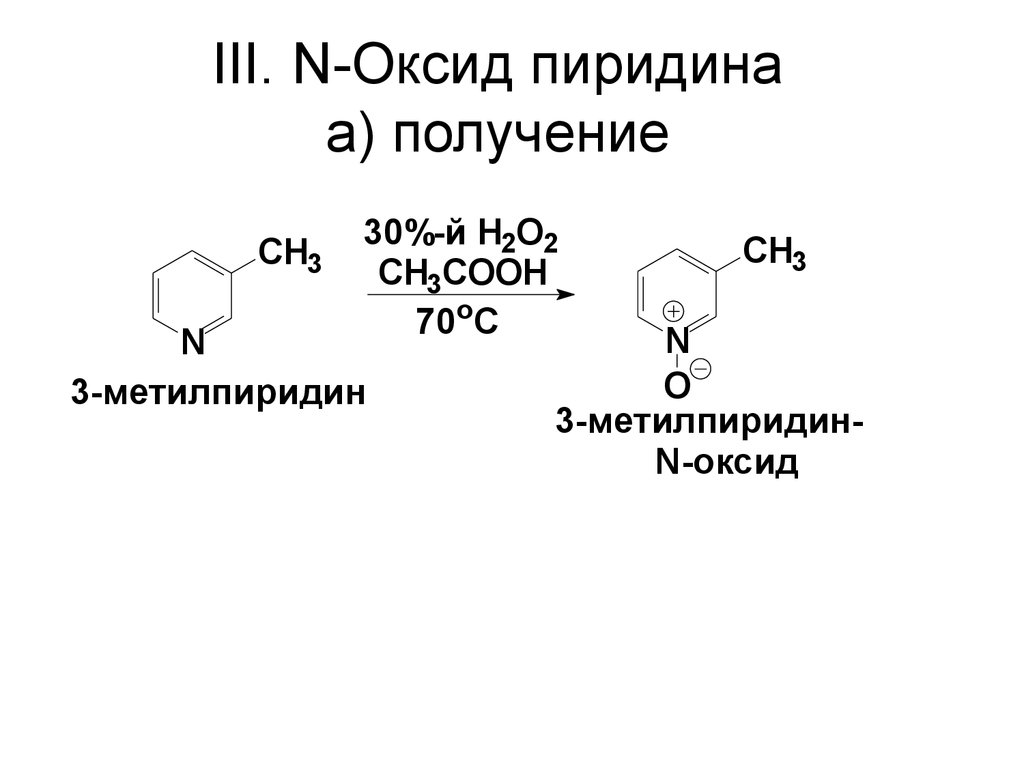
65. III. N-Оксид пиридина a) получение
CH330%-й H2O2
CH3COOH
70oC
N
3-метилпиридин
CH3
N
O
3-метилпиридинN-оксид
66.
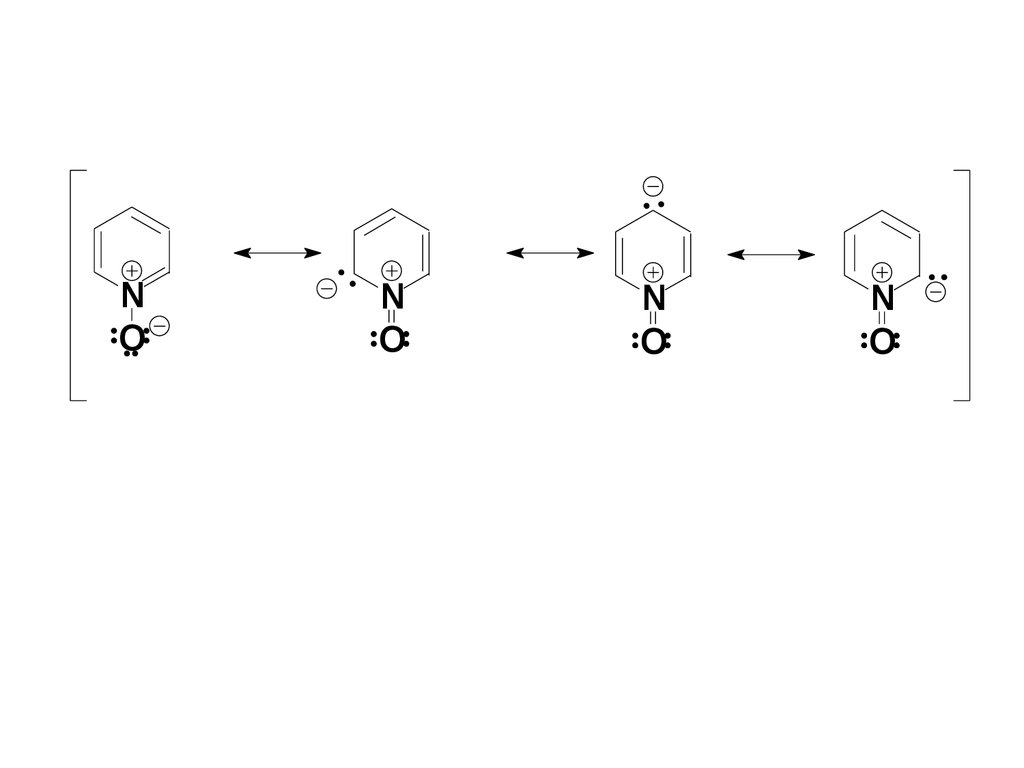
NO
N
O
N
O
N
O
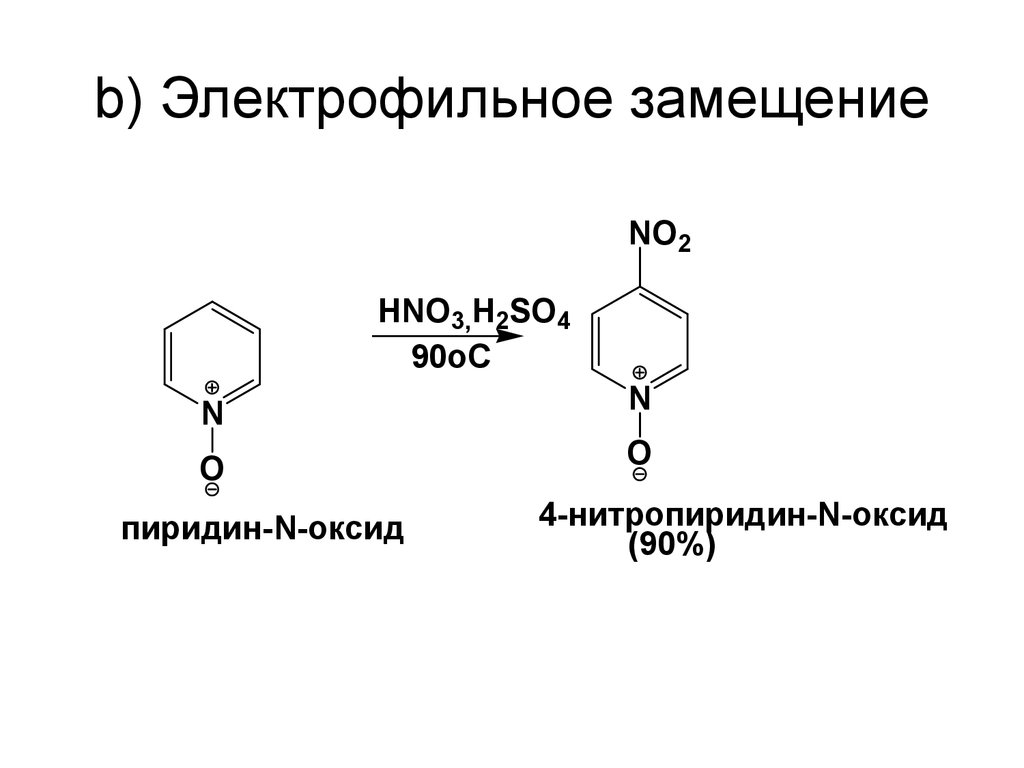
67. b) Электрофильное замещение
NO2HNO3,H2SO4
90oC
N
N
O
O
пиридин-N-оксид
4-нитропиридин-N-оксид
(90%)
68.
• Замещению подвергаетсянепротонированный N-оксид, реакционная
способность которого в 4х10-6 раза ниже
бензола. Интермедиат, образующийся при
атаке Е+ в положение 4, резонансно
стабилизирован атомом кислорода.
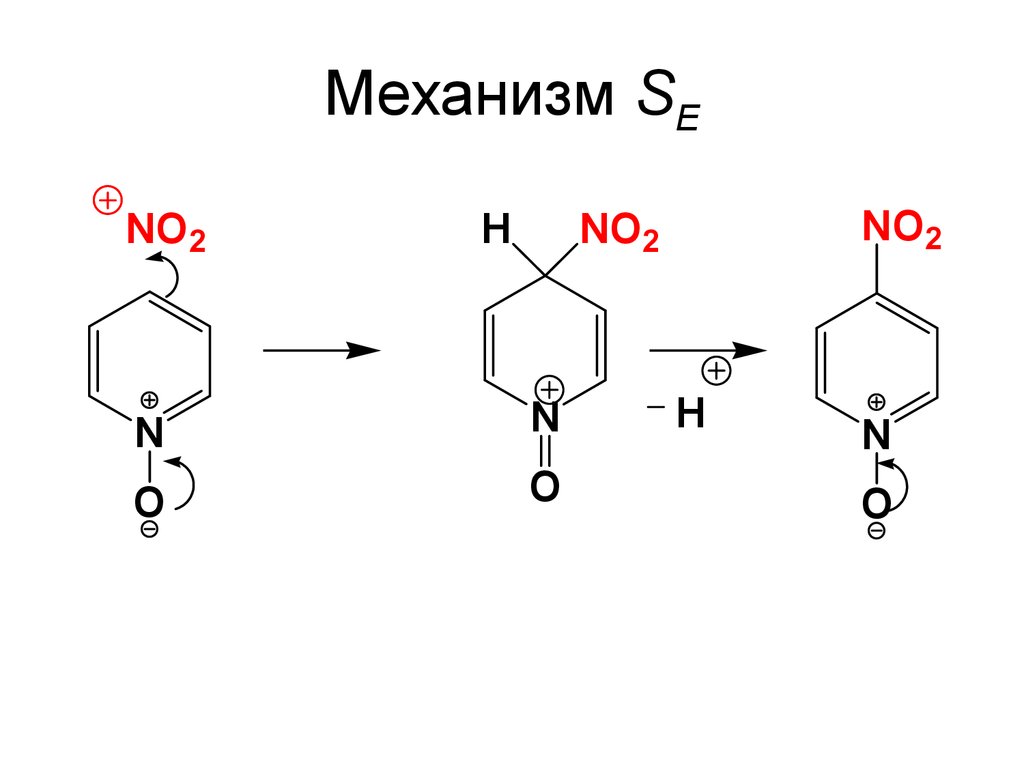
69. Mеханизм SE
NO2H
NO2
NO2
N
N
O
O
H
N
O
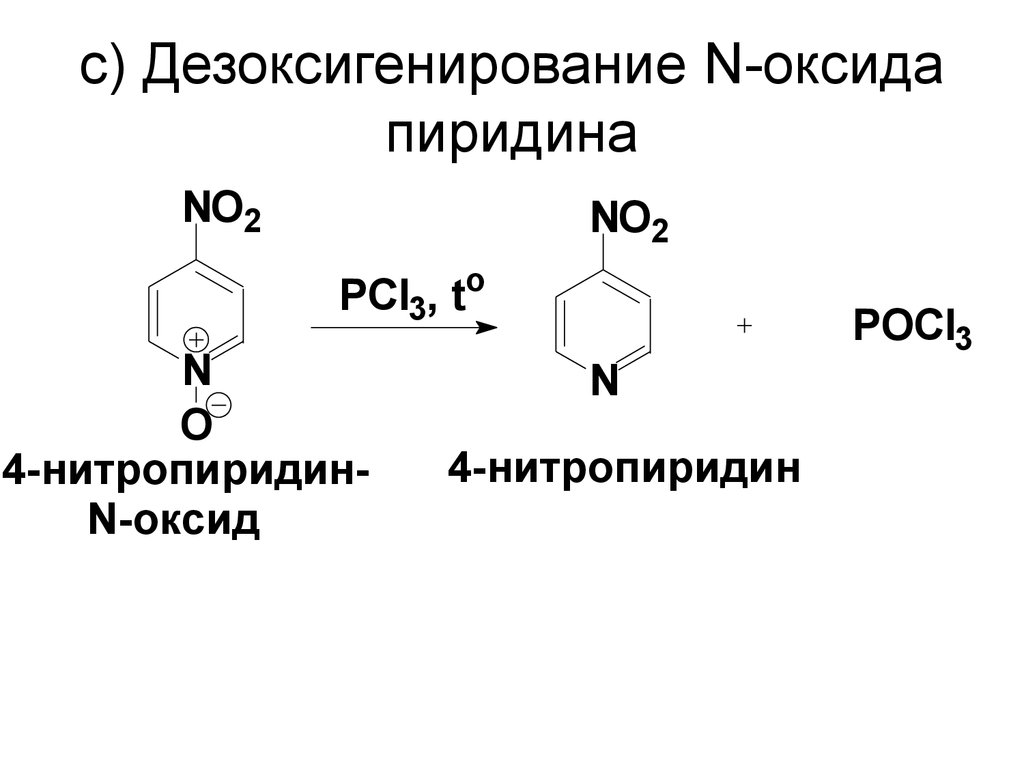
70. c) Дезоксигенирование N-оксида пиридина
NO2NO2
PCl3, to
N
O
4-нитропиридинN-оксид
N
4-нитропиридин
POCl3
71. IV. Нуклеофильное замещение
Высокое сродство к электронуспособствует особой склонности
пиридина к реакциям с нуклеофильными
реагентами. Классическим примером такой
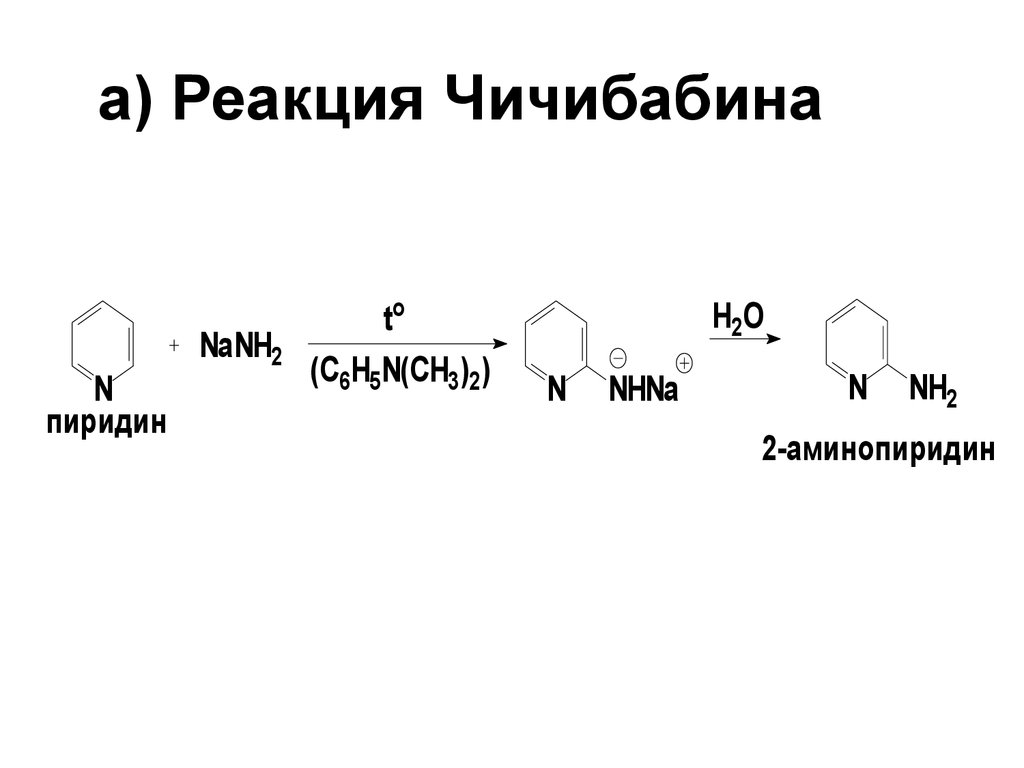
реакции является реакция Чичибабина
(1914 г.). В этой реакции пиридин
обрабатывают амидом натрия при
нагревании в N,N-диметиланилине или
толуоле в качестве растворителя.
72. a) Реакция Чичибабина
Nпиридин
NaNH2
to
(C6H5N(CH3)2)
H2O
N
NHNa
N
NH2
2-аминопиридин
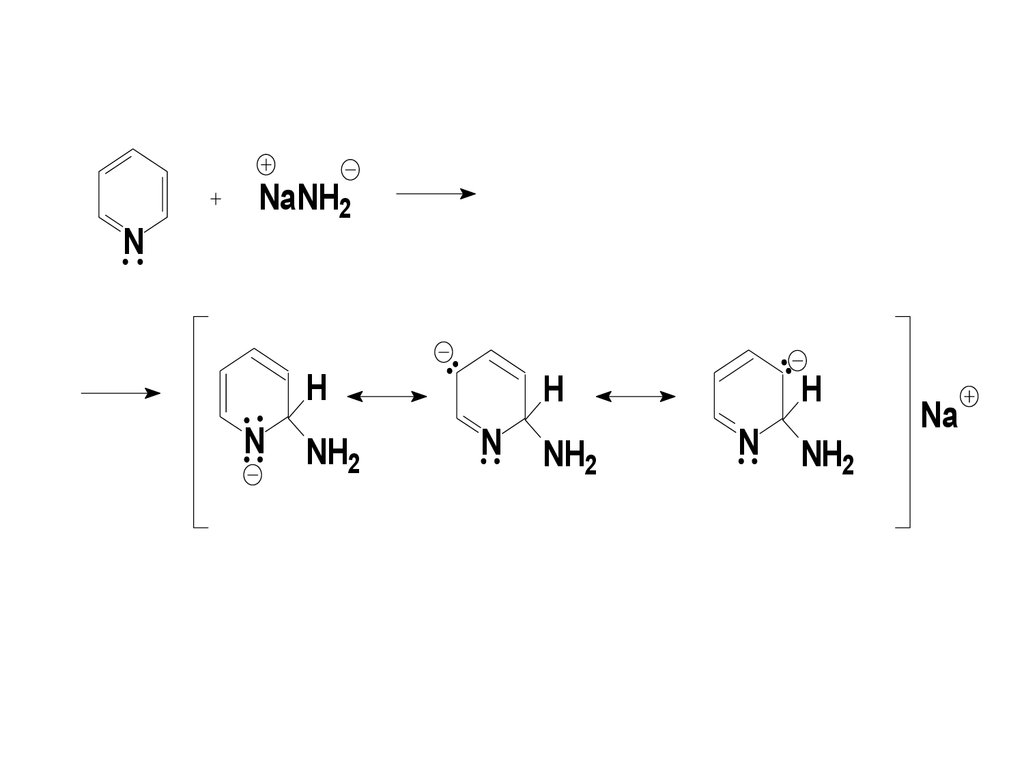
73. Механизм реакции Чичибабина
Стадия 1 – реакция идёт с
преимущественной атакой
нуклеофила по С2 (С6), поскольку
отрицательный заряд в
соответствующем -комплексе
делокализован с участием
электроотрицательного атома азота
цикла:
74.
NNaNH2
H
N
NH2
H
N
NH2
H
N
NH2
Na
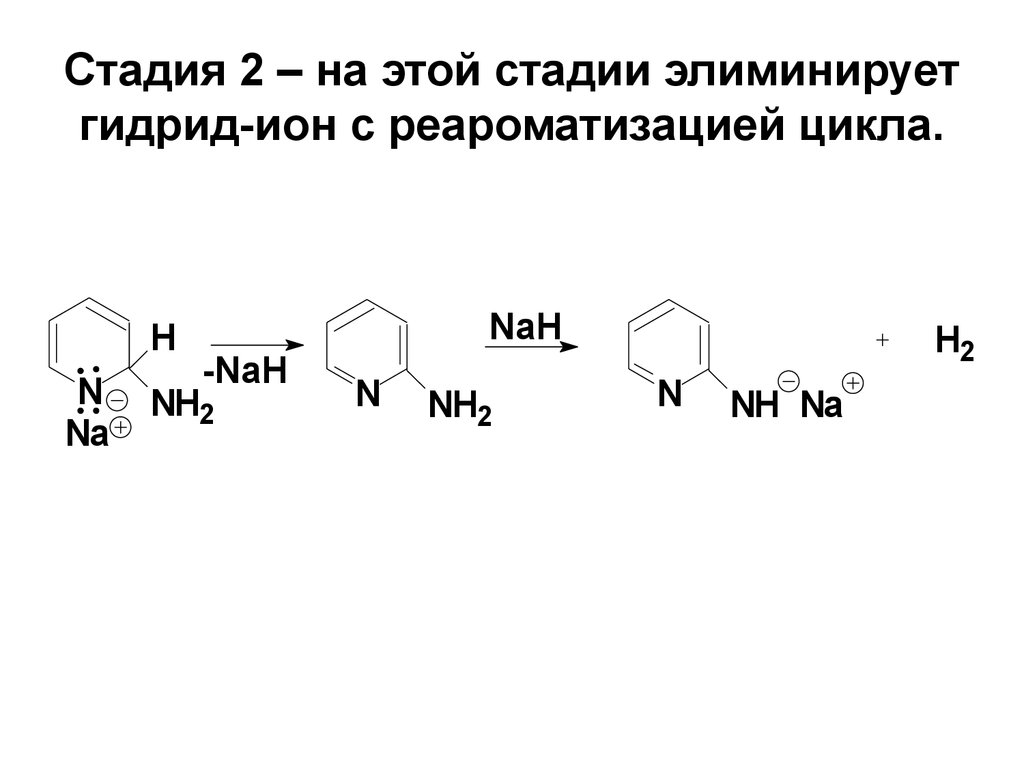
75. Стадия 2 – на этой стадии элиминирует гидрид-ион с реароматизацией цикла.
HN
Na
NaH
-NaH
NH2
N
NH2
H2
N
NH Na
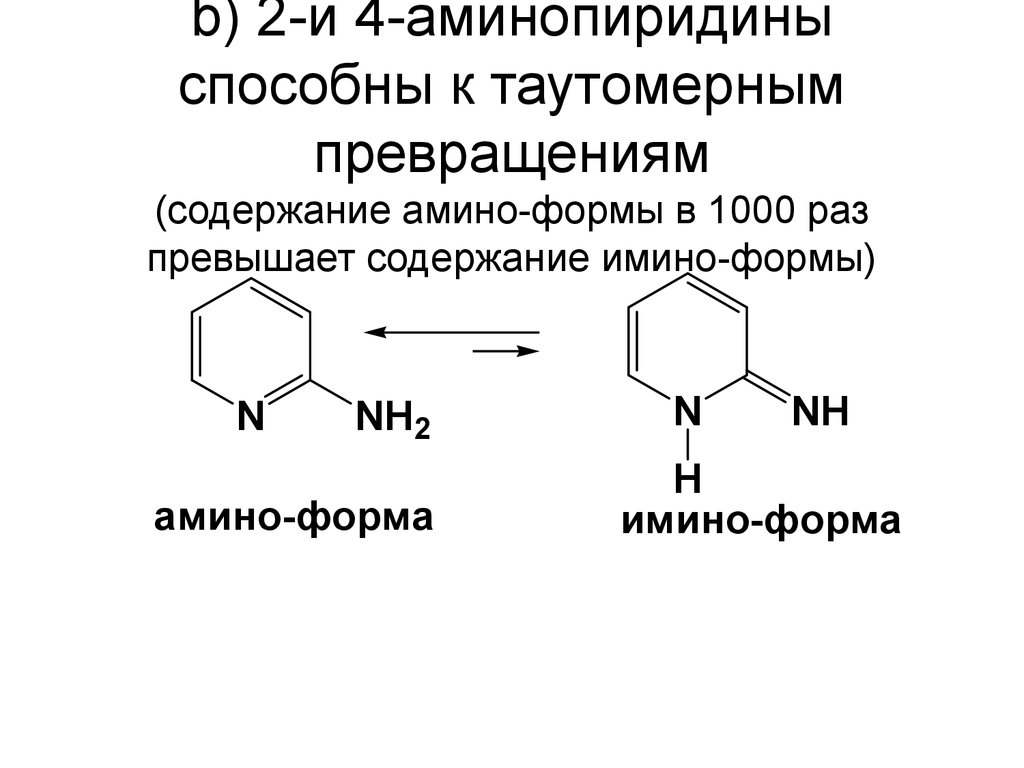
76. b) 2-и 4-аминопиридины способны к таутомерным превращениям (содержание амино-формы в 1000 раз превышает содержание имино-формы)
NNH2
амино-форма
N
NH
H
имино-форма
77. c) Другие реакции SN
1.C6H5Li,эфир2.O2
C6H5
N
KOH,320oC
N
N
OH
1.RLi,
2.O2
N
R
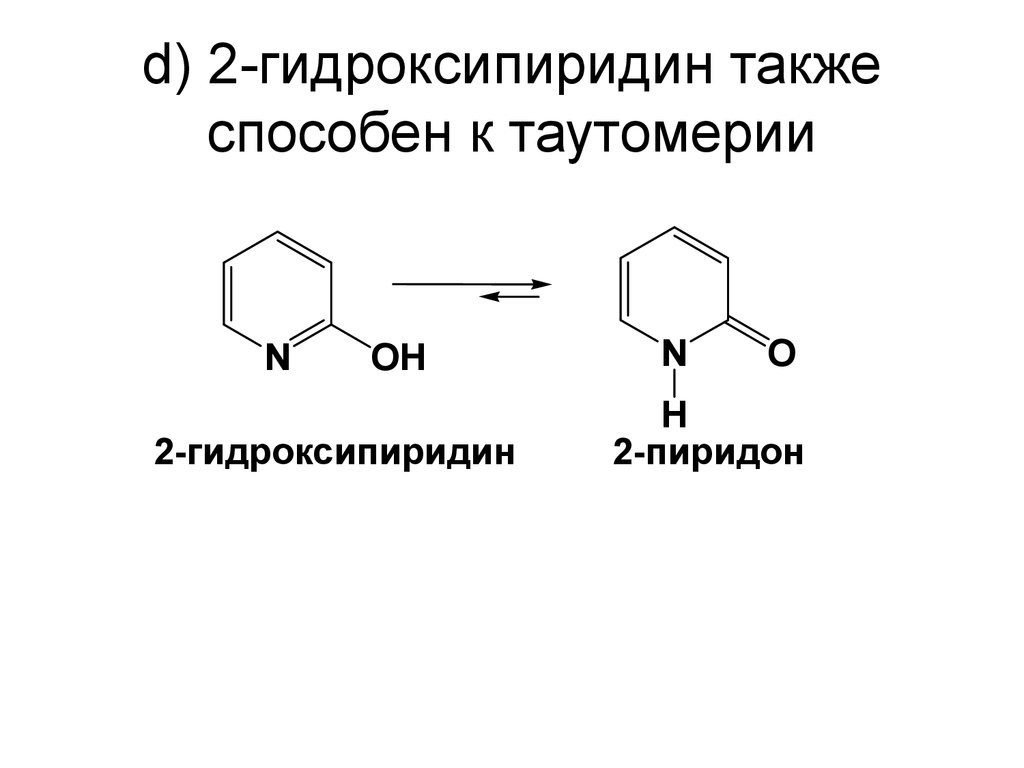
78. d) 2-гидроксипиридин также способен к таутомерии
NOH
2-гидроксипиридин
N
O
H
2-пиридон
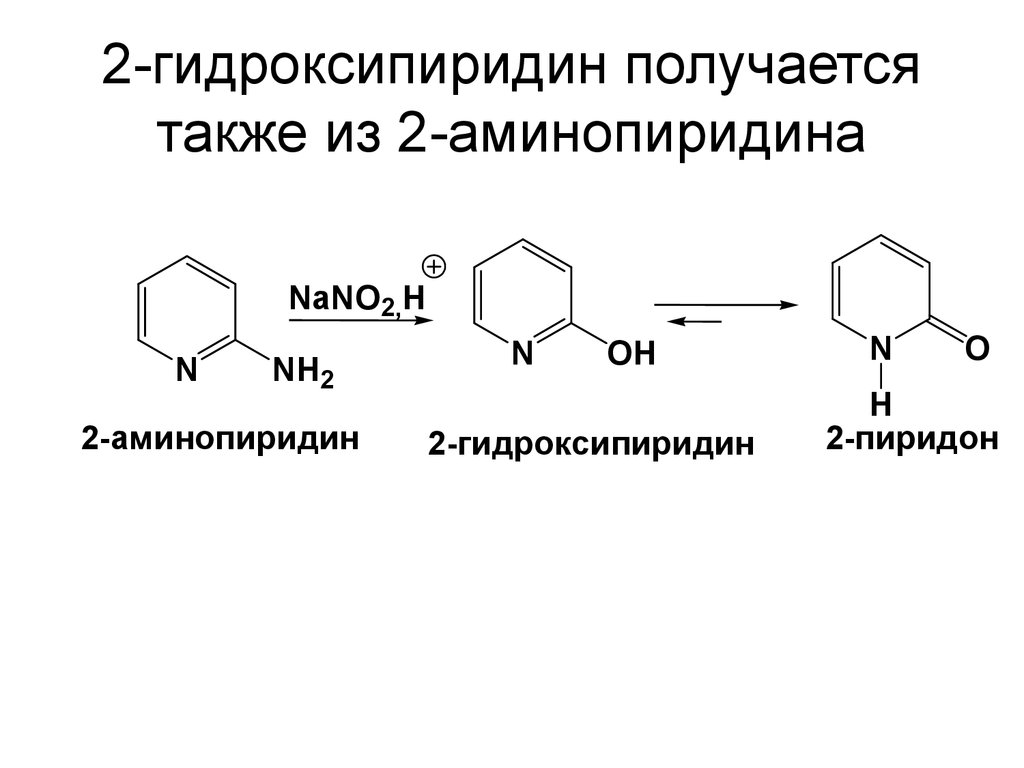
79. 2-гидроксипиридин получается также из 2-аминопиридина
NaNO2,HN
NH2
2-аминопиридин
N
OH
2-гидроксипиридин
N
O
H
2-пиридон
80. V. Восстановление
Электронодефицитный характерпиридина проявляет себя и в
относительной лёгкости восстановления
пиридинового цикла. Важно, что
восстановление гладко проходит не
только как гидрирование в присутствии Ptкатализатора, но и при действии натрия в
абсолютном спирте.
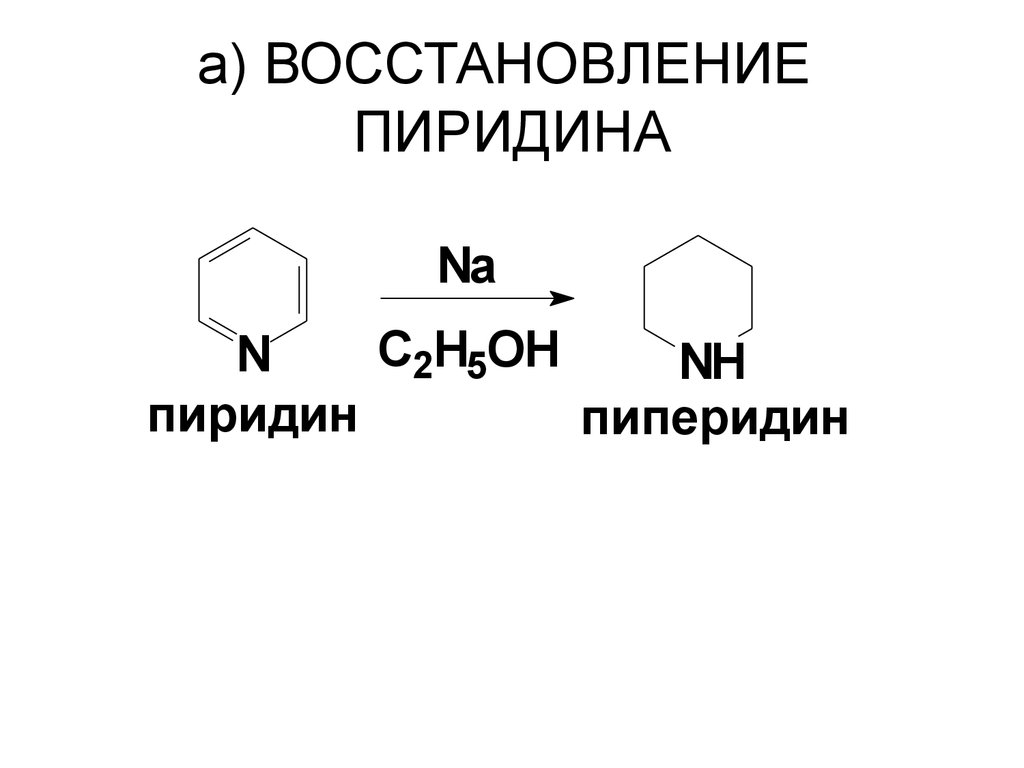
81. a) ВОССТАНОВЛЕНИЕ ПИРИДИНА
NaC2H5OH
N
NH
пиридин
пиперидин
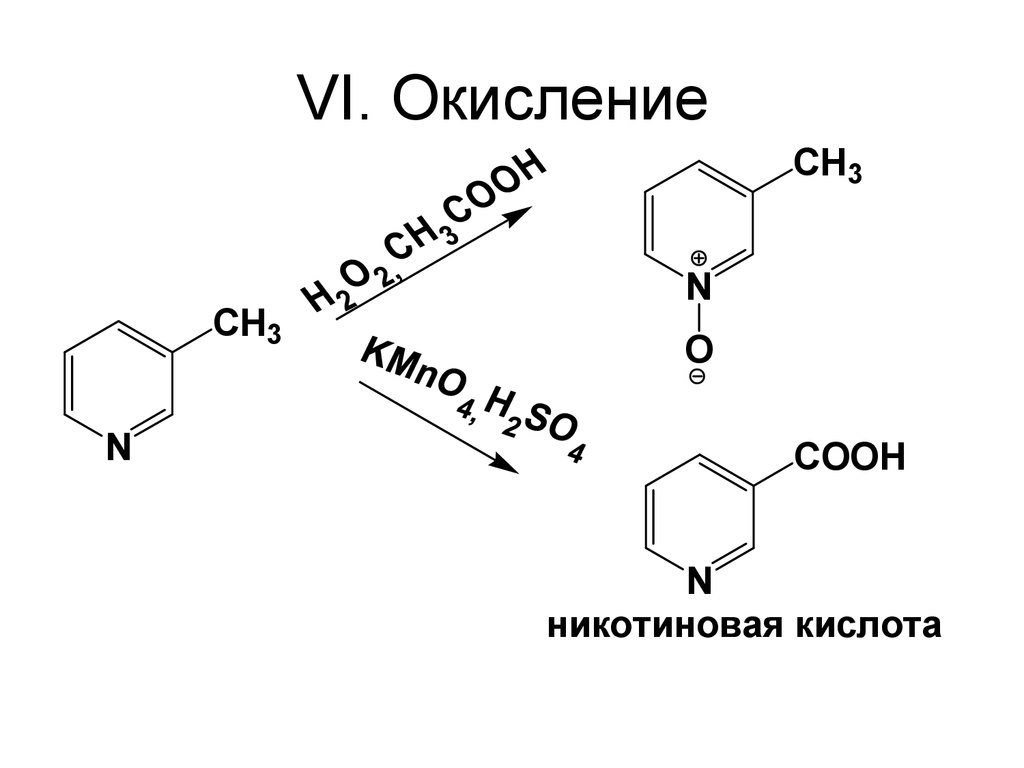
82. VI. Окисление
CH3CH3
N
N
O
COOH
N
никотиновая кислота
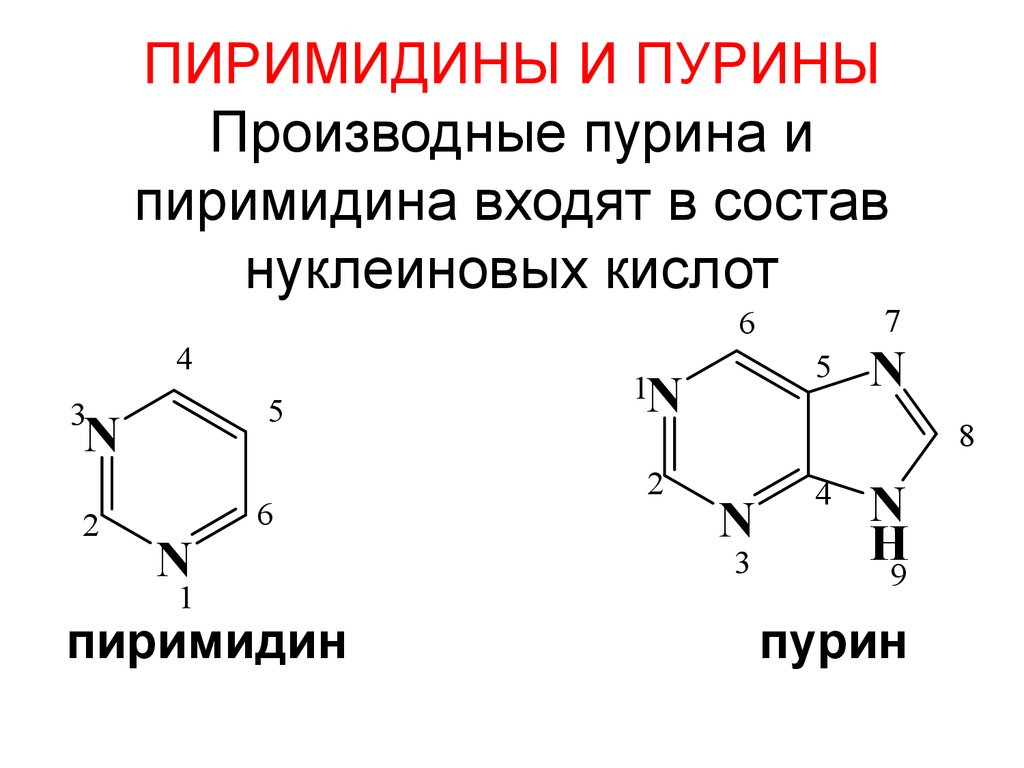
83. ПИРИМИДИНЫ И ПУРИНЫ Производные пурина и пиримидина входят в состав нуклеиновых кислот
45
3
N
2
N
1
7
6
6
пиримидин
5
1N
2
N
8
N
3
4
N
H
9
пурин
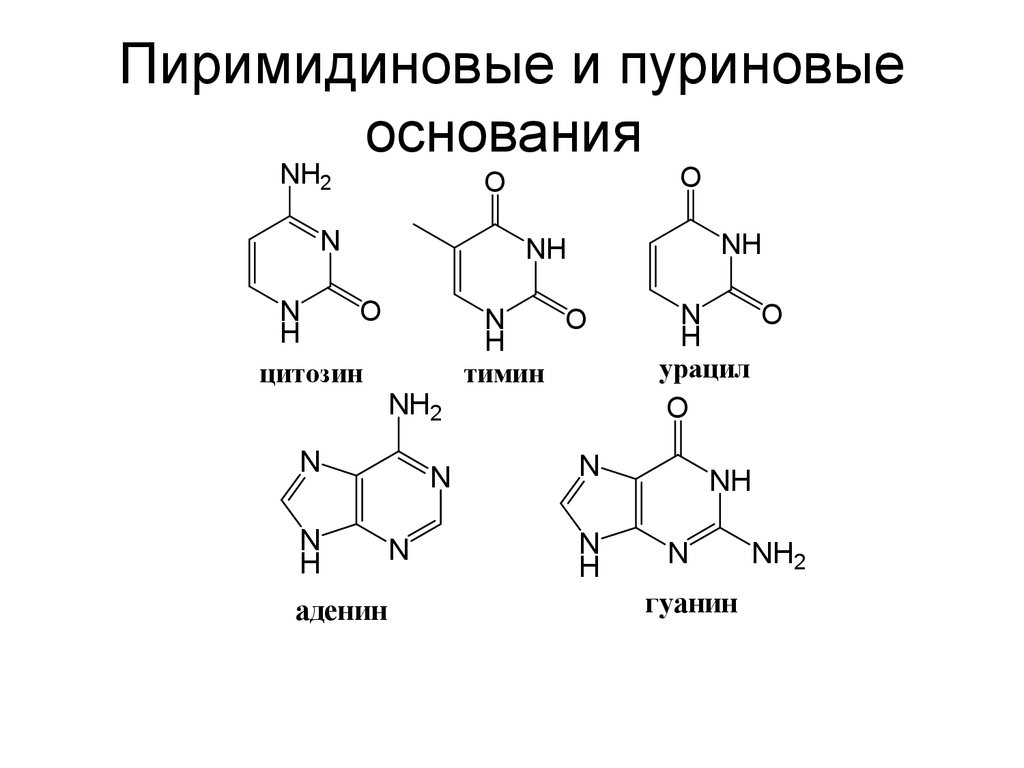
84. Пиримидиновые и пуриновые основания
NH2N
N
O
H
цитозин
аденин
NH
NH
NH2
N
N
H
O
O
N
N
N
O
H
тимин
N
O
H
урацил
O
N
N
H
NH
N
гуанин
NH2
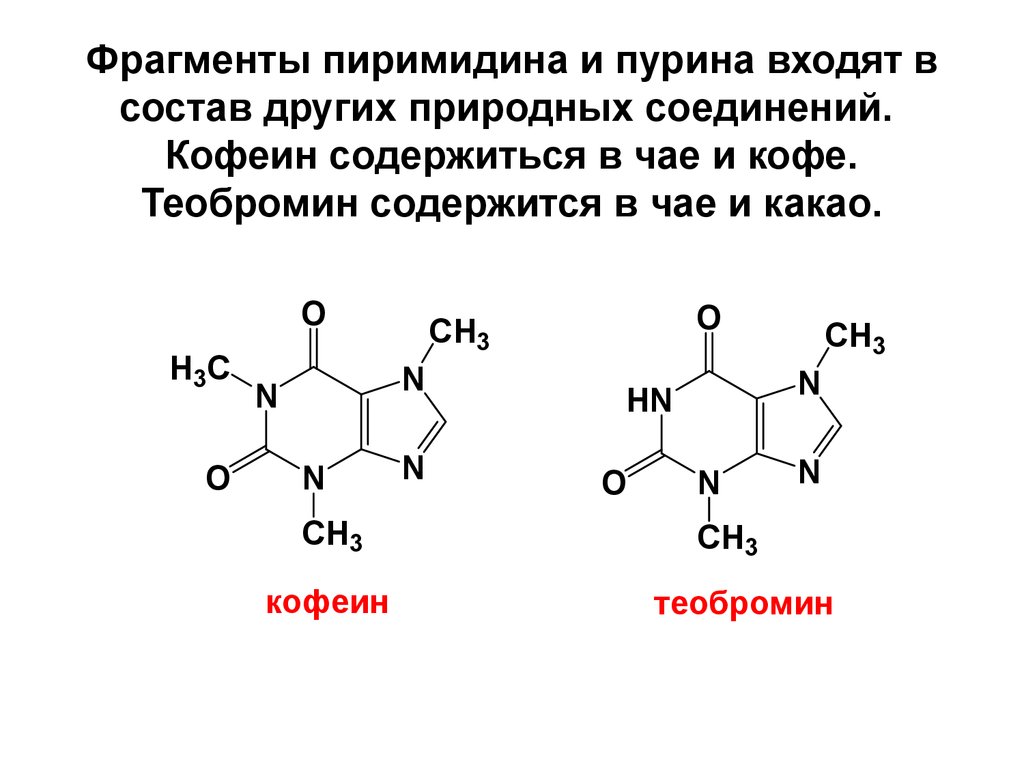
85. Фрагменты пиримидина и пурина входят в состав других природных соединений. Кофеин содержиться в чае и кофе. Теобромин содержится в чае и ка
Фрагменты пиримидина и пурина входят всостав других природных соединений.
Кофеин содержиться в чае и кофе.
Теобромин содержится в чае и какао.
O
H3C
O
N
N
N
CH3
кофеин
O
CH3
N
N
HN
O
CH3
N
N
CH3
теобромин
86.
OC
(C2H5)2N
N
CH3
N
N
CH3
никотин
N
H
диэтиламилд лизергиновой кислоты
87.
ROO
RO
H
H
N CH3























 Химия
Химия