Похожие презентации:
Общие представления о строении и реакционной способности органических соединений
1.
Лекция 1Общие представления о строении
и реакционной способности
органических соединений
Нуриев Вячеслав Назимович,
Химический факультет МГУ
nvn@org.chem.msu.ru
Физтех, 1 курс. Весна 2016
2. 2 семестр. Органическая химия
Всего – 15 лекцийВводный концентр - 2 лекции
Основные типы углеводородных скелетов - 2 лекции
Функциональные производные с простой связью
C-«Элемент» - 4 лекции
Функциональные производные с кратной связью
С=«Элемент» - 4 лекции
Полифункциональные, гетероциклические (в том числе
биологически важные соединения) - 3 лекции
Форма аттестации – экзамен
Физтех, 1 курс. Весна 2016
2
3. Литература
• В.Ф. Травень. "Органическая химия: учебник для вузов" в2 т., М: ИКЦ Академкнига, 2008.
• И.И. Грандберг. "Органическая химия", М.: Дрофа, 2001.
• В.В.Еремин, А.Я.Борщевский. "Общая и физическая
химия", М.: Интеллект, 2012. (Главы 8-11.)
• С. С. Карлов, В. Н. Нуриев, В. И. Теренин, Г.С. Зайцева.
"Задачи по общему курсу органической химии с
решениями для бакалавров", М.: Бином, 2015.
• Ю.С. Шабаров. "Органическая химия" в 2 т., М.:Химия,
1994.
• О.А. Реутов, А.Л. Курц, К.П. Бутин. "Органическая химия".
в 4 т., М.: Бином, 2007.
Физтех, 1 курс. Весна 2016
3
4. «ЛИНКАТУРА»
Dropbox® (для студентов)www.chem.msu.ru/rus/teaching/org.html
Физтех, 1 курс. Весна 2016
4
5. Возникновение «Органической химии»
1806 «Органическая химия – химия соединений углерода»(Берцелиус)
1853 «Органическая химия занимается изучением законов, по
которым превращаются вещества, составляющие организмы растений
и животных. Ее целью является познание способов получения
органических веществ вне живой природы» (Жерар)
1889 «…наука об углеводородах и их производных» (Шорлеммер)
1978 Это раздел химии, изучающий соединения углерода, их
структуру, свойства, методы синтеза. Органическими называют
соединения углерода с другими элементами. (БСЭ)
2012 Organic chemistry is a chemistry subdiscipline involving the
scientific study of the structure, properties, and reactions of organic
compounds and organic materials, i.e., matter in its various forms that
contain carbon atoms. (J. Clayden, N. Greeves & S. Warren "Organic
Chemistry" (Oxford University Press, 2012), pp. 1-15.)
Физтех, 1 курс. Весна 2016
5
6. Отличия «Органической химии»
Известно более 80 000 000 органических соединений –разнообразие связано с уникальной способностью углерода
образовывать прочные цепочки (-СС-) и кратные связи (С=А,
С≡А), при этом ежегодно число органических соединений
увеличивается на 300-400 тысяч.
Гигантский прогресс в развитии органической химии за
последнее столетие был обусловлен рядом причин. Главная из
них - практические потребности развития цивилизации.
Мы живем в органическом мире и сами являемся его
неотъемлемой частью. Каждая клетка живого организма
представляет собой сложнейший микроскопический реактор.
Следовательно, через эту науку мы познаем себя.
Физтех, 1 курс. Весна 2016
6
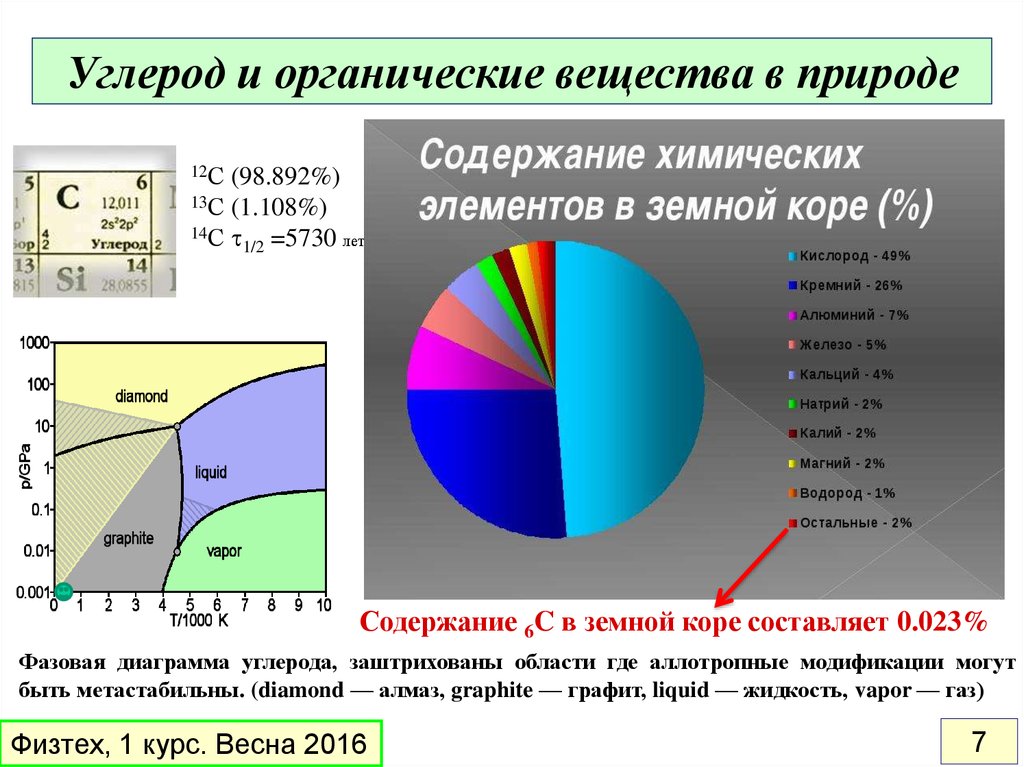
7. Углерод и органические вещества в природе
12С(98.892%)
13С (1.108%)
14С t
1/2 =5730 лет
Содержание 6C в земной коре составляет 0.023%
Фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут
быть метастабильны. (diamond — алмаз, graphite — графит, liquid — жидкость, vapor — газ)
Физтех, 1 курс. Весна 2016
7
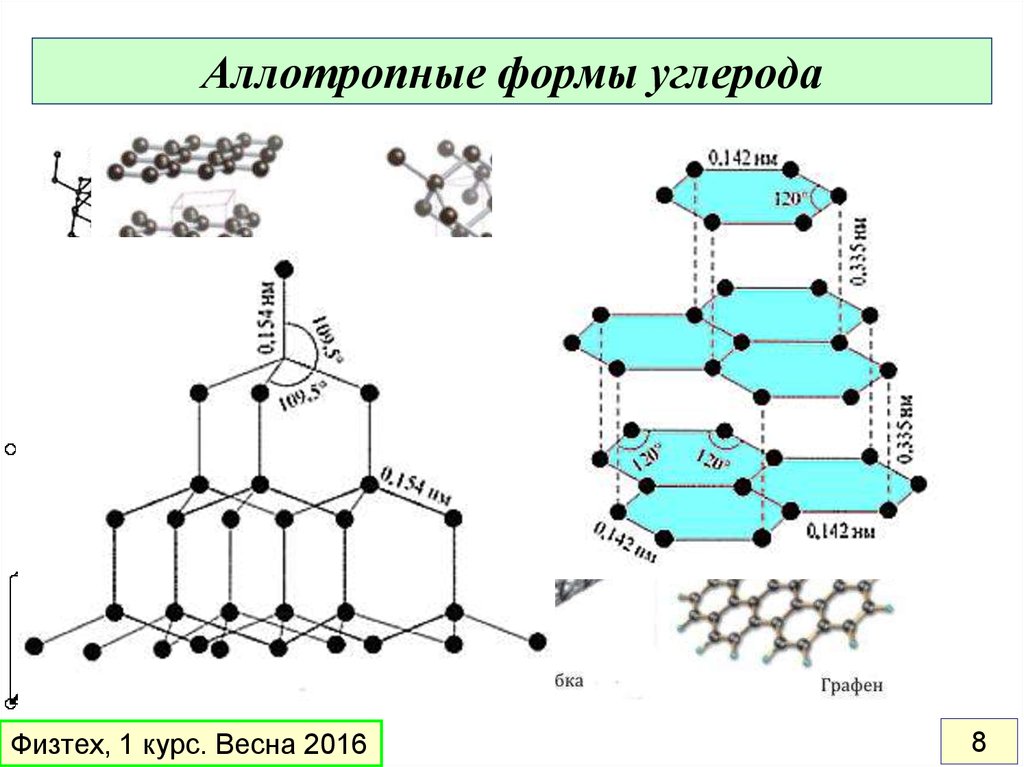
8. Аллотропные формы углерода
а - алмазb - графит
c - лонсдейлит
d – карбин
e – фуллерен C60
g - аморфный углерод
h –нанотрубка (SWCNT)
Физтех, 1 курс. Весна 2016
8
9. Этапы развития Органической химии
II-XVII век (н.э.): этап накопления и реализацииэмпирических знаний
XVIII-1828 г.: виталистическая теория - органические
вещества могут быть получены только в живых
организмах благодаря «жизненной силе»
1806-1861 переходный период (теория типов)
1861-1914: период становления и развития классической
структурной теории
1914-1985: период физической органической химии
1985-н.в.: эра супрамолекулярной химии
Физтех, 1 курс. Весна 2016
9
10. Становление классической структурной теории (КСТ)
К 1860 году открытия и работы, сделанные за полвека,Берцелиусом, Вёлером, Кольбе, Либихом, Бертло, Кольбе,
(Тенаром, Гей-Люссаком, Авогадро - улучшившими методы анализа
Лавуазье), Бунзеном, и наконец основоположниками теории типов
Дюма, Жераром, Франкландом, Купером и Кекуле. Позволили
полностью
опровергнуть
концепции
витализма,
найти
генетическую связь между классами соединений, заложить основы
базовых
превращений
органических
соединений.
Было
установлено, что валентность углерода = 4.
Важнейшим недостатком теории было то, что для описания
различных реакций одного и того же соединения необходимо
было использовать несколько различных формул, её невозможно
было использовать для описания реакций присоединения и
отщепления, а также структуры изомеров.
Физтех, 1 курс. Весна 2016
10
11.
«Всякое органическое соединениеимеет единственную химическую
формулу, отражающую порядок
связывания атомов в молекуле и
определяющую его свойства»
(А.М. Бутлеров, 1861-1864)
Физтех, 1 курс. Весна 2016
11
12.
«Заключения о химическом строении веществ,по всей вероятности, можно всего лучше будет
основывать на изучении способов их
синтетического образования — и
преимущественно — на таких синтезах,
которые совершаются при температуре мало
возвышенной и — вообще — при условиях, где
можно следить за ходом постепенного
усложнения химической частицы»
(А.М. Бутлеров, 1861-1864)
Физтех, 1 курс. Весна 2016
12
13.
«Если при одинаковом составе веществаотличаются свойствами, то они должны
также отличаться и своим химическим
строением»
«О различных способах объяснения некоторых
случаев изомерии»
(А.М. Бутлеров, 1863-1864)
Физтех, 1 курс. Весна 2016
13
14.
В 1848 г. Луи Пастер, кристаллизуя из водного растворанатриево-аммониевую соль виноградной кислоты, обнаружил,
что образуются кристаллы двух видов.
Свойства растворов кристаллов и полученных из них кислот
оказались совершенно идентичными. Исключение составила
только их оптическая активность - растворы обладали
противоположным
вращением
плоскости
поляризации
плоскополяризованного света. Пастер связывал оптическое
вращение с диссимметрией молекул.
Физтех, 1 курс. Весна 2016
14
15.
Идея специфичности строения таких соединений была развитаЯкобом Вант-Гоффом (1874-1875)
Постулат: «сродства (т. е. валентности) атомов
углерода изображаются направленными к вершинам
тетраэдра прямыми, в центре которого находится
сам этот атом».
Следствие: «когда четыре сродства атома углерода
насыщены четырьмя различными одновалентными
группами, можно получить два и только два различных
тетраэдра, относящихся друг к другу как предмет и
его зеркальное отражение»
Физтех, 1 курс. Весна 2016
15
16.
Постулаты КСТ:1.
2.
3.
4.
5.
6.
Физтех, 1 курс. Весна 2016
Любую молекулу можно представить как совокупность атомов различного
вида, соединенных друг с другом в определенном порядке. При этом
всякое органическое соединение имеет единственную химическую
формулу, отражающую этот порядок связывания атомов в молекуле.
Химические и физические свойства молекулы полностью определяются ее
строением.
Коллективное взаимодействие атомов в молекуле можно описать как
совокупность взаимодействий отдельных пар атомов.
Каждый атом обладает способностью образовывать лишь определенное
целое число химических связей, что определяется его валентностью. Оба
атома, образующих химическую связь, затрачивают на нее одинаковое и
целое число единиц своего сродства.
Химические связи могут быть простыми (ординарными) и кратными
(двойными, тройными).
Химические связи имеют определенную направленность в пространстве, а
поэтому каждая молекула имеет строго определенную геометрию.
7. Парные взаимодействия делятся на два типа: главные («сильные»)
взаимодействия или химические связи, и дополнительные («слабые»)
взаимодействия непосредственно не связанных атомов.
16
17.
Периодический закон1A
2A
3A
4A
5A
1
H
1s1
4
Be
1s2
2s2
(n+l)
n
l
Орбитали
1
1
0
1s 1-й период
2
2
0
2s
2
1
2p
3
0
3s
3
1
3p
4
0
4s
3
2
3d
4
1
4p
4
5
7A
8A
2
He
1s2
3
Li
1s2
2s1
3
6A
Относительная энергия
s- и p-орбиталей
5
6
7
8
9
10
B
C
N
O
F
Ne
1s2
1s2
1s2
1s2
1s2
1s2
2s22p1 2s22p2 2s22p3 2s22p4 2s22p5 2s22p6
2-й период
3-й период
4-й период
Физтех, 1 курс. Весна 2016
Энергетическая
последовательность
орбиталей в изолированных атомах
Правило Клечковского при заполнении оболочек
атома более
предпочтительны те
состояния, для которых
n+l, имеет меньшее
значение (при равенстве –
меньшее значение n).
Принцип запрета
Паули - два электрона
не могут находиться в
одном и том же
квантовом состоянии.
Правило Хунда суммарное значение
спинового квантового
числа электронов
данного подслоя должно
быть максимальным.
17
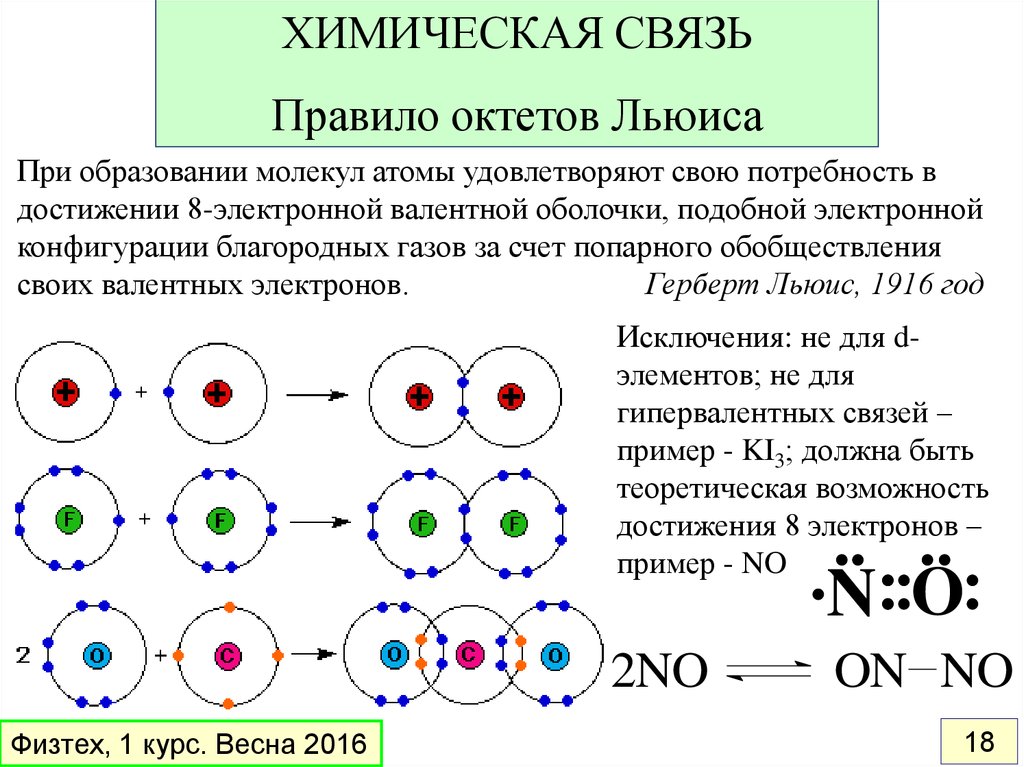
18.
ХИМИЧЕСКАЯ СВЯЗЬПравило октетов Льюиса
При образовании молекул атомы удовлетворяют свою потребность в
достижении 8-электронной валентной оболочки, подобной электронной
конфигурации благородных газов за счет попарного обобществления
своих валентных электронов.
Герберт Льюис, 1916 год
Исключения: не для dэлементов; не для
гипервалентных связей –
пример - KI3; должна быть
теоретическая возможность
достижения 8 электронов –
пример - NO
N O
2NO
Физтех, 1 курс. Весна 2016
ON NO
18
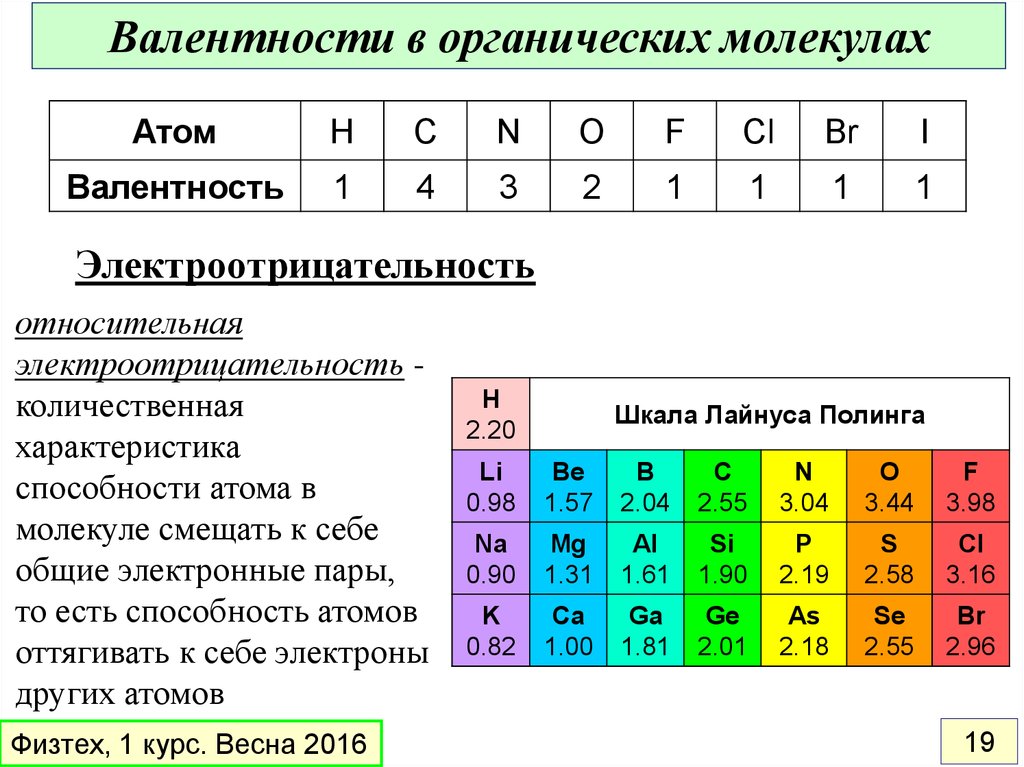
19.
Валентности в органических молекулахАтом
H
C
N
O
F
Cl
Br
I
Валентность
1
4
3
2
1
1
1
1
Электроотрицательность
относительная
электроотрицательность количественная
характеристика
способности атома в
молекуле смещать к себе
общие электронные пары,
то есть способность атомов
оттягивать к себе электроны
других атомов
Физтех, 1 курс. Весна 2016
H
2.20
Шкала Лайнуса Полинга
Li
0.98
Be
1.57
B
2.04
C
2.55
N
3.04
O
3.44
F
3.98
Na
0.90
Mg
1.31
Al
1.61
Si
1.90
P
2.19
S
2.58
Cl
3.16
K
0.82
Ca
1.00
Ga
1.81
Ge
2.01
As
2.18
Se
2.55
Br
2.96
19
20.
Типы химических связейВ органической химии чаще всего встречаются три типа
химической связи:
ковалентная неполярная:
ковалентная полярная:
H3C
ионная:
H
H
H3C
K
H3C
CH3
H
H3CO
H3C
F
Na
Применение значения электроотрицательности для
анализа свойств
H3C H
2.55
pKa
2.20
~56
Физтех, 1 курс. Весна 2016
HO H
3.44
2.20
15.74
F H
3.98
2.20
3.17
20
21.
Классические механизмы образованияхимической связи
H· + H· → H2
·CH3 + ·CH3 → CH3—CH3
рекомбинантный
:NH3 + □H+ → [H3N÷H] +
:NH3 + □BH3 → H3N÷BH3
донорно-акцепторный
в рамках теории молекулярных орбиталей
Электроны в молекуле принадлежат не атомам или связям, а всей
молекуле и они расположены на молекулярных орбиталях
разрыхляющая МО
разрыхляющая МО
H
H
H3N
BH3
связывающая МО
связывающая МО
H
H
Физтех, 1 курс. Весна 2016
H3N
BH3
21
22.
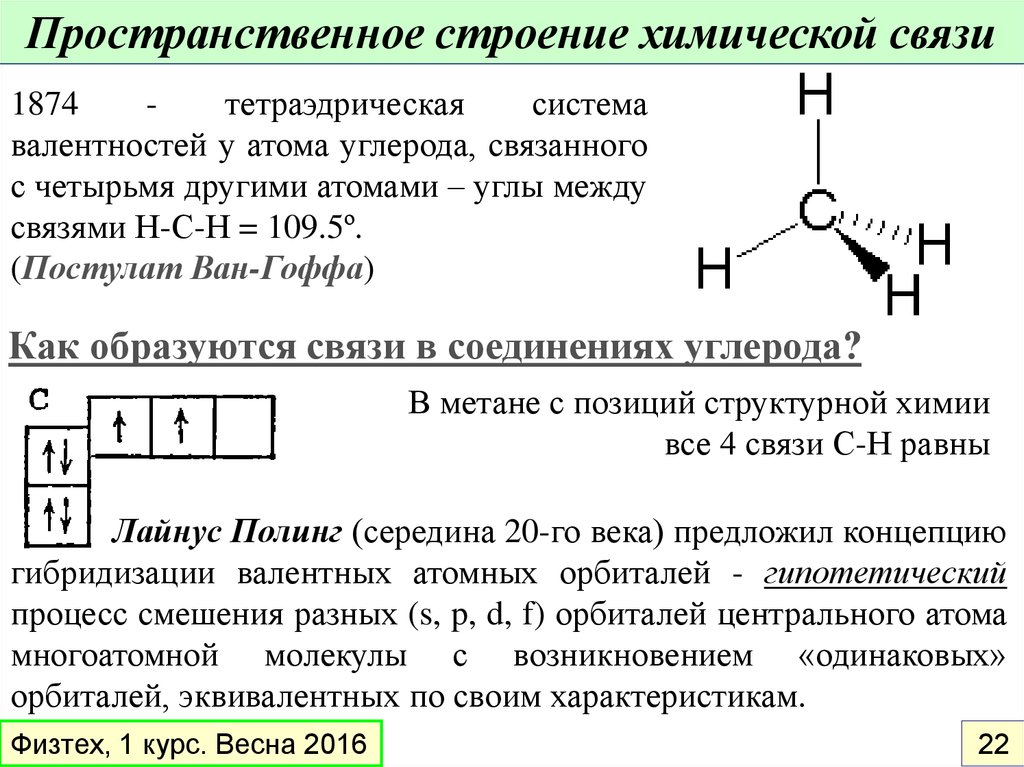
Пространственное строение химической связи1874
тетраэдрическая
система
валентностей у атома углерода, связанного
с четырьмя другими атомами – углы между
связями Н-С-Н = 109.5º.
(Постулат Ван-Гоффа)
Как образуются связи в соединениях углерода?
В метане с позиций структурной химии
все 4 связи С-Н равны
Лайнус Полинг (середина 20-го века) предложил концепцию
гибридизации валентных атомных орбиталей - гипотетический
процесс смешения разных (s, p, d, f) орбиталей центрального атома
многоатомной молекулы с возникновением «одинаковых»
орбиталей, эквивалентных по своим характеристикам.
Физтех, 1 курс. Весна 2016
22
23.
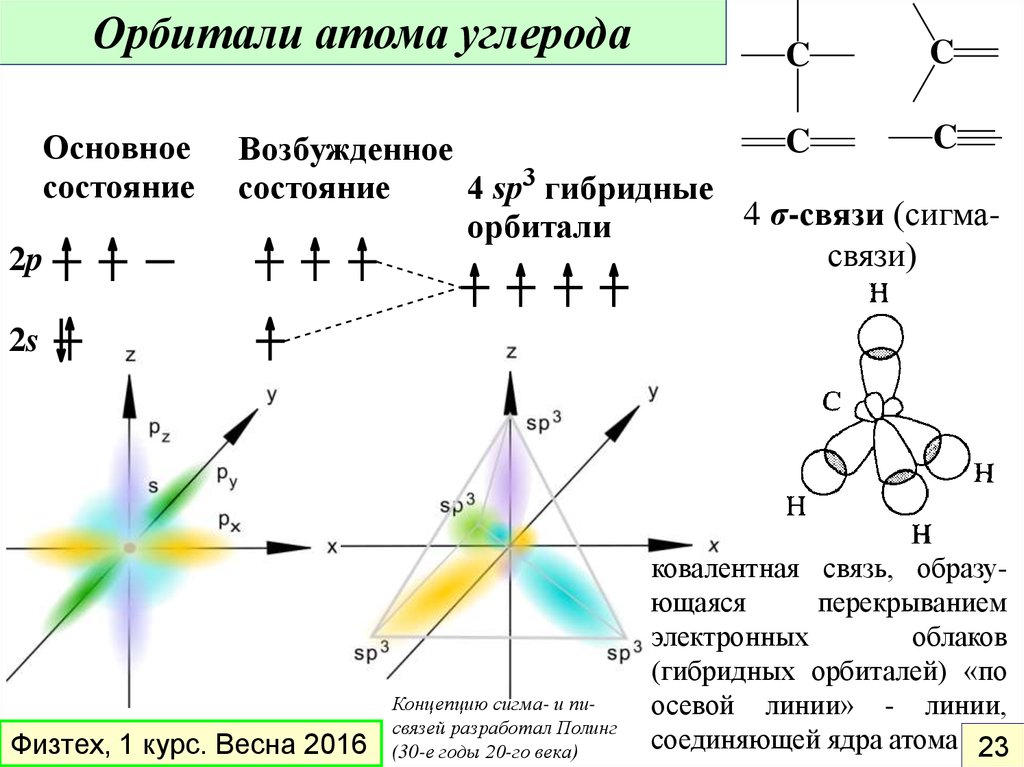
Орбитали атома углеродаОсновное
состояние
2p
C
C
C
C
Возбужденное
состояние
4 sp3 гибридные
4 σ-связи (сигмаорбитали
связи)
2s
Физтех, 1 курс. Весна 2016
Концепцию сигма- и писвязей разработал Полинг
(30-е годы 20-го века)
ковалентная связь, образующаяся
перекрыванием
электронных
облаков
(гибридных орбиталей) «по
осевой линии» - линии,
соединяющей ядра атома 23
24.
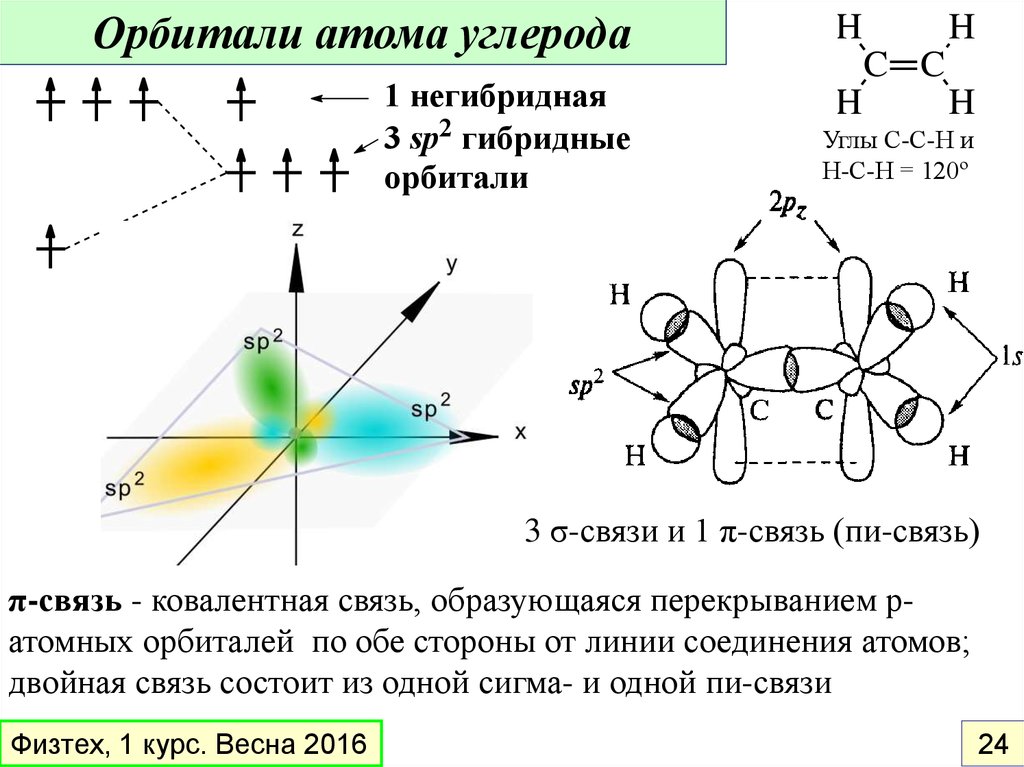
Орбитали атома углеродаH
1 негибридная
3 sp2 гибридные
орбитали
H
H
C C
H
Углы С-С-Н и
Н-С-Н = 120º
3 σ-связи и 1 π-связь (пи-связь)
π-связь - ковалентная связь, образующаяся перекрыванием pатомных орбиталей по обе стороны от линии соединения атомов;
двойная связь состоит из одной сигма- и одной пи-связи
Физтех, 1 курс. Весна 2016
24
25.
Орбитали атома углерода2 негибридные
2 sp гибридные
орбитали
H C C H
Углы С-С-Н = 180º
Лайнус Полинг – модель изогнутых
связей
этилен
Физтех, 1 курс. Весна 2016
25
26.
Орбитали атома углеродаСтроение циклопропана – напряженная структура
x
В ЦП нет максимального перекрывания двух sр -гибридных орбиталей C
о
(угол – 60 ), гибридные орбитали С не эквивалентны. Орбитали C-C связи
цикла имеют высокий р-характер (83%, s-характер = 17%). При
перекрывании таких орбиталей образуются "изогнутые" или "банановые"
связи (электронная плотность в стороне от кольца). Длина C-C связи в
циклопропане короче по сравнению с алканами. Гибридизацию орбиталей
5
C-C-связей в ЦП можно описать как sр . Орбитали связей С-Н имеют
2
более высокий s-характер и очень близки к sp -орбиталям.
Физтех, 1 курс. Весна 2016
26
27.
Параметры ковалентных связей ворганических соединениях
1.
Энергия связи - разность между энергией состояния, в котором
составляющие части системы бесконечно удалены друг от друга и энергией
связанного состояния системы – чем прочнее связь, тем сложнее ее разорвать,
тем менее она реакционноспособна.
2.
Длина связи - расстояние между ядрами химически связанных атомов важная характеристика: чем длиннее связь, тем проще атакующей частицы в
ходе реакции подойти к атому.
3.
Полярность связи - характеристика химической связи, показывающая
изменение распределения электронной плотности в пространстве вокруг ядер
в сравнении с распределением электронной плотности в образующих данную
связь нейтральных атомах.
Поляризуемость связи – способность приобретать дипольный момент
(поляризацию, смещение электронов вдоль связи) под действием внешнего
воздействия (например, в электромагнитном поле). дипольный момент векторная величина, характеризующая асимметрию распределения
положительных и отрицательных зарядов в электрически нейтральной
системе.
Физтех,
1 курс. Весна 2016
31
4.
28.
5. Насыщаемость связи - способность атомов образовывать ограниченное числоковалентных связей. Количество связей, образуемых атомом, ограничено числом
его внешних атомных орбиталей.
6. Кратность связи - определяется количеством электронных пар, участвующих
в связи между атомами.
Типы разрыва ковалентной σ-связи
при гетеролитическом разрыве образуются катион и анион; анион - атом, или
молекула, электрический заряд которой отрицателен, что обусловлено избытком
электронов по сравнению с количеством положительных элементарных зарядов;
катион, соответственно, характеризуется недостатком электронов.
при гомолитическом – два радикала; радикал - частица, содержащая один или
несколько неспаренных электронов на внешней электронной оболочке
Физтех, 1 курс. Весна 2016
32
29.
Энергия связи – это энергия, которая выделяется при образованиимолекулы из одиночных атомов или энергия, требующаяся для
гомолитического разрыва связи (с обратным знаком)
Значения энергий связи (в ккал/моль)
Сверху вниз по группе падает, т.к.
rатома увеличивается (падает Е кул.
взаимодействия между ядром и
электроном)
Физтех, 1 курс. Весна 2016
Гомолитический
разрыв
связи
обычно для газовой фазы более
выгоден чем гетеролитический,
так не требуется дополнительная
энергия
на
преодоление
электростатического притяжения
образовавшихся ионов, в растворе
же
ионы
стабилизируются
молекулами растворителя
Определение энергии
π-С-С связи
33
30.
Длина связи(в нанометрах, пикометрах или Ангстремах: 1Å = 0.1 нм = 100 pm)
Полярность химических связей
Нδ+ — Clδ− или Oδ−=C2δ+=Oδ−, где δ — некоторая доля элементарного заряда
Для HCl установлено, что на каждом из атомов в этой молекуле имеется
эффективный заряд, равный 0.17 заряда целого электрона: на Н +0.17, на Cl
−0.17. Эффективный заряд - определяется как разность между зарядом
электронов, находящимся в некоторой области пространства вблизи ядра, и
зарядом ядра. Условная и приблизительная величина, т.к. невозможно однозначно
выделить в молекуле область, относящуюся исключительно к отдельному атому.
HF – заряд на водороде 0.40+
CO2 – заряд на кислороде 0.11−
Физтех, 1 курс. Весна 2016
HCl – заряд на водороде 0.17+
SiO2 – заряд на кислороде 0.23−
34
31.
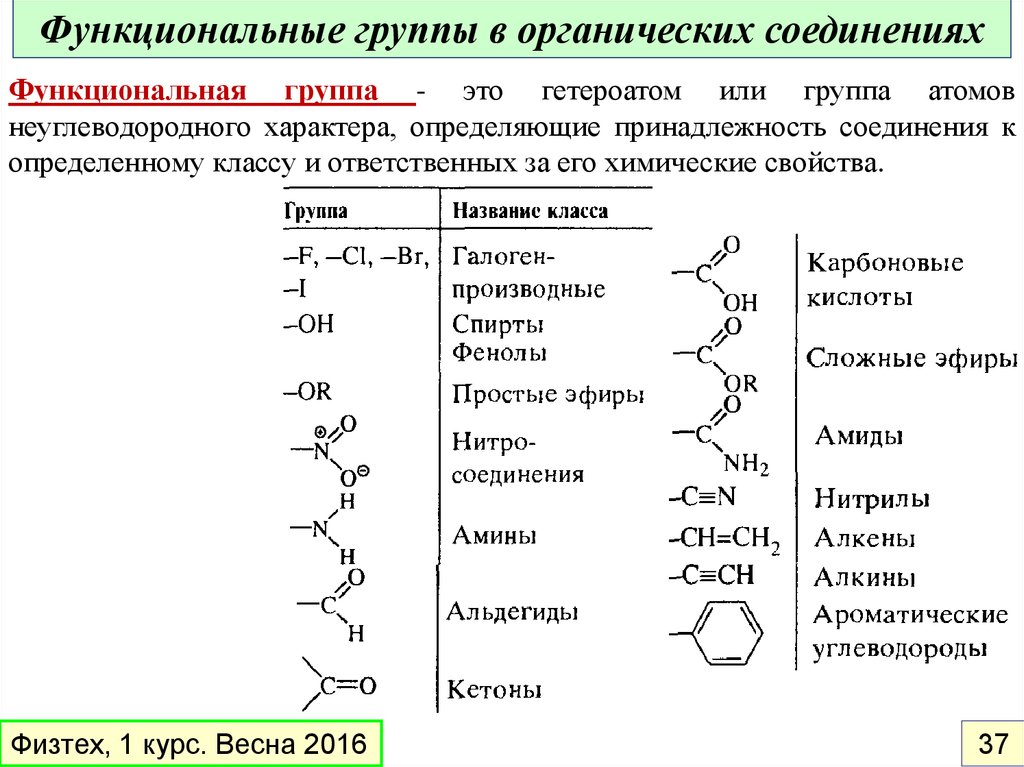
Функциональные группы в органических соединенияхФункциональная группа - это гетероатом или группа атомов
неуглеводородного характера, определяющие принадлежность соединения к
определенному классу и ответственных за его химические свойства.
Физтех, 1 курс. Весна 2016
37
32.
Систематическая номенклатуцра IUPAC ихсоединений названий
Правила составления
1) выбрать родоначальную структуру;
2) выявить все имеющиеся в соединении функциональные группы;
3) установить, какая группа является старшей (табл.); название этой
группы отражается в названии соединения в виде суффикса и его
ставят в конце названия соединения; все остальные группы дают в
названии в виде префиксов (приставок);
4) обозначить ненасыщенность соответствующим суффиксом (-ен
или -ин), а также префиксом (дегидро-, тeтpaгидpo- и др.);
5) пронумеровать главную цепь, придавая старшей группе
наименьший из номеров;
6) перечислить префиксы (приставки) в алфавитном порядке (при
этом умножающие префиксы ди-, три- и т. д. не учитываются);
7) составить полное название соединения.
родоначальпая структура - главная цепь в ациклической молекуле;
циклическая или гетероциклическая система (или ее часть), лежащая в
Физтех, 1 курс. Весна 2016 основе соединения.
42
33.
Называя соединение, сначала перечисляют заместители в алфавитном порядке(числительные не принимают во внимание), причем перед названием радикала ставят
цифру, соответствующую номеру углеродного атома главной цепи, при котором
находится данный радикал. После этого называют углеводород, соответствующий
главной цепи углеродных атомов, отделяя слово от цифр дефисом.
Если соединение содержит несколько одинаковых радикалов, то число их обозначают
греческим числительным (ди, три, тетра...) и ставят перед названием этих радикалов.
Физтех, 1 курс. Весна 2016
45
34.
ИзомерияИзомерия - явление, заключающееся в существовании химических
соединений - изомеров, - одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению
атомов в пространстве и, вследствие этого, по свойствам.
Виды изомеров
Структурные изомеры – вещества, имеющие одинаковую
молекулярную, но разную структурную формулу
Пространственные изомеры – вещества, имеющие одинаковую
молекулярную, структурную формулы, но различающиеся
расположением атомов в пространстве
Структурные
изомеры
Физтех, 1 курс. Весна 2016
46
35.
Структурные изомерыИзомеры положения, различающиеся положением одинаковых
функциональных групп или кратных связей при одинаковом
углеродном скелете.
O
Cl O
Cl
OH
OH
4-хлорбутановая кислота 3-хлорбутановая кислота
Таутомери́я - явление обратимой изомерии, при которой 2 или более
изомера переходят друг в друга: при этом устанавливается таутомерное
равновесие, и вещество одновременно содержит молекулы всех изомеров
(таутомеров) в определённом соотношении
Физтех, 1 курс. Весна 2016
47
36.
Пространственные изомеры: энантиомеры и диастереомерыПространственная изомерия (стереоизомерия) возникает в результате
различий в пространственной конфигурации молекул, имеющих
одинаковое химическое строение.
Три атома в плоскости слайда
за плоскостью
Энантиомеры (оптические изомеры, зеркальные
изомеры) - вещества, характеризующиеся
противоположными по знаку и одинаковыми по
величине вращениями плоскости поляризации
света при идентичности всех других физических
перед плоскостью
и
химических
свойств.
Необходимая
и
достаточная причина возникновения оптических
антиподов - отсутствие элементов симметрии в
молекуле. Например, наличие асимметрического
атоме углерода, то есть атома, связанного с
четырьмя разными заместителями.
Физтех, 1 курс. Весна 2016
48
37.
Диастереомеры - пространственные изомеры, не являющиесяэнантиомерами.
σ-диастереомеры: отличаются друг от друга конфигурацией части
имеющихся в них элементов хиральности (асимметрических
центров)
π-диастереомеры (геометрические изомеры) отличаются друг от
друга различным пространственным расположением заместителей
относительно плоскости двойной связи (например, С=С) или цикла
малеиновая кислота
Физтех, 1 курс. Весна 2016
фумаровая кислота
49
38.
ХиральностьХиральность - отсутствие симметрии относительно правой и левой
стороны
Объект, не совместимый со своим
зеркальным отображением,
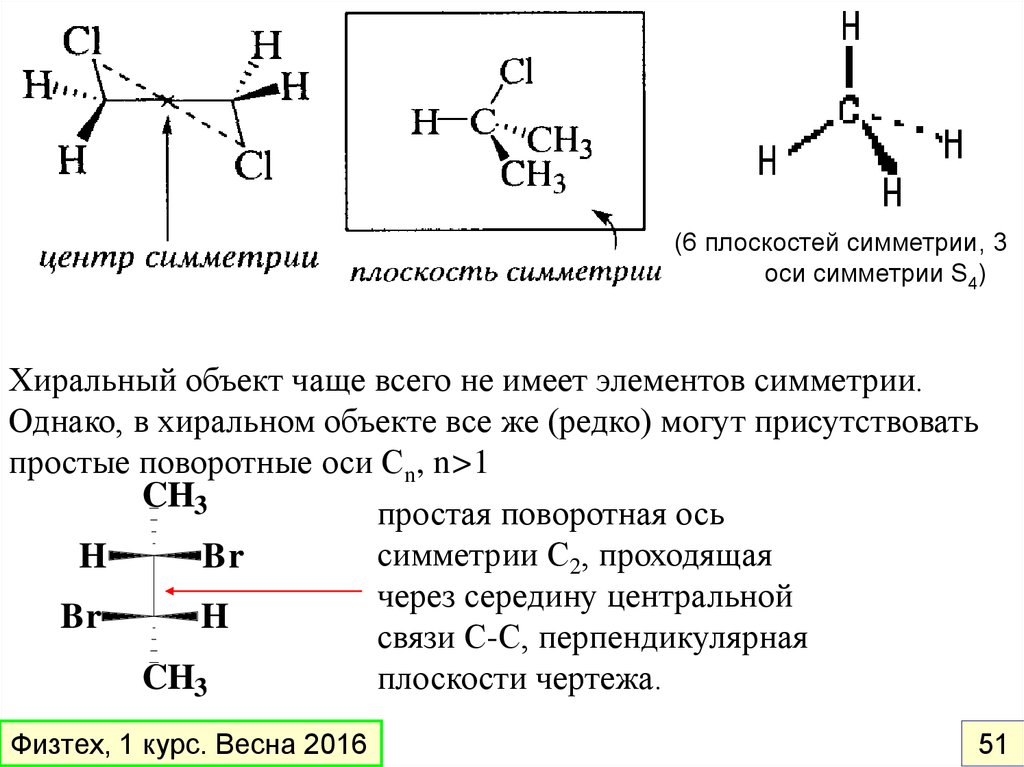
называется ХИРАЛЬНЫМ.
Универсальный признак хиральности
–
отсутствие элементов симметрии в молекуле
Элементы симметрии, исключающие хиральность:
плоскость симметрии (σ )
центр симметрии (L)
зеркально-поворотные оси высших порядков (Sn, n>2)
Физтех, 1 курс. Весна 2016
50
39.
(6 плоскостей симметрии, 3оси симметрии S4)
Хиральный объект чаще всего не имеет элементов симметрии.
Однако, в хиральном объекте все же (редко) могут присутствовать
простые поворотные оси Сn, n>1
CH3
простая поворотная ось
симметрии С2, проходящая
H
Br
через середину центральной
Br
H
связи С-С, перпендикулярная
плоскости чертежа.
CH3
Физтех, 1 курс. Весна 2016
51
40.
Молекулы с одним хиральным центромэнантиомеры
4 разных
заместителя
у атома
углерода
Энантиомеры различаются знаком угла вращения плоскости
плоскополяризованного света
Рацемат – равномолекулярная смесь двух энантиомеров –
угол вращения плоскости = 0о
Физтех, 1 курс. Весна 2016
52
41.
Как определить строение конкретного энантиомера - в 1951 году былразработан специальный вариант рентгеноструктурного анализа, который
позволяет однозначно установить пространственное расположение атомов в
молекуле данного энантиомера. Конфигурация молекулы, определенная таким
путем, называется абсолютной конфигурацией.
Способы изображения энантиомеров
Клиновидные проекции
глицериновые альдегиды
Проекции Фишера
Физтех, 1 курс. Весна 2016
53
42.
R/S-номенклатураКан, Ингольд, Прелог – наименование абсолютной конфигурации
1. определяем порядок старшинства заместителей при
асимметрическом атоме; старшинство атома данного
элемента задается его порядковым номером в
Br > CI> F> Н
Периодической таблице. Чем больше порядковый
номер элемента, тем старше атом.
2. Располагаем молекулу таким образом, чтобы
самый младший заместитель был удален от
наблюдателя (при этом он будет заслонен атомом
углерода) и рассматриваем молекулу вдоль оси
связи углерода с младшим заместителем.
3. Определяем, в каком направлении ПАДАЕТ
старшинство заместителей, находящихся в нашем поле
зрения. Если падение старшинства происходит по
часовой стрелке, обозначаем буквой R. Если
старшинство падает против часовой стрелки, то
конфигурацию обозначаем буквой S.
Физтех, 1 курс. Весна 2016
56
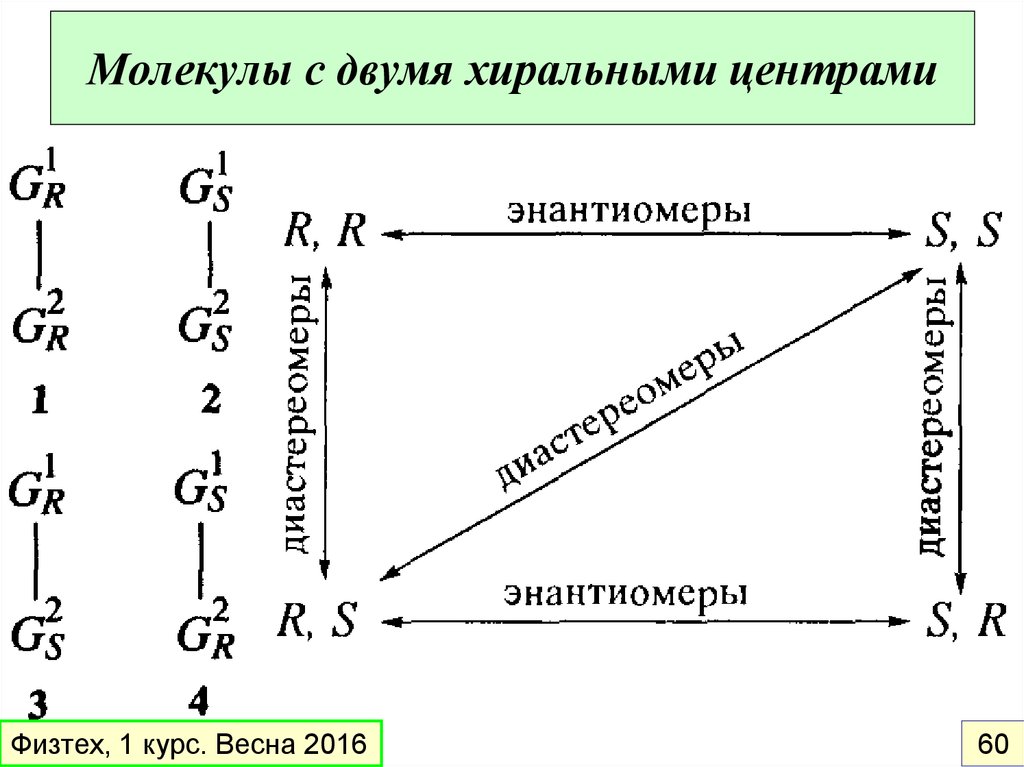
43.
Молекулы с двумя хиральными центрамиФизтех, 1 курс. Весна 2016
60
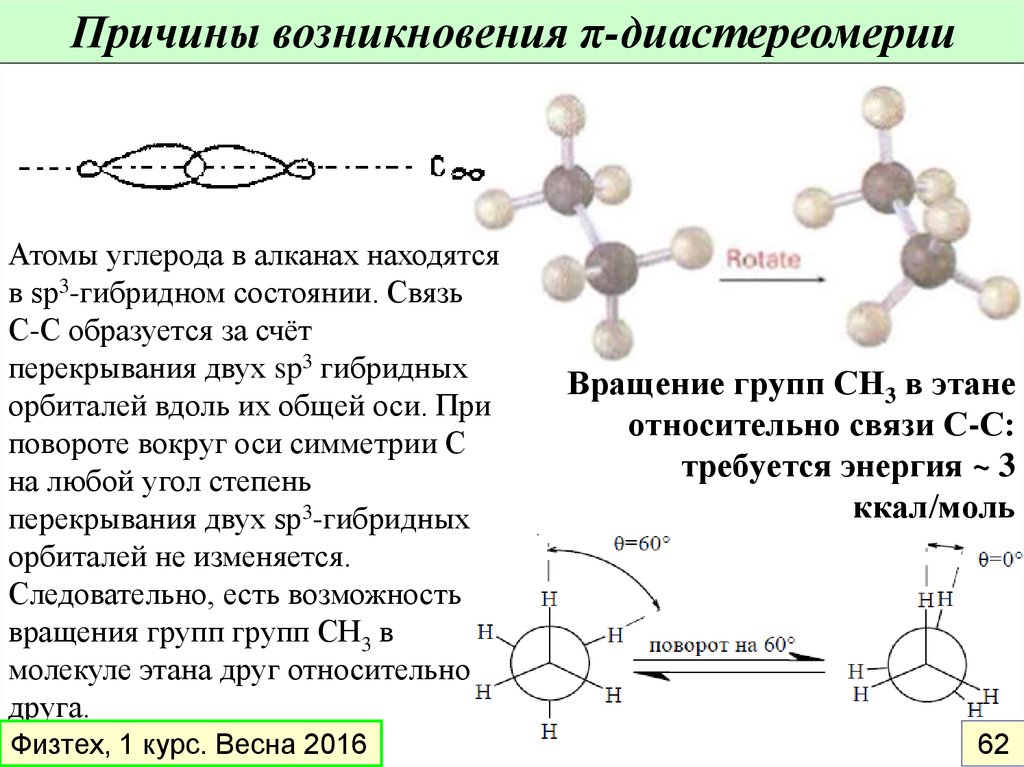
44.
Причины возникновения π-диастереомерииАтомы углерода в алканах находятся
в sp3-гибридном состоянии. Связь
С-С образуется за счёт
перекрывания двух sp3 гибридных
орбиталей вдоль их общей оси. При
повороте вокруг оси симметрии С
на любой угол степень
перекрывания двух sp3-гибридных
орбиталей не изменяется.
Следовательно, есть возможность
вращения групп групп СН3 в
молекуле этана друг относительно
друга.
Физтех, 1 курс. Весна 2016
Вращение групп СН3 в этане
относительно связи С-С:
требуется энергия ~ 3
ккал/моль
62
45.
КонформерыКонформациями называются различные геометрические
(пространственные) формы, которые молекула может принимать в
результате вращения вокруг простых (одинарных) связей и других
внутримолекулярных движений, проходящих без разрыва
химических связей.
Стереоизомеры в конформациях, соответствующих минимумам
потенциальной энергии, называют конформерами (поворотными
изомерами)
Физтех, 1 курс. Весна 2016
63
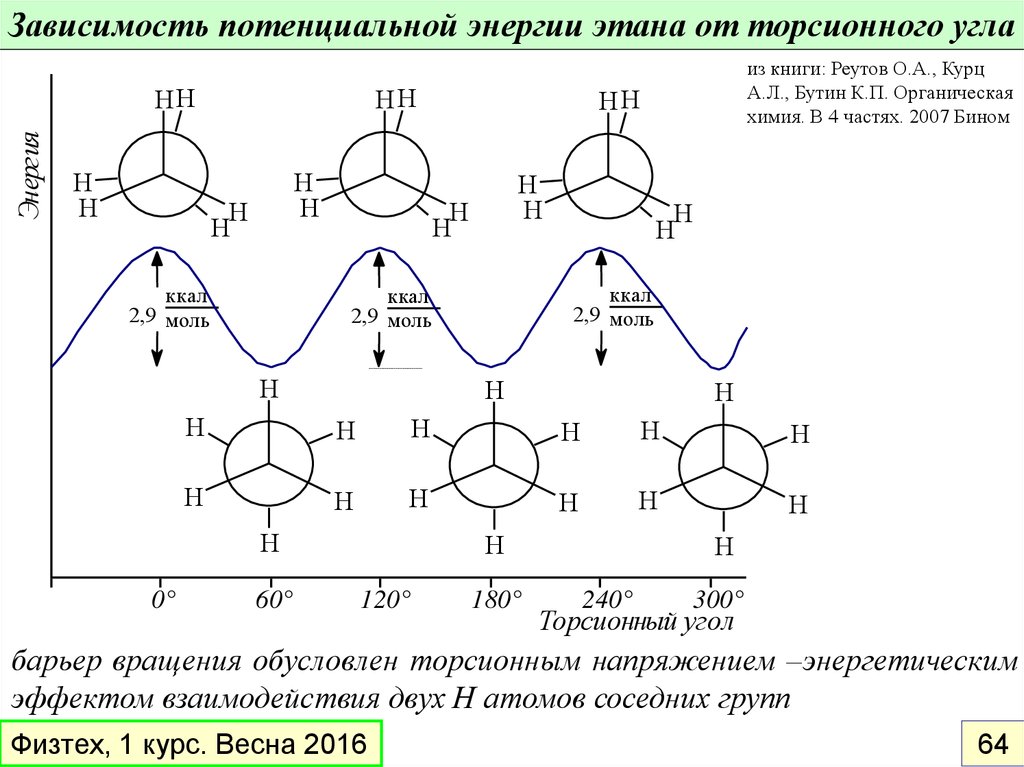
46. Виды изомеров
Зависимость потенциальной энергии этана от торсионного углаЭнергия
HH
H
H
HH
H
H
H
H
ккал
2,9 моль
-60
0
H
H
H
H
ккал
2,9 моль
ккал
2,9 моль
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
0°
HH
H
H
H
из книги: Реутов О.А., Курц
А.Л., Бутин К.П. Органическая
химия. В 4 частях. 2007 Бином
60°
60
H
120°
120
180°
H
240°
300°
180 Торсионный
240
угол
300
барьер вращения обусловлен торсионным напряжением –энергетическим
эффектом взаимодействия двух Н атомов соседних групп
Физтех, 1 курс. Весна 2016
64
47.
Электронные эффекты в органическихсоединениях
Электронные эффекты – это смещение электронной плотности в молекуле или
другой частице под действием заместителей по сравнению с незамещенной
молекулой
Индуктивный эффект - смещение электронной
плотности химической связи по σ-связям,
Пример
обусловленный различиями в электро
отрицательностях атомов
H
CH3
(т.е. существованием полярных
H C H
связей): +I-эффект в случае
H C
CH3
H I эффект = 0
повышения заместителем
CH3
электронной плотности;
+I эффект
–I-эффект в случае понижения заместителем
CF3
электронной плотности (относительно F
"+"
H C F
H C
CF3
незамещённого соединения), т. е.
нулевой индуктивный эффект
F
-I эффект
CF3
принимается для атома водорода.
-I эффект
Физтех, 1 курс. Весна 2016
68
48.
Индуктивный эффектЗаместитель при атоме углерода делает полярной связь C-заместитель
и вызывает поляризацию нескольких соседних связей, то есть заряд на
атомах углерода «индуцируется». Эффект (из-за слабой способности
связей С-С к поляризации) быстро затухает по цепи атомов
+I-эффект
-I-эффект
Физтех, 1 курс. Весна 2016
69
49.
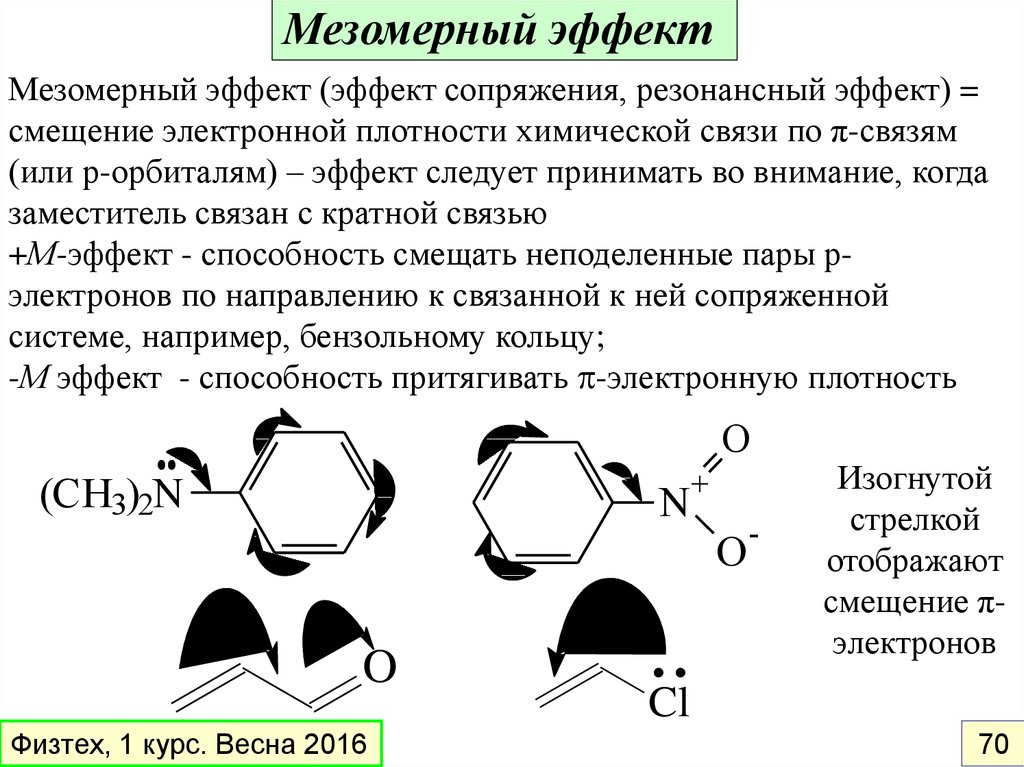
Мезомерный эффектМезомерный эффект (эффект сопряжения, резонансный эффект) =
смещение электронной плотности химической связи по π-связям
(или р-орбиталям) – эффект следует принимать во внимание, когда
заместитель связан с кратной связью
+М-эффект - способность смещать неподеленные пары рэлектронов по направлению к связанной к ней сопряженной
системе, например, бензольному кольцу;
-М эффект - способность притягивать -электронную плотность
O
(CH3)2N
N
+
O
O
Физтех, 1 курс. Весна 2016
..Cl
-
Изогнутой
стрелкой
отображают
смещение πэлектронов
70
50. Хиральность
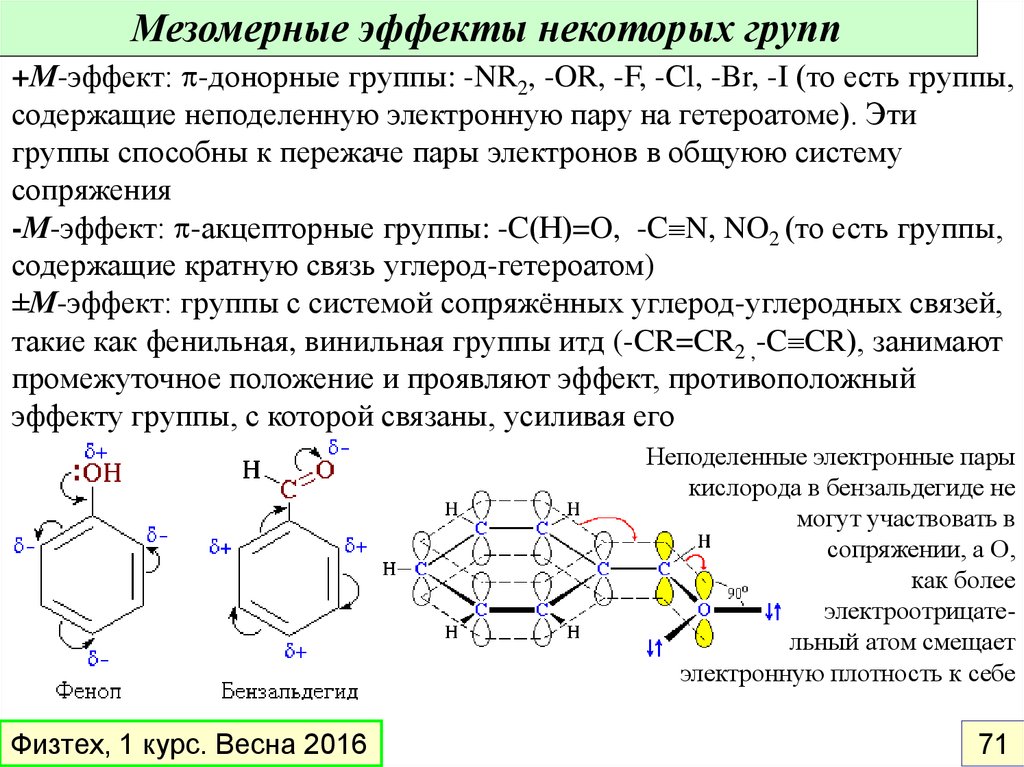
Мезомерные эффекты некоторых групп+М-эффект: -донорные группы: -NR2, -OR, -F, -Cl, -Br, -I (то есть группы,
содержащие неподеленную электронную пару на гетероатоме). Эти
группы способны к пережаче пары электронов в общуюю систему
сопряжения
-М-эффект: -акцепторные группы: -C(Н)=O, -C N, NO2 (то есть группы,
содержащие кратную связь углерод-гетероатом)
±М-эффект: группы с системой сопряжённых углерод-углеродных связей,
такие как фенильная, винильная группы итд (-CR=CR2 ,-C CR), занимают
промежуточное положение и проявляют эффект, противоположный
эффекту группы, с которой связаны, усиливая его
Неподеленные электронные пары
кислорода в бензальдегиде не
могут участвовать в
сопряжении, а О,
как более
электроотрицательный атом смещает
электронную плотность к себе
Физтех, 1 курс. Весна 2016
71
51.
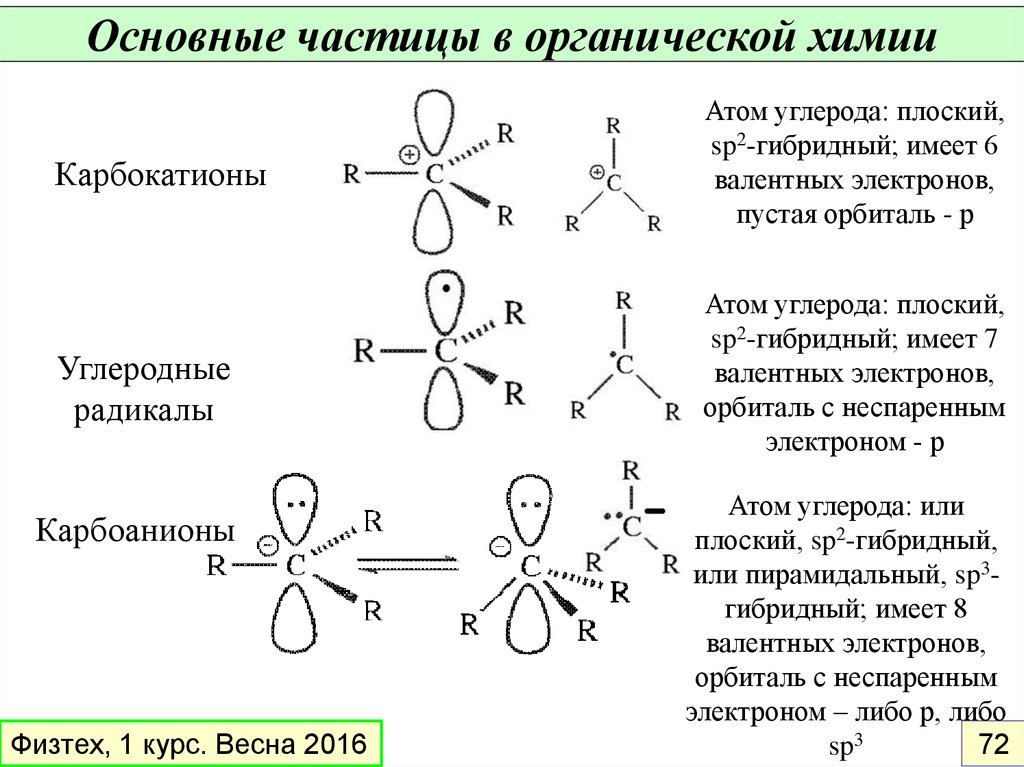
Основные частицы в органической химииКарбокатионы
Углеродные
радикалы
Карбоанионы
Физтех, 1 курс. Весна 2016
Атом углерода: плоский,
sp2-гибридный; имеет 6
валентных электронов,
пустая орбиталь - р
Атом углерода: плоский,
sp2-гибридный; имеет 7
валентных электронов,
орбиталь с неспаренным
электроном - р
Атом углерода: или
плоский, sp2-гибридный,
или пирамидальный, sp3гибридный; имеет 8
валентных электронов,
орбиталь с неспаренным
электроном – либо р, либо
72
sp3
52. Молекулы с одним хиральным центром
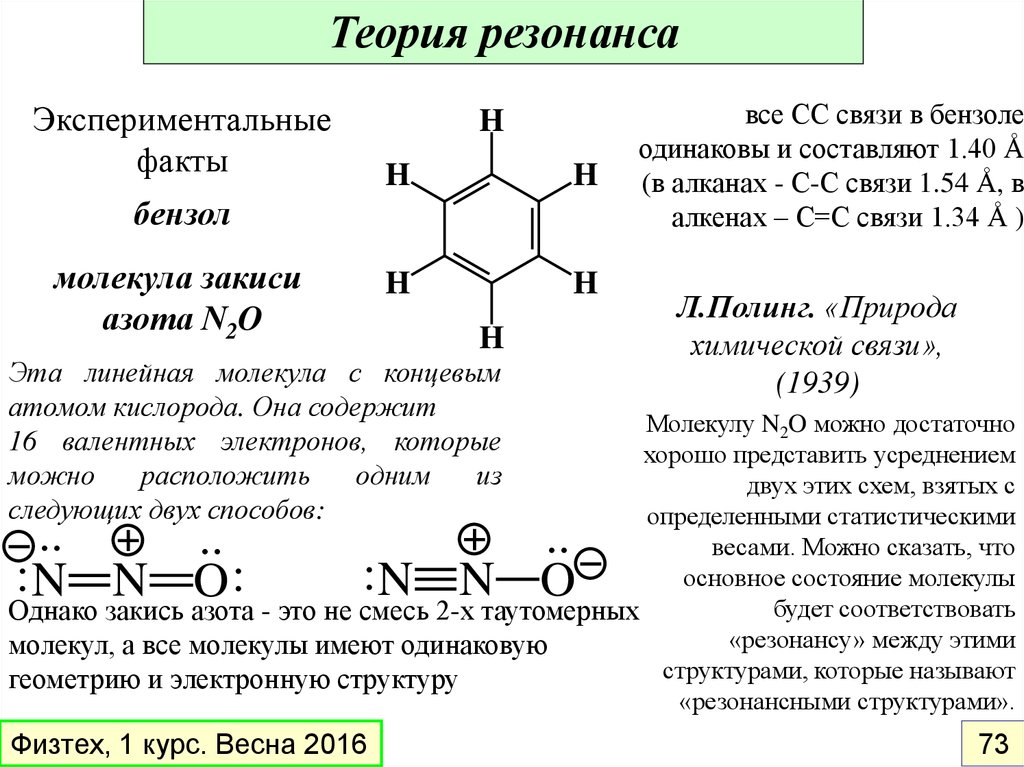
Теория резонансаЭкспериментальные
факты
H
H
H
H
H
бензол
молекула закиси
азота N2O
H
Эта линейная молекула с концевым
атомом кислорода. Она содержит
16 валентных электронов, которые
можно
расположить
одним
из
следующих двух способов:
все СС связи в бензоле
одинаковы и составляют 1.40 Å
(в алканах - С-С связи 1.54 Å, в
алкенах – С=С связи 1.34 Å )
Л.Полинг. «Природа
химической связи»,
(1939)
Молекулу N2O можно достаточно
хорошо представить усреднением
двух этих схем, взятых с
определенными статистическими
весами. Можно сказать, что
основное состояние молекулы
будет соответствовать
Однако закись азота - это не смесь 2-х таутомерных
«резонансу» между этими
молекул, а все молекулы имеют одинаковую
структурами, которые называют
геометрию и электронную структуру
«резонансными структурами».
..
..
:N N O:
..
:N N O
Физтех, 1 курс. Весна 2016
73
53. Способы изображения энантиомеров
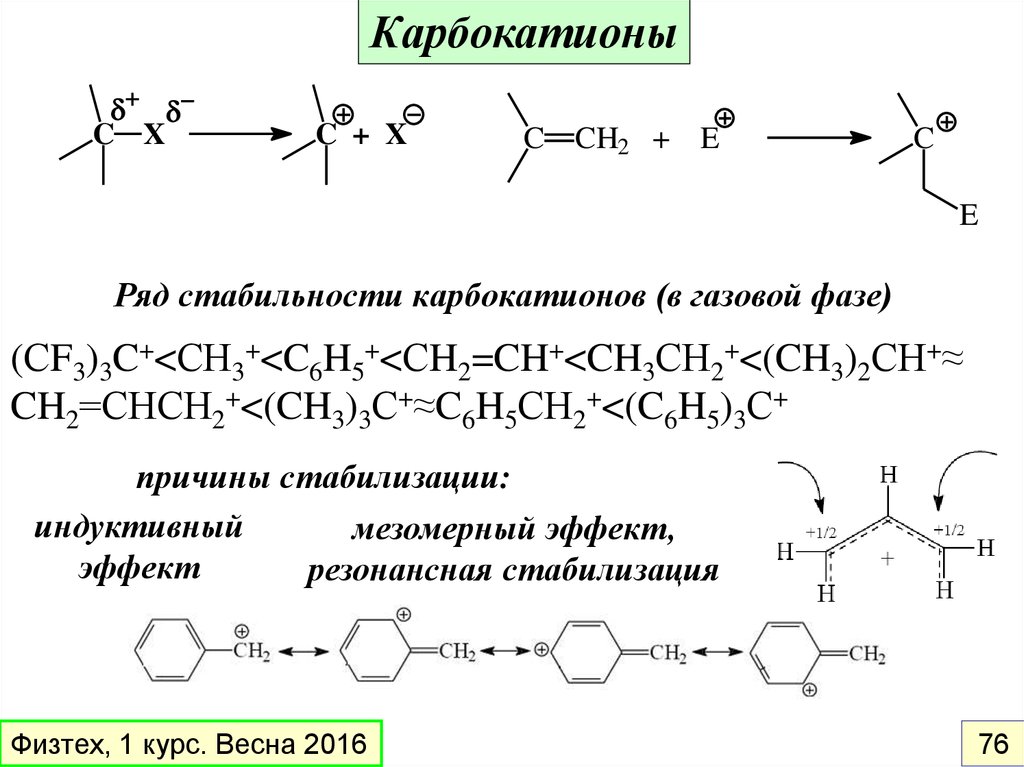
КарбокатионыC X
C + X
C CH2 + E
C
E
Ряд стабильности карбокатионов (в газовой фазе)
(СF3)3C+<СН3+<C6H5+<СH2=CH+<CH3СН2+<(CH3)2СН+≈
CH2=СНСН2+<(CH3)3С+≈C6H5СН2+<(C6H5)3С+
причины стабилизации:
индуктивный
мезомерный эффект,
эффект
резонансная стабилизация
Физтех, 1 курс. Весна 2016
76
54.
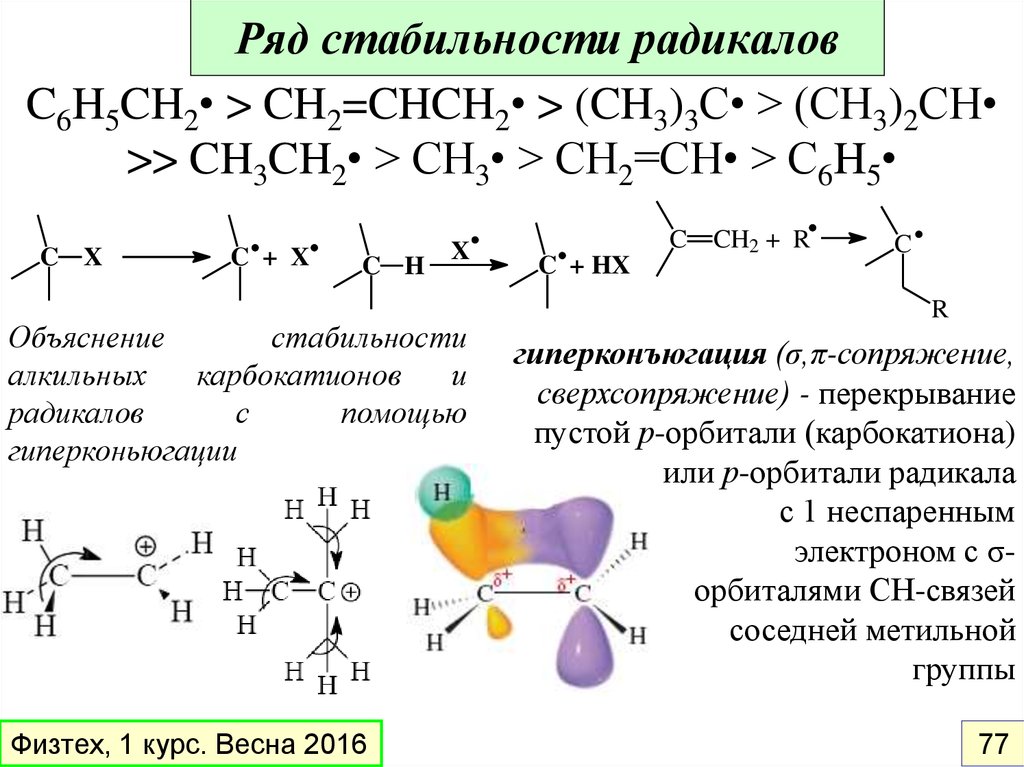
Ряд стабильности радикаловC6H5CH2• > CH2=CHCH2• > (CH3)3C• > (CH3)2CH
>> CH3CH2• > CH3• > CH2=CH• > C6H5
C X
C + X
C H
X
Объяснение
стабильности
алкильных
карбокатионов
и
радикалов
с
помощью
гиперконьюгации
Физтех, 1 курс. Весна 2016
C + HX
C CH2 + R
C
R
гиперконъюгация (σ,π-сопряжение,
сверхсопряжение) - перекрывание
пустой р-орбитали (карбокатиона)
или р-орбитали радикала
с 1 неспаренным
электроном с σорбиталями СН-связей
соседней метильной
группы
77
55.
КарбоанионыC M
C + M
Ряд стабильности карбоанионов
(CH3)3С < (CH3)2СН < CH3СН2 < СН3 < СH2=CH <
C6Н5 < CH2=СНСН2 < C6H5СН2
Причины стабилизации
для бензильного и аллильного – сопряжение неподеленной пары аниона с πсистемой кратных связей; для метильного – отсутствие положительного
индуктивного эффекта алкильных заместителей; для винильного - большая
электроотрицательность sp2-гибридного по сравнению с sp3-гибридным
атомом.
Физтех, 1 курс. Весна 2016
78
56. R/S-номенклатура
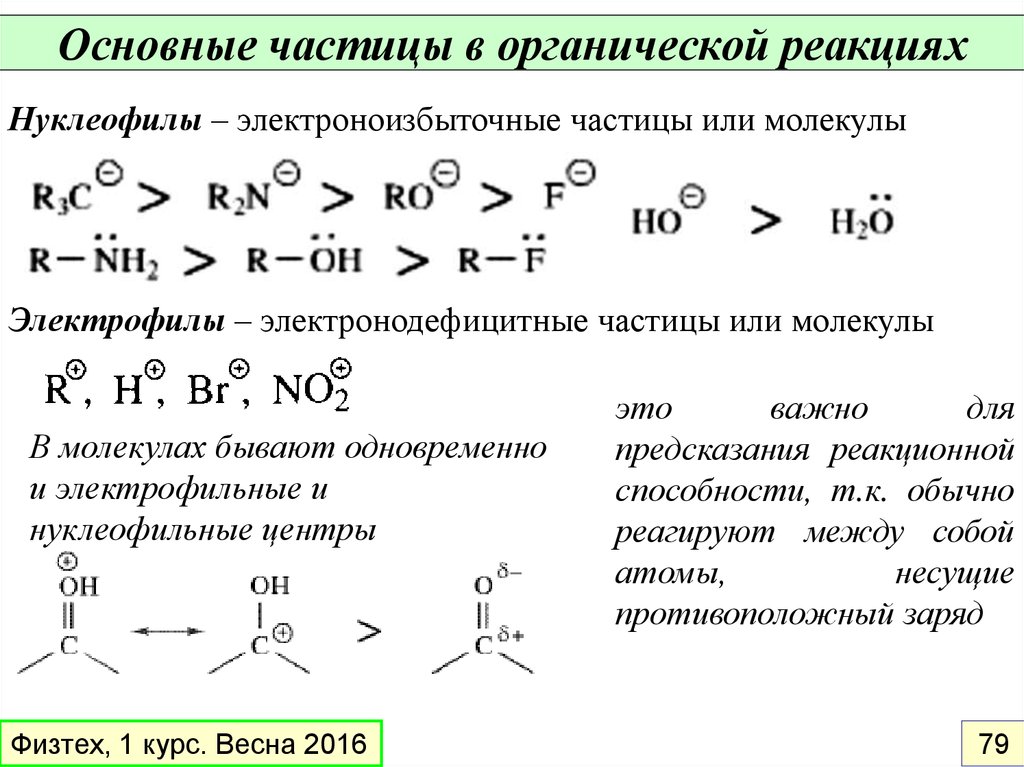
Основные частицы в органической реакцияхНуклеофилы – электроноизбыточные частицы или молекулы
Электрофилы – электронодефицитные частицы или молекулы
В молекулах бывают одновременно
и электрофильные и
нуклеофильные центры
Физтех, 1 курс. Весна 2016
это
важно
для
предсказания реакционной
способности, т.к. обычно
реагируют между собой
атомы,
несущие
противоположный заряд
79
57.
Органические реакцииХимическая реакция - превращение одних веществ в другие,
отличные от исходных по химическому составу и (или) строению.
В неорганических реакциях участвуют ионы, они проходят быстро и до конца
при комнатной температуре. В органических реакциях часто происходят
разрывы ковалентных связей с образованием новых. Как правило, эти процессы
требуют особых условий: определённой температуры, времени реакции, и часто
наличия катализатора. Обычно протекает не одна, а сразу несколько реакций.
Реакции могут протекать и в несколько стадий, не обязательно так, как
реакция условно изображена на схеме. В качестве промежуточных соединений
возникать короткоживущие интермедиаты. Подробное описание всех
превращений, происходящих на молекулярном уровне во время реакции,
называется механизмом реакции.
Субстрат (Реактант,
Исходные вещества)
Физтех, 1 курс. Весна 2016
Реагенты
Условия реакции
Продукты
80
58.
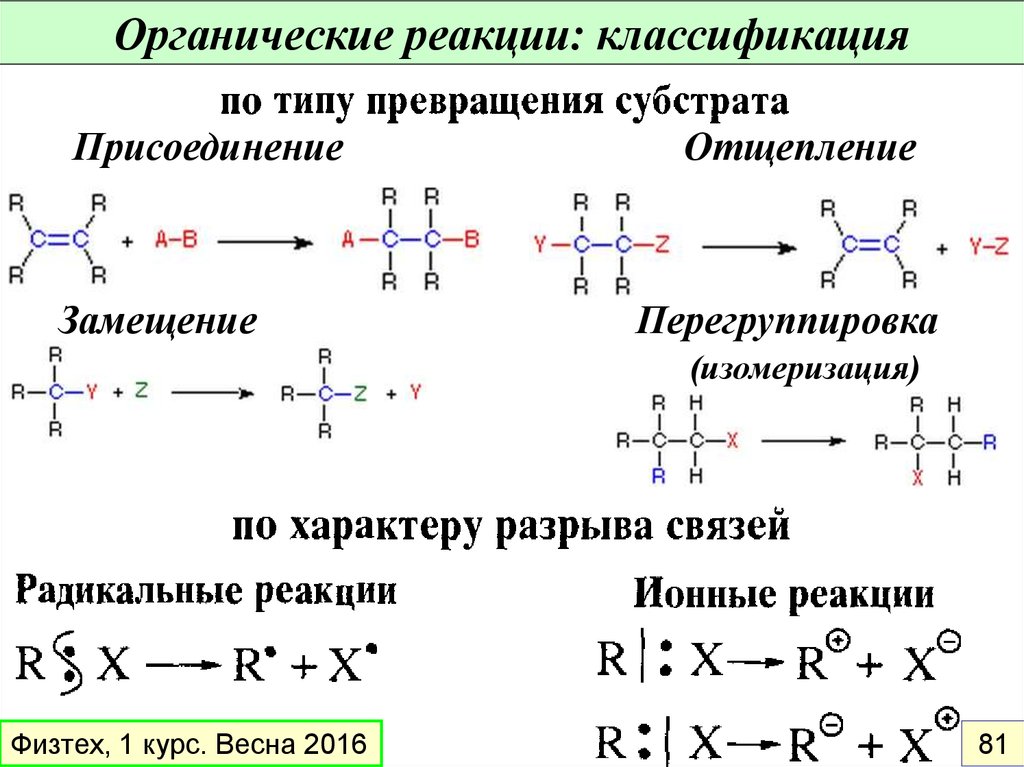
Органические реакции: классификацияПрисоединение
Замещение
Отщепление
Перегруппировка
(изомеризация)
Физтех, 1 курс. Весна 2016
81
59. D/L-номенклатура
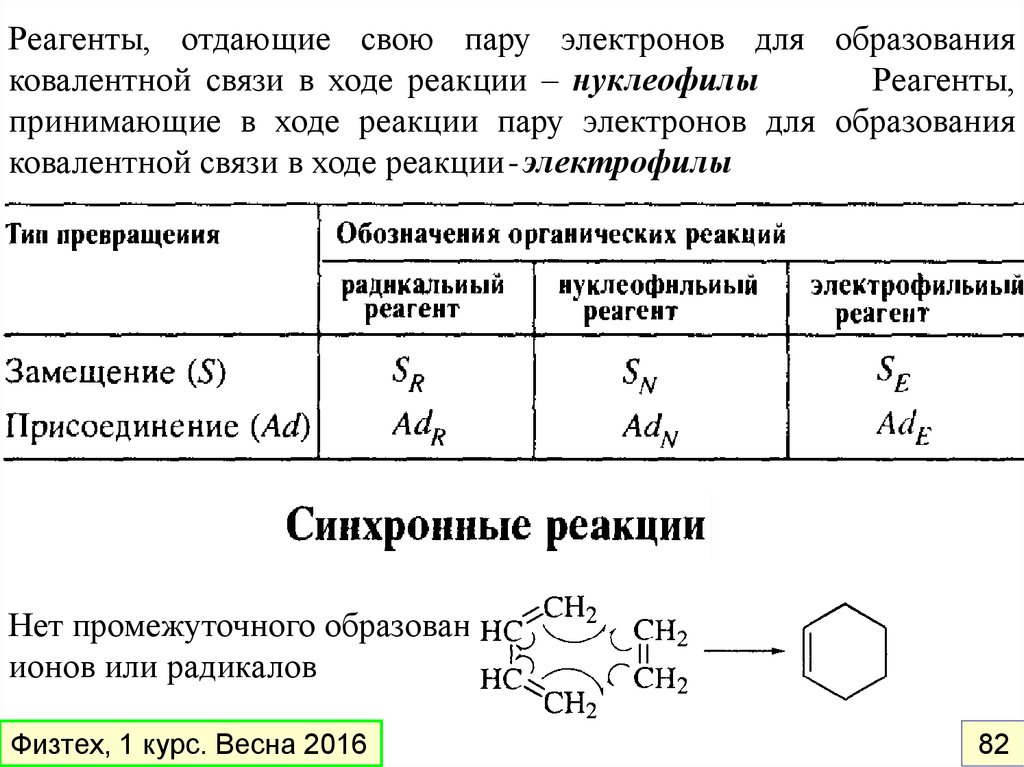
Реагенты, отдающие свою пару электронов для образованияковалентной связи в ходе реакции – нуклеофилы
Реагенты,
принимающие в ходе реакции пару электронов для образования
ковалентной связи в ходе реакции - электрофилы
Нет промежуточного образования
ионов или радикалов
Физтех, 1 курс. Весна 2016
82
60. Молекулы с двумя хиральными центрами
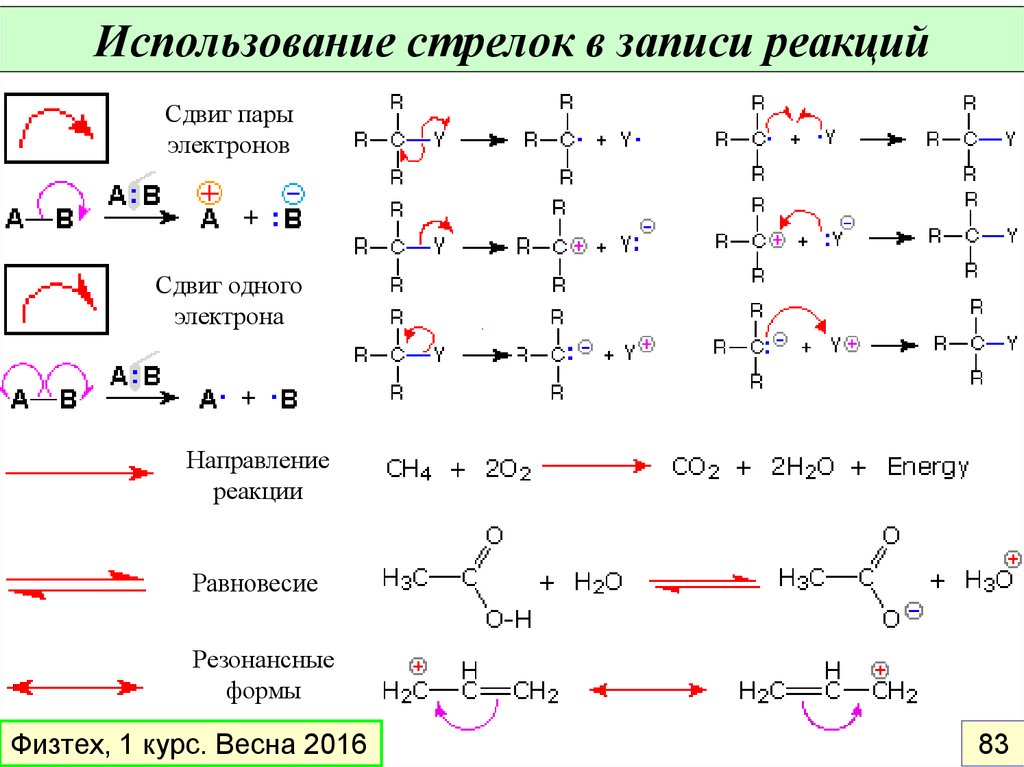
Использование стрелок в записи реакцийСдвиг пары
электронов
Сдвиг одного
электрона
Направление
реакции
Равновесие
Резонансные
формы
Физтех, 1 курс. Весна 2016
83
61. Оптические изомеры соединений с двумя одинаковыми центрами
Основные классы органических соединенийФункциональная группа - структурный фрагмент органической
молекулы (некоторая группа атомов), определяющий её химические
свойства и являющийся критерием ее (молекулы) отнесения к тому
или иному классу органических соединений.
Функциональные группы, входящие в состав различных молекул,
обычно ведут себя одинаково в одной и той же химической реакции,
хотя их химическая активность может быть различной.
Алканы
С-С
Алкены
С=С
Диены
2хС=С
Алкины
С≡С
Галогенпроизводные
С-Hal
Спирты
C-OH
Физтех, 1 курс. Весна 2016
Эфиры
Альдегиды
Кетоны
Карбоновые
кислоты
Сложные
Эфиры
Амиды
C-O-C
C(=O)H
C(=O)-C
C(=O)OH
C(=O)OC
C(=O)N 86
62. Вращение групп СН3 в этане относительно связи С-С: требуется энергия ~ 3 ккал/моль
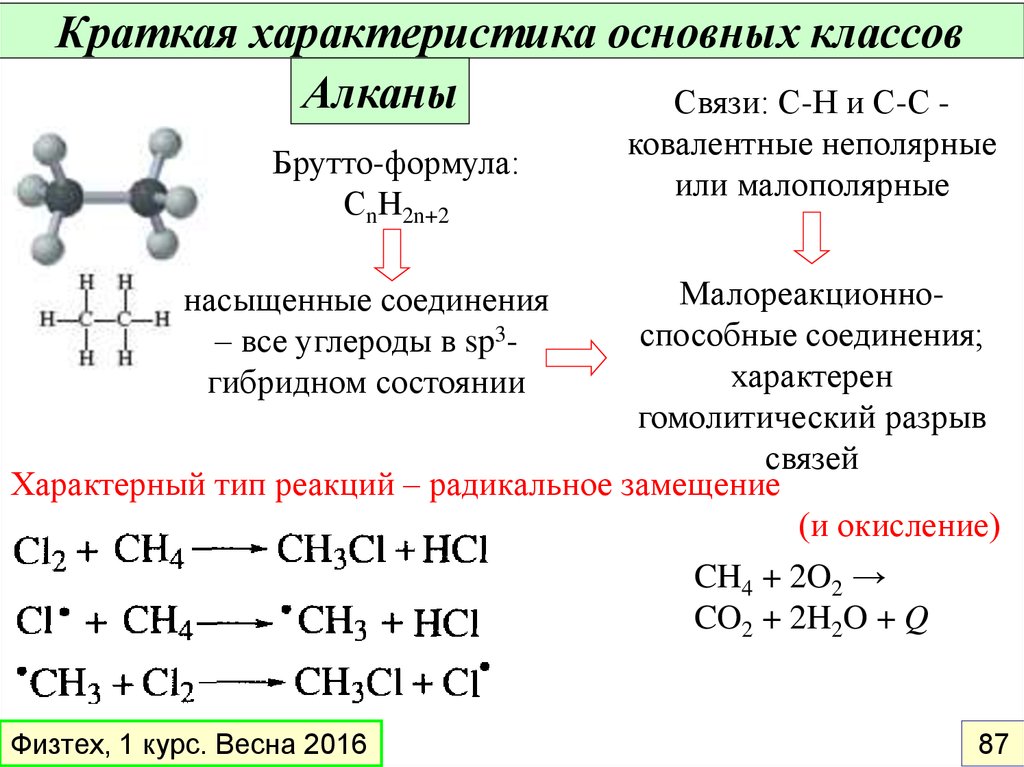
Краткая характеристика основных классовАлканы
Связи: С-Н и С-С Брутто-формула:
СnH2n+2
ковалентные неполярные
или малополярные
Малореакционноспособные соединения;
характерен
гомолитический разрыв
связей
Характерный тип реакций – радикальное замещение
(и окисление)
CH4 + 2O2 →
CO2 + 2H2O + Q
насыщенные соединения
– все углероды в sp3гибридном состоянии
Физтех, 1 курс. Весна 2016
87
63.
Кислоты иоснования в
органической химии
Физтех, 1 курс. Весна 2016
Теория Бренстеда
93
64.
Кислоты и основания Льюиса• Кислота – частица, способная принимать электрон на
вакантную орбиталь
• Основание – частица, способная донировать
электронную пару
Физтех, 1 курс. Весна 2016
94
65. Конформации бутана
Коротко о главном1. Органическая Химия (ОХ) – дисциплина, изучающая химию
соединений углерода с другими элементами. Ее основной
объект – органическая материя. Причина многообразия –
устойчивость связи С-С.
2. Основной понятийный аппарат ОХ тот же, что и для общей
химии. Эл. природа атомов и связей определяет поведение
субстанции в целом. Большую роль играют структурная и
пространственная изомерия.
3. Для полноценной взаимосвязи каждой структуре по жестким
правилам (номенклатура) сопоставлено наименование
органического соединения.
4. Количественно-качественной характеристикой активности
органической молекулы служат электронные эффекты,
табулированные для конкретных функциональных групп и учет
энергетически выгодных резонансных форм.
Физтех, 1 курс. Весна 2016
95
66. Проекция относительно связи С2-С3:
Основные понятияПостулаты Бутлерова и Вант-Гоффа
Стереоизомеры (энантио- и диастереомеры)
Функциональная группа
Конформер и конформации
Гибридизация орбиталей
Электронные эффекты
- индуктивный
- мезомерный
- гиперконъюгация
Теория резонанса
Нуклеофил и электрофил
Гомолитические превращения вещества
Перегруппировка
Физтех, 1 курс. Весна 2016
96











































 Химия
Химия








