Похожие презентации:
Термодинамика
1. ТЕРМОДИНАМИКА
ЕГЭ. ФИЗИКАРЕПЕТИЦИЯ ПО ФИЗИКЕ
Владимир Петрович Сафронов
г. Ростов-на-Дону, 2015
звоните т. 8 928 111 7884
пишите safron-47@mail.ru
ТЕРМОДИНАМИКА
2. Первый закон термодинамики
является законом сохранения энергии в термодинамических процессах.Внутренняя энергия
U, Дж — это кинетическая и потенциальная энергия атомов и молекул,
из которых состоит тело.
Для идеального газа — это кинетическая энергия его молекул.
i
U RT ,
2
i — число степеней свободы молекулы.
Внутренняя энергия является однозначной функцией термодинамических
параметров T, V и не зависит от предыстории состояния
Выражения для внутренней энергии идеального одноатомного газа:
U ( N Eср
2
mvcp
2
)
3
3m
3
3
RT
RT PV N kT CV T
2
2
2
2
Изменение внутренней энергии идеального одноатомного газа:
U12
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
3
3
R T P2V2 PV
1 1
2
2
3. Количество теплоты
Q, Дж — это энергия, передаваемая системе в процессе теплообмена,т.е. без совершения механической работы: теплопроводность, излучение, конвекция.
Для изменения температуры системы на один градус в
различных процессах требуется разное количество теплоты.
Теплоту можно определить, зная теплоемкость процесса.
Теплоемкость
Q
С, Дж/К — это количество теплоты, необходимое для изменения
C
.
T
температуры системы на один градус:
Удельная теплоемкость
теплоемкость одного килограмма вещества.
Зависит от строения вещества и температуры:
C УД
Q
С
.
m T m
Q
С
Молярная теплоемкость
C
.
теплоемкость одного моля вещества.
dT
Нахождение теплоты
Q C T C T CУД m T CУД m t C .
Удельная теплота парообразования r — количество теплоты,
Q
r
QКИП rm.
необходимое для превращения в пар одного килограмма
m
жидкости, нагретой до температуры кипения:
Удельная теплота плавления ,Дж/кг — количество теплоты
Q
QПЛАВ m.
необходимое для плавления одного килограмма, кристаллического
m
вещества, нагретого до температуры плавления:
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
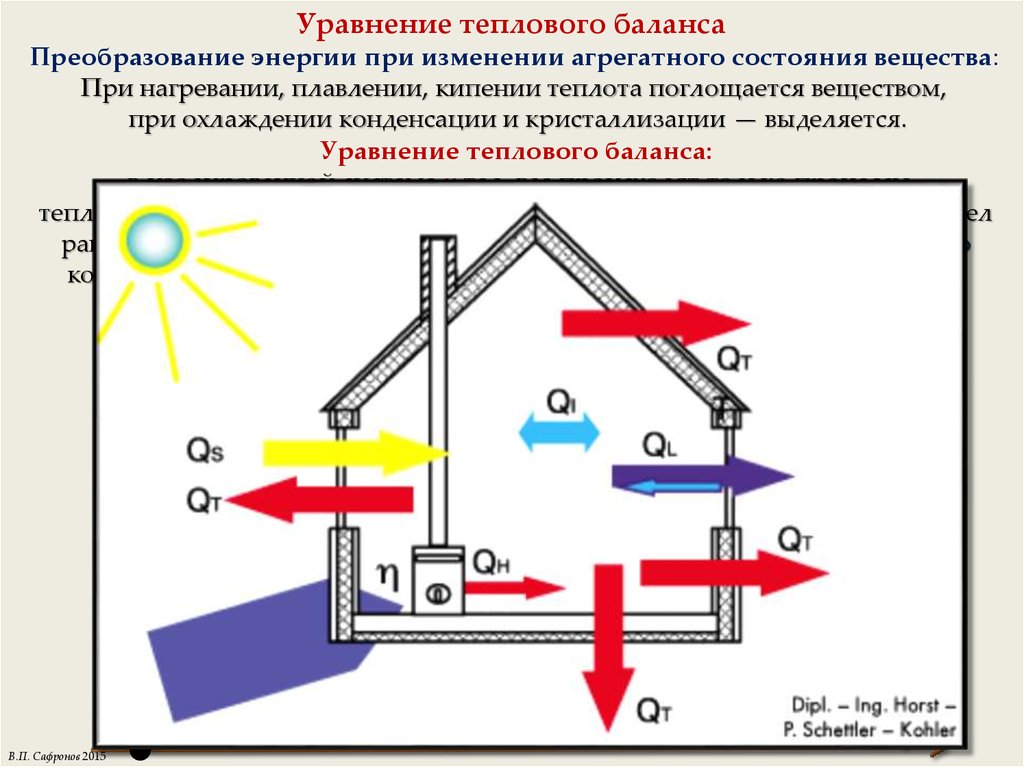
4. Уравнение теплового баланса
Преобразование энергии при изменении агрегатного состояния вещества:При нагревании, плавлении, кипении теплота поглощается веществом,
при охлаждении конденсации и кристаллизации — выделяется.
Уравнение теплового баланса:
в изолированной системе n тел, где происходят только процессы
теплопередачи, алгебраическая сумма изменения внутренней энергии всех тел
равна нулю U = 0. Количество теплоты, отданное телами системы равно
количеству теплоты, полученному телами системы Qотданная = Qполученная.
T
T
нагревание
С1–удельная теплоемкость
λ – удельная теплота
газа
кристалла
плавления
Q5 C 3m T
С2–удельная теплоемкость
r
–
удельная
теплота
жидкости
охлаждение
кипения
С3–удельная теплоемкость
кипение
газа
газа (пара)
TКИП
m – масса
вещества
TПЛАВ
нагревание
жидкости
плавление
нагревание
Q2 m
твердого
кристаллизация
тела Q C m T
1
1
охлаждение
твердого
тела
В.П. Сафронов 2015
Q4 r m
конденсация
Q3 C 2 m T
охлаждение
жидкости
T
TКОНДЕНСАЦИИ
КРИСТАЛЛИЗАЦИИ
Q
5. Работа, совершаемая системой при изменении объема
А, Дж совершается только при изменении объема и зависитот типа термодинамического процесса.
Элементарная работа
S
h
P
A F h ( P F / S ) PS h
A P V .
При конечном изменении объема от V1 до V2 работа
определяется интегрированием
A12
V2
P dV ,
V1
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
поэтому
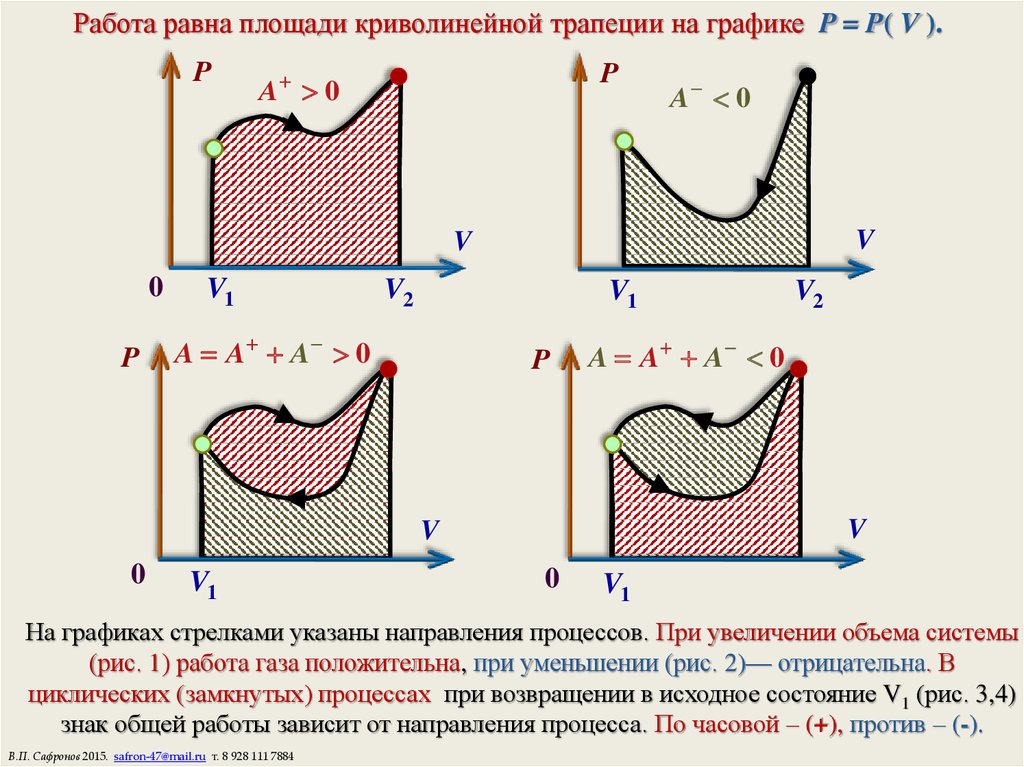
6. Работа равна площади криволинейной трапеции на графике P = P( V ).
PP
A 0
A 0
V
V
0
P
V1
V2
V1
A A A 0
P
A A A 0
V
V
0
V1
V2
0
V1
На графиках стрелками указаны направления процессов. При увеличении объема системы
(рис. 1) работа газа положительна, при уменьшении (рис. 2)— отрицательна. В
циклических (замкнутых) процессах при возвращении в исходное состояние V1 (рис. 3,4)
знак общей работы зависит от направления процесса. По часовой – (+), против – (-).
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
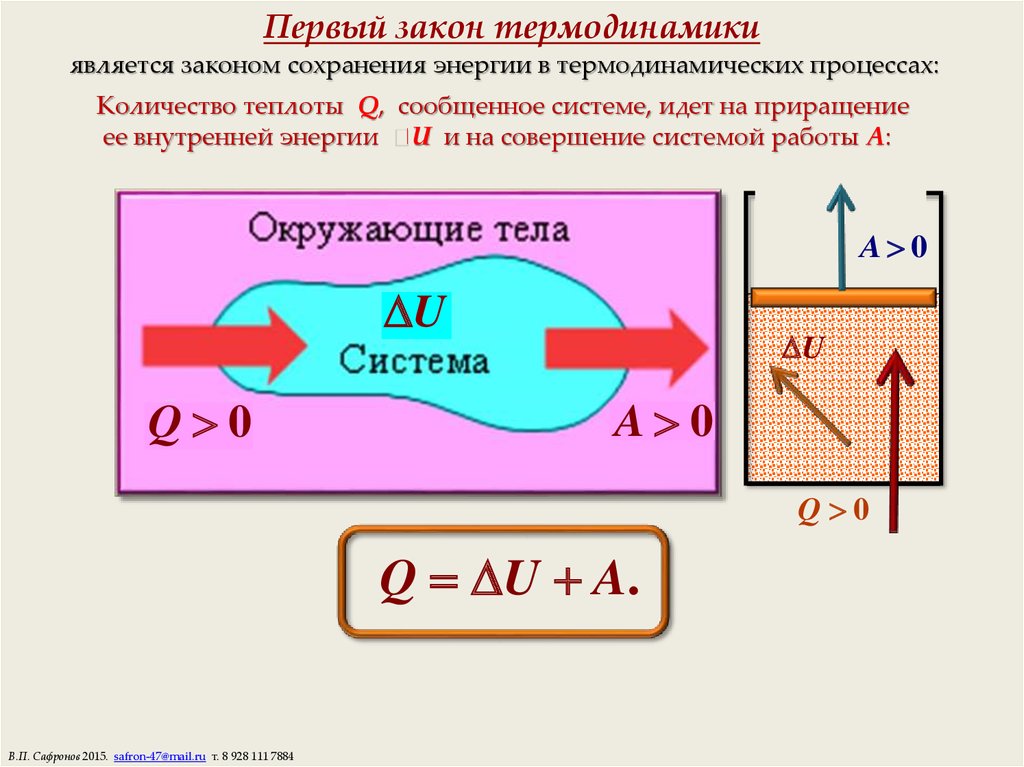
7. Первый закон термодинамики
является законом сохранения энергии в термодинамических процессах:Количество теплоты Q, сообщенное системе, идет на приращение
ее внутренней энергии U и на совершение системой работы A:
A 0
U
Q 0
U
A 0
Q 0
Q U A.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
8. Первый закон термодинамики в изопроцессах
Изохорный процессA 0
V const .
происходит без изменения объема :
Так как V = const
U Q
V=0
A = 0.
Работа в изохорном процессе не совершается, поэтому
Q U.
Q 0
Q U
Теплота расходуется на изменение внутренней энергии
(нагревание газа).
3
3
3
R T V P V P2 P1
2
2
2
CV
Q U 3
R — одноатомный идеальный газ
T T 2
Q U CV T ;
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
— одноатомный идеальный газ
9. Изобарный процесс
происходит приИзобарный процесс
постоянном давлении P const , P 0, P1 P2
A 0
Работа в изобарном процессе
A P V P V2 V1 R T R T2 T1 .
Первый закон термодинамики.
P const
Q U A.
U
Теплота расходуется на изменение внутренней
энергии (нагревание) и совершение газом работы.
Q12 U A12
3
5
5
5
5
R T R T R T P V P V2 V1 A.
2
2
2
2
2
Q 0
г) Теплоемкость.
CP
Q U A
5
CV R R — одноатомный идеальный газ
T T T
2
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
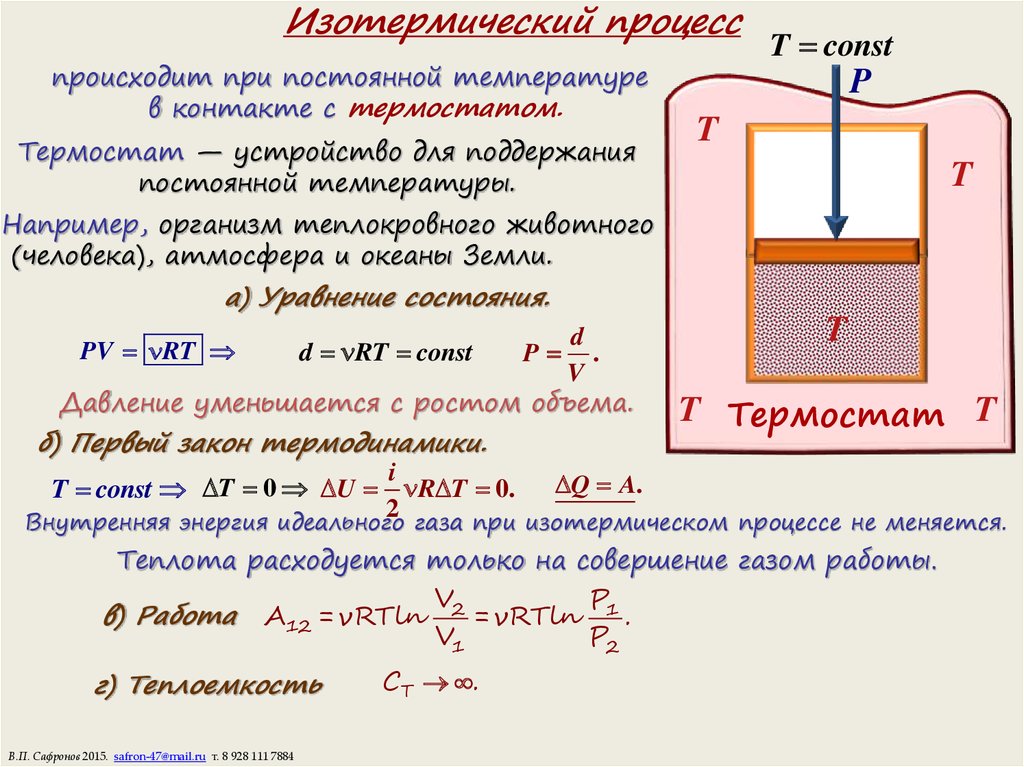
10. Изотермический процесс
происходит при постоянной температурев контакте с термостатом.
Термостат — устройство для поддержания
постоянной температуры.
T const
P
T
T
Например, организм теплокровного животного
(человека), атмосфера и океаны Земли.
а) Уравнение состояния.
d
.
V
Давление уменьшается с ростом объема.
PV RT
d RT const
P
T
T Термостат T
б) Первый закон термодинамики.
i
T const T 0 U R T 0. Q A.
2
Внутренняя энергия идеального газа при изотермическом процессе не меняется.
Теплота расходуется только на совершение газом работы.
V
P
в) Работа A12 = νRTln 2 = νRTln 1 .
V1
P2
г) Теплоемкость
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
CT .
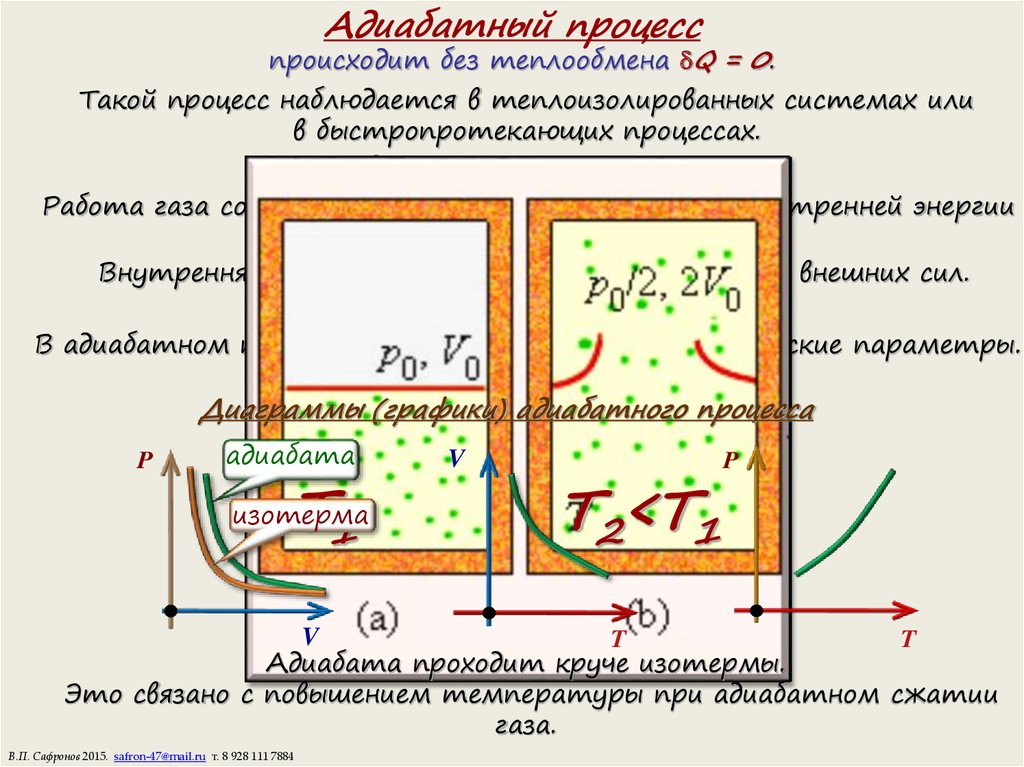
11. Адиабатный процесс
происходит без теплообмена Q = 0.Такой процесс наблюдается в теплоизолированных системах или
в быстропротекающих процессах.
а) Первый закон термодинамики.
Работа газа совершается за счет уменьшения его внутренней энергии
A U .
Внутренняя энергия газа растет за счет работы внешних сил.
U A.
В адиабатном процессе меняются все термодинамические параметры.
PV RT .
Диаграммы (графики) адиабатного процесса
P
адиабата
T1
изотерма
V
T2<T1
P
V
T
T
Адиабата проходит круче изотермы.
Это связано с повышением температуры при адиабатном сжатии
газа.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
12. в) Работа в адиабатном процессе
A U ДВИГАТЕЛЬA CV T .
ДИЗЕЛЯ
i
i
A12 CV T1 T2 R T1 T2 P1V1 P2V2 .
2
2
Одноатомный идеальный газ.
3
3
A12 CV T1 T2 R T1 T2 P1V1 P2V2
2
2
г)Теплоемкость
По определению, адиабатная теплоемкость
Так как
Q = 0,
CQ = Q T .
CQ = 0.
Адиабатная теплоемкость равна нулю.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
13. Второй закон термодинамики
определяет направление протекания процессов в замкнутой системе.Энтропия — мера хаоса в системе.
Чем больше хаос, тем больше энтропия.
В замкнутой системе процессы проходят так,
чтобы энтропия не убывала.
Замкнутые системы за счет необратимых процессов: диффузии,
теплопередачи, внутреннего трения стремятся перейти в
состояние максимального хаоса — в состояние термодинамического
равновесия. Обратные процессы невероятны.
Рассмотрим изменение энтропии в процессах переноса
в замкнутой системе.
Диффузия.
T T
1
2 энтропия
В необратимом процессе Термостат
диффузии
(хаос) возрастает.
(3)
Q
Теплопроводность.
T1
T2
В необратимом процессе
теплопроводности
энтропия возрастает.
(1)
(2)
Внутреннее
трение.
Замкнутая
Замкнутая
система
система трения энтропия возрастает.
В необратимом процессе внутреннего
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
14. Принцип действия тепловых машин (двигателей)
Круговые процессы или циклы — это процессы, в результате которыхсистема возвращается в исходное состояние.
Если при этом газом совершается положительная работа,
цикл называется прямым (по часовой стрелке, тепловой двигатель),
P
A A A 0
P
A A A 0
V
V
0
V1
0
V1
если отрицательная — обратным (против часовой стрелки, холодильник).
Тепловой двигатель превращает внутреннюю энергию топлива в
механическую энергию (работу).
Примеры: паровой, турбинный, двигатель внутреннего сгорания,
двигатель Дизеля.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
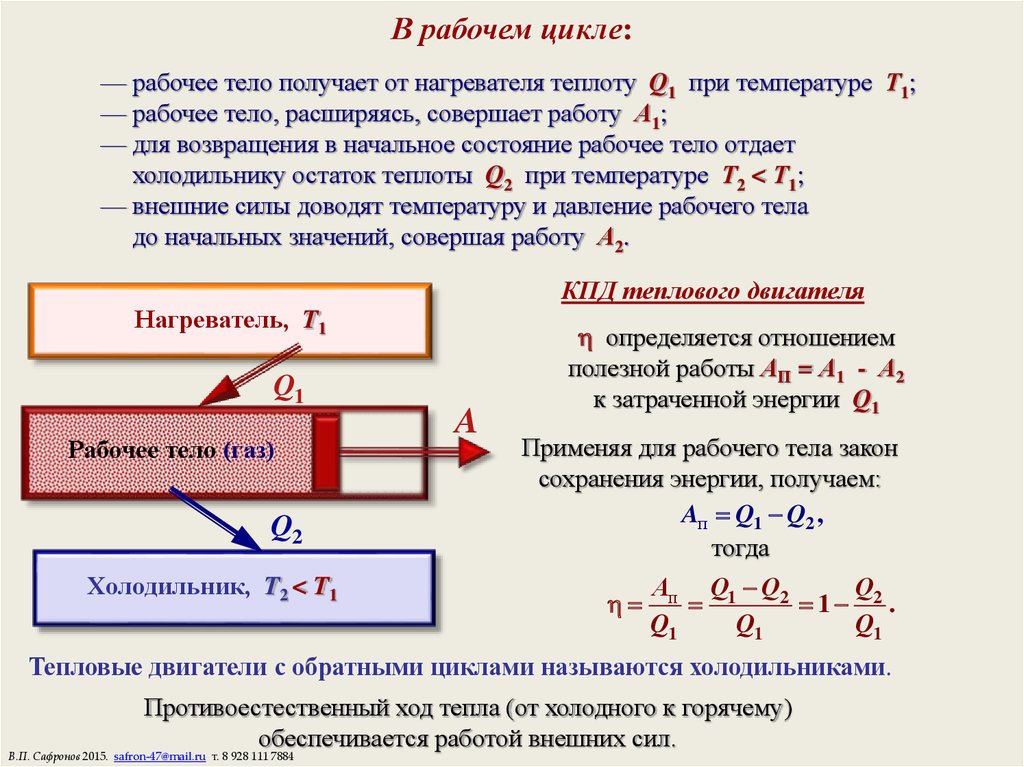
15. В рабочем цикле:
— рабочее тело получает от нагревателя теплоту Q1 при температуре Т1;— рабочее тело, расширяясь, совершает работу А1;
— для возвращения в начальное состояние рабочее тело отдает
холодильнику остаток теплоты Q2 при температуре Т2 < Т1;
— внешние силы доводят температуру и давление рабочего тела
до начальных значений, совершая работу А2.
КПД теплового двигателя
Нагреватель, T1
Q1
Рабочее тело (газ)
Q2
Холодильник, T2 < T1
A
определяется отношением
полезной работы АП = А1 - А2
к затраченной энергии Q1
Применяя для рабочего тела закон
сохранения энергии, получаем:
Aп Q1 Q2 ,
тогда
Ап Q1 Q2
Q
1 2 .
Q1
Q1
Q1
Тепловые двигатели с обратными циклами называются холодильниками.
Противоестественный ход тепла (от холодного к горячему)
обеспечивается работой внешних сил.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
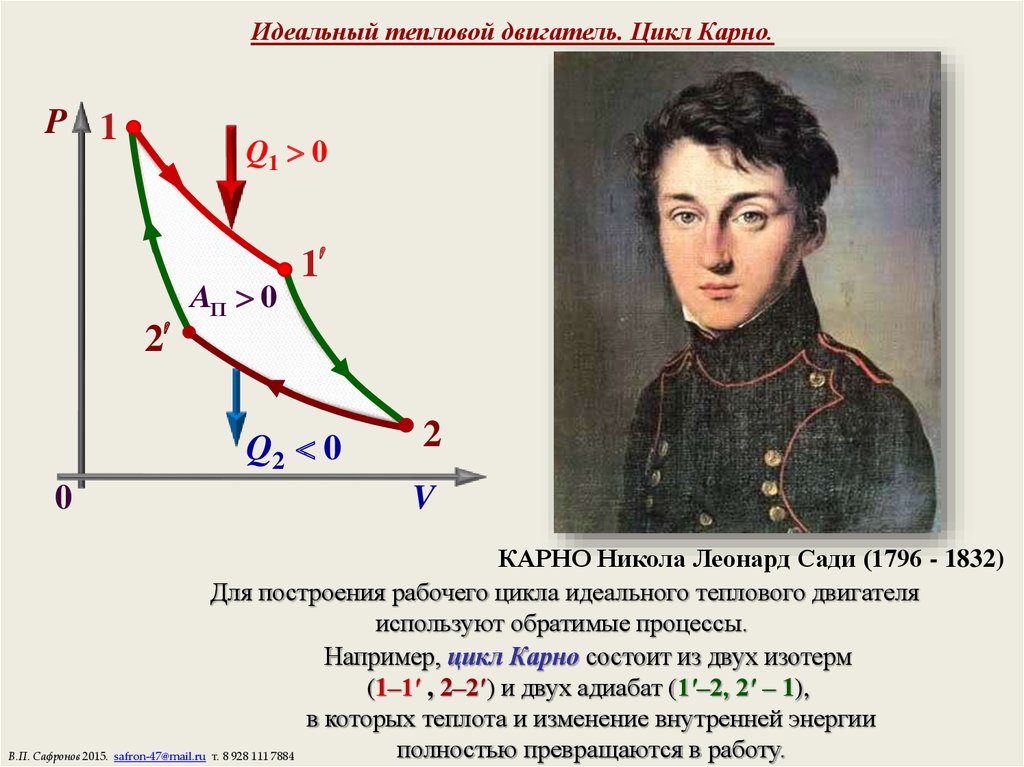
16. Идеальный тепловой двигатель. Цикл Карно.
P 1Q1 0
2
AП 0
1
Q2 0
0
2
V
КАРНО Никола Леонард Сади (1796 - 1832)
Для построения рабочего цикла идеального теплового двигателя
используют обратимые процессы.
Например, цикл Карно состоит из двух изотерм
(1–1′ , 2–2′) и двух адиабат (1′–2, 2′ – 1),
в которых теплота и изменение внутренней энергии
полностью превращаются в работу.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
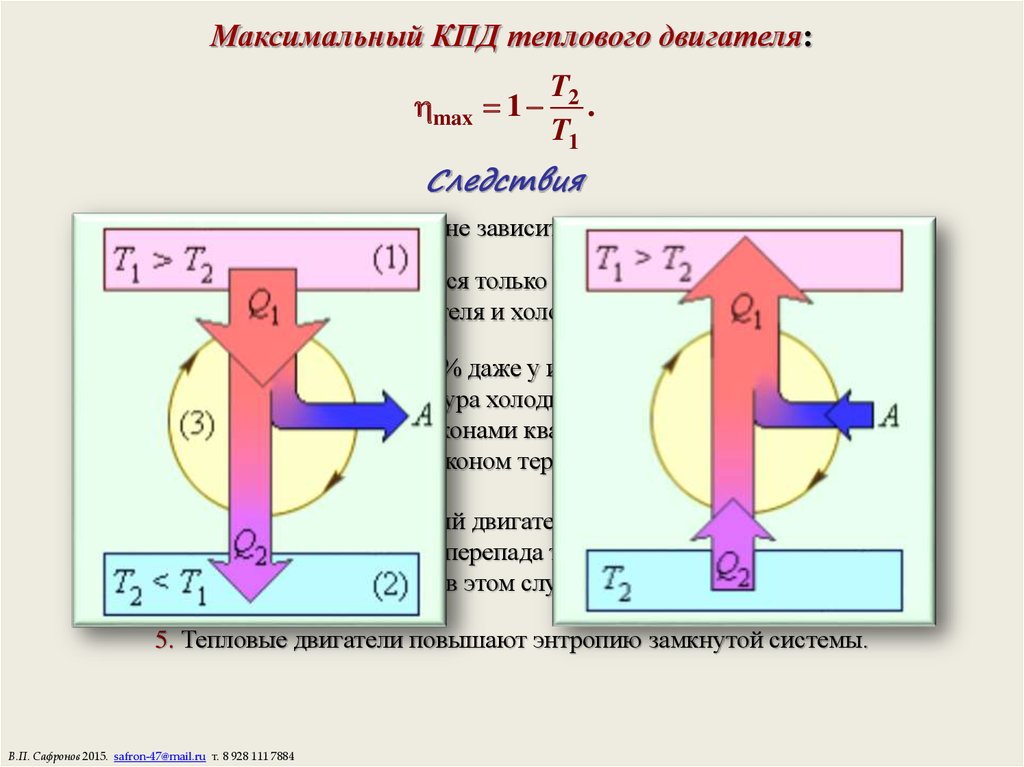
17. Максимальный КПД теплового двигателя:
max 1T2
.
T1
Следствия
1. КПД цикла Карно не зависит от рода рабочего тела.
2. КПД определяется только разницей температур
нагревателя и холодильника.
3. КПД не может быть 100% даже у идеальной тепловой машины,
так как при этом температура холодильника должна быть Т2 = 0,
что запрещено законами квантовой механики и
третьим законом термодинамики.
4. Невозможно создать вечный двигатель второго рода, работающий в
тепловом равновесии без перепада температур, т.е. при Т2 = Т1,
так как в этом случае = 0.
5. Тепловые двигатели повышают энтропию замкнутой системы.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
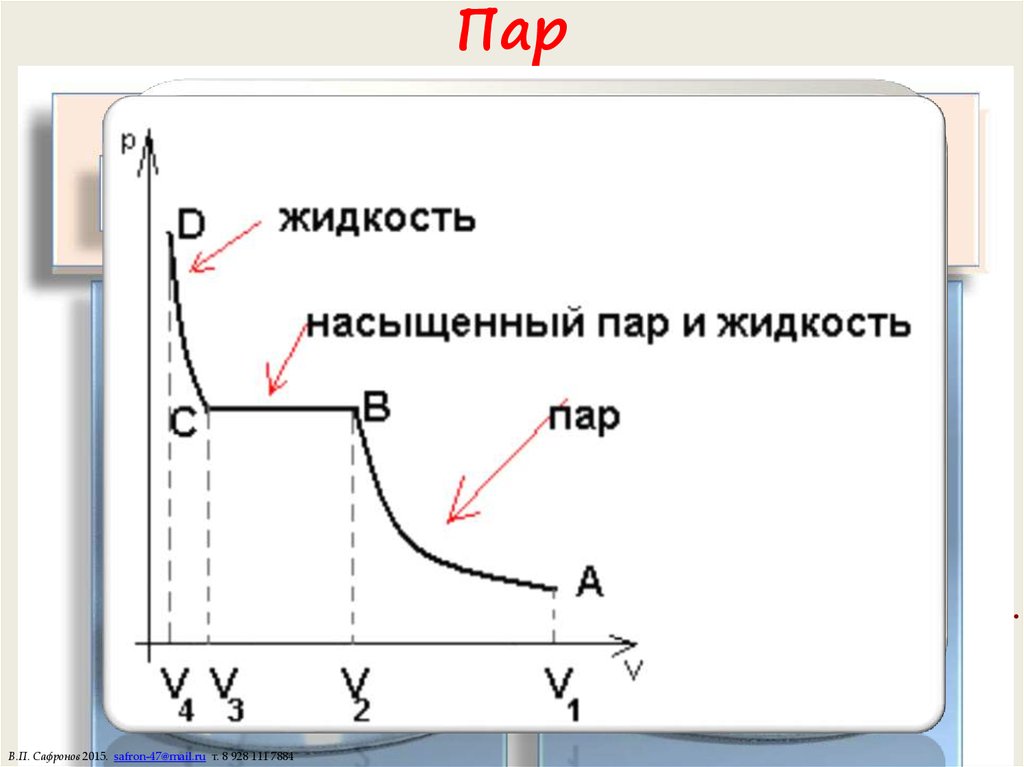
18. Цикл Карно
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 788419. Пар
Испарение — отрыв молекул с поверхности жидкости.Над жидкостью образуется пар.
Испаряются только молекулы, у которых кинетическая энергия больше энергии их
взаимодействия. При этом жидкость охлаждается.
С повышением температуры испарение увеличивается.
Конденсация — процесс обратный испарению. Часть молекул возвращается в жидкость.
Пар называется насыщенным, если количество испарившихся в единицу времени
молекул совпадает с количеством конденсирующихся (динамическое равновесие). При
этом появляется роса.
Если скорость испарения больше скорости конденсации — пар ненасыщенный.
Точка росы — температура, при которой пар становится насыщенным.
Ненасыщенные пары ведут себя как идеальный газ.
Подчиняются закону Клаперона и закону Дальтона.
Насыщенные пары. Плотность, концентрация и давление насыщенного пара при
одинаковой температуре не зависят от объема.
При T const нас const , nнас const , Pнас const Pнас nнас kT , нас Pнас / RT .
При сжатии лишняя масса пара конденсируется в жидкость.
Насыщенные пары подчиняются закону Менделеева-Клаперона и закону Дальтона.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
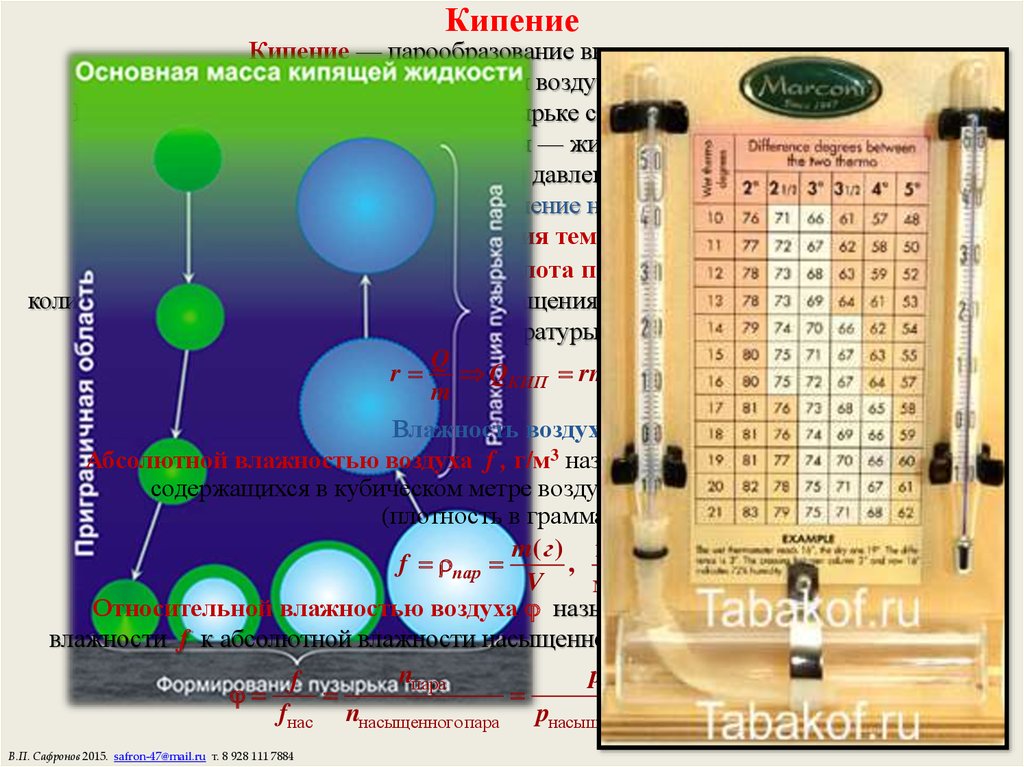
20. Кипение
Кипение — парообразование внутри жидкости.Молекулы испаряются в пузырьки воздуха — зародыши кипения.
Когда давление насыщенного пара в пузырьке станет равно внешнему давлению
— пузырек надувается — жидкость кипит.
При постоянном внешнем давлении ТКИП = const.
Температура кипения воды 100 С, давление насыщенного пара Pн = 105 Па.
С повышением внешнего давления температура кипения растет.
r, Дж/кг — удельная теплота парообразования
количество теплоты, необходимое для превращения в пар одного килограмма жидкости,
нагретой до температуры кипения:
Q
r QКИП rm.
m
Влажность воздуха.
Абсолютной влажностью воздуха f , г/м3 называется масса водяных паров,
содержащихся в кубическом метре воздуха при данных условиях
(плотность в граммах):
m( г ) гр
f пар
, 3
V
м
Относительной влажностью воздуха называется отношение абсолютной
влажности f к абсолютной влажности насыщенного пара fнас при данных условиях:
nпара
рпара
f
100% .
fнас nнасыщенного пара pнасыщенного пара
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884









 Физика
Физика








