Похожие презентации:
Характеристика химического элемента S
1. Характеристика химического элемента
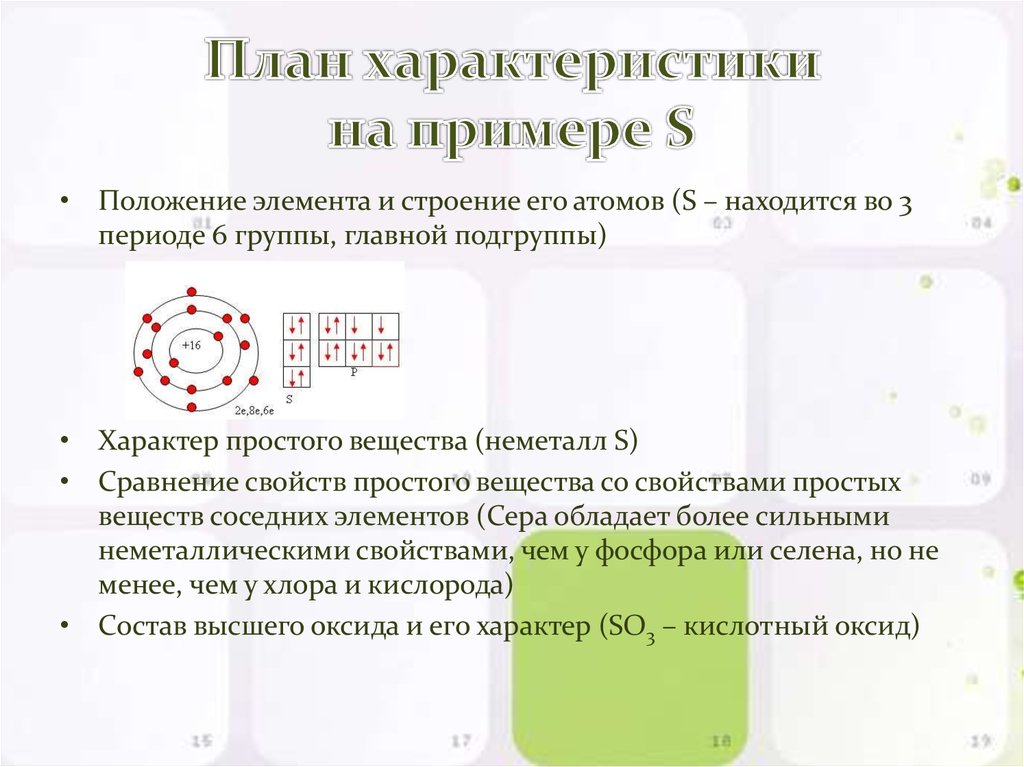
2. План характеристики на примере S
• Положение элемента и строение его атомов (S – находится во 3периоде 6 группы, главной подгруппы)
• Характер простого вещества (неметалл S)
• Сравнение свойств простого вещества со свойствами простых
веществ соседних элементов (Сера обладает более сильными
неметаллическими свойствами, чем у фосфора или селена, но не
менее, чем у хлора и кислорода)
• Состав высшего оксида и его характер (SO3 – кислотный оксид)
3. План характеристики на примере S
• Состав высшего гидроксида, его характер (H2SO4 –кислородосодержащая кислота)
• Состав летучего водородного соединения (H2S – сероводород)
Формулы
высших оксидов
Формулы
летучих
водородных
соединений
4. На таблице отметить изменение свойств
Заряд ядра
Число энергетических уровней
Число электронов на внешнем уровне
Радиус атома
5.
• Восстановительные и окислительные свойства:Вос. Свойства – способность отдавать е
Окис. Свойства – способность притягивать е
• Высшая степень окисления
• Низшая степень окисления
У ПРОСТЫХ ВЕЩЕСТВ
• Металлические/неметаллические свойства
У СОЕДИНЕНИЙ
• Характер высшего оксида
• Характер высшего гидроксида
• Как определить все эти параметры?
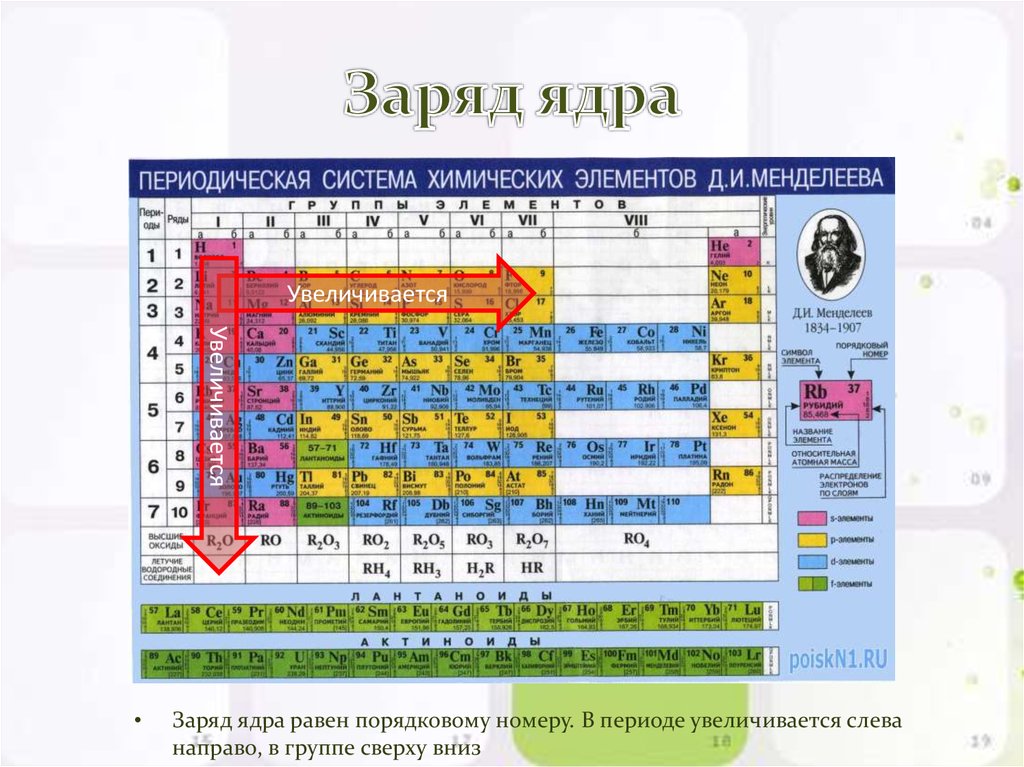
6. Заряд ядра
УвеличиваетсяУвеличивается
Заряд ядра равен порядковому номеру. В периоде увеличивается слева
направо, в группе сверху вниз
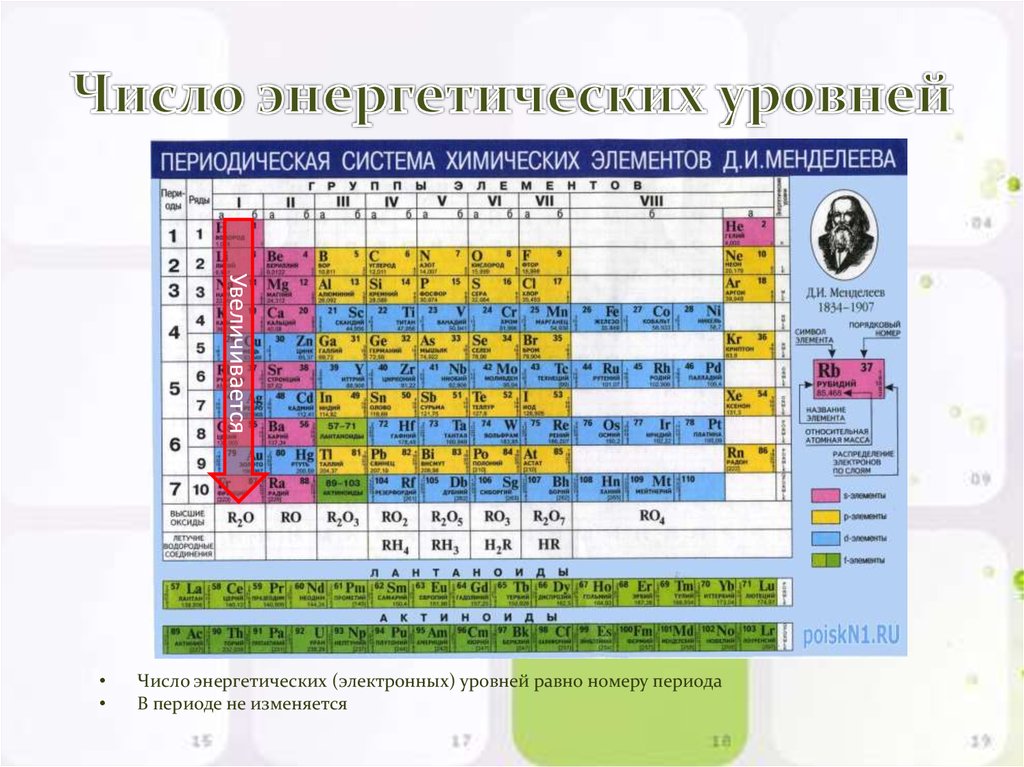
7. Число энергетических уровней
УвеличиваетсяЧисло энергетических (электронных) уровней равно номеру периода
В периоде не изменяется
8. Число электронов на внешнем уровне
УвеличиваетсяЧисло электронов на внешнем уровне равно номеру группы (у
побочной подгруппы = 2)
В группе не изменяется
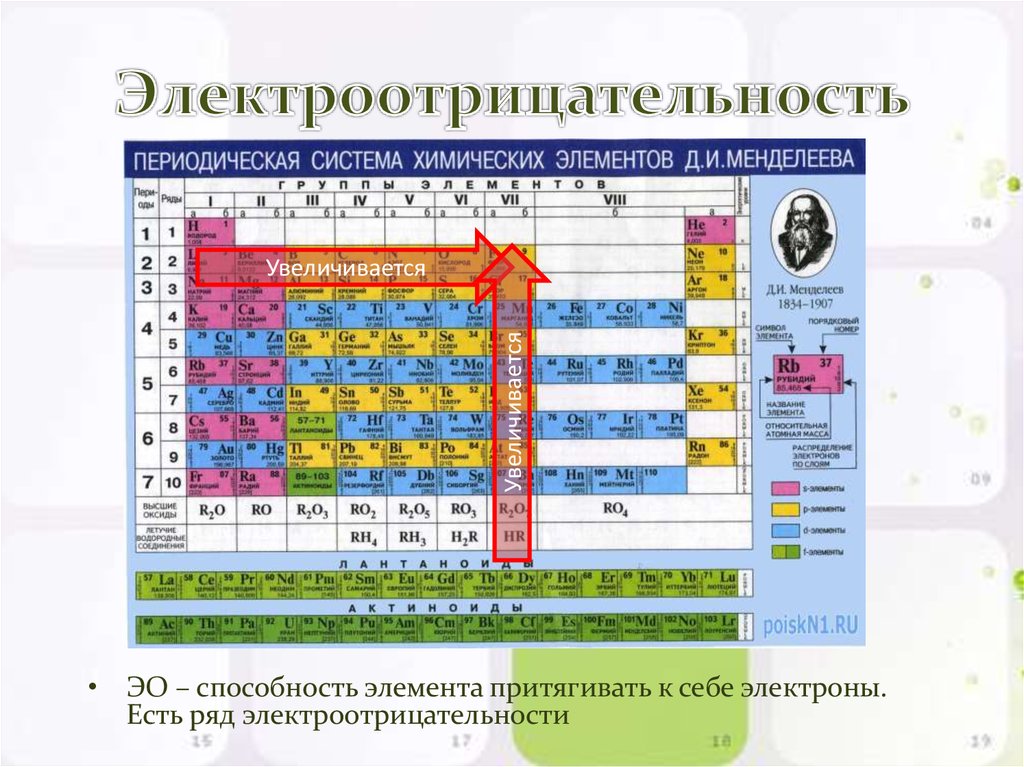
9. Электроотрицательность
УвеличиваетсяУвеличивается
• ЭО – способность элемента притягивать к себе электроны.
Есть ряд электроотрицательности
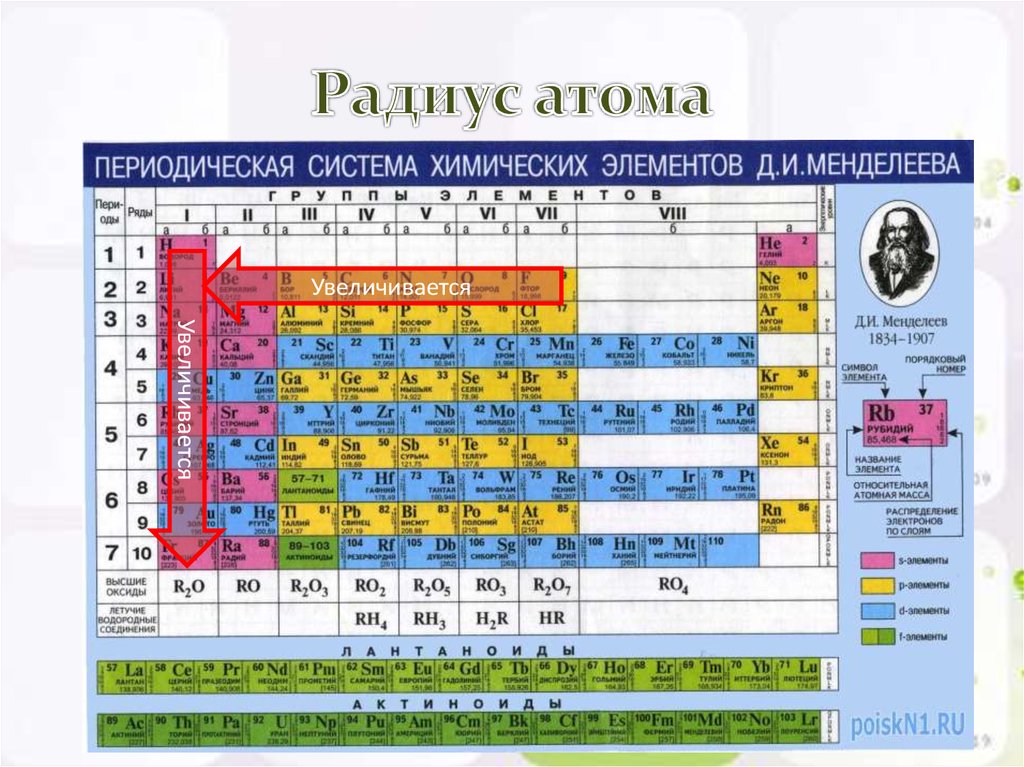
10. Радиус атома
УвеличиваетсяУвеличивается
11. Восстановительные свойства
УвеличиваетсяУвеличивается
Восстановительные свойства – способность отдавать электроны. Присущи металлам
Окислительные свойства – способность принимать электроны. Присуще неметаллам
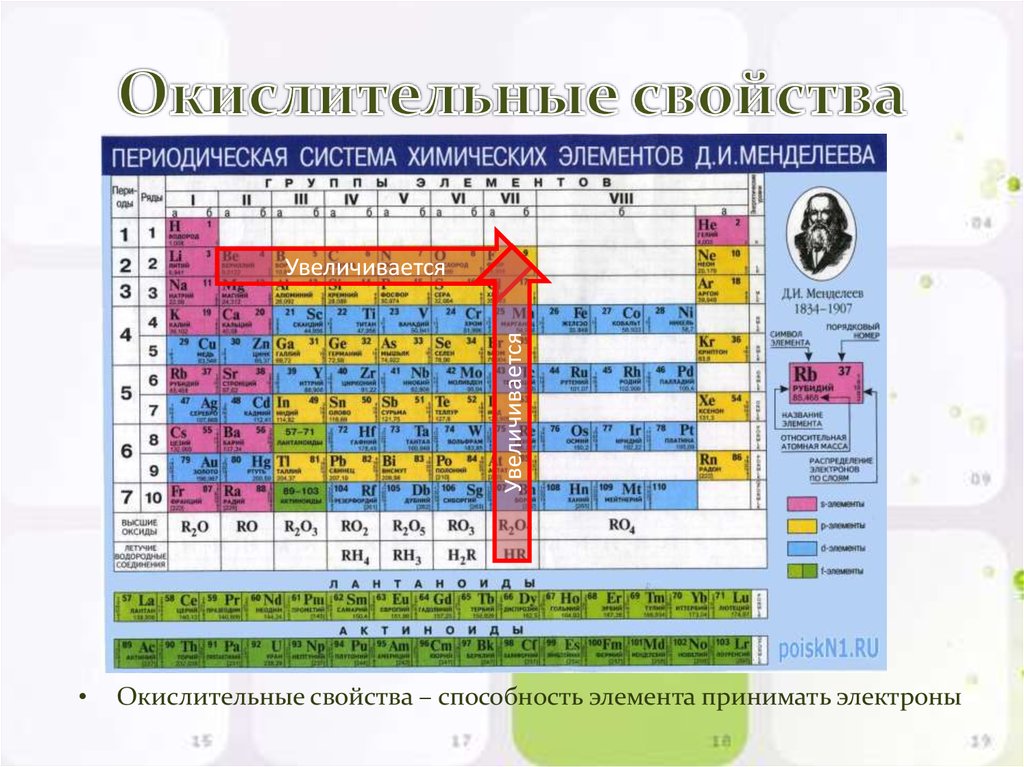
12. Окислительные свойства
УвеличиваетсяУвеличивается
Окислительные свойства – способность элемента принимать электроны
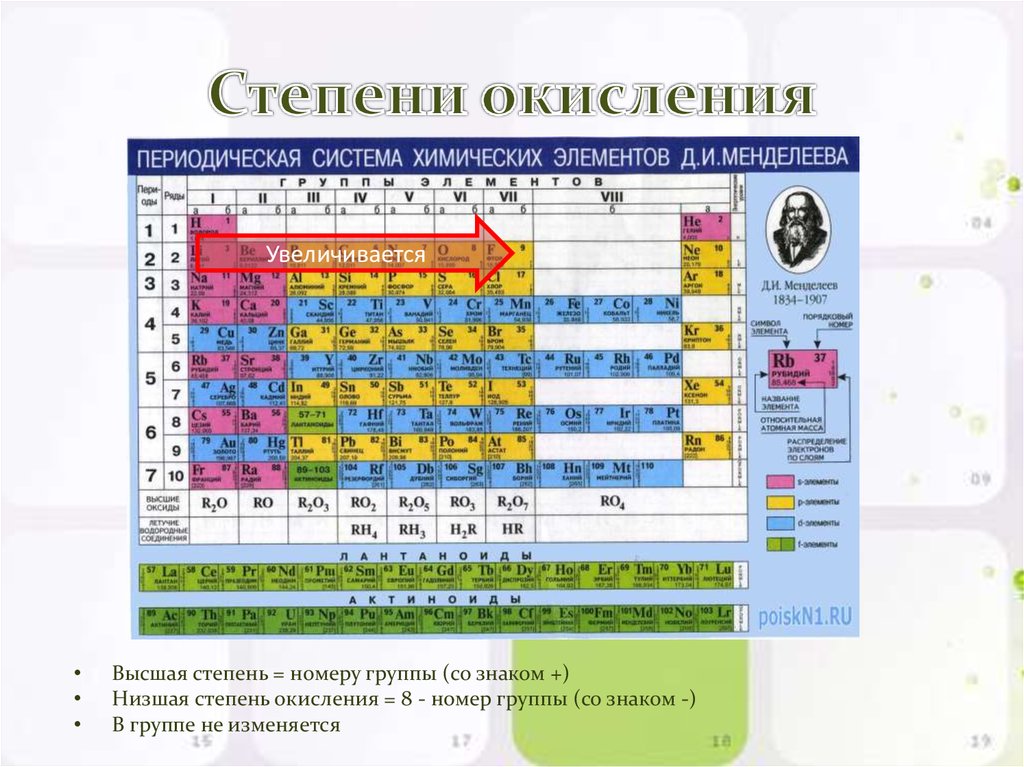
13. Степени окисления
УвеличиваетсяВысшая степень = номеру группы (со знаком +)
Низшая степень окисления = 8 - номер группы (со знаком -)
В группе не изменяется
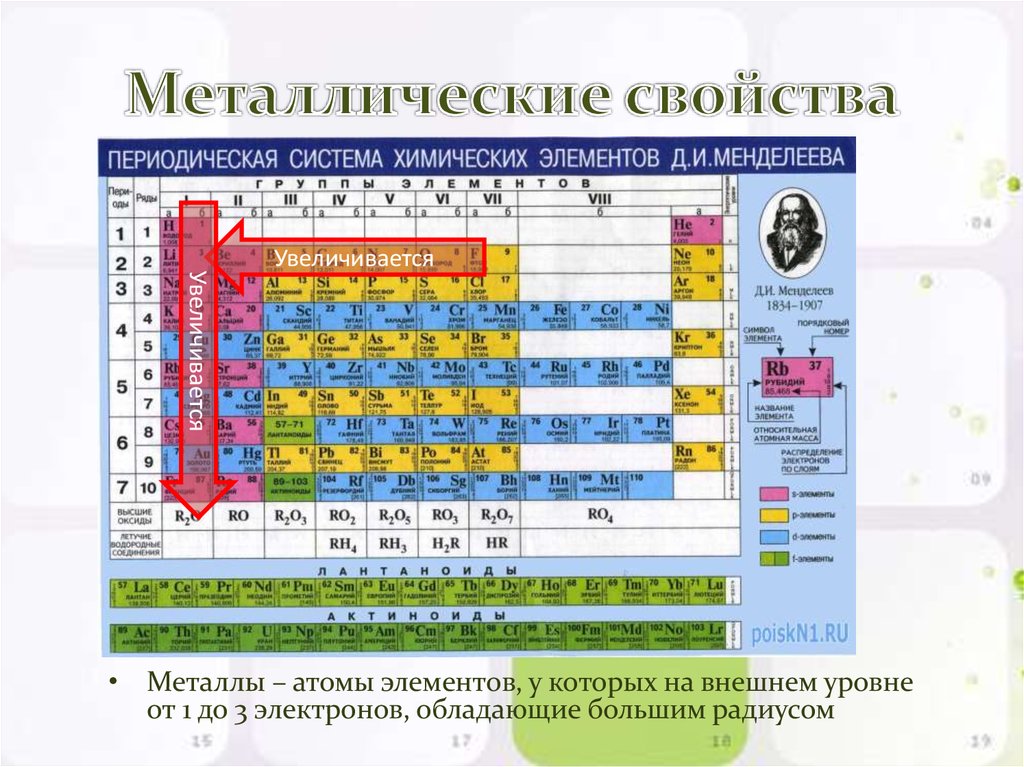
14. Металлические свойства
УвеличиваетсяУвеличивается
• Металлы – атомы элементов, у которых на внешнем уровне
от 1 до 3 электронов, обладающие большим радиусом
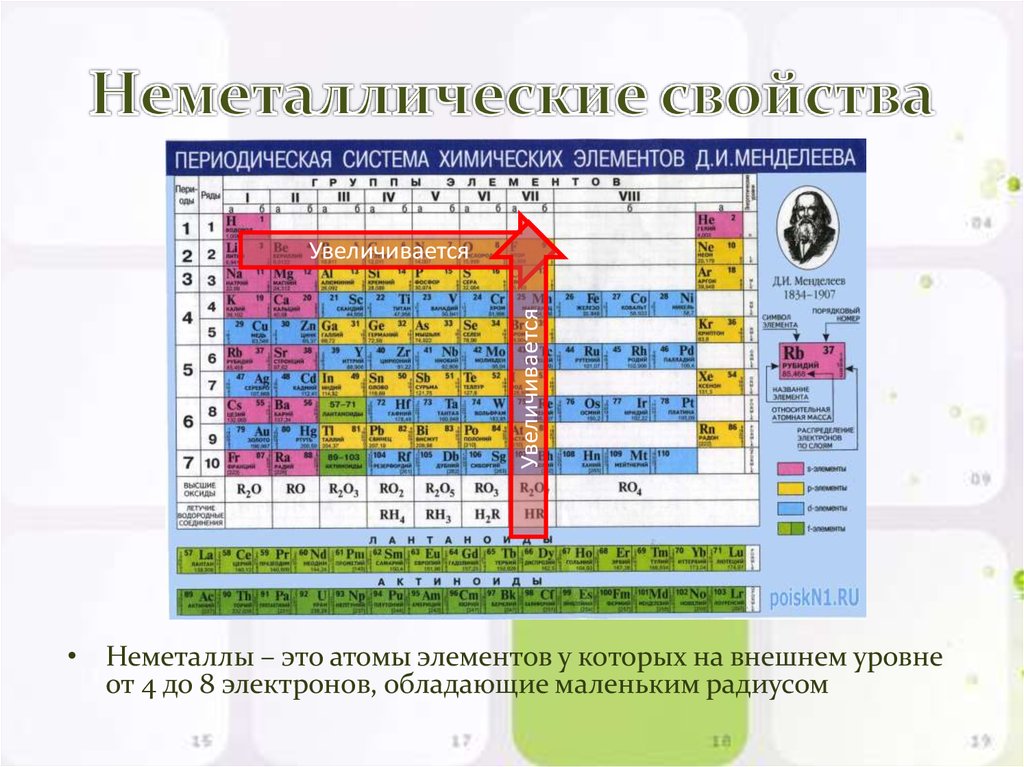
15. Неметаллические свойства
УвеличиваетсяУвеличивается
• Неметаллы – это атомы элементов у которых на внешнем уровне
от 4 до 8 электронов, обладающие маленьким радиусом
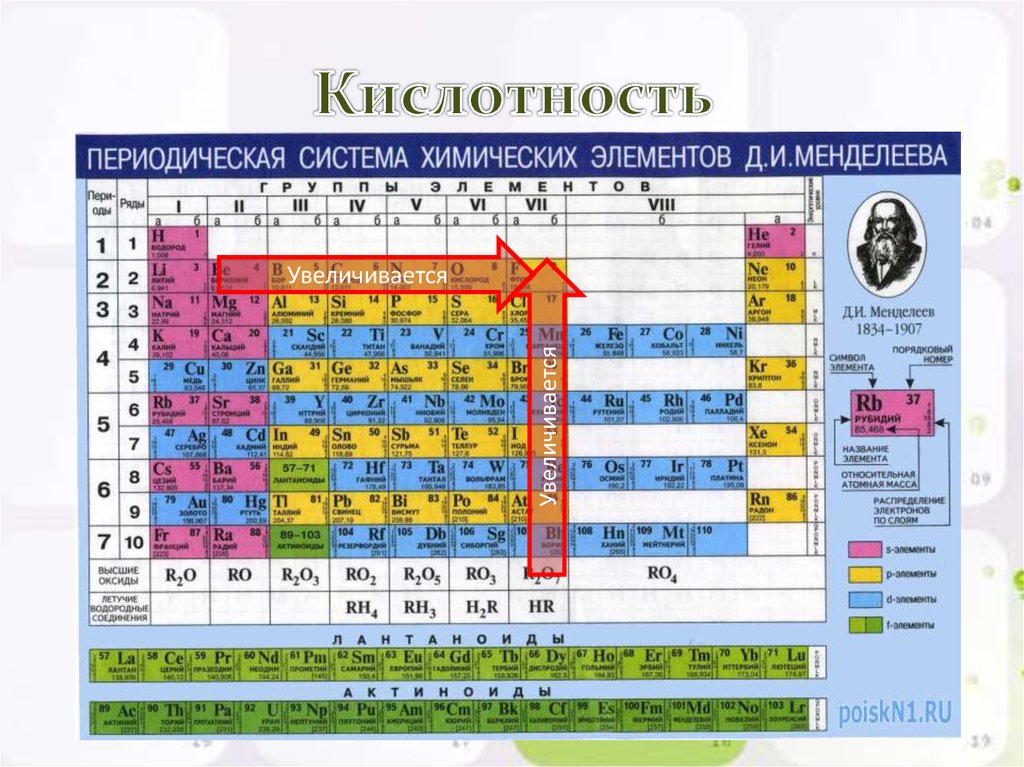
16. Кислотность
УвеличиваетсяУвеличивается
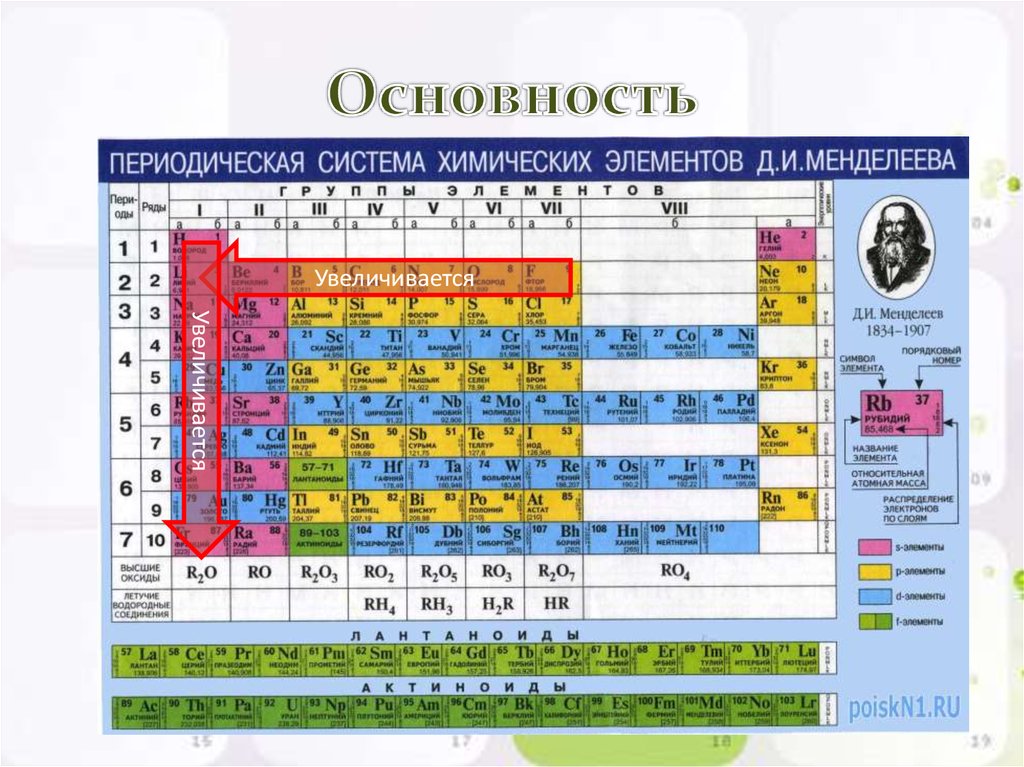
17. Основность
УвеличиваетсяУвеличивается








 Химия
Химия








