Похожие презентации:
Наркотические и ненаркотические анальгетики
1. Наркотические и ненаркотические анальгетики
1. Ноцициептивная и антиноцицептивная системы.Ноцицепторы.
2. Опиоидные (наркотические) анальгетики и их антагонисты
3. Неопиоидные препараты центрального действия с
анальгетической активностью
4. Анальгетики со смешанным механизмом действия
(опиоидный + неопиоидный)
2.
1.Анальгетики — (an отрицание и algos— боль) - препараты, которые при
резорбтивном действии избирательно подавляют болевую чувствительность. Они
не выключают сознание и не угнетают другие виды чувствительности.
ГРУППЫ ПРЕПАРАТОВ
I. Средства преимущественно центрального действия
А. Опиоидные (наркотические) анальгетики
1. Агонисты
2. Агонисты-антагонисты и частичные агонисты
Б. Неопиоидные препараты с анальгетической активностью
1. Неопиоидные (ненаркотические) анальгетики (производные парааминофенола)
2. Препараты из различных фармакологических групп с анальгетическим
компонентом действия
II. Средства преимущественно периферического действия
Неопиоидные (ненаркотические) анальгетики (производные салициловой
кислоты, пиразолона и др.)
3.
I. Ноцицептивная афферентная система: воспринимает, проводитболевые импульсы и формирует реакции на боль (отрицательные эмоции,
рефлекторные изменения функций внутренних органов, безусловные двигательные
рефлексы, волевые усилия, направленные на устранение болевого воздействия). В
восприятии повреждающих (ноцицептивных) стимулов участвуют свободные
неинкапсулированные нервные окончания — ноцицепторы.
1.Ноцицепторы (греч.noceo - повреждаю) Неинкапсулированные, 3
видов - механические, термические и хеморецепторы, которые активируются теплом,
электро-током и алгогенами (брадикинин, гистамин, серотонин, ионы К+ и Н+, ПГЕ,
АХ, цитокины, аденозин, лейкотриены, субстанция Р). Вариантом хеморецепторов
являются ваниллоидные рецепторы VR —регуляторы проницаемости катионных
каналов. Их агонист — капсаицин (вещество стручкового перца).
2. Болевые нервные волокна – Аβ и С
Аβ – миелинизированные (35-100 м/с) - от механо- и терморецепторов к мотонейронам
передних рогов спинного мозга и в ЦНС (чувство острой локализованной боли).
С – немиелинизированные (0,2-2 м/с) – от хеморецепторов к вегетативным нейронам
боковых рогов (симпатический отдел ВНС) и в ЦНС (хроническая нелокализованная
боль).
4.
Пути проведения боли.НР - ноцицептивное раздражение;
Серот. - серотонинергические
волокна; Норадр. норадренергические волокна;
Энк. - энкефалинергические
волокна; минус - тормозной
эффект.
1 - околоводопроводное серое
вещество;
2 - большое ядро шва;
3 - голубое пятно;
4 - большеклеточное ретикулярное
ядро;
5 - гигантоклеточное ретикулярное
ядро;
6 - парагигантоклеточное ядро.
Первым
интегративным
центром, воспринимающим
болевые
импульсы, являются задние рога спинного мозга. Специфические
ноцицептивные нейроны активируются только болевыми импульсами и
могут быть сенситизированы повторяющейся стимуляцией. В них
происходят первичная переработка ноцицептивной информации и
передача ее в структуры головного мозга по спиноталамическому,
спиноретикулярному и спиномезенцефалическому контралатеральным
трактам.
Спиноталамический
путь
оканчивается
на
специфических
вентробазальных ядрах таламуса.
Спиноретикулярный и спиномезенцефалический пути достигают
неспецифических интраламинарных ядер таламуса после переключений
в продолговатом и среднем мозге.
Таламус выполняет функцию коллектора, где собирается и
анализируется сенсорная информация. Из
специфических
ядер
таламуса болевые импульсы поступают в первую (С1) и вторую (С2)
соматосенсорные области коры больших полушарий.
Болевой поток от неспецифических ядер таламуса возбуждает кору
лобной доли. Соматосенсорные зоны оценивают локализацию боли.
Лобная кора формирует эмоционально-аффективные проявления
боли и связанные с ней психические переживания.
5.
Механо- итерморецепторы
передают
болевые
сигналы
по
миелинизированным волокнам Аδ, полимодальные хеморецепторы — по
немиелинизированным волокнам С.
С активацией миелинизированных
афферентов связывают
ощущение
дискриминационной (различимой по модальности — колющей, режущей),
точно локализованной боли (эпикритическая боль). Такая боль длится, пока
действует повреждающий стимул.
Возбуждение
немиелинизированных
волокон
сопровождается
плохо
локализованным, неприятным диффузным жгучим ощущением. Оно возникает от
небольших по силе, но длительно повторяющихся раздражений, слегка
отсрочено вначале и продолжается уже после прекращения воздействия
(протопатическая боль).
При продолжительной боли повышается чувствительность ноцицепторов (при
участии ваниллоидных
рецепторов), активируются
ранее «молчащие»
ноцицепторы, в
проведение
болевых импульсов включаются
толстые
миелинизированные волокна Аβ, возрастает возбудимость нейронов спинного и
головного мозга.
6.
Ноцицептивная система состоит из двух путей проведения болевых импульсов —специфического и неспецифического.
Специфический (неоспиноталамический) путь — высокопороговые специфические
ноцицепторы (преимущественно механо- и терморецепторы), быстропроводящие
афферентные волокна Аδ, специфические ноцицептивные нейроны (задние рога
спинного мозга, вентробазальные ядра таламуса, соматосенсорная кора). Путь
является малонейронным, быстрым, проводит пороговую эпикритическую боль.
Неспецифический
(палеоспиноталамический)
путь
—
низкопороговые
полимодальные ноцицепторы (преимущественно хеморецепторы), медленнопроводящие
немиелинизированные
С- афференты, неспецифические ноцицептивные нейроны
(задние рога спинного мозга, интраламинарные ядра таламуса, кора лобной доли). Этот
путь образует многочисленные коллатерали к ретикулярной формации продолговатого и
среднего мозга, лимбической системе, гипоталамусу. Проводит протопатическую боль.
Пространственная и временная суммация слабых раздражений происходит в ядрах
таламуса.
Общим нейромедиатором для специфического и неспецифического путей является
глутаминовая кислота
7.
Антиноцицептивная система нарушаетвосприятие
боли, проведение болевых импульсов и формирование реакций
на боль.
Болевые импульсы возбуждают нейроны антиноцицептивной
системы, что ведет по принципу отрицательной обратной связи
к угнетению передачи болевых сигналов.
Ноцицептивная и антиноцицептивная системы регулируют
болевую чувствительность в процессе постоянного
взаимодействия.
Рецепторы опиоидов, каннабиоидов, глицина, ГАМК тормозят
выделение нейромедиаторов боли.
8.
2 главных антиноцицептивных системы – опиатная иканнабиоидная (еще - глициновая и ГАМК)
1. Опиатная система представлена нейронами центрального серого вещества
головного мозга. Аксоны этих нейронов образуют пути к коре больших полушарий,
лимбической системе, полосатому телу, таламусу, гипоталамусу, ретикулярной
формации, продолговатому и спинному мозгу. Медиаторами опиоидной
антиноцицептивной системы являются пептиды:
- Лей-энкефалин (5 АМК: тирозин-глицин-глицин-фенилаланин-лейцин),
- Мет-энкефалин (5 АМК: тирозин-глицин-глицин-фенилаланин-метионин),
-Динорфин А (17 АМК),
-Динорфин В (13 АМК),
- β-Эндорфин (31 АМК).
Локализация опиатных рецепторов - пресинаптическая мембрана ноцицепторов
(70%), окончания С-волокон, спинной и головной мозг.
2. Каннабиоидная система – СВ1 и СВ2 рецепторы.
Их активируют производные арахидоната – анандамид (санскр. ананда – блаженство)
и 2-арахидонил-глицерол.
Психотропный агонист – 9-тетра-гидро-каннабиол.
9.
3 типа опиатных рецепторов (сопряжены с G-белками):1. (мю) – мет-энкефалиновые и β–эндорфиновые
рецепторы (подтипы - 1, 2 и 3).
Эффекты активации – угнетение аденилатциклазы ( цАМФ)
и открытие К+ каналов
1 - Супраспинальная анальгезия (изменение эмоционального
восприятия, «переключение»). выделения пролактина.
2 – Спинальная анальгезия. Обстипация (запор).
выделения гормона роста. Угнетение дыхания.
3 – Супраспинальная и спинальная анальгезия.
Все 3 подтипа мю-рецепторов вызывают:
угнетение центра терморегуляции (снижение t тела ниже нормы),
повышение тонуса гладких мышц (миоз), седативный эффект
(сон),развитие эйфории (психическая зависимость), угнетение
синтеза эндорфинов (физическая зависимость)
10.
2. ( 1, 2, дельта) – рецепторы для динорфина А.Эффекты активации – также: угнетение аденилатциклазы
( цАМФ) и открытие К+ каналов
1 - Развитие супраспинальной анальгезии (выражена в
15 раз слабее по сравнению с эффектом активации рецепторов).
2 – Супраспинальная и спинальная анальгезия.
3 – Спинальная анальгезия.
Все 3 подтипа дельта-рецепторов вызывают:
дисфорию, галлюцинации, запор, АД
Нарушают познавательную деятельность, настроение,
обоняние, двигательную активность
11.
3. ( 1, 2, 3, каппа) – лей-энкефалиновыерецепторы
Эффекты активации:
закрываются Са2+ каналы
1 – Спинальная анальгезия. Увеличение диуреза.
2 – Спинальная и супраспинальная анальгезия. диуреза.
3 – Супраспинальная анальгезия.
Все 3 подтипа каппа-рецепторов вызывают:
спазм гладких мышц (миоз), запор.
Изменяют питьевую и пищевую мотивации.
12.
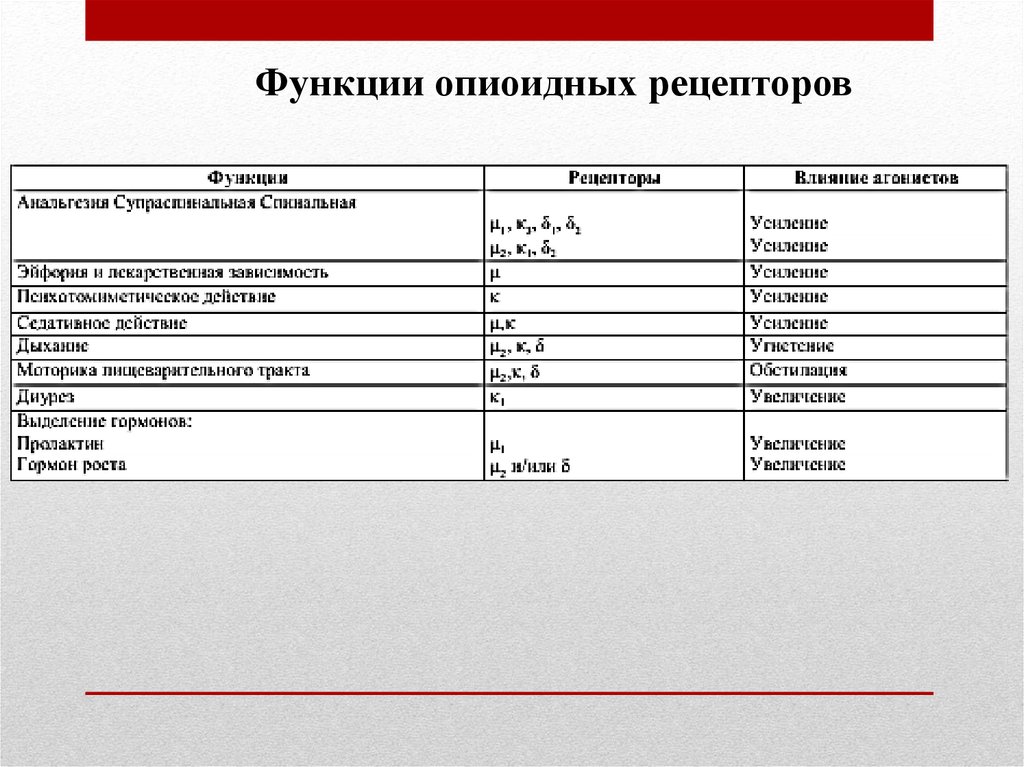
Функции опиоидных рецепторов13.
2. Природнымисточником наркотических анальгетиков
является опий (греч. opos — сок) —высохший млечный сок
снотворного мака (Papaver somniferum). Родина
этого
растения — Малая Азия.
Впервые опий упоминается в
клинописных табличках Шумера
(IV тысячелетие
до
н. э.).
Действие опия на человека описал
греческий врач Теофраст (372 —
287 до н.э.). В Средние века
популярность
опия
как
обезболивающего
средства
возродили Парацельс (1493 —
1541) и Томас Сиденхем (1624 —
1689).
14.
• В состав опия входят алкалоиды (20 %) и балластные вещества (сапонины).• Алкалоиды опия
изохинолина.
представляют
собой
производные
фенантрена
и
• Структуру фенантрена имеют морфин (10%), кодеин (0,5 %) и тебаин (0,2 %).
Из них анальгетиками являются морфин и кодеин (греч. kodeia — маковая
головка).
• Производные изохинолина папаперин (1 %), носкапин (6 %), лауданозин
проявляют свойства миотропных спазмолитиков.
• Морфин был выделен из опия ганноверским фармацевтом Вильгельмом
Сертюрнером в 1806 г. Название алкалоида дано по имени Морфея —
древнегреческого крылатого бога сна, сына Гипноса (греч. morphe —форма, так
как бог являлся в сновидениях в образах людей, животных и природных стихий).
• Термином «опиаты» обозначают только природные вещества, получаемые из
опия (морфин, кодеин). К опиоидам относят синтетические препараты
наркотических анальгетиков.
15.
Агонисты и антагонисты опиатных рецепторовПримечание.
1 — DAMGO — [D-Ала2-Мет-Фен4-Гли (ол)5] энкефалин
2 — СТОР — D-Фен-Цис-Тир-D-Трп-Орн-Тре-Пен-Тре-NH2
3 — Nor-BNI — нор-биналторфимин
4 — DPDPE — [D-Пен2-D-Пен5] энкефалин
16.
МЕХАНИЗМЫ ОБЕЗБОЛИВАЮЩЕГО ДЕЙСТВИЯНаркотические анальгетики являются лигандами опиоидных рецепторов
подобно эндогенным опиоидным пептидам. Они потенцируют тормозящее
влияние опиоидной антиноцицептивной системы на проведение болевых
импульсов, преимущественно
в
центральной
части неспецифической
проекционной системы.
Наркотические анальгетики нарушают в задних рогах спинного мозга
выделение медиаторов боли из окончаний аксона первого чувствительного
нейрона (его
тело
находится
в спинальном ганглии), вызывают
гиперполяризацию нейронов задних рогов; усиливают нисходящий тормозящий
контроль над деятельностью спинного мозга, реализуемый через систему
вставочных нейронов (медиаторы — серотонин и глицин).
Анальгетики подавляют суммацию болевых импульсов в таламусе. В малых
дозах они легче устраняют подпороговую, ноющую, чем острую боль.
Уменьшают активацию болевыми импульсами эмоциональных и вегетативных
центров гипоталамуса, лимбической системы и коры больших полушарий,
ослабляют отрицательную эмоциональную и психическую оценки боли.
17.
Классификация лекарственных средств,влияющих на опиоидные рецепторы
· анальгетики — полные агонисты (преимущественно µ-опиоидных
рецепторов);
·анальгетики с комбинированным действием — частичные
(парциальные) агонисты µ-опиоидных рецепторов
со
свойствами
агонистов или антагонистов к-опиоидных рецепторов (средства этой
группы слабее угнетают дыхательный центр и обладают меньшим
наркогенным потенциалом);
· антагонисты опиоидных рецепторов.
18.
КлассификацияI. Полные агонисты опиоидных рецепторов
а. Природные (опиаты) - мю- и каппа агонисты:
Морфин (1% - 1,0), Омнопон (1% - 1,0).
Этилморфин (Дионин) - анальгезия слабее морфинной в 5-7
раз.
Метилморфин (Кодеин) - слабее морфина в 5-7 раз.
б. Синтетические (опиоиды) – мю-агонисты:
Пиперидины –
Тримеперидин (Промедол-2%-1,0) - слабее в 3-4 раза.
Фентанил, Ремифентанил (Ултива), Пиритрамид (Дипидолор)
– сильнее в 100-300 раз.
Циклогексаноны - Трамадол (150 мг) - слабее в 3-4 р.
Длительного действия - Метадон.
19.
II. Опиоиды с комбинированным действиемПроизводные фенантрена –
Бупренорфин (Бутранол, Норфин) - частичный (парциальный)
мю-агонист, каппа-антагонист– сильнее в 25-50 раз.
Буторфанол (Морадол, Стадол) - частичный мю-агонист и
каппа-агонист– сильнее в 5-раз.
Налорфин, Налбуфин (Нубаин) - мю-антагонист и каппаагонист– обезболивающий эффект такой же, как и у морфина.
Производные бензоморфана –
Пентазоцин (Лексир, Фортрал) - частичный мю-агонист, каппаагонист– слабее в 3-4 раза.
III. Антагонисты опиатных рецепторов
Мю-, каппа-, дельта- антагонисты
Налоксон (Наркан, 2-4 часа), Налтрибен (дельта-2)
Налтрексон (24 часа)
20.
Наркотическиеанальгетики
и их
антагонисты
Примечание.
Влияние на
опиоидные
рецепторы:
+ полный
агонист;
Ч — частичный
агонист;
— антагонист;
? действие не
установлено.
21.
Центральные эффекты :1. Анальгезия - при любых видах боли (малоэффективны при фантомных болях)
2. Подавление кашлевого рефлекса (быстрое привыкание).
3. Эйфория
4. Появление привыкания (даже после однократного приема).
Физическая зависимость проявляется абстинентным синдромом (синдром лишения).
Развивается при прекращении повторных приемов наркотика (угнетение выработки
эндогенных лигандов опиатных рецепторов)
5. Седативный эффект – сонливость
6. Угнетение дыхания - подавление реакции дыхательного центра на двуокись
углерода. Дыхание редкое и глубокое при терапевтических дозах. В токсических
дозах - очень редкое поверхностное дыхание, вплоть до полной его остановки.
7. Повышение тонуса скелетных мышц
8. Снижение температуры тела ниже нормы
(снижение теплопродукции).
9. Тошнота и рвота (усиливающиеся при движении) –активация триггерной
хеморецепторной зоны рвотного центра в продолговатом мозге.
10. Миоз (сужение зрачков)характерный признак приема наркотиков !
22.
Периферические эффекты :1. На вегетативную систему:
Активация биосинтеза и выделения ацетилхолина, серотонина и
гистамина – сухость во рту, расширение сосудов
конъюнктивы глаз, покраснение и зуд кожи.
2. На сердечно-сосудистую систему:
- угнетение проводимости миокарда - брадикардия,
- увеличение мозгового кровотока - головная боль.
3. На ЖКТ: запор + колики.
4. На мочеполовую систему:
снижение почечного кровотока, активация секреции и
высвобождения антидиуретического гормона, повышение
тонуса сфинктеров мочевого пузыря и мочеточников
(уменьшение образования мочи и задержка мочи).
5. На миометрий: снижение тонуса мускулатуры матки
23.
Морфин – производное фенантрена, основной алкалоидопия (10% концентрации).
Выделен из опия в 1806 году ганноверским фармацевтом
Сертюрнером, который назвал его по имени
древнегреческого бога сновидений Морфея (Morpheus,
греч. morphe – форма, образ людей, животных и
природных стихий), сына бога сна Гипноса.
Химическая структура морфина была установлена в
1925 году, а в 1952 году был осуществлен его синтез
(в промышленных масштабах более целесообразно его
получение из растительного сырья).
24.
Морфин (как и все другие опиаты) –хорошо всасывается из ЖКТ,
со слизистых оболочек полости носа,
из подкожной клетчатки, из мышц.
Накапливается в активно
кровоснабжающихся органах и тканях –
печень, легкие, селезенка, скелетные
мышцы.
25.
Морфин – плохо преодолевает тканевыебарьеры, но при ацетилировании в
организме двух гидроксильных групп
превращается в активный метаболит –
диацетилморфин (героин).
Героин – хорошо проникает через ГЭБ.
В мозге диацетилморфин гидролизуется до
моноацетилморфина, и далее – до морфина.
Героин: в США – 1 млн. потребителей, в 2 раза дороже золота по весу.
Самое наркогенное вещество – -метил-фентанил (наркогенный
потенциал в 600 раз больше, чем у морфина).
26.
НАЧАЛО ДЕЙСТВИЯ МОРФИНА –через 10-15 минут после введения под кожу,
и через 20-30 минут после приема внутрь.
Пик концентрации в плазме - через 10-30 минут после
п/к введения и через 1-2 часа после приема внутрь.
Действие однократной дозы - 3-5 часов.
Период полувыведения - 2-3 часа при приеме внутрь.
Т1/2 = 2-3 часа
Т действия = 3-5 часов
Тmax = 1-2 часа
27.
В молекуле морфина - две свободныхгидроксильных группы - легко конъюгируют
с глюкуроновой кислотой.
Морфин-глюкуронид
обладает
более
выраженным анальгетическим эффектом
по сравнению с морфином.
28.
При почечной недостаточности - накоплениеактивных метаболитов длительная
выраженная анальгезия.
Морфин, как и всех опиаты, на 85%
превращается в полярные метаболиты,
которые затем быстро экскретируются
почками.
9-12% морфина - выводится в неизмененном
виде.
29.
7-10% глюкуронидов морфина - экскретируется в желчьи поступает в просвет желудка, откуда может снова
всосаться в кровь, или (при лечении отравления
морфином) может быть удален (промыванием желудка),
или инактивирован (раствором калия перманганата).
Глюкурониды
морфина
Инактивация
в желудке
Показания к применению морфина: выраженные
болевые синдромы (онкологические больные, операции,
тяжелые травмы, инфаркт миокарда), отек легких (с целью
урежения дыхания).
30.
Противопоказания:1. Дыхательная недостаточность,
2. Паралитические, спастические и обструктивные
заболевания ЖКТ,
3. Детский (и старше 60 лет) возраст,
4. Беременность,
5. Черепно-мозговая травма и хирургические заболевания
органов брюшной полости (до установления диагноза).
Побочные эффекты: лекарственная зависимость,
тошнота, запор, миоз, гипотония, угнетение дыхательного
центра, спазм гладкой мускулатуры.
31.
Омнопон– смесь алкалоидов опия
(морфин, кодеин, наркотин, папаверин и тебаин).
По фармакологическим свойствам близок к морфину.
За счет папаверина обладает спазмолитическим
действием на гладкомышечные органы.
Кодеин
(метилморфин) – производное фенантрена,
алкалоид опия (0,5% концентрации), синтезируется из
морфина. Обладает всеми свойствами наркотических
анальгетиков.
По сравнению с морфином, кодеин в большей степени
угнетает кашлевой рефлекс
32.
Синтетические наркотическиеанальгетики
Тримеперидин
(промедол) – синтетический
опиоид, производное N-метилпиперидина (гидрохлорид1,2,4-триметил-4-пропионилокси-4-фенилпиперидин),
оригинальный
отечественный
наркотический
анальгетик, синтезированный в 50-х годах XX века в
Институте органической химии АН СССР.
33.
В отличие от морфина:1. Меньше угнетает дыхательный центр (поэтому может
быть использован при беременности, в родах, и у детей),
2. Повышает тонус маточной мускулатуры,
3. Оказывает спазмолитический эффект (поэтому может
использоваться при почечных и печеночных коликах).
Показания: выраженный болевой синдром (травмы,
злокачественные новообразования, послеоперационный период
и др.), подготовка к операции, роды.
Противопоказания: дыхательная недостаточность.
Побочные действия: тошнота, рвота, слабость,
головокружение. Возможно развитие зависимости.
34.
Фентанил – производное фенилпиперидина, полныйагонист опиатных рецепторов.
Высоко липофильный быстро проникает в ткани
мозга. Накапливается в жировой ткани и медленному
метаболизму.
Применяется парентерально (внутривенно) для быстрого
обезболивания перед и во время хирургической операции,
во время инфаркта миокарда, назначая в комбинации с
нейролептиком дроперидолом (нейролептаналгезия).
Показания: премедикация перед хирургическими
операциями, осуществление вводного наркоза,
послеоперационная анестезия, нейролептанальгезия.
35.
Метадон – производное фенил-гептил-амина.По сравнению с морфином:
- оказывает более длительный эффект,
- медленнее вызывает привыкание и физическую
зависимость.
- вызывает менее выраженную (мягкую), но более
длительную абстиненцию
Примененяется для детоксикации и поддерживающего
лечения героиновых наркоманов с частыми рецидивами.
Левометадила ацетат (1- -ацетил-метадон)
Еще более длительное действие (внутрь один раз в 2-3 дня).
Наиболее целесообразен для детоксикации в клиниках.
36.
Пентазоцин – производное бензоморфанов.Синтетический наркотический анальгетик, агонистантагонист опиоидных рецепторов.
Способен вытеснять морфин из связи с опиатными
рецепторами.
Вызывает абстинентный синдром у лиц с физической
зависимостью к наркотическим анальгетикам.
37.
Антагонисты наркотическиханальгетиков
Налоксон – производное фенантрена.
Полный конкурентный антагонист , , и -опиатных рецепторов,
вытесняет агонисты из связи с ними.
Вызывает абстиненцию у опиатных и героиновых наркоманов.
Показания: интоксикация наркотическими анальгетиками
(тяжелой степени) для конкурентного вытеснения их из связи с
дыхательным центром.
Противопоказания:
гиперчувствительность
38.
ПРОТИВОКАШЛЕВЫЕ СРЕДСТВА –это ЛС, останавливающие кашель.
Применяются при воспалительных
дыхательных путей, легких и плевры.
заболеваниях
верхних
1. Центрального наркотического действия
(угнетают активность нейронов кашлевого центра)
Кодеин, Этилморфин (Дионин) - в Перечне
2. Центрального ненаркотического действия
(не активируют опиатную систему, не вызывают зависимости) Глауцина гидрохлорид, Окселадина цитрат (Тусупрекс)
3. Периферического действия
(местные анестетики, снижают чувствительность слизистой
дыхательных путей) - Преноксдиазина гидрохлорид (Либексин)
- действует 3-4 часа
39.
Отхаркивающие ЛСАцетилцистеин (АЦЦ),
Месна, Мукалтин
(муколитики)
Бромгексин,
–Амброксол,
Гвайфенезин,
Сурфактанты (недоношенным детям)
Порактант альфа (Куросурф), Экзосурф
Окселадина цитрат (Тусупрекс)
Глауцина гидрохлорид
Преноксдиазина гидрохлорид (Либексин)
40.
3. Ненаркотические анальгетики— нестероидные
противовоспалительные средства (НПВС) оказывают противовоспалительное,
жаропонижающее и обезболивающее действие, не вызывая пристрастия и
лекарственной
зависимости. Их
основным
эффектом
является
неспецифический
противовоспалительный
—
способность
подавлять
воспаление любой этиологии.
В 1971 г. Джон Роберт Вейн с сотрудниками открыли, что НПВС обратимо
или необратимо ингибируют циклоксигеназу (ЦОГ) различных тканей и
таким образом уменьшают продукцию простагландинов (ПГ).
Фосфолипиды клеточных мембран под влиянием фосфолипазы А2
освобождают арахидоновую кислоту, которая затем подвергается окислению
и циклизации в эндопероксиды (ПГG2, ПГН2) ферментом ЦОГ. Дальнейшее
превращение нестабильных эндопероксидов в стабильные ПГ катализирует
изомераза.
41.
42.
Изоферменты ЦОГЦОГ-1 как структурный (конституциональный) фермент постоянно
присутствует в эндоплазматическом ретикулуме клеток (за исключением
эритроцитов). Она участвует в продукции ПГ, регулирующих физиологические
процессы в организме, например, катализирует образование простациклина
(вазодилататор и антиагрегант), гастропротективных простагландинов, а также
простагландинов, повышающих почечный кровоток, клубочковую фильтрацию,
выведение ионов и воды .
ЦОГ-2 - фермент эндоплазматического ретикулума и ядерной мембраны,
является структурным только в головном мозге, почках, костях, репродуктивной
системе у женщин (регулирует овуляцию). Активность ЦОГ-2 в 10 — 80 раз
возрастает при воспалении, что втрое повышает уровень ПГ в воспаленной ткани.
Индукторами ЦОГ-2 являются цитокины — интерлейкин-1, фактор некроза
опухоли-α, а также бактериальные липополисахариды, ингибиторами —
глюкокортикоиды и интерлейкин-4.
43.
Образуемые под влиянием ЦОГ-2 ПГ принимают участие в развитии ипрогрессировании острого и хронического воспаления. ПГЕ2, расширяя
артериолы, увеличивает приток крови в зону воспаления. Напротив, ПГF2a
суживает вены и затрудняет отток крови.
В итоге капилляры очага воспаления
расширяются, возрастает
их
проницаемость, развивается экссудация.
Кроме того, ПГ потенцируют действие других медиаторов воспаления —
гистамина, серотонина, брадикинина, увеличивают
выход
ферментов
лизосом, активируют ферменты резорбции костной ткани — коллагеназу и
металлопротеиназы.
44.
Классификация ненаркотическиханальгетиков
— НПВС по степени избирательного ингибирования
изоферментов ЦОГ:
· избирательные ингибиторы ЦОГ-1 — ацетилсалициловая кислота в малых дозах;
· неизбирательные ингибиторы ЦОГ — большинство НПВС;
· преимущественно избирательные ингибиторы ЦОГ-2 — мелоксикам, набуметон,
нимесулид, ацеклофенак в малых дозах;
· специфические ингибиторы ЦОГ-2 — целекоксиб;
· ингибиторы ЦОГ в ЦНС — парацетамол.
45.
Парацетамол ингибирует ЦОГ-3 в ЦНС, препятствуя активациифермента перекисными продуктами. Он обладает жаропонижающим и
обезболивающим эффектами и лишен противовоспалительных свойств (в
нейтрофилах и макрофагах очага воспаления образуется большое количество
продуктов перекисного окисления).
При поступлении в организм парацетамола в токсической дозе (10 — 15 г)
функция
систем
конъюгации
оказывается
недостаточной, поэтому
значительная часть молекул преобразуется в токсические вещества, которые
инициируют перекисное окисление липидов и ковалентно связываются с
биомакромолекулами гепатоцитов. Развивается центролобулярный некроз.
Клинически он протекает в виде печеночной недостаточности (ацидоз,
энцефалопатия, отек мозга, кровотечения). В самых тяжелых случаях
присоединяются почечная недостаточность, сепсис. Специфический антидот
при
отравлении
парацетамолом — химический антагонист Nацетилцистеин. Может понадобиться пересадка печени.
У детей в возрасте до 12 лет система цитохрома Р-450 функционирует не в
полной мере, преобладает конъюгация парацетамола с серной кислотой.
46.
4. Трамадол (трамал) состоит из двух энантиомеров. Одинэнантиомер взаимодействует с опиоидными µ- рецепторами, другой нарушает
нейрональный захват норадреналина и в меньшей степени — серотонина.
Оба энантиомера повышают выделение серотонина из пресинаптических
окончаний. В результате этих эффектов трамадол усиливает сегментарное и
нисходящее
серотонинергическое тормозящее влияние на передачу
ноцицептивных импульсов в задних рогах спинного мозга.
Аффинитет к опиоидным рецепторам значительно меньше, чем у морфина.
Трамадол в 5-10 раз менее активен, чем морфин, однако по анальгетической
эффективности при применении в средних терапевтических дозах сопоставим с
агонистами опиоидных рецепторов. Мало влияет на дыхание и функции
пищеварительного тракта. Наркогенный потенциал у него значительно меньше,
чем у агонистов опиоидных рецепторов.













































 Медицина
Медицина








