Похожие презентации:
Ароматические углеводороды
1. Ароматические углеводороды
25.07.20182.
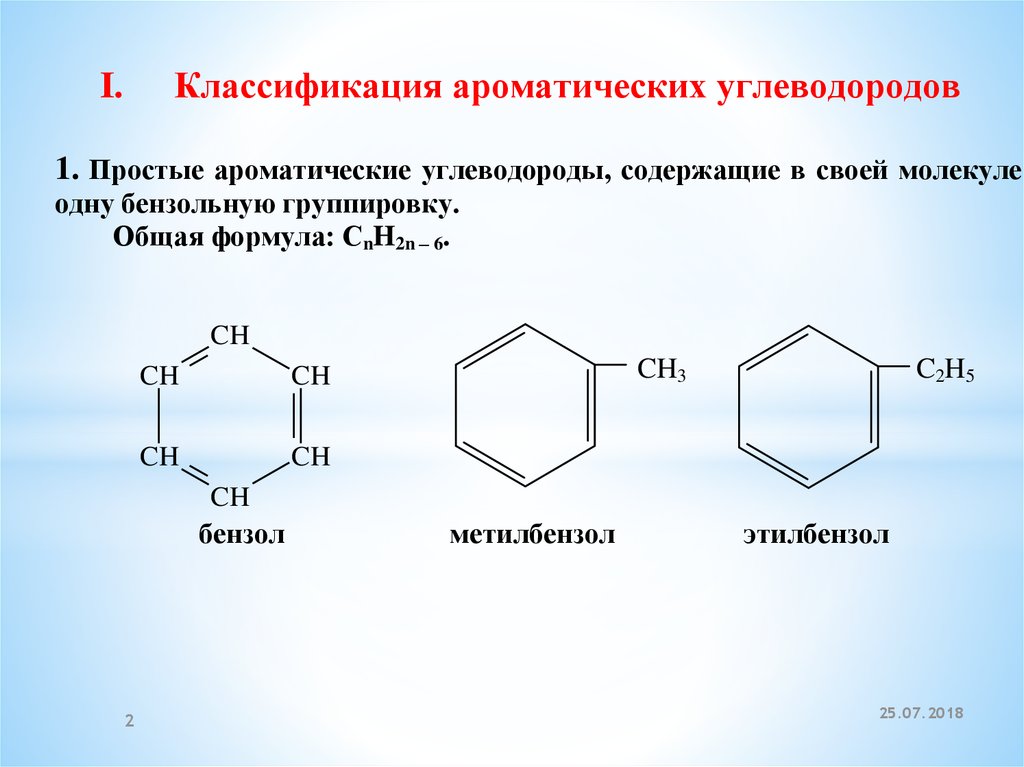
Классификация ароматических углеводородовI.
1. Простые ароматические углеводороды, содержащие в своей молекуле
одну бензольную группировку.
Общая формула: CnH2n – 6.
CH
CH
CH
CH
CH
CH
бензол
2
CH3
метилбензол
C2H5
этилбензол
25.07.2018
3.
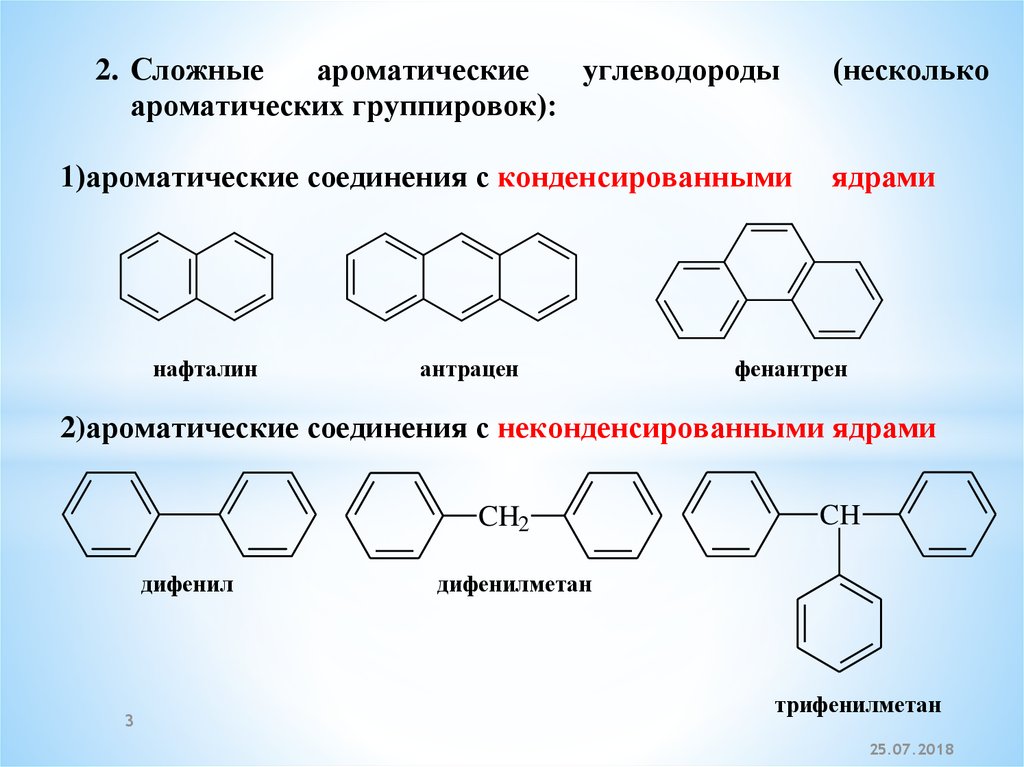
2. Сложныеароматические
углеводороды
ароматических группировок):
1)ароматические соединения с конденсированными
нафталин
антрацен
(несколько
ядрами
фенантрен
2)ароматические соединения с неконденсированными ядрами
CH2
дифенил
3
CH
дифенилметан
трифенилметан
25.07.2018
4.
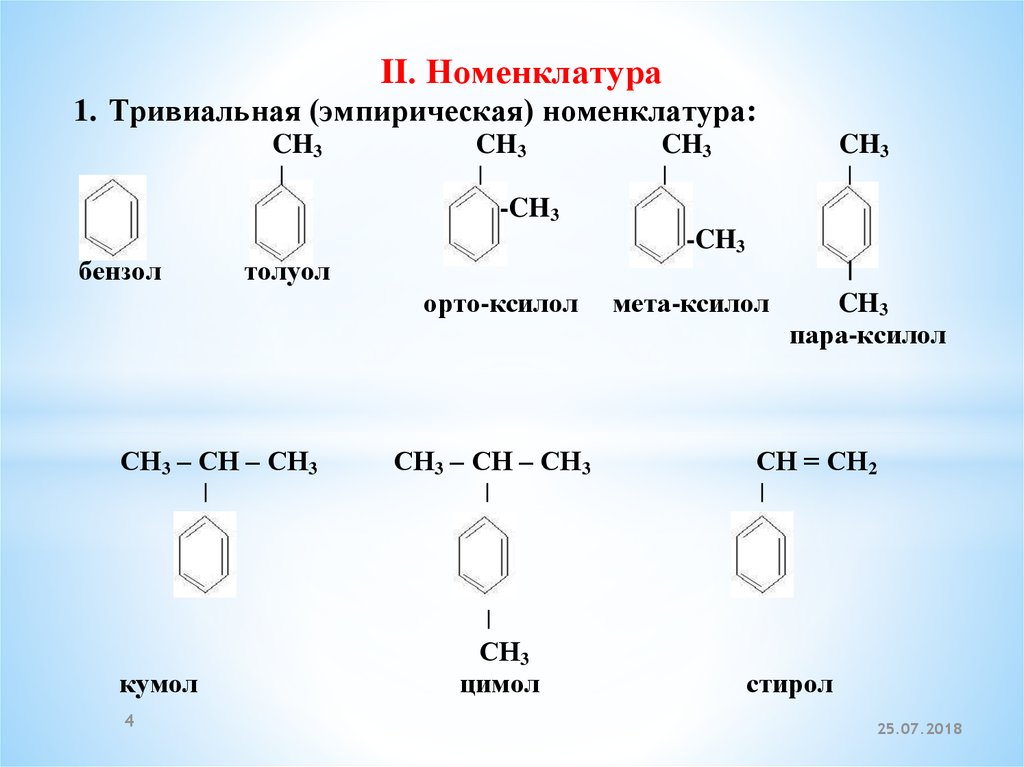
II. Номенклатура1. Тривиальная (эмпирическая) номенклатура:
CH3
|
бензол
CH3
|
-CH3
орто-ксилол
кумол
4
CH3
|
-CH3
толуол
СН3 – СН – СН3
|
CH3
|
СН3 – СН – СН3
|
|
СН3
цимол
|
мета-ксилол
CH3
пара-ксилол
СН = СН2
|
стирол
25.07.2018
5.
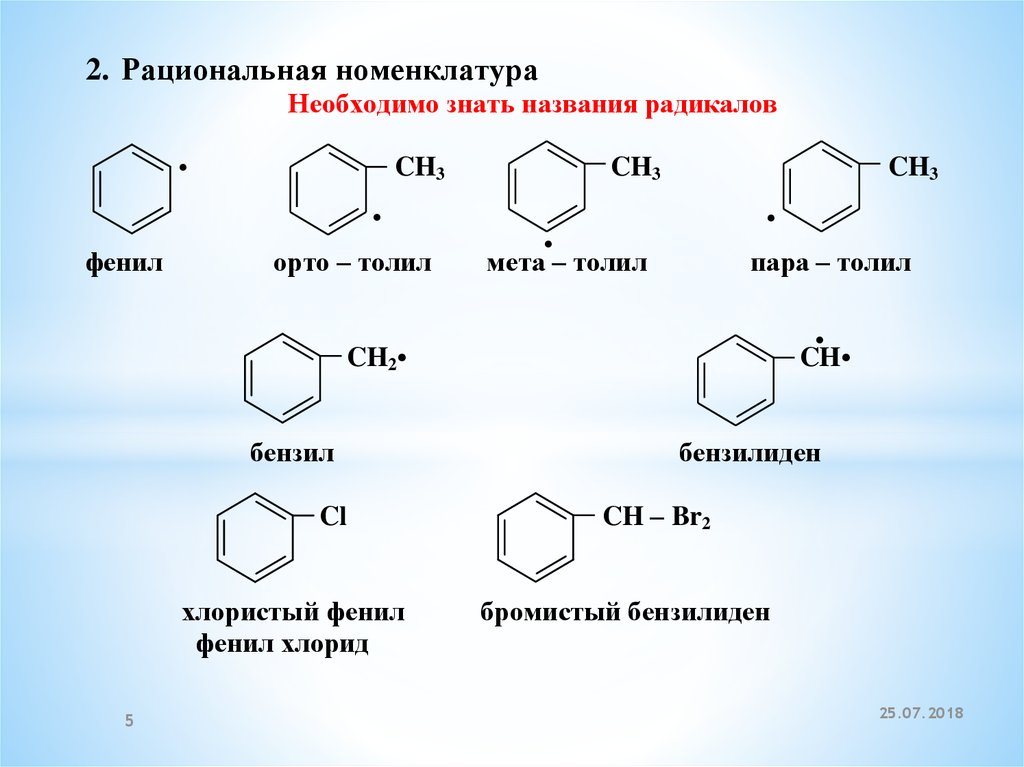
2. Рациональная номенклатураНеобходимо знать названия радикалов
CH3
фенил
орто – толил
CH3
CH3
мета – толил
пара – толил
CH
CH2
бензил
Cl
хлористый фенил
фенил хлорид
5
бензилиден
CH – Br2
бромистый бензилиден
25.07.2018
6.
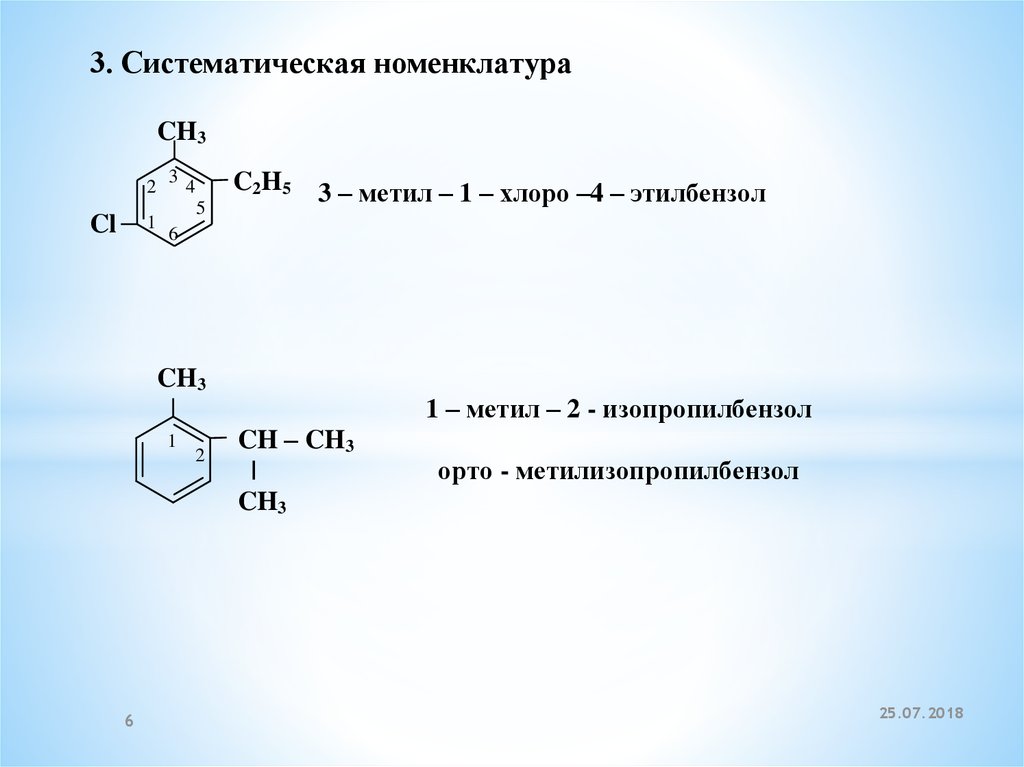
3. Систематическая номенклатураCH3
2
Cl
1
3
C2H5
4
5
3 – метил – 1 – хлоро –4 – этилбензол
6
CH3
1
6
2
1 – метил – 2 - изопропилбензол
CH – CH3
|
CH3
орто - метилизопропилбензол
25.07.2018
7.
III. Cпособы получения ароматических углеводородов1. Промышленные способы получения:
Фракции нефти:
Т кип. до 170ºC – легкое масло (содержит ароматические углеводороды
с одним бензольным кольцом);
Т кип. от 170 до 230ºC – среднее масло (содержит фенолы);
Т
кип.
от 230 до 270ºC – тяжелое масло (содержит нафталин и его
гомологи);
Т кип. от 270 до 340ºC – антраценовое масло (содержит антрацены).
7
25.07.2018
8.
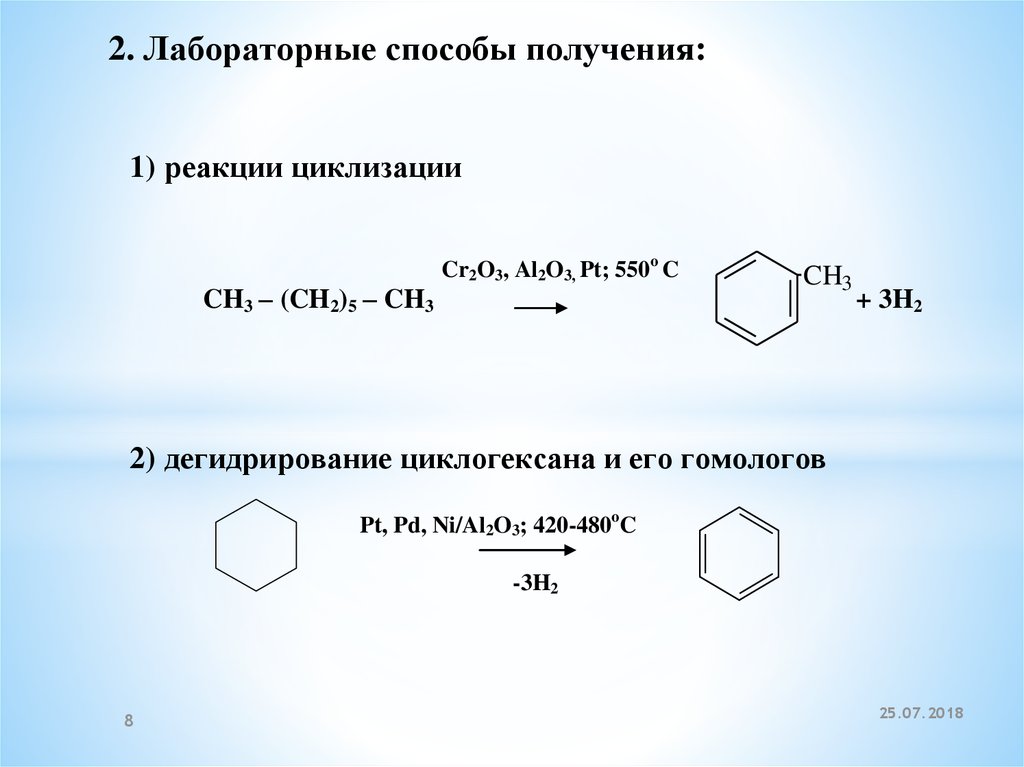
2. Лабораторные способы получения:1) реакции циклизации
CH3 – (CH2)5 – CH3
Cr2O3, Al2O3, Pt; 550o C
CH3
+ 3H2
2) дегидрирование циклогексана и его гомологов
Pt, Pd, Ni/Al2O3; 420-480oC
-3H2
8
25.07.2018
9.
3) тримеризация ацетилена3CH ≡ CH
М.Бертло получал небольшие количества бензола,
пропуская через ацетилен электрический разряд.
С большим выходом ацетилен полимеризуется по
Н.Д. Зелинскому при пропускании газа над
активированным углём при 450-650оС
9
25.07.2018
10.
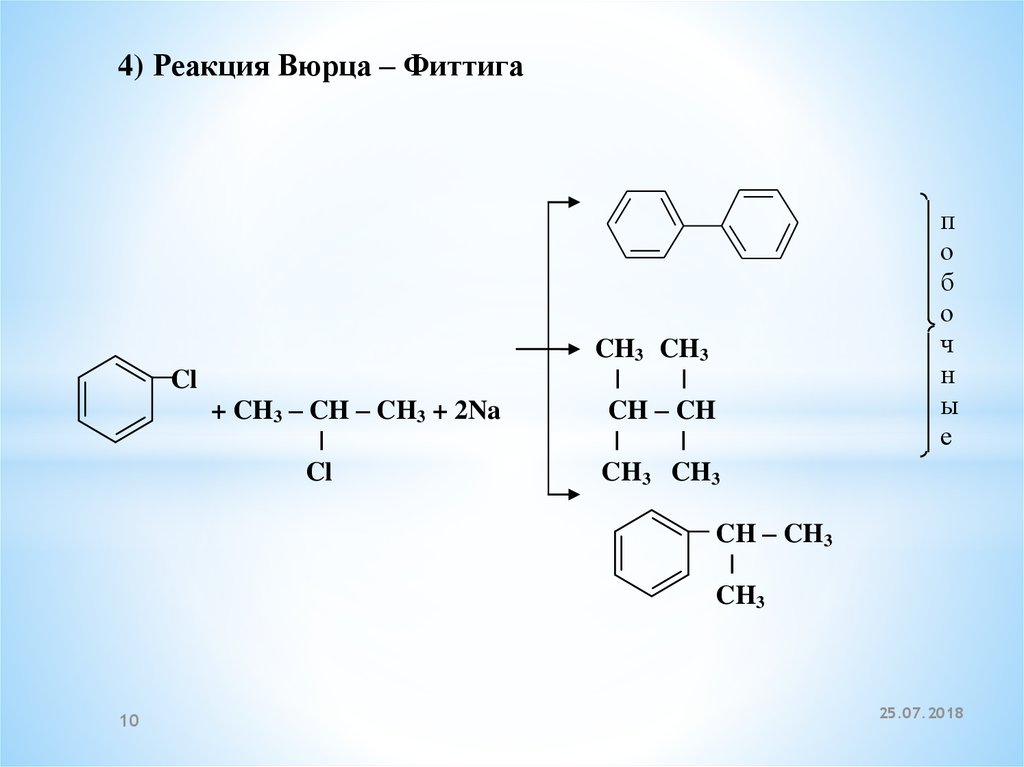
4) Реакция Вюрца – ФиттигаCl
+ CH3 – CH – CH3 + 2Na
|
Cl
CH3 CH3
|
|
CH – CH
|
|
CH3 CH3
п
о
б
о
ч
н
ы
е
CH – CH3
|
CH3
10
25.07.2018
11.
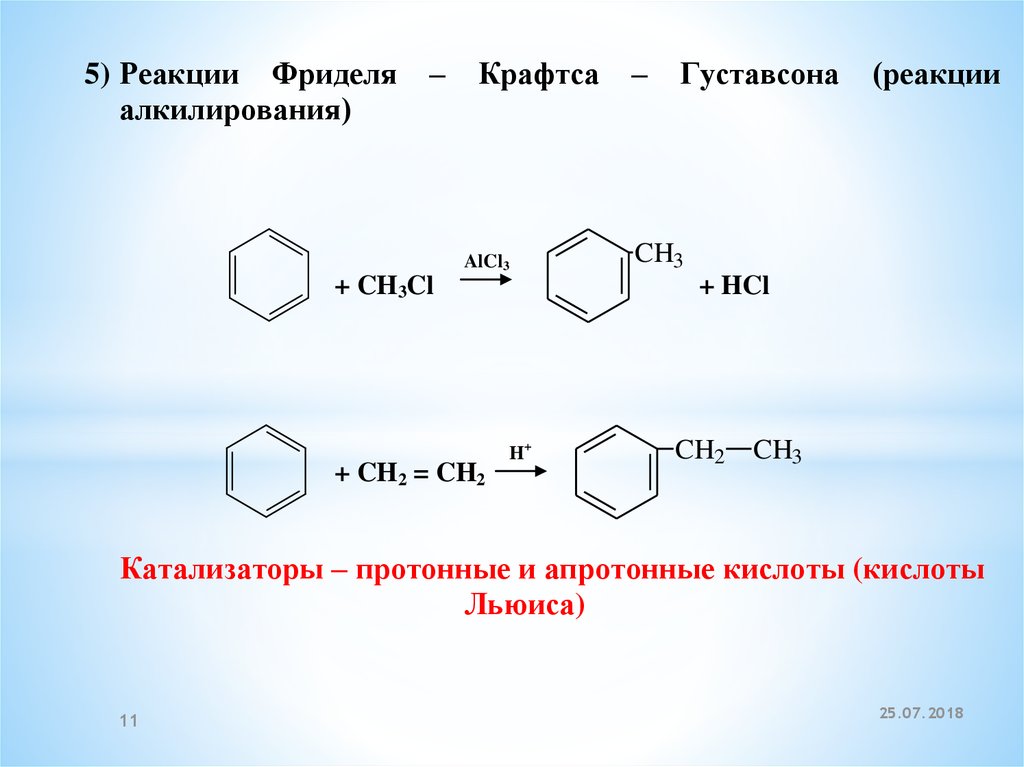
5) Реакции Фриделяалкилирования)
–
Крафтса
Густавсона
(реакции
CH3
AlCl3
+ CH3Cl
+ CH2 = CH2
–
+ HCl
H+
CH2
CH3
Катализаторы – протонные и апротонные кислоты (кислоты
Льюиса)
11
25.07.2018
12.
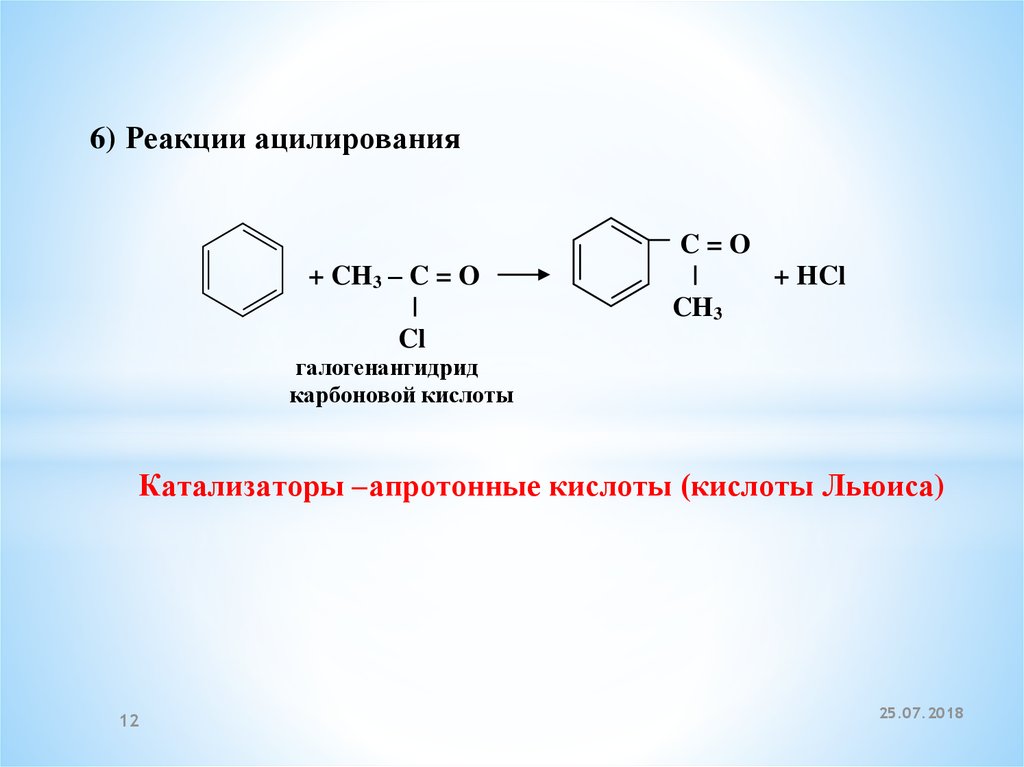
6) Реакции ацилирования+ CH3 – C = O
|
Cl
C=O
|
+ HCl
CH3
галогенангидрид
карбоновой кислоты
Катализаторы –апротонные кислоты (кислоты Льюиса)
12
25.07.2018
13.
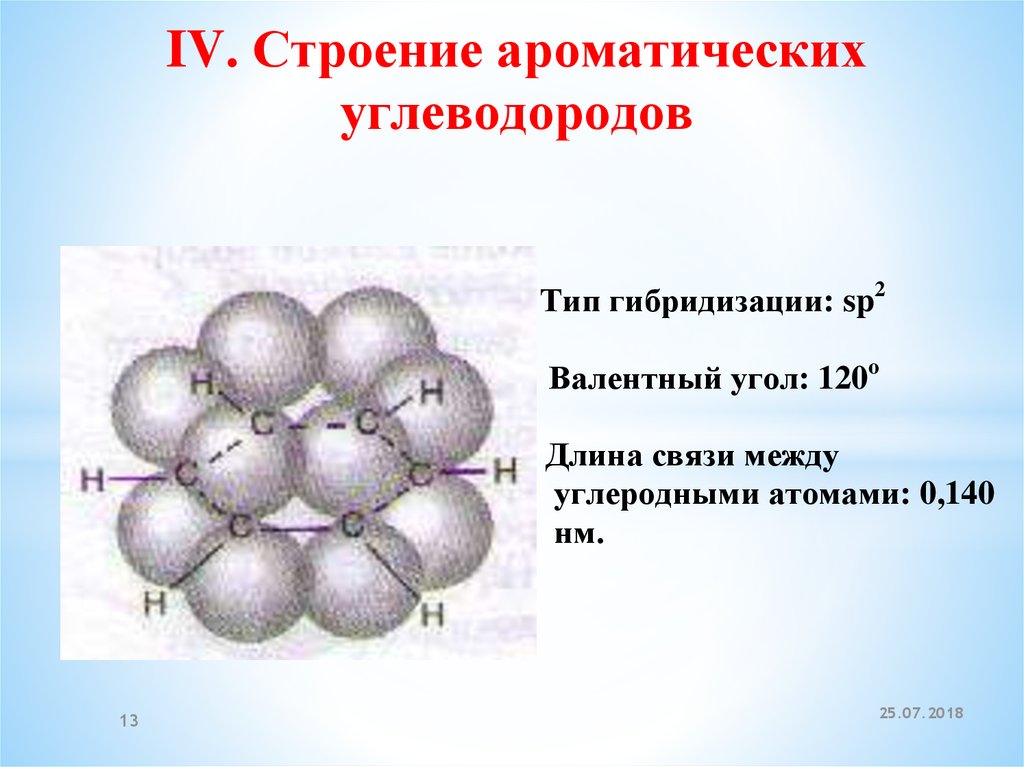
IV. Строение ароматическихуглеводородов
Тип гибридизации: sp2
Валентный угол: 120o
Длина связи между
углеродными атомами: 0,140
нм.
13
25.07.2018
14.
V. Химические свойства1.Реакции присоединения
2.Реакции электрофильного замещения
3.Реакции радикального замещения
4.Реакции окисления
14
25.07.2018
15.
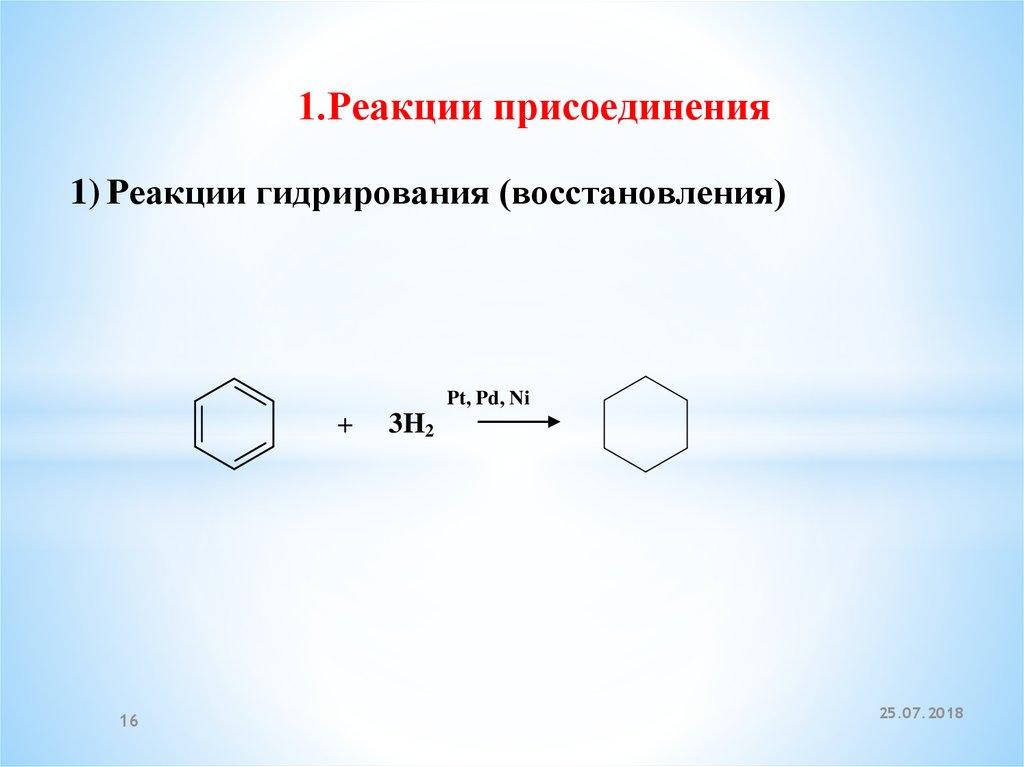
16.
1.Реакции присоединения1) Реакции гидрирования (восстановления)
Pt, Pd, Ni
+
16
3H2
25.07.2018
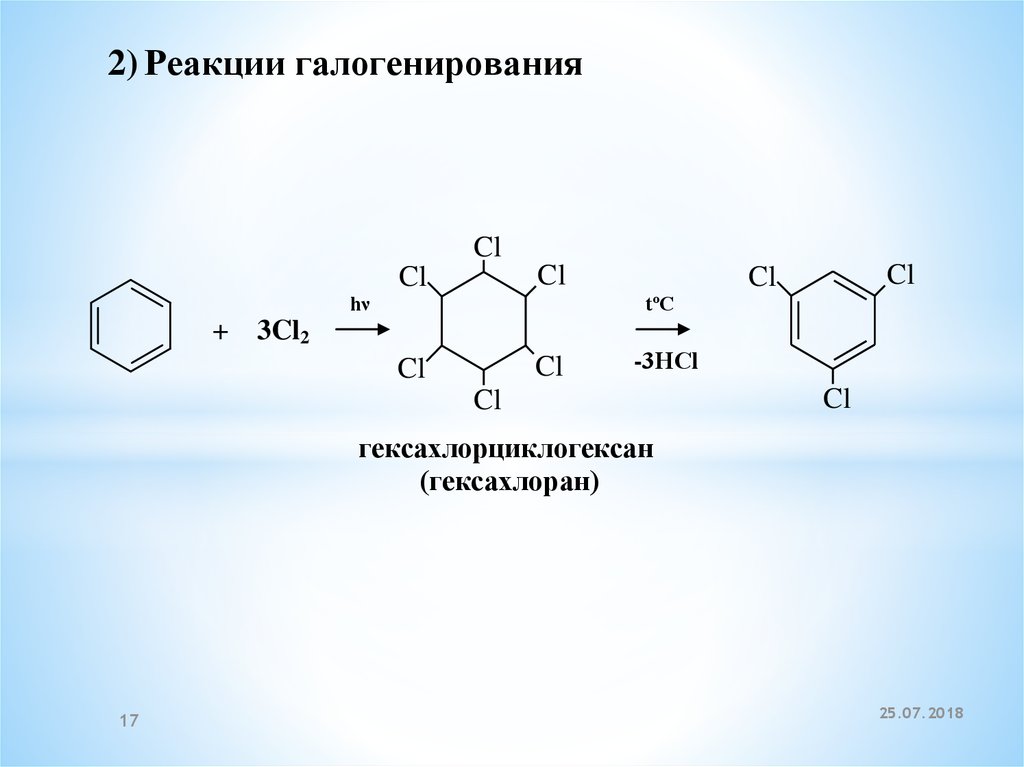
17.
2) Реакции галогенированияCl
hν
Cl
Cl
Cl
Cl
Cl
Cl
tºC
+ 3Cl2
-3НСl
Cl
Cl
гексахлорциклогексан
(гексахлоран)
17
25.07.2018
18.
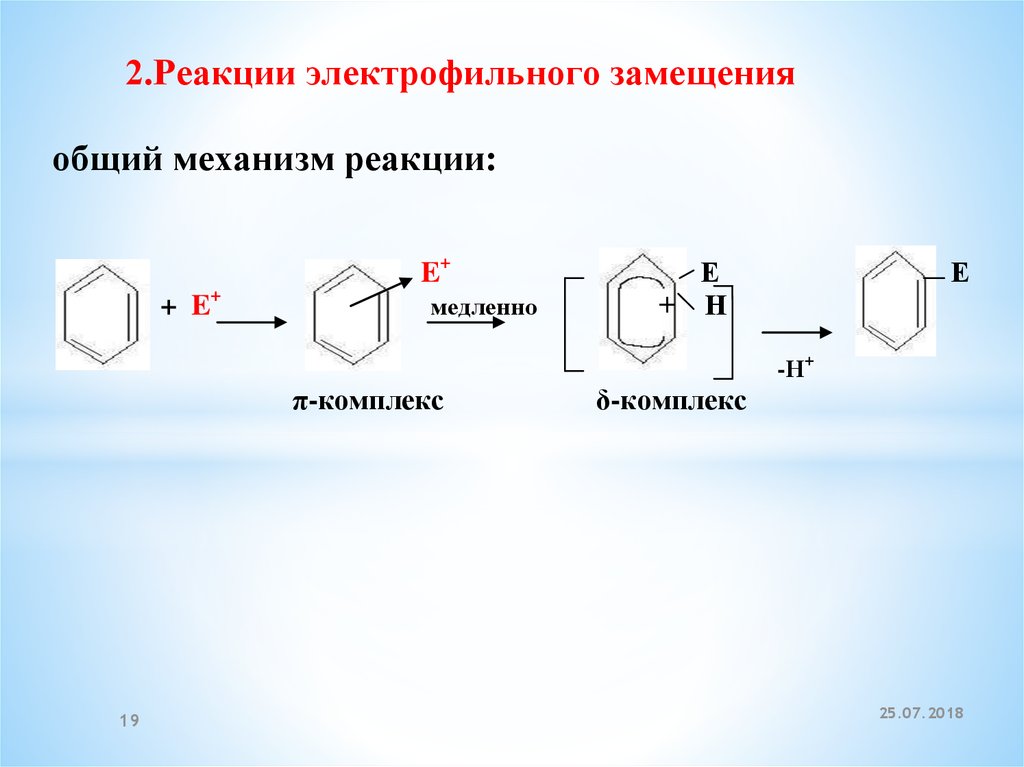
19.
2.Реакции электрофильного замещенияобщий механизм реакции:
E+
+ E+
медленно
Е
+ Н
Е
-Н+
π-комплекс
19
δ-комплекс
25.07.2018
20.
К реакциям электрофильного замещения относятсяследующие реакции:
1) реакции галогенирования;
2) реакции алкилирования:
а) алкилирование галогеналкилами;
б) алкилирование олефинами;
3) реакции нитрования;
4) реакции сульфирования;
5) реакции ацилирования.
20
25.07.2018
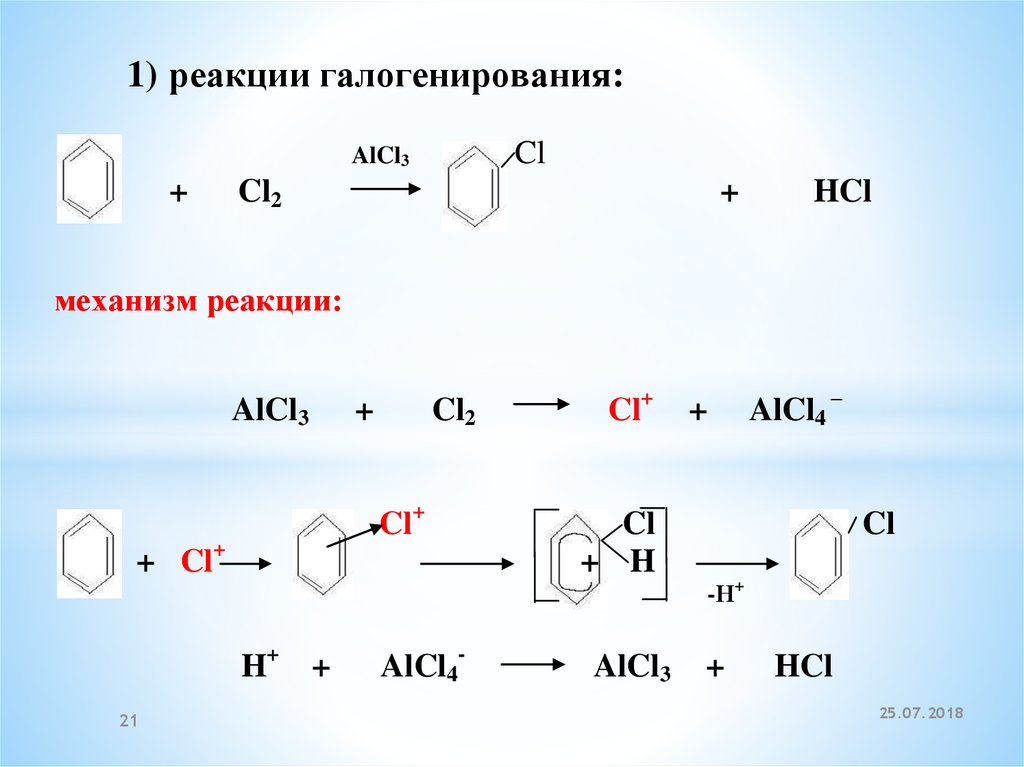
21.
1) реакции галогенирования:Cl
AlCl3
+
Cl2
+
HCl
механизм реакции:
AlCl3
+
Cl2
Cl+
+ Cl+
Cl+
+
AlCl4 –
Cl
+ H
Cl
-Н+
H+
21
+
AlCl4-
AlCl3
+
HCl
25.07.2018
22.
Бромирование бензола1. 2Fe
+ 3Br2 = 2FeBr3
2. C6H6 + Br2 = C6H5Br + HBr
бензол
3. HBr
бромбензол
+ синий лакмус
розовое окрашивание
кислота
4. HBr
+ AgNO3 = AgBr
5. NH3
+ НBr = NH4Br
+ HNO3
6. 2Na2CO3 + H2O + Br2 = 2NaHCO3 + NaBr +NaBrO
22
25.07.2018
23.
24.
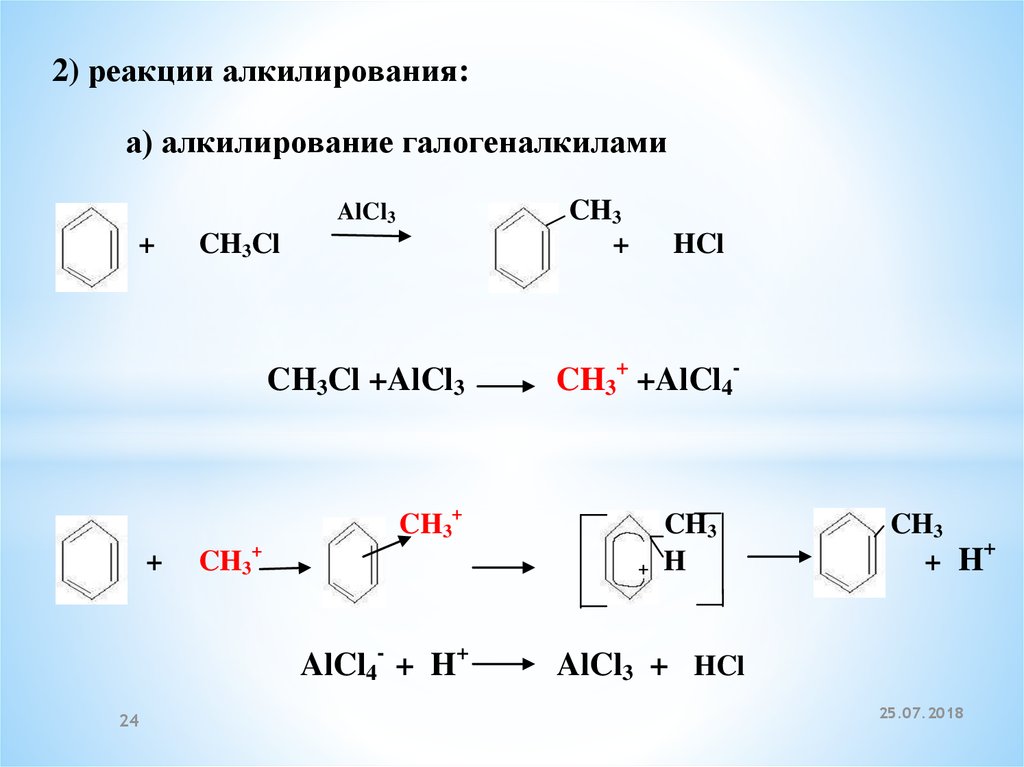
2) реакции алкилирования:а) алкилирование галогеналкилами
CH3
+
AlCl3
+
CH3Cl
CH3Cl +AlCl3
HCl
CH3+ +AlCl4-
CH3+
+
CH3+
+
AlCl4- + H+
24
CH3
H
CH3
+
+ H
AlCl3 + HCl
25.07.2018
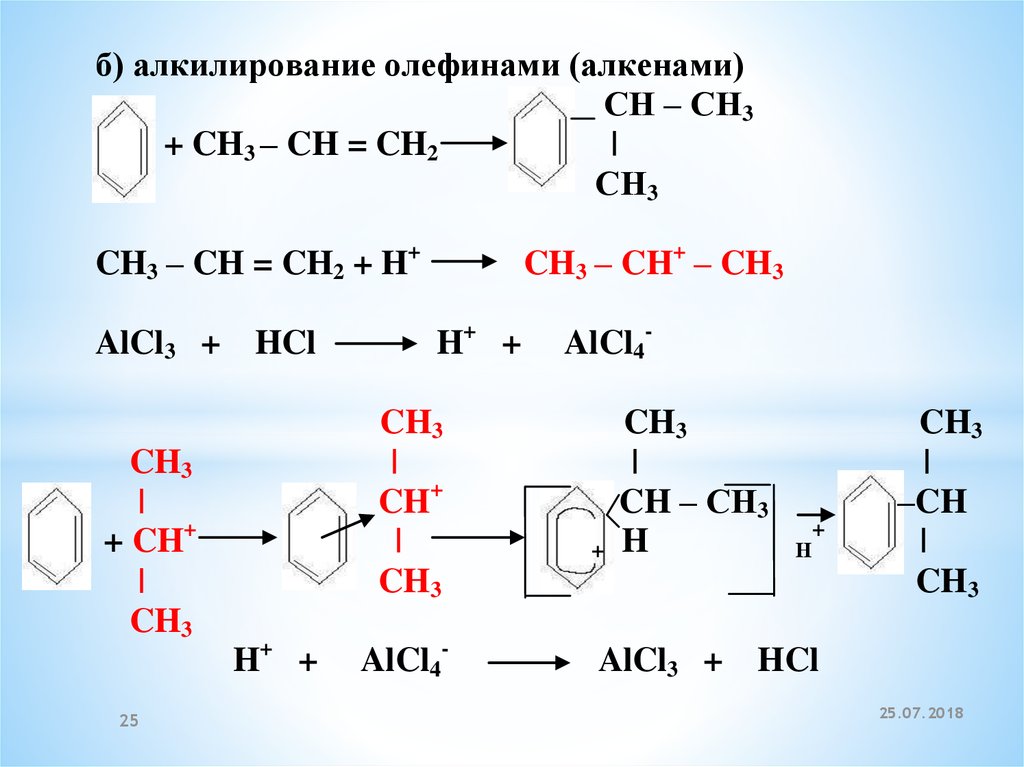
25.
б) алкилирование олефинами (алкенами)СН – СН3
+ CH3 – CH = CH2
|
СН3
CH3 – CH = CH2 + H+
AlCl3 + HCl
CH3
|
+ CH+
|
CH3
25
CH3 – CH+ – CH3
H+ +
CH3
|
CH+
|
CH3
H+ +
AlCl4-
AlCl4-
+
CH3
|
CH – СН3
H
+
Н
CH3
|
–CH
|
CH3
AlCl3 + HCl
25.07.2018
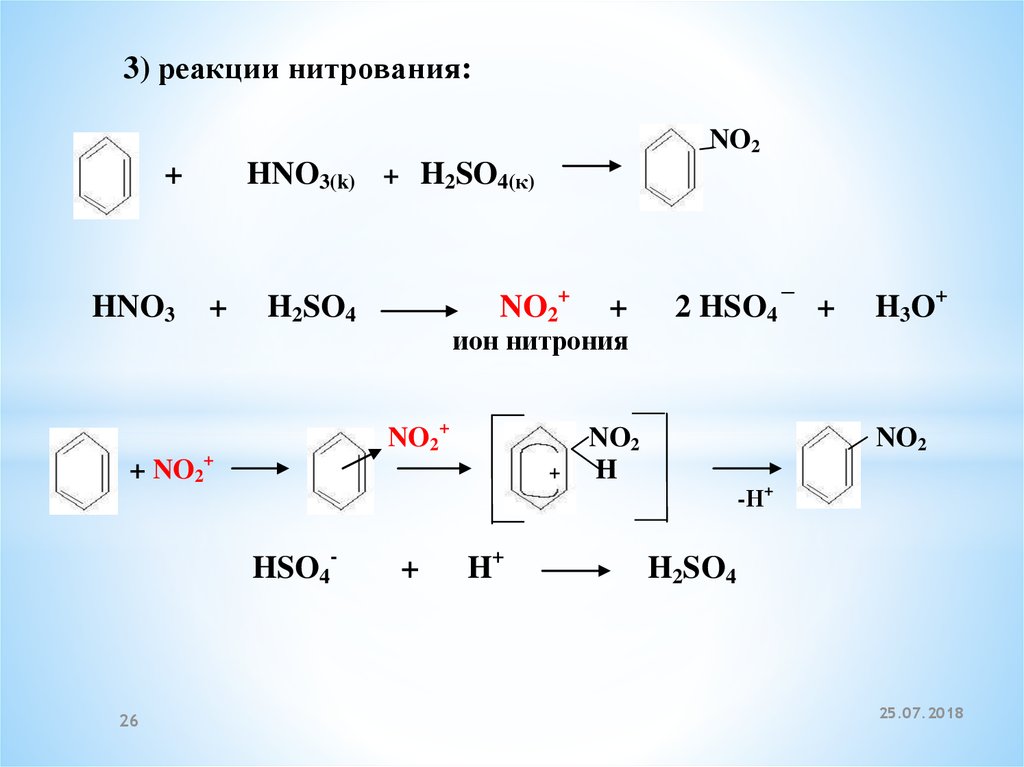
26.
3) реакции нитрования:NO2
+
HNO3
+ NO2
HNO3(k) + H2SO4(к)
+
+
+
ион нитрония
NO2+
+
2 HSO4
NO2
H
+
H3O+
NO2
-Н+
HSO4-
26
NO2+
H2SO4
+
H+
H2SO4
25.07.2018
27.
28.
4) реакции сульфирования:+
H2SO4
SO3H
HSO3 +
3H2SO4
SO3H+
+ SO3H+
+
+
H2 O
2HSO4- + H3O+
SO3H
+ H
SO3H
-H+
бензолсульфокислота
HSO428
+
H+
H2SO4
25.07.2018
29.
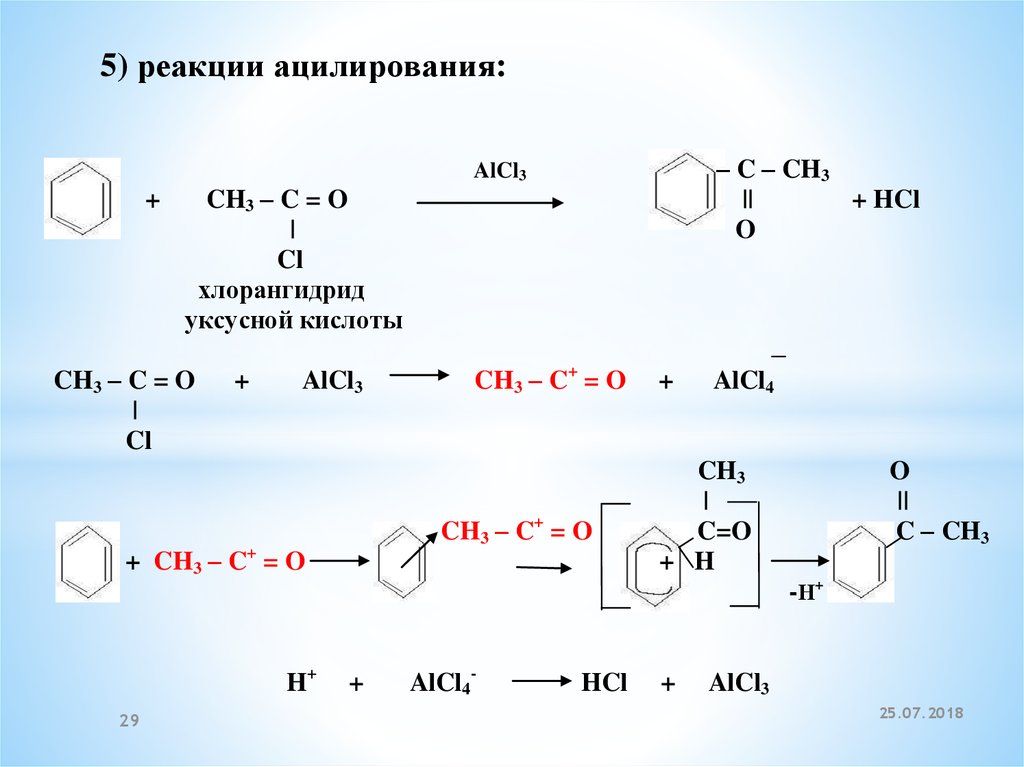
5) реакции ацилирования:– C – CH3
||
+ HCl
O
AlCl3
+
CH3 – C = O
|
Cl
хлорангидрид
уксусной кислоты
CH3 – C = O
|
Cl
+
AlCl3
CH3 – C+ = O
CH3 – C+ = O
+ CH3 – C+ = O
+
AlCl4
CH3
|
C=O
+ H
O
||
C – CH3
-Н +
H+
29
+
AlCl4-
HCl
+
AlCl3
25.07.2018
30.
на вхождение электрофильного агента в бензольноекольцо большое влияние оказывают атомы или группы
атомов уже имеющиеся при углероде бензольного
кольца
эти атомы или группы атомов называются
заместителями
30
25.07.2018
31.
Классификация заместителей1. Заместители первого рода (орто- и пара- ориентанты):
1) активирующие:
– :OH;
̶̶̶̶̶̶̶̶̶̶̶̶̶ :NH2;
–:NH – C = O;
|
R
31
̶̶̶̶̶̶̶̶̶̶̶̶̶ :NHR; –:NR2;
– С6Н5;
–:OR;
–R
25.07.2018
32.
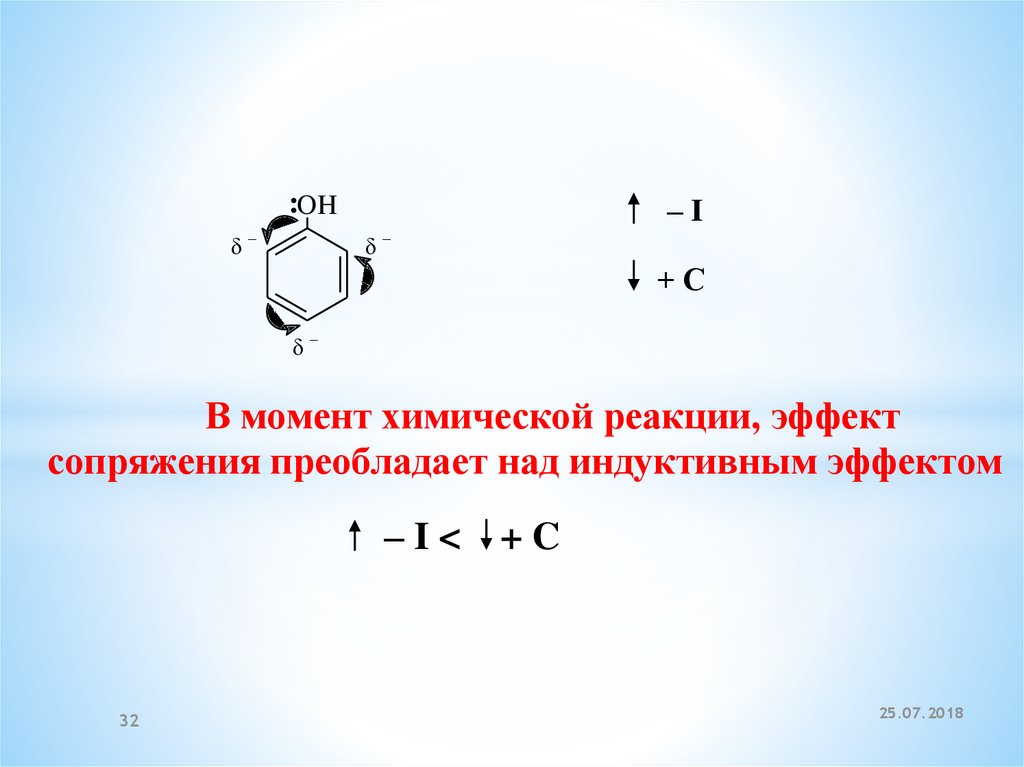
:OH–I
– –
+С
–
В момент химической реакции, эффект
сопряжения преобладает над индуктивным эффектом
–I<
32
+C
25.07.2018
33.
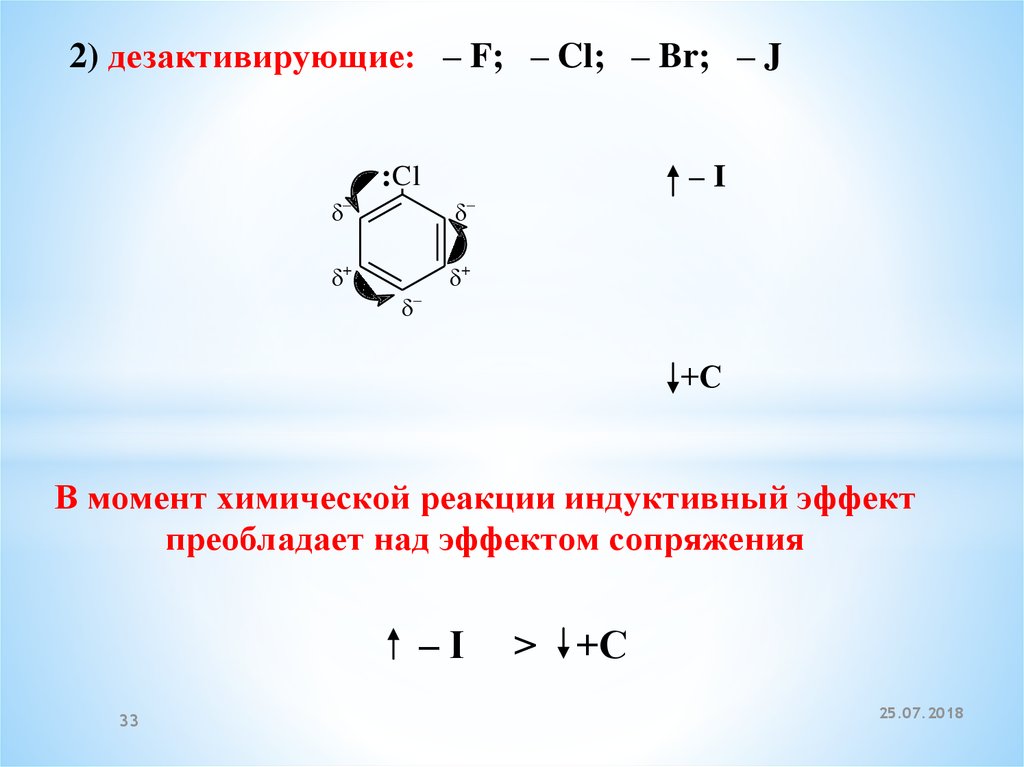
2) дезактивирующие: – F; – Cl; – Br; – J–I
:Cl
– –
+ +
–
+С
В момент химической реакции индуктивный эффект
преобладает над эффектом сопряжения
–I
33
>
+С
25.07.2018
34.
2. Заместители второго рода (мета-ориентанты):дезактивирующие
– NH3+
– NR3+
– CF3+
>
–NO2
>
– SO3H > –C = O
|
H
> –CN > –C = O
|
OH
Усиление дезактивирующего действия
O
||
N
–
34
O
–
–I
–C
25.07.2018
35.
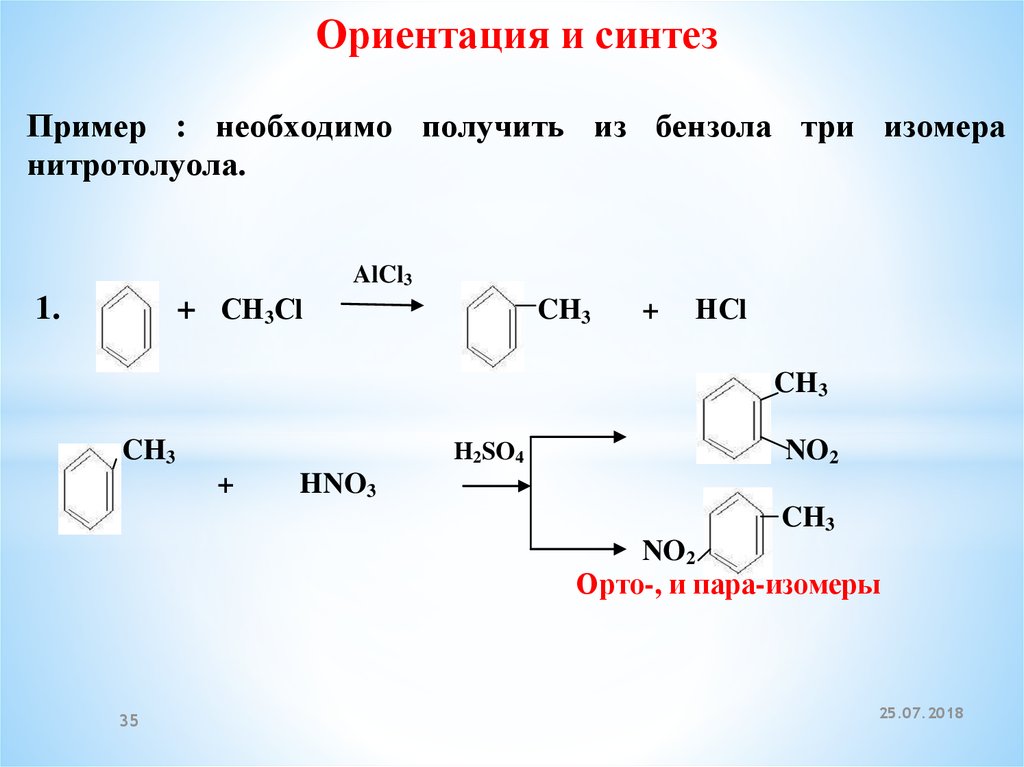
Ориентация и синтезПример : необходимо получить из бензола три изомера
нитротолуола.
AlCl3
+ СН3Сl
1.
CH3
+
НСl
CH3
CH3
H2SO4
+
NO2
HNO3
CH3
NO2
Орто-, и пара-изомеры
35
25.07.2018
36.
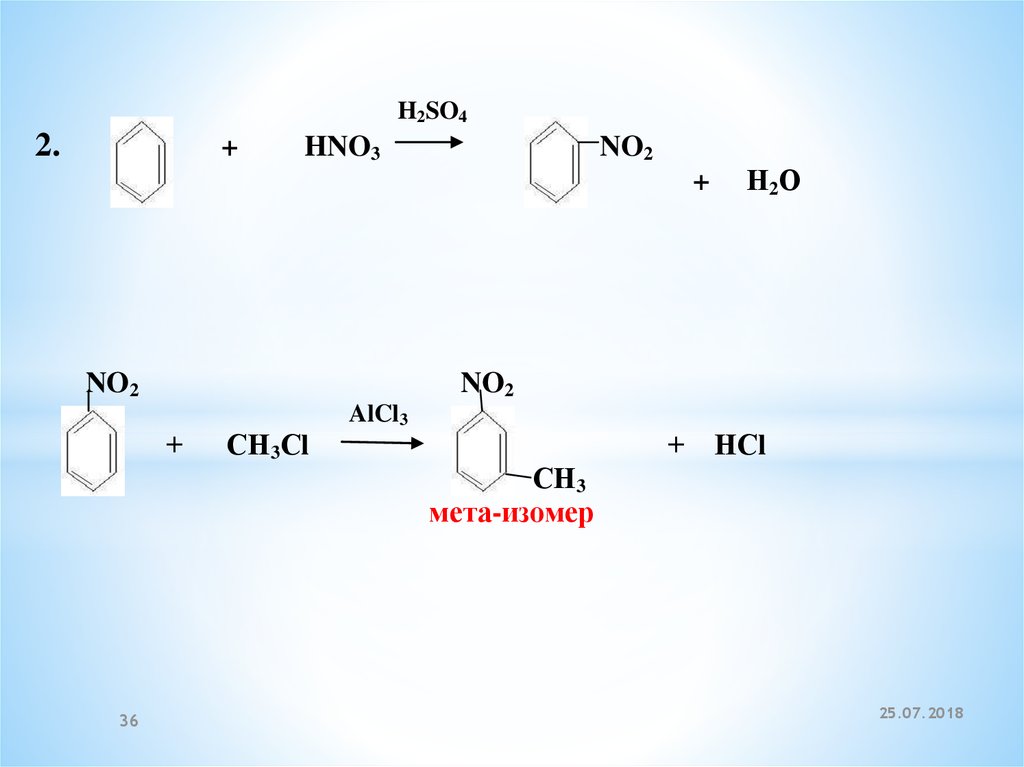
H2SO42.
+
HNO3
NO2
+
NO2
NO2
+
36
Н2О
СН3Сl
AlCl3
+ НСl
СН3
мета-изомер
25.07.2018
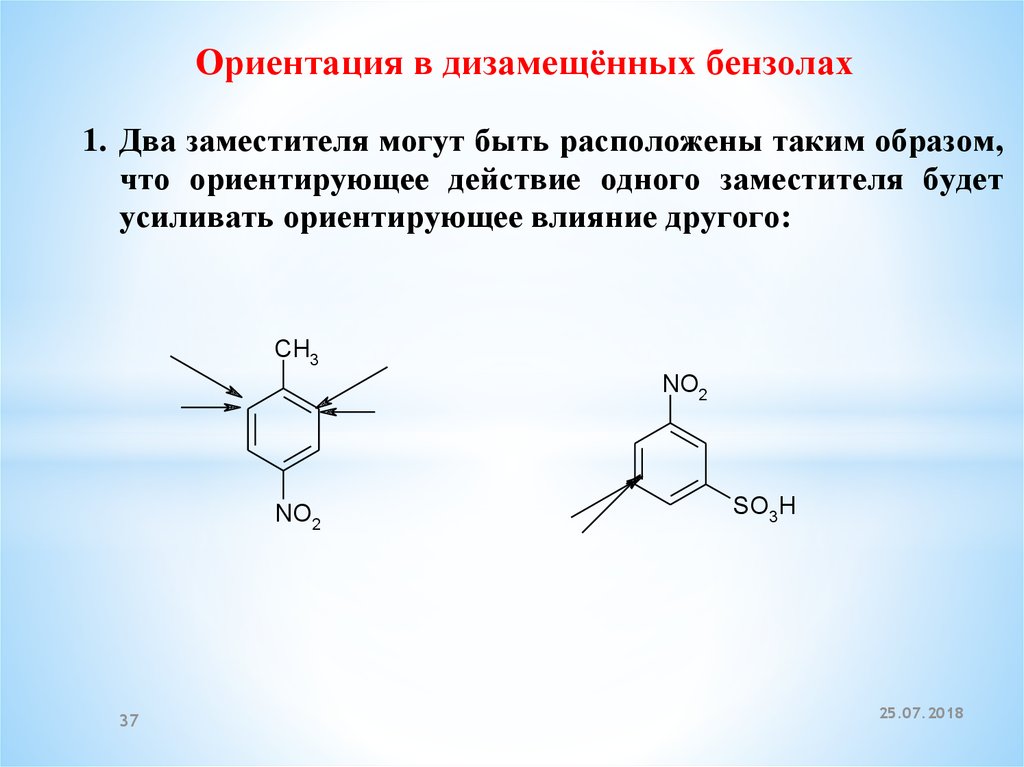
37.
Ориентация в дизамещённых бензолах1. Два заместителя могут быть расположены таким образом,
что ориентирующее действие одного заместителя будет
усиливать ориентирующее влияние другого:
CH3
NO2
NO2
37
SO3H
25.07.2018
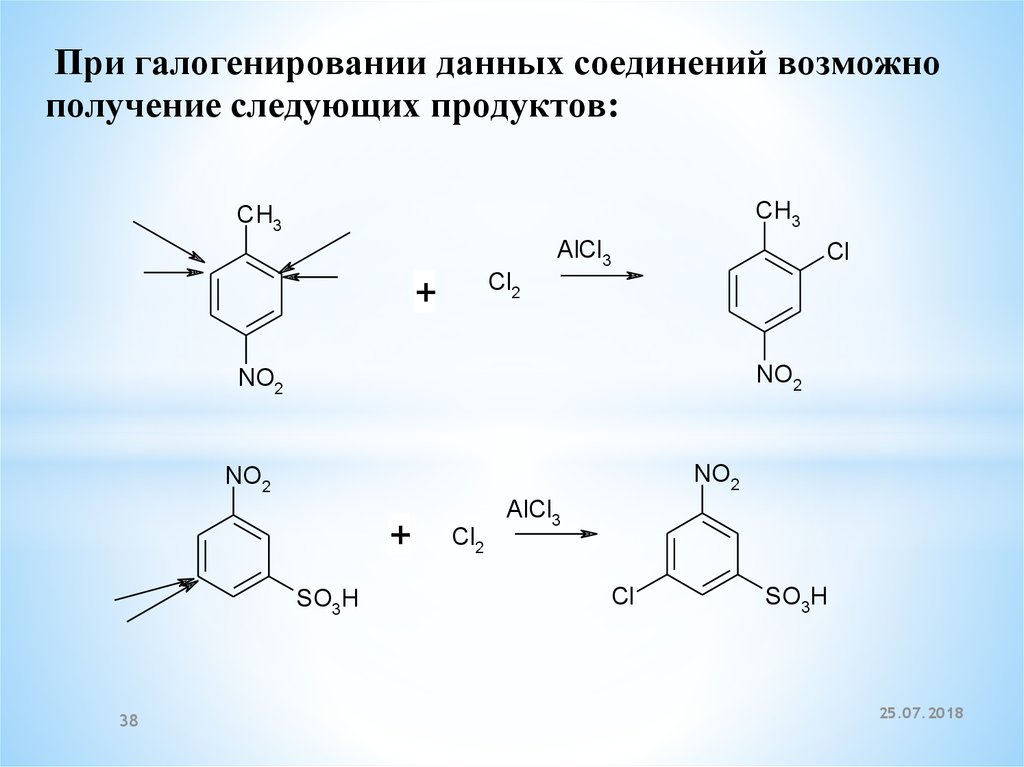
38.
При галогенировании данных соединений возможнополучение следующих продуктов:
CH3
CH3
AlCl3
Cl
Cl2
+
NO2
NO2
NO2
NO2
+
SO3H
38
Cl2
AlCl3
Cl
SO3H
25.07.2018
39.
2. Два заместителя могут быть расположены таким образом,что
ориентирующее
влияние
одной
группы
противоположно влиянию другой группы:
OH
CH3
В этом случае необходимо учитывать ряд активности
заместителей:
Влияние сильно активирующих групп преобладает над
влиянием слабо дезактивирующих или слабо активирующих
групп
39
25.07.2018
40.
Ряд активности заместителей:– NH2
– NH – C = O – O – C = O
– NHR > – OH > – OR >
|
>
|
> – R > – C6H5 >
– NR2
R
R
активирующие
–C=O –C=O –C=O
> F> – Сl > – Br > – I > – NO2 > – SO3H > |
> |
> |
OH
OR
H
слабо дезактивирующие
40
сильно дезактивирующие
25.07.2018
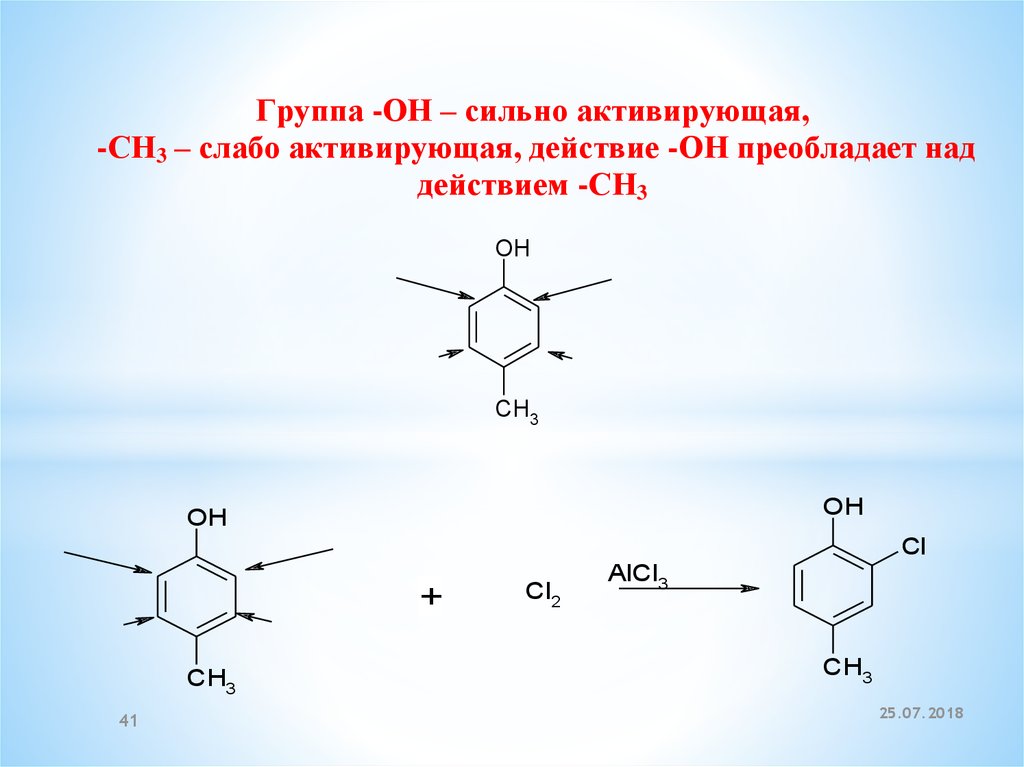
41.
Группа -ОН – сильно активирующая,-СН3 – слабо активирующая, действие -ОН преобладает над
действием -СН3
OH
CH3
OH
OH
Cl
+
CH3
41
Cl2
AlCl3
CH3
25.07.2018
42.
Пример : какие продукты получатся при галогенировании мнитротолуола.NO2
Сl
СН3
NO2
NO2
AlCl3
Вхождение
следующего
заместителя между
двумя близко
расположенными
группами
маловероятно
Cl
+ Сl2
СН3
+ НСl
СН3
NO2
СН3
Cl
42
25.07.2018
43.
-СН3 – заместитель 1 рода (активирующий)направляет следующий заместитель в орто- и
пара- положения, -NO2 заместитель 2 рода
(дезактивирующий) мета-ориентант.
Согласно ряду активности заместителей
действие группы -СН3 преобладает над действием
группы -NO2, поэтому следующий заместитель
отправляется в орто- и пара- положения
относительно группы -СН3
43
25.07.2018
44.
3. Реакции радикального замещенияCH2 – CH3
+ Cl2
α
CH – CH3
|
+
Cl
300-350°C
HCl
ряд устойчивости радикалов
СН2 , CH2 = CH – CH2
бензил
аллил
> CH3 – CH2
44
CH3
|
> CH3 - C• > CH3 - CH
|
|
CH3
CH3
>
CH2 = CH•,
винил
фенил
25.07.2018
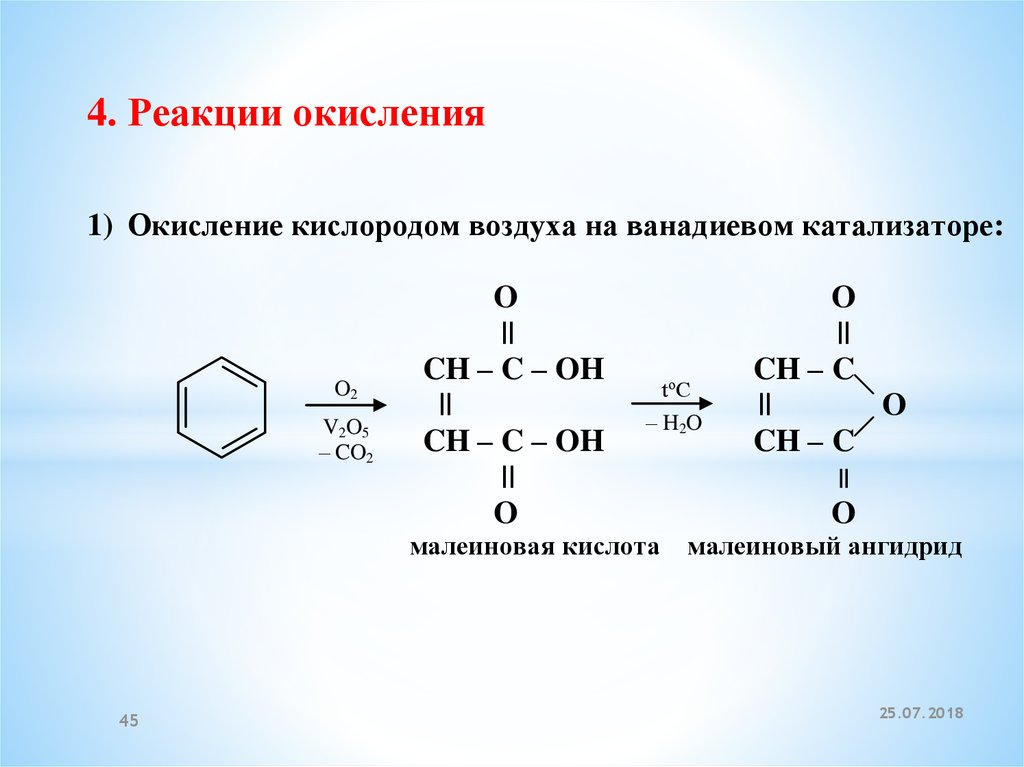
45.
4. Реакции окисления1) Окисление кислородом воздуха на ванадиевом катализаторе:
O2
V2O5
– CO2
O
||
CH – C – OH
||
CH – C – OH
||
O
tºC
– H2O
малеиновая кислота
45
O
||
CH – C
||
O
CH – C
||
O
малеиновый ангидрид
25.07.2018
46.
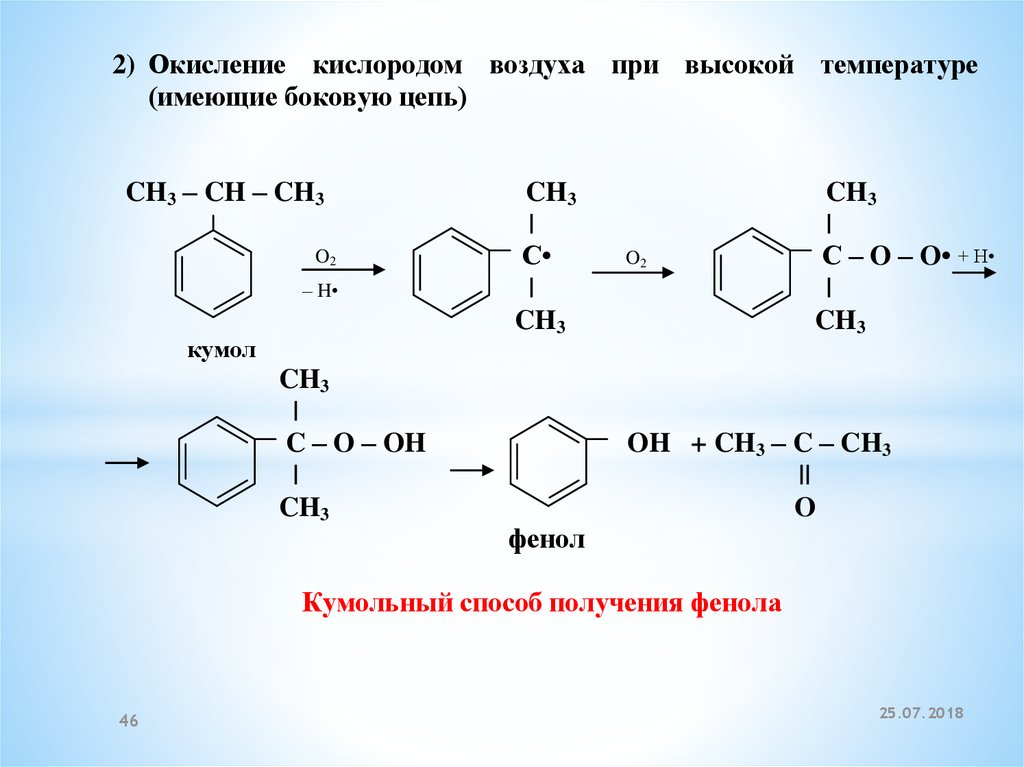
2) Окисление кислородом воздуха при высокой температуре(имеющие боковую цепь)
CH3 – CH – CH3
O2
– H
кумол
CH3
|
C – O – OH
|
CH3
CH3
|
C
|
CH3
O2
CH3
|
C – O – O• + H
|
CH3
OH + CH3 – C – CH3
||
O
фенол
Кумольный способ получения фенола
46
25.07.2018
47.
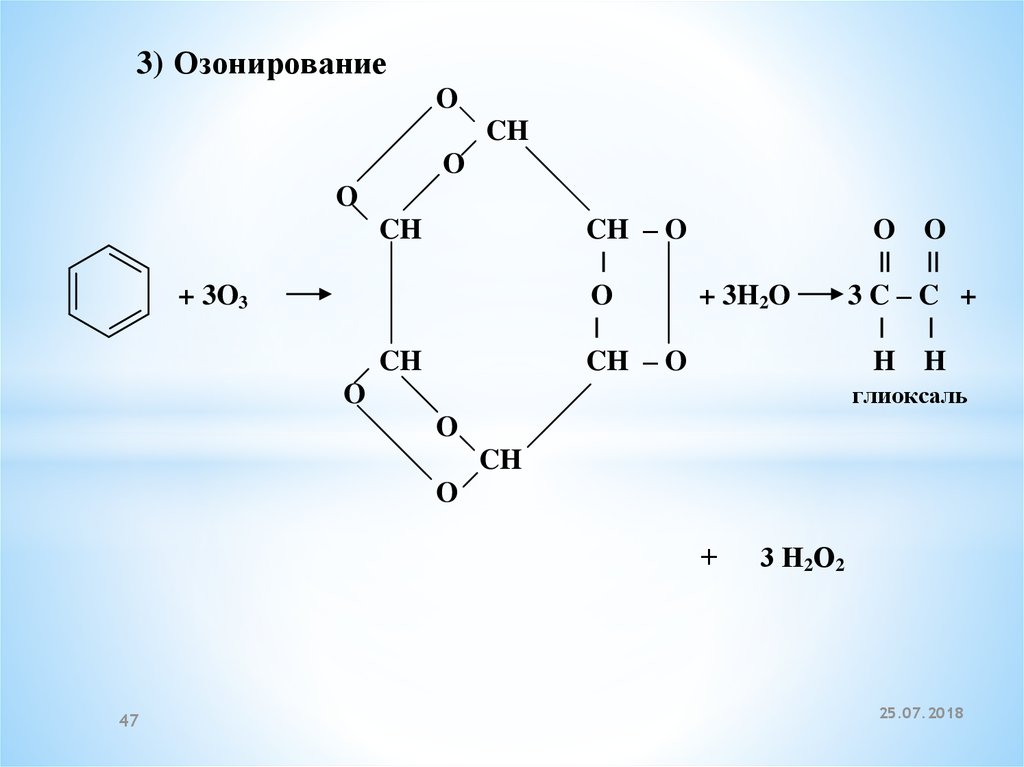
3) ОзонированиеO
CH
O
O
CH – O
|
O
+ 3H2O
|
CH – O
CH
+ 3O3
CH
O O
|| ||
3C–C +
| |
H H
глиоксаль
O
O
CH
O
+
47
3 Н2О2
25.07.2018
48.
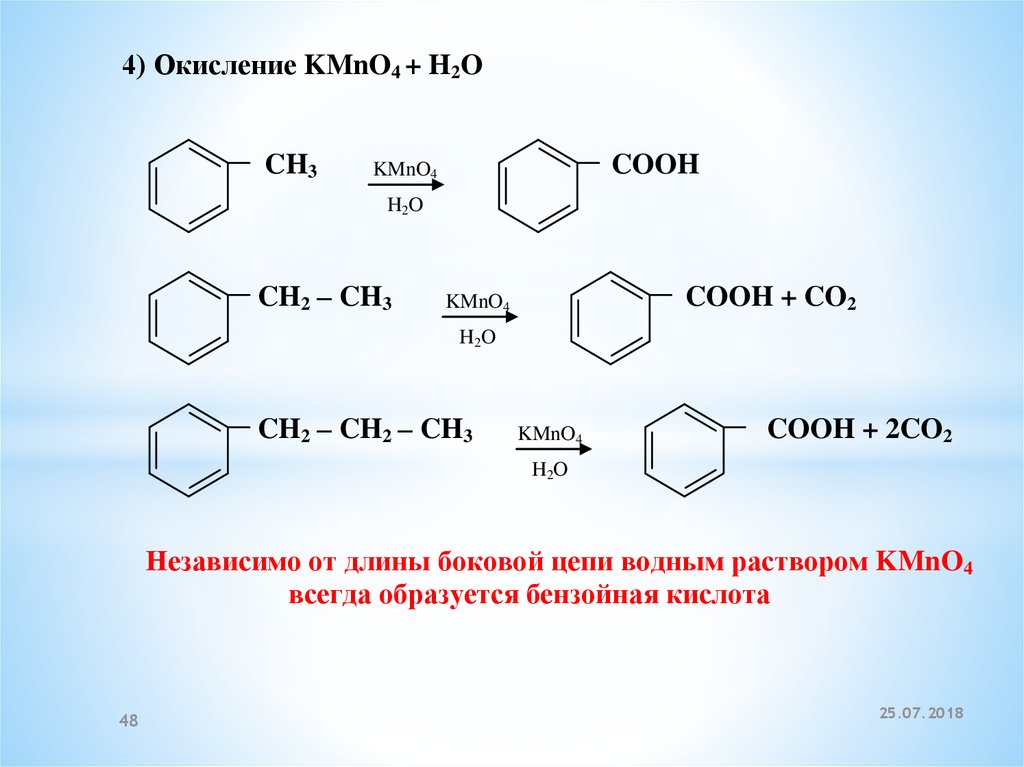
4) Окисление KMnO4 + H2OCH3
COOH
KMnO4
H 2O
CH2 – CH3
COOH + CO2
KMnO4
H2O
CH2 – CH2 – CH3
KMnO4
COOH + 2CO2
H2O
Независимо от длины боковой цепи водным раствором KMnO4
всегда образуется бензойная кислота
48
25.07.2018
49.
5) горение бензола2С6Н6 + 15О2
49
12СО2
+ 6Н2О
25.07.2018
50.
51.
VI. Физические свойства бензола51
25.07.2018
52.
53. Спасибо за Ваше внимание!
5325.07.2018























 Химия
Химия