Похожие презентации:
Ископаемое сырье органической химии
1. ИСКОПАЕМОЕ СЫРЬЕ ОРГАНИЧЕСКОЙ ХИМИИ
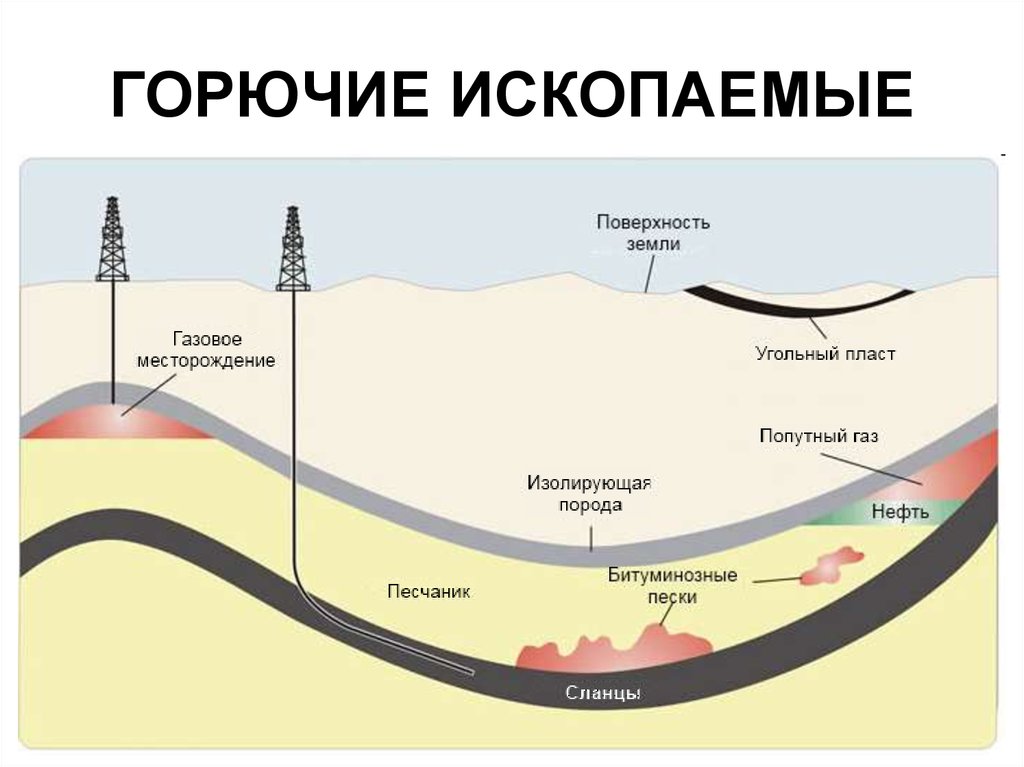
2. ГОРЮЧИЕ ИСКОПАЕМЫЕ И ПРОДУКТЫ ПЕРЕРАБОТКИ
H/Cмасс.
0
0,09
ТВЕРДЫЕ
0,33
0,16
ЖИДКИЕ
ГАЗЫ
3. ГОРЮЧИЕ ИСКОПАЕМЫЕ
4. УГЛЕХИМИЧЕСКОЕ СЫРЬЕ ОРГАНИЧЕСКОЙ ХИМИИ
5.
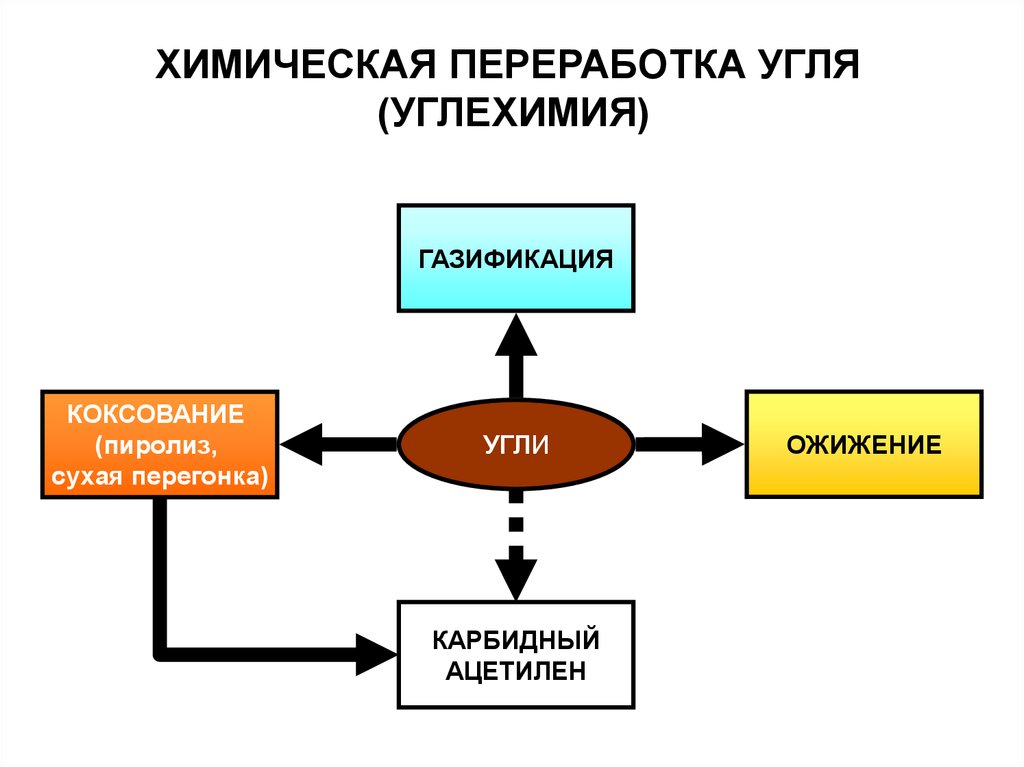
ХИМИЧЕСКАЯ ПЕРЕРАБОТКА УГЛЯ(УГЛЕХИМИЯ)
ГАЗИФИКАЦИЯ
КОКСОВАНИЕ
(пиролиз,
сухая перегонка)
УГЛИ
КАРБИДНЫЙ
АЦЕТИЛЕН
ОЖИЖЕНИЕ
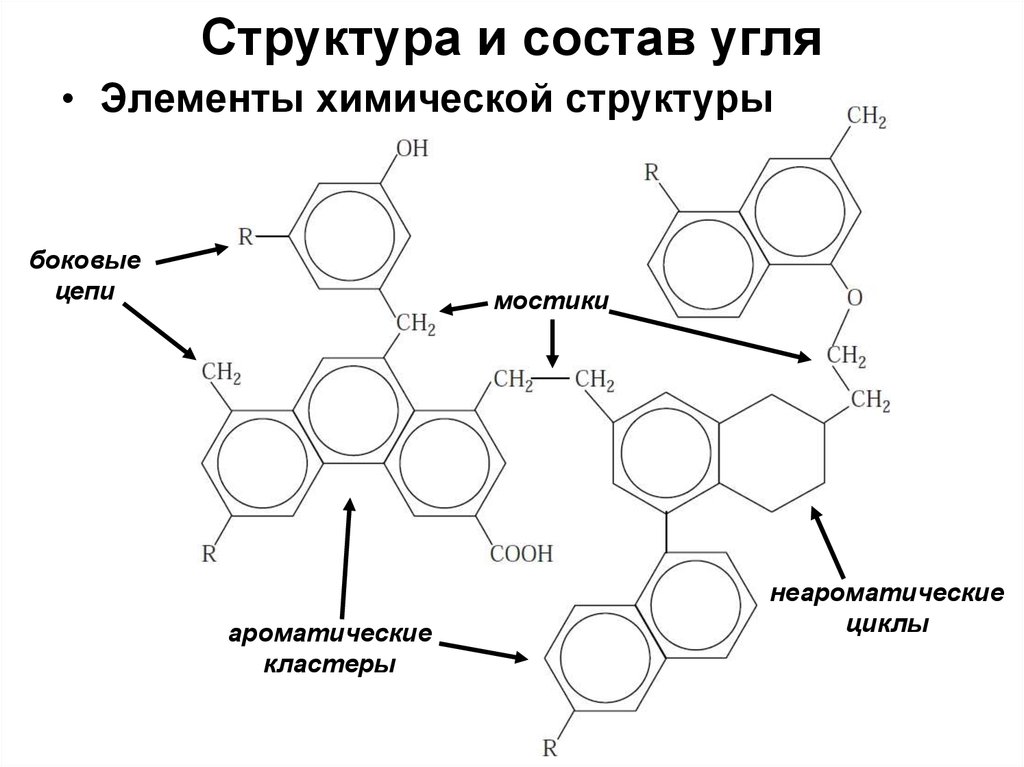
6. Структура и состав угля
• Элементы химической структурыбоковые
цепи
мостики
ароматические
кластеры
неароматические
циклы
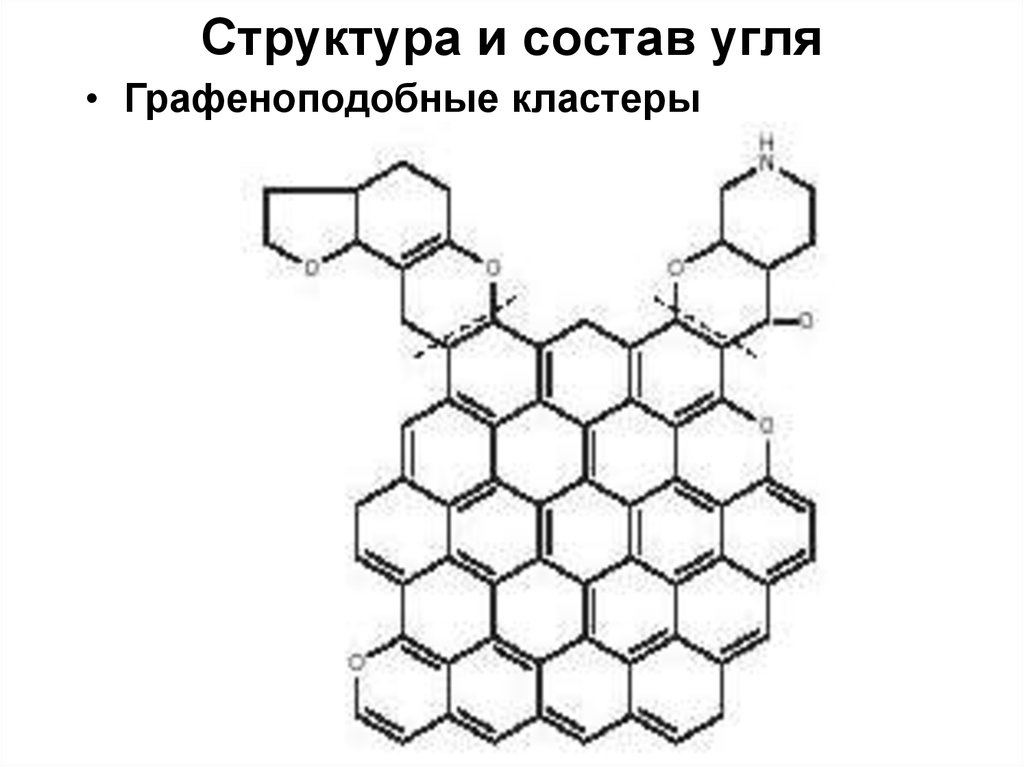
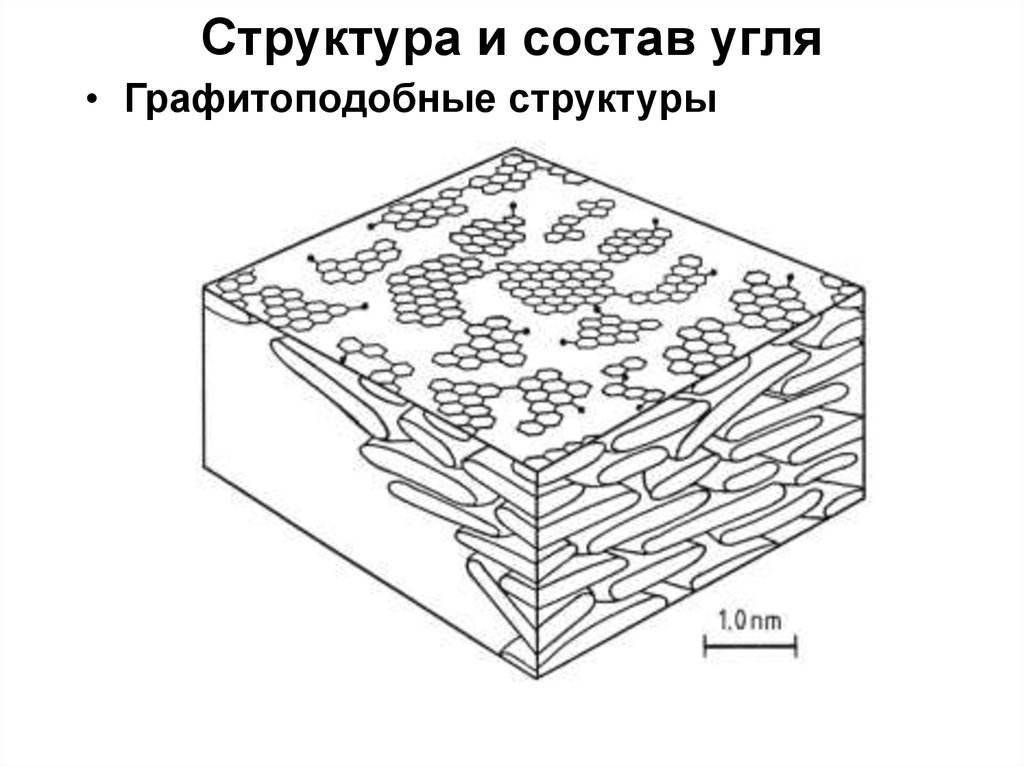
7. Структура и состав угля
• Графеноподобные кластеры8. Структура и состав угля
• Графитоподобные структуры9. Реакции при коксовании угля
УГОЛЬNH3 H2O CH4
Термическая
деструкция
и др.
ОСКОЛКИ
ЛЕТУЧИЕ
ПРОДУКТЫ
Стабилизация
водородом
H2
Вторичные
реакции
Крекинг
(деструкция)
Реполимеризация
(конденсация)
КОКС
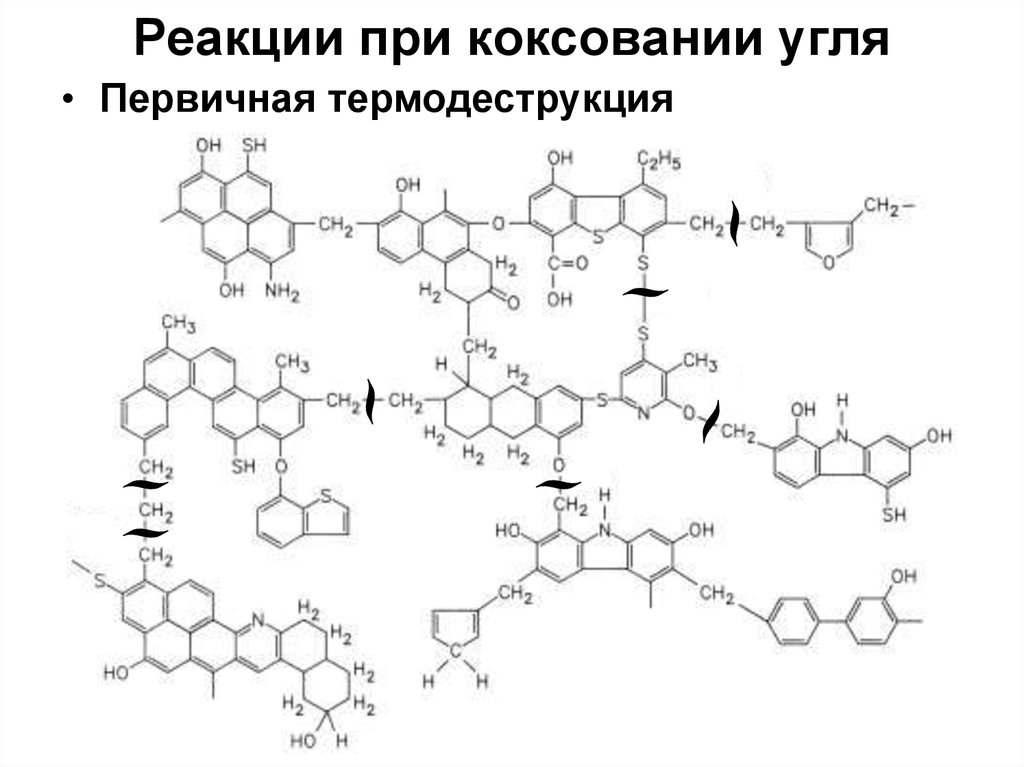
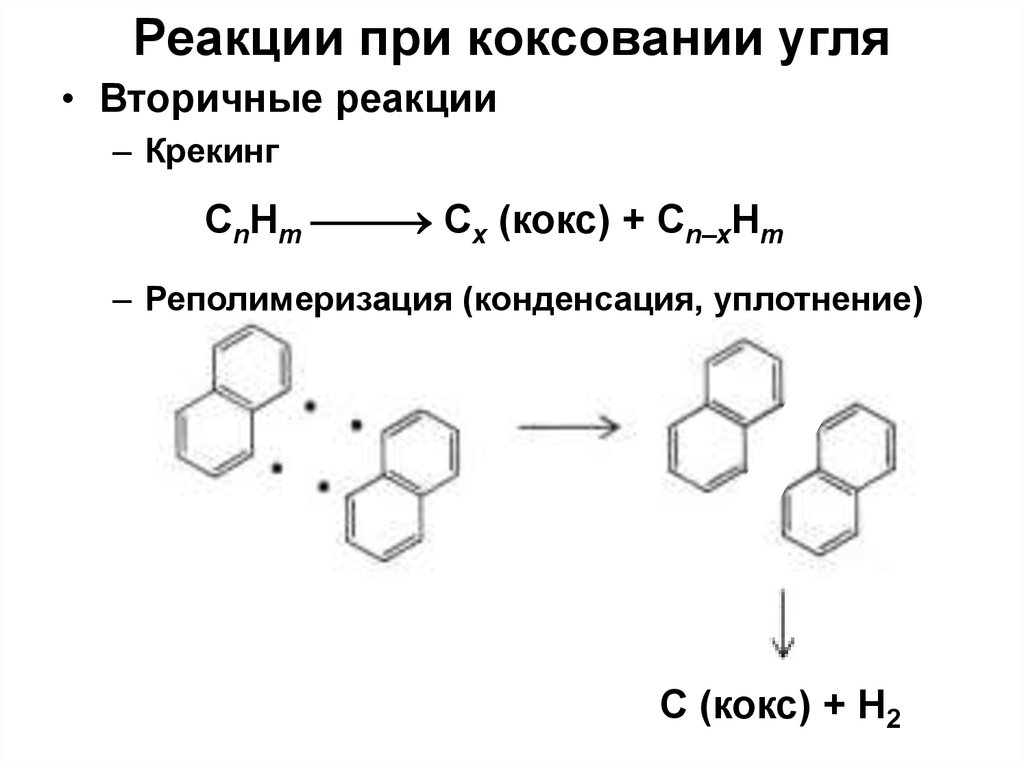
10. Реакции при коксовании угля
• Первичная термодеструкция11. Реакции при коксовании угля
• Вторичные реакции– Крекинг
CnHm Cx (кокс) + Cn–xHm
– Реполимеризация (конденсация, уплотнение)
C (кокс) + H2
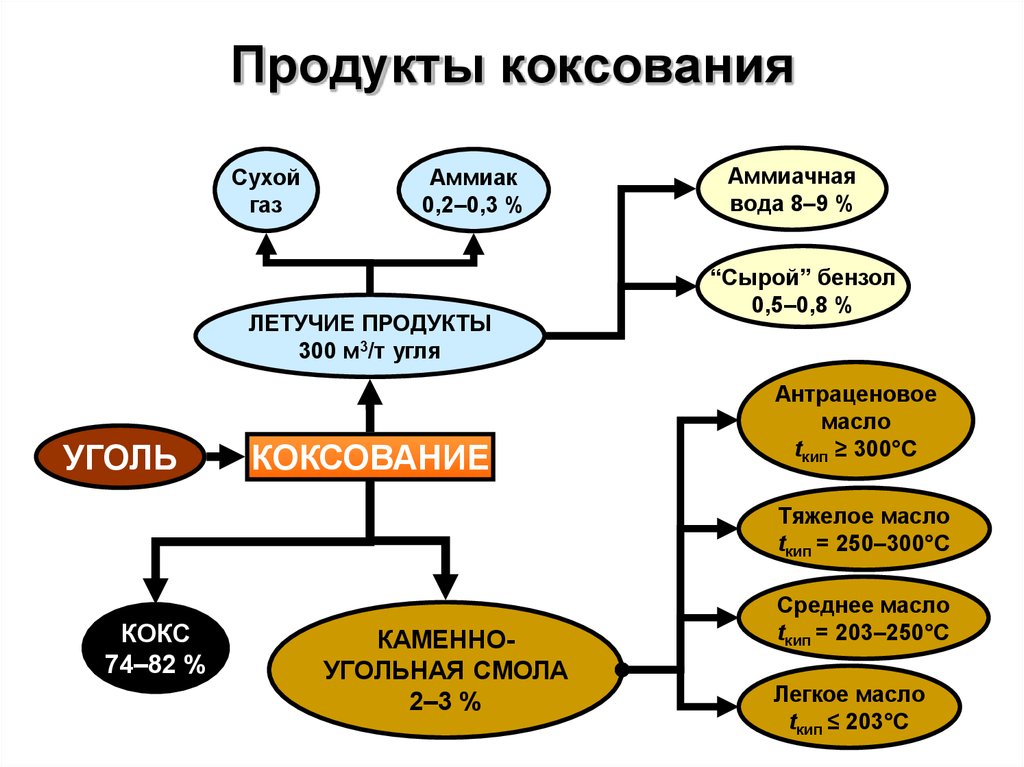
12. Продукты коксования
Сухойгаз
Аммиак
0,2–0,3 %
ЛЕТУЧИЕ ПРОДУКТЫ
300 м3/т угля
УГОЛЬ
КОКСОВАНИЕ
Аммиачная
вода 8–9 %
“Сырой” бензол
0,5–0,8 %
Антраценовое
масло
tкип ≥ 300°С
Тяжелое масло
tкип = 250–300°С
КОКС
74–82 %
КАМЕННОУГОЛЬНАЯ СМОЛА
2–3 %
Среднее масло
tкип = 203–250°С
Легкое масло
tкип ≤ 203°С
13. Некоторые углехимикаты
НафталинАнтрацен
Дифенил
Фенантрен
Фенол
Крезолы
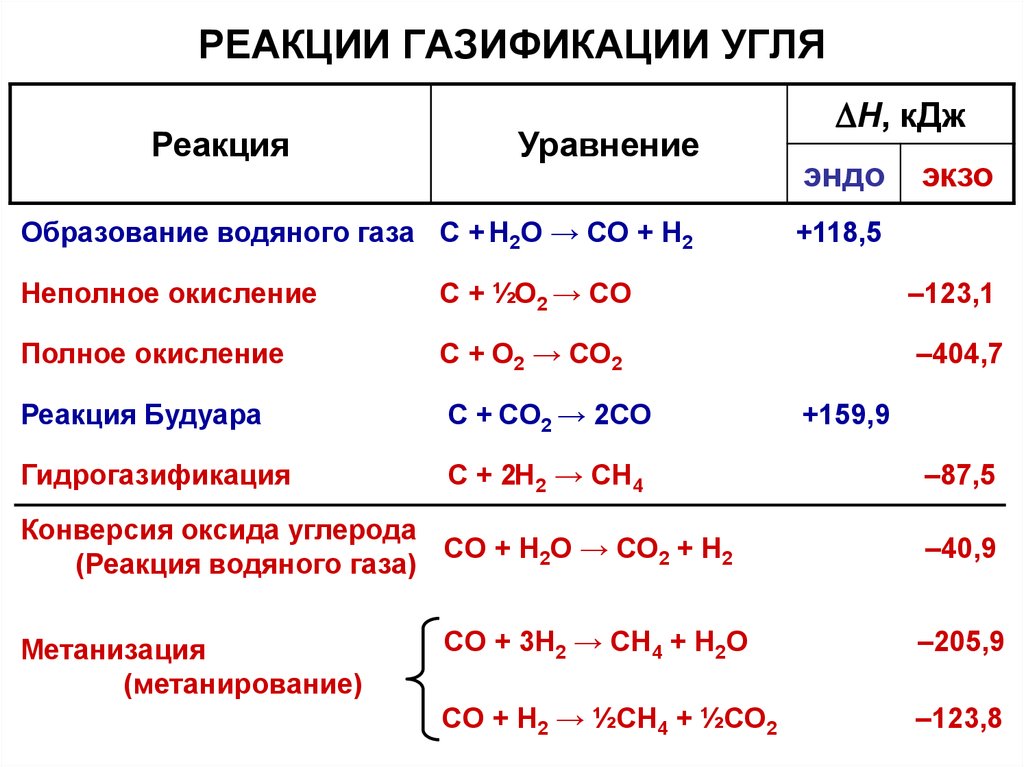
14. РЕАКЦИИ ГАЗИФИКАЦИИ УГЛЯ
РеакцияУравнение
Образование водяного газа С + Н2О → СО + Н2
Н, кДж
эндо
экзо
+118,5
Неполное окисление
С + ½О2 → СО
–123,1
Полное окисление
С + О2 → СО2
–404,7
Реакция Будуара
С + CО2 → 2СО
Гидрогазификация
С + 2Н2 → CH4
Конверсия оксида углерода
СO + Н2О → СО2 + Н2
(Реакция водяного газа)
Метанизация
(метанирование)
+159,9
–87,5
–40,9
СO + 3Н2 → CH4 + Н2О
–205,9
СO + Н2 → ½CH4 + ½СО2
–123,8
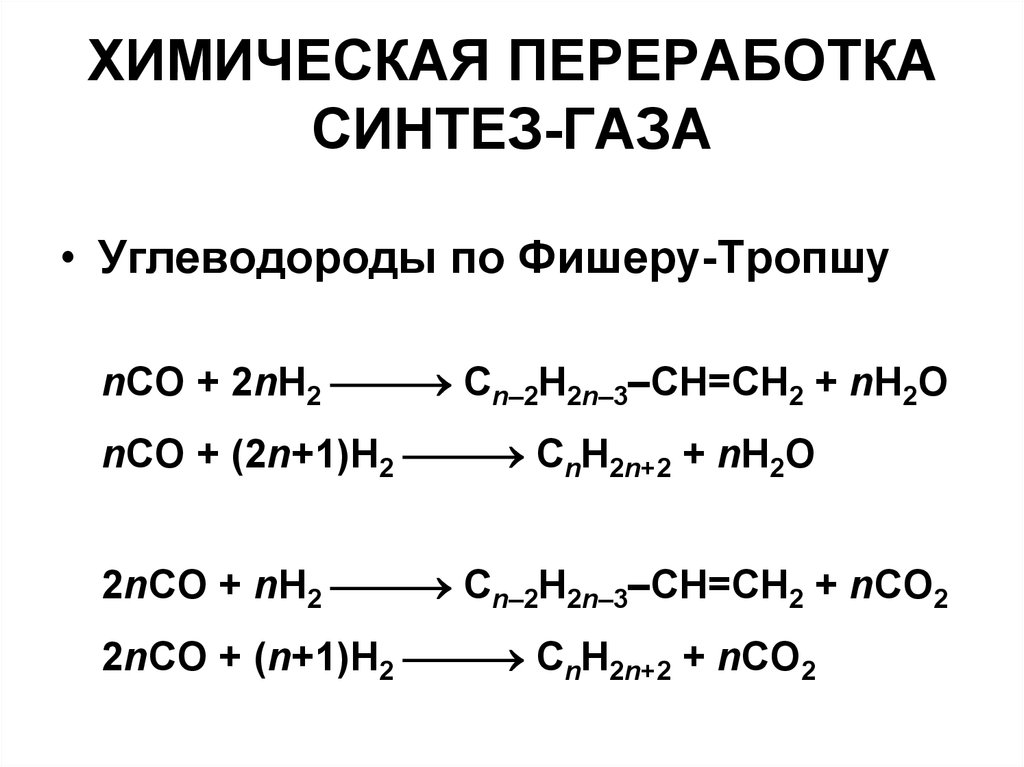
15. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА
• Углеводороды по Фишеру-ТропшуnCO + 2nH2 Cn–2H2n–3–CH=CH2 + nH2O
nCO + (2n+1)H2 CnH2n+2 + nH2O
2nCO + nH2 Cn–2H2n–3–CH=CH2 + nCO2
2nCO + (n+1)H2 CnH2n+2 + nCO2
16. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА
• Метанол (48–49 млн. т/год)CO + 2 H2
CH3OH
• Формальдегид
(28 млн. т/год формалина)
CH3OH + ½O2 CH2O + H2O
• Уксуcная кислота (10–11 млн. т/год)
CH3OH + CO CH3COOH
17. ХИМИЧЕСКАЯ ПЕРЕРАБОТКА СИНТЕЗ-ГАЗА
• Альдегиды и спиртыоксосинтеза
CH3–CH=CH2 + CO + H2
гидроформилирование
+ H2
CH3–CH2–CH2–CHO
CH3–CH2–CH2–CH2OH
• Фосген
CO + Cl2 Cl2C=O
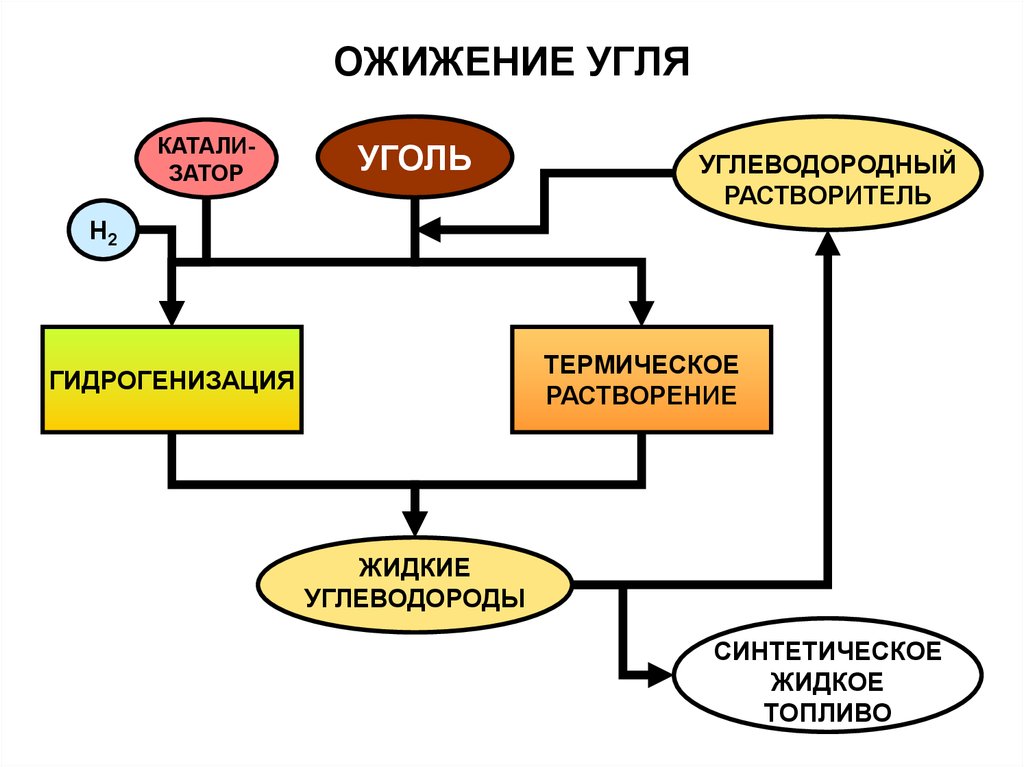
18. ОЖИЖЕНИЕ УГЛЯ
КАТАЛИЗАТОРУГОЛЬ
УГЛЕВОДОРОДНЫЙ
РАСТВОРИТЕЛЬ
H2
ТЕРМИЧЕСКОЕ
РАСТВОРЕНИЕ
ГИДРОГЕНИЗАЦИЯ
ЖИДКИЕ
УГЛЕВОДОРОДЫ
СИНТЕТИЧЕСКОЕ
ЖИДКОЕ
ТОПЛИВО
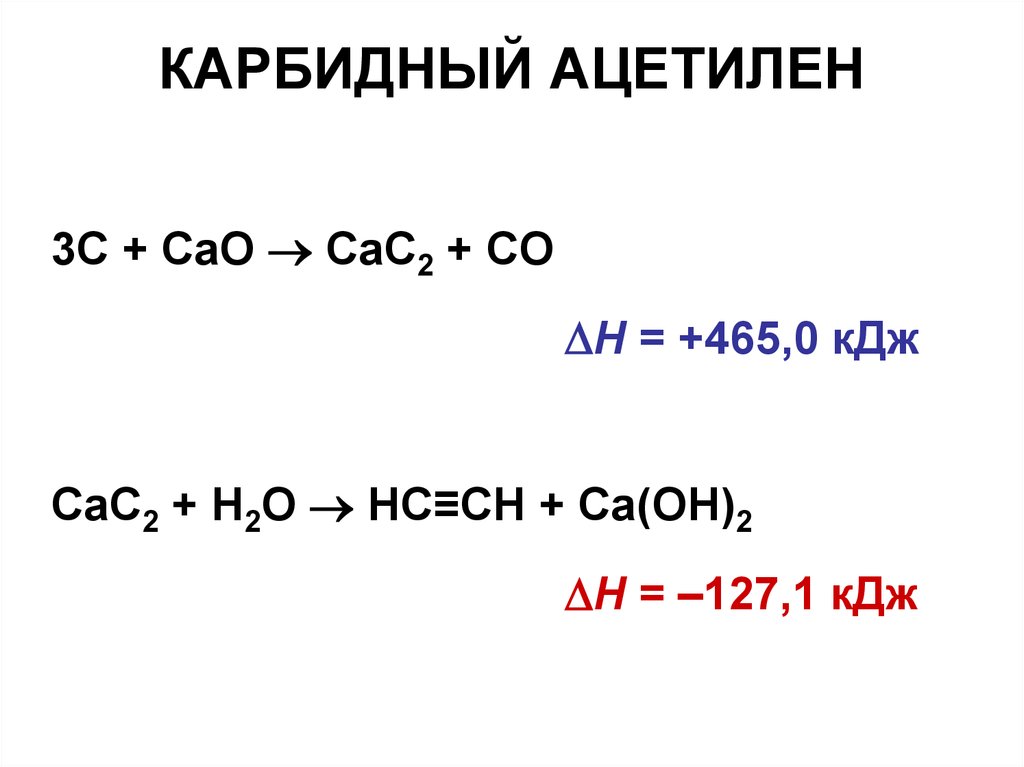
19. КАРБИДНЫЙ АЦЕТИЛЕН
3C + CaO CaC2 + COН = +465,0 кДж
CaC2 + H2O HC≡CH + Ca(OH)2
Н = –127,1 кДж
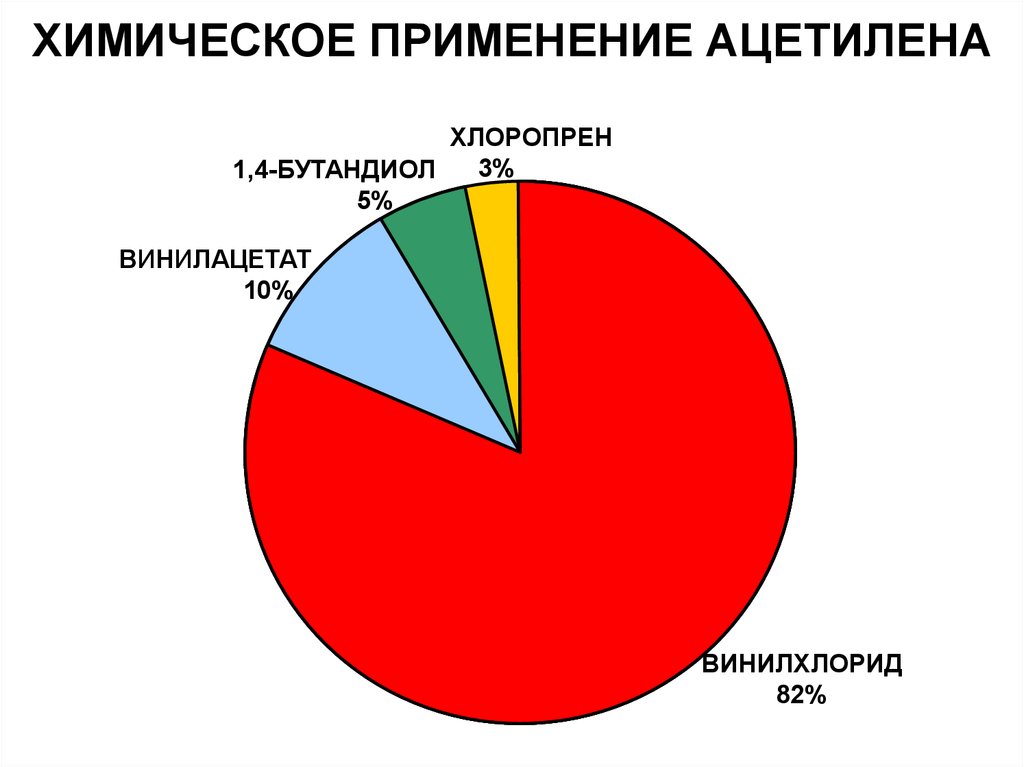
20. ХИМИЧЕСКОЕ ПРИМЕНЕНИЕ АЦЕТИЛЕНА
ХЛОРОПРЕН3%
1,4-БУТАНДИОЛ
5%
ВИНИЛАЦЕТАТ
10%
ВИНИЛХЛОРИД
82%







 Химия
Химия








