Похожие презентации:
Качественный анализ
1. Качественный анализ
1) AgNO3 + HCl = AgCl ↓ + HNO3;2) NaHСO3 + HCl = NaCl + H2O + CO2 ↑
CH2OH
Cu(NO3)2
CHOH 2NaOH
CH2OH
Глицерин
CH2O
Cu /2
CHO
CH2OH
2NaNO3
2H2O
Глицерат меди
Химические реакции, при проведении которых
наблюдается аналитический эффект (сигнал),
называются аналитическими химическими
реакциями.
Они должны протекать достаточно быстро
и быть практически необратимыми.
2.
Специфическими называют те реакции, которыепозволяют обнаружить один ион в присутствии других
ионов.
NH4Cl + NaOH = NH3↑ + H2O + NaCl
Селективные, или избирательные, реакции дают
сходный эффект с несколькими ионами.
Ca+2 + (NH4)2C2O4 = CaC2O4↓ + 2NH4+.
Вa+2 + (NH4)2C2O4 = BaC2O4↓ + 2NH4+.
Sr+2 + (NH4)2C2O4= SrC2O4↓ + 2NH4+.
Реакции, основанные на индивидуальных свойствах
уже образовавшихся продуктов, например, на
способности осадков растворяться в кислотах,
щелочах называются реакциями тождества
3.
Реактивы, применяемые для проведения аналитическихреакций, называют аналитическими реагентами.
Требования к ним: чистота, чувствительность,
специфичность
Химические реактивы классифицируют по степени
чистоты:
-технические (т.)
- > 2% примесей;
- чистые (ч.)
– 1 – 2% примесей;
-чистые для анализа (ч.д.а.) – 0,1 – 1 % примесей;
- химически чистые (х.ч.)
– 0,01 – 0,1% примесей;
- особо чистые (ос.ч.)
< 0,01 % примесей.
4.
Дробный метод анализа заключается в обнаруженииэлемента с помощью специфических или селективных
реакций, которые позволяют обнаруживать ион в
отдельной порции анализируемого раствора. При
этом последовательность обнаружения ионов может
быть произвольной.
Для устранения мешающего влияния сопутствующих
ионов используют два пути:
1) Маскирование мешающих ионов.
Для этого используют химические реакции, приводящие
к уменьшению концентрации мешающих ионов.
2) Методы предварительного разделения ионов.
К ним относят: экстракцию, осаждение, хроматографию.
5.
Для осуществления систематического хода анализапроводится предварительное разделение всех элементов
на отдельные группы, а обнаружение того или иного
компонента с помощью характерных реакций проводится
в присутствии ограниченного числа других элементов.
Для разделения ионов по методу осаждения
наиболее известны схемы анализа:
- сероводородная;
- аммиачно-фосфатная;
- кислотно-щелочная
6.
7.
Кислотно-щелочная классификациякатионов
№
I
II
III
IV
V
VI
Катионы
Групповой
реагент
Продукты реакции и
аналитический сигнал
Ag+, Hg22+, Pb2+ 2 M HCl
AgCl, Hg2Cl2, PbCl2. Осадки
белого цвета
Ca2+, Ba2+, Sr2+
1 М H2SO4
CaSO4, BaSO4. Осадки белого
цвета,
Аl3+, Zn2+, Cr3+
Sn(II,IV),
As(III,V)
Избыток 2 М
NaOH+H2O2
АlO2-, ZnO22-, AsO43-, SnO32- бесцветные растворы; CrO42- –
раствор желтого цвета
Mg2+, Mn2+,
Fe(II,III)
H2MnO3, Mg(OH)2, Fe(ОН)3.
Избыток 2 М
Mg(OH)2 - осадок белого цвета;
NaOH (KOH) +
H2MnO3, Fe(ОН)3 – осад. бурого
H2O2
цв.
Co2+, Ni2+ Hg2+
Избыток
раствора NH3
[Cu(NH3)4]2+, [Cd(NH3)4]2+,
[Ni(NH3)6]2+,[Co(NH3)6]3+,
[Hg(NH3)4]2+
NH +, Na+, K+
Нет
Открывают дробным методом
Cu2+, Cd2+,
8.
9.
• Предел обнаружения (ПрО) – это минимальнаяконцентрация (сmin) или минимальное количество
вещества, которое можно обнаружить данным
методом с допустимой погрешностью
• Чувствительность характеризует изменение
сигнала при изменении концентрации или количества
вещества и выражается коэффициентом
чувствительности (угол наклона градуировочного
графика)
10.
Ионы окрашивают пламя в характерный цвет:
Na+ - желтый;
K+фиолетовый;
Cu2+ - зеленый;
Ca2+ - кирпично-красный;
Ba2+ - желто-зеленый.
Признаком протекания качественной реакции между
йодом и крахмалом является образование синей
окраски
11.
ионИспользуемый реактив
Внешний эффект
Na+
дигидроантимонат калия (KH2SbO4)
белый
осадок
К+
•гексанитрокобальтат натрия
(Na3 [Co(NO2)6]);
•гексанитрокупрат
(Na2Pb[Cu(NO2)6])
•желтый осадок
аморфный
натрия •черные или
коричневые
кристаллы
NH4+
•раствор щелочи (KOH или NaOH);
•реактив Несслера (K2[HgI4] + KOH)
•выделяется газ NH3
•капля
реактива
окрашивается
в
бурый цвет
Cu2+
избыток раствора аммиака
раствор синего цвета
глицерин в щелочной среде
раствор синего цвета
Fe2+
гексацианоферрат
(III)
калия темно-синий осадок
(K3[Fe(CN)6]) (красная кровяная соль) (турнбулева синь)
Fe3+
•гексацианоферрат
(II)
калия •темно-синий осадок
(K4[Fe(CN)6]) (желтая кровяная соль) (берлинская лазурь)
•тиоцианат аммония или калия •кроваво-красное
12.
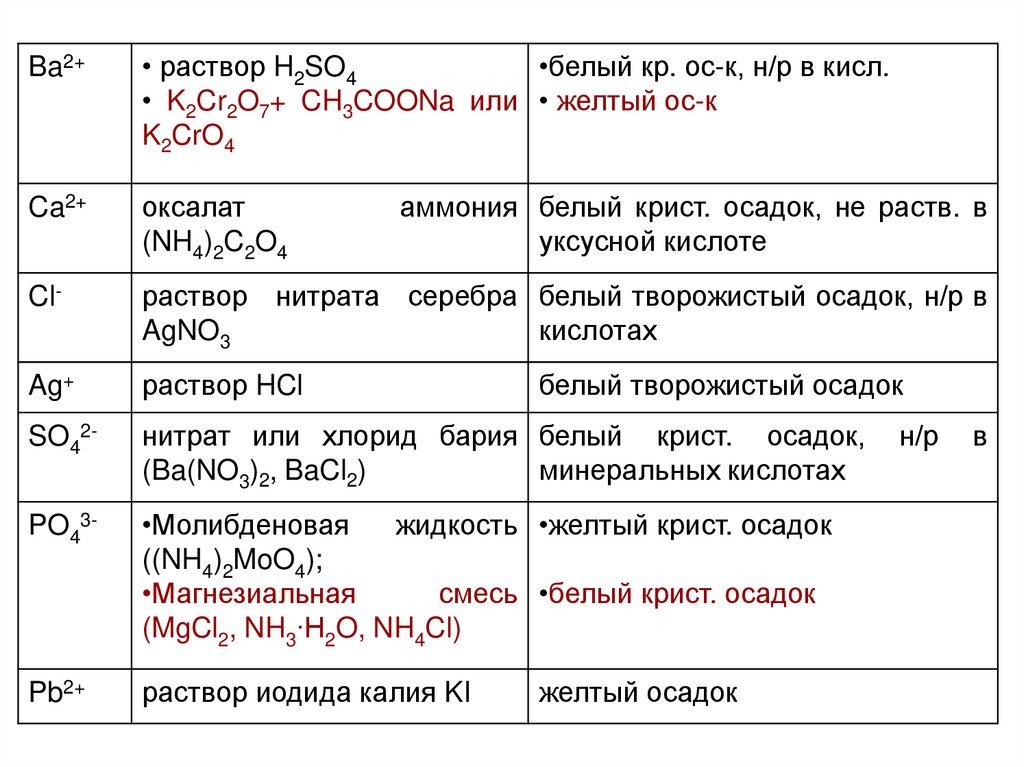
Ba2+• раствор H2SO4
•белый кр. ос-к, н/р в кисл.
• K2Cr2O7+ CH3COONa или • желтый ос-к
K2CrO4
Ca2+
оксалат
(NH4)2C2O4
Cl-
раствор нитрата серебра белый творожистый осадок, н/р в
AgNO3
кислотах
Ag+
раствор HCl
SO42-
нитрат или хлорид бария белый крист. осадок,
(Ba(NO3)2, BaCl2)
минеральных кислотах
PO43-
•Молибденовая
жидкость •желтый крист. осадок
((NH4)2MoO4);
•Магнезиальная
смесь •белый крист. осадок
(MgCl2, NH3∙H2O, NH4Cl)
Pb2+
раствор иодида калия KI
аммония белый крист. осадок, не раств. в
уксусной кислоте
белый творожистый осадок
желтый осадок
н/р
в











 Химия
Химия








