Похожие презентации:
Качественные реакции. Анионы
1. Качественные реакции
КАЧЕСТВЕННЫЕ РЕАКЦИИАНИОНЫ
2.
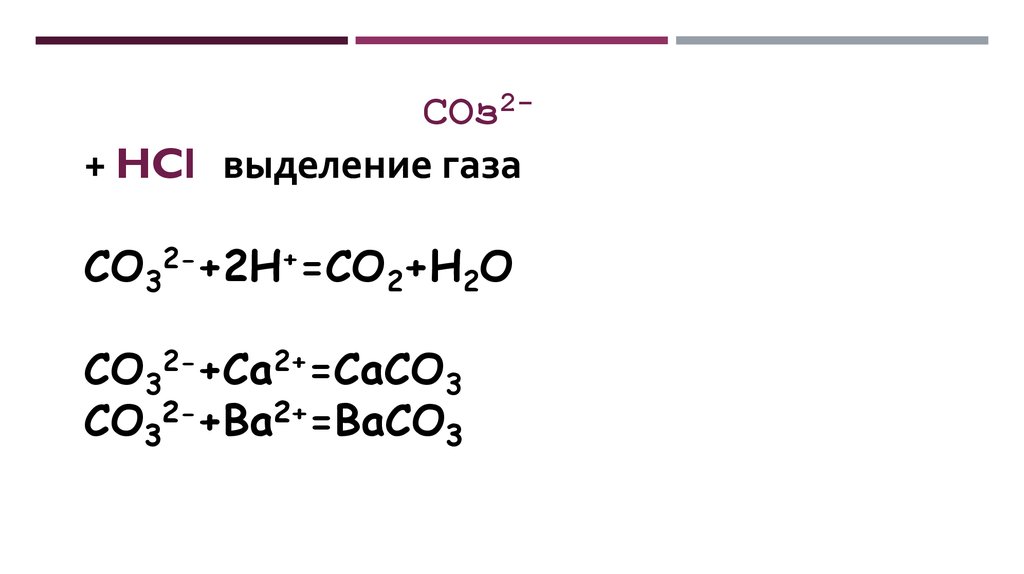
СОз2+ HCl выделение газаCO32-+2H+=CO2+H2O
CO32-+Ca2+=CaCO3
CO32-+Ba2+=BaCO3
3.
2Si03+ NH3 *Н2О
осадок геля кремниевой кислоты.
4.
2SO3 + HCL
SO32-+2H+=SO2+H2O
выделение газа
+ КМп04 + H2SO4
2KMnO4 + 5Na2SO3 + 3H2SO4 →
2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
обесцвечивание раствора
5.
2SO3 + АgNОз
SO32-+2Ag+=Ag2SO3
белый кристаллический осадок, растворимый в
избытке реагента. При кипячении полученного
раствора - серый осадок
+ ВаСl2
белый осадок из нейтральных растворов
SO32-+Ba2+=BaSO3
6.
2SO4 + ВаСl2
белый осадок, нерастворимый в кислотах
и щелочах
SO42-+Ba2+=BaSO4
7.
CL-+ АgNОз
CI-+ Ag+= AgCI
осадок белого цвета,
растворяется в избытке раствора аммиака.
8.
Br+ АgNОз
Br-+ Ag+= AgCI
осадок желтоватого цвета. Плохо
растворяется в избытке раствора
аммиака. Растворим в тиосульфате
+ Pb(N03)2
2I-+Pb2+=PbI2
белый осадок
9.
I+ АgNОз
I-+ Ag+= AgCI
осадок желтого цвета.Не
растворяется в избытке раствора
аммиака. Растворим в тиосульфате
+ Pb(N03)2
2I-+Pb2+=PbI2
желтый осадок
10.
I+ КМn04+ H2SO4обесцвечивание раствора
10KI + 2KMnO4 + 8H2SO4 =
2MnSO4 + 6K2SO4 + 5I2 + 8H2O
+раствор соли железа (+3)
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
коричневое окрашивание, синее в присутствии
крахмала
11.
2S+ КМn04+ H2SO4 обесцвечивание раствора
2KMnO4 + 5H2S + 3H2SO4 →
2MnSO4 + 5S + K2SO4 + 8H2O
+ Pb(N03)2
S2-+Pb2+=PbS
черный осадок , нерастворимый в кислотах
S2-
12.
N03-+ Си + раствор H2SO4
при нагревании бурый газ, образование
зеленовато-голубоватого раствора образование
бурого раствора, выделение бурого газа
Cu+NaNO3+H2SO4конц
=Сu(NO3)2+NO2+Na2SO4 +H2O
13.
N02-+HCl
выделение бурого газа
+ KI + H2SO4 выделение бурого газа
2NaNO2 + 2NaI + 2H2SO4 →
2 NO + I2 + 2Na2SO4 + 2H2O
+NН4Сl при кипячении выделение газа
NaNO2 +NН4Сl → N2 +NaCl +2H2O
при кипячении выделение газа
14.
N02-+АgNОз
бесцветные игольчатые кристаллы,
растворимые при нагревании
+ FeSO4 в слабокислой среде
выделение бурового газа, образование
бурого раствора
15.
Р043-
+ АgNОз
желтый осадок. Количественное осаждение
только в нейтральной среде
+ ВаСl2
белый аморфный осадок, растворимый в
кислотах
+ FeCl3
желтовато-белый осадок
16.
Р043-
+ молибденовая жидкость
желтый осадок
+ ацетат свинца
белый осадок
+ белок
нет изменений
17.
2S2O3 -
+ АgNОз
белый осадок, растворимый в избытке
осадителя
+ ВаСl2
белый осадок, растворимый в горячей воде
18.
2S2O3 -
+ H2SO4
выделение желтого осадка и газа
+ раствор иода
обесцвечивание
+ К2СГ2О7 + H2SO4
зеленый раствор
19.
Бораты(в том числе бура)
+ АgNОз
белый осадок АgВО2,
при нагревании образующий бурый осадок
оксида
+ ВаСl2
белый осадок Ва(ВО2)2
20.
СНзСОО-+ H2SO4
Ощущается запах уксусной кислоты.



















 Химия
Химия








