Похожие презентации:
Методы изучения регуляторных районов генов
1.
Методы изучения регуляторныхрайонов генов
Лекция II
Меркулова Татьяна Ивановна
Институт цитологии и генетики СО РАН
2.
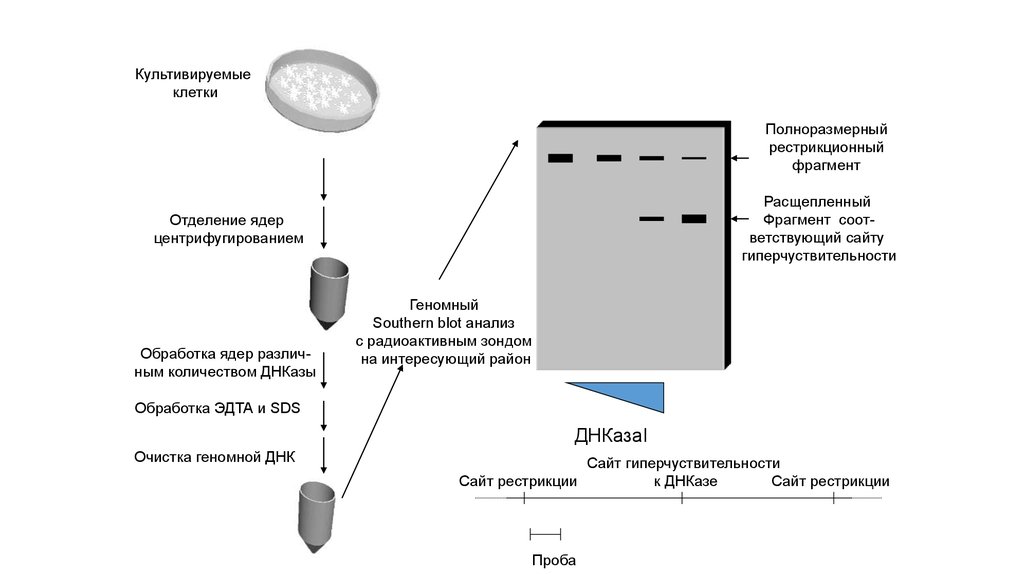
Культивируемыеклетки
Полноразмерный
рестрикционный
фрагмент
Расщепленный
Фрагмент соответствующий сайту
гиперчуствительности
Отделение ядер
центрифугированием
Обработка ядер различным количеством ДНКазы
Геномный
Southern blot анализ
с радиоактивным зондом
на интересующий район
Обработка ЭДТА и SDS
ДНКазаI
Очистка геномной ДНК
Сайт гиперчуствительности
к ДНКазе
Сайт рестрикции
Сайт рестрикции
Проба
3.
Регуляторные районы гена тирозинаминотрансферазы(ТАТ) крысы
Конститутивный печень-специфический энхансер ТАТ в районе –11 т.п.н. от старта
транскрипции.
IIBP
-10550
-10540
HNF3
-10530
-10520
-10510
-10500
-10490
-10480
Печень-специфический глюкокортикоид-индуцибельный энхансер (GRU) ТАТ в районе
-5,5 т.п.н. от старта транскрипции
C/EBP
-5480
-5470
HNF3
-5460
GRE
-5450
C/EBP
-5440
-5430
-5420
-5410
C/EBP
-5400
-5390
-5380
C/EBP HNF3
-5370
-5360
-5350
-5340
HNF3
-5330
-5320
-5310
-5300
Печень-специфический cAMP-индуцибельный энхансер ТАТ в районе –3,6 т.п.н.от
старта транскрипции.
IRE
HNF4
CRE/GME
-3660
-3650
-3640
-3630
-3620
-3610
-3600
-3590
-3580
Печень-специфический глюкокортикоид-индуцибельный энхансер (GRU) ТАТ в районе
–2,5 т.п.н. от старта транскрипции
GRE
GRE
-2610
Ets
-2600
-2590
-2580
GRE
Ets
C/EBP
-2570
-2560
-2550
-2540
-2530
-2520
-2510
-2500
HNF3 C/EBP C/EBP
-2490
-2480
-2470
-2460
Sp1
HNF3
-2450
-2440
-2430
-2420
-2410
-2400
-2390
Регуляторные элементы промотора ТАТ.
C/EBP HNF1
-290
-280
-270
HNF1LIVER
-260
-250
-240
-230
-220
-210
-200
-190
-180
-170
-160
NF-Y
-150
-140
-130
-120
-110
-100
-90
-80
-70
-60
4.
5.
Методы исследования регуляторных районовГетерологичный промотор
Интересующий промотор
Репортерный
ген
Репортерный ген
(Люцефераза или САТ)
ИЛИ
отдаленный
регуляторный район
Для анализа отдаленного
регуляторного района
Для анализа промотора
Трансфекция клеток
репортерной плазмидой
Измерение
активности
фермента
репортерного гена
Инкубация в течении 24-72 часов
транскрипция для эписомных плазмид и
синтез белка
Измерение уровня
репортерной мРНК
Transcriptional Regulation in Eukaryotes: Concepts, Strategies, and Techniques. 2000, Cold Spring Harbor Laboratory Press
6.
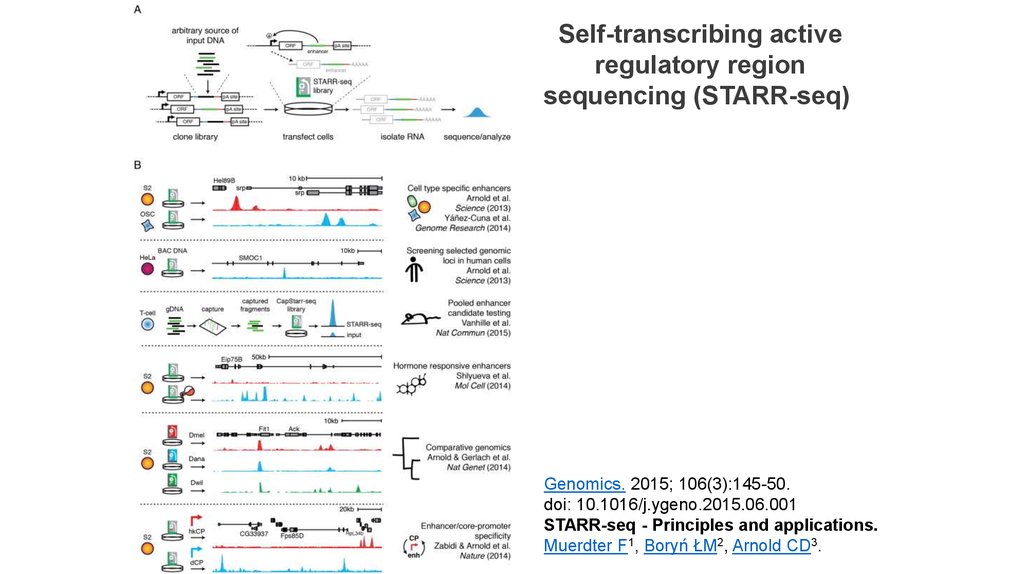
Self-transcribing activeregulatory region
sequencing (STARR-seq)
Genomics. 2015; 106(3):145-50.
doi: 10.1016/j.ygeno.2015.06.001
STARR-seq - Principles and applications.
Muerdter F1, Boryń ŁM2, Arnold CD3.
7.
Регуляторные районы гена тирозинаминотрансферазы(ТАТ) крысы
Конститутивный печень-специфический энхансер ТАТ в районе –11 т.п.н. от старта
транскрипции.
IIBP
-10550
-10540
HNF3
-10530
-10520
-10510
-10500
-10490
-10480
Печень-специфический глюкокортикоид-индуцибельный энхансер (GRU) ТАТ в районе
-5,5 т.п.н. от старта транскрипции
C/EBP
-5480
-5470
HNF3
-5460
GRE
-5450
C/EBP
-5440
-5430
-5420
-5410
C/EBP
-5400
-5390
-5380
C/EBP HNF3
-5370
-5360
-5350
-5340
HNF3
-5330
-5320
-5310
-5300
Печень-специфический cAMP-индуцибельный энхансер ТАТ в районе –3,6 т.п.н.от
старта транскрипции.
IRE
HNF4
CRE/GME
-3660
-3650
-3640
-3630
-3620
-3610
-3600
-3590
-3580
Печень-специфический глюкокортикоид-индуцибельный энхансер (GRU) ТАТ в районе
–2,5 т.п.н. от старта транскрипции
GRE
GRE
-2610
Ets
-2600
-2590
-2580
GRE
Ets
C/EBP
-2570
-2560
-2550
-2540
-2530
-2520
-2510
-2500
HNF3 C/EBP C/EBP
-2490
-2480
-2470
-2460
Sp1
HNF3
-2450
-2440
-2430
-2420
-2410
-2400
-2390
Регуляторные элементы промотора ТАТ.
C/EBP HNF1
-290
-280
-270
HNF1LIVER
-260
-250
-240
-230
-220
-210
-200
-190
-180
-170
-160
NF-Y
-150
-140
-130
-120
-110
-100
-90
-80
-70
-60
8.
Организация регуляторных районов, контролирующихтранскрипцию гена аполипопротеина В человека
ARP1
композиционный элемент
С /EBP
HNF4
HNF4
C/EBP
AGGCCCGGGAGGCGCCCTTTGGACCTTTTGCAATCCTGGCG
- 90
-50
HNF4
C/EBP
C/EBP
-57000
-4000
ЖКТ-специфичный энхансер
(300 п.н.)
ARP1
-3000
C/EBP
NFBA1
BRF1
BRF3
BRF4
LIT1
BRF2
Sp1
HNF3
AF 1
-2000
TATA box
Sp1
--128
-1000
+1
Sp1
Sp1
+1
Регуляторный район
Промотор
(от -128 до -1)
(от -898 до -262)
Негативный регуляторный
Негативный регуляторный
элемент 1 (от -3678 до -1802)
элемент 2 (от -261 до -129)
База данных TRRD, ИЦиГ СО РАН
Регуляторный
район (от +1 до
+128)
HNF1
HNF3
C/EBP
+1000
Печень- и ЖКТспецифичный
энхансер
(от +621 до +1064)
в интроне 2
Печень-специфичный энхансер
(от +346 до +521) в интроне 1
30 сайтов связывания транскрипционных факторов и других типов регуляторных
районов, суммарный размер которых превосходит длину кодируюей части этого гена.
Для генов эукариот характерно (1) наличие большого количества сайтов связывания
транскрипционных факторов в регуляторных районах и (2) наличие в ядрах клеток
большого разнообразия взаимодействующих с ними транскрипционных факторов,
зависящего от стадии клеточного цикла, стадии индивидуального развития,
состояния внутренней и внешней среды организма. Все это обеспечивает
формирование огромного разнообразия вариантов транскрипционных комплексов и
соответствующих им паттернов экспрессии одного и того же гена.
9.
Первые исследования регуляторных элементовPayvar F., Wrange O., et al. Purified glucocorticoid receptors bind selectively in vitro to a cloned DNA fragment whose
transcription is regulated by glucocorticoids in vivo. Proc Natl Acad Sci U S A. 1981 Nov;78(11):6628-32.
10.
Первые исследования регуляторных элементовSelectivity of receptor binding to MTV2-EE [32P]DNA: competition by excess unlabeled DNA. In one experiment (lanes A-G), 100 ng
of end-labeled EcoRI fiagments from pMTV2 were incubated with or without 500 ng of unlabeled closed circular pBR322 or pMTV2 DNA either in the
presence or absence of glucocorticoid receptor for 60 min at 40C; DNA bound to nitrocellulose filters was eluted and analyzed on agarose gels.
Lanes: A, DNA prior to filter binding; B, DNA bound in the absence of added protein; C, DNA bound in the presence of glucocorticoid receptor; D
and E, DNA bound in the absence of glucocorticoid receptor but in the presence of a 5-fold excess of unlabeled pBR322 orpMTV2 DNA, respectively;
F and G, DNA bound in the presence of glucocorticoid receptor together with a 5-fold excess of unlabeled pBR322 or pMTV2 DNA, respectively.
In a second experiment (lanes H-L), 100 ng of the labeled pMTV2 fragments were first incubated in the presence or absence of glucocorticoid
receptor for 30 min at 40C; 500 ng of either RSF2124 or pMTV2 DNA was then added and incubation was continued for an additional 30 min at 40C.
Lanes: H and I, DNA bound in the absence of glucocorticoid receptor but in the presence of added pMTV2 or RSF2124 DNA, respectively; J, DNA
bound in the presence of glucocorticoid receptor; K and L, DNA bound in the presence of glucocorticoid receptor and subsequently challenged with
a 5-fold excess of unlabeled pMTV2 or RSF2124 DNA, respectively.
Payvar F., Wrange O., et al. Purified glucocorticoid receptors bind selectively in vitro to a cloned DNA fragment whose
transcription is regulated by glucocorticoids in vivo. Proc Natl Acad Sci U S A. 1981 Nov;78(11):6628-32.
11.
Связывание глюкокортикоидного рецептора с фрагментамигена триптофаноксигеназы крысы
А. Схема ДНК λТО2. ▌ - экзоны гена TDO2,
- старт транскрипции, R,L - правое и
левое плечи вектора (λch4A), ● - сайты
рестрикции
EcoRI,
I-V
фрагменты
рестрикции λТО2.
- исследованный Данеш У. и сотр.
участок гена; х - выявленные ими GREs
Б. Радиоавтограф геля после электрофореза
EcoRI фрагментов λТО2 в 0,6% агарозе (1 исходная ДНК, 2 - фрагменты ДНК,
извлеченные из комплекса ДНК-рецепторантитело на инактивированном S. Aureus).
В. Радиоавтограф геля после электрофореза
фрагментов II и III в 1% агарозе (1 фрагменты,
задерживающиеся
на
нитроцеллюлозных фильтрах в присутствии
рецептора, 2 - то же в отсутствие рецептора,
3 - исходная ДНК).
Merkulov V.M., Merkulova T.I. “Nucleotide sequence of a fragment of the rat tryptophan oxygenase gene showing
high affinity to glucocorticoid receptor in vitro”. // Biochim. Biophys. Acta 1992. V.1132. P.100-102
12.
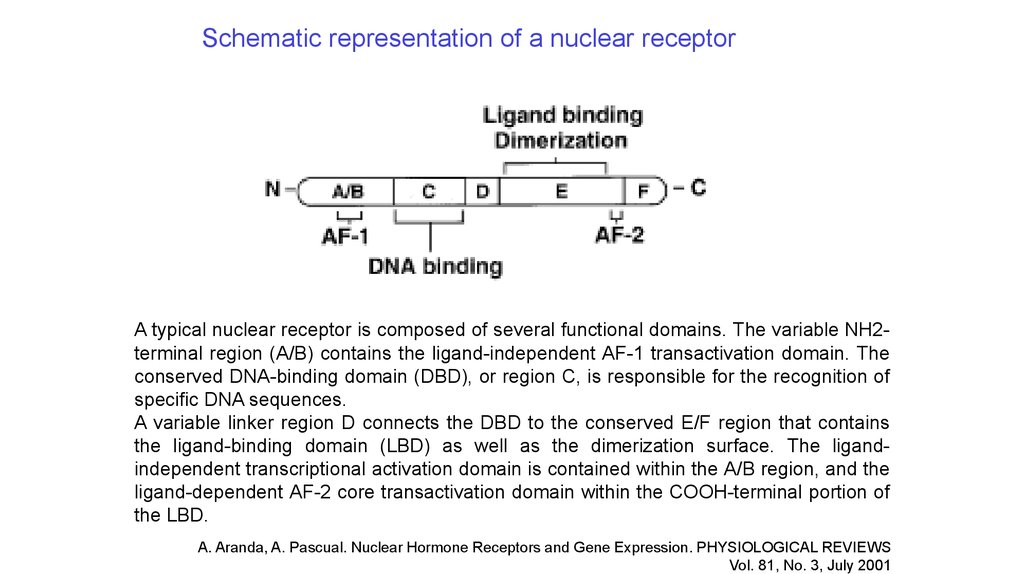
Schematic representation of a nuclear receptorA typical nuclear receptor is composed of several functional domains. The variable NH2terminal region (A/B) contains the ligand-independent AF-1 transactivation domain. The
conserved DNA-binding domain (DBD), or region C, is responsible for the recognition of
specific DNA sequences.
A variable linker region D connects the DBD to the conserved E/F region that contains
the ligand-binding domain (LBD) as well as the dimerization surface. The ligandindependent transcriptional activation domain is contained within the A/B region, and the
ligand-dependent AF-2 core transactivation domain within the COOH-terminal portion of
the LBD.
A. Aranda, A. Pascual. Nuclear Hormone Receptors and Gene Expression. PHYSIOLOGICAL REVIEWS
Vol. 81, No. 3, July 2001
13.
12
3
4
5
6
1
2
32р
5
6
белок
6
5
4
3
2
6
5
2
1
денатурация
денатурация
1
2
3
4
5
5
6
1
+
2
+
+
Не порезанные
Footprint
6
Footprint
1
14.
32рбелок
ExoIII
ExoIII
белок
белок
денатурация
денатурация
+
+
+
Не порезанные
Сайт связывания
6
5
15.
Дикий типА
В
С
D
Свободный зонд
Мутант
16.
Ингибированиесвязывания
Свободный
зонд
Антитела
Суперсдвиг
17.
18.
Связывание олигонуклеотидов, соответствующих предсказанным SF-1сайтам, с белками экстракта ядер клеток семенников крыс (Э) и с тем же
экстрактом после его инкубации c АТ к SF-1 (Э + АТ)
- - - - - - +
- + - + - + -
- - +
- + -
- - + - - +
- + - - + -
- - + - - +
- + - - + -
Э + АТ
Э
- комплекс ДНК/SF-1,
- комплекс ДНК/(SF-1 +
неидентифицированный
белок);
SF-1
cons
SF-1
mut
Cyp17
(мышь)
-283
HSD3b
(мышь)
-113
- - - - - - + - - +
- + - + - + - - + -
Ad
(бык)
-428
Oxt
Cyp11B2
(крыса) (человек)
-159
-324
- - + - - +
- + - - + -
- - +
- + -
SF-1
(мышь)
-224
- - +
- + -
при добавлении
специфических антител
наблюдается
исчезновение
(ослабление) этих
комплексов
Э + АТ
Э
Под названием гена
указана позиция сайта
относительно старта
транскрипции
SF-1
cons
SF-1
mut
StAR
(макака)
-228
Cyp11B1
(морская
свинка)
-126
Cyp11B3
(крыса)
-309
LHbeta
(свинья)
-114
Cyp11B1
(овца)
-337
Slp
(мышь)
+5299
19.
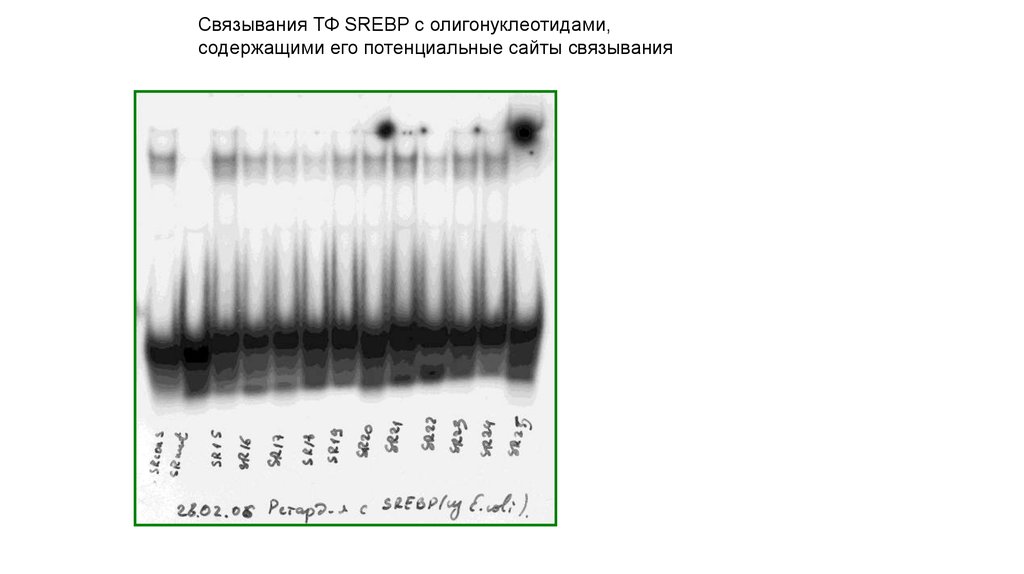
Связывания ТФ SREBP c олигонуклеотидами,содержащими его потенциальные сайты связывания
20.
Частотные матрицы и варианты консенсуса GRbs, полученныев результате анализа 25 (А) и 81 (B) экспериментально
выявленных сайтов
Позитивные GREs (n = 25)
1 2 3 4 5 6 7 8 9 10 11
A
5 15 10 55 10 55 40 15 20 15 0
C
25 0 20 10 75 25 25 15 35 0 0
G
45 65 20 0 0 10 15 25 25 5 95
T
25 20 50 35 15 10 20 45 20 80 5
Cons G G T A C A N N N T G
(n = 81) [GR-TRRD]
1 2 3 4 5 6 7
A
38 13 44 66 6 72 26
C
14 6 17 9 79 14 37
G
37 71 20 9 10 5 17
T
11 10 19 16 5 9 20
Cons G/A G А A C A N
8
32
13
24
31
N
9
25
25
29
21
N
12
5
0
5
90
T
10
8
2
3
87
T
13
5
25
5
65
T
11
0
2
97
1
G
14
0
100
0
0
C
12
6
3
2
89
T
13
6
13
8
73
T
15
5
10
0
85
T
14
1
94
2
3
C
15
15
16
5
68
T
Частоты встречаемости нуклеотидов выражены в %
21.
“ПОЗИТИВНЫЕ” GREs(n=88)
I
GR
GR
“НЕГАТИВНЫЕ” GRE
(n=29)
GR
GR
GnACAnnnTGTTCT
GnACAnnnTGTTCT
~50% всех случаев
<10% всех случаев
II
AGAGTTAATGTTCT
GR
X
XGRAF GR
nnnnnnnnTGTCT
GRE γ-фибриногена
лягушки
III
HNF3
TBP
ACAT
GtgCcnnnTgTTCT
GR
GR
GRE из гена глюкозо-6фосфатазы крысы
ACAAATAT
tccCAnnnnTGTTT A
GR
GR
GRE из промотора гена
остеокальцина человека
22.
Позитивный GREНегативный (tethering) GRE
Композиционный GRE
Наличие палиндрома GRE в
последовательности ДНК
индуцирует образование
димера ГР.
В виде димера ГР, как
правило, активирует
транскрипцию (сверху).
Наличие мономера ГР в
любом из вариантов ДНКбелковых комплексов обычно
подавляет транскрипцию
(внизу).
Треугольник означает другой
фактор транскрипции.
Lefstin JA, Yamamoto KR, 1998
23.
24.
Тонкий делеционный анализ промоторного района длявыявления HRE (элемент, ответственный
за реакцию на гипоксию)
The indicated 5’ or 3’ deletion
mutant of the ROR4 reporter
was transfected along with
pSVgal into Caco2 cells.
Eighteen hours after transfection
the cells were cultured for 24 h
under normoxia (open bar) or
hypoxia (closed bar).
Relative luciferase
activity is represented,
normalized to that in the
transfected cells cultured under
normoxia.
Miki N, Ikuta M, Matsui T. Hypoxia-induced activation of the retinoic acid receptor-related orphan receptor a4 gene
by an interaction between hypoxia-inducible factor-1 and Sp1. J Biol Chem. 2004 Apr 9;279(15):15025-31.
25.
Мутационный анализ HRE (сайта связывания ТФ HIF-1)как пример использования данного метода для
исследования функциональности сайта. Пример 1
Effect of site-directed mutagenesis on CRLR promoter function.
A) Sequence of a wild -type and mutant
pGL3-CRLR reporter plasmids. pGL3-CRLR516 and pGL3-CRLR-516 mut sequences
were identical (hyphens) except for a 3-bp
substitution within the HIF-1 binding site
(underlined).
B) Transient expression assay. Primary
human dermal microvascular endothelial cells
were transfected with ph PG-TK and pGL3CRLR-516 or pGL3-CRLR-516 mut.
Transfected cells were incubated at 20% O2
for 4 h, and then triplicate plates were
incubated at 20 or 0.1% O2 for 16 h. The
pGL3/ph PG-TK ratio was determined for
each plate and was normalized to the results
for pGL3-CRLR-516 in cells at 20% O2
(Relative pGL3/firefly-activity). The ratio of
relative pGL3 activity was also calculated to
determine induction by hypoxia.
Chen KF, Lai YY, Sun HS, Tsai SJ. Transcriptional repression of human cad gene by hypoxia inducible factor-1a.
Nucleic Acids Res. 2005 Sep 9;33(16):5190-8.
26.
Мутационный анализ HRE (сайта связывания ТФ HIF-1)как пример использования данного метода для
исследования функциональности сайта. Пример 2
The transcriptional activation was
measured by a luciferase reporter
assay. HepG2 cells were
transiently transfected with wildtype and mutated promotor
constructs. For each construct
wild-type HRE1-5 are indicated.
After transfection, the cells were
cultured at either 21% or 1%
oxygen for 24 hours before the
assessment of luciferase activity.
In each experiment, luciferase
activity of cells cultured in hypoxia
was determined relative to that of
ambient control cells.
(A) Enhancement of luciferase
activity in wild-type promotor
construct after incubation at 1%
oxygen.
(B) Effect of mutations of single
HREs on the hypoxia-mediated
induction.
(C) Capacity of individual wild-type
HREs to drive transcriptional
expression from the PAI-1
promotor after hypoxic treatment.
T. Fink, A. Kazlauskas, L. Poellinger, P. Ebbesen, and V. Zachar. Identification of a tightly regulated hypoxia-response
element in the promoter of human plasminogen activator inhibitor–1. Blood. 2002; 99:2077-2083
27.
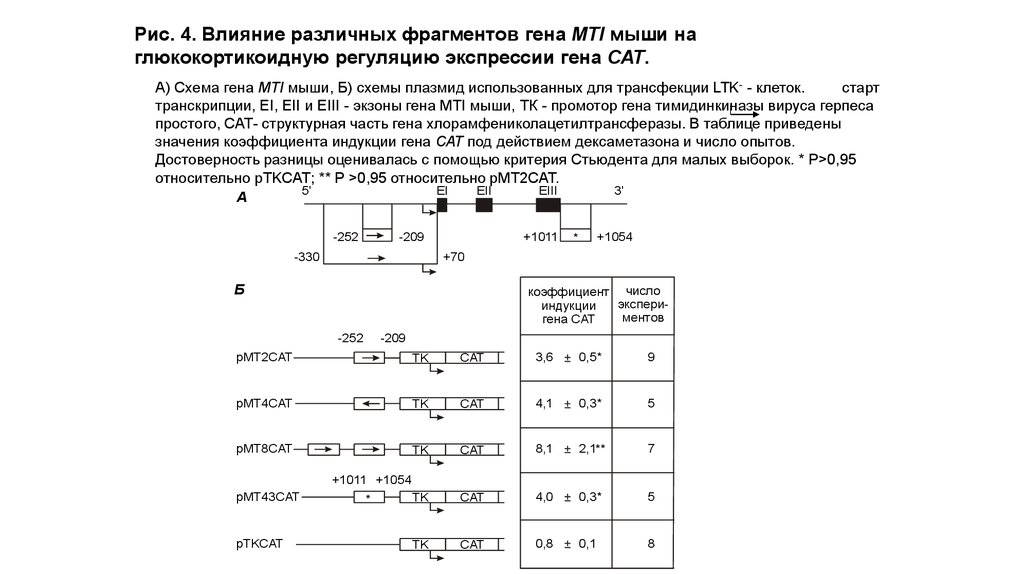
Рис. 4. Влияние различных фрагментов гена МТI мыши наглюкокортикоидную регуляцию экспрессии гена САТ.
А) Схема гена МТI мыши, Б) схемы плазмид использованных для трансфекции LTK- - клеток.
старт
транскрипции, EI, EII и EIII - экзоны гена МТI мыши, ТК - промотор гена тимидинкиназы вируса герпеса
простого, САТ- структурная часть гена хлорамфениколацетилтрансферазы. В таблице приведены
значения коэффициента индукции гена САТ под действием дексаметазона и число опытов.
Достоверность разницы оценивалась с помощью критерия Стьюдента для малых выборок. * P>0,95
относительно pTKCAT; ** P >0,95 относительно pMT2CAT.
5'
A
EI
-252
EII
-209
-330
EIII
+1011
3'
+1054
*
+70
Б
коэффициент число
эксперииндукции
ментов
гена САТ
-252
-209
pMT2CAT
TK
CAT
3,6
0,5*
9
pMT4CAT
TK
CAT
4,1
0,3*
5
pMT8CAT
TK
CAT
8,1
2,1**
7
TK
CAT
4,0
0,3*
5
TK
CAT
0,8
0,1
8
+1011 +1054
pMT43CAT
pTKCAT
*
28.
29.
30.
Genomic footprintingTranscriptional Regulation in Eukaryotes: Concepts, Strategies, and Techniques. 2000, Cold Spring Harbor Laboratory Press
31.
Ligation-mediated PCRLM-PCR is a powerful technique for
detecting DNA strand breaks within a
complex sample.
The technique is well suited for this
purpose because of its extreme
sensitivity and specificity.
LM-PCR was first described by
Barbara Wold and colleagues.
The technique is typically performed
on purified genomic or plasmid DNA
that has previously been cleaved with
limiting concentrations of a nuclease
(e.g., DNase I, micrococcal nuclease,
or a restriction endonuclease).
Alternatively, LM-PCR can be
performed on DNA that had been
modified with DMS or potassium
permanganate, followed by strand
cleavage at the modified nucleotides
by piperidine.
Transcriptional Regulation in Eukaryotes: Concepts, Strategies, and Techniques. 2000, Cold Spring Harbor Laboratory Press
32.
In vivo genomic footprinting demonstrates involvementof CRE-II site in SMN2 gene expression
Intact nuclei isolated from brain and
liver cells of Smn/ mice expressing
eight copies of human SMN2 gene
were exposed to limited dimethylsulfate
treatment, and genomic DNA was
isolated. The DNA was then subjected
to piperidine treatment followed by LMPCR amplification of the SMN2
promoter. The LM-PCR products were
separated on 6% sequencing gel and
exposed to x-ray film. N, naked DNA,
where DNA was treated with dimethyl
sulfate and piperidine after isolation; C,
DNA isolated from control cells treated
in vivo with dimethyl sulfate. The stars
and arrows indicate hypersensitive and
protected G residues, respectively. A,
lower strand spanning from 210 to 283
bp. B, upper strand spanning from 312
to 443 bp of the SMN2 promoter
S. Majumder, S. Varadharaj, K. Ghoshal et al. Identification of a Novel Cyclic AMP-response Element (CRE-II) and the Role of CREB-1 in the cAMP-induced
Expression of the Survival Motor Neuron (SMN) Gene //The Journal of Biological Chemistry / Vol. 279, No. 15, Issue of April 9, pp. 14803–14811, 2004
33.
Принцип метода иммунопреципитации in vivo34.
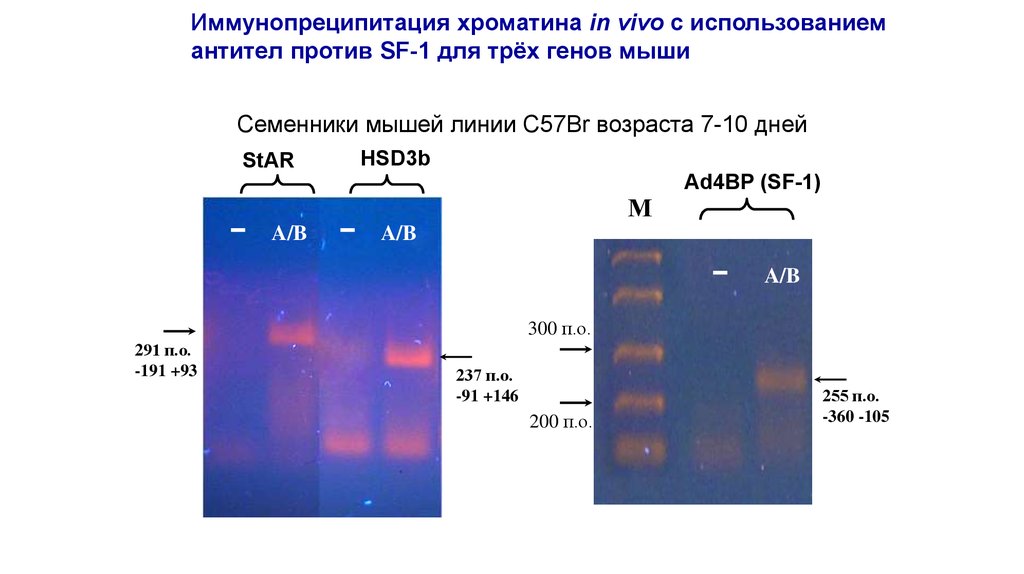
Иммунопреципитация хроматина in vivo с использованиемантител против SF-1 для трёх генов мыши
Семенники мышей линии C57Br возраста 7-10 дней
HSD3b
StAR
Ad4BP (SF-1)
-
A/B
-
М
A/B
-
A/B
300 п.о.
291 п.о.
-191 +93
237 п.о.
-91 +146
200 п.о.
255 п.о.
-360 -105
35.
TRANSFAC and its module TRANSCompel:transcriptional gene regulation in eukaryotes
V. Matys*, O. V. Kel-Margoulis, E. Fricke, I. Liebich, S. Land, A. Barre-Dirrie, I. Reuter, D. Chekmenev, M.
Krull, K. Hornischer, N. Voss, P. Stegmaier, B. Lewicki-Potapov, H. Saxel, A. E. Kel and E. Wingender
Table TRANSFAC
Rel. 7.0
FACTOR
6133
Homo sapiens
1040
Mus musculus
765
D.melanogaster
233
A.thaliana
1751
S.Cerevisiae
368
SITE
7915
MATRIX
398
GENE (all entries)
2397
H.sapiens
608
M.musculus
417
D.melanogaster
145
A.thaliana
115
S.cerevisiae
195
GENE (entries with SITE links)
1504
CLASS
50
CELL
1307
TRANSCompel Rel. 7.0
COMPEL (composite elements) 322
36.
Transcription regulatory regions database (TRRD): itsstatus in 2002
Kolchanov N.A., Ignatieva E.V., Ananko E.A., Podkolodnaya O.A., Stepanenko
I.L., Merkulova T.I., Pozdnyakov M.A., Podkolodny N.L., Naumochkin A.N.,
Romashchenko A.G.


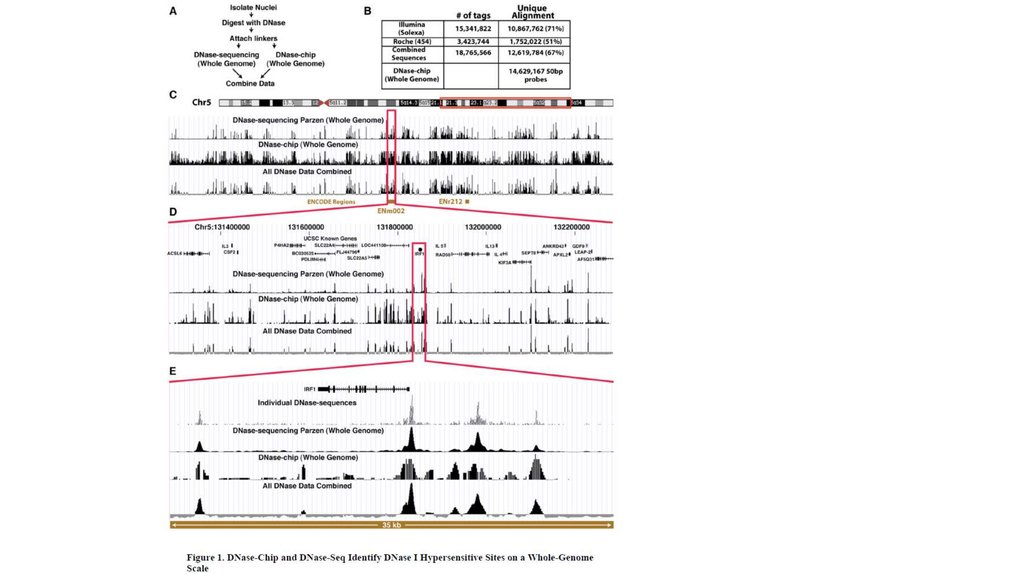




























 Биология
Биология








