Похожие презентации:
Неметаллы. Общая характеристика
1. Неметаллы
2. Неметаллы
План лекции1.Общая
характеристика
неметаллов
2.Элементы VII
группы ПСХЭ
3. Элементы VI
группы ПСХЭ
4. Элементы V группы
ПСХЭ
5. Элементы IV
группы ПСХЭ
3. Общая характеристика неметаллов
Неметаллы в ПС в основномрасполагаются в конце малых и
больших периодов. Количество
электронов на последнем
энергоуровне равно номеру
группы. Для завершения внешних
энергоуровней неметаллы
присоединяют электроны,
следовательно, являются
окислителями.
При взаимодействии с
металлами образуют соединения с
ионной связью. С водородом
образуют летучие соединения. С
кислородом образуют кислотные
оксиды.
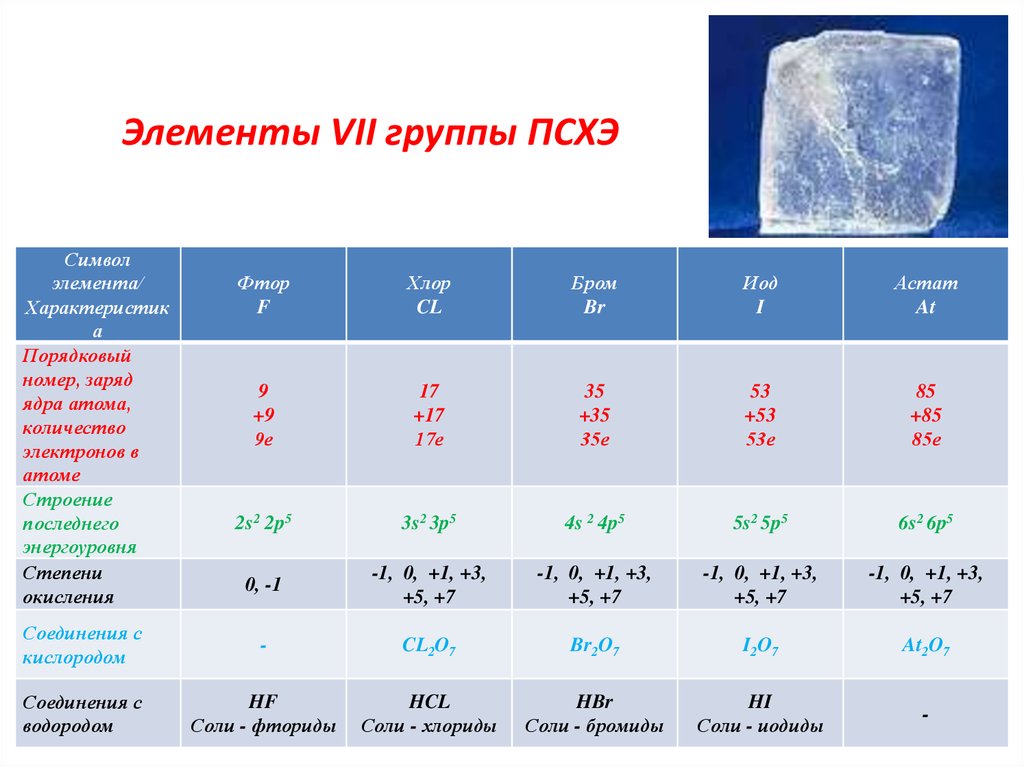
4. Элементы VII группы ПСХЭ
Символэлемента/
Характеристик
а
Порядковый
номер, заряд
ядра атома,
количество
электронов в
атоме
Строение
последнего
энергоуровня
Степени
окисления
Фтор
F
Хлор
CL
Бром
Br
Иод
I
Астат
At
9
+9
9е
17
+17
17е
35
+35
35е
53
+53
53е
85
+85
85е
2s2 2p5
3s2 3p5
4s 2 4p5
5s2 5p5
6s2 6p5
0, -1
-1, 0, +1, +3,
+5, +7
-1, 0, +1, +3,
+5, +7
-1, 0, +1, +3,
+5, +7
-1, 0, +1, +3,
+5, +7
Соединения с
кислородом
-
CL2O7
Br2O7
I2O7
At2O7
Соединения с
водородом
HF
Соли - фториды
HCL
Соли - хлориды
HBr
Соли - бромиды
HI
Соли - иодиды
-
5. Элементы VII группы ПСХЭ отдельные представители
HCLO – кислота хлорноватистая, соли –гипохлориты, слабая кислота
HCLO2 – кислота хлористая, соли – хлориты,
слабый электролит
HCLO3 – хлорноватая кислота, соли - хлораты
HCLO4 – хлорная кислота, соли – перхлораты,
сильная кислота
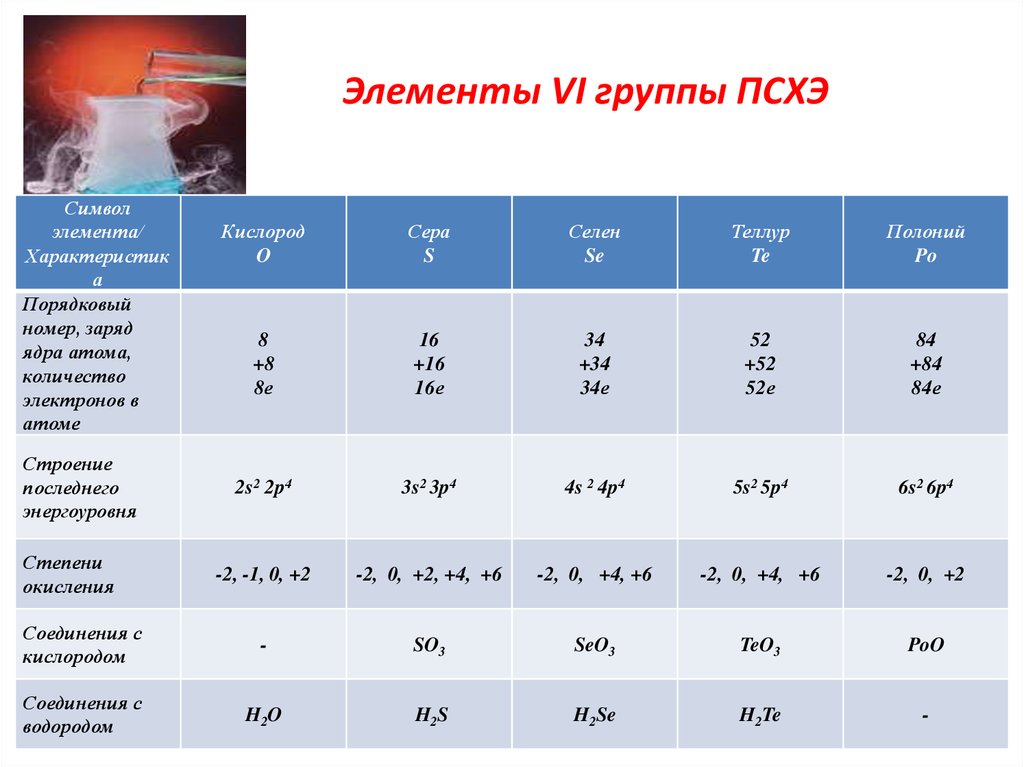
6. Элементы VI группы ПСХЭ
Символэлемента/
Характеристик
а
Порядковый
номер, заряд
ядра атома,
количество
электронов в
атоме
Кислород
O
Сера
S
Селен
Se
Теллур
Te
Полоний
Po
8
+8
8е
16
+16
16е
34
+34
34е
52
+52
52е
84
+84
84е
2s2 2p4
3s2 3p4
4s 2 4p4
5s2 5p4
6s2 6p4
-2, -1, 0, +2
-2, 0, +2, +4, +6
-2, 0, +4, +6
-2, 0, +4, +6
-2, 0, +2
Соединения с
кислородом
-
SO3
SeO3
TeO3
PoO
Соединения с
водородом
H2O
H2S
H2Se
H2Te
-
Строение
последнего
энергоуровня
Степени
окисления
7. Элементы VI группы ПСХЭ отдельные представители
H2S – сероводородная кислота, солисульфиды, гидросульфиды
H2SO3 - сернистая кислота, соли –
сульфиты, гидросульфиты
H2SO4 - серная кислота, соли –
сульфаты, гидросульфаты
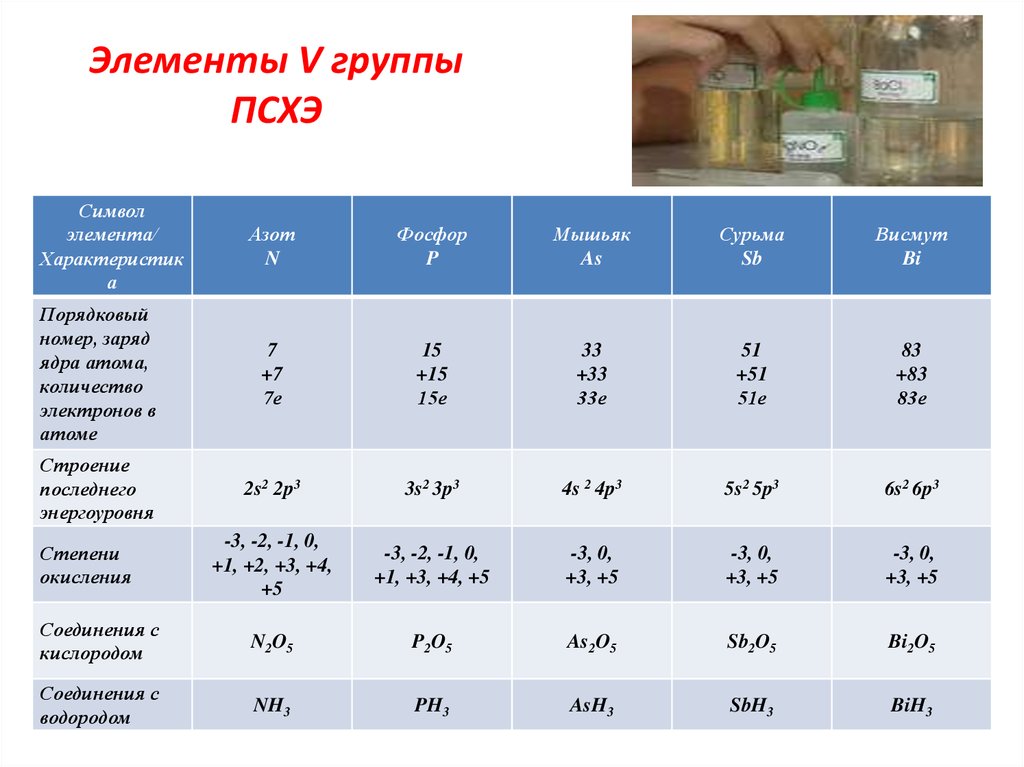
8. Элементы V группы ПСХЭ
Символэлемента/
Характеристик
а
Азот
N
Фосфор
P
Мышьяк
As
Сурьма
Sb
Висмут
Bi
Порядковый
номер, заряд
ядра атома,
количество
электронов в
атоме
7
+7
7е
15
+15
15е
33
+33
33е
51
+51
51е
83
+83
83е
Строение
последнего
энергоуровня
2s2 2p3
3s2 3p3
4s 2 4p3
5s2 5p3
6s2 6p3
-3, -2, -1, 0,
+1, +2, +3, +4,
+5
-3, -2, -1, 0,
+1, +3, +4, +5
-3, 0,
+3, +5
-3, 0,
+3, +5
-3, 0,
+3, +5
Соединения с
кислородом
N2O5
P2O5
As2O5
Sb2O5
Bi2O5
Соединения с
водородом
NH3
PH3
AsH3
SbH3
BiH3
Степени
окисления
9. Элементы V группы ПСХЭ отдельные представители
NH3 – аммиак, водный раствор – NH4OH –нашатырный спирт, гидроксид аммония
HNO2 – азотистая кислота, соли – нитриты
HNO3 – азотная кислота, соли – нитраты
Н3PO4 – фосфорная кислота, соли – фосфаты,
гидрофосфаты, дигидрофосфаты
10. Элементы IV группы ПСХЭ
Символэлемента/
Характеристик
а
Углерод
C
Кремний
Si
Германий
Ge
Олово
Sn
Свинец
Pb
Порядковый
номер, заряд
ядра атома,
количество
электронов в
атоме
6
+6
6е
14
+14
14е
32
+32
32е
50
+50
50е
82
+82
82е
Строение
последнего
энергоуровня
2s2 2p2
3s2 3p2
4s 2 4p2
5s2 5p2
6s2 6p2
Степени
окисления
-4, 0,
+2, +4
-4, 0,
+2, +4
-4, 0, +4
-4, 0,
+2, +4
-4, 0,
+2, +4
Соединения с
кислородом
CO2
SiO2
GeO2
SnO2
PbO2
Соединения с
водородом
CH4
SiH4
GeH4
SnH4
PbH4
11. Элементы IV группы ПСХЭ отдельные представители
CO – угарный газCO2 - углекислый газ
H2CO3 – угольная кислота, соли –
карбонаты, гидрокарбонаты
H2SiO3 – кремниевая кислота, соли –
силикаты, гидросиликаты








 Химия
Химия








