Похожие презентации:
Кинетика ферментативных реакций
1.
Кинетика ферментативных реакцийV = Vmax
[S]
──────
[S] + КМ
Vmax
V = ──────
1 + КМ/[S]
2. Кинетика ферментативных реакций
• Кинетическая схема Михаэлиса-Ментенk1
k2
E+S
ES
k-1
v0 = k2[ES]
E+P
3. Квазистационарное приближение
E+Sk1
ES
k2
E+P
k-1
• Скорость образования ES = Скорость
расходования ES
d[ES]
dt
k1[E][S] = k-1[ES] + k2[ES]
=0
4.
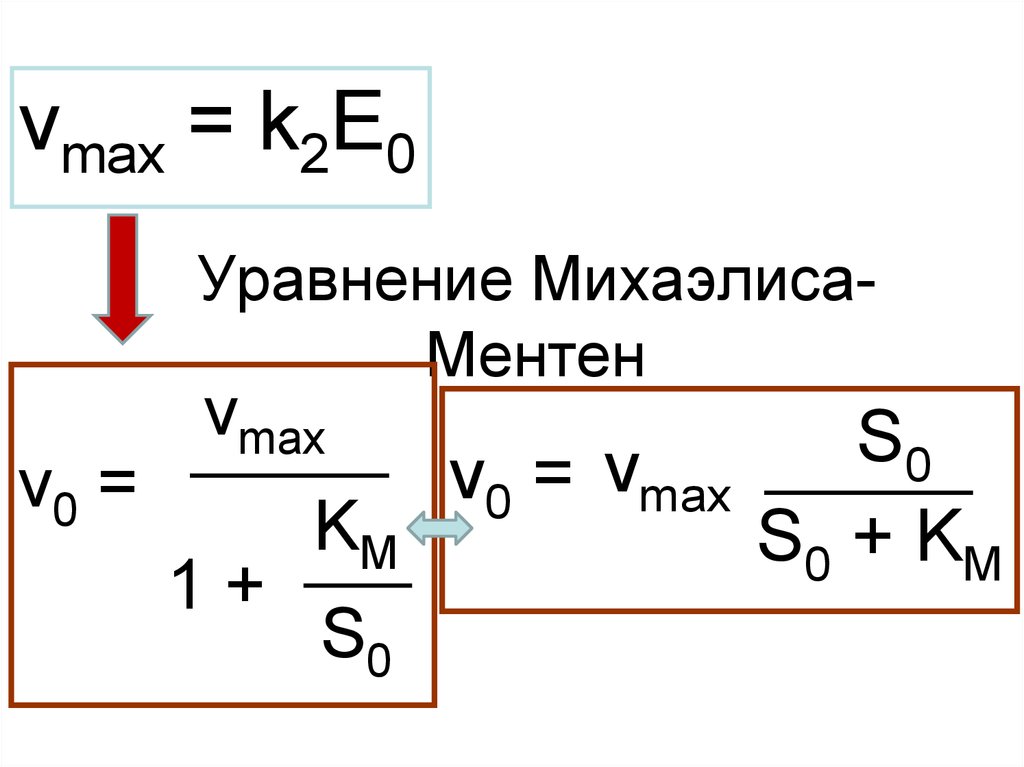
5. Уравнение Михаэлиса-Ментен
vmax = k2E0Уравнение МихаэлисаМентен
v0 =
vmax
1+
KM
S0
v0 = vmax
S0
S0 + KM
6.
7.
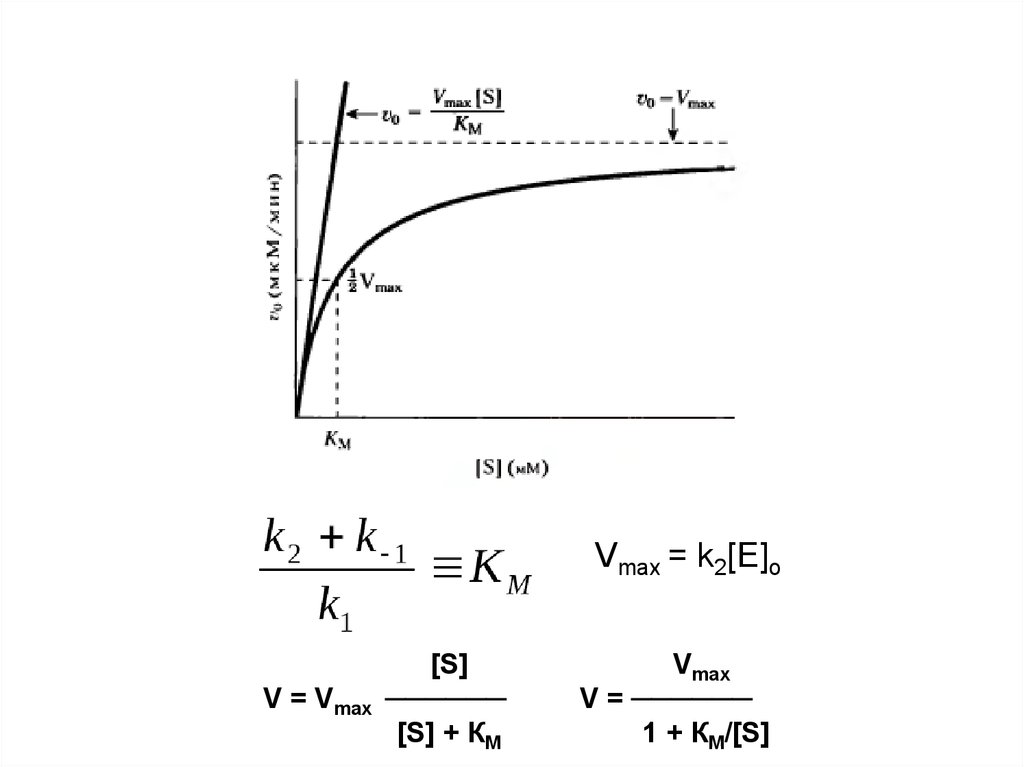
Vmax = k2[E]oV = Vmax
[S]
──────
[S] + КМ
Vmax
V = ──────
1 + КМ/[S]
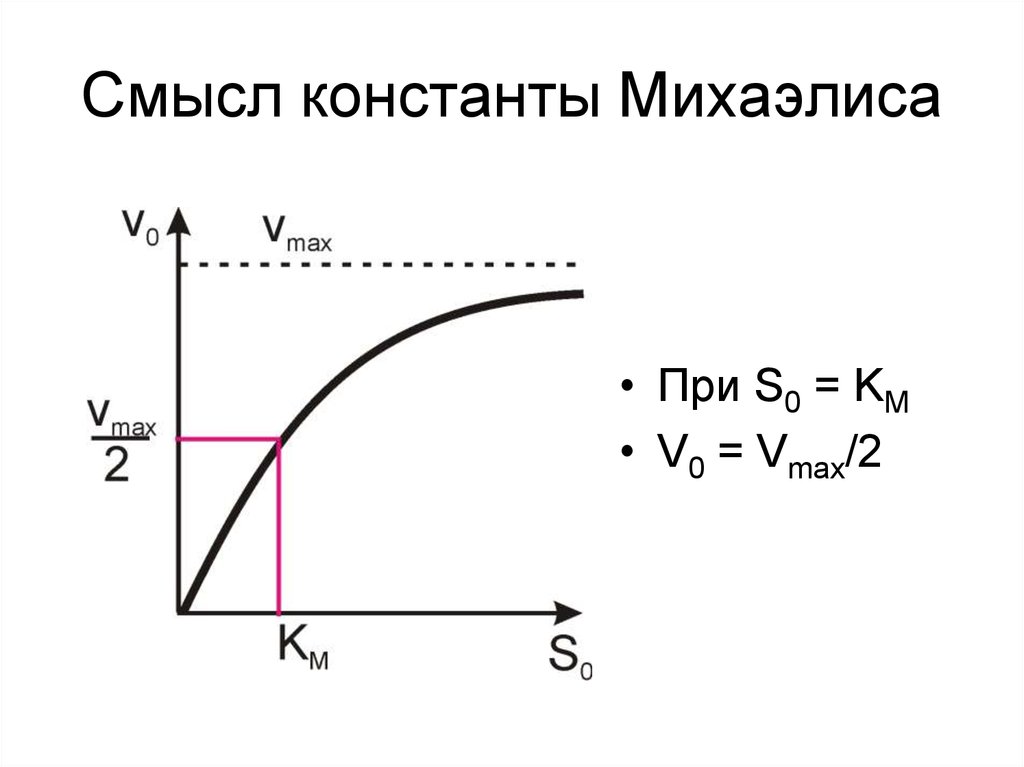
8. Смысл константы Михаэлиса
• При S0 = KM• V0 = Vmax/2
9.
Vmax = k2[E]oV = Vmax
[S]
──────
[S] + КМ
Vmax
V = ──────
1 + КМ/[S]
10.
Величины КМ для различных ферментовФермент
Химотрипсин
Субстрат
КМ , М
Ацетил Lтриптофанамид
5 10-3
СО2
8 10-3
Карбоангидраза
Аргинин-тРНКсинтетаза
E+S
3 10 -6
4 10 -7
3 10 -4
Arg
тРНК
АТР
k1
ES
k-1
k2
E+P
11.
Величины k2 для различных ферментовVmax = k2[E]o
Фермент
Число оборотов/cек
Карбоангидраза
Ацетилхолинэстераза
Химотрипсин
ДНК-полимераза I
Лизоцим
Рибулозо-1,5карбоксилаза
600 000
25 000
1000
15
0.5
0.05
12.
График Лайнуивера – Берка,
V = Vmax
1/V
Vmax
V = ──────
1 + КМ/[S]
tg = KM/Vmax
-1 / KM
[S]
──────
[S] + КМ
График Иди-Хофсти
1 / Vmax
1/[S]
KM . 1
1
1
=
+ V [S]
V
V
max
max
V = Vmax - KM . V
[S]
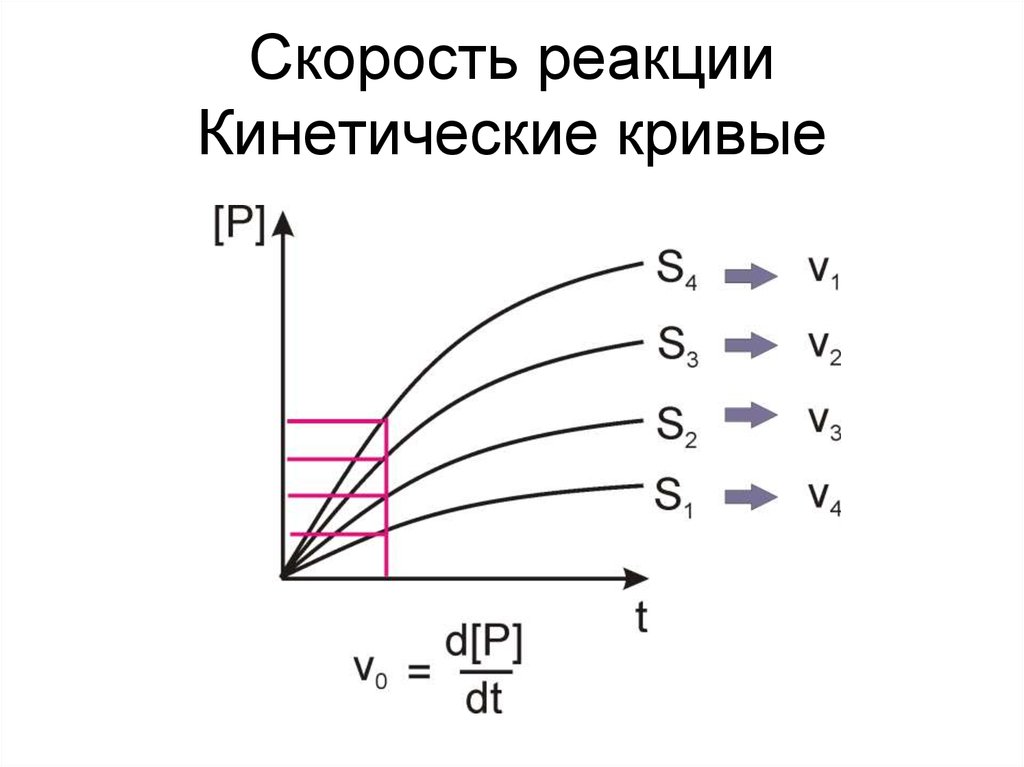
13. Скорость реакции Кинетические кривые
14.
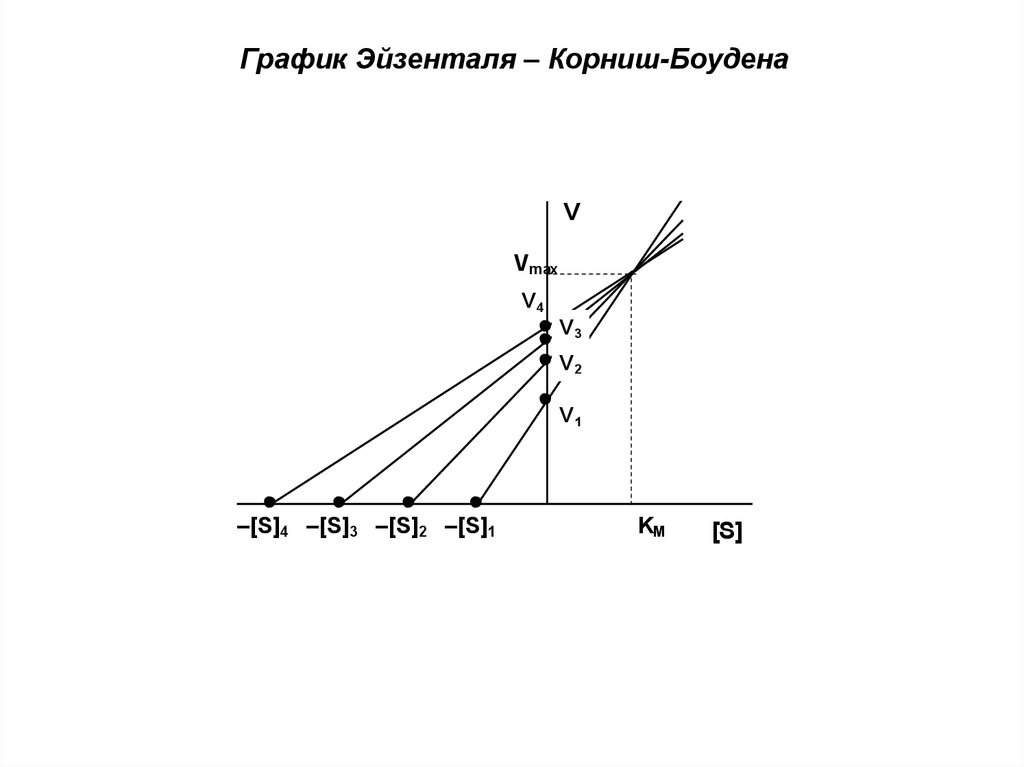
График Эйзенталя – Корниш-БоуденаV
Vmax
V4
V3
V2
V1
–[S]4 –[S]3 –[S]2 –[S]1
KM
[S]
15.
16.
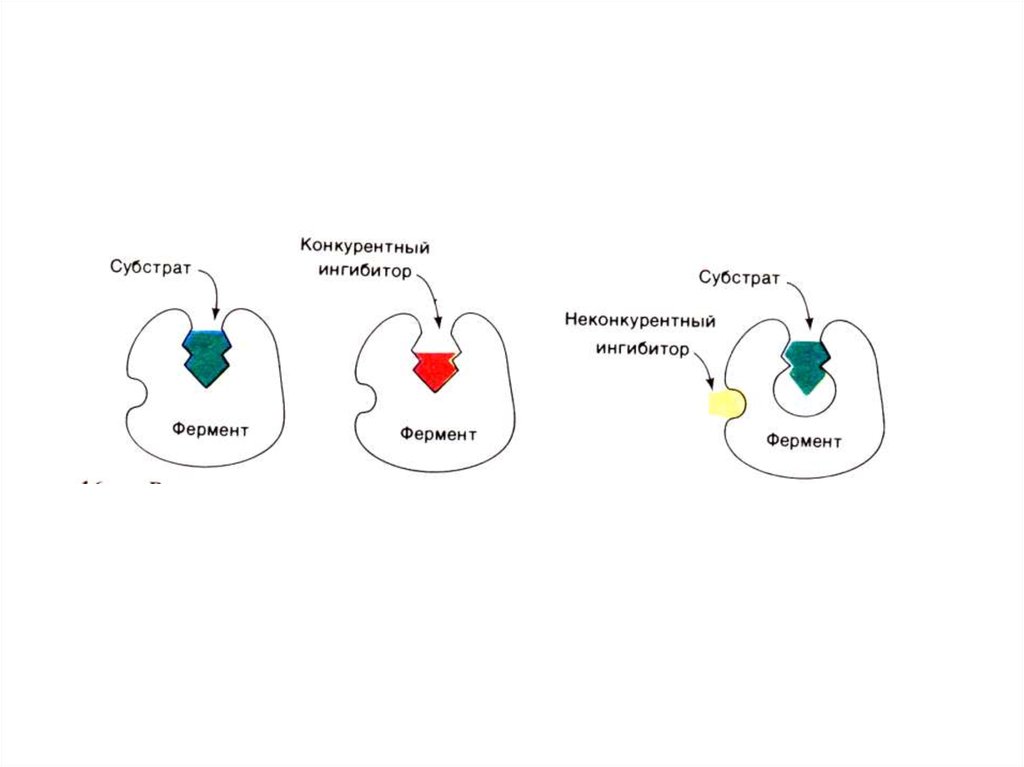
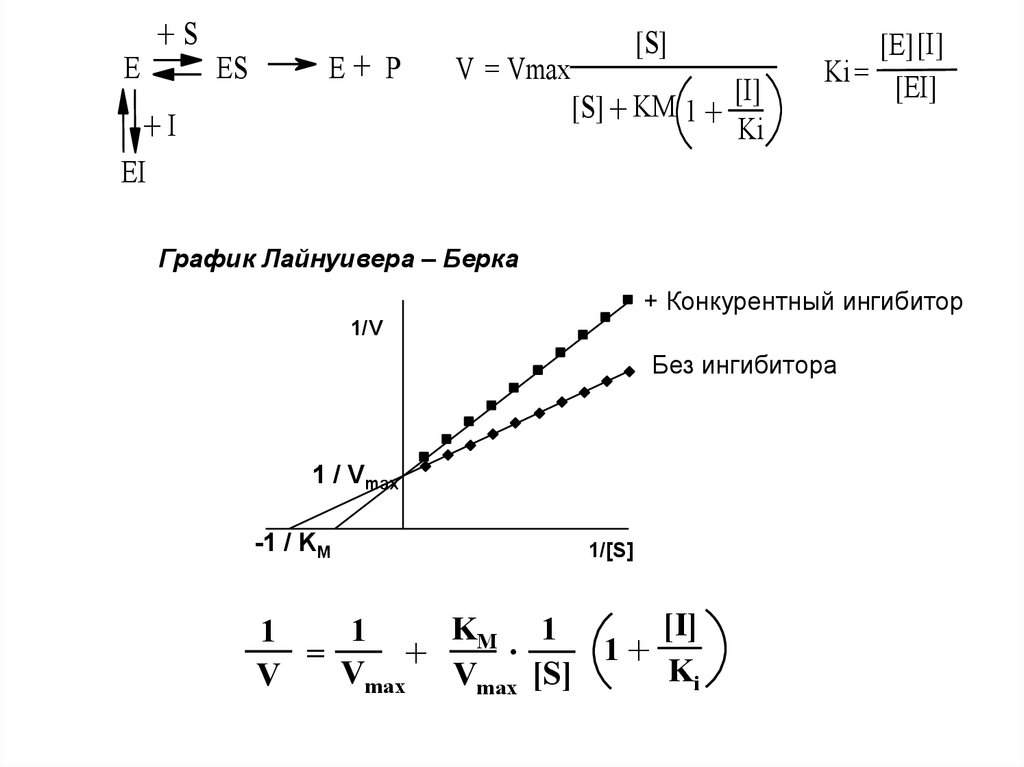
+SE
ES
E+ P
[S]
V = Vmax
[S] + KM 1 +
+I
[I]
Ki
[E][I]
Ki =
[EI]
EI
График Лайнуивера – Берка
+ Конкурентный ингибитор
1/V
Без ингибитора
1 / Vmax
-1 / KM
1/[S]
[I]
KM . 1
1
1
1+
=
+
Ki
Vmax Vmax [S]
V
17.
График Иди-ХофстиVmax
Без ингибитора
+ Конкурентный ингибитор
__tgɑ = KM
Vmax/KM
V = Vmax
KM .
V
[I]
[S] 1 + Ki
18.
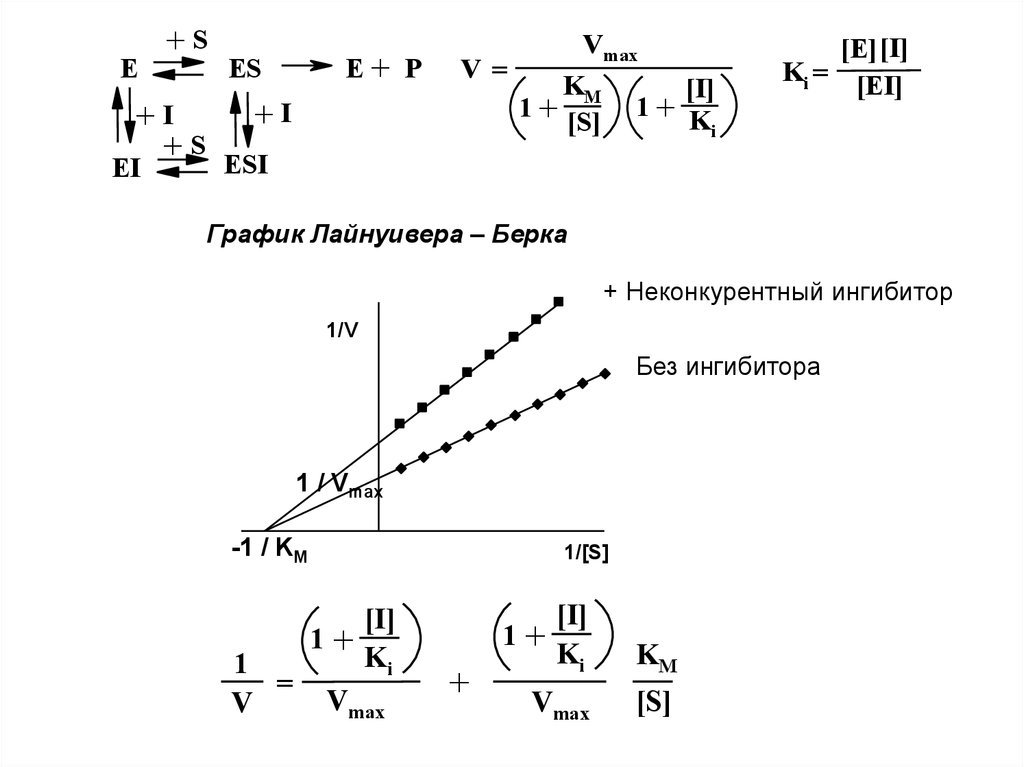
E+S
E+ P
ES
+I
+I
+ S ESI
EI
Vmax
V=
KM
[I]
1+ K
1+
[S]
i
[E][I]
Ki =
[EI]
График Лайнуивера – Берка
+ Неконкурентный ингибитор
1/V
Без ингибитора
1 / Vmax
-1 / KM
[I]
1+
Ki
1
=
Vmax
V
1/[S]
+
[I]
1+
Ki
KM
Vmax
[S]
19.
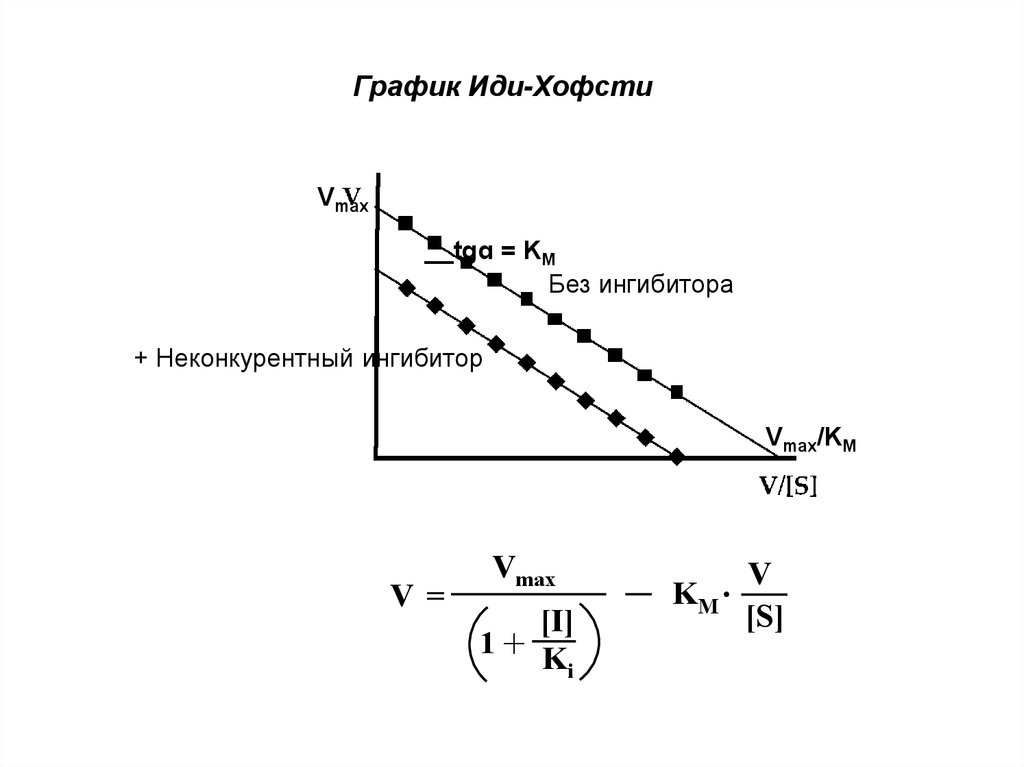
График Иди-ХофстиVmax
__tgɑ = KM
Без ингибитора
+ Неконкурентный ингибитор
Vmax/KM
V =
Vmax
1+
[I]
Ki
V
.
KM
[S]
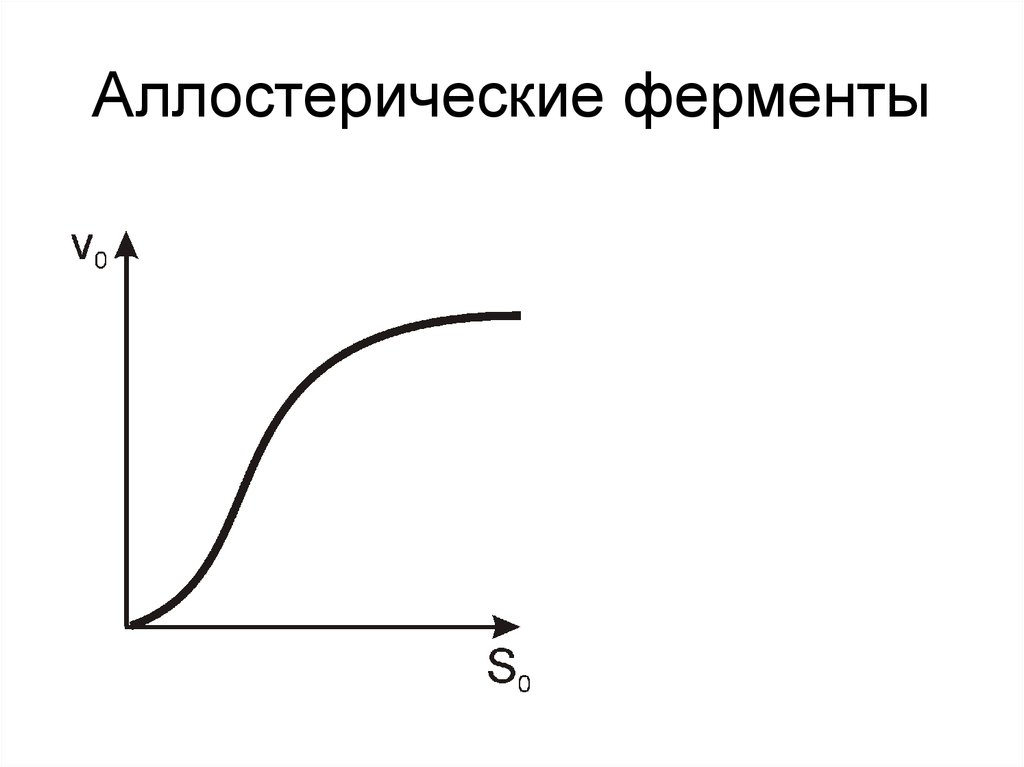
20. Аллостерические ферменты
21.
КЛАССЫ ФЕРМЕНТОВ1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Синтетазы (лигазы)
7. Транслоказы
22. Классификация ферментативных реакций
IUBMB,International Union of Biochemistry and
Molecular Biology
EC – Enzyme Classification
КФ – классификация ферментов
23. КФ(EC): N.N.N.N
• Класс• Подкласс
• Подподкласс
• Порядковый номер в подподклассе
24.
КЛАССЫ ФЕРМЕНТОВ1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Синтетазы (лигазы)
7. Транслоказы
25. 1. Оксидоредуктазы
Ферменты, катализирующиеокислительно-восстановительные
реакции
Подклассы – донор электронов
Подподклассы – акцептор электронов
26. Подклассы оксидоредуктаз, действующие на доноры:
• 1. CH-OH группу• 2. альдегидную или
оксогруппу
• 3. CH-CH группу
• 4. CH-NH2 группу
• 5. CH-NH группу
• 6. NADH или NADPH
• 7. прочие азотистые
соединения
• 8. сернистые соединения
• 9. гем
• 10. дифенолы и
родственные соединения
11. H2O2 в качестве
акцептора
12. H2
13. на один донор с
внедрением молекулы
кислорода
14. На пару доноров с
внедрением или
восстановлением
молекулы кислорода
…
27. 1. Оксидоредуктазы (25 подклассов)
Подкласс 1: Действующие на CH-OHгруппу донора (8 подподклассов)
Подподкласс 1: NAD+ или NADP+ в
качестве акцептора (403 реакции)
Реакция 1:
CH3CH2OH + NAD+
КФ: 1.1.1.1
CH3CHO + NADH + H+
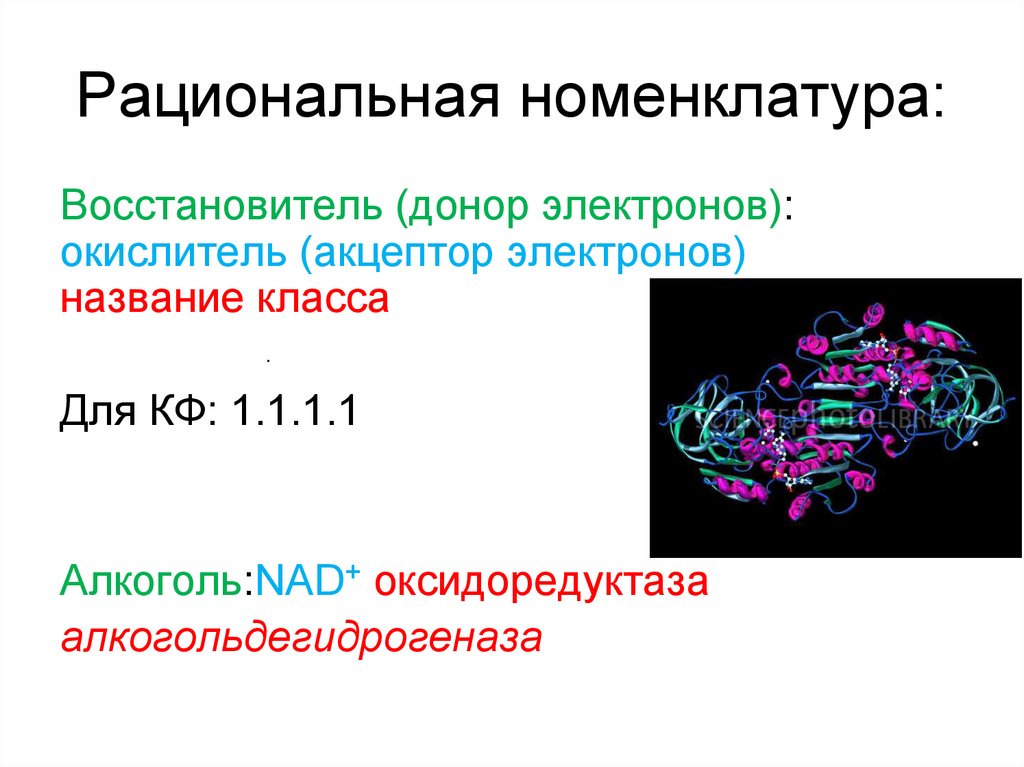
28. Рациональная номенклатура:
Восстановитель (донор электронов):окислитель (акцептор электронов)
название класса
.
Для КФ: 1.1.1.1
Алкоголь:NAD+ оксидоредуктаза
алкогольдегидрогеназа
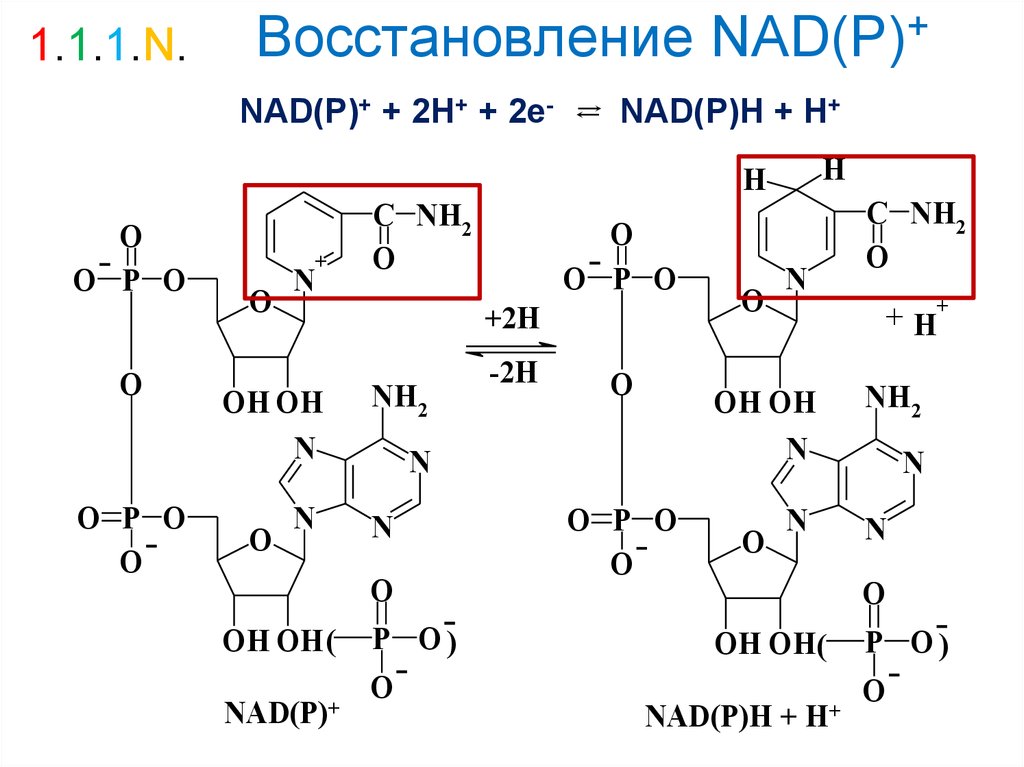
29. Восстановление NAD(P)+
1.1.1.N.Восстановление NAD(P)+
NAD(Р)+ + 2Н+ + 2е-
NAD(Р)Н + Н+
H
H
O
O P O
O
O P O
O
O
N
+
C NH2
O
+2H
OH OH
NH2
N
N
O
O
O P O
N
N
O
OH OH (
NAD(P)+
P O)
O
-2H
O
O P O
O
O
N
C NH2
O
+ H+
OH OH
NH2
N
N
O
N
N
O
OH OH(
NAD(P)H + H+
P O)
O
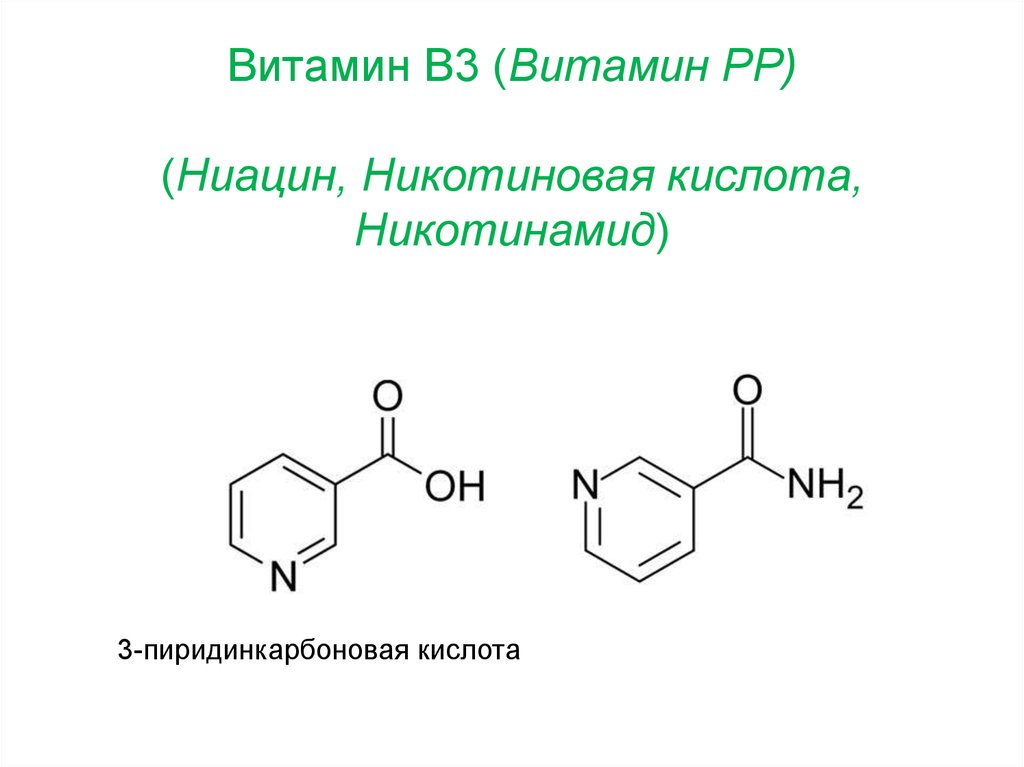
30. Витамин B3 (Витамин PP) (Ниацин, Никотиновая кислота, Никотинамид)
3-пиридинкарбоновая кислота31. 1.1.3.4. Глюкозооксидаза
Подкласс 1: Действующие на CH-OH группу донораПодподкласс 3: O2 в качестве акцептора
Флавопротеин
β-D-глюкоза + O2 = D-глюконо-1,5-лактон + H2O2
β-D-глюкоза:кислород 1-оксидоредуктаза
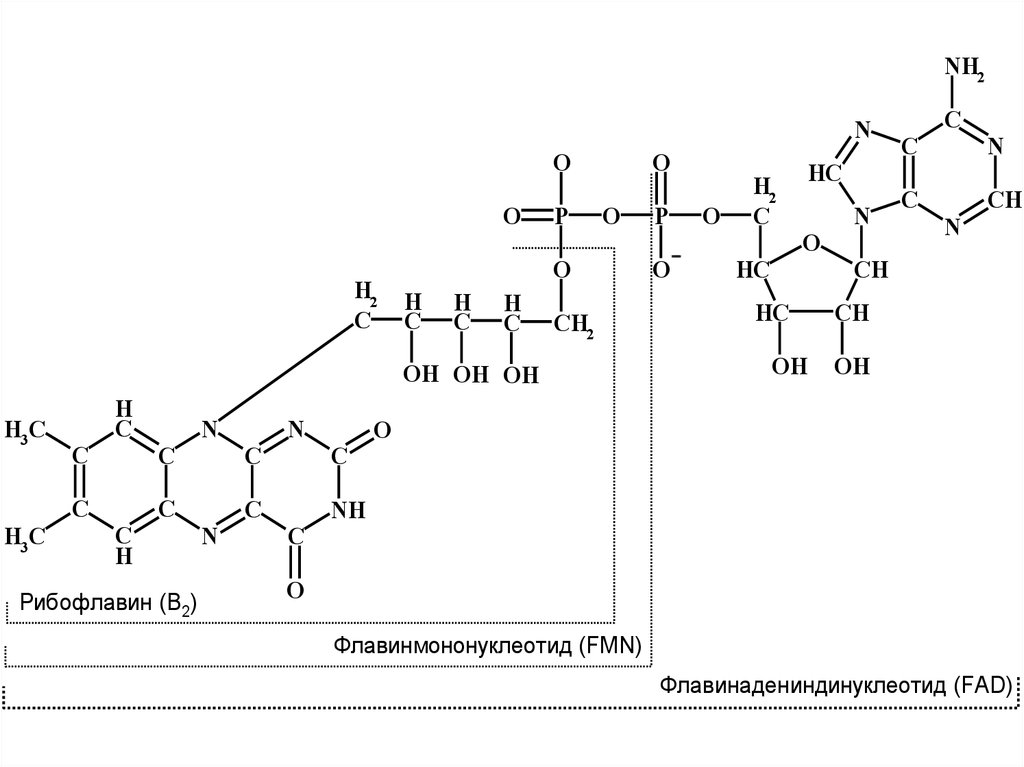
32.
NH2N
O
O
H2
C
P
O
O
O
H
C
H
C
H
C
CH2
OH OH OH
H3 C
H3 C
H
C
C
C
C
C
C
H
Рибофлавин (B2)
N
C
N
N
C
C
C
P
O
O
H2
C
HC
O
HC
N
C
C
N
C
CH
N
CH
HC
OH
CH
OH
O
NH
O
Флавинмононуклеотид (FMN)
Флавинадениндинуклеотид (FAD)
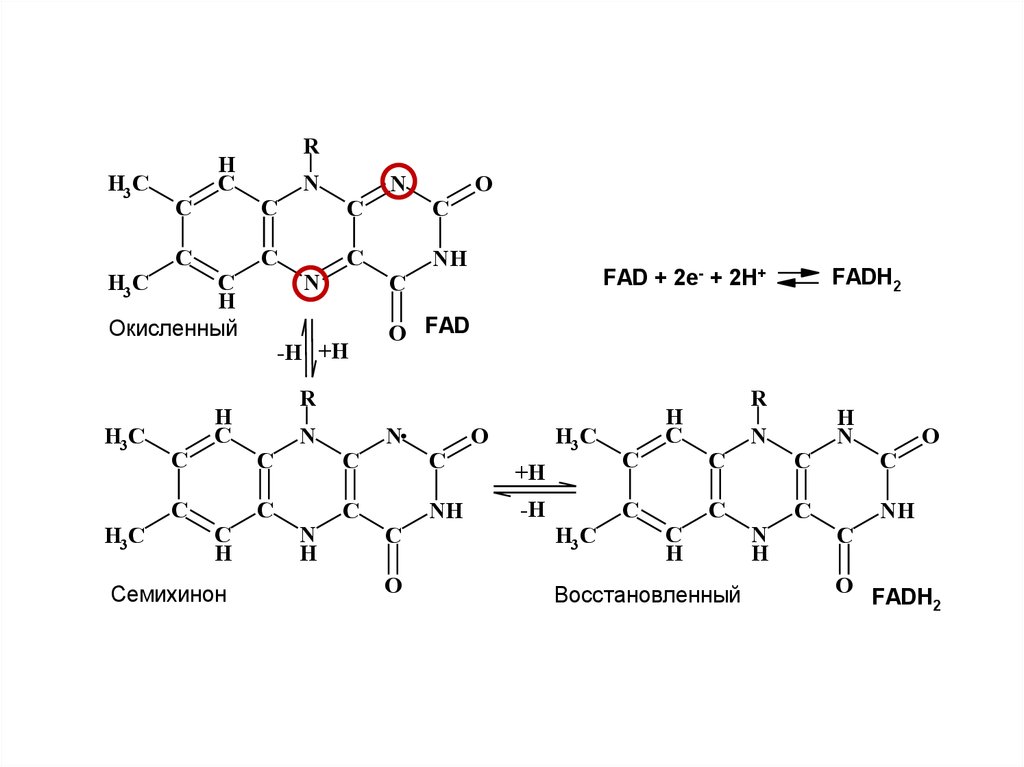
33.
H3 CR
H
C
C
C
C
C
C
H
Окисленный
H3 C
C
C
O
NH
C
C
C
N
C
N
H
FADH2
FAD + 2e- + 2H+
O FAD
R
C
Семихинон
N
C
-H +H
H
C
C
H
C
N
H3 C
H3 C
N
N
C
C
C
O
NH
H3 C
O
+H
-H
H3 C
R
H
C
C
C
C
C
C
H
Восстановленный
N
C
N
H
H
N
C
C
C
O
O
NH
FADH2
34.
1.2.4.1. Пируват дегидрогеназаПодкласс 2: Действующие на альдегидные и
кетогруппы донора
Подподкласс 4: дисульфид в качестве акцептора
Окислительное декарбоксилирование -кетокислот
пируватдегидрогеназный
комплекс
O
O
C
C O
+
CoA
+
NAD
+
C O
+
NADH
CH3
CH3
пируват
CoA
CO2
ацетил-СоА
Кофермент – тиаминпирофосфат (ТРР)
Простетическая группа – липоамид
+
+
H
35.
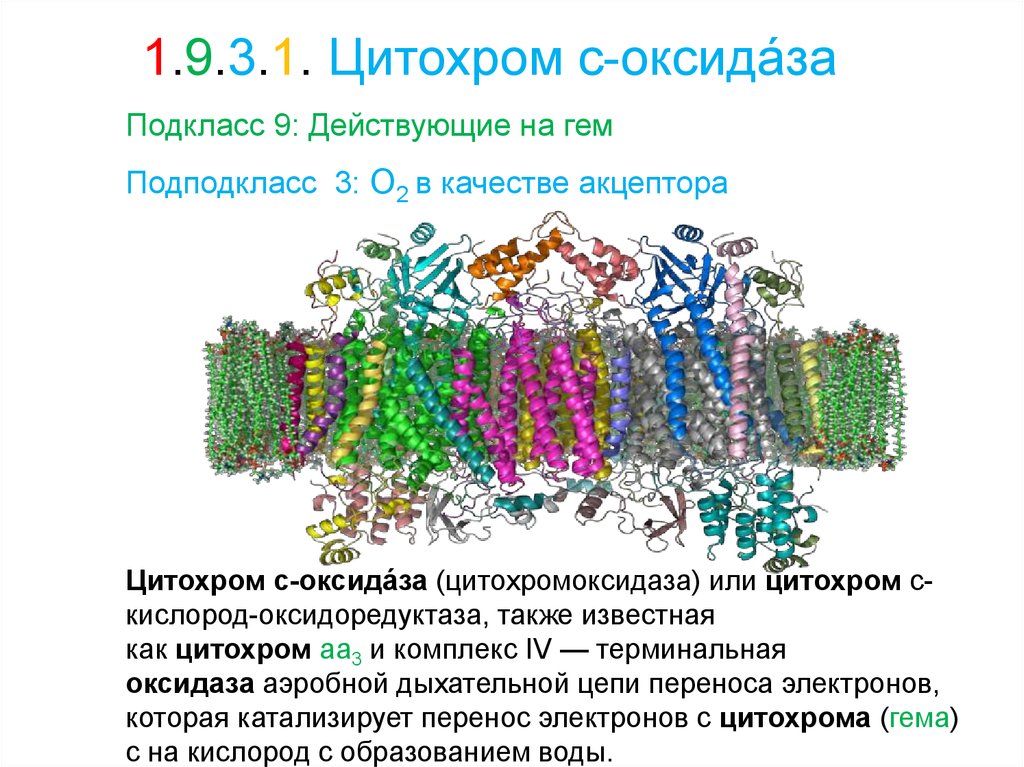
1.9.3.1. Цитохром с-оксида́заПодкласс 9: Действующие на гем
Подподкласс 3: O2 в качестве акцептора
Цитохром с-оксида́за (цитохромоксидаза) или цитохром скислород-оксидоредуктаза, также известная
как цитохром aa3 и комплекс IV — терминальная
оксидаза аэробной дыхательной цепи переноса электронов,
которая катализирует перенос электронов с цитохрома (гема)
с на кислород с образованием воды.
36. 1.11.1.6. Каталаза
Подкласс 11: Действующие на пероксид в качествеакцептора
Подподкласс 1: пероксидазы
Гем-содержащий фермент
2 H2O2 = O2 + 2 H2O
Рациональное название
пероксид водорода:пероксид водорода
оксидоредуктаза
37.
H2 CCH
CH3
CH2
H3 C
CH
N
N
Fe
N
N
CH3
H3 C
OOC
CH2
CH2
CH2
CH2
COO
38.
Подкласс 141.14.3.N.
Цитохром P450 (цитохром P450-зависимая
монооксигеназа, cytochrome P450, CYP) —
общее название ферментов семейства P450,
катализируют
расщепление
соединений
разного типа с участием NADPH и О2. Входят в
класс гемопротеинов.
Цитохром P450, связанный с монооксидом
углерода,
имеет
максимум
поглощения света при длине волны 450 нм, что
определило его название.
Система
цитохрома
P450
участвует
в окислении многочисленных соединений, как
эндогенных, так и экзогенных. Ферменты этой
группы
играют
важную
роль
в
обмене
стероидов,
желчных
кислот,
ненасыщеных жирных кислот, фенольных
метаболитов, а также в нейтрализации
ксенобиотиков (лекарств, ядов.наркотиков).






















 Биология
Биология








