Похожие презентации:
Общие свойства металлов
1. Общие свойства металлов
2. УМК «ХИМИЯ»
Тема лекции:Общие свойства
металлов
Лектор – Иванов М.Г.
3. Цель лекции: изложение основных понятий физических и химических свойств металлов в рамках современной химической теории
Компетенции, формируемые у студента:Умения:
прогнозировать на основе современных
представлений о строении атомов и химической
связи, физические и химические свойства металлов.
4.
Нахождение в природысодержание
MnO2
SiO2
Al2O3
FeS2
Ag2S
CuFeS2
MnSiO3
CuCO3(OH)2
CaSO4.2H2O
Оксиды - Fe3O4,
MnO2
Сульфиды - ZnS,
FeS2
Соли- MnSiO3,
CuCO3(OH)2,
CaSO4.2H2O
5.
Нахождение в природысодержание
В свободном виде
(самородки)- Au, Pt,
Ag, Cu
Au
Pt
6.
7.
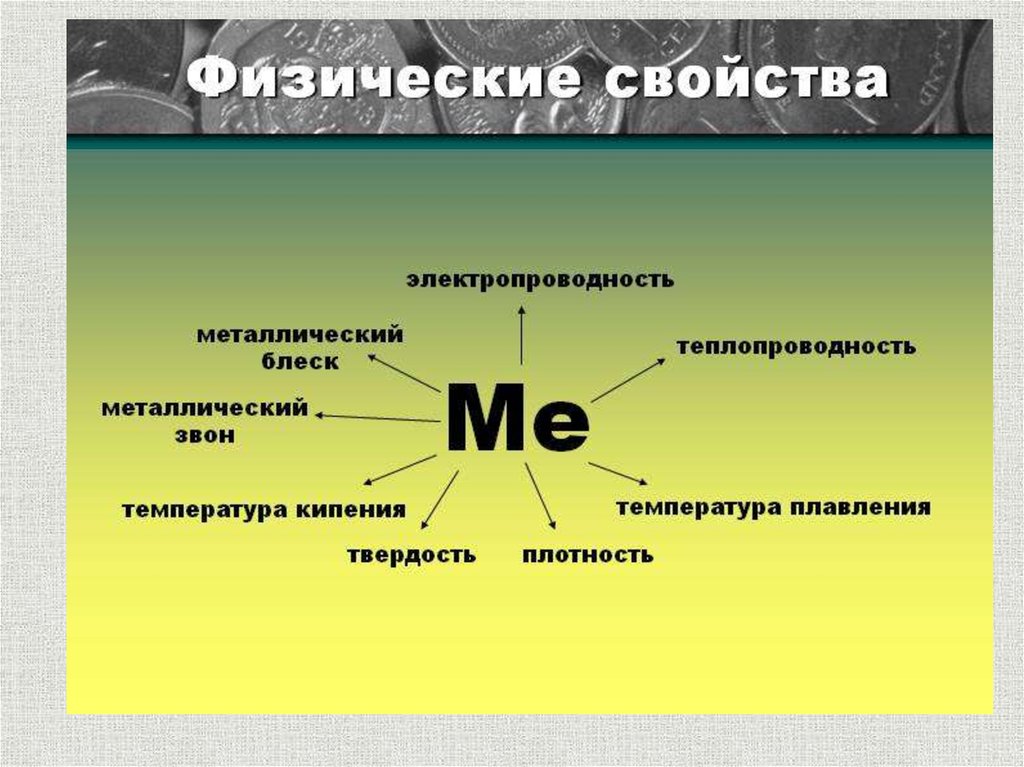
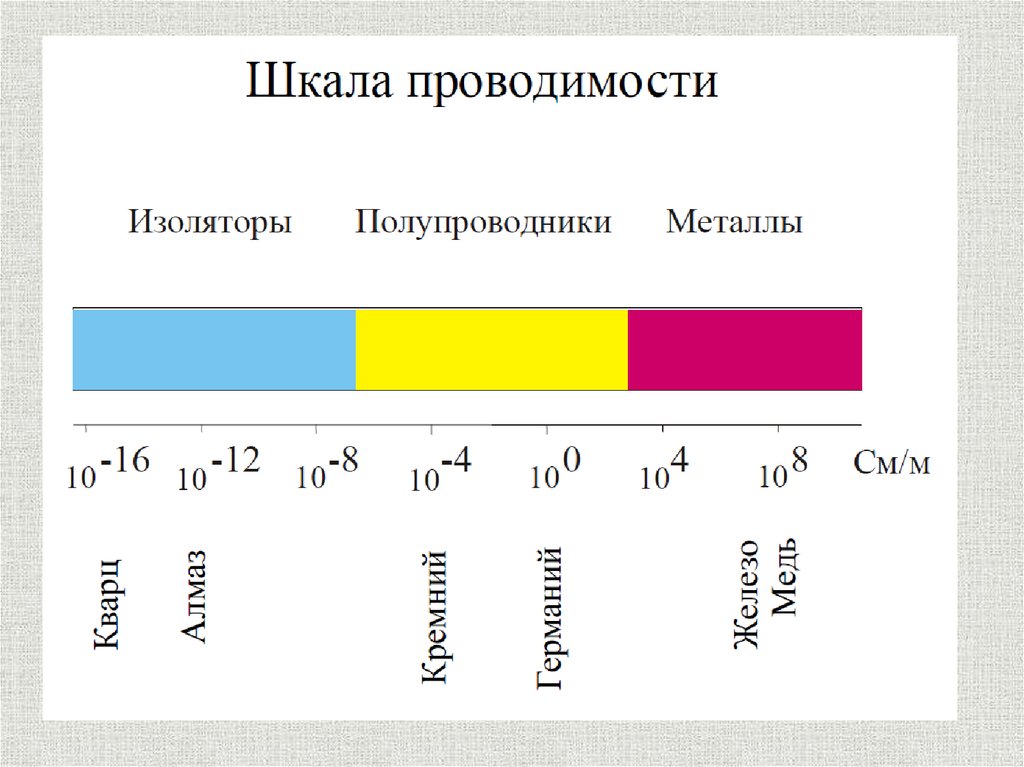
8. Металлический блеск
металлический блеск – электроны, заполняющиемежатомное пространство отражают световые лучи,
а не пропускают как стекло. Поэтому все металлы в
кристаллическом состоянии имеют металлический
блеск.
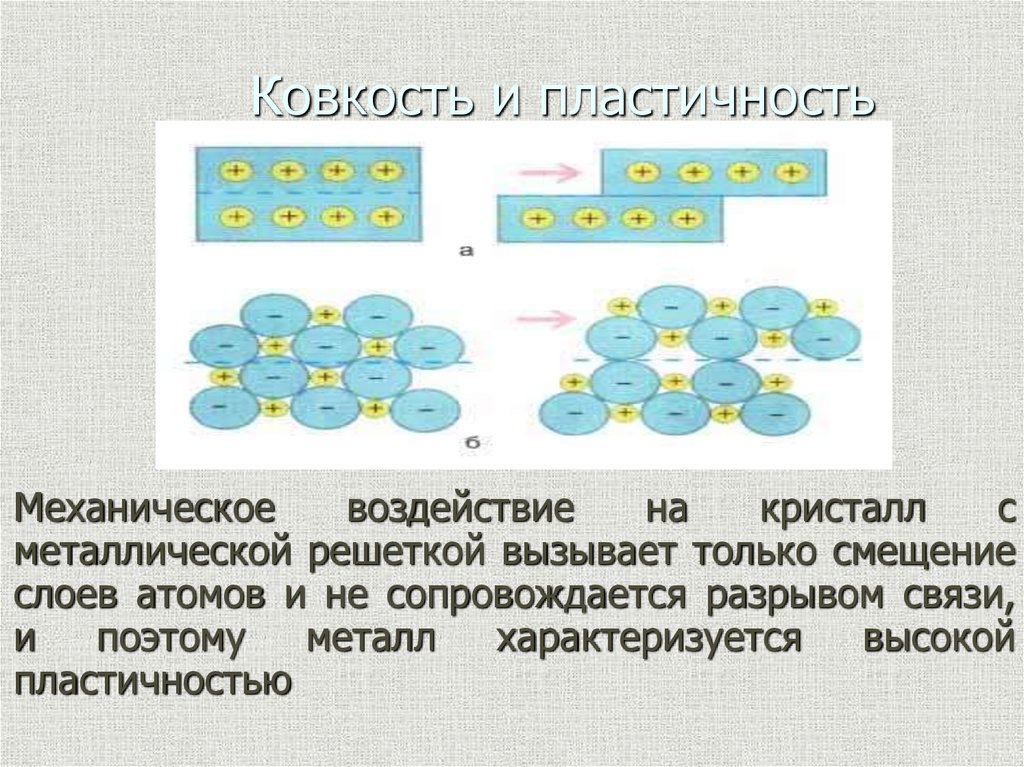
9. Ковкость и пластичность
Механическоевоздействие
на
кристалл
с
металлической решеткой вызывает только смещение
слоев атомов и не сопровождается разрывом связи,
и
поэтому
металл
характеризуется
высокой
пластичностью
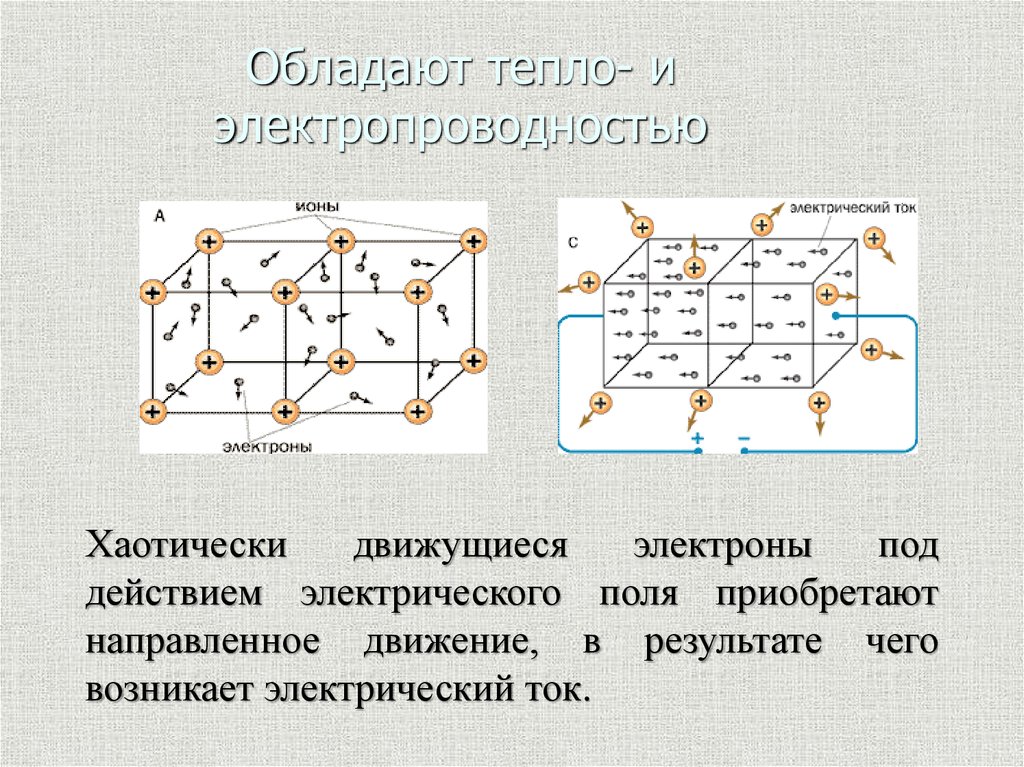
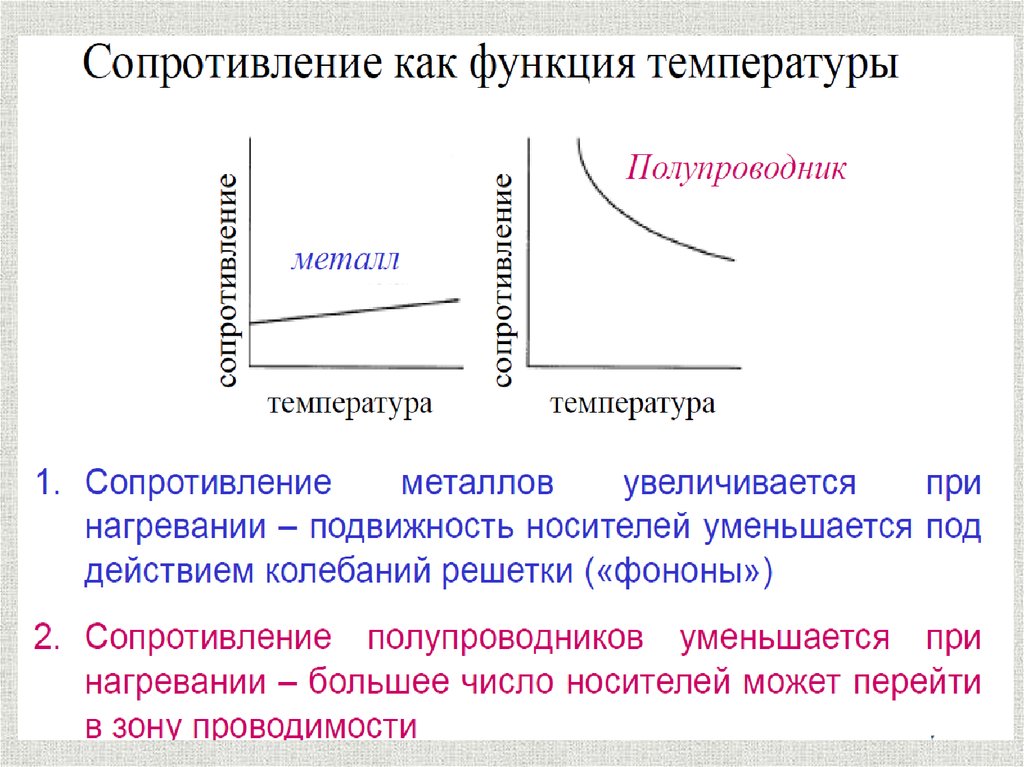
10. Обладают тепло- и электропроводностью
Хаотическидвижущиеся
электроны
под
действием электрического поля приобретают
направленное движение, в результате чего
возникает электрический ток.
11.
РтутьЦезий
Вольфрам
12.
ТанталЛитий
13.
СереброЗолото
Платина
14. Магнитные свойства металлов
Ферромагнетики – металлы способные сильнонамагничиваться и долго сохранять это свойство
(Fe, Co, Ni).
Парамагнетики – слабо намагничиваются и не
сохраняют это состояние вне магнитного поля
(щелочные, щелочно-земельные и большая часть
переходных металлов).
Диамагнетики
–
металлы,
выталкиваемые
магнитным полем (Cu, Аg, Au, Bi).
15.
16.
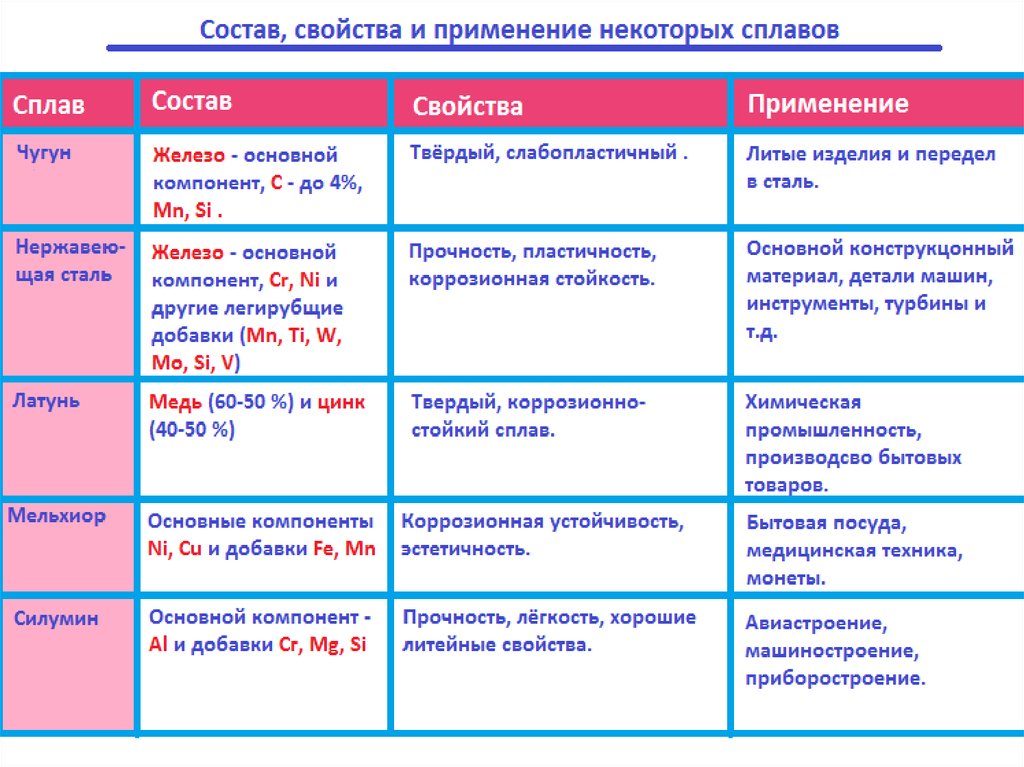
Сплавы металловСплавы - (твердые растворы) — это системы, состоящие из двух и
более металлов или металлов и неметаллов.
! Сплавы отличаются по физическим свойствам от металлов, их
образующих. Это объясняется изменением строения кристаллов сплавов
по сравнению со строением образующих его металлов.
Например:
Сплав Вуда: tпл = 68 °, а температуры плавления металлов, образующих
сплав:
Bi—271,0 °С; РЬ — 327,4 °С; Sn—231,9 °С; Cd— 321 °С.
Латунь: обладает большей твердостью, чем исходные металлы,
образующие сплав (Си и Zn)Черные сплавы — сплавы, получаемые на основе железа, — чугун и
сталь.
Цветные сплавы — сплавы, полученные на основе меди (основной
компонент), латуни, бронзы.
Легкие сплавы — сплавы на основе магния или алюминия — дуралюмин,
магналий.
Благородные и редкие сплавы — сплавы на основе драгоценных и
редких металлов — ювелирные сплавы.
17.
Виды и свойства чугунов.Вид чугуна
Состав
Свойства
Серый чугун Содержит 1,7-4,3% С,
Сравнительно
(с высоким 1,25-4,0% Si и до 1,5%
мягкий и
содержанием Mn. Большое содержаподдающийся
кремния)
ние кремния снижает
механической
растворимость углерообработке.
да. Поэтому углерод Свободный углерод
выделяется в виде
придает чугуну
графита.
мягкость.
Белый чугун
(с
небольшим
содержанием
кремния)
Содержит 1,7-4,3%С,
более 4% Mn,но очень
мало кремния.Углерод
в основном содержится в виде цементита –
карбида железа.
Твёрдый и хрупкий.
Эти свойства
придаёт цементит,
который обладает
большой
твёрдостью.
Применение
Различные литые
детали
(шестерни, колёса
, трубы и т.д.)
Переработка в
сталь.
18.
19.
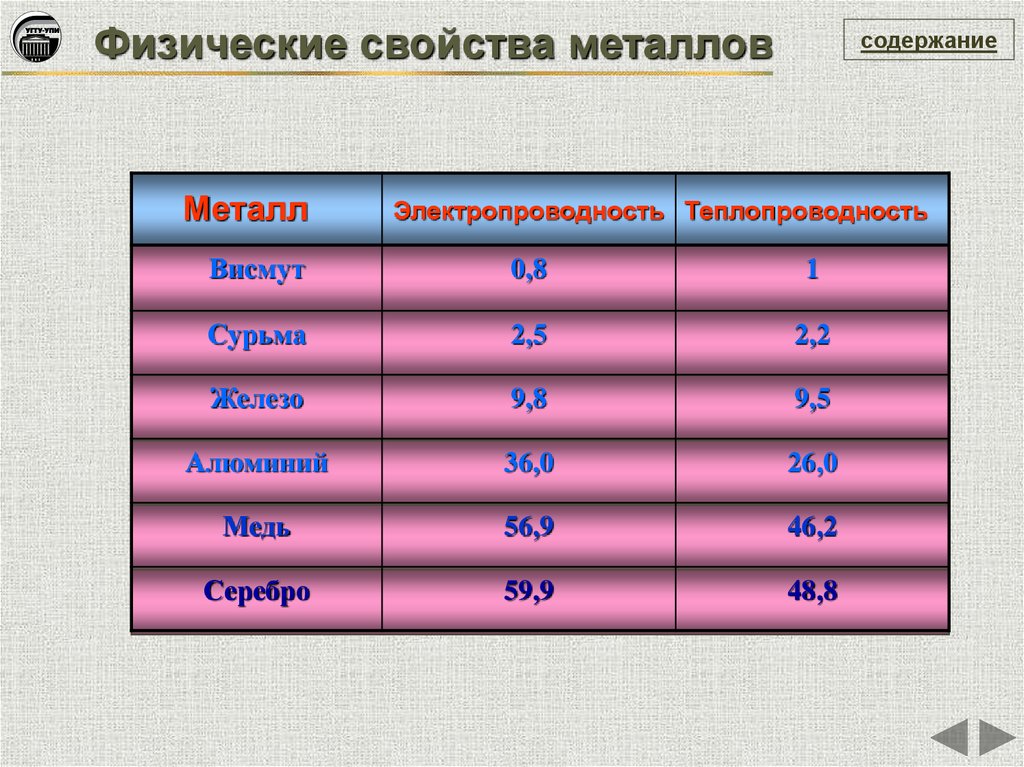
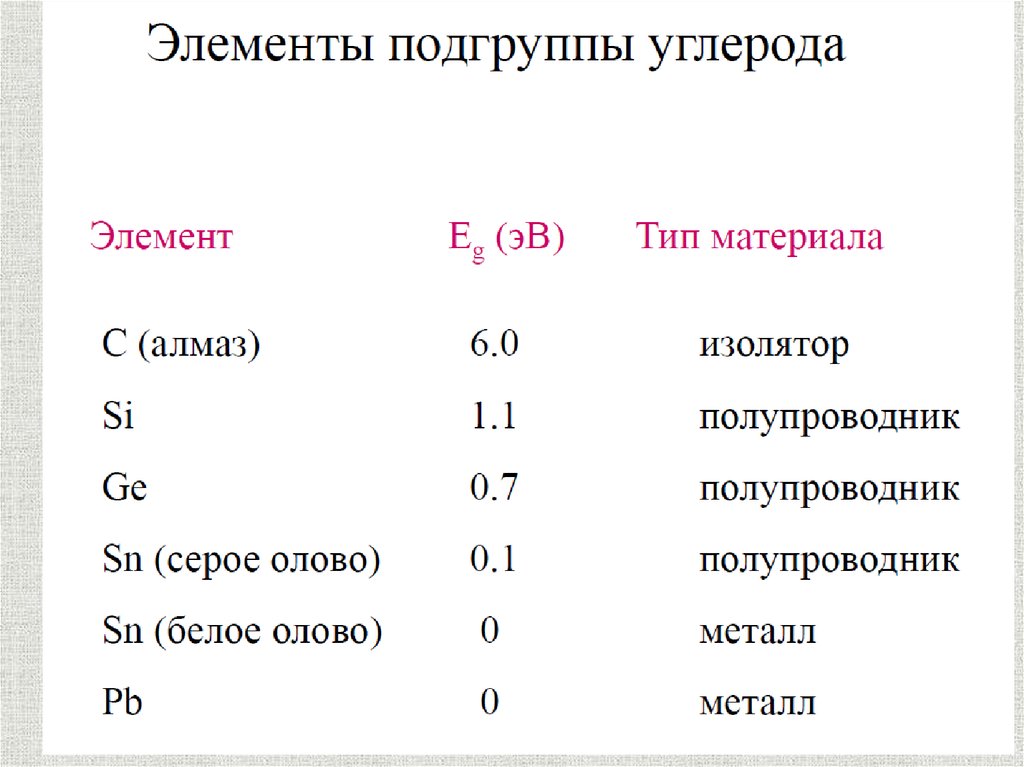
Физические свойства металловМеталл
содержание
Электропроводность Теплопроводность
Висмут
0,8
1
Сурьма
2,5
2,2
Железо
9,8
9,5
Алюминий
36,0
26,0
Медь
56,9
46,2
Серебро
59,9
48,8
20.
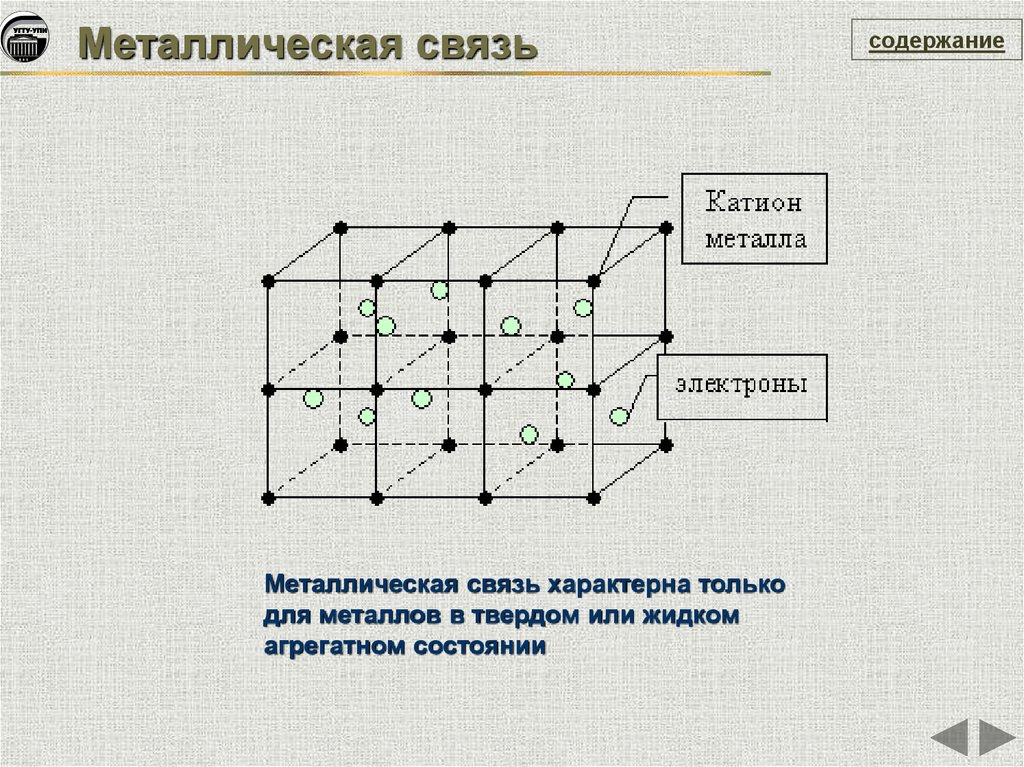
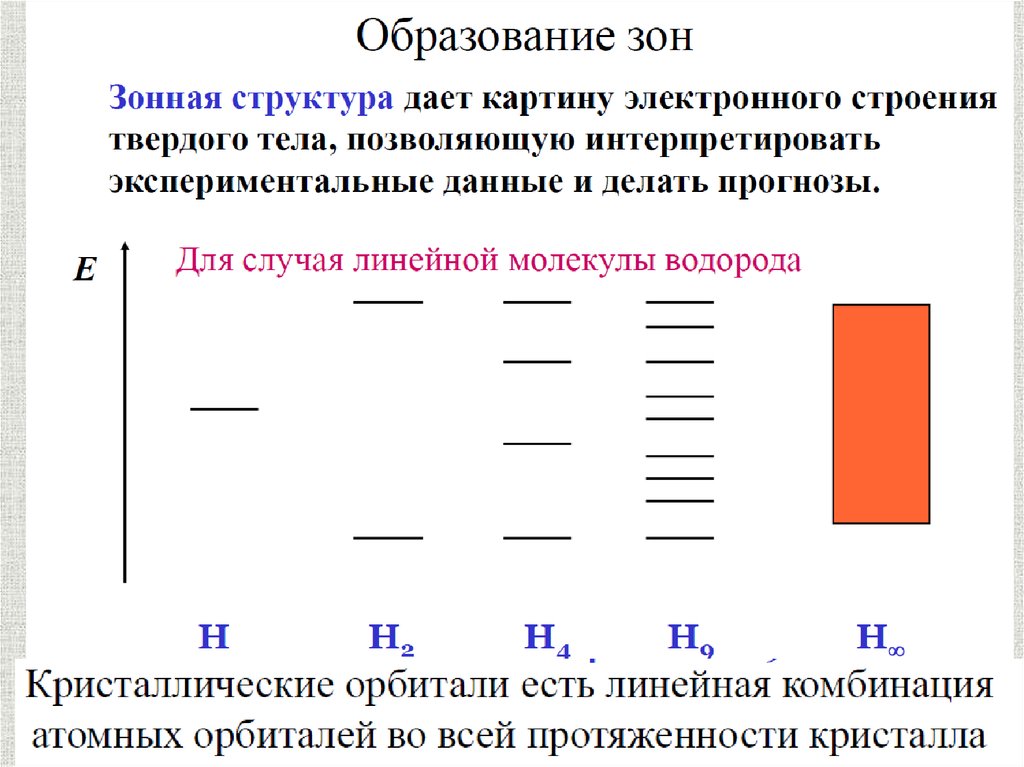
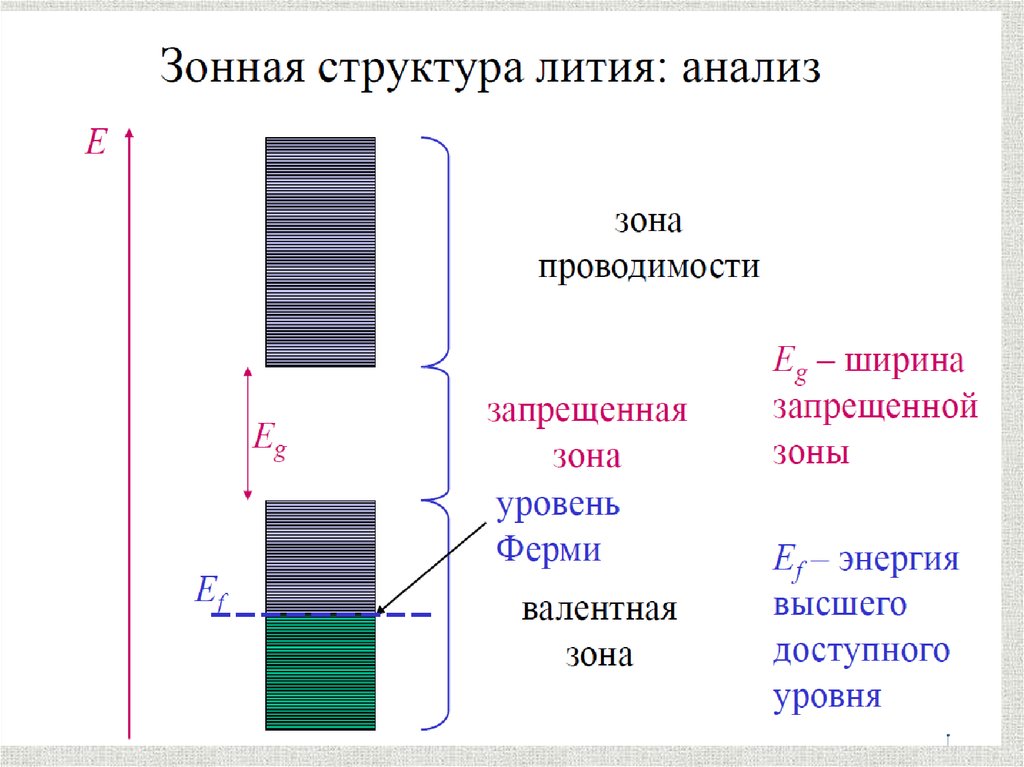
Металлическая связьМеталлическая связь характерна только
для металлов в твердом или жидком
агрегатном состоянии
содержание
21.
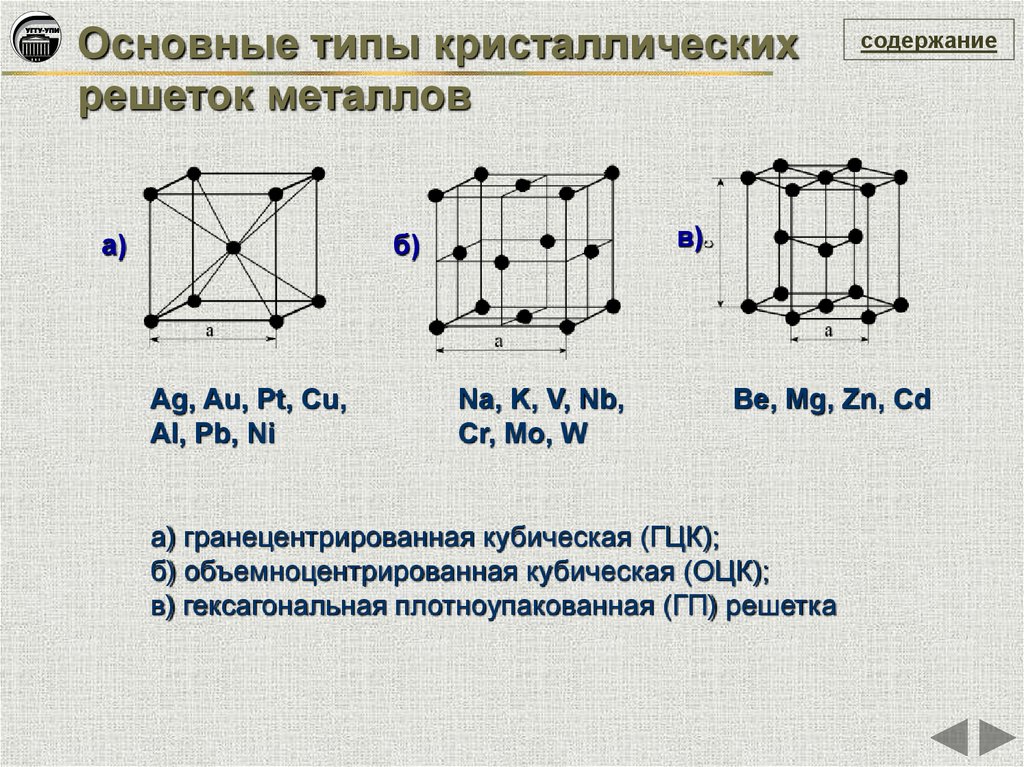
Основные типы кристаллическихрешеток металлов
а)
в)
б)
Ag, Au, Pt, Cu,
Al, Pb, Ni
содержание
Na, K, V, Nb,
Cr, Mo, W
Be, Mg, Zn, Cd
а) гранецентрированная кубическая (ГЦК);
б) объемноцентрированная кубическая (ОЦК);
в) гексагональная плотноупакованная (ГП) решетка
22.
23.
24.
25.
26.
27.
28.
29.
30.
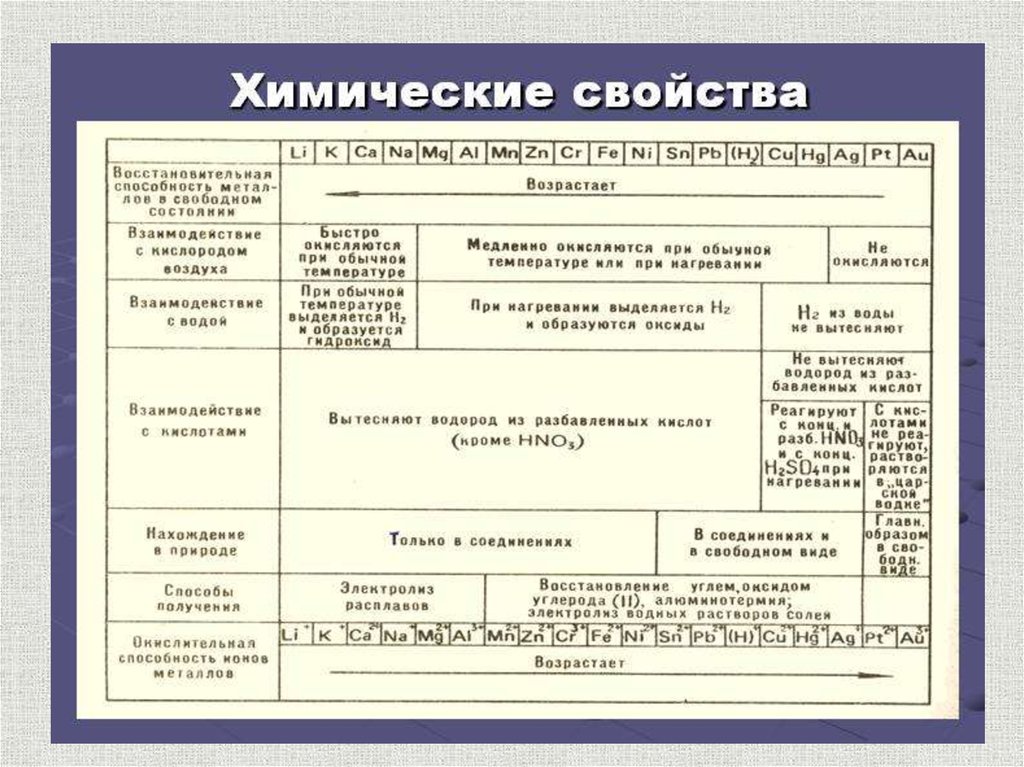
Химические свойства металловсодержание
По своим химическим свойствам все металлы являются восстановителями
Взаимодействие с простыми веществами
с кислородом
4Li + O2 = 2Li2O
4Al + 3O2 = 2Al2O3
с серой
Zn + S = ZnS
Hg + S = HgS
с галогенами
Cu + Cl2 = CuCl2
Ni + Cl2 = NiCl2
с водородом
2Na + H2 = 2NaH
2Li + H2 = 2LiH
с азотом
3Mg + N2 = Mg3N2
3Ca + N2 = Ca3N2
с углеродом
4Al + 3C = Al3C4
с фосфором
3Ca + 2P = Ca3P2
интерметаллические соединения
3Cu + Au = Cu3Au
31.
Электрохимический ряднапряжений металлов
содержание
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Ag, Hg, Au
Gо = - ∆ЕоnF
где
F - число Фарадея (96485 Кл);
n - число электронов на один перенесенный ион.
∆Ео - разность стандартных потенциалов системы, В
E oок ля E oв ля
32.
33.
34.
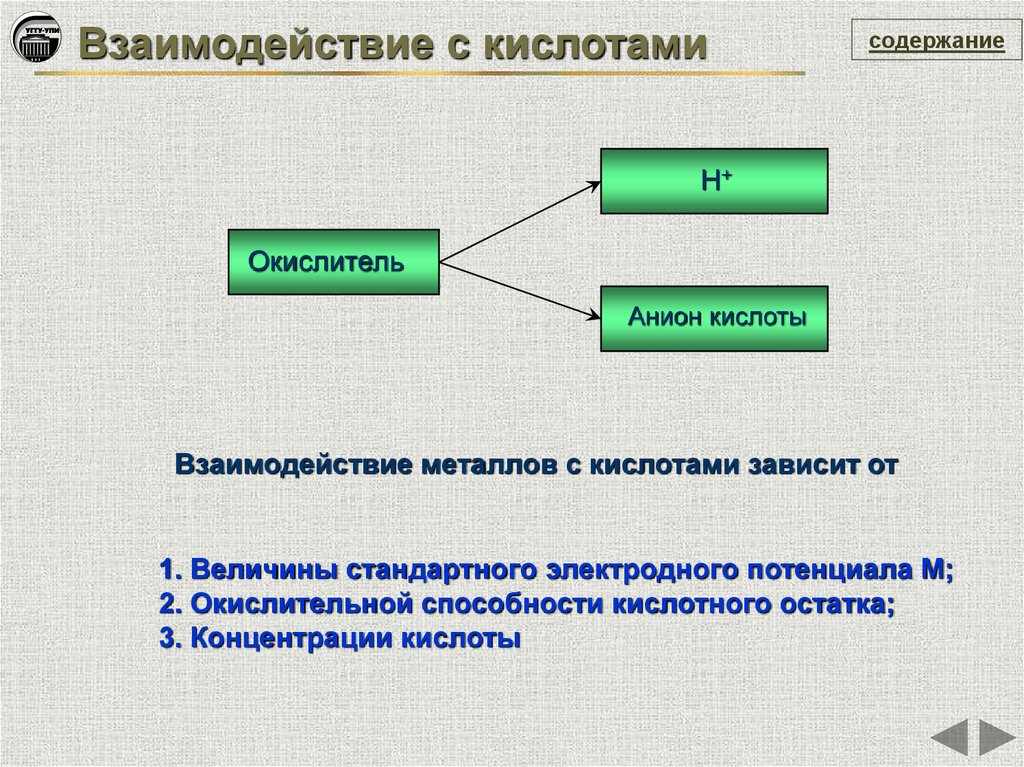
Взаимодействие с кислотамисодержание
Н+
Окислитель
Анион кислоты
Взаимодействие металлов с кислотами зависит от
1. Величины стандартного электродного потенциала М;
2. Окислительной способности кислотного остатка;
3. Концентрации кислоты
35.
36.
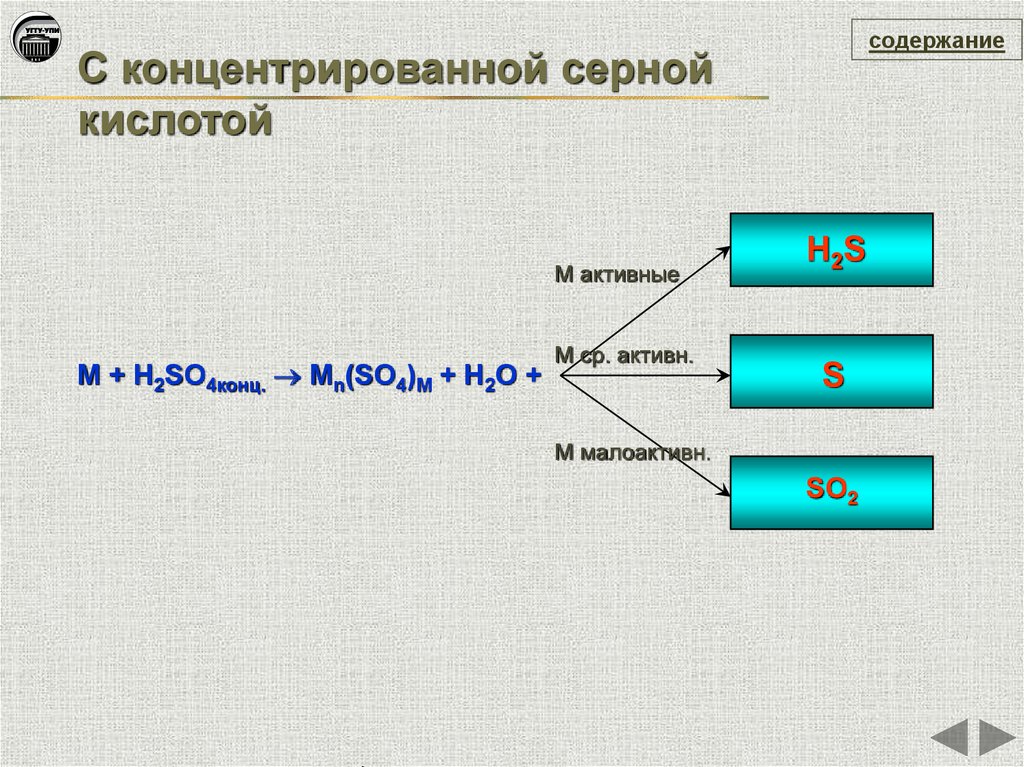
содержаниеС концентрированной серной
кислотой
М активные
М + H2SO4конц. Мn(SO4)M + H2O +
М ср. активн.
H2S
S
М малоактивн.
SO2
37.
38.
39.
С концентрированной азотнойкислотой
М + HNO3конц. М(NO3)M + H2O + NO2
3Re + 7HNO3 = 3HReO4 + 7NO + 2H2O
Au + HNO3 + 4HCl = H[AuCl4 ] + NO + 2H2O
«царская водка»
содержание
40.
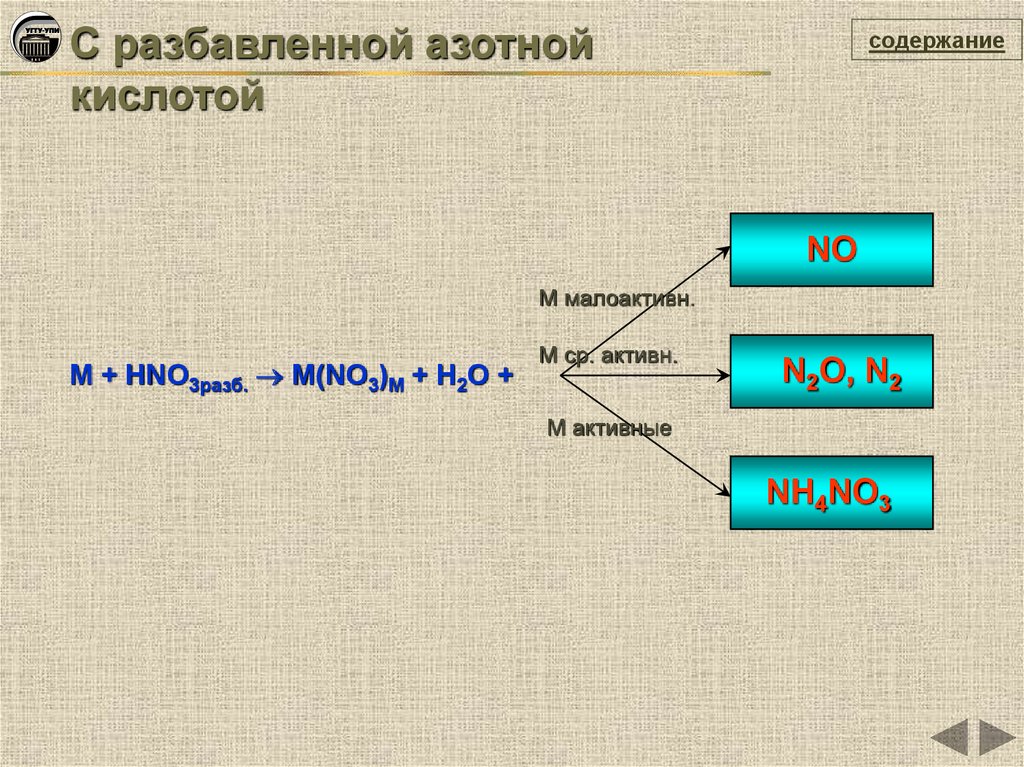
С разбавленной азотнойкислотой
содержание
NO
М малоактивн.
М + HNO3разб. М(NO3)M + H2O +
М ср. активн.
N2O, N2
М активные
NH4NO3
41.
42.
43.
Взаимодействие с водойпри pH = 7
M + H2O M(OH)n + H2
окислитель
2H 2O 2e H 2 2OH
Eок ля E 2H 2O/H 2 0,41 B,
Явление глубокого торможения окисления металла,
обусловленное наличием на его поверхности защитных
оксидных пленок, называется пассивацией.
содержание
44.
Взаимодействие с воднымирастворами щелочей
при pH = 14
окислитель
E
0
2H2O/H2
содержание
0,83 B
2H 2O 2e H 2 2OH
в растворах щелочей растворяются металлы,
потенциалы которых меньше -0,83В, склонные к
образованию гидроксокомплексов типа [Me(OH)4 ]nто есть металлы, чьи гидроксиды являются
амфотерными: Ве(OH)2, (Al(OH)3, Zn(OH)2,
Sn(OH)2, Рb(OH)2, Cr(OH)3 и др.
45.
46.
47.
48.
Список литературысодержание
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа.
2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы
неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.: МГУ,
1993.
4. А. Джонсон. Термодинамические аспекты в курсе
неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и
реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы
физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г. Т.2.
стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.:
Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа,
1987.
11. CRC Hand book of Chemistry and Physics. 82 издание. 2001-2002.































 Химия
Химия








