Похожие презентации:
Химический практикум для олимпиадной команды. Количественный анализ
1.
Химический практикум дляолимпиадной команды
Лекция 3
Количественный анализ
CH3
N
O
2. Гравиметрия (весовой анализ)
• Химический метод анализа, при котором определяемыйкомпонент выделяют в виде малорастворимого соединения
определенного состава, которое после соответствующей
обработки взвешивают с высокой точностью.
• Al3+ + 3NH3∙H2O Al(OH)3↓ + 3NH4+
Al(OH)3 – осаждаемая форма
• 2Al(OH)3 (t⁰C) Al2O3 + 3H2O↑
Al2O3 – весовая форма
3. Гравиметрия (весовой анализ)
Требования к осаждаемой форме:• Количественное осаждение (в пределах обнаружения)
• Строго селективное осаждение (отсутствие примесей)
• Легкость фильтрации (достаточно крупнокристаллическое вещество)
4. Гравиметрия (весовой анализ)
Требования к весовой форме:• Химическая устойчивость
• Строго постоянный стехиометрический состав
• Малое значение гравиметрического фактора
Гравиметрический фактор (f)– массовая доля определяемого
компонента в весовой форме.
m(Al) = f ∙ m(Al2O3) = 0,52926 ∙ m(Al2O3)
5. Представление результатов (точность расчетов)
• Сложение, вычитание – по меньшему количеству цифр после запятой:1 + 0,1 = 1 (т.к. 1 с равным успехом получается при округлении 0,6 и 1,4)
1,0 + 0,1 = 1,1
• Умножение, деление:
на экспериментальные величины – см.выше (округляем)
на строго известные величины – без округления
(стехиометрический коэффициент 2 = 2.00000000…)
• Логарифмирование: +1 значащая цифра
ln(6) = 1,8
log10(3 ∙ 102) = 2,5
log10(300) = 2,477
• Потенцирование: -1 значащая цифра
e1,8 = 6
e1,80 = 6,0
e1,800 = 6,05
6. Представление результатов (точность расчетов)
• Сложный (многостадийный) расчет - ответ округляется в соответствии с точностьюнаименее точной из исходных величин:
4,0 ∙ (82353 – 2,43 ∙ 104) = 2,3 ∙ 105
НО!
Результаты промежуточных расчетов не округляются
(их оставляют с запасом в 1-2 значащих цифры,
которые будут отсечены в окончательном ответе)
• Маленький гравиметрический фактор: минимизация влияния погрешности весов:
m = (1,0219 ± 0,0004) г
0,10000 ∙ m = (0,10219±0,00004) г
7.
NN
3
+ Al
3+
8 -о к с и х и н о л и н
O
N
O N
3
-
+3H
N
Весовая форма
Fe3+
Fe(OH)3 (Fe2O3 ∙ xH2O)
Fe2O3
Ba2+
BaSO4
BaSO4
Ni2+
Диметилглиоксимат никеля
Ni(C4H7N2O2)2
Ni(C4H7N2O2)2
Co3+
1-нитрозо-2-нафтолят кобальта
Со(С10Н6NО2)3 ∙ 2Н2О
Со(С10Н6NО2)3
Mg2+
8-оксихинолят магния
Mg(C9H6NO)2 ∙ 2H2O
Mg(C9H6NO)2
Al3+
8-оксихинолят алюминия
Al(C9H6NO)3 ∙ xH2O
Al(C9H6NO)3
N
M g
2 +
+
N
O
+ M g
2
O
Al
N O
O
Осаждаемая форма
O
O
N
OH
+ C o3+ + 3O H
O
O
a -н и т р о з о - -н а ф т о л
Co
N O
O
+ 3 H 2O
N
.
O.. H
O
H 3C N O H
2
+ Ni
2+
H 3C N O H
Д и м ети л гл и о кси м
(Р е а к т и в Ч у г а е в а )
+ 2N H 3
NH3
aq
N
O
N
Ni
N
N
O
H O
...
OH
Определяемый
компонент
N i(H d m g ) 2
+ 2 N H 4+
8. Титриметрия (объемный анализ)
• Химический метод анализа, при котором количество (массу,концентрацию etc) анализируемого вещества определяют по объему
вещества известной концентрации, вступившего в реакцию с
анализируемым.
• Фактор эквивалентности (f) – часть молекулы, дающая одну
активную в данной реакции частицу
• H3PO4 + 3NaOH = Na3PO4 + 3H2O
• H3PO4 + NaOH = NaH2PO4 + 3H2O
f(H3PO4) = 1/3
f(H3PO4) = 1
9. Титриметрия (объемный анализ)
• Эквивалентная концентрация (нормальность) – условнаяконцентрация активных частиц, эквивалентная концентрации
вещества в растворе. Имеет размерность моль/л, но со своим
специальным обозначением – N.
Сэкв = C/f
• H2SO4 2H+ + SO42C(H2SO4) = 0,1M
f(H2SO4) = 1/2
Сэкв(H2SO4) = 0,2N
• MnO4- + 8H+ + 5e- Mn2+ + 4H2O
C(KMnO4) = 0,02M
f(MnO4-/8H+) = 1/5
Сэкв(MnO4-) = 0,1N
10. Титриметрия (объемный анализ)
• Аналит – вещество, концентрация которого неизвестна (определяемое)• Титрант – вещество известной концентрации.
• Стандартизация – процесс уточнения концентрации титранта
• Аликвота – точно известный объем аналита
• Титрование – процесс установления концентрации аналита.
• Закон эквивалентов:
CэквV (аналита) = CэквV (титранта)
C1V1/f1 = С2V2/f2
11. Титриметрия (объемный анализ)
Требования к титриметрическим реакциям:• Протекание строго количественное (в пределах обнаружения)
• Высокая скорость протекания
• Отсутствие побочных процессов
• Возможность фиксации конечной точки (индикации)
12. Классификация титриметрических реакций
По химии процесса:• Кислотно-основное титрование
ацидиметрическое (титрант – кислота)
алкалиметрическое (титрант – щелочь)
• Окислительно-восстановительное титрование
перманганатометрия, дихроматометрия, иодометрия (прямая,
обратная, заместительная), иодатометрия, цериметрия etc
• Осадительное титрование
аргентометрия, гексацианоферратометрия
• Комлексонометрическое титрование
(самый распространенный титрант – ЭДТА)
13. Классификация титриметрических реакций
По способу фиксации конечной точки:• Визуальная индикация (в присутствии специальных веществ,
меняющих окраску при достижении конечной точки – индикаторов.
Фенолфталеин, метиловый оранжевый в К-О титровании; крахмал в
иодометрии; хромат калия в аргентометрии по Мору etc)
• Самоиндикация (перманганат)
• Физико-химическая индикация
скачок электрохимического потенциала (потенциометрия)
скачок проводимости (кондуктометрия)
14. Типичный вид кривой титрования
• Зависимость наблюдаемой характеристики раствора (рН, эл.хим.потенциала) от объема добавленного титранта или от доли титрования
• Доля титрования (D) – отношение добавленного объема титранта к
стехиометрическому
pH
14,00
12,00
10,00
8,00
6,00
4,00
2,00
0,00
0,00
HCl (1M) + NaOH (1M)
D
1,00
2,00
V HCl, мл V NaOH, мл
D
рН
10
0
0
0
10
5
0,5
0,48
10
9
0,9
1,28
10
9,9
0,99
2,30
10
9,99
0,999
3,30
10
10
1
7
10
10,001
1,0001
9,70
15. Типичный вид кривой титрования
• Точка эквивалентности – точка полного протекания реакции• Конечная точка титрования – точка «срабатывания» индикатора
pH
14,00
12,00
10,00
8,00
6,00
4,00
2,00
0,00
0,00
HCl (1M) + NaOH (1M)
D
1,00
рНТЭ = 7; рНКТТ ≠ 7!
2,00
Индикатор
Метиловый
оранжевый
рН перехода
3,1 – 4,4
Бромкрезоловый
зеленый
Бромтимоловый
синий
3,8 – 5,4
Фенолфталеин
Индигокармин
8,2 – 10,6
11,6 – 14,0
6,0 – 7,6
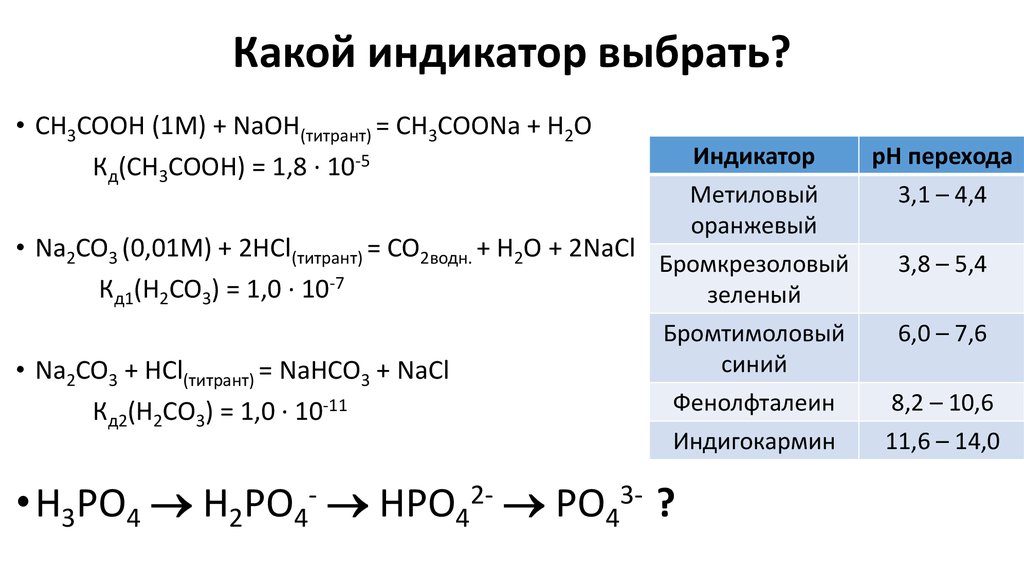
16. Какой индикатор выбрать?
• CH3COOH (1M) + NaOH(титрант) = CH3COONa + H2OКд(CH3COOH) = 1,8 ∙ 10-5
Индикатор
рН перехода
Метиловый
оранжевый
• Na2CO3 (0,01M) + 2HCl(титрант) = CO2водн. + H2O + 2NaCl
Бромкрезоловый
Кд1(H2CO3) = 1,0 ∙ 10-7
зеленый
3,1 – 4,4
Бромтимоловый
синий
Фенолфталеин
6,0 – 7,6
• Na2CO3 + HCl(титрант) = NaHCO3 + NaCl
Кд2(H2CO3) = 1,0 ∙ 10-11
Индигокармин
• H3PO4 H2PO4- HPO42- PO43- ?
3,8 – 5,4
8,2 – 10,6
11,6 – 14,0
17. Установка для титрования
1. Штатив2. Бюретка (наполняется титрантом,
фиксирует его расход)
3. Резиновая трубка
4. Шарик (надавливанием на трубку в
боковой области шарика управляют
потоком титранта)
5. Стеклянный носик
6. Колба для титрования (аналит +
индикатор + вспомогательные растворы)
7. Пипетка Мора (для отбора точного
объема аналита – аликвоты)

















 Химия
Химия








