Похожие презентации:
Составление проекта нормативной документации на лекарственные формы для парентерального введения
1. Презентация тема: составление проекта нормативной документации на лекарственные формы для парентерального введение (ПОРОШОК ДЛЯ
Южно-Казахстанская медицинская академияКафедра фармацевтической и токсикологической химии
ПРЕЗЕНТАЦИЯ
ТЕМА: СОСТАВЛЕНИЕ ПРОЕКТА НОРМАТИВНОЙ ДОКУМЕНТАЦИИ
НА ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЕ
(ПОРОШОК ДЛЯ ПРИГОТОВЛЕНИЯ ИНЬЕКЦИОННЫХ
ЛЕКАРСТВЕННЫХ СРЕДСТВ)
Выполнила: Толибекова Л.М.
Группа: 502 ФК «Б»
Проверила: к.фарм.н, и.о.
профессора Сопбекова А.О.
Шымкент 2018 г
2. План
I. ВВЕДЕНИЕII. ОСНОВНАЯ ЧАСТЬ
1. ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ
ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ
2. ПОРОШКИ ДЛЯ ПРИГОТОВЛЕНИЯ
ИНЬЕКЦИОННЫХ ИЛИ ВНУТРИВЕННЫХ
ИНФУЗИОННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
3. ПРОЦЕСС ТЕХНОЛОГИИ ПОРОШКА
4. СТАНДАРТИЗАЦИЯ
ІІІ. ЗАКЛЮЧЕНИЕ
ЛИТЕРАТУРА
3. ОПРЕДЕЛЕНИЕ
• ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ ПАРЕНТЕРАЛЬНОГОПРИМЕНЕНИЯ (ПАРЕНТЕРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ
СРЕДСТВА) – СТЕРИЛЬНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА,
ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ВВЕДЕНИЯ ПУТЕМ ИНЬЕКЦИЙ,
ИНФУЗИЙ ИЛИ ИМПЛАНТАЦИЙ В ОРГАНИЗМ ЧЕЛОВЕКА ИЛИ
ЖИВОТНОГО.
4.
Лекарственные средства для парентеральногоприменения классифицируются следующим
образом:
Инъекционные лекарственные средства;
Внутривенные инфузионные лекарственные
средства;
Концентраты для инъекционных или
внутривенных инфузионных лекарственных
средств;
Порошки для инъекционных или
внутривенных инфузионных лекарственных
средств;
Имплантанты.
5.
• Инъекционные лекарственные средства –это стерильные растворы, эмульсии или суспензии.
Растворы для инъекций должны быть прозрачными и
практически свободными от частиц. Эмульсии
для инъекций не должны обнаруживать признаков
расслоения. В суспензиях для инъекций может
наблюдаться осадок, который должен
быстро диспергироваться при взбалтывании, образуя
суспензию. Образовавшаяся суспензия должна быть
достаточно стабильной для того, чтобы обеспечить
необходимую дозу при введении.
• Растворители, исходные и вспомогательные
вещества, применяемые для
приготовления лекарственных
форм для инъекций должны быть разрешенными к
медицинскому применению и соответствовать
требованиям нормативно-технической документации.
6.
Парентеральный путь введения в организм лекарствимеет ряд преимуществ перед другими методами:
быстрое действие и полная биологическая
доступность лекарственного вещества;
точность и удобство дозирования;
возможность введения лекарственного вещества
больному, находящемуся в бессознательном
состоянии или, когда лекарство нельзя вводить
через рот;
отсутствие влияния секретов ЖКТ и ферментов
печени, что имеет место при внутреннем
употреблении лекарств;
возможность создания больших
запасов стерильных растворов, что облегчает и
ускоряет их отпуск из аптек.
7.
Наряду с преимуществами инъекционный путьвведения имеет и некоторые недостатки:
при введении жидкостей через поврежденный покров
кожи в кровь легко могут попасть патогенные
микроорганизмы;
вместе с раствором для инъекций в организм может
быть введен воздух, вызывающий эмболию сосудов или
расстройство сердечной деятельности;
даже незначительные количества посторонних
примесей могут оказать вредное влияние на организм
больного;
психоэмоциональный аспект, связанный с
болезненностью инъекционного пути введения;
инъекции лекарств могут осуществляться только
квалифицированными специалистами.
8.
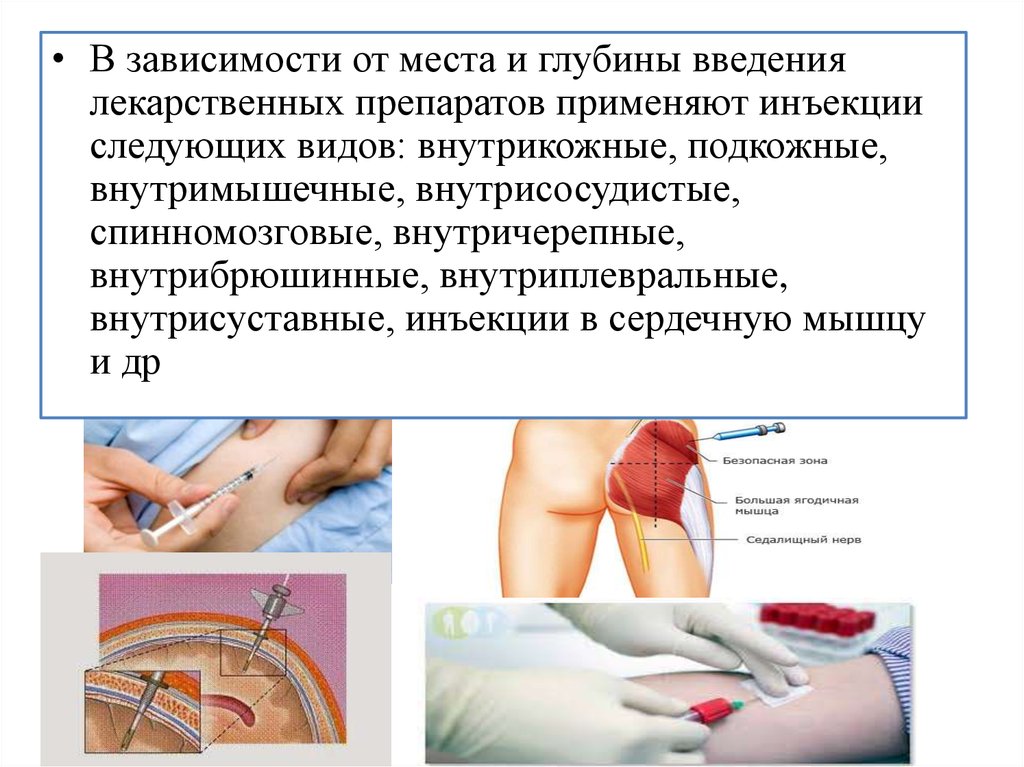
• В зависимости от места и глубины введениялекарственных препаратов применяют инъекции
следующих видов: внутрикожные, подкожные,
внутримышечные, внутрисосудистые,
спинномозговые, внутричерепные,
внутрибрюшинные, внутриплевральные,
внутрисуставные, инъекции в сердечную мышцу
и др
9.
Требования к лекарственным средствам для парентеральногоприменения
• Стерильность
• Отсутствие механических частиц
• Пирогенность
• Аномальная токсичность
• Прозрачность
• Цветность
• Объём
• Дополнительные требования
• Изотоничность
• Изоионичность
• Изогидричность
• Изовязкость
10.
• Порошки – лекарственная форма,состоящая из твердых отдельных сухих
частиц различной дисперсности,
обладающая свойством сыпучести.
• Порошки должны быть однородными при
рассмотрении невооруженным глазом и
иметь размер частиц не более 160 мкм,
если не указано иначе в фармакопейной
статье или нормативной документации.
11.
• Порошки для инъекционных иливнутривенных инфузионных лекарственных
средств – представляют собой
твердые стерильные вещества, помещенные в
контейнер. При встряхивании с указанным объемом
соответствующей стерильной жидкости они быстро
образуют или прозрачный, свободный от частиц
раствор, или однородную суспензию. После
растворения или суспендирования они должны
соответствовать требованиям, предъявляемым
к инъекционным или инфузионным лекарственным
средствам.
12.
• Для приготовления инъекционных илиинфузионных лекарственных форм
содержимое упаковки с лекарственным
препаратом растворяют или диспергируют
в подходящем стерильном растворителе
непосредственно перед введением.
Полученные растворы или суспензии
должны соответствовать всем требованиям,
предъявляемым к растворам для инъекций
или суспензиям для инъекций.
13. Процесс технологии
• Процесс получения порошков состоит изследующих стадий:
• - Подготовка помещений, оборудования, персонала
• – измельчение исходных веществ;
• – получение однородного порошка (просеивание);
• – смешивание;
• – фасовка, упаковка,
• - стерилизация
• - маркировка.
14.
Для обеспечения асептики необходимо учитыватьисточники микробной контаминации лекарственных
препаратов, которыми являются:
- воздух;
- поверхность оборудования и помещений;
- персонал;
- вспомогательные и упаковочные материалы;
- лекарственные вещества.
Поэтому в аптеке, изготавливающей стерильные
лекарственные формы, необходимо наличие:
- помещений асептического блока;
- оборудования для поддержания асептических условий, в
том числе воздушного шлюза, ламинарного бокса,
бактерицидных облучателей, ковриков для обеспыливания
обуви;
- устройств кондиционирования, фильтрации и стерилизации
воздуха.
15. Измельчение
• Целью стадии является измельчение порошков доразмеров частиц, нормируемых в фармакопее (не
более 0,16 мм).
• измельчение продолжают до получения
однородных порошков (поверхность порошка,
выровненная пестиком, в ступке при рассмотрении
невооруженным глазом с расстояния 20-25 см при
естественном освещении не должна иметь
отдельных частиц, блесков или включений).
16. В производстве
Способы измельчения:а - раздавливание;
б - раскалывание;
в - удар;
г - истирание;
д - разламывание;
е - изрезывание;
ж - распиливание
Измельчение каждого вещества в составе смеси производят отдельно!
17.
Машины ударно-центробежного действия• Молотковая мельница
• 1-корпус, 2-броневые плиты, 3вал, 4-диск, 5-молоток, 6колосниковая решетка
• Дисковая мельница
«Эксцельсиор»
18. Особые случаи измельчения:
• 1. Трудноизмельчаемые порошки измельчают вприсутствии вспомогательных жидкостей
(спиртоэфирная смесь или этанол) За рубежом для
этой цели рекомендуется глицерин.
• 2. Вещества, образующие эвтектические смеси
измельчают в присутствии вспомогательной
жидкости. Если в составе порошка присутствует
смесь этих веществ, для предотвращения
образования эвтектической смеси и утраты
сыпучести рекомендуется введение наполнителей
(лактоза, магния оксид, каолин или аэросил).
Данное изменение в прописи рецепта должно
согласовываться с врачом.
19. Смешивание (mixtio)
• Цель стадии смешивания - получение однороднойпорошковой смеси. Смешивание, как правило,
проводят одновременно с измельчением в ступке,
аппарате М.Х. Исламгулова или других аппаратах,
используемых для этой цели
• Для качественного смешивания порошков
необходимо следовать правилам смешивания и
учитывать свойства веществ и факторов внешней
среды
Мельница Исламгулова
20.
. Для получения однородных смесей смешивание ведут по принципу «от меньшего к
большему». При этом соотношение веществ должно быть не более чем 1:20, при
смешивании с веществом списка А - 1:1. Если соотношение более 1:20, при
смешивании лекарственных веществ необходимо первоначально растереть в ступке
вещество, выписанное в большей массе, затерев им поры, затем высыпать на капсулу,
оставив в ступке количество, примерно равное массе второго компонента. Затем
добавить второй компонент, перемешать, добавляя частями первый.
2. Вещества списков А и Б, выписанные в массе менее 0,05 г на все дозы, используют в
виде тритураций - смеси (1:100 или 1:10) с молочным сахаром или другими
вспомогательными веществами, разрешенными к медицинскому применению.
3. Пылящие или легкораспыляемые вещества смешивают в последнюю очередь.
Исключением являются случаи, когда нет другого вещества для затирания пор ступки.
4. Красящие вещества добавляют в последнюю очередь в середину между слоями
предварительно смешанной массы.
5. Жидкости вводят в последнюю очередь - каплями на поверхность порошка. Если
масса утрачивает сыпучесть, разрешается введение индифферентного наполнителя
(лактоза) в количестве, обеспечивающем сыпучесть смеси. Развеску увеличивают.
Измененную пропись указывают на оборотной стороне рецепта.
21.
Виды смесителей: с вращающимся корпусом, червячнолопастные, с псевдоожижением сыпучего материала,центробежного действия с вращающимся конусом
Барабанные смесители
22. Просеивание (cubratio)
• Цель просеивания - получение продукта содинаковым размером частиц. Просеивание
проводят через сито капроновое с отверстиями 0,1
мм Операция является необходимой при получении
вдуваний, присыпок и глазных порошков (размер
частиц менее 0,1 мм). При изготовлении порошков
для приготовления растворов используют сито с
отверстиями 0,2-0,3 мм.
23. В производстве
• Виды сит (по характерусетки)
• а,б – плетеные
• в – штампованные
• г - колосниковые
Типы ситовых механизмов:
Машины с плоскими ситами
Барабанные просеивающие машины
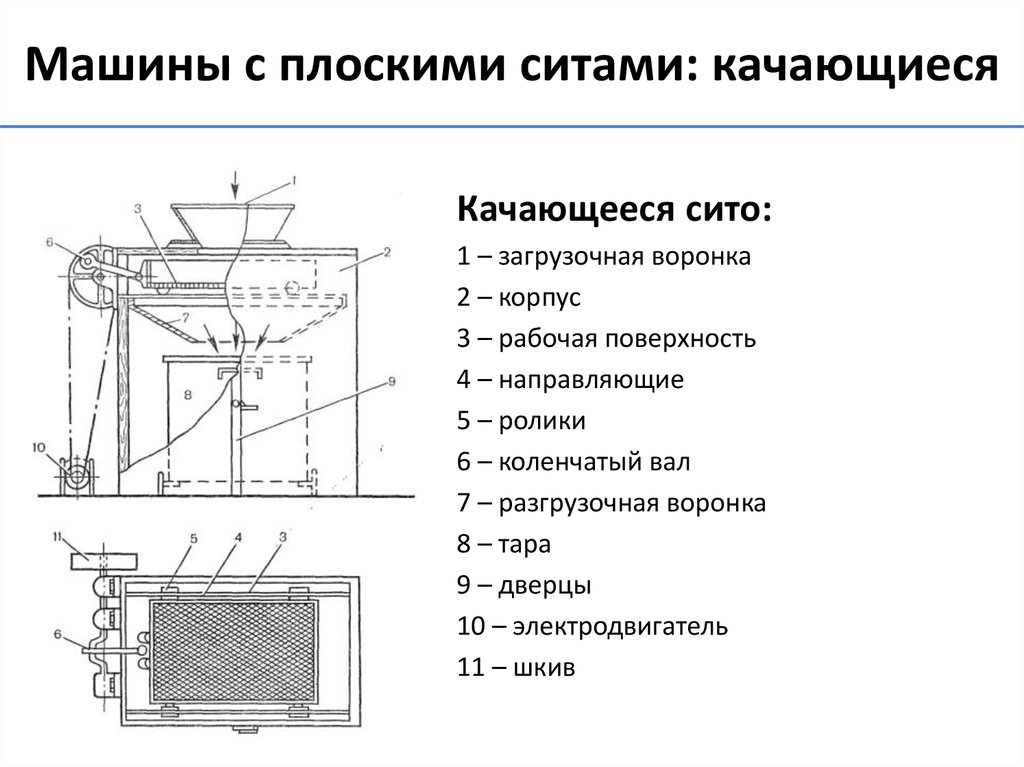
24.
Машины с плоскими ситами: качающиеся• Качающееся сито:
1 – загрузочная воронка
2 – корпус
3 – рабочая поверхность
4 – направляющие
5 – ролики
6 – коленчатый вал
7 – разгрузочная воронка
8 – тара
9 – дверцы
10 – электродвигатель
11 – шкив
25.
Машины с плоскими ситами: вибрационные(электромагнитные, гирационные, вибрационные)
• Вибросито:
1- крышка
2 - сетка на каркасе
3- патрубок разгрузки,
4 -корпус,
5 –вибровозбудитель
(пространственная
трехкомпонентная
вибрация)
• 6 -рама
• 7 -электродвигатель
26. стерилизация
• Стерилизация горячим воздухом(воздушная стерилизация)
• Для этого метода термической
стерилизации стандартными условиями
являются нагревание при температуре
не менее 160 °С в течение не менее
2 ч.
• Для стерилизации термостойких
порошкообразных веществ (натрия
хлорида, цинка оксида, талька, белой
глины и др.) или минеральных и
растительных масел, жиров, ланолина,
вазелина, воска и др. температуру и
время стерилизации устанавливают в
зависимости от массы образца
Стерильный шкаф ШШС500П
27.
Условия стерилизации для термостойких порошкообразных веществМасса образца, г
Температура, °С
Минимальное время
стерилизации, мин
до 25
180
30
200
10
180
40
200
20
180
60
200
30
от 25 до100
от 100 до 200
Термостабильные порошки предварительно должны быть упакованы в коробки или
биксы. Предельная масса упаковки не должна превышать 500 г . С целью
равномерного прогрева толщина слоя порошков должна быть не более 6-7 см.
28. Дозирование
• Дозирование порошков проводят по массе и по объему. Длядозирования по массе используют весы аптечные для сыпучих
материалов. Однако развешивание порошков с помощью
ручных аптечных весов является довольно трудоемкой
операцией, требующей определенных навыков, особенно при
дозировании значительных количеств порошков (например,
при изготовлении дозированных порошков для лечебных
учреждений или в запас).
• Более производительным, но менее точным является
дозирование по объему. Для дозирования по объему
используют автоматический дозатор ТК-3, созданный в ЦНИИФ.
Действие дозатора основано на отделении порции порошка
вращающимся с постоянной скоростью шнеком. Через
определенные промежутки времени, задаваемые на пульте
управления прибора, шнек отключается. Оператор меняет тару
для новой дозы.
29.
Способы дозирования: по массе и по объемуШнековый дозатор (по объему):
1-бункер
2-загрузочная воронка
3-направляющая мешалка
4-дроссельный клапан
5-дозирующий шнек
6-флакон
30. Упаковка
• Выбор упаковочного материала осуществляетсяв соответствии с физико-химическими
свойствами порошков
• флаконы с притертыми пробками – для
порошков с летучими веществами;
31. оформление
• На всех этикетках для оформления порошков,приготовляемых в порядке внутриаптечной
заготовки и фасовки, должны быть следующие
обозначения:
• - местонахождение аптечного учреждения
(предприятия);
• - наименование аптечного учреждения
(предприятия);
• - способ применения (внутреннее, наружное);
• - дата приготовления... ;
• - годен до ... ;
32.
Стандартизация порошковописание (цвет, вкус, запах);
подлинность;
средняя масса и отклонение в массе отдельных порошков;
сыпучесть;
посторонние примеси;
микробиологическая чистота;
соответствие упаковки и оформления входящим в состав
ингредиентам.
• Стерильность
• Апирогенность
33.
• Описание• Порошки должны быть однородными при
рассмотрении невооруженным глазом и
иметь размер частиц не более 160 мкм,
если не указано иное в фармакопейной
статье или нормативной документации.
34. Цефтазидим порошок для иньекций
• белый или белый с желтовато-бежевымоттенком порошок
35. идентификация
• для веществ, обладающих специфическими свойствами,внешние признаки могут выступать в качестве
показателей подлинности вещества. Кроме того, они в
ряде случаев отражают состав лекарственного
вещества. Так, например, это относится к
кристаллогидратам, меняющим свой внешний вид в
зависимости от содержания воды. Кроме того, ряд
лекарственных веществ за счет способности окисляться
под действием кислорода воздуха, могут приобретать
несвойственную им окраску. Поэтому контроль внешних
признаков является важным при определении
подлинности вещества, и они включены в ФС в раздел
«описание».
36. Идентификация цефтазидима
• На хромотограмме испытуемого раствора,полученной при количественном
определении, время удерживания
основного пика должно совпадать с
временем удерживания пика цефтазидима
на хромотограмме раствора сравнения
37. Прозрачность раствора
• Прозрачность и степень мутности жидкостейопределяют путем сравнения испытуемой жидкости с
растворителем или эталонами визуально или
инструментальным методом.
• Визуальное испытание проводят в одинаковых
пробирках с притертой пробкой из прозрачного
бесцветного и нейтрального стекла с внутренним
диаметром около 15 мм. Для сравнения берут равные
объемы эталона и испытуемой жидкости (5 или 10 мл).
Испытание проводят при освещении электрической
лампой матового стекла мощностью 40 Вт,
расположенной над образцом, просматривая растворы
перпендикулярно вертикальной оси пробирок на
черном фоне через 5 мин после приготовления эталона.
38. Прозрачность раствора цефтазидима
• 1 г препарата растворяет в воде, свободной отуглерода диоксида, доводят тем же
растворителем до обьема 10.0 мл.
полученный раствор должен быть прозрачным
Испытуемый жидкость считают прозрачной,
если она выдерживает сравнение с водой
39. Цветность раствора
• Для визуальной оценки окраски жидкостей взависимости от интенсивности в области
коричневых, желтых и красных цветов используют
один из двух методов, описанных в статье.
• Бесцветной считается жидкость, если ее окраска не
отличается от воды (в случае растворов – от
соответствующего растворителя) или она окрашена
не более интенсивно, чем эталон В9.
• Сравнение степени окраски жидкости с эталонами
(В, BY, Y, GY, R)1-3 обычно проводят по методу 1; в
случае использования эталонов В4-9, (BY, Y, GY, R)47 применяют метод 2.
40.
• Метод 1• Испытания проводят в одинаковых пробирках из бесцветного,
прозрачного, нейтрального стекла с внутренним диаметром
около 12 мм, используя равные объемы – 2,0 мл испытуемой
жидкости и воды, или растворителя, или эталона сравнения,
описанного в статье. Сравнивают окраску при рассеянном
дневном свете, горизонтально (перпендикулярно оси
пробирок) на матово-белом фоне.
• Метод 2
• Испытания проводят в одинаковых пробирках из бесцветного,
прозрачного, нейтрального стекла с внутренним диаметром от
15 до 25 мм, используя равные слои высотой 40 мм
испытуемой жидкости и воды, или растворителя, или эталона
сравнения, описанного в статье. Сравнивают окраску при
рассеянном дневном свете сверху вдоль вертикальной оси
пробирок на матово-белом фоне.
41.
Стандартныерастворы
Желтый
исходный
раствор, мл
Красный
исходный
раствор, мл
Голубой
исходный
раствор, мл
1 % раствор
хлористоводоро
дной
кислоты, мл
В
(коричневый)
30,0
30,0
24,0
16,0
ВY
(коричневатожелтый)
24,0
10,0
4,0
62,0
Y (желтый)
24,0
6,0
0
70,0
GY
(зеленоватожелтый)
96,0
2,0
2,0
0
R (красный)
10,0
20,0
0
70,0
42. Механические включения: невидимые частицы
• Механические включения инъекционных ивнутривенных инфузионных растворов
— это посторонние подвижные нерастворимые
частицы, за исключением пузырьков газа, случайно
присутствующих в растворах.
Оборудование. Для контроля используют прибор
основанный но принципе светоблакировки,
который
позволяет автоматически измерять количество и
размер частиц. Прибор калибруют, используя
дисперсионные взвеси
СО ЮФ РК сферических частиц размером от 5
до 25 мкм.
43.
• Методика. Перемешивают содержимое образца, медленнопереворачивая его 20 раз. При необходимости осторожно
удаляют этикетки и элементы укупорки. Очищают наружные
поверхности вскрываемой упаковки струей воды, свободной от
частиц, и удаляют пробку, избегая какого-либо загрязнения
содержимого. Готовят испытуемый раствор в соответствии с
указаниями, приведенными выше, в зависимости от объема
содержимого контейнера. Для удаления пузырьков воздуха
приготовленный раствор оставляют стоять в течение 2 мин или
обрабатывают ультразвуком.
• В объединенной пробе объемом не менее 25 мл определяют
число частиц размером, равным или превышающим 10 и 25
мкм. Проводят 4 измерения. При этом не принимают в расчет
результаты определения для первой пробы и рассчитывают
среднее число частиц в испытуемом образце.
• препараты с номинальным объемом более 100 мл отвечают
требованиям, если в 1 мл среднее число частиц размером 10
мкм и более не превышает 25, а среднее число частиц
размером 25 мкм и более не превышает 3.
44. потеря в массе при высушивании
• Под понятием «Потеря в массепри высушивании»
подразумевают потерю в массе
за счет гигроскопической влаги и
летучих веществ, которую
определяют в веществе при
высушивании до постоянной
массы, или в течение времени,
указанного в фармакопейной
статье
• Потеря массы при высушивании
цефотоксима не более 15.0%
АНАЛИЗАТОР ВЛАЖНОСТИ
45.
Способ 1.
Если не указано иначе, пробу высушивают в течение 2 ч в
сушильном шкафу в пределах температурного интервала,
указанного в фармакопейной статье или нормативной
документации. Затем открытый бюкс вместе с крышкой
помещают в эксикатор для охлаждения на 50 мин, после чего
закрывают крышкой и взвешивают. Последующие взвешивания
проводят после каждого часа дальнейшего высушивания до
достижения постоянной массы. При отсутствии других указаний
пробу сушат до постоянной массы при температуре от 100 до
105ºС.
Способ 2
Высушивание проводят в эксикаторе над фосфора (V) оксидом
одним из следующих методов:
– при атмосферном давлении и комнатной температуре;
– в вакууме при комнатной температуре или температуре,
указанной в фармакопейной статье или нормативной
документации;
– в «глубоком вакууме»: при давлении не более 0,1 кПа при
температуре, указанной в фармакопейной статье или
нормативной документации..
46. пирогенность
• Настоящая общая фармакопейная статьяраспространяется на испытание
пирогенности инъекционных растворов и
фармацевтических субстанций, из которых
они изготавливаются. Испытание основано
на измерении температуры тела у кроликов
до и после инъекции.
47.
• Каждого кролика содержат в отдельной клетке наполноценном пищевом рационе, ограждая от
раздражающих воздействий (акустических,
оптических и других). В помещениях, где находятся
животные и проводятся испытания, поддерживают
постоянную температуру воздуха 20 ± 3 ºС. Перед
испытанием проводят осмотр животных и отбирают
здоровых кроликов одного пола, не альбиносов, с
массой тела от 2,0 до 3,5 кг, которые не теряли в
массе в течение предыдущей недели. За 18 часов
до испытания кроликов лишают корма без
ограничения воды. Во время опыта животные не
получают ни корма, ни воды.
48.
• Испытуемое лекарственное средство вводят в ушнуювену кролика. Объем инъецируемого раствора должен
составлять не менее 0,2 мл и не более 10 мл на 1,0 кг
массы тела животного. Перед введением раствор
подогревают до температуры 37,0 ± 2ºС.
• Измерения температуры после внутривенного введения
испытуемого лекарственного средства проводят с
интервалом не более 30 минут на протяжении трех
часов. При других путях парентерального введения – на
протяжении пяти часов.
49.
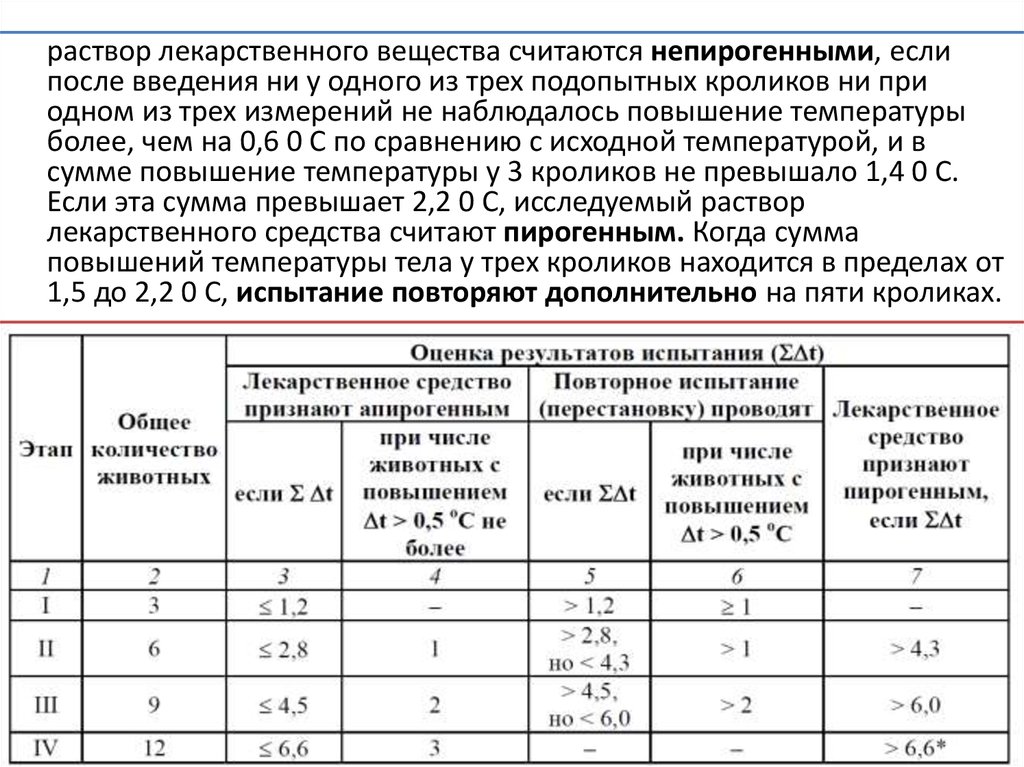
раствор лекарственного вещества считаются непирогенными, еслипосле введения ни у одного из трех подопытных кроликов ни при
одном из трех измерений не наблюдалось повышение температуры
более, чем на 0,6 0 С по сравнению с исходной температурой, и в
сумме повышение температуры у 3 кроликов не превышало 1,4 0 С.
Если эта сумма превышает 2,2 0 С, исследуемый раствор
лекарственного средства считают пирогенным. Когда сумма
повышений температуры тела у трех кроликов находится в пределах от
1,5 до 2,2 0 С, испытание повторяют дополнительно на пяти кроликах.
50. стерильность
• Определение стерильности растворов проводится путемпосева и инкубации на специальных тест-средах образцов
каждой серии продукции. При обнаружении роста
микроорганизмов хотя бы в одной пробирке испытание
повторяют на таком же количестве сосудов. И только при
отсутствии роста при повторном посеве серия считается
стерильной. Определению стерильности
подвергают ампулы или флаконы каждой серии, одновременно
подвергавшиеся стерилизации в одном стерилизующем
аппарате.
51.
• .Для фильтрования применяют установку с мембраной диаметром47 мм и размером пор 0,45±0,02 мкм. Фильтры стерилизуют при
температуре 121±1°С 20 мин. Испытаемый порошок растворяют
в воде для инъекций, фильтруют через стерильную мембрану,
которую промывают от раствора 3-5 порциями растворителя по
100 мл, разрезают стерильными ножницами на 2 части, одну из
них помещают в колбу с тиогликолевой средой, вторую – в среду
Сабуро, 7 дней инкубируют при ежедневном просмотре. Все
операции проводят в асептических условиях. При отсутствии
роста на двух средах делают заключение о стерильности серии.
стерильный
Не стерильный
52. Заключение
• Испытуемый порошок для иньекцийЦефтазидим соответствует требованиям ГФ
РК.
53. литературы
• Фармакопея РК I том. Стр: 25, 36, 37, 112, 164,173, 254, 324, 512, 539
• Фармакопея II том. Стр: 550
• http://pharmacopoeia.ru/ofs-1-4-1-0010-15poroshki/
• http://pharmacopoeia.ru/ofs-1-4-1-0007-15lekarstvennye-formy-dlya-parenteralnogoprimeneniya/
• http://vmede.org/sait/?id=Farm_texnologiya_bzg
_ls_gavrilov_2010&menu=Farm_texnologiya_bzg
_ls_gavrilov_2010&page=10



















































 Медицина
Медицина








