Похожие презентации:
Пептиды. Номенклатура и классификация пептидов. Особенности строения пептидной связи. Физические и химические свойства пептидов
1. Пептиды
Номенклатура и классификация пептидов.Особенности строения пептидной связи. Физические и
химические свойства пептидов. Изоэлекрическая
точка. Группы пептидов, биороль. Синтез пептидов.
2.
ПЕПТИДЫ – это природные или синтетические соединения, молекулыкоторых построены из остатков α-аминокислот, соединенных между
собой пептидными (амидными) связями -C(O) NH-.
O
H2N CH C OH
R
O
H2N CH C NH CH COOH
H NH CH COOH
- H2O
R
R
R
пептидная связь
пептидные связи
O
O
O
H2N CH C NH CH C NH CH C NH CH COOH
R2
R4
R1
R3
С-конец
N-конец
тетрапептид
Могут содержать в молекуле также неаминокислотную
компоненту (например, остаток углевода, НК).
По числу аминокислотных остатков, входящих в молекулы
пептидов, различают дипептиды, трипептиды, тетрапептиды и т.д.
Пептиды, содержащие до 10 аминокислотных остатков, называются
олигопептидами, содержащие более 10 аминокислотных остатков
полипептидами. Природные полипептиды с молекулярной массой более
6 000 Да называются белками.
Пептиды. Лекция
2
28.11.2018
3. Историческая справка
Впервые пептиды были выделены из ферментативных гидролизатовбелков.
Термин «пептиды» предложен Э. Фишером.
Первый синтетический пептид получил T. Курциус в 1881
Э. Фишер к 1905 разработал первый общий метод синтеза пептидов и
синтезировал ряд олигопептидов различного строения.
Существенный вклад в развитие химии пептидов внесли ученики Э.
Фишера: Э. Абдергальден, Г. Лейке и M. Бергман. В 1932 M Бергман и Л.
Зервас использовали в синтезе пептидов бензилоксикарбонильную
группу (карбобензоксигруппу) для защиты α-аминогрупп аминокислот,
что ознаменовало новый этап в развитии синтеза пептидов.
Полученные N-защищенные аминокислоты (Nкарбобензоксиаминокислоты) широко использовали для получения
различных пептидов, которые успешно применяли для изучения ряда
ключевых проблем химии и биохимии, например, для исследования
субстратной специфичности протеолитических ферментов. С
применением N-карбобензоксиаминокислот были впервые
синтезированы природные пептиды (глутатион, карнозин и др.).
Пептиды. Лекция
3
28.11.2018
4. Историческая справка
Важное достижение в этой области - разработанный в начале 50-х гг. P.Воганом и др. синтез пептидов методом смешанных ангидридов.
В 1953 В. Дю Виньо синтезировал первый пептидный гормон - окситоцин.
На основе разработанной P. Меррифилдом в 1963 концепции
твердофазного пептидного синтеза были созданы автоматические
синтезаторы пептидов. Получили интенсивное развитие методы
контролируемого ферментативного синтеза пептидов. Использование
новых методов позволило осуществить синтез гормона инсулина и др.
Успехи синтетической химии пептидов были подготовлены
достижениями в области разработки таких методов разделения,
очистки и анализа пептидов, как ионообменная хроматография,
электрофорез на различных носителях, гель-фильтрация,
высокоэффективная жидкостная хроматография (ВЭЖХ), иммунохимический анализ и др. Получили большое развитие также методы
анализа концевых групп и методы ступенчатого расщепления пептидов.
Были, в частности, созданы автоматические аминокислотные
анализаторы и автоматические приборы для определения первичной
структуры пептидов - секвенаторы.
Пептиды. Лекция
4
28.11.2018
5. Номенклатура пептидов
АланилфенилаланилглицилсеринNH2 CH CO NH CH CO NH CH2 CO NH CH COOH
CH2 C6H5
CH2 OH
CH3
Ala-Phe-Gly-Ser
Пептиды. Лекция
5
или
AFGS
28.11.2018
6. Классификация пептидов
Гомомерные пептиды при гидролизе образуют только аминокислоты, гетеромерные наряду саминокислотами соеденения др. классов. В зависимости от структуры неаминокислотной
компоненты, гетеромерные пептиды делятся на глико-, липо-, нуклео-, фосфопептиды и др.
Гомомерные и гетеромерные пептиды могут быть линейными и циклическими. Аминокислотные
остатки в них могут быть соединены между собой только пептидными связями (гомодетные
пептиды) или не только пептидными, а сложноэфирными, дисульфидными и др. (гетеродетные
пептиды). Гетеродетные пептиды со встроенными в цепь гидроксиаминокислотами называются
пептолидами. Пептиды, содержащие в молекуле остатки только одной аминокислоты, называются
гомополиаминокислотами, а содержащие одинаковые повторяющиеся участки (из одной или
нескольких аминокислотных остатков) регулярными пептидами. Депсипептиды содержат одну или
несколько сложноэфирных групп.
Пептиды. Лекция
6
28.11.2018
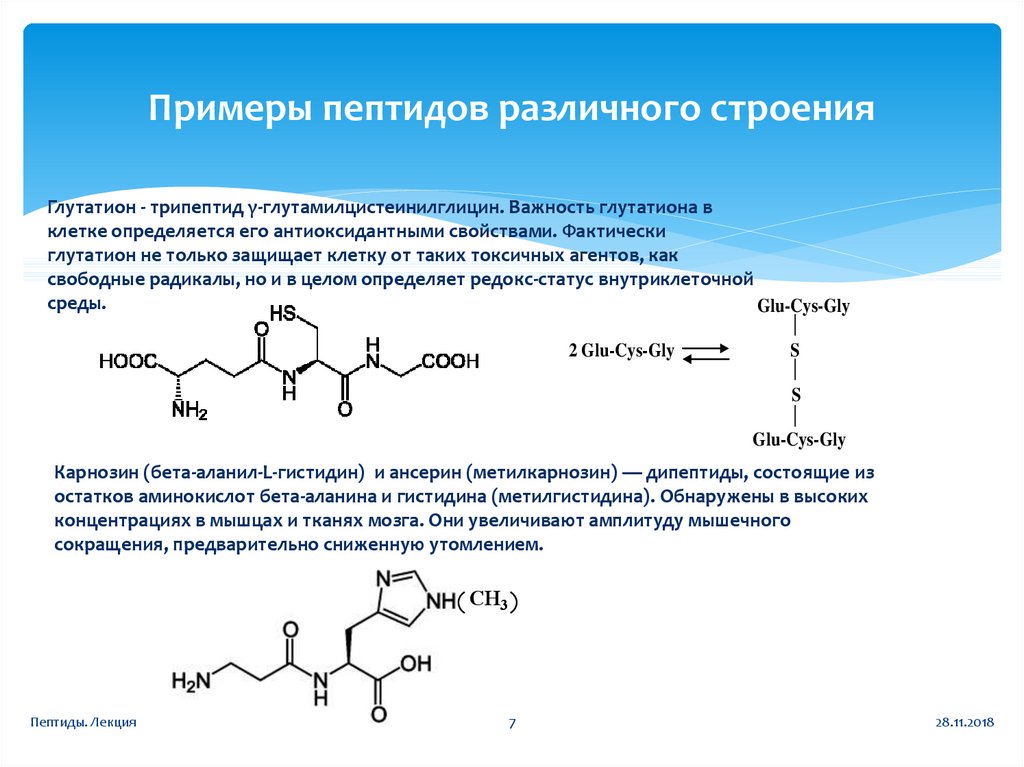
7. Примеры пептидов различного строения
Глутатион - трипептид γ-глутамилцистеинилглицин. Важность глутатиона вклетке определяется его антиоксидантными свойствами. Фактически
глутатион не только защищает клетку от таких токсичных агентов, как
свободные радикалы, но и в целом определяет редокс-статус внутриклеточной
среды.
Glu-Cys-Gly
2 Glu-Cys-Gly
S
S
Glu-Cys-Gly
Карнозин (бета-аланил-L-гистидин) и ансерин (метилкарнозин) — дипептиды, состоящие из
остатков аминокислот бета-аланина и гистидина (метилгистидина). Обнаружены в высоких
концентрациях в мышцах и тканях мозга. Они увеличивают амплитуду мышечного
сокращения, предварительно сниженную утомлением.
CH3
Пептиды. Лекция
7
28.11.2018
8. Примеры пептидов различного строения
Tyr-Gly-Gly-Phe-MetTyr-Gly-Gly-Phe-Leu
Met- энкефалин
Leu- энкефалин
Энкефалины – нейропептиды с морфиноподобным действием, вырабатываемые центральной нервной
системой позвоночных. Уменьшают двигательную активность, участвуют в обезболивании и др.
Являются олигопептидами – состоят из 5 аминокислот, образуются в результате посттрансляционного
преобразования полипротеина.
цикло-(D-Hyd-L-Ser)2
Мембранно-активный антибиотик серратомолид — тетрапептид с повторяющимися
остатками D-8-гидроксидекановой кислоты (D-Hyd) и L-серина является депсипепдом.
(D-Phe – L-Pro – L-Val – L-Orn – L-Leu)2
Пептиды. Лекция
Грамицидин S — антибиотик тиротрициновой группы. Продуцируется
споровой палочкой Bacillus brevis var. G.- B. В промышленности
получают синтетическим путём. Первый советский антибиотик, был
выделен Г. Ф. Гаузе и М. Г. Бражниковой в 1942 г. Cыграл важную роль в
спасении многих тысяч жизней на фронтах Великой Отечественной
войны
8
28.11.2018
9. Особенности строения пептидной связи
RR
C NH
O
R1
C NH
R1
O
Пептидная связь имеет свойства частично двойной связи. Это проявляется в
уменьшении длины этой связи (0,132 нм)по сравнению с длиной простой
связи C-N (0,147 нм).
Следствия:
к –NH- в –CONH- не может присоединятся или отщепляться Н при рН 0-14
свободное вращение вокруг связи С-N отсутствует
Пептиды. Лекция
9
28.11.2018
10. Свойства пептидов
Олигопептиды по свойствам близки к аминокислотам, полипептиды подобныбелкам. Олигопептиды представляют собой, как правило, кристаллические
вещества, разлагающиеся при t 200-300 0C. Пептиды хорошо растворимы в воде,
разбавленных кислотах и щелочах, почти не растворимы в органических
растворителях. Исключение: олигопептиды, построенные из остатков
гидрофобных аминокислот.
Олигопептиды обладают амфотерными свойствами и, в зависимости от
кислотности среды, могут существовать в форме катионов, анионов или цвиттер+
ионов.
+
NH
NH2
3
NH
3
CH3 CH
CO
CH3
NH
CH
COO-
pH > 7
+
+H
CH3 CH
CO
NH
CH3 CH
COOpH = 7
+ H+
CH3 CH
CO
NH
CH3 CH
COOH
pH < 7
Изоэлектрическая точка (рI) пептидов колеблется в широких пределах и зависит
от состава аминокислотных остатков в молекуле.
Основные полосы поглощения в ИК спектре для группы –NH- 3300 и 3080 см-1, для
группы C=O 1660 см-1. В УФ спектре полоса поглощения пептидной группы
находится в области 180-230 нм.
Пептиды. Лекция
10
28.11.2018
11. Химические свойства пептидов
Химические свойства олигопептидов определяются содержащимися в нихфункциональными группами, а также особенностями пептидной связи. Их
химические превращения в значительной мере аналогичны соответствующим
реакциям аминокислот. Они дают положитительную биуретовую реакцию и
нингидриновую реакцию.
NH2 CH CO NH CH COOH
CH3
CH3
1. CH3I, HCl
NH2 CH CO NH CH CO OCH3
2.NH3, - NH4Cl
CH3
CH3
аланилаланин
метиловый эфир аланилаланина
Дипептиды и их производные (особенно эфиры) легко циклизуются, превращаясь в
дикетопиперазины:
CH3
NH
O
NH2 CH CO NH CH COOH
CH3
CH3
- H2O
O
NH
CH3
аланилаланин
2,5 - диметилдикетопиперазин
Под действием 5,7 Н соляной кислоты пептиды гидролизуются до аминокислот в
течение 24 ч при 105 0C:
O
H2N CH C
R
NH CH COOH
R
+ H2O
O
H2N CH C OH
R
H NH CH COOH
R
пептидная связь
Пептиды. Лекция
11
28.11.2018
12. Синтез пептидов
В организме:каскадные процессы
рибосомальный синтез
нерибосомальный синтез (пантотеновая к-та и
фосфопантотеин) – у микроорганизмов
Вне организма:
химический синтез
Пептиды. Лекция
12
28.11.2018
13. Регуляция кровяного давления:
12
3
4 5 6
7
8
9 10 11
Asp - Arg - Val - Tyr - Ile - His - Pro - Phe - His - Ley - Val - .....
Ангиотензиноген
Ренин
1
2
3
4 5 6
7
8
9 10
Asp - Arg - Val - Tyr - Ile - His - Pro - Phe - His - Ley
Ангиотензин - 1
Карбоксидипептидилпептидаза
АПФ
1
2
3
4 5 6
7
8
Asp - Arg - Val - Tyr - Ile - His - Pro - Phe
Ангиотензин - 2
Ангиотензин-2 — олигопептидный гормон, который вызывает вазоконстрикцию
(сужение сосудов), повышение кровяного давления и высвобождение другого гормона
альдостерона из коры надпочечеников в кровоток. Ангиотензин образуется из белкапредшественника ангиотензиногена, сывороточного глобулина, который продуцируется в
основном печенью. Ангиотензин играет важную роль в т. н. ренин-ангиотензиновой системе.
Пептиды. Лекция
13
28.11.2018
14. Строение пантотеновой кислоты
остаток -аланинаCH3
HOCH2 C CH OH
CH3
C NHCH2CH2COOH
O
остаток, синтезирующийся из валина
Пантотеновая кислота (Витамин B5) - белый мелкокристаллический порошок,
хорошо растворимый в воде. Она синтезируется растениями и микроорганизмами, содержится
во многих продуктах животного и растительного происхождения (яйцо, печень, мясо, рыба,
молоко, дрожжи, картофель, морковь, пшеница, яблоки). В кишечнике человека пантотеновая
кислота в небольших количествах продуцируется кишечной палочкой. Пантотеновая кислота универсальный витамин, в ней или её производных нуждаются человек, животные, растения и
микроорганизмы.
Пептиды. Лекция
14
28.11.2018
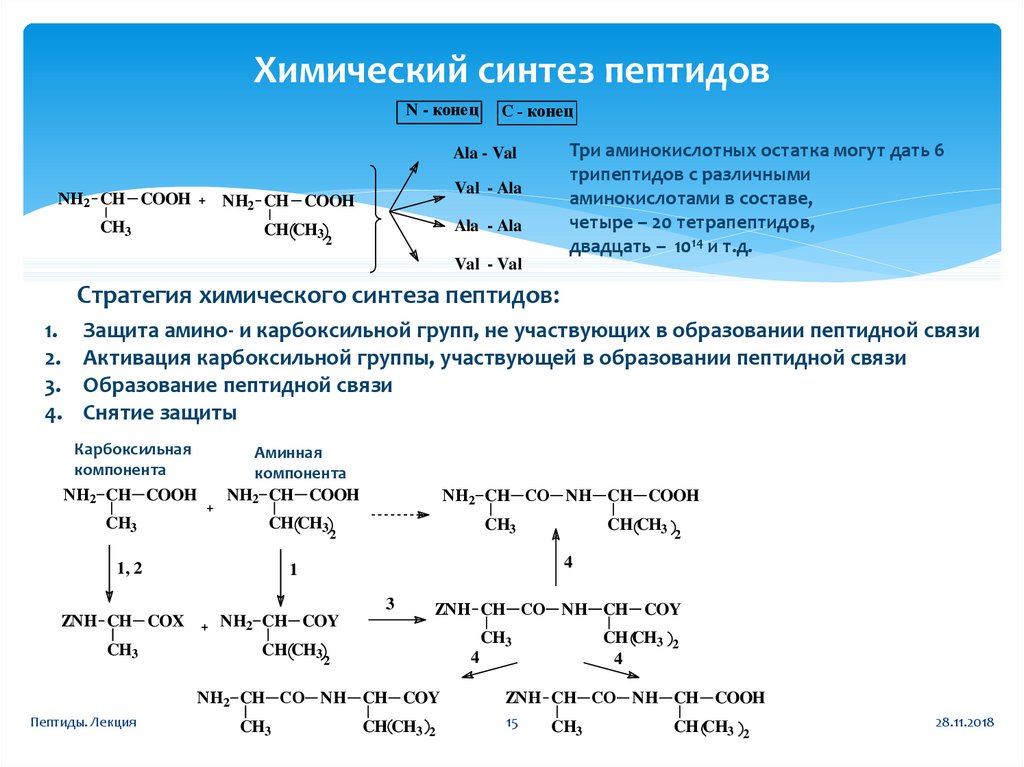
15. Химический синтез пептидов
N - конецС - конец
Три аминокислотных остатка могут дать 6
трипептидов с различными
аминокислотами в составе,
четыре – 20 тетрапептидов,
двадцать – 1014 и т.д.
Ala - Val
NH2 CH COOH
CH3
Val - Ala
NH2 CH COOH
CH CH3
Ala - Ala
2
Val - Val
Стратегия химического синтеза пептидов:
1.
2.
3.
4.
Защита амино- и карбоксильной групп, не участвующих в образовании пептидной связи
Активация карбоксильной группы, участвующей в образовании пептидной связи
Образование пептидной связи
Снятие защиты
Карбоксильная
компонента
NH2 CH COOH
CH3
Аминная
компонента
NH2 CH COOH
CH CH3
1, 2
ZNH CH COX
CH3
NH2 CH CO NH CH COOH
CH3
2
3
NH2 CH COY
ZNH CH CO NH CH COY
CH3
CH3
CH CH3
4
4
2
NH2 CH CO NH CH COY
Пептиды. Лекция
2
4
1
CH CH3
CH CH3
CH CH3
2
2
ZNH CH CO NH CH COOH
15
CH3
CH CH3
2
28.11.2018
16. Защитные группы
Все защитные группы делят на N-защитные (для временной защиты группы NH2), С-защитные (длявременной защиты карбоксильных групп COOH) и R-защитные (для временной защиты других
функциональных групп в боковой цепи аминокислот).
Среди N-защитных групп наиболее важными являются ацильные защитные группы [в т.ч. типа
ROC(O)], а также алкильные и аралкильные защитные группы.
Примеры N-защитных групп типа ROC(O):
бензилоксикарбонильная группа (карбобензоксигруппа) C6H5CH2OCO
трет-бутоксикарбонильная группа (СН3)3СОСО.
К ацильным N-защитным группам относят:
формильную HCO, трифторацетильную CF3CO и др.
Представители N-защитных групп алкильной и аралкильной природы:
триметилсилильная (CH3)3Si и трифенилметильная (тритильная) (C6H 5)3С.
Среди С-защитных групп важнейшими являются сложно-эфирные и замещенные гидразидные
группы. К первым относят, например, метокси-, этокси- и трет-бутоксигруппы. С-защитные группы
гидразидного типа - бензилоксикарбонил-, трет-бутилоксикарбонил-, тритил- и фенил-гидразиды.
В качестве R-защитных групп широко используют ацильные группы, в т. ч. типа ROC(O) (для
защиты аминогрупп и гуанидиногрупп в боковых цепях лизина и аргинина соответственно),
сложноэфирные группировки (для защиты карбоксилов в боковых цепях аспарагиновой и
глутаминовой к-т), а также алкильные и аралкильные группы (для защиты групп ОН и SH в боковых
цепях гидроксиаминокислот и цистеина соответственно).
Пептиды. Лекция
16
28.11.2018
17. Способы образования пептидной связи
Метод активированных эфиров:основан на предварительном образовании сложноэфирного производного
карбоксильной компоненты путем введения в нее спиртового остатка, содержащего
сильный электроноакцепторный заместитель. В качестве активированных эфиров
широко используют пентафтор-, пентахлор-, трихлор- и n-нитрофениловые эфиры
защищенных аминокисот и пептидов;
Карбодиимидный метод:
предусматривает использование различных замещенных карбодиимидов, таких как
дициклогексилкарбодиимид (ДЦГ) : C6H11 N C N C6H11
Метод смешанных ангидридов:
основан на предварительной активации карбоксильной компоненты пептидного
синтеза путем образования смешанного ангидрида с карбоновой или
неорганической кислотой. Наиболее часто используют алкиловые эфиры
хлормуравьиной (хлоругольной) к-ты, особенно этиловый и изобутиловый эфиры:
C2H5 O C Cl
O
Азидный метод:
предусматривает активацию карбоксильной компоненты предварительным
превращением ее в азид N-замещенной аминокислоты или пептида.
Пептиды. Лекция
17
28.11.2018
18. Карбодиимидный метод:
Карбоксильнаякомпонента
ДЦГ
N C
XNH CH COOH
N
R
Аминокомпонента
XN H CH CO O
R
C
H2 N
N
HN
Дициклогексилизомочевина
Дипептид
XNH CH CO
R
CHR 1 COY
NH CH
NH C NH
COY
R1
O
Использование ДЦГ в качестве конденсирующего реагента позволяет
осуществлять синтез пептидов и в водных средах, т. к. скорости реакций гидролиза и
аминолиза промежуточно образующейся О-ацилизомочевины существенно различаются.
При синтезе пептидов этим методом находят также применение различные
водорастворимые карбодиимиды (например, N-диметиламинопропил-N'этилкарбодиимид).
Пептиды. Лекция
18
28.11.2018
19. Метод смешанных ангидридов:
Карбоксильнаякомпонента
XN H CH COOH
Этоксикарбохлорид
CH3 N
3
C2H5 O C Cl
R
O
15 0C,
CH3 NHCl
3
Аминокомпонента
XN H CH C
R
O
O C O C2H5
H2 N
CHR 1 COY
CO2
C2H5OH
O
Дипептид
XN H CH CO
R
NH CH
COY
R1
В одном из вариантов метода смешанных ангидридов в качестве конденсирующего
агента применяют 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин. Это соеденение легко
образует с карбоксильной компонентой промежуточный смешанный ангидрид, быстро
вступающий в реакцию конденсации, причем полностью исключается нежелательная
побочная реакция.
Частный случай метода смешанных ангидридов - метод симметричных ангидридов,
в котором используют ангидриды аминокислот [XNHCH(R)C(O)]2O. Их применение исключает
возможность диспропорционирования или неправильного аминолиза.
Пептиды. Лекция
19
28.11.2018
20. Азидный метод:
Карбоксильнаякомпонента
Гидразин
XNH CH COOAlk
NH2 NH2
NaNO2 , H
XNH CH CO
R
NH NH2
R
Азид АК
XNH CH C
R
Аминокомпонента
H2 N
N N N
CHR 1 COY
O
Дипептид
XNH CH CO
R
NH CH
COY
N3H
R1
Ввиду нестойкости азидов их в свободном виде из раствора, как правило, не
выделяют. Если вместо нитритов щелочных металлов для реакции с гидразидом
использовать алкиловые эфиры азотистой кислоты (например, трет-бутилнитрит), то
азидную конденсацию можно проводить в органическом растворителе; образующуюся
HN3 связывают третичными аминами.
Нередко азидная конденсация осложняется нежелательными побочными
реакциями (превращение гидразида не в азид, а в амид; реакция гидразида с азидом,
ведущая к образованию 1,2-диацил-гидразина; промежуточное образование изоцианата,
который в результате перегруппировки Курциуса может приводить к производному
мочевины или соответствующему уретану и др.).
Преимущества азидного метода - малая степень рацемизации, возможность
применения серина и треонина без защиты гидроксильных групп.
Пептиды. Лекция
20
28.11.2018
21. Рацемизация при синтезе пептидов:
ДипептидXNH CH CO
R
Енольная форма
NH CH
R1
COY
XNH CH CO
NH C
R1
R
C
Y
Рацемат
OH
Наиболее важные способы исключения рацемизации:
1) Наращивание пептидной цепи в направлении от С-конца к N-концу с применением
N-защитных групп типа ROC(O).
2) Активация N-защищенных пептидных фрагментов с С-концевы-ми остатками
пролина или глицина.
3) Использование азидного метода (при отсутствии избытка третичного основания
и поддержании низких температур в реакционной среде).
4) Применение активированных эфиров аминокислот, аминолиз которых протекает
через переходное состояние, стабилизирующееся водородными связями
(например, эфиров, образованных с N-гидроксипиперидином и 8гидроксихинолином).
5) Использование карбодиимидного метода с добавками N-гидроксисоеденений или
кислот Льюиса.
Пептиды. Лекция
21
28.11.2018
22. Методы деблокирования
Для превращения защищенных пептидов в свободныеиспользуют специальные методы деблокирования, которые основаны на
реакциях, обеспечивающих отщепление различных защитных групп,
гарантирующих сохранение всех пептидных связей в молекуле.
Примеры деблокирования:
удаление бензилоксикарбонильной группы каталитическим гидрогенолизом при
атмосферном давлении и комнатной температуре:
C6H5
O
CH2 O C NH CH
R
H2/Pd
COOH
H2N CH COOH + CO2 + C6H5 CH3
R
отщепление трет-бутилоксикарбонильной группы мягким ацидолизом:
CF3COOH
CH3 3C O C NH CH CO
R
O
NH2
CH CO
CH3
C OH
3
CO2
R
гидролитическое отщепление трифторацетильной группы под действием
разбавленных растворов оснований:
CF3
C NH CH CO
O
Пептиды. Лекция
NaOH
NH2
CH CO
R
CF3 COONa
R
22
28.11.2018
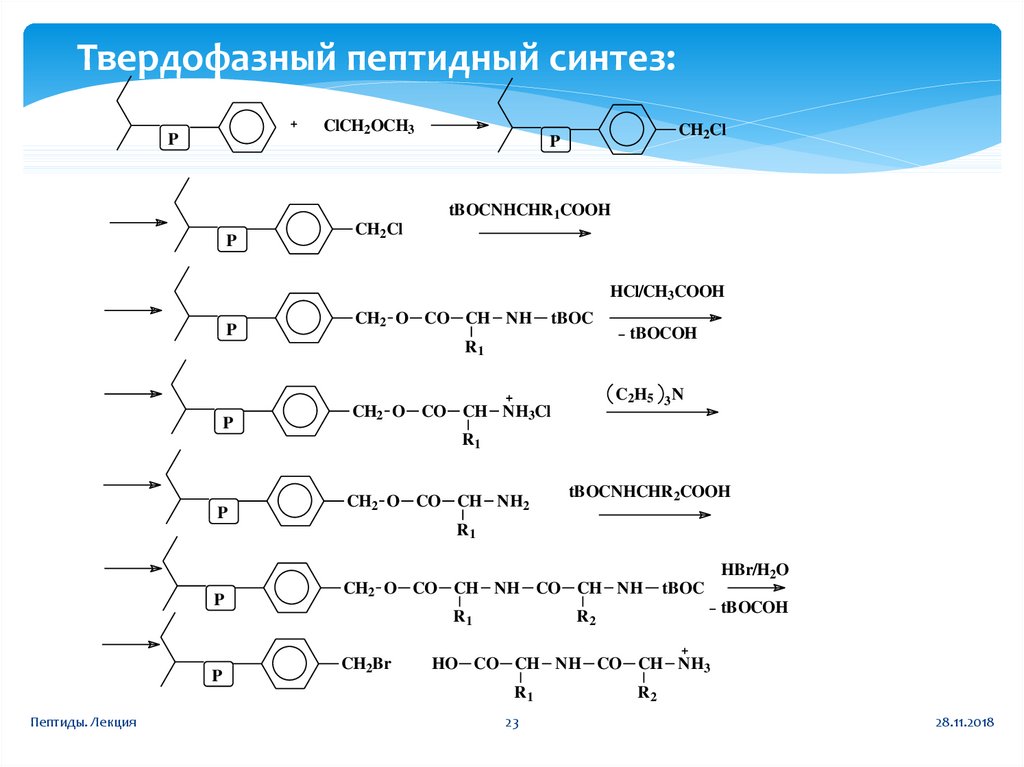
23.
Твердофазный пептидный синтез:ClCH2OCH3
P
CH2Cl
P
tBOCNHCHR1COOH
P
CH2Cl
HCl/CH3COOH
P
CH2 O CO CH NH
tBOC
R1
P
tBOCOH
C2H5
CH2 O CO CH NH3Cl
3N
R1
P
CH2 O CO CH NH2
tBOCNHCHR2COOH
R1
HBr/H2O
P
CH2 O CO CH NH CO CH NH
R1
P
CH2Br
tBOCOH
R2
HO CO CH NH CO CH NH3
R1
Пептиды. Лекция
tBOC
23
R2
28.11.2018
24. Биологическая роль пептидов, группы пептидов:
-гормоны (окситоцин, инсулин, и др.)- регуляторы иммунитета (тафтсин: Thr—Lys—Pro—Arg)
-участвующие в пищеварении (гастрин)
- регулирующие тонус сосудов (ангиотензин-2, брадикинин)
- обезболивающие (энкефалины, эндорфины)
- регулирующие аппетит (лептин, нейропептид Y)
- участвующие в высшей нервной деятельности (сон, память,
страх и т.д.)
- токсины (токсины ос, пчел, амфибий, конусов)
- антибиотики (валиномицин, грамицидин S) и т.д.
Пептиды. Лекция
24
28.11.2018





















 Химия
Химия








