Похожие презентации:
Гидроксикислоты (оксикислоты)
1.
*ОРГАНИЧЕСКАЯ ХИМИЯЛекция№14
Тема:Гидроксикислоты
2.
*ГИДРОКСИКИСЛОТЫ (ОКСИКИСЛОТЫ)Гидроксикислоты содержат в молекуле две функциональные группы –
карбоксильную (COOH) и гидроксильную (OH)
1.
Номенклатура
Карбоксильная группа (COOH) по номенклатурным
правилам
является
более
старшей,
чем
гидроксигруппа (OH), поэтому карбоксильная группа
определяет в названии кислоты окончание (-овая), а
гидроксигруппа – приставку
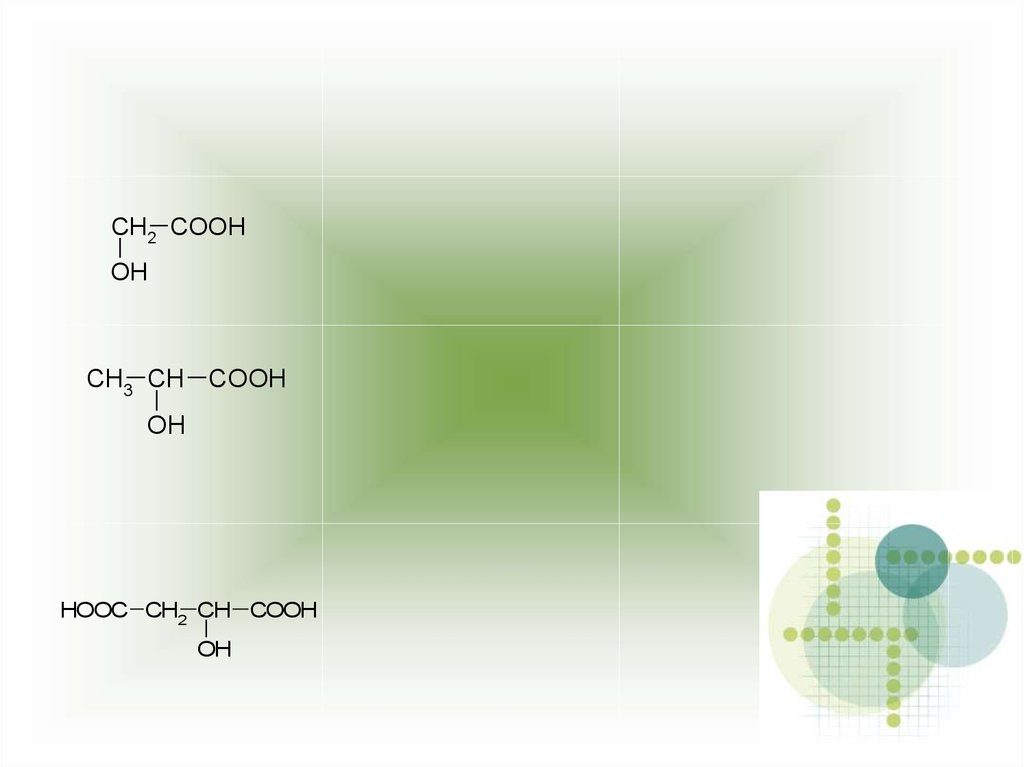
CH3 CH COOH
OH
2-гидроксипропановая кислота
3.
CH2 COOHOH
CH3 CH COOH
OH
HOOC CH2 CH COOH
OH
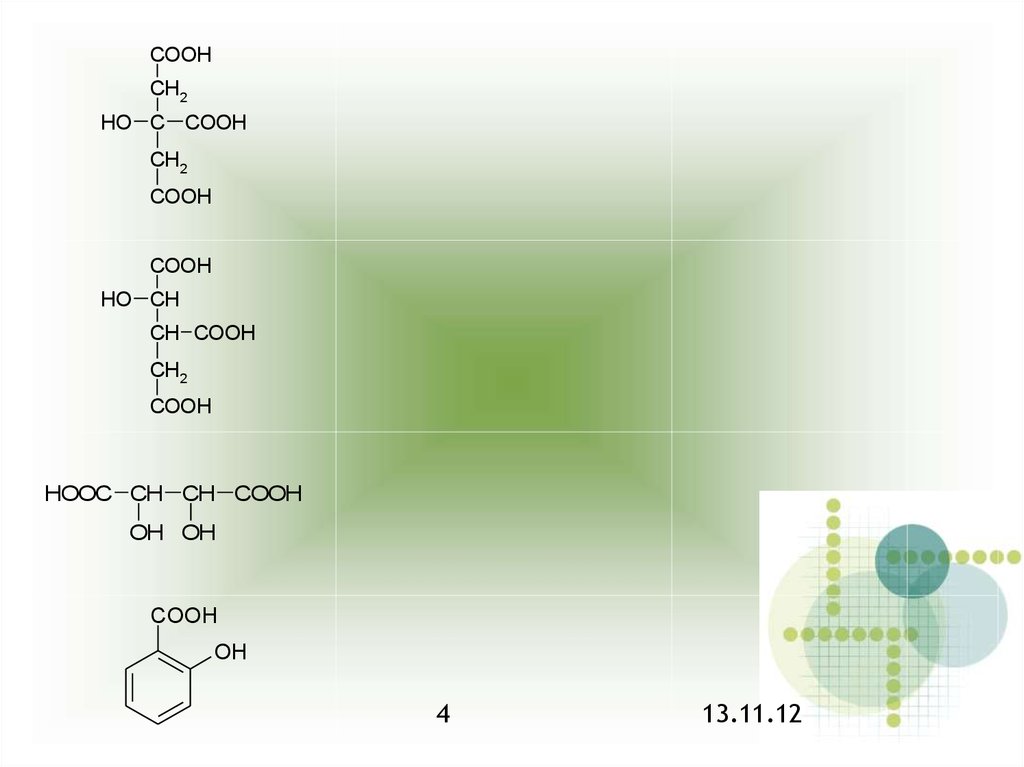
4.
COOHCH2
HO C COOH
CH2
COOH
COOH
HO CH
CH COOH
CH2
COOH
HOOC CH CH COOH
OH OH
COOH
OH
4
13.11.12
5.
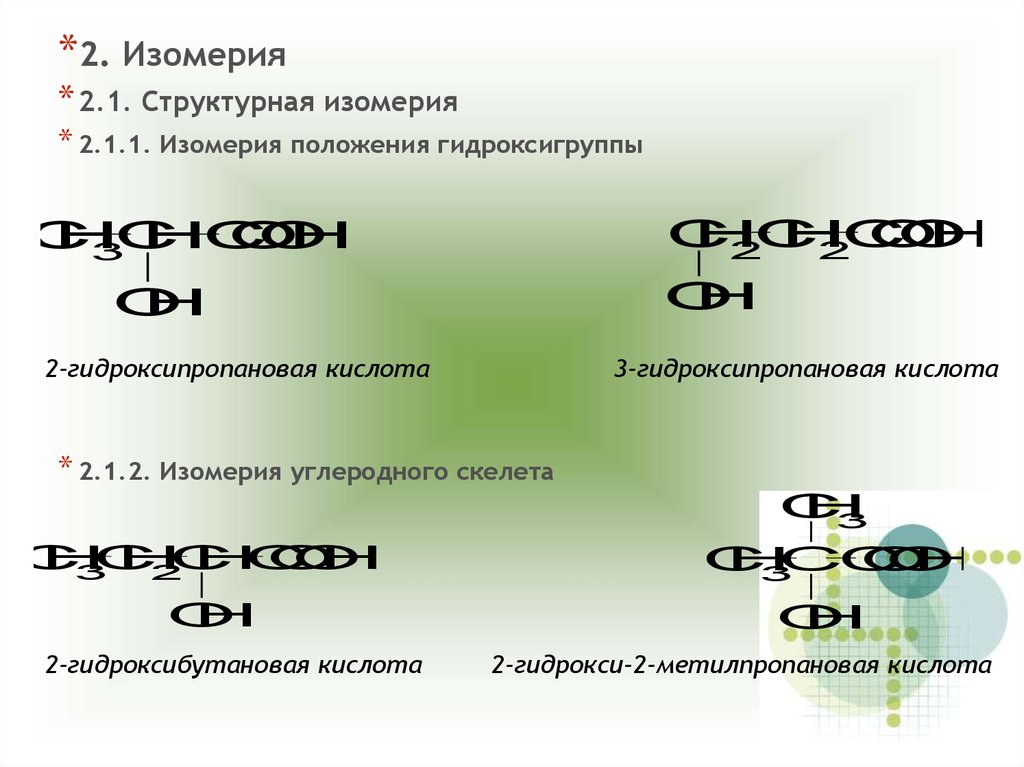
*2. Изомерия* 2.1. Структурная изомерия
* 2.1.1. Изомерия положения гидроксигруппы
C
H
C
H
C
O
O
H
2
2
C
H
C
HC
O
O
H
3
O
H
O
H
2-гидроксипропановая кислота
3-гидроксипропановая кислота
* 2.1.2. Изомерия углеродного скелета
C
H
3
C
H
C
H
C
HC
O
O
H
3
2
O
H
2-гидроксибутановая кислота
C
H
CC
O
O
H
3
O
H
2-гидрокси-2-метилпропановая кислота
6.
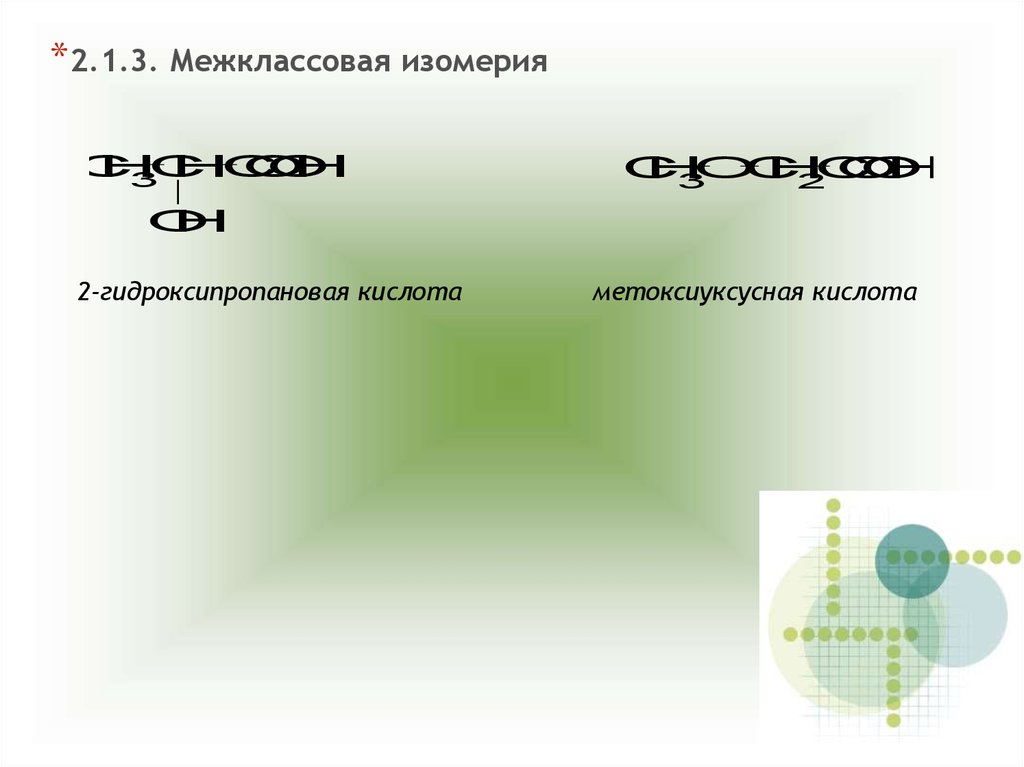
*2.1.3. Межклассовая изомерияC
H
C
HC
O
O
H
3
C
H
OC
H
C
O
O
H
3
2
O
H
2-гидроксипропановая кислота
метоксиуксусная кислота
7.
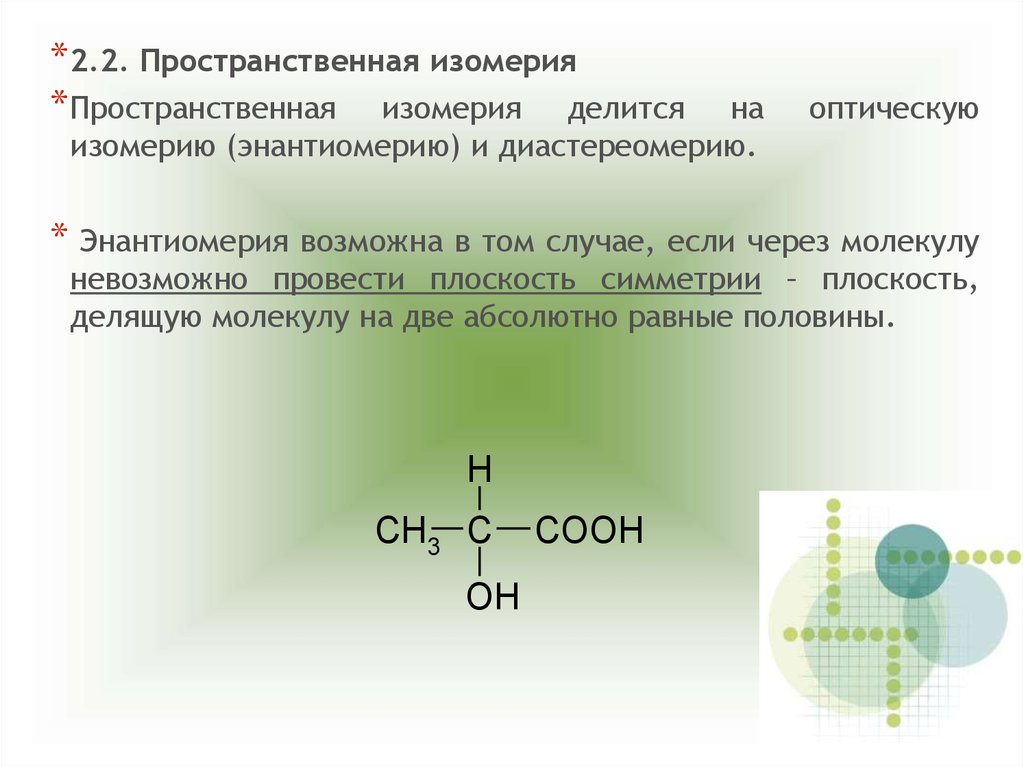
*2.2. Пространственная изомерия*Пространственная изомерия делится
на
изомерию (энантиомерию) и диастереомерию.
оптическую
* Энантиомерия возможна в том случае, если через молекулу
невозможно провести плоскость симметрии – плоскость,
делящую молекулу на две абсолютно равные половины.
H
CH3 C
OH
COOH
8.
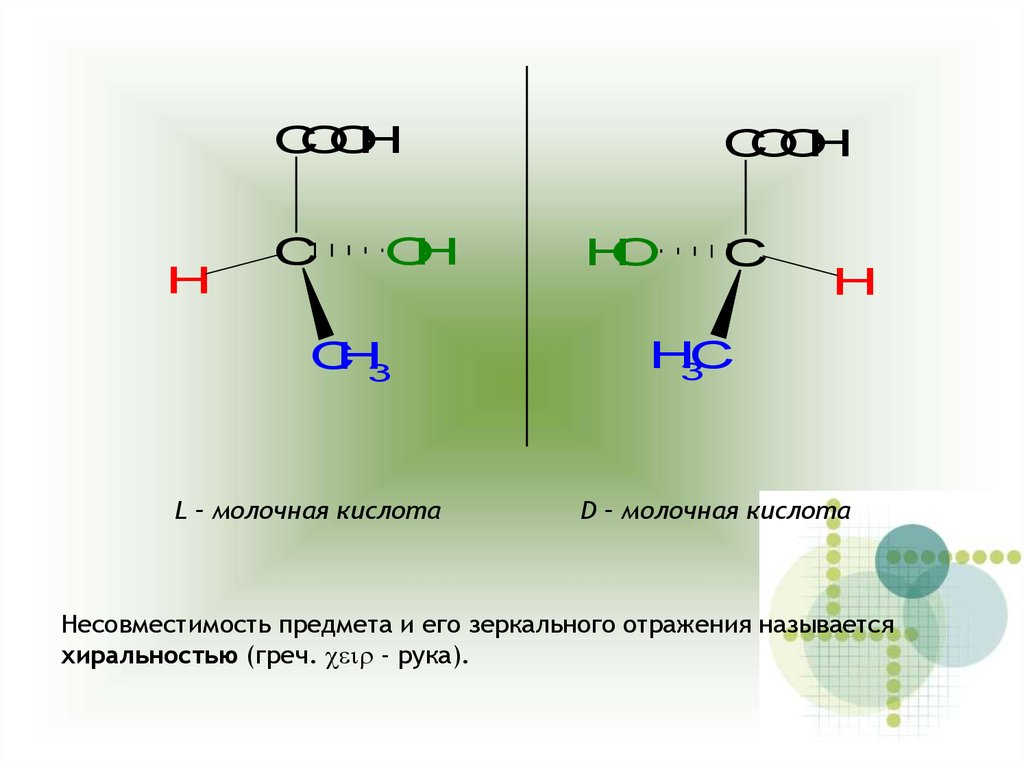
CO
O
H
H
C
O
H
C
H3
L – молочная кислота
C
O
O
H
H
O
C
H
H3C
D – молочная кислота
Несовместимость предмета и его зеркального отражения называется
хиральностью (греч. ceir - рука).
9.
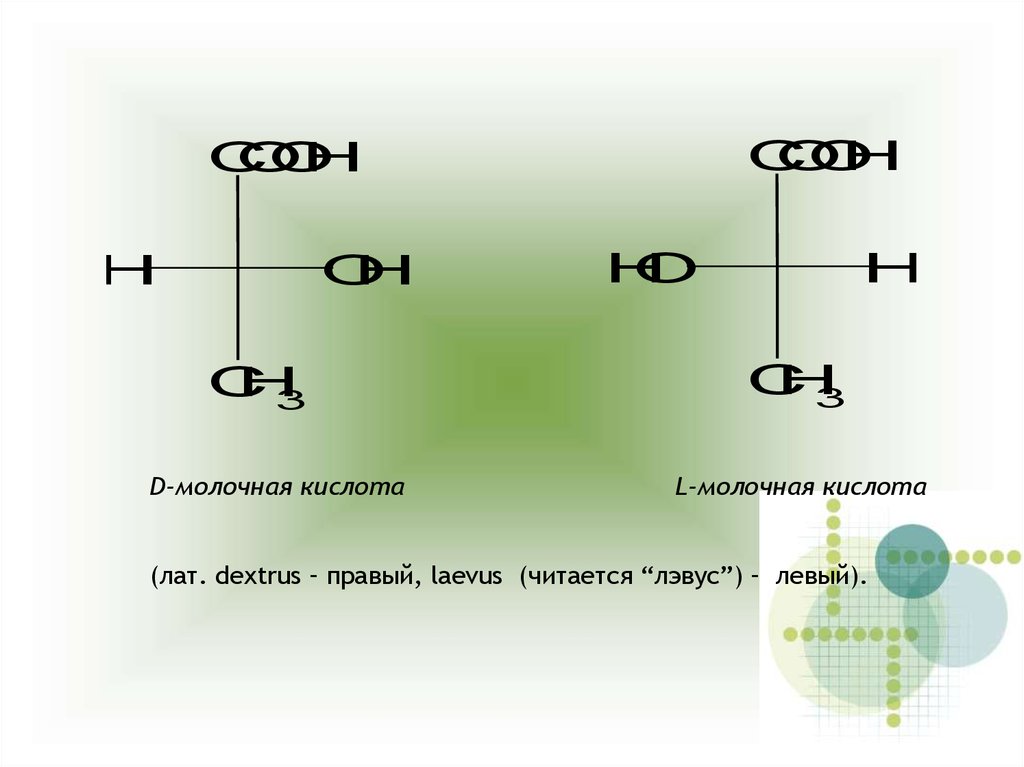
CO
O
H
C
O
O
H
H
O
H
C
H
3
D-молочная кислота
H
O
H
C
H
3
L-молочная кислота
(лат. dextrus – правый, laevus (читается “лэвус”) – левый).
10.
*2. Физические и биологические свойства*Гидроксикислоты являются, как правило, твёрдыми
телами.
Рацемическая молочная кислота может быть жидкой (т. пл.
18оС).
*Запахом гидроксикислоты почти не обладают.
* Гидроксикислоты имеют очень большое
значение в
биологической химии; их можно встретить во многих очень
важных метаболических путях – цикле Кребса, гликолизе,
пентозофосфатном цикле, b-окислении жирных кислот,
биосинтезе жирных кислот и т.д.
11.
*3. Химические свойства* Гидроксикислоты являются одновременно и кислотами и спиртами,
поэтому могут проявлять свойства и карбоновых кислот и спиртов.
* 3.1. Кислотные свойства
a
(
O
H
)
H
C
C
H
C
O
O
H +C
2
3
O
H
молочная кислота
H
O
a+2
H
C
C
H
C
O
OC
2
3
O
H
2
лактат кальция
Лактат кальция используется как модификатор в кондитерской
промышленности, в медицине как кальциевый препарат, растворы
используются для опрыскивания фруктов с целью их сохранения
12.
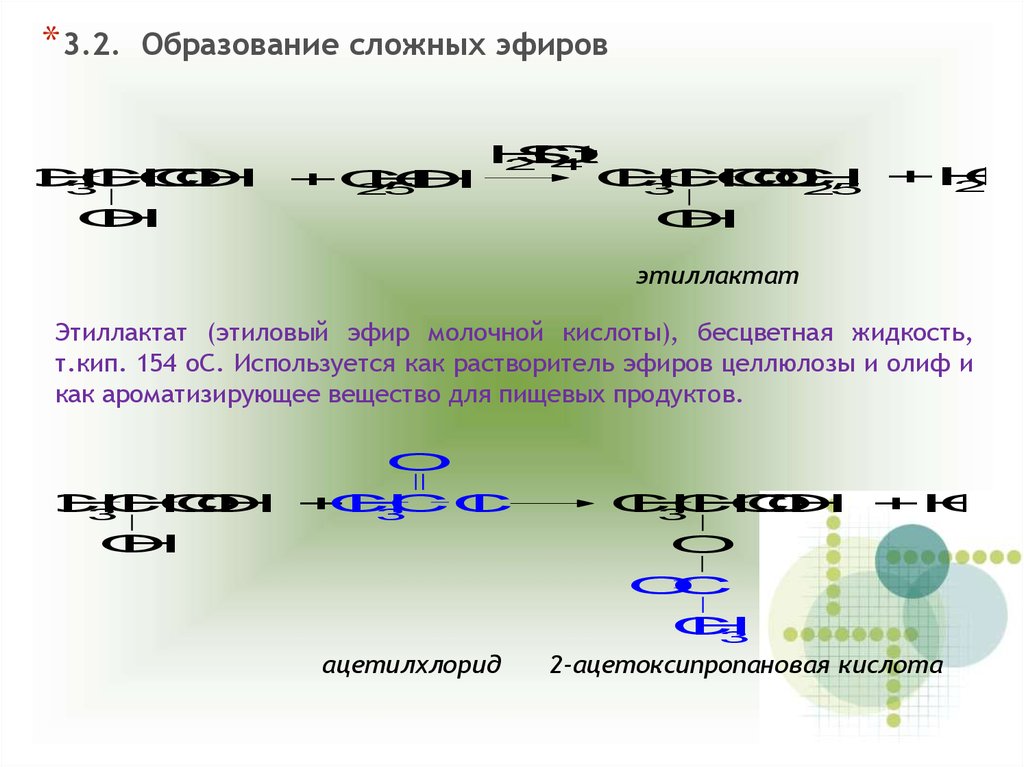
*3.2.Образование сложных эфиров
C
H
C
H
C
O
O
H
3
H
S
O
,t
2
4
+H
O
C
H
C
H
C
O
O
C
H
+C
H
O
H
2
2
5
3
25
O
H
O
H
этиллактат
Этиллактат (этиловый эфир молочной кислоты), бесцветная жидкость,
т.кип. 154 oC. Используется как растворитель эфиров целлюлозы и олиф и
как ароматизирующее вещество для пищевых продуктов.
O
C
H
C
H
C
O
O
H +
C
H
CC
l
3
3
O
H
C
H
C
H
C
O
O
H +H
C
l
3
O
O
C
C
H
3
ацетилхлорид
2-ацетоксипропановая кислота
13.
CO
O
H
O
H
C
O
H C
3
O
+
C
H
C
3
C
O
O
H
C
C
H
O
3
O
O
C
H
C
+
3
O
H
O
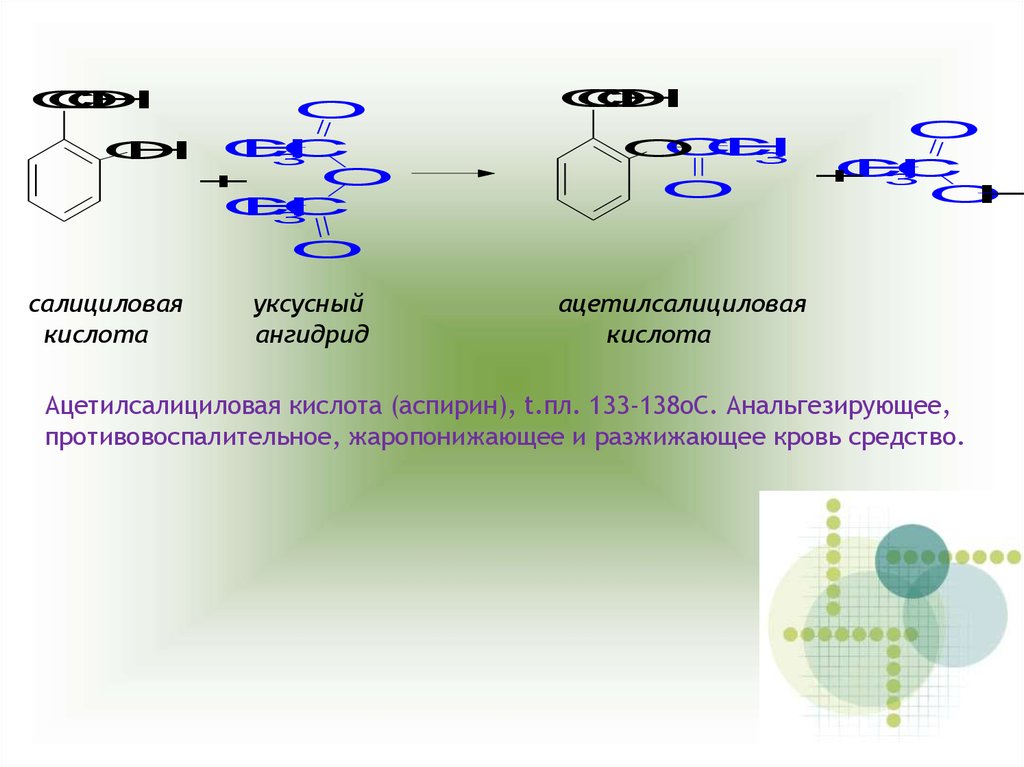
салициловая
кислота
уксусный
ангидрид
ацетилсалициловая
кислота
Ацетилсалициловая кислота (аспирин), t.пл. 133-138оС. Анальгезирующее,
противовоспалительное, жаропонижающее и разжижающее кровь средство.
14.
*3.3.Поведение при нагревании
*a-Гидроксикислоты при нагревании дают лактид – циклический
сложный эфир, содержащий две сложноэфирные группы в
составе цикла:
H
OC
HH
O O
3
O O
O
HH
C
H
3
молочная кислота
t
H
O OC
3
+ 2
H
O
2
O O
C
H
3
лактид
15.
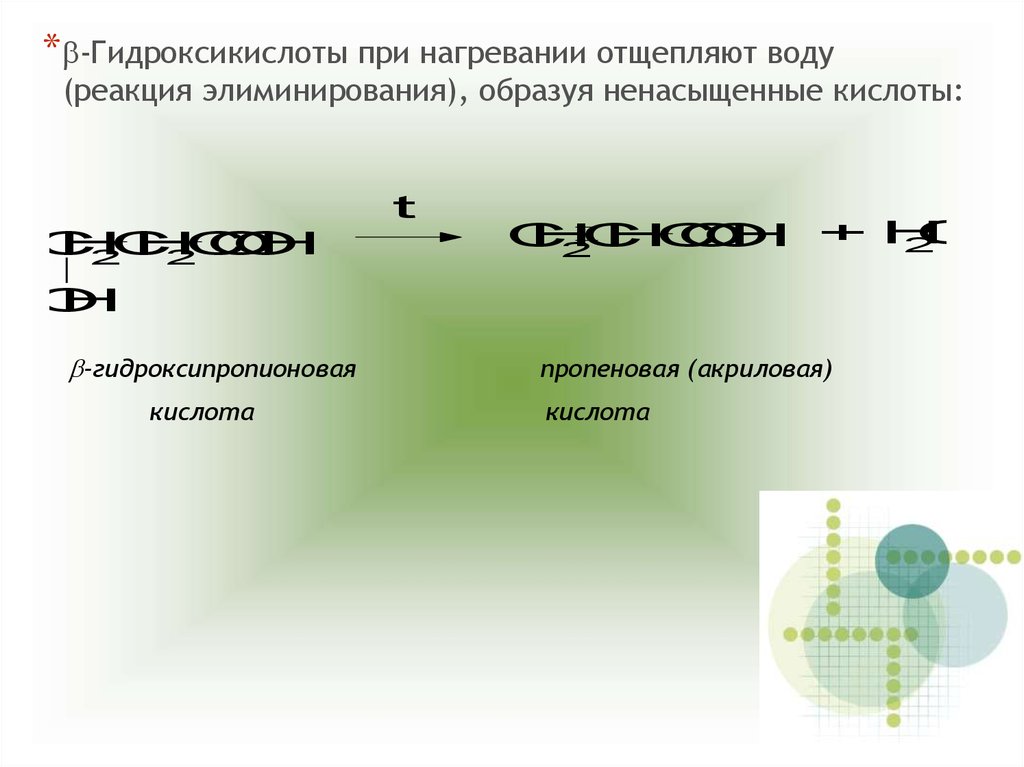
*b-Гидроксикислоты при нагревании отщепляют воду(реакция элиминирования), образуя ненасыщенные кислоты:
t
C
H
C
H
C
O
O
H
2
2
O
C
H
C
HC
O
O
H + H
2
2
O
H
b-гидроксипропионовая
кислота
пропеновая (акриловая)
кислота
16.
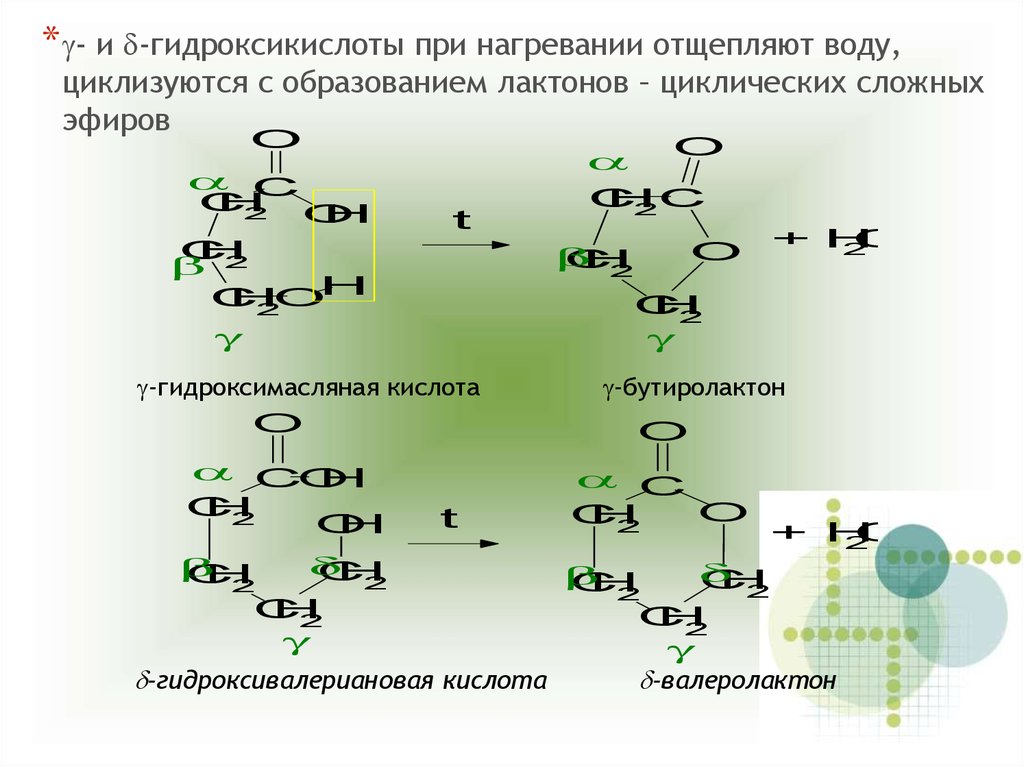
*g- и d-гидроксикислоты при нагревании отщепляют воду,циклизуются с образованием лактонов – циклических сложных
эфиров
O
a C
C
H
2
O
H
t
O
a
C
H
C
2
b
C
H
2
C
H
b 2
H
C
H
O
2
O
+ H
O
2
C
H
2
g
g
g-гидроксимасляная кислота
g-бутиролактон
O
O
a CO
H
C
H
2
O
H
a C
O
C
H
2
t
+ H
O
2
d
b
C
H
d
C
H
b
C
H
2
C
H
2
2
2
C
H
C
H
2
2
g
g
d-гидроксивалериановая кислота
d-валеролактон
17.
CO
O
H
O
H
t
O
H
+ C
O
2
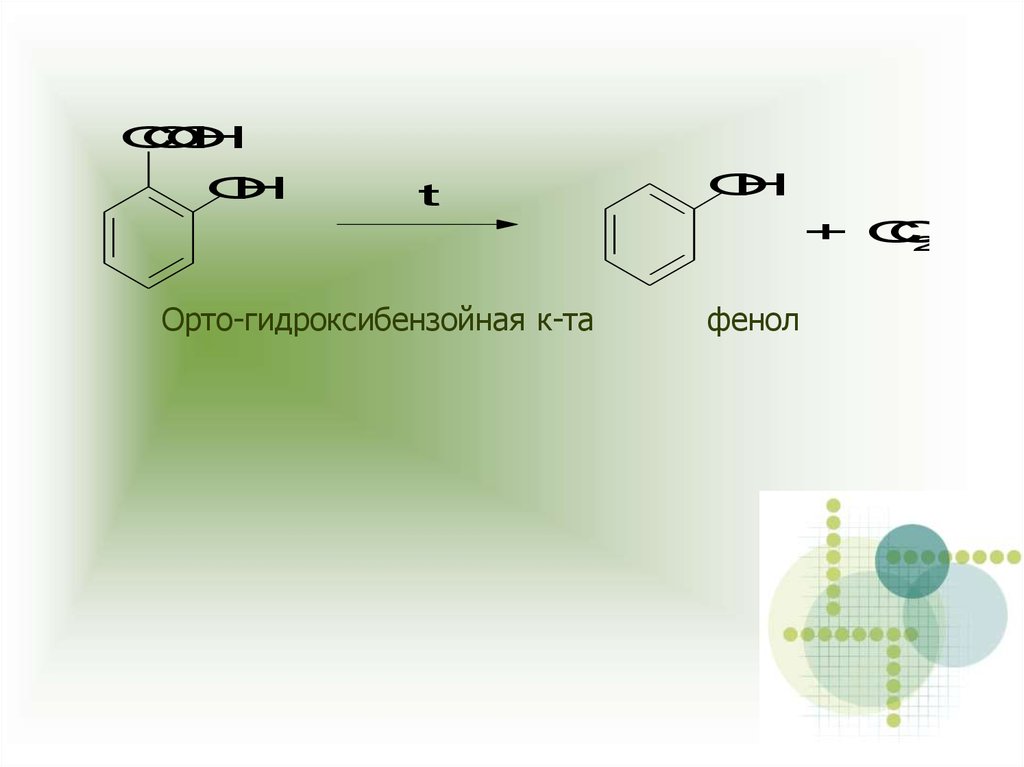
Орто-гидроксибензойная к-та
фенол
18.
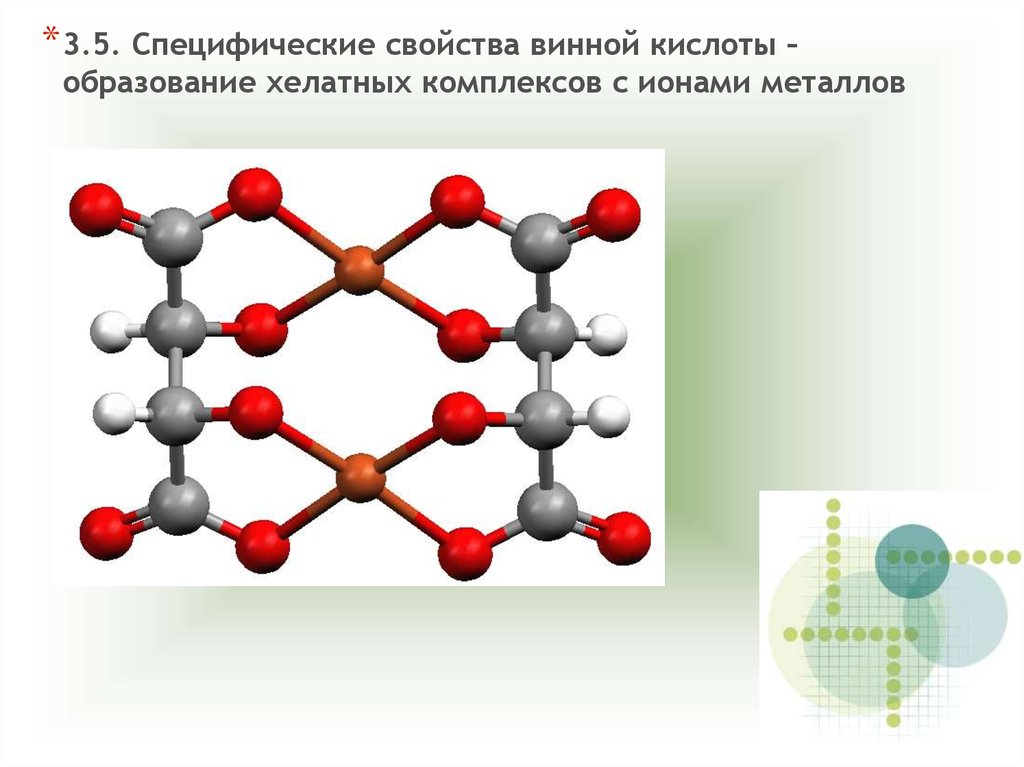
*3.5. Специфические свойства винной кислоты –образование хелатных комплексов с ионами металлов
19.
*4. Получение*1. Из природных источников
*молочная кислота – из скисшего молока (К. Шееле, 1780),
* яблочная – из яблок (К. Шееле),
* винная кислота – из винного камня (К. Шееле, 1769).
20.
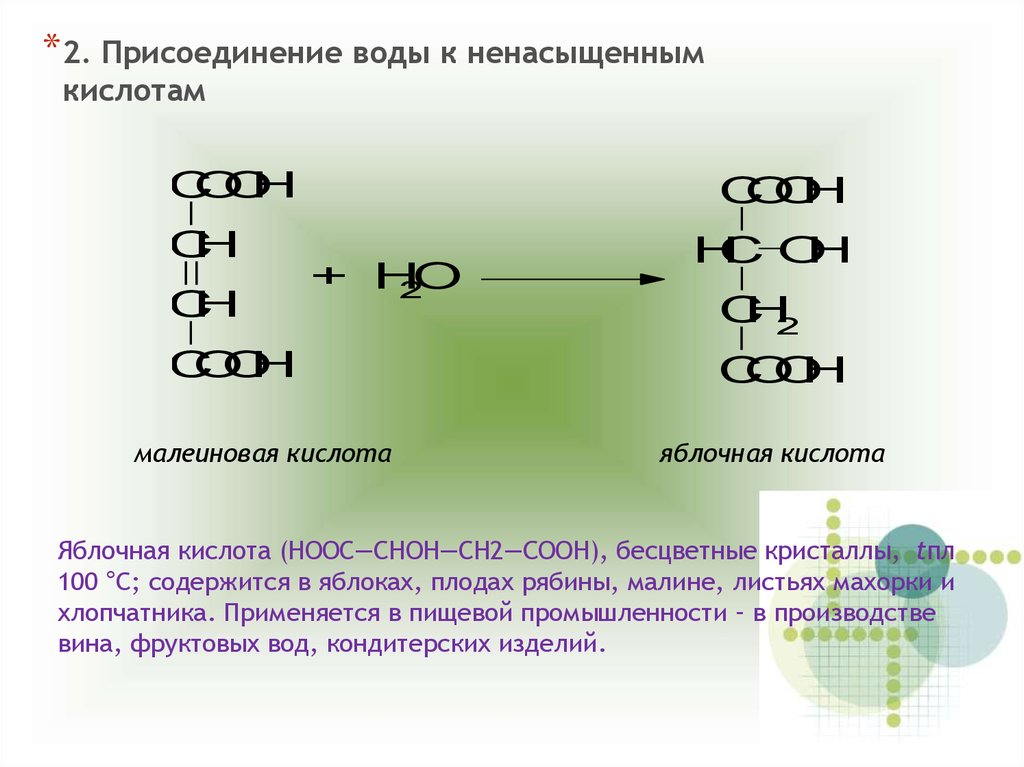
*2. Присоединение воды к ненасыщеннымкислотам
C
O
O
H
C
H
C
H
C
O
O
H
+ H
2O
C
O
O
H
малеиновая кислота
H
CO
H
C
H2
C
O
O
H
яблочная кислота
Яблочная кислота (НООС—СНОН—СН2—CООН), бесцветные кристаллы, tпл
100 °С; содержится в яблоках, плодах рябины, малине, листьях махорки и
хлопчатника. Применяется в пищевой промышленности – в производстве
вина, фруктовых вод, кондитерских изделий.
21.
OH
O
O
г
и
д
р
а
т
а
з
а
R
C
H
C
H
C
S
K
o
A
R
HC
CH
C
S
K
o
A +H
O
2
2
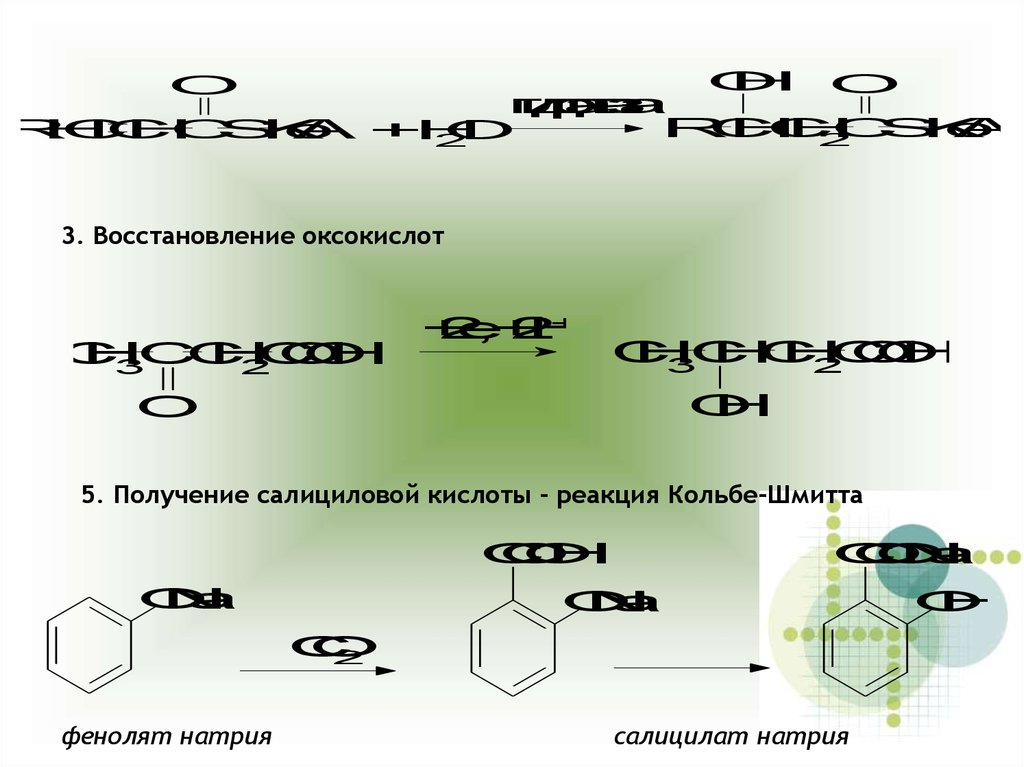
3. Восстановление оксокислот
C
H
CC
H
C
O
O
H
3
2
+
+
2
e
,+
2
H
C
H
C
HC
H
C
O
O
H
3
2
O
H
O
5. Получение салициловой кислоты - реакция Кольбе-Шмитта
C
O
O
H
O
N
a
C
O
O
N
a
O
N
a
C
O
2
фенолят натрия
салицилат натрия
O
H
22.
Спасибоза
Ваше внимание!







 Химия
Химия








