Похожие презентации:
Гидролиз солей. Лекция №18
1. Гидролиз солей.
ГБПОУ ЛО «Выборгский медицинский колледж»Лекция №18
Гидролиз солей.
Преподаватель: Видерникова Е.А.
2.
Гидролиз – реакция обменного взаимодействияхимического вещества с молекулами воды.
Термин «гидролиз» означает разложение соли водой
(«гидро» вода, «лизис» - разложении).
Гидролиз солей – процесс химического обменного
взаимодействия ионов соли с молекулами воды,
приводящий к образованию слабого электролита и
сопровождающийся изменением рH среды.
продукт нейтрализации
3.
4.
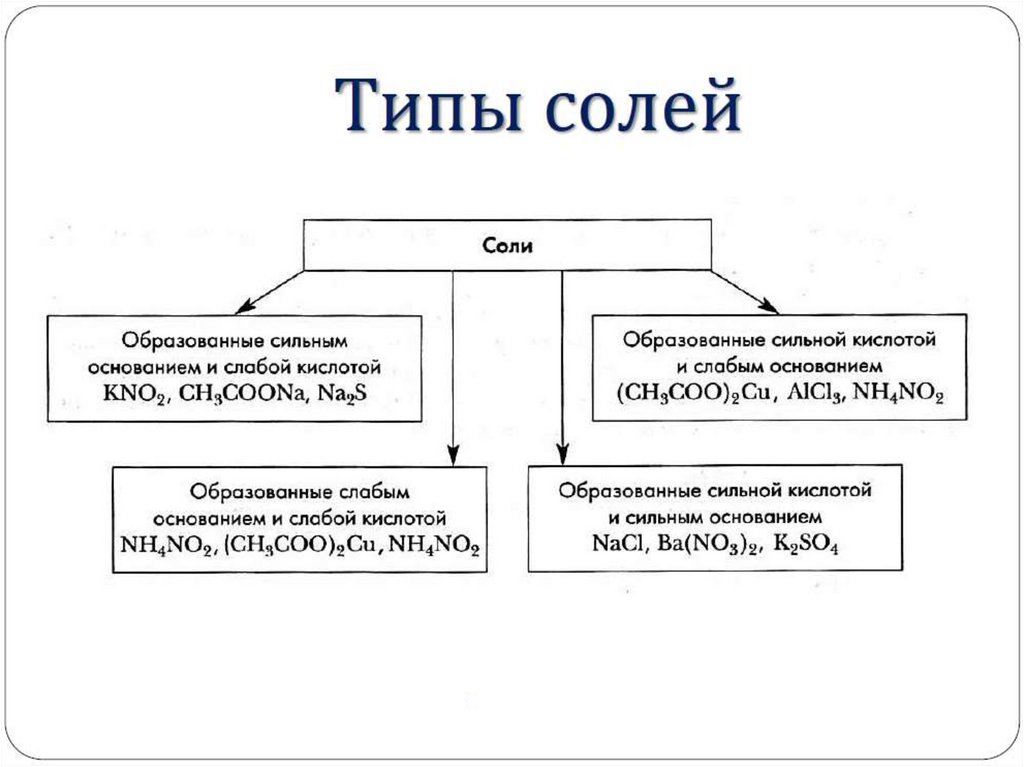
Гидролизу подвергаются:I.
Растворимые соли, в состав которых входит
хотя бы один слабый ион (обратимый гидролиз):
1. Соли, образованные слабым основанием и сильной
кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4 (гидролиз
по катиону).
2. Соли, образованные сильным основанием и слабой
кислотой Na2CO3, К2S, Na2SO3 (гидролиз по аниону).
3. Соли, образованные слабым основанием и слабой
кислотой NН4NO2, Ni(NO2)2, (CН3COO)2Cu (гидролиз по
катиону и аниону).
5.
ПРИМЕР гидролиза по катионуслабое основание
сильная кислота
6.
ПРИМЕР гидролиза по катионукислая среда
кислая среда
кислая среда
рН<7
рН<7
рН<7
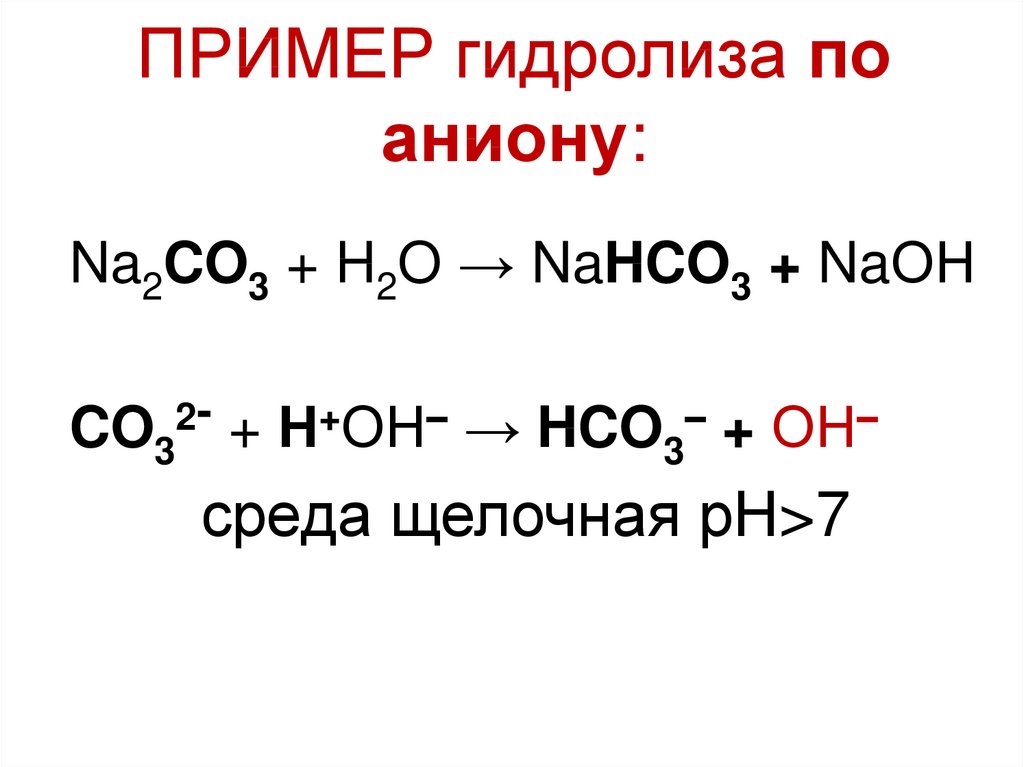
7. ПРИМЕР гидролиза по аниону:
Na2CO3 + H2O → NaHCO3 + NaОН2
CO3
+ Н+ОН– → HCO3– + ОН–
среда щелочная рН>7
8. Гидролиз соли слабой кислоты и слабого основания
Проходит полностью; рН = 7 :Al2(SO3)3 + 6H2O 2Al(OH)3 + 3H2SO3
H2SO3 → H2O + SO2↑
9.
10.
11.
12.
13.
14.
Факторы, влияющие на процесс гидролиза1. Температура.
Т.к. реакция гидролиза эндотермическая, повышение температуры
смещает равновесие в системе вправо, степень гидролиза
возрастает.
2. Концентрация продуктов гидролиза.
Повышение концентрации Н+ или ОН- смещает равновесие влево,
степень гидролиза уменьшается.
3. Разбавление.
При разбавлении равновесие смещается вправо, степень гидролиза
возрастает.
4. Концентрация соли.
Концентрация соли уменьшает степень гидролиза. Рассмотрение
этого фактора приводит к парадоксальному выводу: равновесие в
системе смещается вправо, в соответствии с принципом Ле Шателье,
но степень гидролиза уменьшается.














 Химия
Химия








