Похожие презентации:
Молекулярно-генетическая диагностика колоректального рака
1. Молекулярно-генетическая диагностика колоректального рака
ФГБОУ ВО «ПИМУ» Минздрава РоссииМолекулярно-генетическая
диагностика колоректального рака
Подготовила:
студентка педиатрического факультета
614группы
Гурьева О.Д.
Нижний Новгород,
2018г.
2. Сокращения
РЭА - раковоэмбриональный антиген/CEA - carcinoembryonic antigen
СА 19-9, СА 242 - карбогидратные антигены
АФП - α-фетопротеин
MSI – микросателлитная нестабильность
MSS – микросателлитная стабильность
2
3. Давыдов М. И., Аксель Е. М. Статистика злокачественных новообразований в России и странах СНГ в 2009 г //Вестник РОНц им. НН
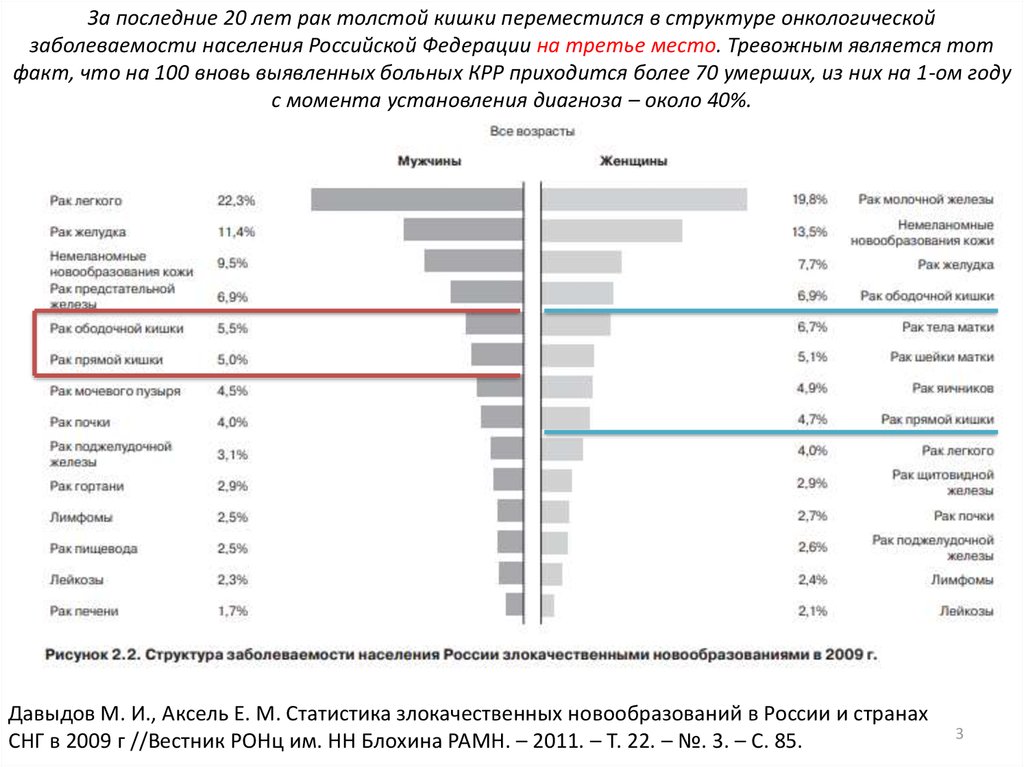
За последние 20 лет рак толстой кишки переместился в структуре онкологическойзаболеваемости населения Российской Федерации на третье место. Тревожным является тот
факт, что на 100 вновь выявленных больных КРР приходится более 70 умерших, из них на 1-ом году
с момента установления диагноза – около 40%.
Давыдов М. И., Аксель Е. М. Статистика злокачественных новообразований в России и странах
СНГ в 2009 г //Вестник РОНц им. НН Блохина РАМН. – 2011. – Т. 22. – №. 3. – С. 85.
3
4.
Cancer Statistics, 2009Cancer Statistics, 2009, Volume: 59, Issue: 4, Pages: 225-249, First published: 09 July 2009, DOI:
(10.3322/caac.20006)
5. CA CANCER J CLIN 2009;59:225-249 https://doi.org/10.3322/caac.20006
CA CANCER J CLIN 2009;59:225-249https://doi.org/10.3322/caac.20006
5
6.
www.seer.cancer.gov6
7. Этиология КРР
Большинство случаев является спорадическими, лишь 5 - 10%составляют наследственные раки, предрасположенность к которым
передается по аутосомно-доминантному типу.
Предрасполагающие факторы:
Воспалительные заболевания кишечника (язвенный колит, болезнь
Крона)
Полипы
Факторы риска:
Возраст после 50 лет риск развития КРР удваивается в каждую
последующую декаду жизни и достигает максимума в 60-75 лет
Особенности питания, «западный» стиль жизни
Ранее перенесенный КРР, рак женских гениталий или молочной
железы, а также наличие в анамнезе КРР у кровных родственников
7
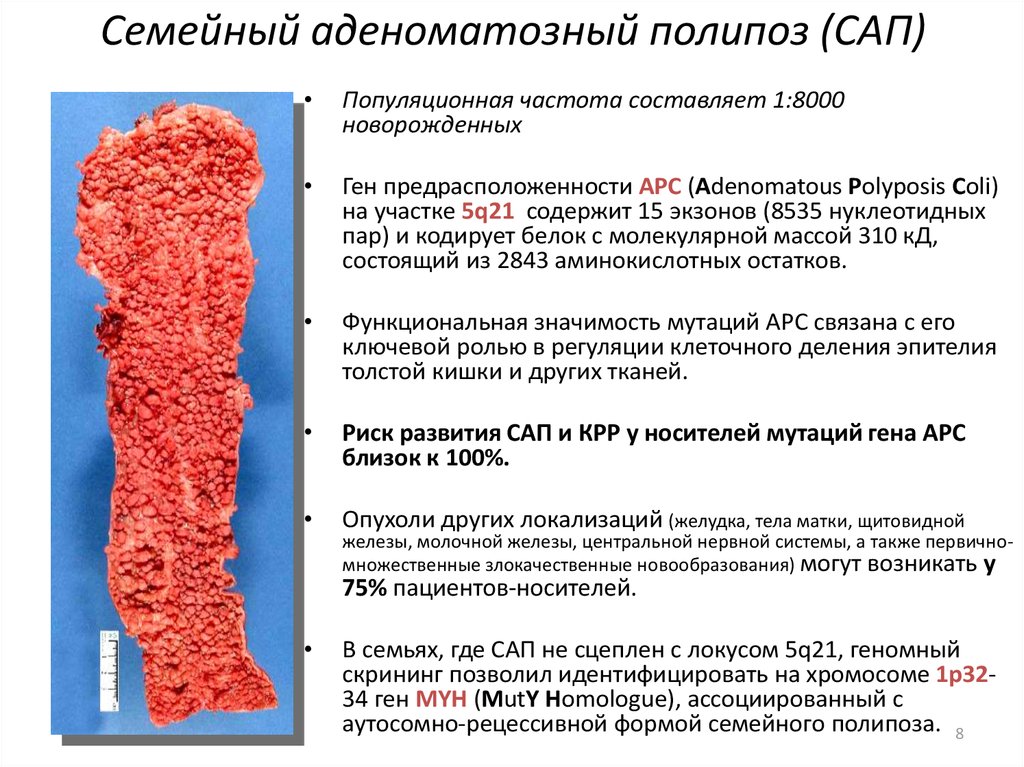
8. Семейный аденоматозный полипоз (САП)
Популяционная частота составляет 1:8000
новорожденных
Ген предрасположенности APC (Adenomatous Polyposis Coli)
на участке 5q21 содержит 15 экзонов (8535 нуклеотидных
пар) и кодирует белок с молекулярной массой 310 кД,
состоящий из 2843 аминокислотных остатков.
Функциональная значимость мутаций АРС связана с его
ключевой ролью в регуляции клеточного деления эпителия
толстой кишки и других тканей.
Риск развития САП и КРР у носителей мутаций гена АРС
близок к 100%.
Опухоли других локализаций (желудка, тела матки, щитовидной
железы, молочной железы, центральной нервной системы, а также первичномножественные злокачественные новообразования) могут возникать у
75% пациентов-носителей.
В семьях, где САП не сцеплен с локусом 5q21, геномный
скрининг позволил идентифицировать на хромосоме 1р3234 ген MYH (MutY Homologue), ассоциированный с
аутосомно-рецессивной формой семейного полипоза. 8
9. Диагностика САП
• Подозрение на семейный аденоматоз – тестирование на мутациюгена АРС:
А) при наличии у пациента более 20 полипов кишечника
В) при наличии у пациента родственника первой линии с установленным
диагнозом семейного аденоматоза
• Подозрение на наличие аттенуированной формы семейного
аденоматоза, MYH–ассоциированный полипоз – тестирование на
мутацию MYH – пациенты, у которых выявлено более 20 полипов
толстой кишки, но с отрицательным анализом на мутацию АРС:
А) пациенты, у которых в семье прослеживается рецессивное
наследование семейного аденоматоза;
Б) пациенты, у которых полипы выявляются в более позднем возрасте
(34-44 лет).
9
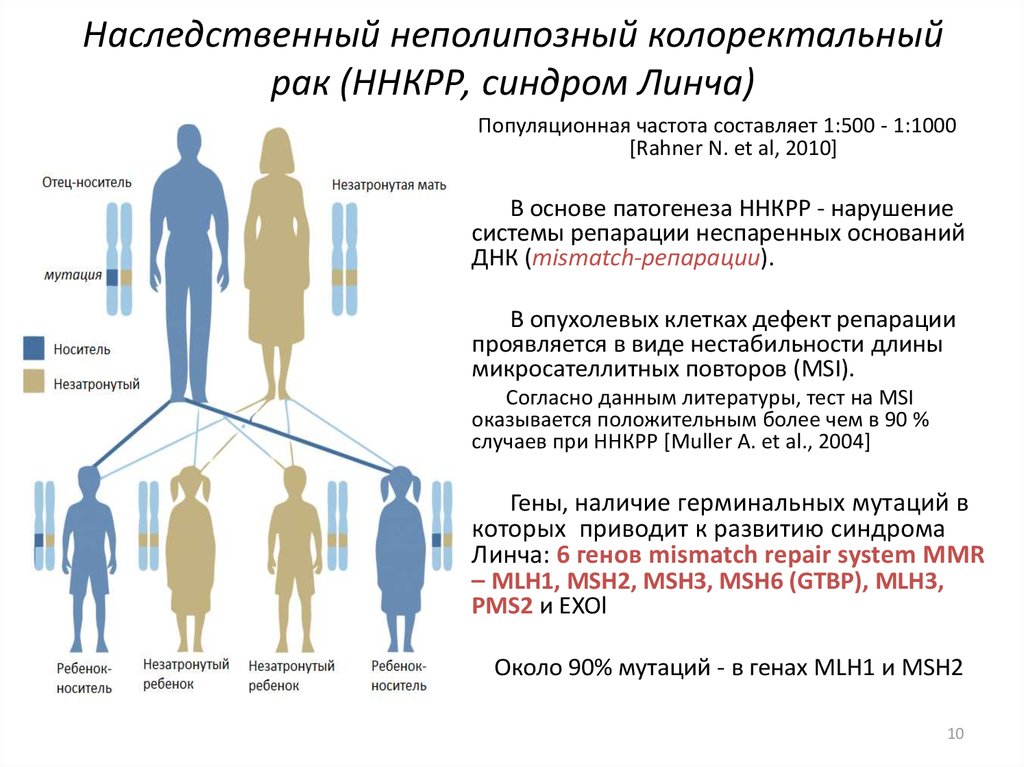
10. Наследственный неполипозный колоректальный рак (ННКРР, синдром Линча)
Популяционная частота составляет 1:500 - 1:1000[Rahner N. et al, 2010]
В основе патогенеза ННКРР - нарушение
системы репарации неспаренных оснований
ДНК (mismatch-репарации).
В опухолевых клетках дефект репарации
проявляется в виде нестабильности длины
микросателлитных повторов (MSI).
Согласно данным литературы, тест на MSI
оказывается положительным более чем в 90 %
случаев при ННКРР [Muller A. et al., 2004]
Гены, наличие герминальных мутаций в
которых приводит к развитию синдрома
Линча: 6 генов mismatch repair system MMR
– MLH1, MSH2, MSH3, MSH6 (GTBP), MLH3,
PMS2 и ЕXOl
Около 90% мутаций - в генах MLH1 и MSH2
10
11.
Амстердамские критерии, критерии Бетезды[Vasen H.F. et al., 1999; Umar A. Et al., 2004]:
1.
Молодой возраст возникновения заболевания (до 50 лет)
2.
Наличие трёх или более родственников с HNPCC- ассоциированными опухолями (рак
толстой кишки, рак эндометрия, рак тонкого кишечника, желудка, яичников, уретры,
почечной лоханки, синдром Тюрко или синдром Мюирр-Торре)
3. Заболевание должно встречаться более, чем в одном поколении, не меньше чем один
из заболевших, должен быть родственником первой степени родства по отношению к
остальным двум.
4.
Первично- множественный характер злокачественных новообразований
5.
Семейный аденоматозный полипоз должен быть исключен.
Для пациентов с наличием клинических критериев HNPCC-тест на MSI,
для MSI+ последующее ДНК-секвенирование кодирующей последовательности
генов MMR с целью выявления в них герминогенных мутаций.
Только в случае выявления зародышевой мутации может быть поставлен
диагноз синдрома Линча.
11
12.
Микросателлитнаянестабильность – состояние
особой склонности ДНК клетки
к развитию стойких изменений
в последовательности
нуклеотидов входящих в её
структуру.
Микросателлиты - короткие
последовательности в ДНК из 1-5
оснований, повторяющиеся до
нескольких десятков раз.
Микросателлиты встречаются и в
норме. При нестабильности их
число увеличивается, что и может
быть выявлено.
Лабораторный тест на
микросаттелитную
нестабильность (выделение
тотальной ДНК из парафиновых
срезов, ПЦР) с использованием
панели мононуклеотидных
маркеров ВАТ25, ВАТ26 и ВАТ40
и последующим сравнением с
нормальной тканью (чаще
кровью)
12
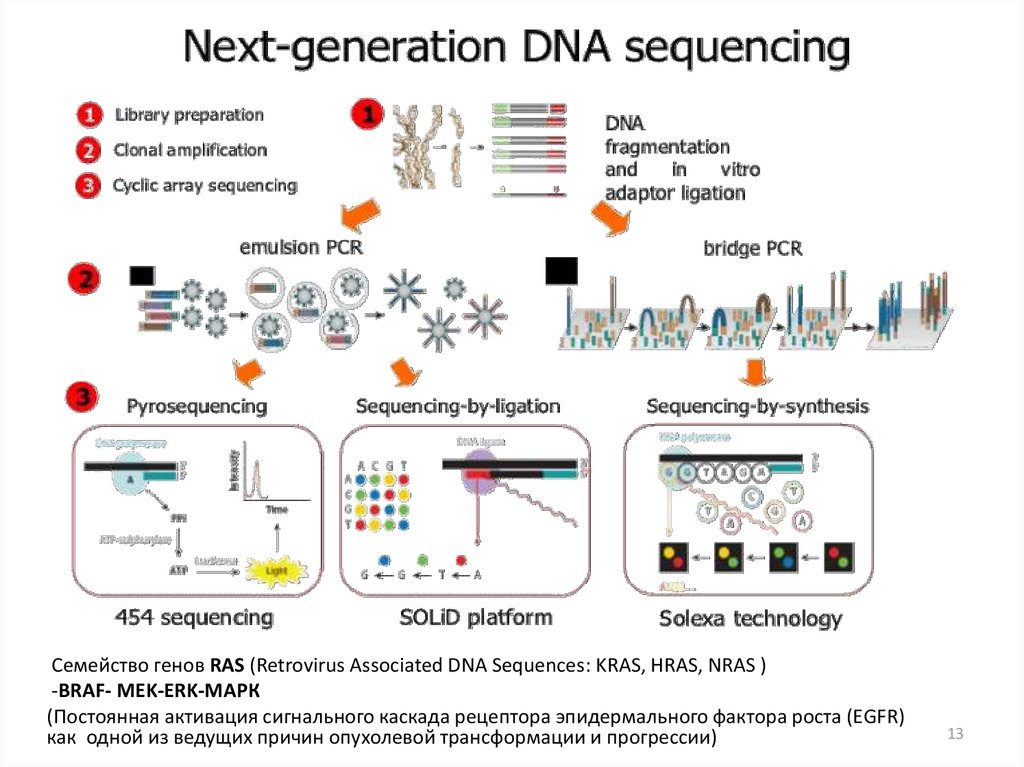
13.
Семейство генов RAS (Retrovirus Associated DNA Sequences: KRAS, HRAS, NRAS )-ВRAF- MEK-ERK-МАРК
(Постоянная активация сигнального каскада рецептора эпидермального фактора роста (EGFR)
как одной из ведущих причин опухолевой трансформации и прогрессии)
13
14. Когда же еще необходимо тестирование молекулярных биомаркеров?
*По рекомендациям American Society for Clinical Pathology, College of AmericanPathologists, Association for Molecular Pathology, and ASCO[7] and ESMO 2016
1. Пациенты с КРР, рассматривающиеся для терапии антиэпидермальными факторами
роста (EGFR) цетуксимабом и панитумумабом, и пациенты с диагностироваными или
заподозреными отдаленными метастазами аденокарциномы должны пройти
мутационное тестирование RAS (экзоны 2–4 генов KRAS и NRAS), т.к. наличие мутаций
RAS является негативным прогностическим биомаркером для ответа на терапию антителом EGFR
для mCRC.
2. Мутационный анализ положения BRAF p.V600 следует проводить в ткани КРР у
отдельных пациентов для прогностической стратификации.
3. Тестирование дигидропиримидиндегидрогеназы (DPD) перед введением
фторурацила (5-FU) остается вариантом, но обычно не рекомендуется; Однако это
следует сделать до повторного введения 5-ФУ у пациентов, которые испытали
тяжелую токсичность 5-ФУ.
4. Тестирование MSI в условиях мКРР может предоставить полезную информацию для
генетического консультирования и имеет сильную прогностическую ценность для
использования ингибиторов контрольных точек (например, пембролизумаба)
5. Клиницистам следует назначить тестирование, чтобы идентифицировать пациентов с
MMR высоким риском синдрома Линча и / или прогностической стратификации. 14
15.
The guidelines ESMO не рекомендуют следующиеновые биомаркеры для рутинного ведения
пациентов вне рамок клинических испытаний:
• Мутации в PIK3CA, экзон 20
• Потеря PTEN от IHC
• Уровни лигандов EGFR амфирегулина, эпирегулина и
TGF-α
• Уровни экспрессии белка EGFR
• Амплификация EGFR и число копий, а также мутации
эктодомена EGFR
• HER2-амплификация или HER2-активирующие
мутации
• Сверхэкспрессия рецепторов HER3 и MET
15
16.
сывороточные онкомаркеры16
17. Клинические рекомендации МЗ РФ 2018г Рак ободочной кишки и ректосигмоидного отдела Профессиональные ассоциации: Ассоциация
онкологов России Российское обществоклинической онкологии
2.3 Лабораторная диагностика онкомаркеры РЭА,
СА 19.9
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - IV)
5. Профилактика онкомаркеры РЭА, СА 19.9
каждые 3 месяца первые 2 года и далее каждые 6
мес. в последующие 3 года.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Содержание сывороточных маркеров не имеет самостоятельного значения
в диагностике и оценке степени распространения болезни и в большей
степени содержит информацию о прогностических характеристиках
опухоли; этот метод может быть использован при динамическом
наблюдении за больными, а также для оценки эффективности терапии.
17
18. Раково-эмбриональный антиген (РЭА/CEA - Carcinoembryonic antigen)
Раково-эмбриональный антиген(РЭА/CEA - Carcinoembryonic antigen)
Онкофетальный белок, обнаруживается в эпителиальных клетках
пищеварительного тракта и бронхов.
У взрослых людей продуцируется в очень ограниченном количестве
эпителиальными клетками бронхов, молочной железы и кишечного
тракта.
В минимальных количествах РЭА обнаруживается в крови,
плевральном экссудате, асцитической жидкости и спинномозговой
жидкости.
Степень повышения РЭА коррелирует не столько с массой опухоли,
сколько со степенью дифференцировки опухолевых клеток, и
больные с низкодифференцированными опухолями могут иметь
нормальный уровень этого маркера.
Значения нормы: 0–5 нг/мл.
Пограничные значения: 5–8 нг/мл.
Патологические значения: >8 нг/мл.
18
19. СА 19-9 (карбогидратный антиген)
СА 19-9 (карбогидратный антиген)Распространенность этого маркера тесно связана с группами крови.
При редко встречающейся группе Lewis (А/В) он не вырабатывается
(из-за дефицита фермента фукозилтрансферазы, необходимого для синтеза белка СА
19-9 и антигена Льюиса).
У взрослых вырабатывается в очень небольшом количестве эпителиальными
клетками бронхов и пищеварительного тракта.
В минимальных концентрациях присутствует в крови, плевральном экссудате,
асцитической и спинномозговой жидкости. При КРР определяется в
комбинации с РЭА.
Выведение СА 19-9 из организма происходит через желчные пути, поэтому
любое затруднение оттока желчи сопровождается повышением его уровня. В
этих случаях для уточнения диагноза используются показатели
гаммаглутаминтрансфераза и щелочная фосфатаза.
Значения нормы : 0–30 МЕ/мл
Пограничные значения: 30–40 МЕ/мл
Патологические значения: 40 МЕ/мл и выше
19
20. АФП (альфа-фетопротеин)
• Определение АФП имеет второстепенное значение.• АФП вырабатывается желточным мешком, а позже и печенью плода.
• При достижении двухлетнего возраста уровень АФП составляет 5 мг/л
и сохраняется на этом уровне у взрослых здоровых людей.
• Повышается при герминогенных опухолях.
Пограничные значения: 5–10 МЕ/мл
Патологические значения: 10 МЕ/мл и выше
20
21. Tumor M2-PK (опухолевая М2-пируват-киназа)
• Высокоспецифичный опухолевой белок, не обладаеторганоспецифичностью и может быть маркером выбора для
диагностики разных опухолей.
• Выявляет специфический для опухолей метаболический статус вне
зависимости от их локализации.
• Является маркером степени агрессивности злокачественной опухоли.
• В отличие от других онкомаркеров, используемых в клинической
практике, является не накопительным, а метаболическим маркером,
и наиболее рано и в достаточном для определения количестве
поступает в кровоток.
• Определение содержания Tu M2-PK дает возможность ранней
диагностики опухолей, возникновения метастазов или рецидивов
опухоли.
Пограничные значения: 15–20 Ед/мл
Патологические значения: 20 Ед/мл и выше
21
22. СА 242
• Эпитоп антигена СА 242 представляет собойсиаловый углевод, который располагается на
гликопротеине типа муцина в карциномах многих
органов.
• Для диагностики и наблюдения за ходом болезни
при раке ЖКТ исследуется в комбинации с РЭА.
Значения нормы: 0–30 МЕ/мл (медиана=6,4)
22
23. Выводы
Несмотря на то, что развитие колоректального рака в большинствеслучаев носит спорадический характер, а на долю наследственного КРР
приходится от 5 до 15 % всех новообразований толстой кишки, данная
проблема является особенно актуальной.
Т.к. пациенты с синдромом Линча имеют более благоприятный прогноз,
небольшую частоту метастазирования, свои особенности чувствительности
к различным группам химиопрепаратов, что так же важно и для других
наследственных патологий. Поэтому ранняя диагностика у данной
категории пациентов позволяет надеется на полное излечение от
заболевания и дает возможность для стратификации риска развития КРР у
родственников .
Что касается сывороточных онкомаркеров, сегодня они могут
использоваться как критерий опухолевого ответа на лечение, а также для
оценки прогноза. Однако исследователи надеются, что в скором времени
они будут использовать онкомаркеры и для скрининговых тестов, что
может помочь раннему обнаружению опухолей в бессимптомном
периоде.
23
24. Литература
1.2.
3.
4.
5.
6.
7.
8.
9.
Devita, Hellman, and Rosenberg’s cancer : principles & practice of oncology / editors, Vincent T.
DeVita, Jr., Theodore S. Lawrence, Steven A. Rosenberg ; with 404 contributing authors.—10th
edition. Copyright © 2015 Wolters Kluwer Health.
Янус Г. А., Корнилов А. В., Суспицын Е. Н., Зайцева О. А., Яцук О. С., Стрекалов Д. Л., Поляков
И. C., Бреништер С. И., Правосудов И. В., Гуляев А. В., Семиглазов В. В., Имянитов Е. Н.
Молекулярно-генетическая диагностика наследственного неполипозного рака толстой кишки
// Сибирский онкологический журнал. 2012. №2.
Chakravarty et al. OncoKB: A Precision Oncology Knowledge Base. JCO Precision Oncology published online May 16, 2017. DOI: 10.1200/PO.17.00011
[Guideline] Colorectal cancer. Medscape. Elwyn C Cabebe, MD; Chief Editor: N Joseph Espat, MD,
MS. Nov 15, 2018; Accessed: Nov 15, 2018.
Сергеева Н. С., Маршутина Н. В. Общие представления о серологических биомаркерах и их
месте в онкологии //Практическая онкология. – 2011. – Т. 12. – №. 4. – С. 147-154.
http://oncokb.org
[Guideline] Sepulveda AR, Hamilton SR, Allegra CJ, Grody W, Cushman-Vokoun AM, Funkhouser
WK, et al. Molecular Biomarkers for the Evaluation of Colorectal Cancer: Guideline From the
American Society for Clinical Pathology, College of American Pathologists, Association for
Molecular Pathology, and American Society of Clinical Oncology. Arch Pathol Lab Med. 2017 Feb 6.
19 (2):187-225. [Medline].
https://newtonew.com/science/v-kurse-dela-chto-takoe-onkomarkery
http://www.cancergenome.ru/mutations/EGFR/
24




















 Медицина
Медицина








