Похожие презентации:
Химические свойства кислот
1. А 11. Химические свойства кислот
Выполнила: Сейтуарова Диана2.
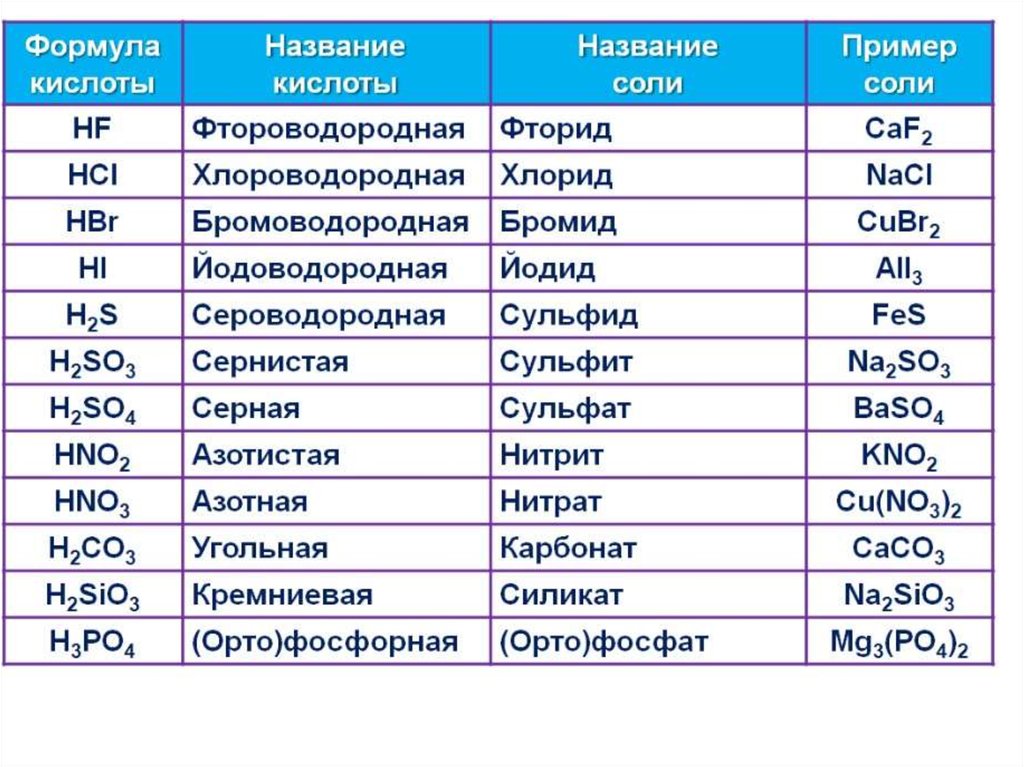
• Кислотами называют класс химическихсоединений, содержащих в своем составе
подвижные атомы водорода, способные
замещаться на атомы металлов, и
кислотных остатков.
3.
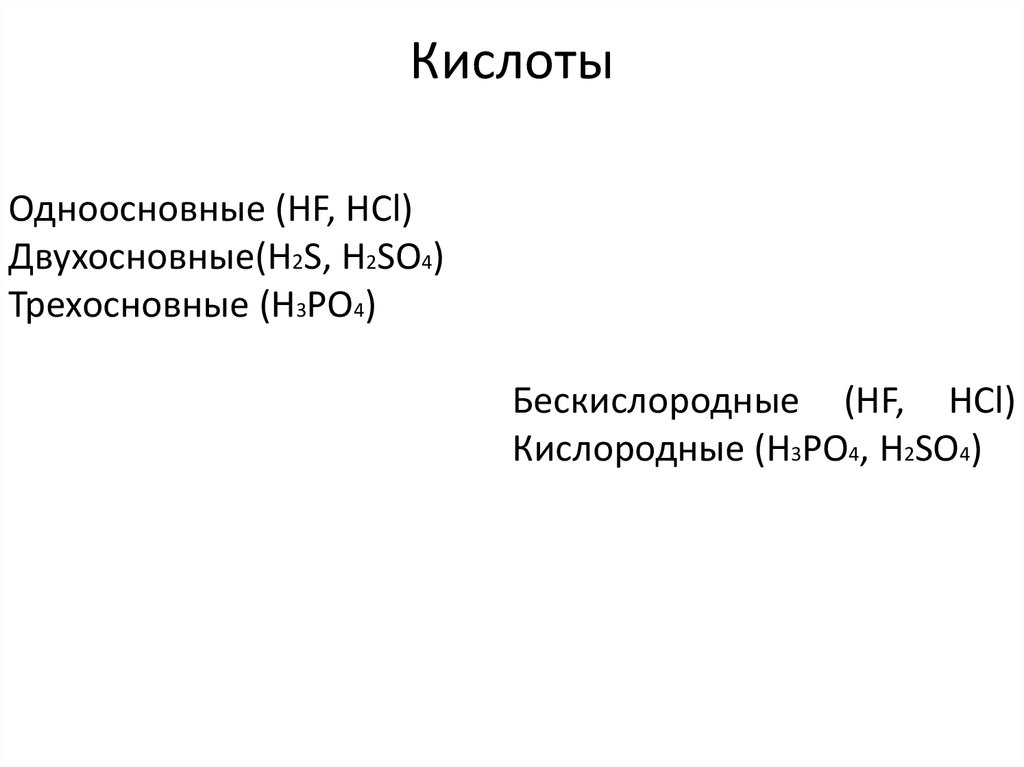
4. Кислоты
Одноосновные (HF, HCl)Двухосновные(H2S, H2SO4)
Трехосновные (H3PO4)
Бескислородные (HF, HCl)
Кислородные (H3PO4, H2SO4)
5.
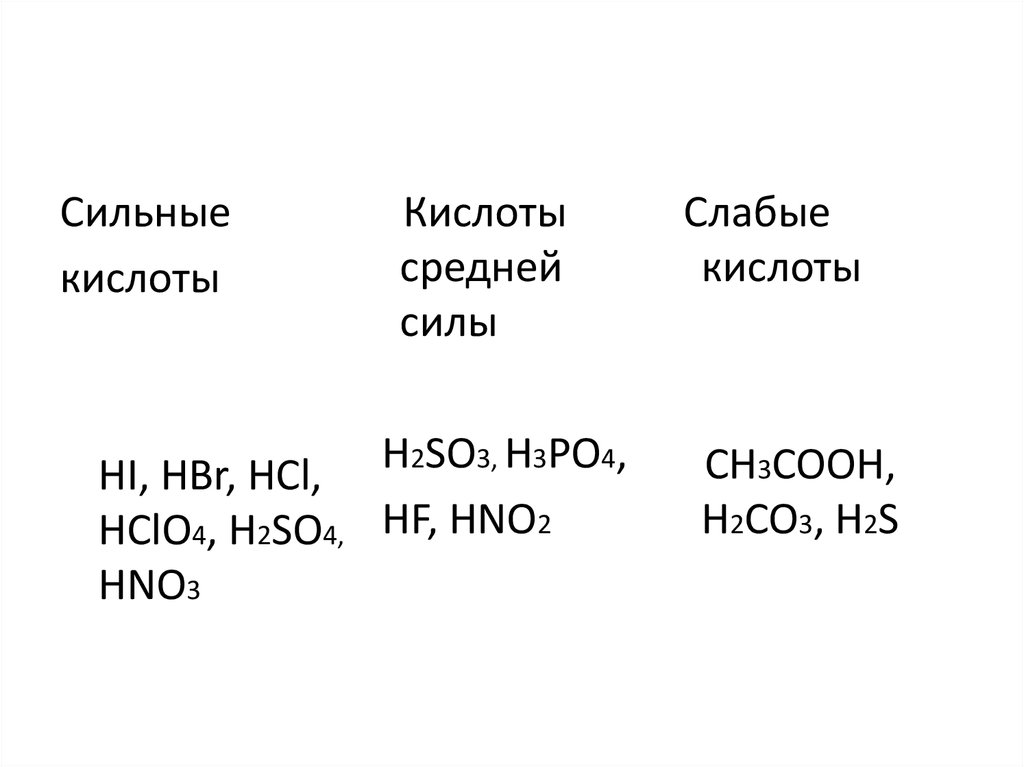
Сильныекислоты
Кислоты
средней
силы
HI, HBr, HCl, H2SO3, H3PO4,
HClO4, H2SO4, HF, HNO2
HNO3
Слабые
кислоты
CH3COOH,
H2CO3, H2S
6.
7.
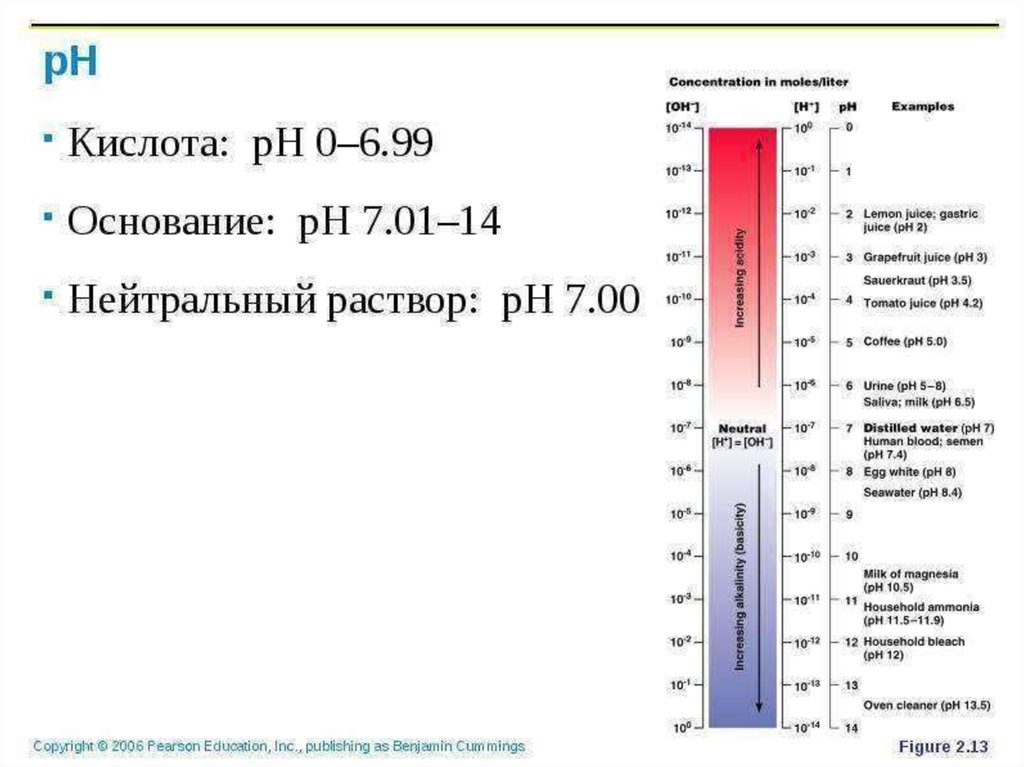
Водные растворы кислот имеют рН<7.
При этих значениях
Лакмус – имеет красную окраску
Метиловый оранжевый - розовый
8. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль
Кислота + металл =
Кислота + основный оксид =
Кислота + амфотерный оксид =
Кислота + основание =
Кислота + соль =
9. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль
• 1. Кислоты вступают в реакцию с металлами, стоящие вэлектрохимическом ряду напряжений металлов левее
водорода. При этом образуется соль и выделяется
водород:
Mg + 2HCl = MgCl2 + H2
• Исключением является азотная кислота и конц серная
кислота, водород не выделяется.
• Кислота + ме = соль + водород
• 1) Ba + HF =
4)Ag + H2S =
• 2) Na + HI =
5) Fe + H2SO4 =
• 3) Cu + HBr =
10. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль
• 2. C основными и амфотерными оксидами собразованием солей и воды, например:
• H2SO4 + MgO = MgSO4 + H2O
• 6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
• Кислота + основный оксид = соль и вода
• Кислота + амфотерный оксид = соль и вода
• 1) BaO + HF =
4) K2O + H2S =
• 2) Na2O + HI =
5) Fe2O3 + H2SO4 =
• 3) Al2O3 + HBr =
11. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль
• 3. Все кислоты вступают в реакцию соснованиями (реакция нейтрализации) с
образованием солей и воды
HCl + NaOH = NaCl + H2O
• Кислота + основание = соль + вода
• 1) Ba(OH)2 + HF =
4) KOH + H2S =
• 2) NaOH + HI =
5) Fe(OH)3 + H2SO4 =
• 3) Al(OH)3 + HBr =
12. Ме – основный оксид– основание – соль неМе – кислотный оксид– кислота - соль
• 4.Сильные кислоты вытесняют более слабые кислотыиз их солей. При этом образуется новая кислота и новая
соль:
Na2S + 2HCl = 2NaCl + H2S
Кислота + соль = новая кислота + новая соль
Необходимые условия течения реакции: - в результате
реакции должны получиться газ, осадок или вода
• 1) BaCl2 + H2SO4 =
• 2) Na2S + HI =
• 3) AlBr3+ H3PO4 =
4) MgCl2 + HF =
5) FeCl3 + HF =
13.
14.
Химические свойства кислот.Все кислоты обладают общим характерным свойством - образование солей при замещении
катионов водорода на катионы металла/аммония.
Рассмотрим химические свойства растворимых в воде кислот:
1. При растворении в воде диссоциируют с образованием катионов водорода и аниона
кислотного остатка. Изменяют окраску индикаторов на красный (розовый) цвет, за
исключением фенолфталеина (не реагирует на кислоты, остаётся бесцветным).
2. Взаимодействие с металлами, стоящими в ряду активности левее водорода (при условии
образования растворимой соли):
кислота + металл = соль + водород.
При взаимодействии с металлами исключениями являются кислоты-окислители - азотная и
концентрированная серная кислоты. Во-первых, они реагируют и с некоторыми металлами,
стоящими в ряду активности правее водорода. Во-вторых, в реакция с металлами никогда
не выделяется водород, но образуются соль соответствующей кислоты, вода и продукты
восстановления азота или серы соответственно.
3. Взаимодействие с основаниями/амфотерными гидроксидами:
кислота + основание = соль + вода.
4. Взаимодействие с аммиаком: кислота + аммиак = соль аммония
5. Взаимодействие с солями (при условии образования газа или осадка):
кислота + соль = соль + кислота.
Многоосновные кислоты способны к образованию не только средних, но и кислых солей.
Нерастворимая кремниевая кислота не изменяет окраску индикаторов (очень слабая
кислота), но способна реагировать с растворами щелочей при небольшом нагревании:
1. Взаимодействие кремниевой кислоты с раствором щёлочи:
кремниевая кислота + щёлочь = соль + вода.
2. Разложение (при длительном хранении или при нагревании)
кремниевая кислота = оксид кремния (IV) + вода.










 Химия
Химия








