Похожие презентации:
Комплексные соединения
1. Комплексные соединения
Выполнила ученица11 Б класса
Данилкина Надежда
2.
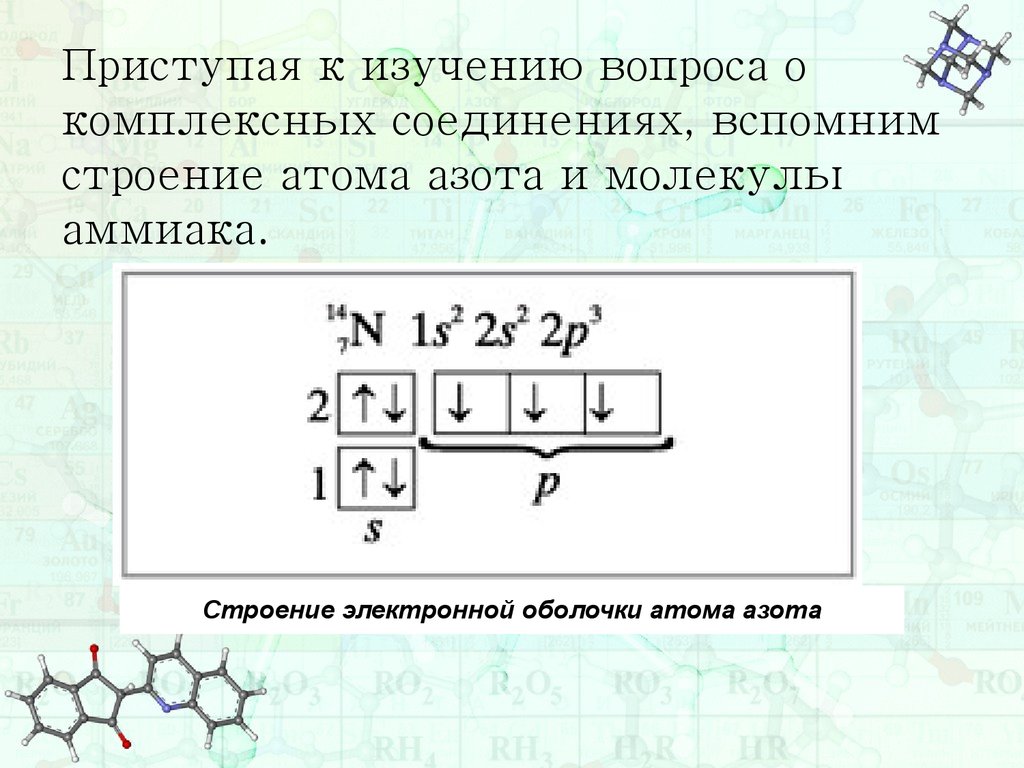
Приступая к изучению вопроса окомплексных соединениях, вспомним
строение атома азота и молекулы
аммиака.
Строение электронной оболочки атома азота
3.
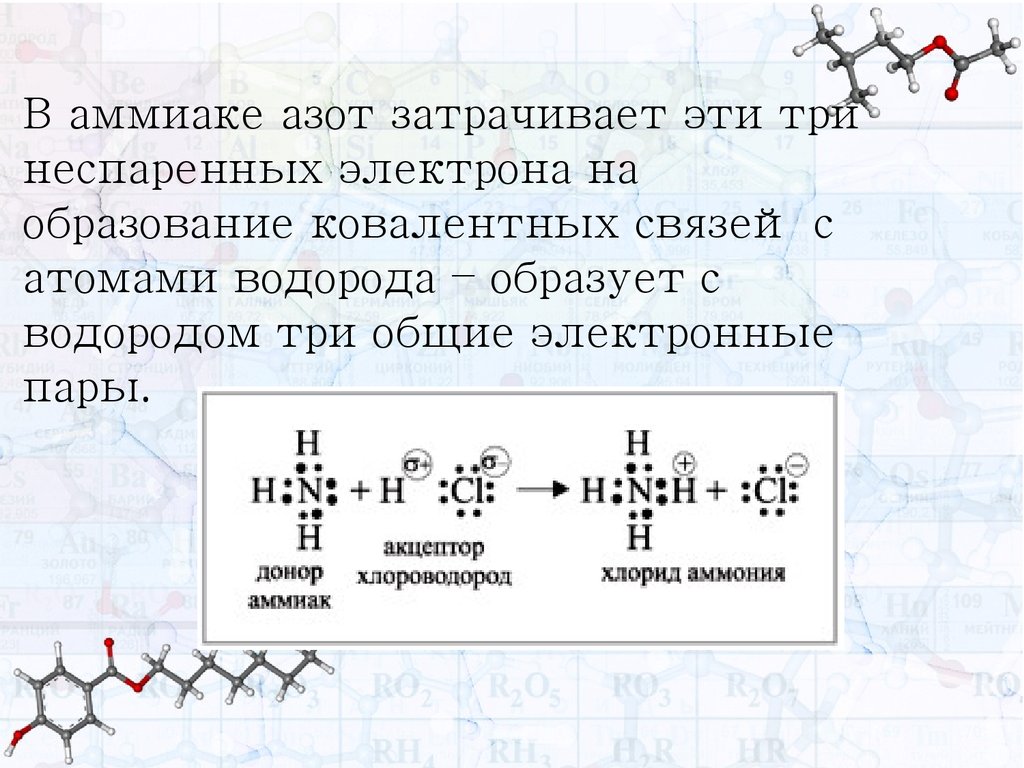
В аммиаке азот затрачивает эти тринеспаренных электрона на
образование ковалентных связей с
атомами водорода – образует с
водородом три общие электронные
пары.
4.
Соединения, образование которых несвязано с возникновением новых
электронных пар (общая электронная
пара образовалась за счет собственной
электронной пары одного из
партнеров), называются
комплексными.
5.
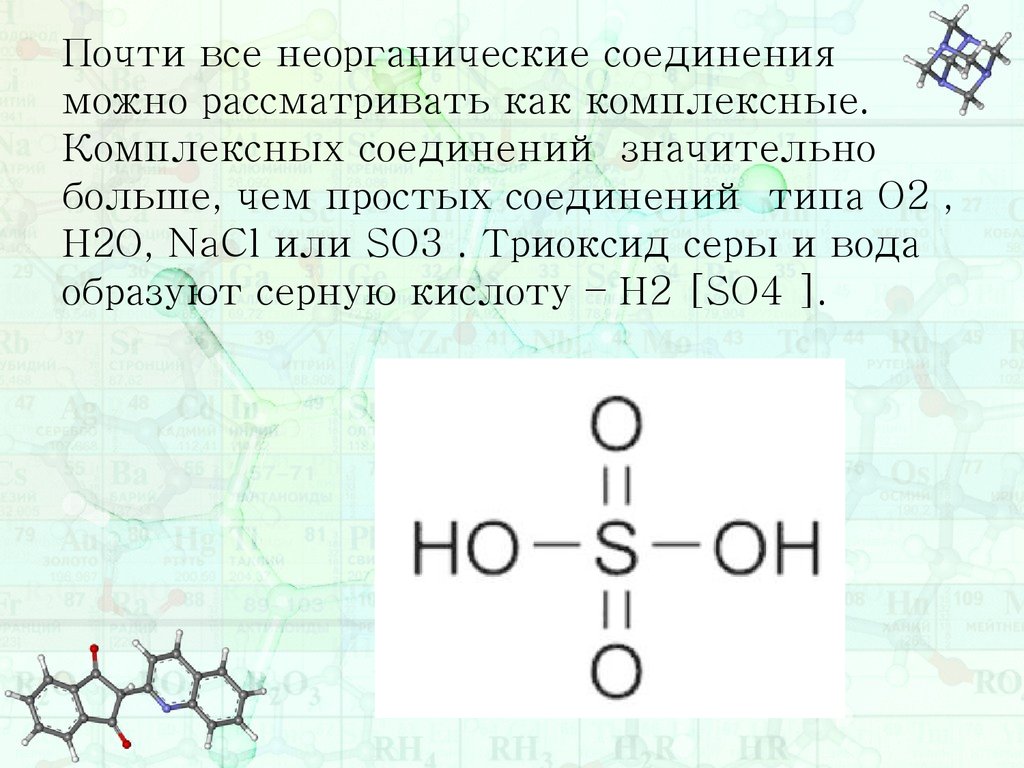
Почти все неорганические соединенияможно рассматривать как комплексные.
Комплексных соединений значительно
больше, чем простых соединений типа О2 ,
Н2О, NaCl или SO3 . Триоксид серы и вода
образуют серную кислоту – Н2 [SO4 ].
6.
Наиболее удачно строение и своистватаких соединений объясняет
координационная теория.
Создатель теории – шведский
ученый
Альфред Вернер
Комплексные соединения - вещества, в состав
которых входят сложные частицы, содержащие
молекулы или сложные ионы, способные к
самостоятельному существованию
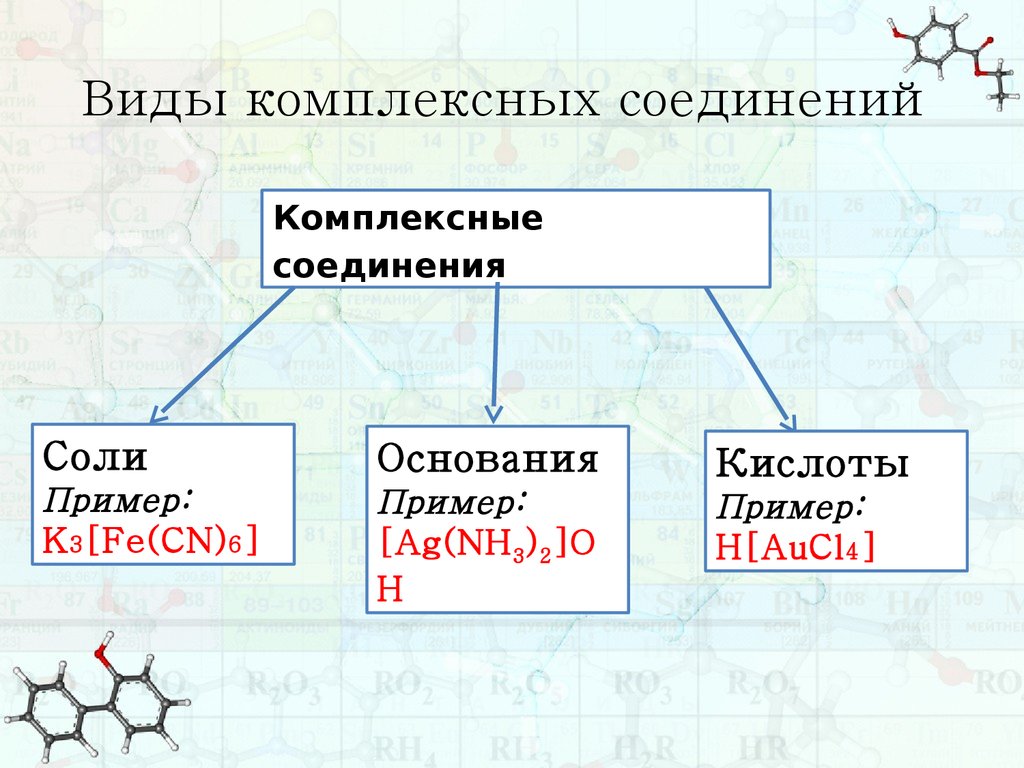
7. Виды комплексных соединений
Комплексныесоединения
Соли
Основания
Пример:
K 3[Fe(CN) 6]
Кислоты
Пример:
[Ag(NH 3) 2]O
H
Пример:
H[AuCl 4]
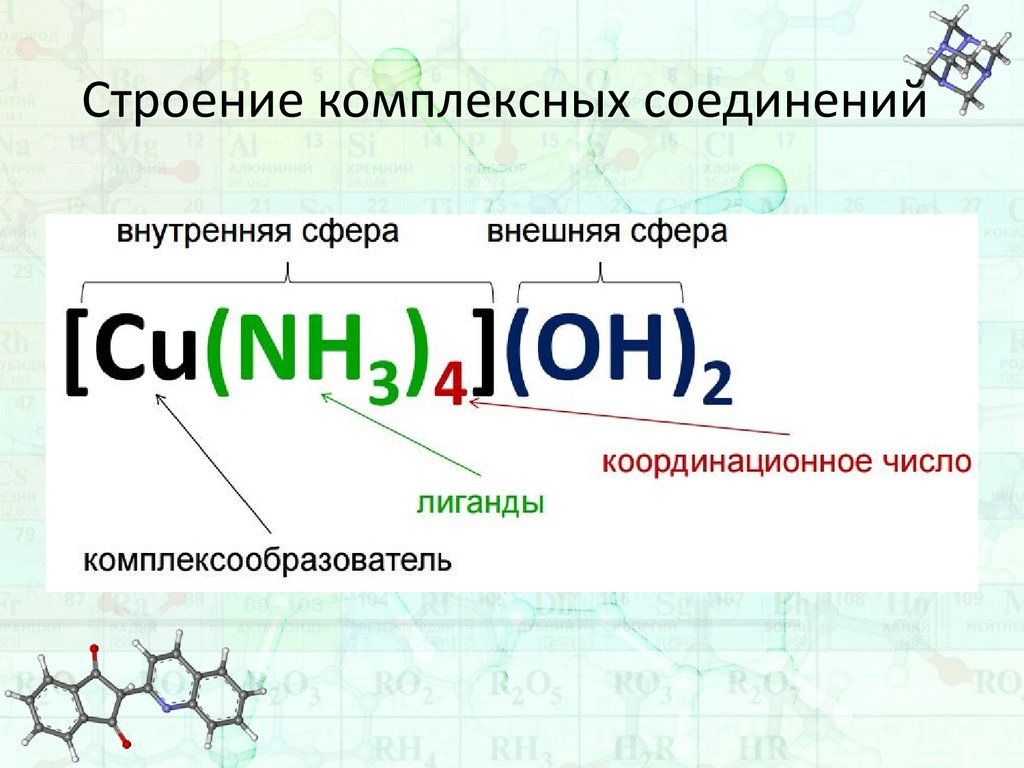
8. Строение комплексных соединений
9.
Составления названиякомплексного соединения
1 . Установить, входит ли в него комплексный
катион или комплексный анион.
Название соединения, содержащего комплексный
катион, начинается с названия лигандов — ионов
внутренней сферы с суффиксом О
например: ионы F– – фторо, Cl– – хлоро, I– – йодо,
CN– – циано, OH– – гидроксо, CNS– – роданидо;
[Cu(NH3)4] (OH)2
гидроксид тетраамминмеди(II)
10.
2.Если этих лигандов больше чем один, тоих названию предшествует
соответствующее греческое числительное:
2 – ди,
3 – три,
4 – тетра,
5 – пента,
6 – гекса.
[Cu(NH3)4] (OH)2
гидроксид тетра амминмеди(II)
11.
3.После названия лигандов — ионовназвание лигандов — нейтральных
молекул. При этом NH3 называют
аммин, NO — нитрозил, H2O— аква.
[Cu(NH3) 4] (OH)2
гидроксид тетра амминмеди(II)
12.
4. Затем следует название центрального ионакомплексообразователя, которое производят от
латинского названия элемента с различными
окончаниями в зависимости от валентности
центрального иона
[Cu(NH3) 4] (OH)2
гидроксид тетра амминмеди(II)
13.
5.В комплексных анионах
добавляется суффикс «ат» к названию
комплексообразователя
Пример:
Na[Ag(CN)2] дицианоаргентаАТ натрия
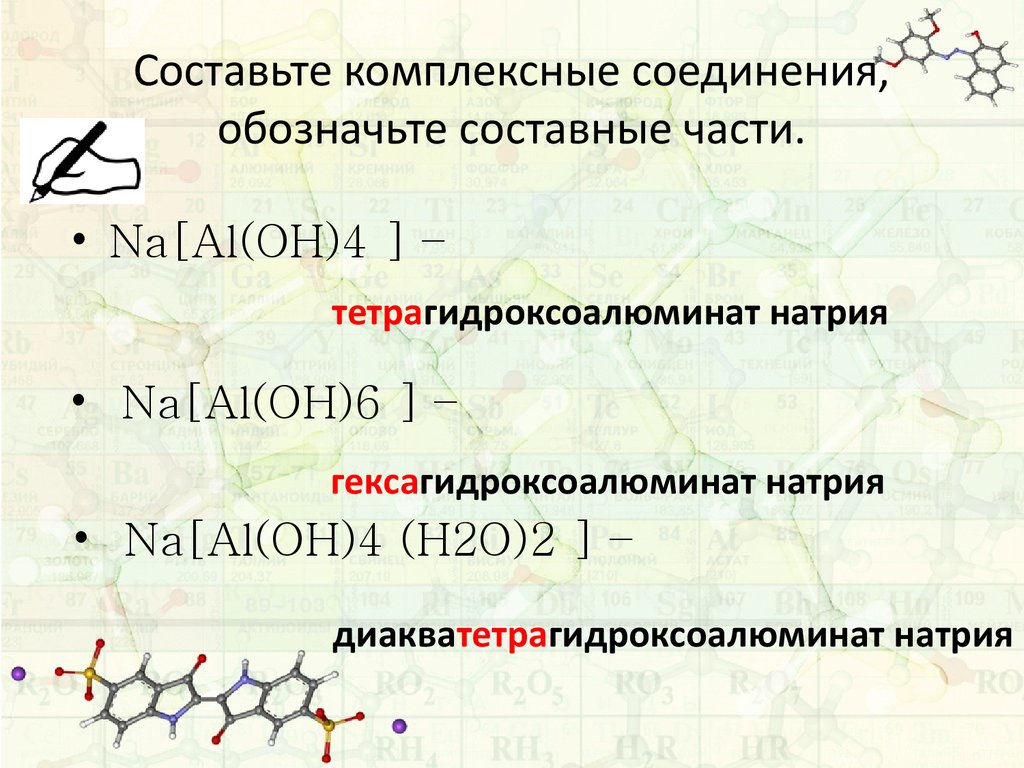
14. Составьте комплексные соединения, обозначьте составные части.
• Na[Al(OH)4 ] –тетрагидроксоалюминат натрия
• Na[Al(OH)6 ] –
гексагидроксоалюминат натрия
• Na[Al(OH)4 (H2O)2 ] –
диакватетрагидроксоалюминат натрия
15.
Демонстрационный опытCu(OH)2 + 4NH3 = [Cu(NH3 )4 ](OH)2
16.
• K3 [Fe(CN)6 ] – красная кровянаясоль
17.
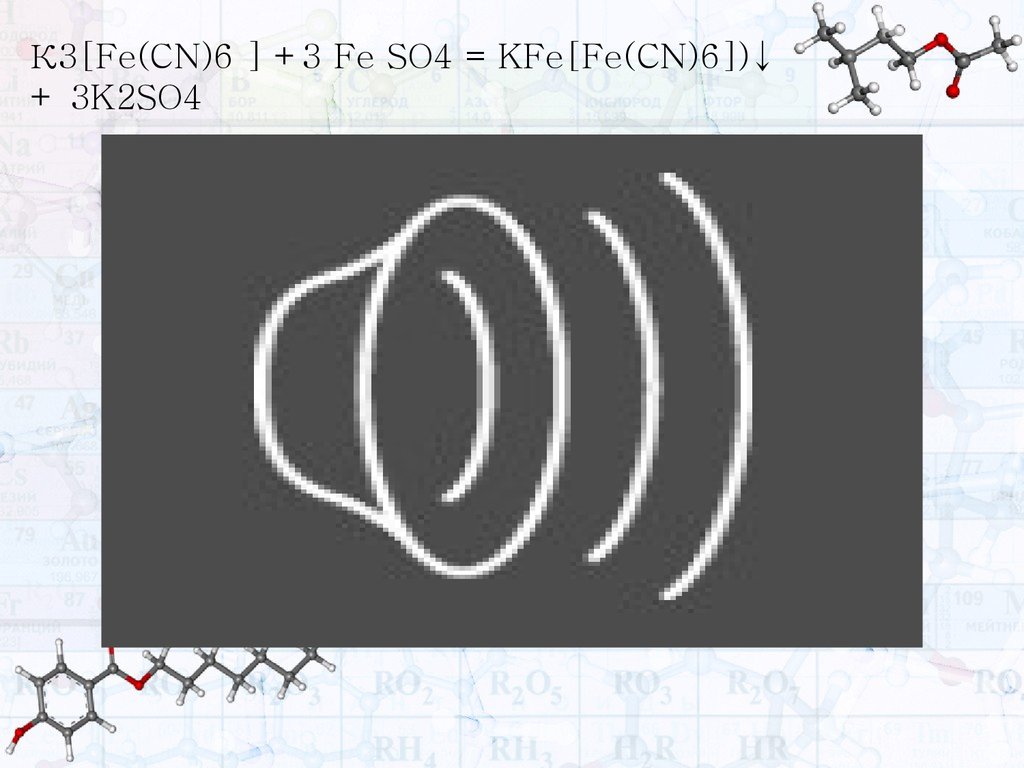
К3[Fe(CN)6 ] +3 Fe SO4 = KFe[Fe(CN)6])↓+ 3K2SO4
18.
• K4 [Fe(CN)6 ] – желтая кровяная соль19.
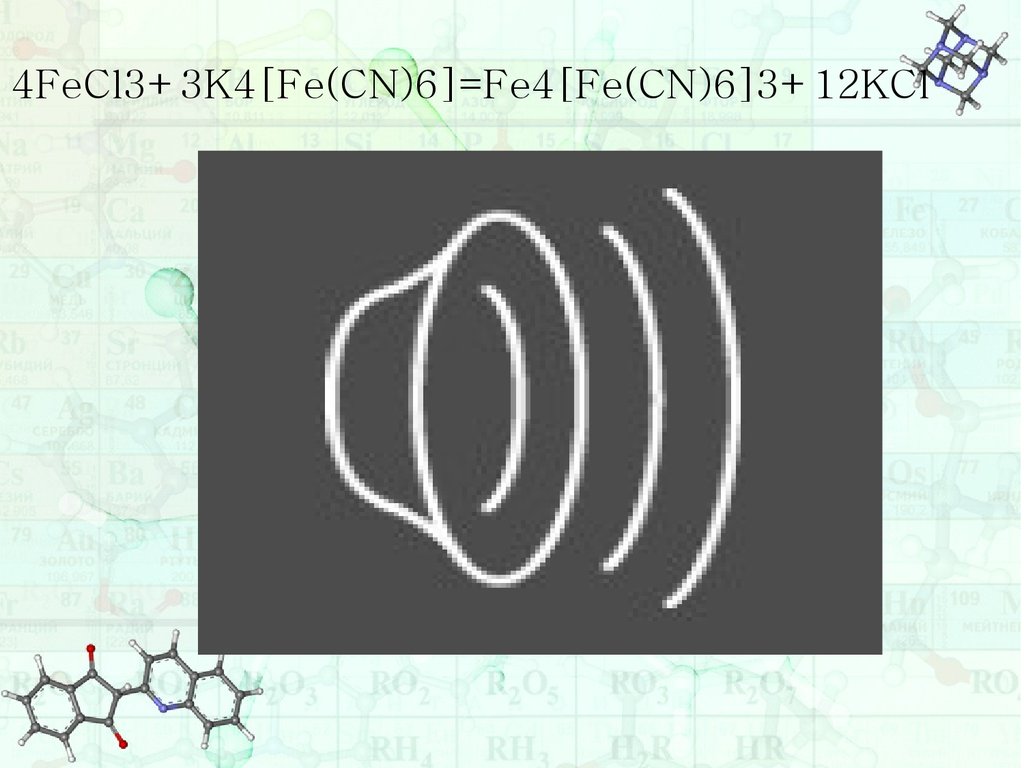
4FeCl3+3K4[Fe(CN)6]=Fe4[Fe(CN)6]3+12KCl20.
• [Ag(NH3 )2 ]OH –аммиачныйраствор оксида серебра
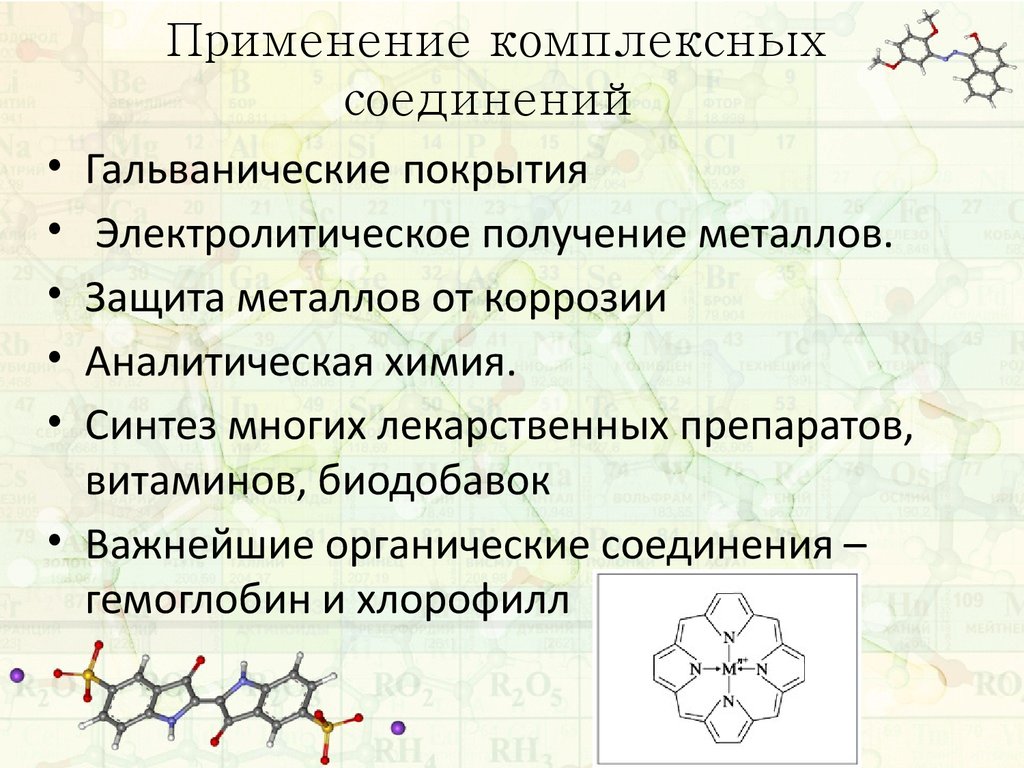
21. Применение комплексных соединений
Гальванические покрытия
Электролитическое получение металлов.
Защита металлов от коррозии
Аналитическая химия.
Синтез многих лекарственных препаратов,
витаминов, биодобавок
• Важнейшие органические соединения –
гемоглобин и хлорофилл











 Химия
Химия








