Похожие презентации:
Введение в клиническую фармакологию
1.
Рязанский государственный медицинский университетим. акад. И.П. Павлова
кафедра фармакологии с курсом фармации ФДПО
Введение в клиническую фармакологию
Доцент, к.м.н. А.В. Щулькин
2.
Клиническая фармакологияКлиническая фармакология может быть
определена
как
наука,
изучающая
взаимодействие лекарственного средства с
организмом здорового и больного человека.
Предметом клинической фармакологии
является лекарство в условиях клинической
практики.
3.
Задачи клинической фармакологии• реализация научной базы для проведения
предрегистрационных клинических исследований новых ЛС,
экспертизы новых и генерических ЛС, выявление новых
эффектов и областей применения уже существующих
препаратов
• разработка новых схем и способов применения препарата
• участие в регулировании рынка ЛС и медицинских услуг
• участие в создании формуляров ЛС
• оптимизация фармакотерапии в отдельных лечебных
учреждениях
• комплексная оценка безопасности ЛС
• оценка экономических и социальных результатов
использования ЛС
• создание рекомендаций по клинической практике.
4.
Цель преподавания клиническойфармакологии
формирование у студентов умений выбора эффективных,
безопасных лекарственных средств и их режимов
дозирования на основе клинических рекомендаций,
стандартов диагностики и лечения, формуляров, перечня
жизненно необходимых и важнейших лекарственных
средств
для
проведения
современной
индивидуализированной,
контролируемой
фармакотерапии, с использованием основных данных по
фармакокинетике, фармакодинамике, фармакогенетике,
фармакоэкономики,
фармакоэпидемиологии,
по
взаимодействию лекарственных средств с учетом
проявления нежелательных лекарственных реакций,
положений доказательной медицины.
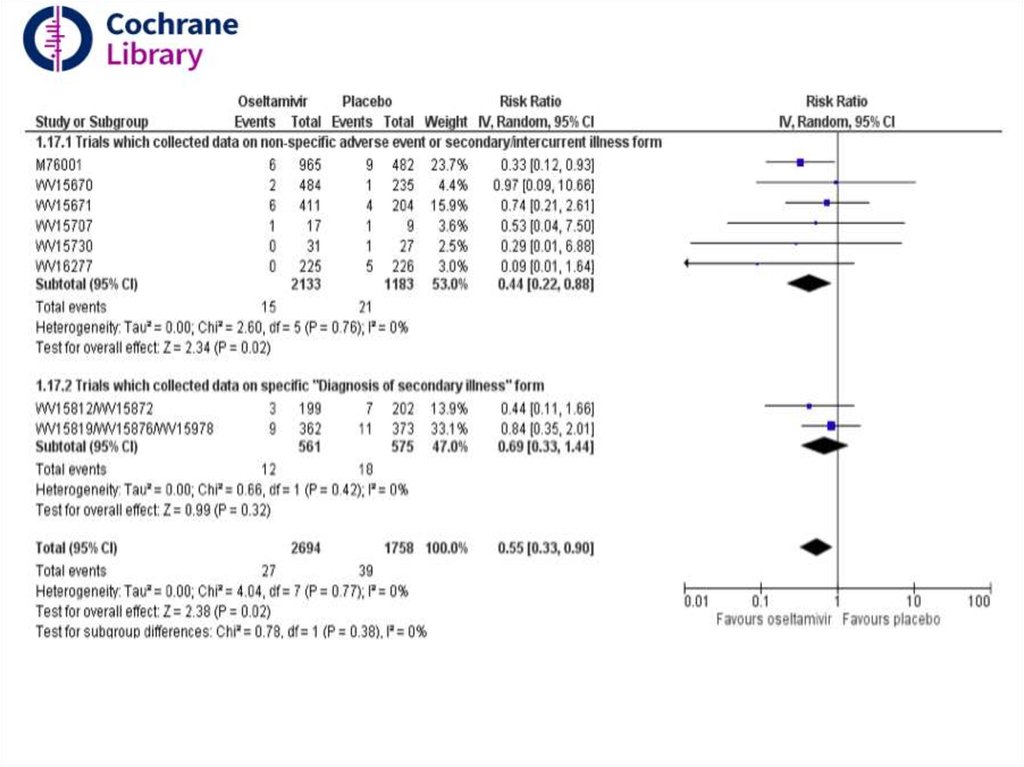
5.
Основные принципы клинической фармакологии• Первый принцип. Доказательная медицина в
отношении использования лекарств для лечения
заболевания. Только доказательства, полученные
в
результате
правильно
выполненных
экспериментальных и клинических исследований,
могут быть использованы в преподавании и
клинической практике
• Второй принцип – фармакологическое мышление
у постели больного.
6.
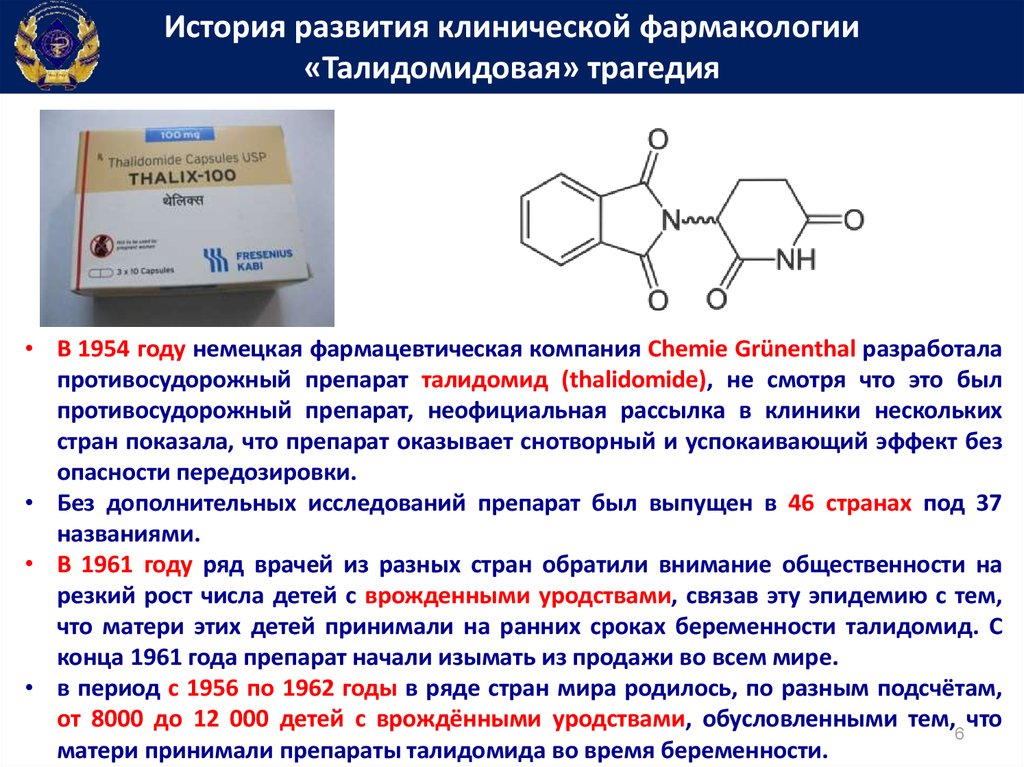
История развития клинической фармакологии«Талидомидовая» трагедия
• В 1954 году немецкая фармацевтическая компания Chemie Grünenthal разработала
противосудорожный препарат талидомид (thalidomide), не смотря что это был
противосудорожный препарат, неофициальная рассылка в клиники нескольких
стран показала, что препарат оказывает снотворный и успокаивающий эффект без
опасности передозировки.
• Без дополнительных исследований препарат был выпущен в 46 странах под 37
названиями.
• В 1961 году ряд врачей из разных стран обратили внимание общественности на
резкий рост числа детей с врожденными уродствами, связав эту эпидемию с тем,
что матери этих детей принимали на ранних сроках беременности талидомид. С
конца 1961 года препарат начали изымать из продажи во всем мире.
• в период с 1956 по 1962 годы в ряде стран мира родилось, по разным подсчётам,
от 8000 до 12 000 детей с врождёнными уродствами, обусловленными тем,6 что
матери принимали препараты талидомида во время беременности.
7.
История развития клинической фармакологии«Талидомидовая» трагедия
8.
История развития клинической фармакологии• 50-60 годы XX века характеризовались бурным развитием
химической и фармацевтической промышленности, что
привело к появлению на рынке тысяч активных субстанций.
• Однако, для производства лекарств необходимо было
доказать их безопасность и эффективность. Но в мире было
специальности, которая бы этим занималась.
• С этой целью в 1974 году вышло письмо ВОЗ
«Клиническая
фармакология:
задачи,
организация
обслуживания, и подготовка кадров».
9.
Развитие клинической фармакологиив России
• В
нашей
стране
основоположником
клинической
фармакологии
является
академик Б.Е. Вотчал. На рубеже 50-60 годов
он организовал обучение врачей в
Центральном институте усовершенствования
врачей.
• В 1962 году вышла его книга «Очерки
клинической фармакологии», которая не
утратила своей значимости и сегодня.
10.
Развитие клинической фармакологиив России
• Академик М.Д. Машковский создал
руководство
по
фармакотерапии
«Лекарственные
средства»,
которое
служит не одному поколению врачей.
• Благодаря члену-корреспонденту АМН
СССР
К.М.
Лакину,
клиническая
фармакология вошла в учебные планы
медицинских и фармацевтических вузов.
«Для достижения успеха
терапии
необходимо научиться управлять судьбой
лекарственного средства в организме
больного».
11.
Развитие клинической фармакологиив России
• В 1970 году в 1-м ММИ им. И.М. Сеченова на базе ЦНИЛ
была
организована
лаборатория
клинической
фармакологии, которую возглавил профессор В.Г. Кукес,
ныне академик РАМН. Академик РАМН В.Г. Кукес
возглавляет Проблемную учебно-методическую комиссию
по клинической фармакологии Минздравсоцразвития РФ,
которая во многом определяет развитие клинической
фармакологии как учебной дисциплины в российских
медицинских и фармацевтических вузах.
• Петров В.И. - главный клинический фармаколог РФ с
2008 г
12.
Программа ФАРМА-2020• Стратегия Фарма-2020 и государственная программа
«Развитие фармацевтической и медицинской
промышленности на 2013–2020 годы»
• Основной целью Фармы-2020 является увеличение
доли препаратов, произведенных в России — до 50%
к 2020 году.
13.
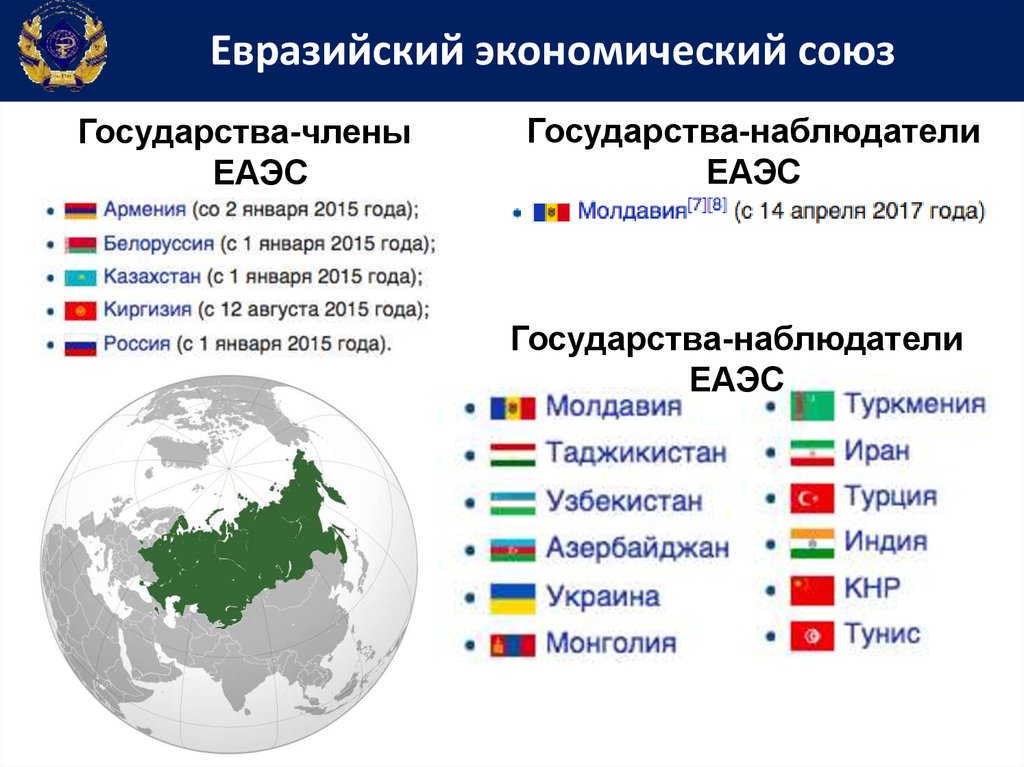
Евразийский экономический союзГосударства-члены
ЕАЭС
Государства-наблюдатели
ЕАЭС
Государства-наблюдатели
ЕАЭС
14.
Регулирующие документы• По наднациональным нормам единого рынка будут
осуществляться разработка, доклиническое и клиническое
изучение, контроль качества, регистрация, производство и
дистрибьюция лекарственных препаратов.
• Предусмотрен переходный период, обеспечивающий
плавный
переход
от
национального
к
единому
регулированию.
• до 31 декабря 2020 года изготовитель имеет право выбирать,
по каким правилам (национальным или единым) он будет
осуществлять регистрацию лекарств.
• Все
лекарственные
препараты,
которые
были
зарегистрированы по национальным правилам до 31
декабря 2020 года, должны пройти перерегистрацию по
правилам единого рынка до 31 декабря 2025 года.
15.
Юридический статус врача-клиническогофармаколога
• Федеральный закон №61-ФЗ
«Об обращении лекарственных
средств»
• Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 200н
“Об утверждении правил надлежащей клинической практики”
• Приказ Минздрава России №131 от 05.05.1997 «О введении
специальности «клиническая фармакология»»
• Приказ Минздрава РФ №494 от 22.10.2003 «О совершенствовании
деятельности врачей – клинических фармакологов»
• Приказ № 110 от 12.02.07 «О порядке назначения и выписывания
лекарственных средств, изделий медицинского назначения и
специализированных продуктов лечебного питания»
• Профессиональный стандарт врача клинического фармаколога
(проект на общественное обсуждение)
16.
17.
Источники информации о лекарственныхпрепаратах
• http://grls.rosminzdrav.ru
• http://roszdravnadzor.ru
• http://www.regmed.ru
• https://www.fda.gov
• https://www.ema.europa.eu
• http://www.eurasiancommission.org/ru
18.
Основные определенияЛекарственные средства - вещества или их комбинации,
вступающие в контакт с организмом человека или животного,
проникающие в органы, ткани организма человека или
животного, применяемые для профилактики, диагностики (за
исключением веществ или их комбинаций, не контактирующих
с организмом человека или животного), лечения заболевания,
реабилитации, для сохранения, предотвращения или
прерывания беременности и полученные из крови, плазмы
крови, из органов, тканей организма человека или животного,
растений, минералов методами синтеза или с применением
биологических технологий. К лекарственным средствам
относятся фармацевтические субстанции и лекарственные
препараты.
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 27.12.2018) "Об обращении
лекарственных средств"
19.
Основные определенияФармацевтическая субстанция - лекарственное средство
в
виде
одного
или
нескольких
обладающих
фармакологической активностью действующих веществ вне
зависимости от природы происхождения, которое
предназначено
для
производства,
изготовления
лекарственных препаратов и определяет их эффективность.
Вспомогательные вещества - вещества неорганического
или органического происхождения, используемые в
процессе производства, изготовления лекарственных
препаратов для придания им необходимых физикохимических свойств;
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 27.12.2018) "Об обращении
лекарственных средств"
20.
Основные определения• Лекарственные препараты - лекарственные средства в
виде
лекарственных
форм,
применяемые
для
профилактики, диагностики, лечения заболевания,
реабилитации, для сохранения, предотвращения или
прерывания беременности.
• Лекарственная форма - состояние лекарственного
препарата, соответствующее способам его введения и
применения
и
обеспечивающее
достижение
необходимого лечебного эффекта.
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 27.12.2018) "Об обращении
лекарственных средств"
21.
Источники информации о лекарственныхсредствах
Согласно ФЗ «Об обращении лекарственных средств» и
отраслевому стандарту «Государственный информационный
стандарт ЛС» официальными источниками информации о ЛС в
России являются:
•Инструкция по применению ЛП для потребителей (листоквкладыш), информация в котором предназначен для пациентов
•Инструкция по применению ЛП для специалистов (врачей и
провизоров)
22.
Источники информации о лекарственныхсредствах
• В реальных условиях функцию инструкций по
применению ЛП для специалистов выполняют типовые
клинико-фармакологические статьи (ТКФС), а листкивкладыши представляют собой инструкции, в которых
информация для потребителей (пациентов) сочетается с
информацией для специалистов (врачей и провизоров)
• ТКФС разрабатывается только по МНН
• ТКФС включает следующие разделы: фармакологическое
действие, фармакокинетика, показания к применению,
противопоказания, применение с осторожностью, режим
дозирования, побочное действие, передозировка,
взаимодействие, особые указания
23.
Фармакотерапия в клинической практикерегламентируется
Инструкции по применению (листок-вкладыш)
ТКФС
Стандарты медицинской помощи
Клинические рекомендации
24.
Стандарт медицинской помощиСтандарт медицинской помощи - то нормативный документ,
определяющий требования к выполнению медицинской помощи
больному при определенном заболевании, с определенным
синдромом или в определенной клинической ситуации.
Стандарты разрабатываются для решения следующих задач:
•Выбор оптимальной технологии профилактики, диагностики, лечения
и реабилитации для конкретного больного
•Защита прав пациента и врача при разрешении спорных и
конфликтных вопросов
•Проведение экспертизы и оценка качества медицинской помощи
•Планирование объемом медицинской помощи
•Расчет необходимых затрат на оказание медицинской помощи
•Обоснование программы государственных гарантий оказания
медицинской помощи населению
25.
Стандарт медицинской помощи• Согласно Федеральному закону от 21.11.2011 N 323-ФЗ "Об
основах охраны здоровья граждан Российской Федерации"
(далее - Закон N 323-ФЗ) с 1 января 2013 года медицинская
помощь организуется и оказывается в соответствии с
порядками оказания медицинской помощи, обязательными
для исполнения на территории Российской Федерации
всеми медицинскими организациями, а также на основе
стандартов медицинской помощи, за исключением
медицинской помощи, оказываемой в рамках клинической
апробации.
26.
Клинические рекомендации27.
Основные определенияКлиническое исследование лекарственного препарата изучение диагностических, лечебных, профилактических,
фармакологических свойств лекарственного препарата в
процессе его применения у человека, животного, в том числе
процессов всасывания, распределения, изменения и
выведения, путем применения научных методов оценок в
целях получения доказательств безопасности, качества и
эффективности лекарственного препарата, данных о
нежелательных реакциях организма человека, животного на
применение лекарственного препарата и об эффекте его
взаимодействия с другими лекарственными препаратами и
(или) пищевыми продуктами, кормами;
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 27.12.2018) "Об обращении
лекарственных средств"
28.
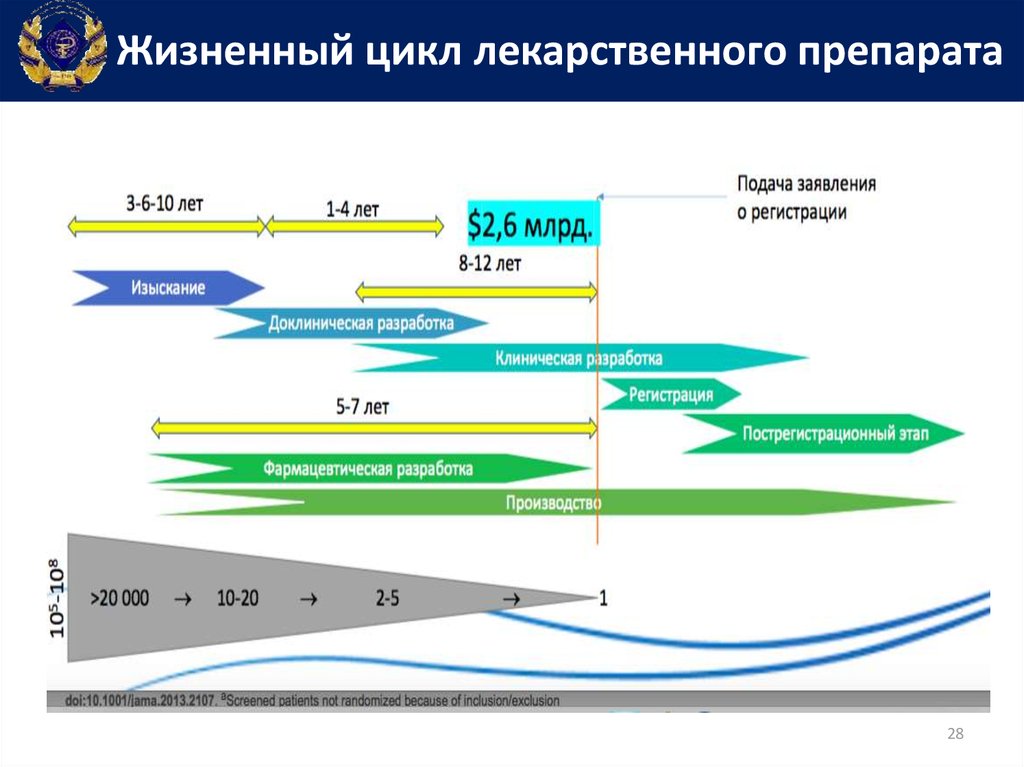
Жизненный цикл лекарственного препарата28
29.
2930.
3031.
3132.
3233.
3334.
Виды клинических исследований1. Описательные исследования
•Описание случая – наиболее старый способ медицинского
исследования, представляющий собой подробное изложение
данных, полученных путем наблюдения одного или нескольких
больных (не более 10)
•Описание серии случаев – исследование, в котором представлен
количественный анализ (чаще всего с применением описательной
статистики) группы больных численностью 10 человек
35.
Виды клинических исследований• К
количественным
описательным
исследованиям
относится изучение использования лекарственных
средств:
- Обзор и оценка использования лекарственных средств
- Обзор потребления лекарственных средств
- Программы использования лекарственных средств
- Обзор использования ЛС предназначен для анализа
обоснованности и адекватности применения ЛС
- В качестве критериев оценки используются показания к
назначению, рациональность выбора препаратов и
режима дозирования, необходимость
36.
Виды клинических исследований2. Исследование «случай-контроль» - ретроспективное
исследование, в котором по архивным данным сравнивают
две группы: в одну отобраны пациенты с определенной
патологией, в другую – без нее.
37.
Виды клинических исследований3. Одномоментные исследования (поперечное) - вид
исследования
в
котором
участники
подвергаются
однократному
обследованию,
обычно
в
течение
относительно короткого периода времени, что позволяет в
дальнейшем оценить распространенность того или иного
исхода, течения заболевания, эффективности диагностики.
38.
Виды клинических исследований4. Когортное исследование – обсервационное исследование, в
котором изначально объединенную каким-либо общим
признаком выделенную группу людей (когорту) наблюдают в
течение некоторого времени и сравнивают исходы у тех кто был
и не был подвергнут действию изучаемого вмешательства или
другого фактора, либо был подвергнут ему в разной степени
•Выделяют два типа когортных исследований:
•Параллельное когортное исследование – когорты формируются
в настоящем времени и в последующем наблюдаются
•Историческое когортное исследование - выделение когорт
происходит
по
архивным
документам,
наблюдение
производится вплоть до настоящего момента
39.
Виды клинических исследований5. Рандомизированное контролируемое испытание (РКИ) тип научного (часто медицинского) эксперимента, при котором
его участники случайным образом делятся на группы, в одной
из которых проводится исследуемое вмешательство, а в другой
(контрольной) применяются стандартные методики или
плацебо.
40.
Недостатки клинических исследований• Далекий от реального «идеальный» контингент
пациентов,
• Ограничения по количеству участвующих
пациентов
• Ограниченный период наблюдения
41.
«Конечные точки» в клиническихисследованиях
• Для оценки эффективности нового ЛС по результатам
клинических исследований могут быть использованы
первичные, вторичные и третичные «конечные точки». Эти
основные показатели оценивают в контролируемых
сравнительных исследованиях по результатам лечения по
крайней мере в двух группах: основной (больные получают
новый способ лечения или новый препарат) и группе
сравнения (больные не получают изучаемый препарат или
принимают известный препарат сравнения).
42.
«Конечные точки» в клиническихисследованиях
• Например, при исследовании эффективности лечения и
профилактики ишемической болезни сердца (ИБС) выделяют
следующие «конечные точки».
• Первичные - основные показатели, связанные с возможностью
увеличения продолжительности жизни больного. В клинических исследованиях к ним относят снижение общей смертности, смертности от сердечно-сосудистых заболеваний, в частности инфаркта миокарда и инсульта.
• Вторичные - отражают улучшение качества жизни либо вследствие
снижения
заболеваемости,
либо
облегчения
симптомов
заболевания (например, уменьшение частоты приступов стенокардии, увеличение толерантности к физической нагрузке).
• Третичные - показатели, связанные с возможностью профилактики
заболевания (например, у больных с ИБС — стабилизация АД,
нормализация содержания глюкозы в крови, снижение концентрации общего ХС, ЛПНП и т.д.).
43.
Классификация рекомендацийУровень доказанности
44.
Классификация рекомендаций• Уровень I (А) — хорошо разработанные, крупные,
рандомизиро ванные, двойные слепые,
плацебоконтролируемые исследования. Данные, по
лученные в результате мета-анализа нескольких
рандомизированных контролируемых исследований.
• Уровень II (В) — небольшие рандомизированные и
контролируемые исследования (если статистически
корректные результаты не получены из-за малого количества
больных, включённых в исследование).
• Уровень III (С) — исследования «случай—контроль», или
когортные исследования (иногда их относят к уровню II).
• Уровень IV (D) — сведения, содержащиеся в отчётах
экспертных групп или консенсусах специалистов (иногда их
относят к уровню III).
45.
Мета-анализ• Мета-анализ – статистический анализ количественных
результатов нескольких исследований, посвященных одному и
тому же вопросу (количественный систематический обзор).
• Систематический обзор – это обобщение данных по одной
частной четко сформулированной проблеме с использованием
систематических и точных методов поиска, отбора и
критической оценки исследований, относящихся к теме
обзора, а также дальнейшим анализом сведений в него
включенных.
46.
Мета-анализ• Целью мета-анализа является не только оценка
эффективности/безопасности изучаемого вмешательства, но
также выявление, изучение и объяснение неоднородности
(гетерогенности) в результатах исследований и подгруппах
пациентов. Для этого обязательным является проведение
теста на статистическую гетерогенность (Хи-квадрат).
Значение Хи-квадрата много больше, чем число испытаний в
мета-анализе свидетельствует о том, что испытания
отличаются друг от друга. При обнаружении существенных
различий между исследованиями выводы мета-анализа
можно поставить под сомнение.
47.
Мета-анализ• Отношение шансов (ОШ). Шанс события – это вероятность
того, что оно произойдет, в сравнении с вероятностью того,
что оно не произойдет. Если принять вероятность события за
Р, то шанс того, что событие произойдет равен Р/(1-P). Чем
ближе значение ОШ к 1, тем меньше различий в
эффективности (безопасности) сравниваемых вмешательств.
• Относительный риск (ОР). Отношение частоты развития
определенного исхода в группах сравнения. При ОР>1 частота
развития изучаемого исхода выше в основной группе, чем в
контрольной.
• При ОР<1 – ниже. При низкой частоте развития исхода этот
показатель близок к отношению шансов.
48.
Мета-анализ• Снижение относительного риска (СОР). Снижение частоты
событий в исследуемой группе (ЧСИГ) по сравнению с
частотой событий в контрольной группе (ЧСКГ).
СОР = (ЧСКГ – ЧСИГ)/ЧСКГ
• Снижение абсолютного риска (САР). Абсолютная
арифметическая разность между частоты событий в
группах сравнения.
САР = ЧСКГ – ЧСИГ
49.
Мета-анализ• ЧБНЛБИ (равнозначно ЧБНЛ) – число больных, которых
нужно лечить определенным методом в течение
определенного времени, чтобы достичь благоприятного
исхода или предотвратить неблагоприятный исход.
Показатель всегда предполагает существование группы
сравнения (референтной группы), в которой больные
получают плацебо, либо другое лечение, либо вообще не
получают его.
• ЧБНЛ для определенного вмешательства является величиной,
обратной САР при этом вмешательстве. Простота расчета
позволяет использовать ЧБНЛ в качестве основного
цифрового показателя эффективности (или потенциального
вреда) анализируемого вмешательства
50.
Мета-анализ• ЧБНЛНИ – число больных, которых нужно
лечить определенным методом в течение
определенного времени для выявления
дополнительного неблагоприятного исхода.
Знание этого показателя позволяет более
полно оценить степень риска вмешательства у
конкретного пациента. Особую важность этот
показатель
приобретает
при
оценке
целесообразности
профилактического
вмешательства.
51.
107 отчетов о клинических исследованиях из EMA, FDA и японскогорегулятора компаний GlaxoSmithKline и Roche. На первом этапе
(оценка надлежащего плана исследования) в анализ было
включено 53 исследования, на втором этапе 46 исследований, в
том числе 20 исследований осельтамивира (9623 участника) и 26
исследований занамивира (14 628 участников).
52.
Время до первого облегчения симптомов.•У взрослых осельтамивир сократил время до первого
облегчения симптомов на 16,8 часа. Это означает сокращение
времени до первого облегчения симптомов с 7 до 6,3 дня. У
детей, страдающих астмой, эффекта не было, но у других
здоровых детей (снижение на 29%, 95% ДИ от 12 до 47 часов, P =
0,001).
•Занамивир сократил время первого облегчения симптомов у
взрослых на 0,60 дня (95% ДИ от 0,39 до 0,81 дня, P <0,00001),
что эквивалентно сокращению средней продолжительности
симптомов с 6,6 до 6,0 дня. Эффект у детей не был
значительным. В анализе подгрупп мы не обнаружили никаких
свидетельств различия в эффекте лечения занамивиром по
времени до первого облегчения симптомов у взрослых в
подгруппах, инфицированных гриппом и не инфицированных
гриппом (P = 0,53).
53.
Серьезные осложнения гриппа.• В исследованиях по лечению взрослых осельтамивир
значительно не уменьшал те осложнения, которые
классифицировались как серьезные или те, которые привели к
прекращению исследования (ОР 0,07%, 95% ДИ от 0,78 до 0,44);
• Занамивир также не оказал достоверного влияния.
54.
Пневмония.• Осельтамивир значительно уменьшил выраженность
симптомов при непроверенной пневмонии (ОР 1,00%, 95% ДИ
0,22 до 1,49); ЧБНЛБИ = 100 (95% ДИ от 67 до 451) в
обработанной популяции
• Эффект был незначительным в пяти исследованиях, в
которых использовалась точная диагностика пневмонии.
• Ни в одном из исследований лечения осельтамивиром не
сообщалось о влиянии на рентгенологически
подтвержденную пневмонию.
• Не было значимого влияния занамивира ни на самооценку,
ни на рентгенологически подтвержденную пневмонию.
• В профилактике занамивир значительно снижал риск
непроверенной пневмонии у взрослых (ОР 0,32%, 95% ДИ от
0,09 до 0,41) ЧБНЛБИ = 311 (95% ДИ от 244 до 1086)
55.
56.
Виды фармакотерапии1. Этиотропная (устранение причины заболевания).
2. Патогенетическая (влияющая на механизм развития
заболевания).
3. Заместительная (компенсация недостатка в
организме жизнен но важных веществ).
4. Симптоматическая (устранение отдельных
синдромов или симптомов заболевания).
5. Общеукрепляющая (восстановление нарушенных
звеньев адаптационной системы организма).
6. Профилактическая (предупреждение развития
острого процесса или обострения хронического).
57. Цели и задачи рациональной фармакотерапии
Цели и задачи рациональнойфармакотерапии
• • определение показаний к фармакотерапии и
её цели;
• выбор ЛС или комбинации ЛС;
• выбор путей и способов введения, а также
форм выпуска ЛС;
• определение индивидуальной дозы и
режима дозирования ЛС;
• коррекция режимов дозирования ЛС в
процессе лечения;
• выбор критериев, методов, средств и сроков
контроля фармако
58.
Цели и задачи рациональнойфармакотерапии
• определение показаний к фармакотерапии и её цели;
• выбор ЛС или комбинации ЛС;
• выбор путей и способов введения, а также форм
выпуска ЛС;
• определение индивидуальной дозы и режима
дозирования ЛС;
• коррекция режимов дозирования ЛС в процессе
лечения;
• выбор критериев, методов, средств и сроков контроля
фармакотерапии;
• обоснование сроков и длительности фармакотерапии;
• определение показаний и технологии отмены ЛС.
59.
Фармакодинамика• Фармакодинамика
это
раздел
фармакологии, изучающий механизмы
действия лекарственных средств, а также
совокупность эффектов, вызванных ими.
60.
• Доказательнаямедицина
–
это
добросовестное, точное и осмысленное
использование
лучших
результатов
клинических исследований для выбора
лечения конкретного больного (Sackett D.L.
et al., 1996)
• Клинические
рекомендации
(Clinical
Guidelines)
–
систематически
разрабатываемые положения, помогающие
принимать
правильные
решения
относительно врачебной тактики при
определенных
клинических
обстоятельствах.
61.
• Фармакоэпидемиология – это наука,изучающая
с
помощью
эпидемиологических
методов
эффективность,
безопасность
и
особенности использования лекарственных
средств в реальных условиях на уровне
популяции или больших групп людей,
способствуя при этом рациональному и
экономически приемлемому применению
наиболее эффективных и безопасных ЛС.
62. Спасибо за внимание!!!
Доцент, к.м.н. Щулькин А.В.E-mail: alekseyshulkin@rambler.ru

























































 Медицина
Медицина








