Похожие презентации:
Типы химических реакций
1. Типы химических реакций
СР
З
О
2. Вещества можно классифицировать
Посоставу
По
агрегатному состоянию
По
происхождению
3. «Подарки» природы
4. «Подарки» природы
СераУголь
Кремний
Серебро
Золото
Платина
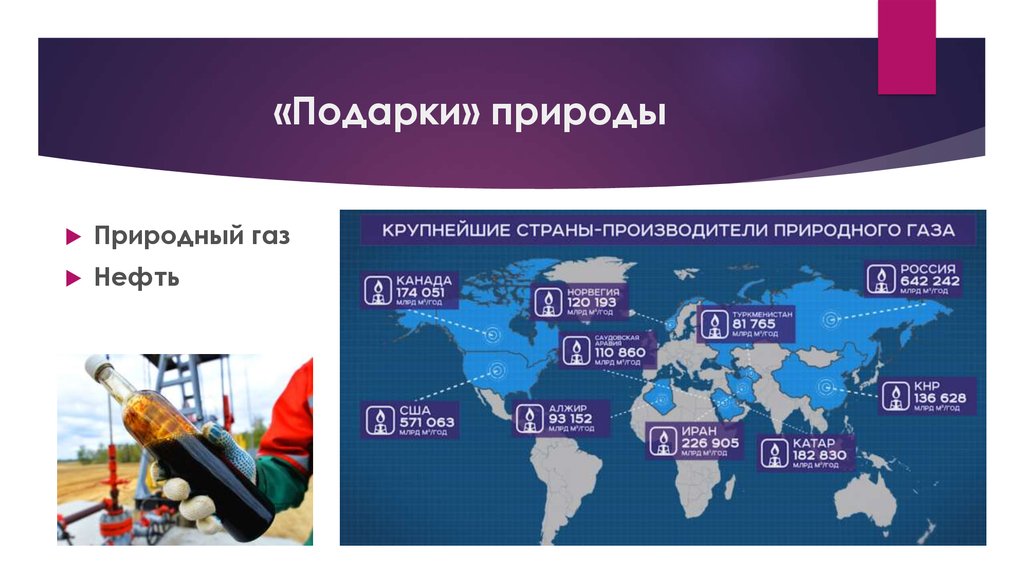
5. «Подарки» природы
Природный газНефть
6. «Подарки» природы
ВодаКремнезем (кварц, опал, аметист)
Глинозем,боксит, корунд
Красный и бурый железняки
7. «Подарки» природы
Каменная соль (галенит)Сода (натрит)
Известняк (мел, мрамор)
Апатиты, фосфориты
8. Используя эти «подарки», получите следующие вещества:
1. Водород2. Алюминий
3. Железо
4. Гашеную
известь
5. Угольную кислоту
6. Фосфорную кислоту
7. Фосфат натрия
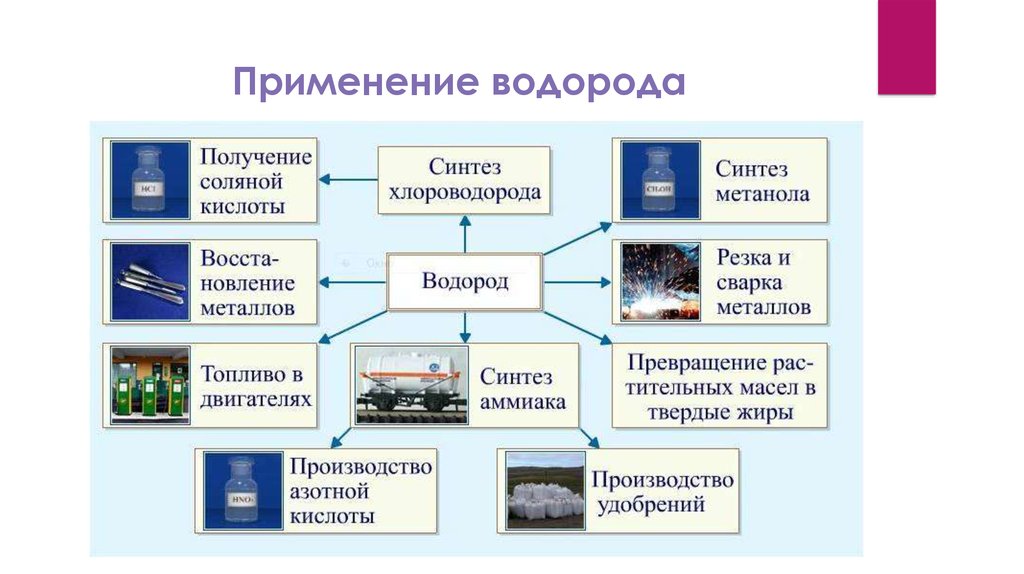
9. Применение водорода
10.
11.
12.
13.
Средний американец выпивает 180 л газированной воды в год;средний россиянин — 50 л, средний китаец — 20 л воды в год
14.
15.
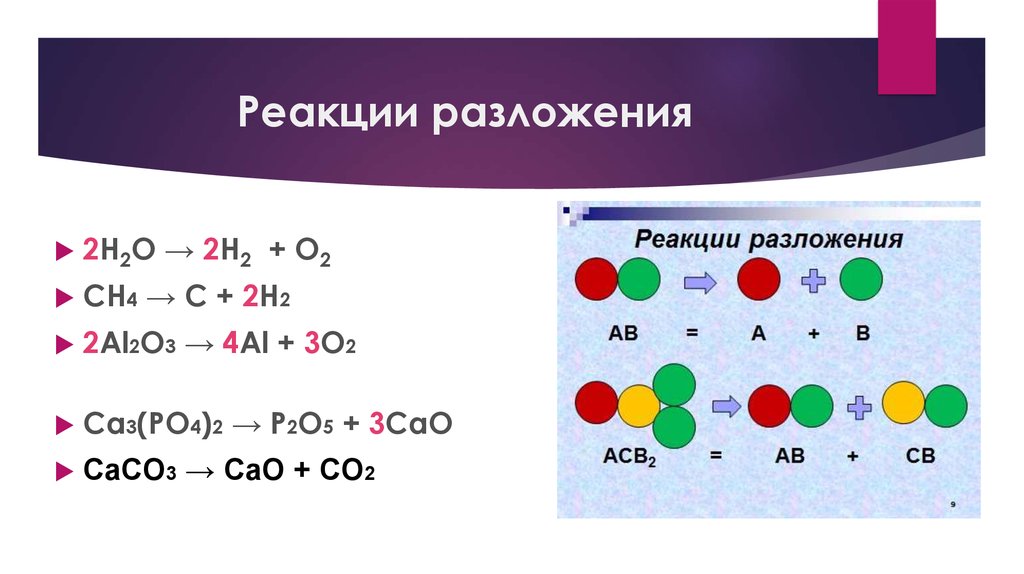
16. Реакции разложения
2H2O → 2H2 + O2CH4 → С + 2H2
2Al2О3 → 4Al + 3О2
Ca3(PO4)2 → P2O5 + 3CaO
CaCO3 → CaO + CO2
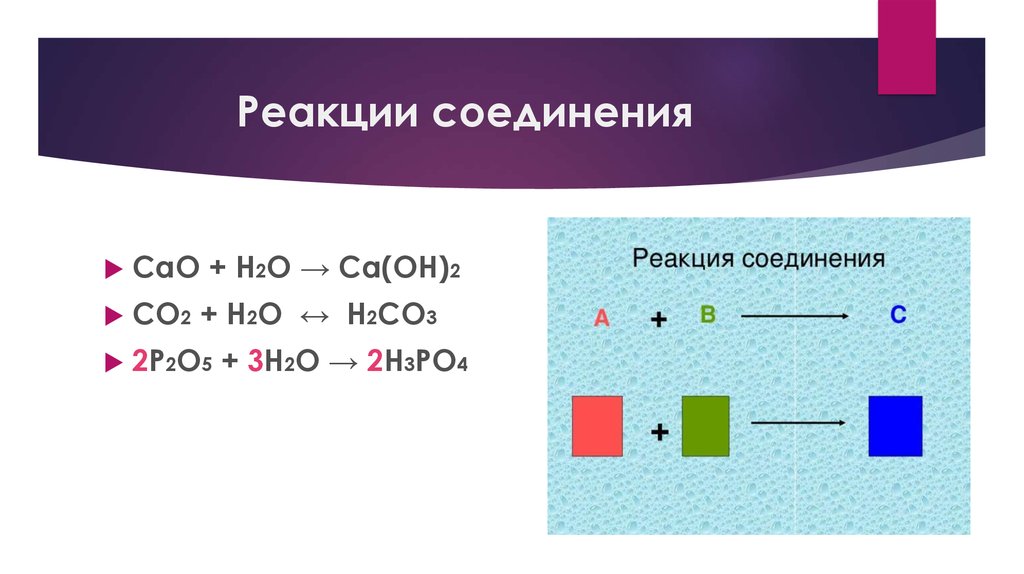
17. Реакции соединения
CaO + H2O → Ca(OH)2СО2 + Н2О ↔ Н2СО3
2P2O5 + 3Н2О → 2H3PO4
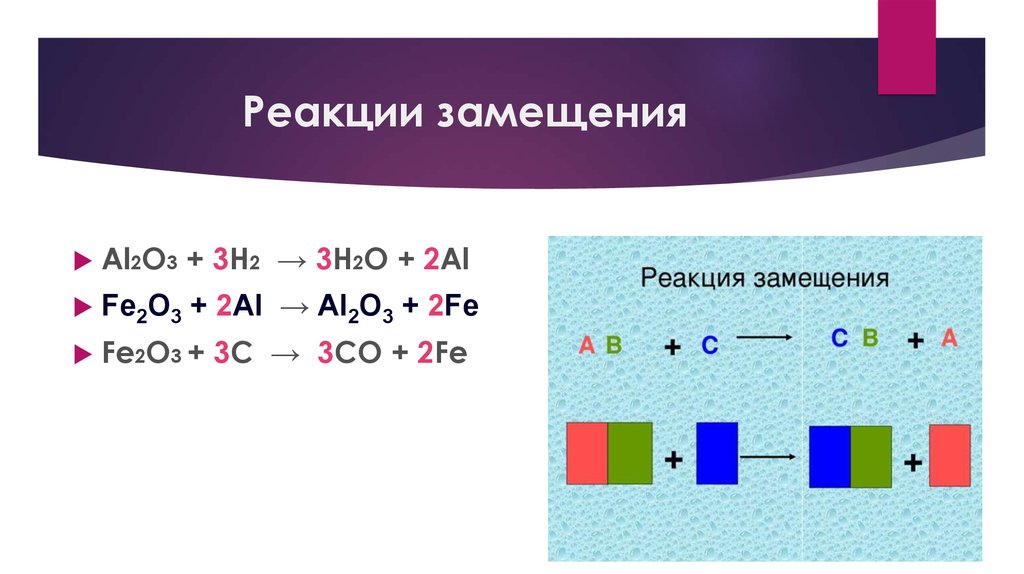
18. Реакции замещения
Al2O3 + 3H2 → 3H2O + 2AlFe2O3 + 2Al → Al2O3 + 2Fe
Fe2O3 + 3C → 3CO + 2Fe
19. Реакция обмена
3Na2CO3+ 2H3PO4 →
2Na3PO4 + 3H2O + 3CO2
20. Домашнее задание
§34 № 1повторить формулы
для
расчета количества вещества















 Химия
Химия








