Похожие презентации:
Лекция 8.3. Реакции окисления и восстановления органических соединений
1.
8.3. Реакции окисления ивосстановления органических
соединений
Имеют большое значение в
процессе метаболизма
(катаболизма), в цепи переноса
электронов и окислительном
фосфорилировании, что составляет
основу клеточного дыхания
2.
В результате окисления веществвыделяется энергия, которая
запасается в форме
высокоэнергетических
соединений, таких как АТФ, а
затем расходуется в процессе
анаболизма. Реакция окисления
способствует детоксикации и
выведению ксенобиотиков
3.
Химические реакции, в процессекоторых происходит перенос
электронов от одной молекулы к
другой, называются ОВ
Окисление - процесс отдачи
электронов молекулой,
восстановление –
приобретение электронов
4.
Восстановители – донорыэлектронов
Окислители – акцепторы
электронов
5.
В органической химии подокислением понимают
реакции, при которых
происходит
удаление из молекулы атомов
водорода или образование
более полярных связей из
менее полярных
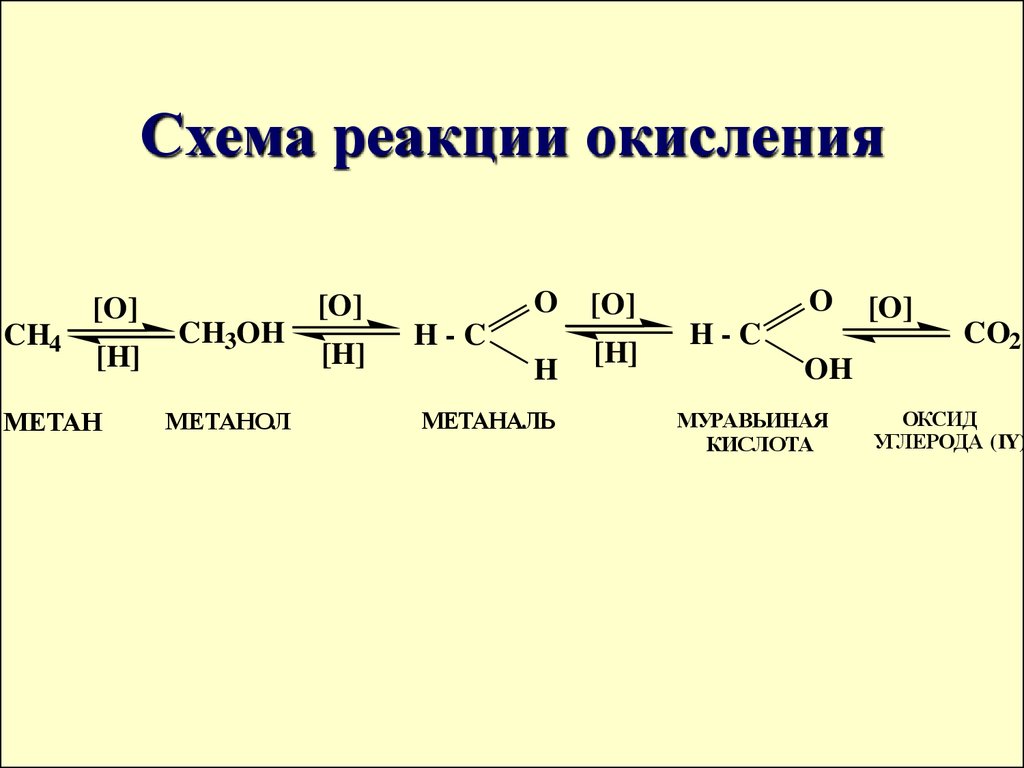
6. Схема реакции окисления
CH4[O]
[H]
МЕТАН
CH3OH
МЕТАНОЛ
O
[O]
[H]
H-C
H
МЕТАНАЛЬ
O
[O]
[H]
H-C
[O]
CO2
OH
МУРАВЬИНАЯ
КИСЛОТА
ОКСИД
УГЛЕРОДА (IY)
7.
Механизмы окисления ивосстановления
1.Прямой перенос ē (одноэлектронный
перенос)
Fе2+– ē → Fе3+
Эта ОВ пара может отдавать свои
электроны любому восстанавливающемуся соединению
8.
2. Перенос атома(свободнорадикальный
связи R–Н)
водорода
разрыв
3. Перенос электронов от
донора к акцептору в форме
гидрид-иона Н –
9.
4. Перенос электронов путемпрямого
взаимодействия
органического восстановителя с
кислородом,
приводящий
к
продукту
с
ковалентносвязанным кислородом
10.
Примером последней реакции можетслужить алифатическое
гидроксилирование – один из путей
биотрансформации лекарственных
средств (ЛС) в организме,
приводящий к повышению
полярности и гидрофильности ЛС,
что способствует их выведению из
организма
11.
Взаимодействие ЛС с кислородомпроисходит в митохондриях
R - CH3 +
1/2 O2
R - CH2 - OH
12.
Примерами реакцийокисления и восстановления
являются реакции
дегидрирования и
гидрирования
13.
На одной из стадий ЦТКокисление янтарной кислоты до
фумаровой
H
HOOC - CH - CH - COOH
H
H
ЯНТАРНАЯ КИСЛОТА
COOH
[O]
C
HOOC
C
H
ФУМАРОВАЯ КИСЛОТА
14.
Окисление гидроксильных иоксогрупп
Спирты обладают большей
способностью к окислению, чем
насыщенные углеводороды
Первичные спирты окисляются до
соответствующих альдегидов,
вторичные спирты – до кетонов,
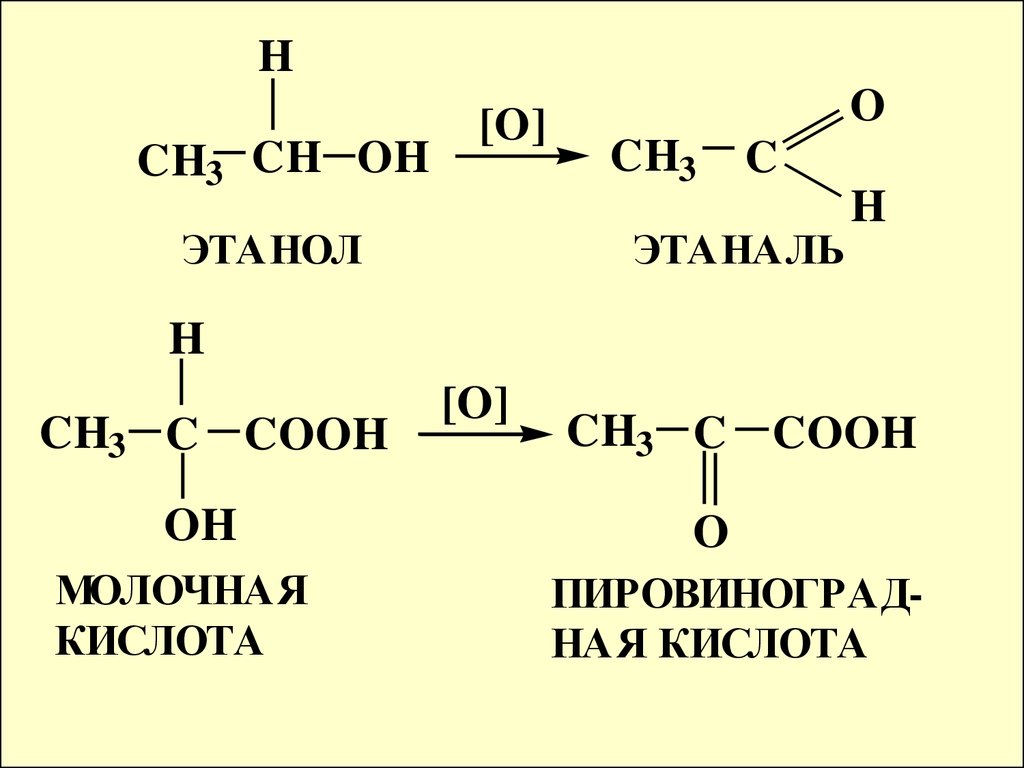
15.
HCH3 CH OH
[O]
ЭТАНОЛ
O
CH3
C
ЭТАНАЛЬ
H
H
CH3 C COOH
OH
МОЛОЧНАЯ
КИСЛОТА
[O]
CH3 C COOH
O
ПИРОВИНОГРАДНАЯ КИСЛОТА
16.
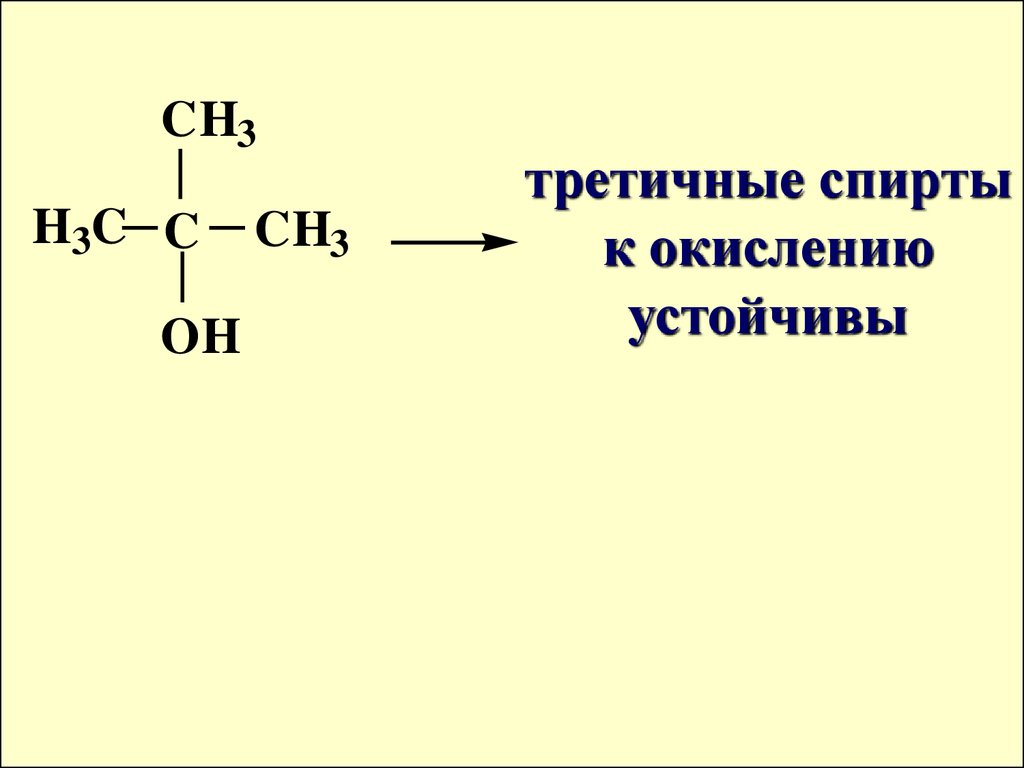
CH3H3C C
OH
CH3
третичные спирты
к окислению
устойчивы
17.
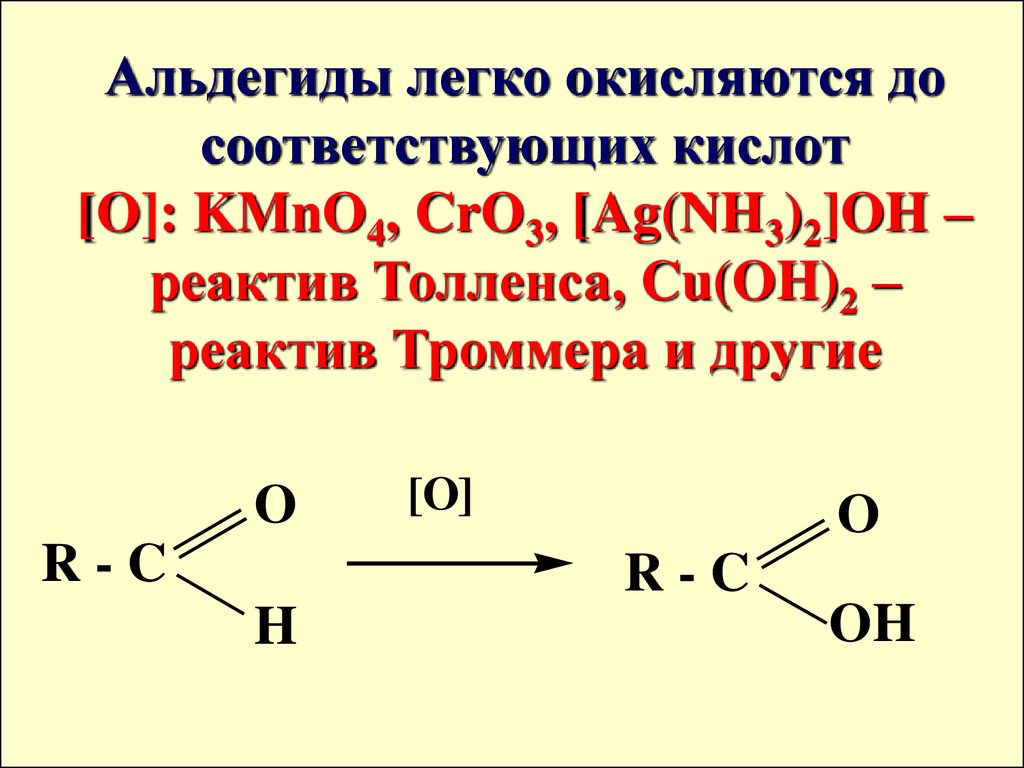
Альдегиды легко окисляются досоответствующих кислот
[O]: KMnO4, CrO3, [Ag(NH3)2]OH –
реактив Толленса, Cu(OH)2 –
реактив Троммера и другие
O
R-C
[O]
O
R-C
H
OH
18.
Кетоны к окислениюустойчивы
19.
Реакция окисления in vivo сучастием НАД+
O
C
+ R' - C - OH
NH2
+
N
H
H
H
O
C
[O]
N
NH2
+
R' - C
O
H
+
H
R
R
НАД
+
СУБСТРАТ
НАД-Н
СУБСТРАТ
ОКИСЛЕННЫЙ
+
H
20.
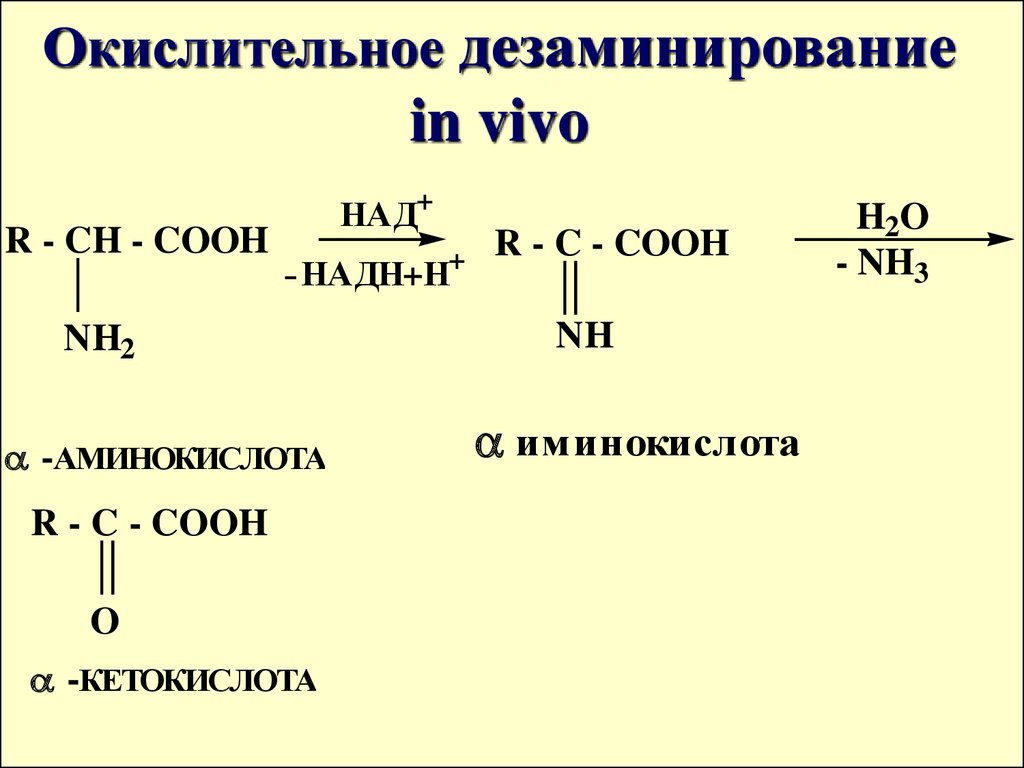
Окислительное дезаминированиеin vivo
R - CH - COOH
НАД+
+
- НАДН+Н
NH2
-АМИНОКИСЛОТА
R - C - COOH
O
-КЕТОКИСЛОТА
R - C - COOH
NH
иминокислота
H2O
- NH3
21.
Реакции восстановленияРеакции восстановления
обратны реакциям
окисления: восстановление
альдегидов приводит к
образованию первичных
спиртов; кетонов – вторичных
спиртов
22.
В качествевосстанавливающего агента
in vitro используют
алюмогидрид лития LiAlH4
или гидриды щелочных
металлов
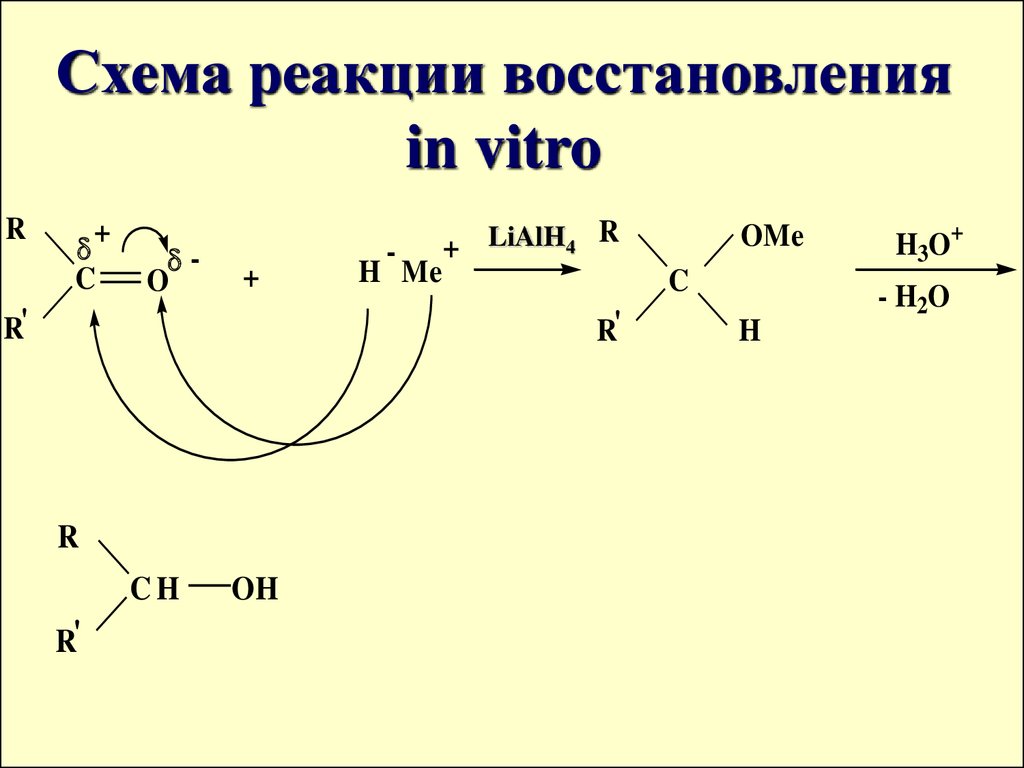
23. Схема реакции восстановления in vitro
Схема реакции восстановленияin vitro
R
+
C
O
+
R'
-
H Me
+ LiAlH4 R
C
R'
R
CH
R'
OH
OMe
H3O+
- H2O
H
24. Схема реакции восстановления in vivo
Схема реакции восстановленияin vivo
O
CH3 - C
+
H
НАД . Н
+
+ Н
CH3 - CH2 - OH + НАД
+
25.
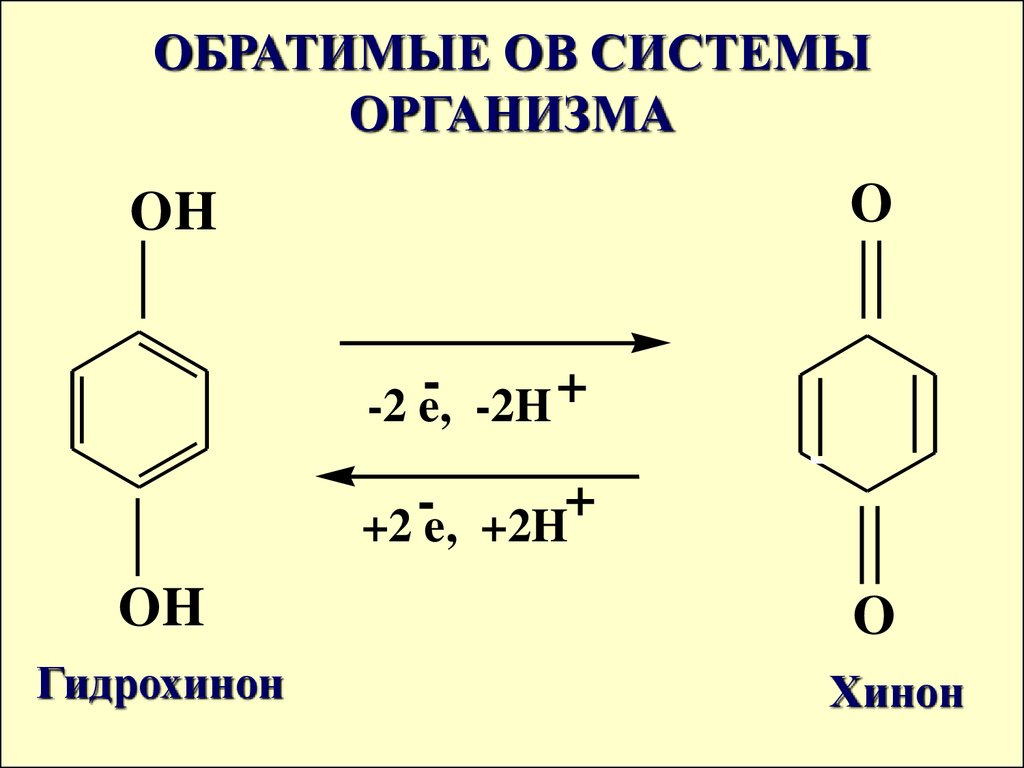
Обратимые ОВ системыорганизма
К ним относятся системы –
гидрохинон-хинон и
сульфид-дисульфид
Легкость перехода из окисленной в
восстановленную форму и обратимость
таких реакций служат основой для их
участия в биологически важных
процессах
26. ОБРАТИМЫЕ ОВ СИСТЕМЫ ОРГАНИЗМА
OOH
+
-2 e, -2H
+
+2 e, +2H
OH
Гидрохинон
O
Хинон
27.
Система гидрохинон-хинонвходит в состав
кофермента Q-убихинон,
участвует в переносе
электронов в митохондриях и
дыхательной цепи
28.
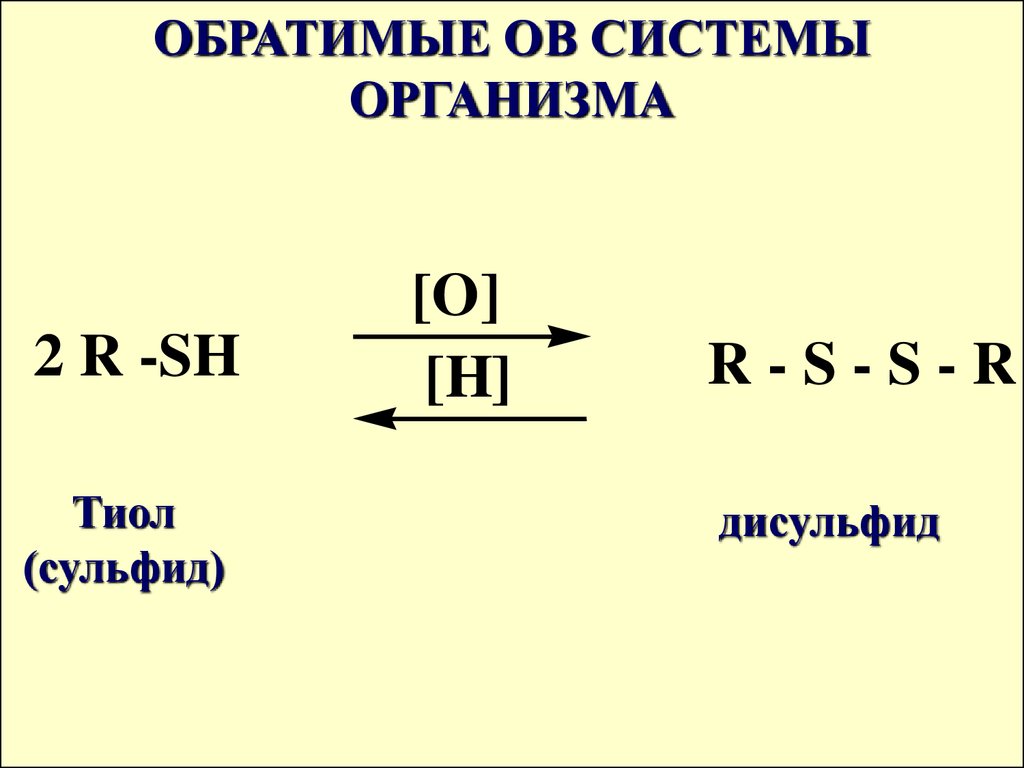
Обратимая ОВ реакция всистеме сульфид-дисульфид
играет важную роль в
формировании
пространственной структуры
белков
29.
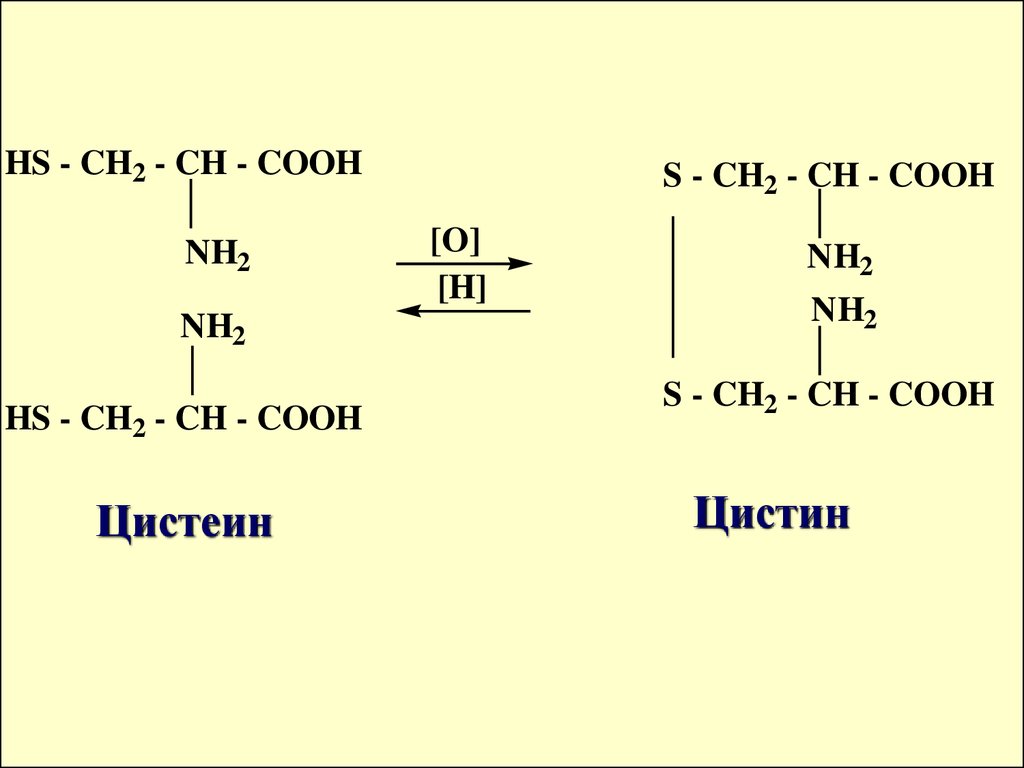
ОБРАТИМЫЕ ОВ СИСТЕМЫОРГАНИЗМА
2 R -SH
Тиол
(сульфид)
[O]
[H]
R-S-S-R
дисульфид
30.
HS - CH2 - CH - COOHNH2
NH2
HS - CH2 - CH - COOH
Цистеин
S - CH2 - CH - COOH
[O]
[H]
NH2
NH2
S - CH2 - CH - COOH
Цистин





















 Химия
Химия








